SKRINING FUNGI dan BAKTERI KITINOLITIK SERTA POTENSI
advertisement

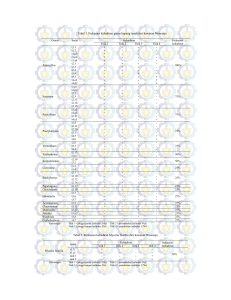
SKRINING FUNGI dan BAKTERI KITINOLITIK SERTA POTENSI AKTIVITAS KITINASENYA Hany Latifah Zein, Dra. Tri Aminingsih, M.Si, Ir. Elizabeth.C. Situmorang, M.Si Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Pakuan Bogor ABSTRAK Kelapa sawit merupakan salah satu tanaman perkebunan yang banyak dimanfaatkan oleh manusia. Salah satu kendala dalam industri kelapa sawit adalah serangan penyakit busuk pangkal batang. Penyakit ini disebabkan oleh fungi Ganoderma boninense yang hinggap pada batang tanaman kelapa sawit. Pada saat ini upaya pengendalian Ganoderma boninense masih mengandalkan pestisida. Perlu dilakukan pemilihan agen pengendali hayati yang efektif dan ramah lingkungan berupa fungi dan bakteri yang melibatkan enzim kitinase. Hasili penelitian menunjukkan bahwa telah terpilih 9 isolat , 4 isolat dari genus bakteri yakni SMCC/B/09/00007, SMCC/B/09/00008,SMCC/B/09/00012, SMCC/B/09/00033 dan 5 isolat dari genus fungi yakni SMCC/F/09/00013, SMCC/F/09/00019, SMCC/F/09/00026, SMCC/F/09/00036 dan SMCC/F/09/00037. Aktivitas enzim kitinase tertinggi pada bakteri ditunjukkan oleh isolat SMCC/B/09/00008 dengan nilai ativitas sebesar 3,091 U/mL dan aktivitas spesifik sebesar 1,370 mg/mL dihasilkan pada waktu inkubasi hari ke-4. Untuk genus fungi ditunjukkan oleh SMCC/F/09/00026 dengan nilai aktivitas enzim sebesar 2,190 U/mL dan aktivitas enzim spesifik sebesar 0,980 U/mg dihasilkan pada waktu inkubasi hari ke-5. Isolat-isolat terpilih inilah yang dapat dijadikan sebagai pengendali hayati Ganoderma boninense Keyword : fungi, bakteri, enzim kitinase,aktivitas spesifik PENDAHULUAN Laju perkembangan industri kelapa sawit di Indonesia semakin pesat, terutama luas peningkatan luas lahan kelapa sawit. Kelapa Sawit adalah salah satu palma yang menghasilkan minyak nabati, yang lebih dikenal dengan sebutan palm oil. Sumber minyak nabat dapat berasal dari kelapa, kelapa sawit, kacang tanah, kacang kedelai, biji bunga matahari, dan lainnya. Kelapa sawit adalah penyumbang minyak nabati terbesar di dunia (2000-3000 kg/ha), manakala kelapa hanya mencapai 700-1000 kg/ha (Siregar, 2006). Salah satu kendala dalam industri kelapa sawit adalah Penyakit Busuk Pangkal Batang (BPB). Penyakit ini merugikan karena dapat mengakibatkan pelapukan batang (Sinaga et al., 2003). Penyebab penyakit BPB adalah Ganoderma boninense yang merupakan cendawan patogen tular tanah yang menyebabkan kematian kelapa sawit di beberapa perkebunan Indonesia (Susanto, 2002). Pada saat ini upaya pengendalian terhadap hama dan penyakit tanaman masih mengandalkan pestisida sbagai pengendalian utama. Kenyataannya bahwa pengendaian dengan menggunakan senyawa kimia bukan merupakan alternatif yang terbaik, karena sifat racun yang terdapat dalam senyawa tersebut dapat meracuni manusia, ternak piaraan, serangga penyerbuk, musuh alami, serta lingkungan yang dapat menimbulkan polusi, bahkan pemakaian dosis yang tidak tepat bisa membuat hama dan penyakit menjadi resisten. Berdasarkan hal tersebut maka perlu diambil alternatif pengendalian yang efektif terhadap penyebab penyakit tanaman tanpa mengandalkan fungisida (Ismail & Tenrirawe, 2013). Trichoderma Viridae, Gliocladium dan Asperigillus sp (Khaeruni & Gusnawaty, 2012). Dalam penelitian ini akan dilakukan pengujian aktivitas enzim kitinase dari berbagai koleksi SInarmas Culture Collection (SMCC). Isolat dengan aktivitas kitinase tertinggi diharapkan menjadi agen potensial untuk digunakan sebagai komponen formula biofungisida pengendali Ganodema boninense . METODE PENELITIAN Bahan Bahan-bahan yang digunakan adalah sepuluh isolat bakteri dan sepuluh isolat fungi koleksi Sinarmas Culture Collection (SMCC), PDA, PDB, NA,NB, koloidal kitin, Yeast extract, Agar, Peptone, KH2PO4, K2HPO4, (NH4)2SO4, Na2CO3, MgSO4.7H20, CaCl.2H2O, K3Fe(CN)6, Nacl 0,85%, buffer Phosphate, CuSO4, Follin-Ciocalteu, aquadest, spirtus, paper towel, plastik cling wrap, alumunium foil.. Upaya pengendalian yang efektif dan ramah lingkungan perlu dilakukan, salah satunya adalah menggunakan mikroorganisme kitinolitik yang melibatkan enzim kitinase (Muharni & Widjajanti, 2011). Enzim kitinase banyak dimanfaatkan sebagai pengendali hayati terutama pada bagi tanaman yang terserang infeksi fungi patogen. Hal ini dikarenakan kitin merupakan komponen utama dinding sel fungi yang dapat didegradasi oleh enzim kitinase (Herdyastuti et al., 2009). Alat Alat-alat yang digunakan adalah cawan Petri, spatula, mikro pipet, centrifuge, biosafety cabinet, haemocytometer, autoklaf, kuvet, hot plate, spektropotometer, pH, neraca digital, microwave, magnetic stirer, ose, api Bunsen, tusuk sate, sedotan, Erlenmeyer, tabung reaksi, inkubator kocok, rak tube, shaker, Schott bottle, korek api, colony counter, inkubator suhu 37 dan inkubator suhu 30 Beberapa genus baktei kitinolitik adalah Aeromonas, Psedomonas, Bacillus, Vibrio, Xanthomonas, Serratia (Ayu et al., 2010) dan Burkholderia (Syamsuddin & Ulim, 2013). Selain genus bakteri, alternatif pengendalian penyakit tular tanah secara biologi dapat pula dilakukan mikroorganisme fungi seperti, Trichoderma harzianum, 2 permukaan media kitin padat. Agar tumbuh dengan sempurna fungi disimpan di inkubator dengan suhu 30 , diamati perkembangannya sampai terbentuk zona bening. METODE KERJA Isolat fungi dan isolat bakteri yang diduga memiliki aktivitas kitinolitik di skrining di media kitin padat setelah terpilih isolat yang memiliki aktivitas kitinolitik. Isolat bakteri maka akan dibuat kurva pertumbuhan bakteri untuk mengetahui dimana fase inokulan kitinase akan diambil, untuk isolat fungi akan diuji kerapatan sporanya. Pembuatan Kurva Pertumbuhan Bakteri SMCC Disiapkan isolat bakteri SMCC terpilih, diinokulasikan pada medium NB 10 mL, di inkubasi selama 1×24 jam dengan inkubator kocok, selanjutnya medium berisi bakteri tersebut dipindahkan pada medium NB 100 mL sebanyak 100 µL. Inilah yang akan menjadi starter yang akan di ukur setiap 2 jam pada panjang gelombang 600 nm Selanjutnya dilakukan pemurnian pada bakteri dan fungi. Isolat bakteri diinokulasikan terlebih dahulu ke dalam media NB untuk mengetahui waktu inokulan yang akan diambil, selanjutnya diinokulasikan pada media kitin cair untuk di uji aktivitas enzim kitinase, kadar proteinnya serta aktivitas spesifiknya. Hal yang sama pun dilakukan pada fungi, hanya saja fungi tidak melalui tahap inokulasi pada medium NB. Pengujian Kerapatan Spora Fungi SMCC Pengujian kerapatan spora pada fungi bertujuan untuk mengetahui jumlah spora masingmasing fungi. Fungi terpilih ditumbuhkan pada medium PDA selam 10 hari, dilepaskan sporanya dengan cara dikeruk dan dilarutkan dengan larutan NaCl 0,85%. Diteteskan pada bidang haemocytometer, diamati dibawah mikroskop. Skrining Bakteri dan Fungi Isolat fungi dan bakteri yang diduga memiliki aktivitas kitinolitik diuji pada medium kitin padat. Isolat bakteri harus ditumbuhkan terlebih dahulu pada medium Nutrient Broth (NB) dengan umur 1×24 jam, diteteskan pada edium kitin padat sebanyak 20µL tepat di tengah permukaan kitin padat, penyimpanan dilakukan pada inkubator 37 . Diamati perkembangannya sampai terbentuk zona bening. Pengujian Aktivitas Kitinase Aktivitas enzim kitinas diuji berdasarkan metode Schales (Pratiwi, 2015) yang dimodifikasi. Modifikasi ini dilakukan pada nilai konsentrasi dan volume pereaksi. Pengujian aktivitas enzim dilakukan menggunakan substrat kolidal kitin dengan konsentrasi 0,3% , 0,75 buffer phosphate , dan ekstrak kasar dari fungi dan bakteri. Campuran diinkubasi pada suhu 37 selama 30 menit. Selanjutnya disentrifugasi pada kecepatan 6000 rpm selama 4 Isolat fungi ditumbuhkan pada medium Potato Dextrose Agar (PDA) sampai usia sepuluh hari dan dipindahkan pada media kitin padat dengan metode cuplik menggunakan sedotan dan tusuk sate, penyimpanan disc fungi dilakukan tepat ditengah 3 menit. Pelet di buang, supernatan diambil sebanyak 2,5 mL , lalu ditambah dengan 2,5 aquadest dan 5 mL pereaksi Schales. Didihkan selama 10 menit . setelah dingin, absorbansi larutan diukur pada panjang gelombang 420 nm. Dilakukan pula pengujian untuk kontrol dengan penambahn ekstrak kasar fungi dan bakteri setelah inkubasi. Satu unit aktivitas kitinase didefinisikan sebagai jumlah enzim yang menghasilkan 1 gula reduksi N-asetilglukosamin selama 1 menit. memiliki indeks kitinolitik tertinggi yaitu sebesar 1,1 cm, dan yang memiliki indeks kitinolitik terendah adalah SMCC/F/09/00036 dan SMCC/F/09/00037 sebesar 0,1 cm. Penentuan Kadar Protein Kadar protein ditentukan menggunakan metode Lowry dan sebagai standar digunakan Bovine Serum Albumin (Dewi, 2013) Gambar 1. Aktivitas Kitinolitik Bakteri SMCC Indeks Kitinolitik dari masing-masing isolat berbeda-beda. Terjadinya perbedaan indeks kitinolitik ini disebabkan oleh perbedaan aktivitas kitinase dari masing-masing isolat bakteri dan fungi. Penetuan Aktivitas Spesifik Aktivitas spesifik dapat ditentukan dengan perbandingan antara Aktivitas Enzim Kitinase dan Konsentrasi Protein . HASIL DAN PEMBAHASAN Hasil skrining pada media kitin padat menunjukkan bahwa dari 20 isolat bakteri dan fungi SMCC terdapat 9 isolat yang menunjukkan adanya aktivitas kitinase, 4 isolat bakteri (Gambar 1) dan 5 isolat fungi (Gambar 2). Indeks kitinolitik tertinggi pada isolat bakteri terdapat pada isolat SMCC/B/09/00008 sebesar 1,5 cm dan terendah adalah isolat SMCC/B/09/00012 sebesar 0,2 cm. Gambar 2. Aktivitas Kitinolitik Fungi SMCC Hasil skrining fungi SMCC menunjukkan bahwa isolat fungi dengan kode SMCC/F/09/00026 Menurut besarnya zona 4 Dewi (2008), bening yang dihasilkan tergantung pada jumlah monomer N-asetilglukosamin yang dihasilkan dari proses hidrolisis kitin. Semakin banyak jumlah monomer N-asetilglukosamin yang dihasilkan maka akan semakin besar zona bening yang terbentuk disekitar koloni, zona yang dihasilkan akan menunjukkan besar kecil aktivitas kitinolitik. stasioner setelah kultur berumur 12 jam. Menurut Cahyani (2013) inokulum untuk produksi kitinase dipilih pada fase pertengahan atau fase eksponensial sampai fase stasioner awal, pada fase ini metabolisme optimum dan sintesis bahan sel sangat cepat dengan jumlah konstan, sehingga pada fase ini bakteri sangat baik apabila dijadikan sebagai inokulum. Variasi zona bening yang dihasilkan yang ditemukan dari tiap isolat diduga disebabkan perbedaan suhu dan pH baik pada kondisi alami maupun perlakuan di laboratorium selama penelitian berlangsung. Seperti dikemukakan Lehninger (1998), bahwa aktivitas suatu enzim dipengaruhi oleh beberapa faktor, yaitu pH, suhu, aktivator, inhibitor, konsentrasi substrat dan enzim Kurva Pertumbuhan Kitinolitik Kerapatan Spora Fungi Kitinolitik Uji kerapata spora dimaksudkan untuk mengetahui jumlah spora pada isolat serta kemampuan hidup spora pada fungi Tabel 1. Kerapatan Fungi Kitinolitik Kode Isolat Bakteri Kurva pertumbuhan bakteri merupakan hal yang penting untuk dilakukan dalam karakterisasi bakteri. Dari pengukuran kurva pertumbuhan maka akan diketahui fase-fase dalam pertumbuhan bakteri Kerapatan Spora SMCC/F/09/00013 2,29× 108 SMCC/F/09/00019 3,65 × 108 SMCC/F/09/00026 3,75 × 108 SMCC/F/09/00036 5,97 × 107 SMCC/F/09/00037 5,19 × 107 Berdasarkan Tabel 1 diketahui kerapatn spora paling tinggi ditunjukkan isolat SMCC/F/09/00026 dan yang terendah ditunjukkan isolat SMCC/F/09/00037. Menurut Situmorang (2012) perbedaan pertumbuhan spora diakibatkan adanya faktor kematangan spora pada saat pembuatan inokulum, serta periode dorman dan germinasi Isolat bakteri SMCC/B/09/00007 dan SMCC/B/09/00033 mengalami laju yang lambat dibandingkan SMCC/B/09/00008 dan SMCC/09/00012 karena memasuki fase eksponensial pada jam ke-6 sampai jam ke-16, kemudian masuk fase stasioner setelah kultur bakteri berumur 18 jam. Isolat bakteri SMCC/B/09/00008 dan SMCC/B/09/00012 mengalami laju pertumbuhan yang lebih cepat karena memasuki fase eksponensial pada pertumbuhan ke-2 sampai jam ke-10, mulai memasuki fase Aktivitas Enzim Kitinase Fungi dan Bakteri SMCC Hasil pengukuran aktivitas enzim kiinase dilakukan pada isolat 5 terpilih hasil skrining yakni empat isolat bakteri dan lima isolat fungi Aktivitas Kitinase (Unit/mL) 3.500 3.000 2.500 2.000 SMCC/B/09/00007 1.500 SMCC/B/09/00008 1.000 SMCC/B/09/00012 0.500 SMCC/B/09/00033 0.000 1 2 3 4 5 6 7 Waktu Inkubasi (Hari ke-) Gambar 3. Aktivitas Kitinase Bakteri SMCC pada Berbagai Waktu Inkubasi Aktivitas Kitinase (Unit/mL) 2.500 2.000 SMCC/F/09/00013 1.500 SMCC/F/09/00019 1.000 SMCC/F/09/00026 0.500 SMCC/F/09/00036 0.000 SMCC/F/09/00037 1 2 3 4 5 6 7 Waktu Inkubasi (Hari ke-) Gambar 4. Aktivitas Kitinase Fungi SMCC pada Berbagai Waktu Inkubasi Bakteri SMCC menpunyai aktivitas tertinggi pada hari ke-4, dan nilai aktivitas tertingg ditunjukkan oleh SMCC/B/09/00008 sebesar 3,091 U/mg dan aktivitas terendah ditunjukkan SMCC/B/09/00012 dengan nilai aktivitas sebesar 1,539 U/mL. Berdasarkan Gambar 3 diketahui perbedaan nilai aktivitas berdasarkan zona bening yang terbentuk SMCC/B/09/00033 memiliki zona bening terbesar kedua setelah SMCC/B/09/00008 tetapi menghasilkan aktivitas yang kecil yakni sekitar 2,116 jika dibandingkan SMCC/B/09/00007 yang memiliki aktivitas kitinolitik kecil tapi menghasilkan aktivitas enzim kitinasenya sekitar 2,319 U/mL. Diduga zona bening yang terbentuk pada saat itu disebabkan kkondisi yang diinginkan SMCC/B/09/00007 tidak optimum. Seperti dilaporkan Muharni & Widjajanti (2011), beberapa faktor seperti perbedaan jenis mikroorganisme, kecepatan pertumbuhan setiap isolat pada medium padat dan cair, jumlah inokulum yang diberikan pada medium , diduga menjadi penyebab tidak berkolerasinya nilai aktivitas hidrolisis enzim kitinase. 6 Untuk isolat fungi. Tiga Menurut Dewi (2008), isolat fungi mencapai nilai aktivitas kehadiran enzim kitinolitik pada tertinggi pada hari ke-5 dan dua medium pertumbuhan dapat dilihat lainnya pada hari ke-6. Isolat yang dari reaksi pelepasan N-asetil Dmencapai aktivitas tertinggi pada glukosamin dari koloidal kitin. hari ke-5 adalah SMCC/F/09/00013 Kemampuan bakteri dan fungi untuk sebesar 1,885 U/mL, isolat fungi memproduksi kitinase sangat SMCC/F/09/00019 sebesar 2,001 bervariasi, mungkin disebabkan U/mL dan SMCC/F/09/0026 sebesar perbedaan kecil pada gen yang 2,190 U/mL. Dua isolat yang mengkodenya. Setiap spesies mencapai nilai aktivitas tertinggi memiliki variasi terhadap perlakuan pada hari ke-6 adalah suhu yang berimplikasi terhadap SMCC/F/09/00036 sebesar 1,693 diproduksi dan diseksresikannya dan SMCC/F/09/00037 dengan nilai enzim pada medium aktivitas sebesar 1,590 U/mL Tabel 2. Kadar Protein Fungi SMCC Pada Berbagai Waktu Inkubasi Kode Isolat 1 2,226 2,231 2,224 2,241 2,226 Aktivitas Spesifik (U/mg) SMCC/F/09/00013 SMCC/B/09/00019 SMCC/B/09/00026 SMCC/B/09/00036 SMCC/B/09/00037 2 2,224 2,247 2,223 2,229 2,229 Kadar Protein (mg/mL Waktu Inkubasi (Hari ke-) 3 4 5 2,236 2,214 2,236 2,261 2,249 2,230 2,239 2,227 2,236 2,234 2,224 2,232 2,241 2,228 2,238 6 2,244 2,250 2,240 2,230 2,243 7 2,237 2,231 2,244 2,238 2,246 1.200 1.000 0.800 SMCC/F/09/00013 0.600 SMCC/F/09/00019 0.400 SMCC/F/09/00026 0.200 SMCC/F/09/00036 SMCC/F/09/00037 0.000 1 2 3 4 5 6 7 Waktu Inkubasi (Hari ke-) Gambar 5. Aktivitas Spesfik Kitinase Fungi SMCC 7 Tabel.3. kadar Protein Bakteri SMCC Pada Berbagai Waktu Inkubasi Kadar Protein (mg/mL Kode Isolat Waktu Inkubasi (Hari ke-) 2 3 4 5 6 7 SMCC/B/09/00007 2,251 2,248 2,260 2,253 2,226 2,244 2,230 SMCC/B/09/00008 2,239 2,233 2,248 2,257 2,247 2,252 2,231 SMCC/B/09/00012 2,251 2,253 2,251 2,258 2,224 2,260 2,228 SMCC/B/09/00033 2,247 2,248 2,246 2,261 2,242 2,250 2,233 Aktivitas Kitinase (Unit/mL) 1 3.500 3.000 2.500 2.000 SMCC/B/09/00007 1.500 SMCC/B/09/00008 1.000 SMCC/B/09/00012 0.500 SMCC/B/09/00033 0.000 1 2 3 4 5 6 7 Waktu Inkubasi (Hari ke-) Gambar 6. Aktivitas Spesifik Kitinase Bakteri SMCC SMCC/B/09/00012 dengan nilai aktivitas sebesar 0,682 U/mg. Hasil kadar protein dan aktivitas spesifik enzim kitinase fungi SMCC yang diperoleh dapat dilihat pada Tabel 2 dan Gambar 5. Tiga isolat fungi menunjukkan puncak aktivitas tertinggi pada hari ke-5 dan dua lainnya menunjukkan aktivitas tertinggi pada hari ke-6. Aktivitas spesifik tertinggi ditunjukkan oleh isolat SMCC/F/09/00026 dengan nilai aktivitas sebesar 0,980 U/mg. Dan yang terendah ditunjukkan oleh Kadar Protein dan Aktivitas Spesifik Fungi dan Bakteri SMCC Untuk menentukan aktivitas spesifik maka harus didaptakan terlebih dahulu kadar proteinnya. Hasil kadar protein dan aktivitas spesifik enzim kitinase bakteri SMCC yang diperoleh dapat dilihat pada Tabel 3 dan Gambar 6. Aktivitas spesifik enzim kitinase tertinggi ditunjukkan oleh SMCC/B/09/00008 dengan nilai aktivitas 1,370 U/mg dan yang terendah ditunjukkan isolat 8 isolat SMCC/F/09/00037 dengan nilai aktivitas sebesar 0,709 U/mg Isolat bakteri yang menunjukkan aktivitas spesifik tertinggi ditunjukkan oleh SMCC/B/09/00008 dengan nilai aktivitas spesifik sebesar 1,370 U/mg. Pada genus fungi aktivitas spesifik tertinggi dicapai pada hari ke-5 dan 6. Isolat fungi yang menunjukkan aktivitas spesifik tertinggi adalah SMCC/F/09/00026 dengan nilai aktivitas sebesar 0,980 U/mg. Isolat-isolat terpilih inilah yang bisa dijadikan sebagai pengendali hayati untuk Ganoderma boninense Kesimpulan Berdasarkan hasil penelitian yang berjudul “Skrining Fungi dan Bakteri SERTA POTENSI AKTIVITAS KITINASENYA”. Disimpulkan bahwa : 1. Telah terpilih isolat bakteri dan isolat fungi yang memiliki aktivitas kitinolitik. Dari genus bakteri terdapat empat isolat yaiu SMCC/B/09/00007, SMCC/B/09/00008, SMCC/B/09/00012, SMCC/B/09/00033. Dari genus fungi terdapat lima isolat yaitu : SMCC/F/09/00013, SMCC/F/09/00019, SMCC/F/09/00026, SMCC/F/09/00036, SMCC/F/09/00037. 2. Aktivitas enzim kitinase tertinggi dicapai pada hari ke-4. Isolat bakteri yang menunjukkan aktivitas kitinase tertinggi adalah SMCC/B/09/00008 dengan nilai aktivitas kitinase sebesar 3,091 U/mL dan untuk isolat fungi aktivitas tertinggi dicapai pada hari ke-5 dan ke-6. Isolat fungi yang menunjukkan aktivitas enzim kitinase tertinggi adalah SMCC/F/)9/00026 dengan nilai aktivitas sebesar 2,190. Aktivitas tertinggi pada bakteri dicapai pada hari ke-4. Saran Saran dari penelitian “SKRINING FUNGI dan BAKTERI KITINOLITIK SERTA POTENSI AKTIVITAS KITINASENYA” yaitu perlu dilakukan penelitian lanjutan sehingga dapat ditentukan waktu pemanenan, pH dan faktor fisik lain yang memungkinkan diperolehnya kondisi optimal agar kitinase dapat maksimal diproduksi DAFTAR PUSTAKA Ayu A, Suryanto D, Nurwahyuni I. 2010. Potensi Bakteri Kitinolitik Dalam Pengendalian Asperigillus niger Penyebab Penyakit Busuk Pangkal Akar Pada Tanaman Kacsang Tanah. Medan : USU Repository. 9 Cahyani L. 2013. Pemanfaatan Tepung Cangkang Udang Sebagai Media Produksi Kitinase Oleh Bakteri Kitinolitik Isolat 26. Skripsi. Fakultas Matemtika dan Ilmu Pengetahuan Alam Universitas Jember. Dewi IM. 2008. Isolasi Bakteri dan Uji Aktivitas Kitinase Termofilik Kasar Dari Sumber Air Panas Tinggi Raja, Simalungun Sumatera Utara. Tesis. Sekolah Pascasarjana Universitas Sumatera Utara, Medan. Dewi NY. 2013. Penetapan Kadar Dan Analisis Profil Protein Dan Asam Amino Ekstrak Ampas Biji Jinten Hitam (Nigella sativa Linn.) Dengan Metode SDS-PAGE dan KCKT. Skripsi. Fakultas Keokteran dan Ilmu Kesehatan Program Studi Farmasi Universitas Islam Negeri Jakarta. Herdyastuti N, Raharjo TJ, Mudasir, Matsjeh S. 2009. Kitin Dari Limbah Cangkang Udang Sebagai Media Untuk Bakteri Kitinolitik Yang Diisolasi Dari Lumpur Sawah. J Manusia dan Lingkungan Vol 16 No.2 Juli 2009: 115121. Ismail N., Tenrirawe A. 2013. Potensi Agens Hayati Tricoiderma spp. Sebagai Agens Pengendali Hayati. Balai Pengkajian Teknologi Pertanian,Sulawesi Utara. Lehninger A .1998. Dasar-Dasar Biokimia.Jilid 1.Cetakan Pertama. Jakarta: Penerbit Erlangga Khaeruni A, Gusnawaty HS. 2012. Utilization of Bacillus spp.As Biological Control Fusarium Wilt Disease on Hot Pepper. Jurnal Agroteknos 2(3) : 182189. Muharni & H Widjajanti. 2011. Skrining bakteri kitinolitik antagonis terhadap pertumbuhan jamur akar putih (Rigidoporus lignosus) dari rizosfir tanaman karet. Jurnal Penelitian Sains 14(1):50-56 Pratiwi RS, Susanto TE, Wardani YAK, Sutrisno A. 2015. Enzim Kitinase dan Aplikasi di Bidang Industri : Kajian Pustaka. Jurnal Pangan dan Agroindustri 3:878-88 Siregar AZ.2006. Kelapa Sawit : Minyak Nabati Berprospek Tinggi. Medan : USU Repository. Situmorang EC. 2012. Teknuk Perbanyakan Spora dan Penyimpanan Spora Indigenus Trichoderma asperellum T13 Dan Asperigillus niger A1. Tesis. Sekolah Pascasarjana. Institiut Pertanian Bogor. Susanto A. 2002. Kajian pengendalian hayati Ganoderma boninense Pat. penyebab penyakit busuk pangkal batang kelapa sawit. Disertasi Doktor. Institut Pertanian Bogor. Bogor. Syamsuddin, Ulim MA. 2013. Daya Hambat Kandidat Agens Biokontrol Terhadap Pertumbuhan Koloni Patogen Phytophthora Capsici Secara In Vitro. Jurnal Floratek 8:64-72. 10 11