BAB II TINJAUAN PUSTAKA 2.1 Kitin dan Kitosan Kitin berasal dari
advertisement

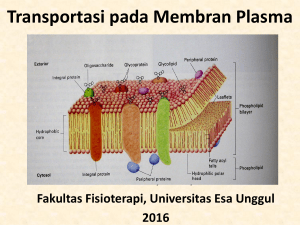
BAB II TINJAUAN PUSTAKA 2.1 Kitin dan Kitosan Kitin berasal dari bahasa Yunani chit̅ n yang berarti baju atau jubah. Seperti selulosa pada tumbuhan, kitin berperan sebagai bahan penguat dinding sel hewan dan tumbuhan tingkat rendah yang makanannya kaya akan protein. Kitin adalah salah satu polisakarida di dalam unit dasar suatu gula amino. Polisakarida adalah suatu molekul unsur yang memberikan kekuatan mekanik organisme. Kitin pertama kali ditemukan pada tahun 1811 oleh Henry Broconnot sebagai hasil isolasi dari jamur, sedangkan kitin dari serangga diisolasi pertama kali pada tahun 1820-an. Kitosan ditemukan oleh Rouget (1859) dengan merefluks kitin dengan alkali pada suhu 180° C, proses ini disebut deasetilasi. Pada proses tersebut terjadi pergantian gugus asetamida (NHCOCH3) dengan gugus amino (NH2). Dalam hal ini, proses deasetilasi kitin dapat berlaku tanpa pemutusan rantai polimer (Meriatna, 2008). Kelarutan kitosan sangat dipengaruhi oleh proses deasetilasi. Gugus amin yang mempunyai ion H+ bebas inilah yang berperan sebagai donor elektron dan menyebabkan kitosan mampu larut dalam asam-asam organik. Senyawa kitin banyak terdapat pada kulit luar hewan seperti Anthropoda, Molusca, Annelida dan juga terdapat pada dinding sel tumbuhan tingkat rendah seperti Fungi (jamur). Senyawasenyawa yang terdapat dalam kulit luar tersebut adalah kitin (15 - 40%), protein (20 - 40%) dan kalsium karbonat (20 – 50%). Setelah selulosa, kitin diperhitungkan sebagai polisakarida yang terdapat melimpah di alam (Meriatna, 2008) Pada Gambar 2.1 dan 2.2 terlihat bahwa kitin murni mengandung gugus asetamida (NHCOCH3) dan kitosan murni mengandung gugus amino (NH2). Perbedaan gugus ini akan mempengaruhi sifat-sifat kimia senyawa tersebut. Perbedaan antara kitin dan kitosan adalah berdasarkan kandungan nitrogennya, bila nitrogen kurang dari 7% maka polimer disebut kitin dan apabila kandungan total nitrogennya lebih dari 7% maka disebut kitosan (Meriatna, 2008). Rumus umum kitin adalah (C8H13NO5) atau disebut juga poli(1,4)-2-Asetamida-2-Deoksi--DGlukosa, dimana strukturnya seperti terlihat pada Gambar 2.1. Gambar 2.1 Struktur Kitin (Meriatna, 2008) Rumus umum kitosan adalah (C6H11NO4) atau disebut sebagai poli(1,4)-2-Amino-2-Deoksi--DGlukosa, dimana strukturnya seperti terlihat pada Gambar 2.2. Gambar 2.2 Struktur Kitosan (Meriatna, 2008) 2.1.1 Sifat-Sifat Kitosan Kitosan adalah padatan amorf berwarna putih yang tidak larut dalam: air, H2SO4 dan asam yang mempunya pH lebih besar dari 6,5. Sedangkan dalam asam mineral pekat seperti HCl dan HNO3 kitosan dapat larut pada konsentrasi 0,15 – 1,1%. Menurut Robert (1992) sudah melaporkan bahwa, kitosan mudah mengalami degradasi secara biologis, tidak beracun dan baik sebagai flokulan dan koagulan serta mudah membentuk membran atau film. Kitosan merupakan suatu biopolimer alam yang bersifat reaktif yang dapat melakukan perubahan-perubahan kimia. Oleh karenanya banyak turunan kitosan dapat dibuat dengan mudah. Beberapa turunan kitosan yang telah dihasilkan dan juga telah diketahui kegunaannya antara lain: a. N-karboksialkil kitosan, digunakan sebagai pengumpul ion logam b. Asetil kitosan, digunakan dalam industri tekstil dan membran c. Kitosan glukan, digunakan sebagai pengkelat ion logam Sandford dan Hutchins (1987) menyatakan sifat kationik, biologi, dan kelarutan kitosan adalah: 1. Sifat kationik: a. Jumlah muatan positifnya tinggi: satu muatan per unit gugus glukosamin, jika terdapat banyak material bermuatan negatif (seperti protein) disekitarnya maka muatan positifnya berinteraksi kuat dengan muatan negatif bahan. b. Flokulan yang baik: gugus NH3+ berinteraksi dengan muatan negatif dari koloid. c. Mengikat ion-ion logam (Fe, Cu, Hg, Pb, Cr, Ni, Pu, dan U). 2. Sifat biologi: a. Polimer alami yang dapat mengalami degradasi secara alami b. Tidak beracun 3. Sifat kimia: a. Linear poliamin (poli D-glukosamin) yang memiliki gugus amino yang baik untuk reaksi kimia dan pembentukan garam dengan asam. b. Gugus amino yang reaktif c. Gugus hidroksil yang reaktif (C3-OH, C6-OH) yang dapat membentuk senyawa turunannya. 4. Sifat kelarutan kitosan (kationik amin, NH3+ ): a. Berbentuk larutan kental b. Berbentuk gel Karakteristik kitosan seperti dituliskan pada Tabel 2.1 Tabel 2.1 Karakteristik Kitosan (Meriatna, 2008). No. Karakteristik Ukuran 1 Bentuk partikel serpihan 2 Kadar air <10% 3 Kadar abu <2% 4 Persen deasetilasi >70% 5 Warna larutan jernih 6 Viskositas: 7 Rendah <200 Pa.s Medium 200-799 Pa.s Tinggi 800-2000 Pa.s Ekstra tinggi >2000 Pa.s Berat molekul <100 gram/mol 2.1.2 Kegunaan Kitosan Kitosan banyak digunakan oleh berbagai industri antara lain: industri farmasi, kesehatan, biokimia, bioteknologi, pangan, pengolahan limbah, kosmetik, agro industri, industri tekstil, industri perkayuan, industri kertas dan industri elektronika. Aplikasi khusus berdasarkan sifat kationiknya adalah untuk pengolahan limbah cair yaitu bersifat sebagai resin penukar ion untuk meminimalisasi logam-logam berat, mengkoagulasi minyak atau lemak, mengurangi kekeruhan, penstabil minyak, rasa dan lemak dalam produk industri pangan (Meriatna, 2008). Tabel 2.2 menunjukkan beberapa aplikasi dan fungsi kitosan di berbagai bidang. Tabel 2.2 Aplikasi dan fungsi kitosan di berbagai bidang (Meriatna, 2008). No. 1. Bidang aplikasi Fungsi Pengolahan limbah - bahan koagulasi/flokuasi untuk limbah cair - menurunkan kadar logam dari limbah cair 2. Pertanian - dapat menurunkan kadar asam dari sayur dan buah 3. - dapat sebagai pupuk - serat tekstil - meningkatkan ketahanan warna - bahan-bahan immobilisasi enzim - limbah industri pangan - koagulasi atau flokulasi - industri buah - flokulan pektin/protein Industri tekstil 4. Bioteknologi 5. Klarifikasi/penjernihan: - pengolahan minuman - flokulan protein/mikroba alkohol 6. - penjernihan air minum - koagulasi - penjernihan kolam renang - flokulan mikroba - penjernihan zat warna - pembentuk komplek - penjernihan tannin - pembentuk komplek - bahan dasar kosmetik untuk rambut Kosmetik dan kulit 7. 8. 2.2 Biomedis Fotografi - mempercepat penyembuhan luka - menurunkan kadar kolesterol - melindungi film dari kerusakan Membran Kata membran berasal dari bahasa latin membrane yang berarti potongan kain. Membran merupakan lapisan semipermeabel yang dapat melewatkan komponen tertentu dan menahan komponen lain berdasarkan perbedaan “ukuran” komponen yang akan dipisahkan (Hobbie, 1978). Membran dapat berfungsi sebagai penghalang (barrier) dalam bentuk lapisan tipis yang sangat selektif antara dua fasa, hanya dapat melewatkan komponen tertentu dan menahan komponen-komponen lain dari suatu fluida yang dilewatkan pada membran (Ackerman, 1988). Komponen aktif membran adalah suatu senyawa bermuatan atau netral yang mampu membentuk senyawa kompleks dengan ion-ion secara reversibel dan membawanya melalui membran organik. Senyawa seperti ini disebut ionofor atau pembawa ion (ion carrier). Membran disebut juga selaput yang bersifat semipermeabel yang memungkinkan lewatnya jenis partikel atau molekul tertentu. Membran dapat berbentuk padatan atau liquid, serta berfungsi sebagai media pemisah yang selektif berdasarkan perbedaan ukuran partikel, koefisien difusivitas, muatan listrik maupun perbedaan kelarutan. Membran banyak digunakan dalam proses pemisahan, pemurnian, dan pemekatan suatu larutan. Keunggulan pemisahan dengan menggunakan membran antara lain hemat energi, serta mampu memisahkan larutan-larutan yang peka terhadap suhu. 2.3 Klasifikasi Membran Membran dapat diklasifikasikan menjadi beberapa kelompok sesuai dengan parameternya. Misalnya membran berukuran tipis atau tebal, dari segi homogenitas strukturnya: membran homogen atau heterogen, dari segi proses pembentukan dan bahan penyusunnya: membran alami atau buatan, dan lain sebagainya. Secara makro, membran merupakan pembatas antara dua fasa yang berlangsung secara selektif, sedangkan proses pemisahannya merupakan skala mikro yang meliputi difusi, kelarutan, osmosis, mikrofiltrasi, ultrafiltrasi, dialisis, pertukaran ion, dan elektrodialisa (Meriatna, 2008). Mulder (1996), mengelompokkan membran berdasarkan beberapa hal yaitu: 1. Jenis membran berdasarkan bahan dasar pembuatannya, yaitu: a. Membran biologis, yaitu membran yang terdapat dalam sel mahluk hidup b. Membran sistesis, dapat dibedakan menjadi membran organik (bahan peyusun utamanya adalah polimer atau cairan), membran anorganik (bahan penyusun utamanya adalah logam atau non logam, kaca, atau campuran keduanya (keramik)). 2. Jenis membran berdasarkan fungsinya sebagai filtrasi, yaitu: Membran dapat diklasifikasikan dalam beberapa golongan yang berhubungan dengan ukuran diameter partikel yang akan dipisahkan, yaitu: a. Membran mikrofiltrasi, memiliki ketebalan ≈ 10 − 150 , ukuran pori ≈ 0,05 − 10 , gaya dorong (driving force) < 200 kPa. Membran ini terbuat dari bahan polimer atau keramik, dan dapat digunakan dalam bidang aplikasi analitik, sterilisasi (makanan, farmasi), pemurnian air, bioreaktor membran dan plasmapheresis (kesehatan). b. Membran ultrafiltrasi, memiliki ketebalan ≈ 150 , ukuran pori ≈ 1 − 100, driving force 100-1000 kPa. Membran ini terbuat dari bahan polimer atau keramik, dan dapat digunakan dalam bidang pembuatan susu, makanan, pembuatan logam, tekstil, dan dalam bidang farmasi. c. Membran hiperfiltrasi (reseverse osmosis), memiliki ketebalan lapisan bawah ≈ 150 dan lapisan atas ≈ 1 , ukuran pori < 2 nm, driving force untuk air payau 1500-2500 kPa dan untuk air laut 4000-8000 kPa. Membran dari: selulosa asetat, aromatik poliamida, dan dapat digunakan sebagai desalinasi air payau dan air laut, digunakan untuk menghasilkan air murni (ultrapure water). 3. Jenis membran berdasarkan ukuran pori prinsip pemisahan yaitu: Berdasarkan ukuran pori pada proses pemisahan, membran dapat diklasifikasikan sebagai berikut: a. Membran berpori, dimana prinsip pemisahannya adalah berdasarkan ukuran partikel zat yang akan dipisahkan terhadap ukuran pori membran. Membran jenis ini biasa digunakan dalam proses pemisahan mikrofiltrasi, ultrafiltrasi dan osmosis. b. Membran tak berpori, prinsip pemisahannya berdasarkan perbedaan kelarutan dan kemampuan berdifusi suatu zat terhadap membran tersebut. Membran ini digunakan untuk pemisahan gas. c. Membran liquid (berbentuk emulsi), dimana membran bertindak sebagai zat pembawa yang menentukan selektivitas terhadap komponen tertentu yang akan dipisahkan. Pemisahan menggunakan membran liquid sering dilakukan dengan teknik difusi dengan memilih jenis emulsi dan zat pembawa yang spesifik untuk zat tertentu. 2.4 Teknologi Filtrasi Filtrasi adalah suatu proses pemisahan suatu zat padat dari fluida (cair maupun gas) yang dilakukan dengan menggunakan suatu medium berpori atau bahan berpori lain untuk menghilangkan sebanyak mungkin zat tersebut. Pada pengolahan air minum, filtrasi digunakan untuk menyaring air hasil dari proses koagulasi, flokulasi dan sedimentasi sehingga dihasilkan air minum dengan kandungan mineral tertentu dan dengan kualitas yang sesuai dengan yang diinginkan. Membran berfungsi memisahkan material berdasarkan ukuran dan bentuk molekul, menahan komponen dari molekul yang mempunyai ukuran lebih besar dari pori-pori membran dan melewatkan komponen yang mempunyai ukuran yang lebih kecil. Dalam hal tertentu pemisahan dilakukan dengan melibatkan muatan pada membran. Larutan yang mengandung komponen yang tertahan disebut konsentrat dan larutan yang mengalir melewati membran disebut permeat. Filtrasi dengan menggunakan membran, selain berfungsi sebagai sarana pemisahan juga berfungsi sebagai sarana pemekatan dan pemurnian dari suatu larutan yang dilewatkan pada membran tersebut. Beberapa pertimbangan atas berbagai penggunaannya menyangkut sifat-sifat mekanik dan kimia, penggunaan secara komersial serta segi ekonomisnya. Keuntungan penggunaan teknologi membran didalam berbagai proses tersebut meliputi: prosesnya yang sederhana, berlangsung pada suhu kamar, sifatnya tidak merusak bahan yang dipisahkan atau dimurnikan, biaya operasinya rendah karena tidak memerlukan bahan kimia. Teknik pemisahan dengan membran umumnya berdasarkan ukuran partikel dan berat molekul yang akan dipisahkan dengan gaya dorong berupa beda tekanan, medan listrik dan beda konsentrasi. Proses pemisahan dengan membran yang memakai gaya dorong berupa beda tekanan dapat dikelompokkan menjadi tiga yaitu mikrofiltrasi (MF), ultrafiltrasi (UF) dan Hiperfiltrasi (HF) / reverse osmosis (RO), yang sudah dijelaskan pada sub bab 2.3. Teknik pemisahan dengan membran yang menggunakan tekanan sebagai gaya dorong dapat dipandang sebagai metode filtrasi yang baik untuk memisahkan partikel-partikel halus, molekul dan ion dalam larutan. Penggunaan tekanan sebagai gaya dorong dapat dioperasikan pada model aliran dead end dan model aliran cross flow. A. Filtrasi Dead end Model aliran dead end diperlihatkan pada Gambar 2.3. Dalam model filtrasi dead end, aliran sampel tegak lurus terhadap membran atau permukaan saringan sehingga hanya ada satu produk filtrasi yaitu permeat saja. Semua larutan sampel melewati filter dan mengalami pemulihan. Pada konfigurasi filtrasi model dead end, aliran berakhir pada permukaan membran sehingga terjadi pengumpulan pada permukaaannya yang dapat menyebabkan penurunan tekanan secara drastis dan menyebabkan terjadinya pengotoran (fouling) pada permukaan membran dan ini berdampak pada penurunan fluks. (permeat) Gambar 2.3 Model aliran dead end (Anonim, 2004) B. Filtrasi Cross Flow Filtrasi model cross flow merupakan sistem dimana larutan umpan dialirkan searah dengan membran, yang memberikan dua produk filtrasi yaitu permeat (larutan yang melewati membran) dan konsentrat (larutan yang mengandung komponen yang tertahan). Dengan konfigurasi pada filtrasi cross flow hanya sebagian zat terlarut yang menumpuk pada membran dan akibatnya penurunan fluks tidak terlalu besar. Filtrasi cross flow lebih banyak digunakan dilihat dari keuntungannya, yaitu: penyumbatan zat terlarut pada membran menjadi berkurang dibandingkan dengan filtrasi dead end. Model aliran cross flow ditunjukkan pada Gambar 2.4. (konsentrat) (permeat) Gambar 2.4 Model aliran cross flow (Anonim, 2004) 2.5 Atomic Absorption Spectroscopy (AAS) Atomic Absorption Spectroscopy (AAS) adalah suatu teknik analisis untuk menetapkan konsentrasi suatu unsur (logam) dalam suatu sampel. AAS pertama kali dikembangkan oleh Sir Alan Walsh pada tahun 1950. Prinsip kerja AAS adalah absorbansi cahaya oleh atom pada sampel. Atom-atom dari sampel akan menyerap sebagian sinar yang dipancarkan oleh sumber cahaya (hollow cathode lamp). Penyerapan energi oleh atom terjadi pada panjang gelombang tertentu sesuai dengan energi yang dibutuhkan oleh atom tersebut untuk bereksitasi dari keadaan dasar ke keadaan yang lebih tinggi. Dengan menyerap energi, atom dalam keadaan dasar dapat mengalami eksitasi ke tingkat yang lebih tinggi. Keadaan ini tidak berlangsung lama, sehingga atom akan kembali ke tingkat energi dasar dan memancarkan energi dalam bentuk radiasi gelombang elektromagnetik. Gambar 2.5 Skema alat Atomic Absorption Spectroscopy (AAS) (Bennaogest, 2011) Gambar 2.5 menunjukkan skema AAS dimana sumber cahaya yang dihasilkan dari lampu katoda yang dilewatkan ke dalam nyala api yang berisi sampel yang telah teratomisasi, kemudian radiasi tersebut di teruskan ke detektor melalui monokromator. Detektor dipakai untuk mengukur intensitas radiasi yang diteruskan, dimana akan dikuatkan oleh penguat AC. Dari detektor menuju sistem penguat yang dipakai untuk membedakan radiasi yang berasal dari sumber radiasi dan radiasi yang berasal dari nyala api setelah radiasi tersebut keluar dari detektor. Selanjutnya sinar masuk menuju pembacaan yang merupakan alat pencatat hasil. Hasil pembacaan dapat berupa angka atau kurva yang menggambarkan absorbansi atau intensitas emisi. 2.6 Metode Permeabilitas Dalam proses filtrasi, ukuran dan distribusi pori dari membran adalah merupakan faktor yang menentukan partikel atau molekul yang akan tertahan dan yang akan melewati membran. Kemampuan atau efisiensi membran dalam proses filtrasi tersebut dapat dinyatakan dalam selektivitas dan fluks atau laju permeatnya. Fluks didefinisikan sebagai volume fluida yang mengalir melalui membran per satuan luas per satuan waktu. Dalam proses filtrasi, fluks yang melewati membran akan menurun seiring dengan waktu dikarenakan akumulasi dari zat terlarut pada permukaan membran. Proses ini disebut pengotoran (fouling) membran yang sangat berpengaruh terhadap kemampuan membran pada proses filtrasi. Fluks dapat dihitung dengan menggunakan rumus: = (2.1) Dimana: J = fluks yang melewati membran ( ∙ ) = volume permeat () = waktu pengukuran (jam) A = luas membran (m2) 2.7 Limbah Fixer Film Roentgent Cairan pencuci film yang telah terpakai banyak mengandung perak yang mana apabila dibuang ke perairan akan membahayakan kehidupan di perairan tersebut. Cairan pencuci film tersebut umumnya terdiri dari 2 jenis cairan yaitu fixer dan developer. Larutan fixer mengandung natrium tiosulfat, natrium sulfit dan natrium bisulfit, kalium aluminium sulfat, dan asam asetat sebagai buffer. Larutan fixer secara lambat menimbulkan gas sulfur dioksida. Gas ini bersifat toksik dan sangat sensitif bagi pengidap asma. Zat-zat tersebut dapat mencapai betuk kestabilannya melalui proses penguraian sebagai berikut: Natrium Sulfit terurai menjadi sulfur dioksida ketika dibiarkan di dalam suatu larutan asam atau air. 2Na2SO3 + 2H2O 2SO2 + 4NaOH Natrium tiosulfat dalam suatu larutan akan terurai menjadi zat sulfur dioksida yang sangat beracun. Banyak pengidap asma yang sensitif terhadap sulfur dioksida. Na2S2O3 + H2O 2SO2 + 2NaOH Natrium bisulfit terurai ke dalam bentuk sulfur dioksida apabila kontak dengan asam asetat atau asam borat (Marta, 2007). NaHSO3 + CH3COOH SO2 + CH3COONa + H2O Proses terjadinya limbah fixer terdiri dari tiga tahap yaitu: Tahap I: proses pemotretan atau penangkapan gambar; Tahap II: proses develoving dan Tahap III: proses pencucian fixer. 1. Tahap I: Proses pemotretan atau penangkapan gambar - Setelah lembaran film fotografi kontak dengan cahaya, secara visual pada lembaran film tersebut sama sekali tidak terlihat ada perubahan. Gambar akan muncul setelah lembaran film dicelupkan ke dalam larutan developer. - Pada saat proses fotografi, terjadi kontak antara film dengan energi cahaya yang menyebabkan terlepasnya elektron dari Br- dari bentuk kristal AgBr. Persamaan reaksinya ditulis sebagai berikut: Energi cahaya + AgBr - Br + e- Elektron akan terperangkap di dalam daerah sensitif kristal yang disebut sensivity speck (SS) SS + e- - SS- Ion bebas Ag+ akan tertarik ke sensitivity specks dan berubah menjadi atom perak netral: Ag+ + SS- - SSAg0 Proses tersebut akan berlangsung terus-menerus secara berulang hingga cahaya menyerang semua lapisan kristal AgBr, dengan reaksi: e- + SSAg SS Ag- + Ag+ - SS Ag2 Proses berlanjut: SS Ag-n-1 + Ag+ - SS Ag- SSAgn Reaksi terakhir SSAgn membentuk kluster-kluster atom perak yang berisi n atom dimana n>4. Dengan demikian semua kristal AgBr akan berisi atom perak netral sangat kecil. Kluster-kluster kecil tersebut membentuk suatu “gambar tidak terlihat“ pada film. Bagian kristal yang tidak terkena cahaya tidak terjadi kluster-kluster. 2. Tahap II: Proses developing Ketika lapisan film diproses di dalam larutan developer, hanya kristal yang mengandung kluster-kluster logam perak yang berubah menjadi hitam. Sedangkan bagian yang lain berubah menjadi tidak berwarna. Lapisan Kristal yang bewarna hitam membentuk suatu bentuk gambar yang difoto, yaitu sebagai akibat reduksi dari ion perak menjadi logam perak oleh larutan developer. Untuk lembaran film foto Rontgent proses di dalam developer ini berlangsung selama 10 detik. Reaksi yang terjadi sebagai berikut: developer + Ag+ (pada kristal yang berisi kluster atom perak) Ag0 developer + Ag+ (pada kristal yang tidak berisi cluster atom perak) tidak ada reaksi. Gambar yang muncul belum stabil sehingga perlu proses selanjutnya yaitu pencucian dengan pelarut fixer yang disebut proses fixing. 3. Tahap III: Proses Pencucian fixer (fixing) Setelah proses developing di dalam larutan developer berhenti, pada lapisan film masih berisi kristal AgBr yang tidak kontak dengan cahaya. Bagian lapisan tersebut masih bersifat sensitif terhadap cahaya sehingga harus disisihkan. Jika tidak, bagian tersebut akan berubah menjadi hitam apabila kontak dengan cahaya. Akibatnya semua bagian gambar menjadi hitam. Kristal-kristal AgBr tidak larut di dalam air sehingga harus dicuci dengan fixer. Fixer mengandung natrium tiosulfat (Na2S2O3) yang terlarut di dalam air menjadi ion tiosulfat. Dengan demikian AgBr dapat dibersihkan dan lembaran film tidak lagi sensitif terhadap cahaya. Adapun hasil dari pencucian lembaran film tersebut menghasilkan limbah fixer yang didalamnya terdapat senyawa AgBr. 2.8 Perak Perak adalah logam lunak, berwarna putih dan padat. Logam perak banyak digunakan sebagai bahan fotografi, konduktor, produk-produk elektronik, baterai, cermin dan sebagainya. Nama latin perak adalah argentum (Ag) dan pada tabel sistem berkala terletak pada golongan IB. Kerapatan logam perak relatif tinggi yaitu 10,5 g/ml dan dapat melebur pada temperatur 960,5 °C. Perak tidak larut dalam asam klorida, asam sulfat encer (1 M) atau asam nitrat encer (2 M). Perak melarut dalam larutan asam nitrat yang lebih pekat (8 M) atau dalam asam pekat panas. Perak membentuk ion monovalen yaitu Ag+ dalam larutan tak berwarna. Perak nitrat mudah larut di dalam air; perak asetat, perak nitrit dan perak sulfat kurang larut; sedangkan semua senyawa perak lainnya tidak larut di dalam air. Halida-halida perak peka terhadap cahaya. Cahaya matahari atau sinar ultraviolet dapat menguraikan endapan perak halida dan butiran perak menjadi abu-abu hitam karena terbentuknya logam perak. Ciri-ciri khas ini dipakai secara luas dalam bidang fotografi. Logam perak memiliki karakteristik fisika dan kimia seperti terlihat pada Tabel 2.3. Tabel 2.3 Karakterisrik logam perak (Anonim, 2011) Karakteristik Keterangan Nomor Atom 47 Simbol Atom Ag Berat Atom 107,868 Warna Putih Bentuk Padat Berat jenis 10,49 ". $%& Hambatan listrik '20℃*15,87 Ωm Rasio beracun 0,37 Konfigurasi Elektron ./0142 53 Diameter Atom 144 pm, Titik leleh 961,78 °6 Titik didih 2162 °6 Bilangan Oksidasi 1 Susunan magnetik Diamagnetik Struktur kristal Face centered cubic (Fcc) Elektronegatif 1,93 (skala pauling) Energi ionisasi 1st: 731,0 kJ/mol, 2nd: 2070 kJ/mol, dan 3rd: 3361 kJ/mol Radius kovalen 153 pm Radius gaya van der waal 172 pm 2.8.1 Pemanfaatan Perak Perak murni mempunyai suatu kilau metalik putih yang tajam. Material perak lebih keras dibandingkan emas dan mudah untuk dilelehkan. Perak yang murni mempunyai sifat kelistrikan yang tinggi dan daya hantar termal yang baik dibandingkan logam lain pada umumnya, stabil di dalam air, tetapi memudar ketika kontak dengan ozon, sulfida hidrogen, atau air yang berisi belerang. Bentuk garamnya adalah perak nitrat (AgNO3) dan perak halida (AgX dengan X adalah golongan VIIA di dalam tabel periodik yaitu F, Cl, Br, I, At) yang secara luas digunakan di dalam teknik fotografi. Berikut adalah beberapa kegunaan perak: 1. Produk elektronik. Contohnya print sirkuit keyboard komputer yang menggunakan kontak listrik perak. 2. Produk cermin yang membutuhkan superior refleksifitas utuk pencahayaan yang jelas. Dewasa ini pembuatan cermin memakai aluminium karena lebih murah. 3. Perak klorida secara luas digunakan dalam pemeriksaan pH dan pengukuran potensiometrik. 2.8.2 Toksisitas Perak Pada dasarnya perak murni tidak bercun, namun perak menjadi berbahaya dalam bentuk senyawa garam. Campuran perak dapat terbawa pada sistem peredaran tubuh mahkluk hidup dan tersimpan pada sistem jaringan tubuh seperti di mata, kulit dan organ internal. Penyakit karena terpapar perak adalah Argyria dimana pada tubuh terlihat adanya warna abu-abu pada kulit dan pada selaput lendir. Nilai oral LD50 (lethal dose 50) pada hewan untuk perak koloid adalah 100 mg/kg dan perak nitrat adalah 129 mg/kg. Sedangkan untuk perak sianida adalah 125 mg/kg (Marta, 2007). Dimana LD50 adalah dosis dari bahan kimia yang dapat menyebabkan kematian sampai 50% dari jumlah hewan yang diuji. Yang dimaksud dengan nilai oral LD50 sebesar 100 mg/kg adalah jumlah dosis perak koloid yang diberikan untuk setiap 1 kg berat badan sebesar 100 mg.