hemoglobin (hb)
advertisement

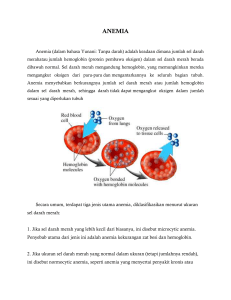
HEMOGLOBIN (HB) Pengertian Hemoglobin Hemoglobin adalah suatu zat warna atau pigmen dari butir butir darah merah, mengandung zat besi (Fe) dan protein. Protein tersebut adalah globin yaitu suatu histone. Warna merah pada Hb disebabkan oleh adanya heme yaitu gugusan metal dengan Fe sebagai inti atom pada pusat molekul porphyrin. Butir retikulosit mengandung RNA mempunyai kempampuan untuk membantu mensintesa Hb. Hb berikatan dengan oksigen membentuk HbO2. Oksigen juga bereaksi dengan Fe2+ didalam Heme. Afinitas Hb terhadap oksigen dipengaruhi oleh pH, suhu, dan konsentrasi 2,3 difosfatgli. Serat (2,3-DPG), (2,3-DPG dan H+) berkompetisi dengan oksigen untuk reaksi deoksigenasi Hb dapat menurunkan afinitas Hb terhadap O2 dengan jalan menempatkan posisi yang aman dari 4 rantai peptida. Bila darah mendapat berbagai obat dan bahan oksidasi lainnya secara invitro atau invivo maka Fe2+ akan berubah menjadi Fe3+ yang membentuk methemoglobin dengan warna gelap dan apabila methemoglobin terlalu banyak dalam peredaran darah dapat menyebabkan suatu kerusakan pada kulit karena terjadinya cyanose ( darah yang banyak mengandung CO2 ). Bila CO dari udara masuk kedalam darah dan bergabung dengan Hb maka CO itu akan mendesak keluar O2 karena afinitas CO 200x lebih besar dari O2 dan hal ini akan mempengaruhi suplai O2 keberbagai otot daging. Dalam keadaan serius hal ini mengakibatkan kematian dalam waktu 30-60 menit. Terdapat berbagai cara untuk menetapka kadar Hb tetapi yang sering dikerjakan dilaboratorium adalah yang berdasarkan kolorimetrik visual metode sahli dan fotoelektrik cara cyanmeth hemoglobin / hemoglobinsianida. Cara sahli kurang baik karena tidak semua Hb dapat diubah menjadi hematin asam misalnya karboksihemoglobin, methemoglobin dan sulfhemoglobin. Selain itu untuk pemeriksaan Hb Sahli tidak dapat distandartkan sehingga kecepatan yang dapat dicapai ± 30%. Namun dari dua metode tersebut, metode cyanmeth hemoglobin adalah metode yang paling dianjurkan oleh Internasional Commite for Standardization in Hematology (ICSH). Hb berperan penting dalam mempertahankan bentuk sel darah merah dan member warna merah pada darah. Struktur hemoglobin yang abnormal bisa menggangu bentuk sel darah merah sehingga dapat menghambat fungsi dan aliran darah melewati pembuluh darah. Beberapa kondisi yang berkaitan dengan jumlah SDM dan Hb yaitu : 1. Jumlah SDM normal tapi Hb kurang karena ukuran SDM lebih kecil dari pada normal yang disebut anemia mikrositik. 2. Jumlah SDM normal tapi Hb kurang karena kadar Hb memang kurang dari keaadan nomal yang disebut anemia hipokromik. Fungsi Hb - Mengatur pertukaran CO2 dan O2 didalam jaringan tubuh. Mengambil O2 dari paru – paru kemudian dibawa keseluruh tubuh untuk bahan bakar. Membawa CO2 dari jaringan tubuh sebagai sisa metabolisme ke paru – paru untuk dibuang. Kadar Hb dipengaruhi oleh : Umur Jenis kelamin Lingkungan / tempat tinggal Kadar Hb pada orang yang tinggal didaratan tinggi kadarnya tinggi karena semakin tinggi suatu tempat maka kadar oksigen semakin rendah, sehingga kadar oksigen yang diangkut dalam jaringan akan menurun dan dapat mempengaruhi sumsum tulang untuk memproduksi erytrosit karena jumlah erytrosit meningkat maka kadar Hb tinggi Kadar Hb pada keaadaan gagal ginjal dan sindroma nefrotik keaadannya rendah karena ginja rusak dan tidak dapat membentuk hormone erytropoetin yang merupakan hormone pembentuk erytrosit. Jenis - jenis hemoglobin (Hb) Pada manusia telah dikenal kurang dari 14 macam Hb yang dipelajari secara mendalam dengan bantuan elektrokoresis. Hb diberi nama dengan simbol alfabeta misalnya ; Hb A, Hb C, Hb D, Hb E, Hb F, Hb G, Hb I, Hb M, Hb S, dan sebagainya. (Joice, 2008) Kadang-kadang Hb diberi nama menurut kota tempat ditemukan jenis Hb atau orang yang menemukannya, misalnya ; Hb New York, Hb Sydney, Hb Bart, Hb Gower, dan lain-lain. Hb A (Adult Dewasa) mulai diproduksi pada usia 5 - 6 bulan kehidupan intrauterine janin, pada usia 6 bulan postnatal kosentrasi Hb A 99%. Hb A terdiri dari 2 rantai α dan 2 rantai β. Hb F (Foetus janin) mulai ditemukan dalam darah pada minggu ke dua puluh usia kehamilan. Pada bayi Hb F dan sebelum usia 2 tahun jumlah tinggal sedikit, diganti oleh Hb A. Karena sifatnya yang resisten terhadap alkali, Hb F ini mudah dipisahkan dari Hb A. Hb F terdiri dari 2 rantai α dan 2 rantai T. Sintesis hemoglobin Fungsi utama sel darah merah adalah mengangkut O2 ke jaringan dan mengembalikan CO2 dari jaringan ke paru-paru. Untuk mencapai pertukaran gas ini, sel darah merah mengandung protein khusus, yaitu hemoglobin dan setiap hemoglobin dewasa normal (Hb A) terdiri atas empat rantai polipeptida α2 β2, masing-masing dengan gugus haemnya sendiri. Berat molekul Hb A adalah 68.000 darah dewasa normal juga berisi jumlah kecil dua hemoglobin lain, Hb F dan Hb A2 yang juga mengandung rantai y dan rantai s masing-masing sebagai pengganti β. 65% hemoglobin disintesis dalam eritroblas dan tiga puluh lima persen hemoglobin disintesis pada stadium retikulosit. Sintesis haem, terjadi banyak dalam mitokondria oleh sederet reaksi biokimia yang dimulai dengan kondensasi glisin dan suksinil. Koenzim A dibawah aksi enzim kunci data-amino laevulinic acid (Ala) sintase yang membatasi kecepatan. Pridoksal fosfat (Vitamin B) adalah koenzim untuk reaksi ini yang diransang oleh eritro protein dan dihambat oleh hacm. Akhirnya protoporfirin bergabung dengan besi untuk membentuk hacm yang masing-masing molekulnya bergabung dengan rantai globin yang terbuat pada poliribosom. Kemudian tetramer empat rantai globin dengan masing-masing gugus hacmnya sendiri terbentuk dalam “kantong” untuk membangun molekul hemoglobin. Struktur hemoglobin Pada pusat molekul terdapat cincin heterosiklik yang dikenal dengan porifin yang menahan satu atom besi. Atom besi ini merupakan situs/lokal ikatan oksigen. Porifin yang mengandung besi disebut heme. Nama hemoglobin merupakan gabungan dari heme dan globin. Globin sebagai istilah generik untuk protein globural. Ada beberapa protein mengandung heme, dan hemoglobin adalah yang paling dikenal dan paling banyak dipelajari. Pada manusia dewasa, hemoglobin berupa tetramer (mengandung 4 subunit protein), yang terdiri dari masing-masing dua sub unit mirip secara struktural dan berukuran hampir sama. Tiap sub unit memiliki berat molekul ± 16,000 Dalton, sehingga berat molekul total tetramernya menjadi sekitar 64,000 Dalton. Tiap sub unit hemoglobin mengandung satu heme, sehingga secara keseluruhan hemoglobin memilki kapasitas empat molekul oksigen. Tinjauan Umum Tentang Pemeriksaan Hemoglobin Penetapan kadar hemoglobin ditentukan dengan bermacam-macam cara dan yang banyak dipakai di laboratorium klinik ialah cara fotoelektrit dan kolorimetrik visual. Cara sahli Prinsip hemoglobin diubah mejadi asam hematin, kemudian warna yang terjadi dibandingkan secara visual dengan standar dalam alat itu. Cara Sahli banyak dipakai di Indonesia, walau cara ini tidak tepat 100%, mengalami kurang darah atau darahnya masih normal, pada pemeriksaan ini factor kesalahan kira-kira 10%, kelemahan cara ini berdasarkan kenyataan bahwa asam hematin itu bukanlah merupakan larutan sejati dan juga alat hemoglobimeter itu sukar distandarkan, selain itu tidak semua macam hemoglobin dapat diubah hematin misalnya ; karboxyhemoglobin, methemoglobin, sulfahemoglobin. Cara cyanmethemoglobin Prinsipnya adalah hemoglobin diubah menjadi cyanmethemoglobin dalam larutan drabkin yang berisi kalium sianida dan kalium ferisianida. Absorbensi larutan diukur pada panjang gelombang 540 nm. Larutan drabkin yang dipakai untuk mengubah hemoglobin, oxyhemoglobin, methemoglobin, dan karboxymoglobin menjadi cyanmethemoglobin, sedang sulfhemoglobin tidak berubah karena tidak diukur. Cara ini sangat bagus untuk laboratorium rutin dan sangat dianjurkan untuk penetapan kadar hemoglobin dengan teliti karena standar cyanmethemoglobin yang ditanggungkan kadarnya stabil dan dapat dibeli. Larutan drabkin teridri atas natrium bikarbonat 1 gram, kalium sianida 50 mg, kalium ferisianida 200 mg, aqudest 100 ml. (Dian Rakyat, 2006) Peningkatan kadar Hb Terdapat pada penderita : anemia, kanker, ginjal, pemberian cairan intravena berlebih dan Hodgkin. Obat – obatan : antibiotik, aspirin obat kanker, indometasin, sulfanomida, primaquin, rifampin. Penurunan kadar Hb Pada pasien : dehidrasi, polisitemia, gagal jantung, luka bakar hebat. Obat – obatan : Metidopa dan Gentamicin Pemeriksaan hemoglobin dengan Metode Sahli Kadar Hb darah dapat ditentukan dengan cara sahli yaitu atas pembentukan asam hematin setelah darah ditambah larutan Hcl 0,1 N. kekurangan perhitungan Hb menggunakan metode sahli adalah pengukuran secara visual dengan mencocokan warna larutan sampel dengan warna batang gelas standard. Metode ini memiliki kesalahan sebesar 30 % sehingga tidak dapat untuk menghitung indeks eritrosit. Darah + Hcl 0,1 N disebut asam hematin. Alat yang digunakan adalah hymometer yang berisi : - Standart Hb dengan warna pembanding Tabung Hb Aspirator Spatula pipet Pastuer Pipet sahli Bahan – bahan yang digunakan adalah - Darah Alkohol 70% HCl 0,1 N Aquades Prosedur pemeriksaan 1. HCl dimasukan kedalam tabung pengencer ± 5 tetes. 2. Darah dihisap dengan pipet hemoglobin sampai garis tanda 0,02 ml. 3. Darah yang melekat pada ujung pipet dihapus menggunakan kapas atau tissue 4. Mencatat waktu dan darah dialirkan kedalam dasar tabung pengencer yang berisi HCl . Darah yang dimasukan tidak boleh menggelembung. 5. Membilas pipet yang masih berisi darah dengan menghisap larutan HCl kedala pipet 2 atau 3 kali sampai darah yang tertinggal pada piprt menghilang. 6. Supaya cairan bercampur dengan rata harus dihomogenkan terlebih dahulu. 7. Tambahkan air setetes demi setetes, tiap kali diaduk dengan batang standart . 8. Baca kadar Hb dengan gram /100ml darah ( gram %) Sumber kesalahan pemeriksaan Hb dengan metode sahli a. b. c. d. e. f. Cara visual / mata telanjang Standar warna tidak stabil Tidak memiliki standarisasi yang tepat Mata lelah Sumber cahaya kurang baik Alat tidak bersih Berdasarkan hasil praktikum dengan metode sahli dinilai lebih besar tingkat keakuratannya dibandingkan dengan metode talquist. Hal tersebut terjadi karena beberapa factor diantarannya adalah ketelitian dari praktikum yang cenderung lebih besar saat menggunakan metode hymometer sahli yang memiliki skala lebih baik dan sebaliknya skala H menggunakan metode sahli memili keakuratan yang sangat rendah yaitu ± 30% dibandingkan dengan metode cyanmeth hemoglobin. Cara sahli bukan cara yang paling teliti karena : 1. Hematin bukan larutan sejati 2. Alat tidak bisa di standartkan 3. Tidak semua Hb dapat diubah menjadi hematin Fungsi pemeriksaan Hb sahli 1. Mengetahui adanya perdarahan yang tersembunyi 2. Mengetahui sebab – sebab penyakit 3. Mengetahui indeks erytrosit 4. Untuk persiapan operasi Syarat penilaian Hb sahli : 1. 2. 3. 4. Skala menghadap kedepan Standart tidak memucat Cahaya terang Setinggi miniskus bawah Penyebab tinggi palsu pada hasil pemeriksaan : 1. 2. 3. 4. 5. Waktu lebih dari 3 menit Banyak gelembung udara Standart warna pucat Darah diujung pipet tidak dihapus Darah yang digunakan lisis Penyebab rendah palsu pada hasil pemeriksaan : 1. 2. 3. 4. 5. 6. Pipet Hb kotor Tusukan kurang dalam Ujung pipet tidak rata Pipet basah Pemipetan kurang dari 20 cm Darah dalam pipet tidak dibilas Nilai Normal 1. Bayi baru lahir : 15,2 – 23,6 gr/dl 2. 3. 4. 5. 6. 7. 8. 9. Noenatus 2 bulan Anak usia 1-3 tahun Anak usia 4-5 tahun Anak usia 6-10 tahun Pria dewasa Wanita dewasa Ibu hamil : 15 – 25 gr/dl : 9 – 14 gr/dl : 10,8 – 12,8 gr/dl : 10,7 – 14,7 gr/dl : 10,8 -15,6 gr/dl : 12 – 16 gr/dl :11 – 14 gr/dl :10 gr/dl Pemeriksaan hemoglobin dengan metode cyanmeth Hemoglobin merupakan penyusun eritrosit berupa protein yang mengandung zat besi dan memiliki afinitas terhadap oksigen untuk membentuk oksihemaglobin. Dari mekanisme afinitas tersebut maka akan dapat berlangsung proses distribusi oksigen dari pulma menuju jaringan (Pearce, 1991). Pada hemoglobin manusia dewasa normal (hemoglobin A), terdapat 2 jenis rantai polipeptida yang dinamakan rantai α dan rantai β. Pada rantai α, masing-masing mengandung141 gugus asam amino, sedangkan pada rantai β masing-masing mengandung 146 rantai asam amino. Sehingga hemoglobin A dinamai α2β2. Akan tetapi tidak semua hemoglobin dalam darah dewasa normal merupakan hemoglobin A, sekitar 2,5% hemoglobin merupakan hemoglobin A2, tempat rantai β diganti oleh rantai δ (α2δ2) (Hanong, 2001). Adanya hemoglobin dalam darah ini menyebabkan eritrosit berwarna merah, karena hemoglobin merupakan penyususn 30% dari total isi eritrosit (Mutshler, 1991). Hemoglobin mempunyai berat molekul penyusun 64.450 dan merupakan suatu molekul yang dibentuk oleh 4 rantai polipeptida, dimana pada tiap polipeptida melekat pada gugus heme. Heme adalah suatu turunan porfirin yang mengandung besi (Fe). Polipeptida ini dinamai secara bersama sebagai bagian dari globin dari molekul hemoglobin. Adapun fungsi dari hemoglobin ini sebagai alat transportasi O2 serta membawa hasil akhir proses respirasi CO2. Ada beberapa metode pemeriksaan hemoglobin.Diantara metode pemeriksaan hemoglobin yang paling sering digunakan di laboratorium dan yang paling sederhana adalah metode sahli, dan yang lebih canggih adalah metode cyanmethemoglobin (Bachyar, 2002). Prinsip kerja : Hemoglobin akan di ubah oleh kalium ferisianida (K3Fe(CN)6) menjadi methemoglobin yang kemudian di ubah menjadi hemoglobin sianida (HiCN) oleh kalium sianida (KCN) Alat : spektrofotometer / fotometer dengan filter 540nm tabung reaksi klinipet dan tip dispenser tabung reaksi Reagen : -larutan drabkin -K3Fe 200mg -KCN 50mg -kH2PO4 140mg -non ionic detergent 1ml -aquadest 1000ml -pH 7,0 - 7,4 larutan sianmethemoblobin standart Cara kerja : kedalam tabung reaksi di masukkan 5ml larutan drabkin hisaplah darah vena (EDTA) dengan pipet otomatik hapuslah kelebihan darah yang menempel dengan kertas pembersih / tissue masukkan darah dalam pipet ke dalam tabung reaksi yang berisi larutan drabkin pipet di bilas dengan larutan drabkin tersebut campur larutan dengan cara mengoyang - goyangkan tabung secara perlahan lahan hingga larutan homegen dan biarkan selama 5 menit lalu baca dengan menggunakan fotometer / spektrofotometer sebagai blanko de gunakan larutan drabkin Nilai normal : laki - laki dewasa : 13,0 - 18,0 gl wanita dewasa : 11,5 -16,5 gl wanita hamil : 11,0 - 16,5 gl anak - anak (3 -6 tahun) : 12,0 - 14,0 gl bayi : 13,5 - 19,5 gl Perhitungan : = absorben sampel x kadar Hb standar = ........... gl % absorben standart Pembahasan Hemoglobin terdiri atas zat besi yang merupakan pembawa oksigen. Jumlah sel darah merah dan kadar hemoglobin tidak selalu meningkat atau menurun bersamaan, sebagai contoh ; penurunan jumlah sel darah merah disertai kadar hemoglobin yang sedikit meningkat atau normal terjadi pada kasus anemia pernisiosa serta kadar sel darah merah yang sedikit meningkat atau normal disertai dengan kadar hemoglobin yang menurun terjadi pada anemia difisiensi zat besi (mikrositik). Pemeriksaan kadar hemoglobin sangat penting dilakukan dalam menegakan diagnosa dari suatu penyakit, sebab jumlah kadar hemoglobin dalam setiap sel darah akan menentukan kemampuan darah untuk mengangkut oksigen dari paru-paru keseluruh tubuh. Pemeriksaan hemoglobin terdiri atas beberapa metode ; Metode Sahli. Metode Kuprisulfat, Metode Tallsquit, dan Metode Cyanmethemoglobin,, dari keempat macam metode di atas yang paling populer atau banyak digunakan adalah metode cyanmethemoglobin, karena praktis atau mudah dikerjakan serta ketelitiannya lebih baik dai pada tiga metode diatas. Dengan mengabaikan masa inkubasi dikawatirkan bisa mendapatkan hasil yang tidak sesuai dikarenakan proses pemeriksaan terlalu singkat mengakibatkan eritrositnya belum dilisiskan maka hasil yang dikeluarkan oleh alat tersebut sangat tinggi. Sesuai prosedur kerja Hb, setelah sampel dicampur dengan reagen drabskin, kemudian diinkubasi selama 5 menit dan baca pada fotometer 5010, hal ini diselenggarakan agar eritrosit dalam darah lisis terlebih dahulu kemudian akan bereaksi dengan kalium cianida membentuk cyanmethemoglobin, namun sering kita jumpai di laboratorium petugas sering mengabaikan masa inkubasi, misalnya dalam pemeriksaan Hb yang seharusnya masa inkubasi 5 menit terkadang tampa diinkubasi sampel pemeriksaan Hb langsung dibaca hingga mengeluarkan hasil yang tidak akurat. Berdasarkan hasil penelitian pada tanggal 9 Juni 2010 perbandingan hasil pemeriksaan kadar hemoglobin inkubasi 2 menit dan 5 menit , terdapat perbedaan namun perbedaan tersebut tidaklah bermakna, dikarenakan nilai perbedaan hasil pemeriksaan kadar hemoglobin 2 menit dan 5 menit hanya mencapai 0 – 0,3 g/dl, namun setelah dilakukan uji statistic dipatkan hasil perbedaan tidak bermakna pada perbadingan pemeriksaan kadar hemoglobin inkubasi 2 menit dan 5 menit metode cyanmethemoglobin. Hal ini tentunya tidak sesuai teori yang telah ada sebelumnya, ini terjadi dikarena pengaruh jumlah sampel yang diteliti oleh peneliti tidak sebayak dengan jumlah sampel yang telah diteliti oleh peneliti sebelumnya. Maka pemeriksaan kadar hemoglobin metode cyanmethemoglobin dianjurkan harus diinkubasi 5 menit sesuai dengan prosedur yang telah ditetapkan. Sumber kesalahan yang mungkin terjadi dalam hasil pemeriksaan kadar hemoglobin metode cyanmethemoglobin adalah satatis vena pada waktu pengambilan darah menyebabkan kadar hemoglobin tinggi dari seharusnya, sebaliknya kontaminasi cairan jaringan menyebabkan kadar hemoglobin rendah dari seharusnya, begitu juga dengan pemakaian antikoagulan yang berlebihan dapat menyebabkan penurunan kadar hemoglobin, terjadi bekuan darah, darah yang lipemik dapat menyebabkan kadar hemoglobin tinggi dari pada seharusnya, adanya leukositas berat menyebabkan kadar hemoglobin tinggi dari pada seharusnya, penggunaan reagen yang sudah tidak baik atau kadaluarsa, volume pemipetan yang kurang tepat, darah kurang atau lebih dari 20 µl maupun saat pemipetan reagen drabskin kurang atau lebih dari 5,0 ml, masa inkubasi yang berkurang menyebabkan eritrosit belum lisis hingga tidak bereaksi sempurana dengan kalium sianida menyebabkan kadar hemoglobin tinggi dari pada seharusnya, penggunaan fotometer 5010 yang kurang baik misalnya panjang gelombang yang tidak tepat.