Keseimbangan Asam Basa
advertisement

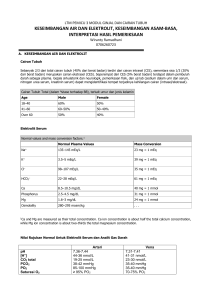
Keseimbangan Asam Basa Dr. OK.M. Syahputra, M.Kes Dr. Almaycano Ginting, M.Kes Departemen Biokimia FK USU KESEIMBANGAN ASAM BASA Pengertian pH Defanisi pH -log (H+) Untuk menghitung pH larutan : 1.Hitung konsentrasi ion Hidrogen (H+) 2.Hitung logaritma ion Hidrogen 3.Nilai pH adalah nilai Log dari No No..2 pH darah normal : 7,4 + 0,05 Konsentrasi pH ditentukan Hidrogen oleh ion (H+) 1 2 ph cairan tubuh • Nanoekivalan konsentrasi ion H ( 40 nEq / L ) dalam keseimbangan terhadap miliekivalen konsentrasi elektrolit seperti Na, K, Cl dan HCO3 cairan tubuh • Ph = - log 10 [ion H] = log 10 ( 1 / [ion H] ), karena [ion H] = 4 * 10-8 Eq / L, maka : Ph = 7,4 • Ph cairan tubuh normal antara 7,3 – 7,4 dan nilai ph yang mungkin untuk hidup antara 6,8 - 8 Produk asam dari metabolisme • Katabolisme asam amino mengandung sulfur menghasilkan asam sulfurik dan katabolisme fosfolipid menghasilkan asam fosforik • Kedua jenis asam tersebut merupakan asam yang tidak dapat menguap (non volatile acid) acid) dan dibentuk sekitar 40 – 80 mEq / hari • Katabolisme karbohidrat dan lipid membentuk sekitar 15.000 – 20.000 mMol CO2 / hari hari,, yang termasuk asam yang mudah menguap (volatile acid) acid) 3 KESEIMBANGAN ASAM BASA Ion H+ berasal dari: dari: 1.Oxidasi karbohidrat/ karbohidrat/ hidrat arang yg tdk sempurna 2.Oxidasi FFA yg tdk sempurna ketosis 3.NH3 dari deaminasi oxidatif asam amino NH3 urea 4.Proses pengangkutan CO2 dr jaringan ke paruparu-paru tdpt ion H+ dlm darah Asam dan basa • HA = H+ + A- , maka asam diartikan sebagai suatu donor proton ( HA ) dan basa sebagai akseptor proton ( A- ) • Eritrosit dan sel tubulus ginjal mengandung enzym karbonat anhidrase, anhidrase, mengkatalisa : CO2 + H2O ⇔ H2CO3 . • Asam karbonat merupakan donor proton (H2CO3) ⇔ H+ + HCO3 - ) maka CO2 selalu digolongkan sebagai asam 4 Mekanisme fisiologis homeostasis Ph • Sistem kerja buffer yang dipengaruhi sifat-sifat fisik dan kimianya sifat• Sistem pernapasan yang mengatur perubahan pCO2 melalui perubahan ventilasi • Sistem pengaturan ginjal terhadap penyimpanan bikarbonat tubuh Buffer • Substansi yang dapat menerima proton • • (ion H ) & meminimalisasi perubahan Ph Suatu larutan asam lemah dengan garamnya Buffer-- buffer penting tubuh : Buffer 1. ECF : HCO32. ICF : HPO42- , H2PO4- dan protein ( Hb ) 3. Karbonat tulang 5 Buffer penting tubuh • Efektivitas tergantung pada : - Ph lazim yang dapat dipertahankan - Konsentrasinya pada cairan tubuh - pKa - Mekanisme khusus yang dimiliki, dimiliki, seperti HCO3 yang merupakan bagian dari sistem terbuka (volatile volatile)) • Bikarbonat : pKa 1,3 U dibawah Ph fisiologis, konsentrasi ekstrasel tinggi, fisiologis, tinggi, berada dalam keseimbangan dengan CO2 (bagian dari sistem terbuka) terbuka) Buffer penting tubuh • Fosfat : konsentrasi intrasel tinggi, tinggi, penting pada pengasaman urine, dengan pKa 6,8 mempertahankan ph cairan tubulus distal 6 s/d 7 • Protein : protein plasma sebagai buffer ekstrasel dengan peran terbatas, terbatas, Hb berperan besar sebagai buffer intrasel • Karbonat tulang : simpanan buffer yang potensial,, berperan penting sebagai potensial respon jangka panjang pada asidosis kronis 6 Transport oksigen darah • Diikat reversible dan dibawa oleh hemeprotein “hemoglobin “ → Hb + O2 ⇔ HbO2 • Derajat pengikatan ditentukan oleh PO2 sekitar Hb • Affinitas Hb terhadap O2 berkurang oleh : 1. Peninggian [ H+ ] 2. Peninggian PCO2 (efek Bohr) Bohr) 3. Peninggian suhu 4. Peninggian [ 2,3 bifosfogliserat eritrosit ] 7 Transport CO2 darah • 10% dalam bentuk larut dalam plasma • 20% berikatan dengan gugus α amino terminal residu valin pada molekul globin dari Hb ( ikatan karbamino ) • 70% dalam bentuk garam HCO3• Efek Haldane : oksigenasi Hb diparudiparu-paru meningkatkan pelepasan CO2, sebaliknya deoksigenasi Hb dijaringan perifer meningkatkan pengambilan CO2 • Chloride shift : gerakan Cl – untuk mengimbangi gerakan HCO3 – antara eritrosit dan plasma → arah gerakan berbeda dijaringan dan dialveoli Pengaturan pernafasan oleh SSP • Diperantarai oleh PCO2 darah • PCO2 lebih besar dari 40 mmHg → stimulasi medulla oblongata → ventilasi alveoli meningkat • Sistem ini mengatur ekskresi dan retensi CO2 darah → pengaturan PCO2 → berperan dalam pengaturan keseimbangan asam basa tubuh 8 Pengaturan asam basa oleh ginjal • Dengan mengatur [ HCO3 - ] darah • Ambang ginjal untuk HCO3 - : 26 – 28 mmol/ L, sedangkan [HCO3 - ] plasma : 25 – 26 mmol/L → sangat sedikit diekskresi • HCO3 – hasil filtrasi darah mengalami reabsorbsi ditub. Proksimal ( 90 %) dan ditub. Distal ( 10 %) • CO2 hasil filtrasi dan CO2 yang berasal dari HCO3 berdiffusi bebas kesel tubulus → dalam sel : CO2 + H2O ⇔ H2CO3 ⇔ H+ + HCO3- ( oleh karbonat anhidrase ) Pengaturan asam basa oleh ginjal • PCO2 darah ↑ → PCO2 sel tubulus ↑ → [H+] ↑ → sekresi H+ kelumen ↑ ( antiport H+- Na+ ) → mereabsorbsi HCO3 dan dan//atau diekskresi melalui urine • H+ dilumen berguna untuk : 1. Reabsorbsi HCO3 2. Bereaksi dengan buffer HPO4= / H2PO4- dan menjadi penukar Na+ pada Na2HPO4 menjadi NaH2PO4 (penghematan Na) 3. Bereaksi dengan NH3 ( deaminasi oksidatif asamasamasam amino disel tubulus ) membentuk NH4+ (pKa = 9,6) untuk dapat menetralisir asam kuat (sulfat dan fosfat ) yang akan diekskresi → melindungi mukosa saluran kemih 9 Persamaan HendersonHenderson-Hasselbach • Ph = pKa + log ( [ A- ] / [ HA ] ) • Ph = pKa + log ( [HCO3-] / [H2CO3] ) • CO2 larut dalam plasma dan membentuk H2CO3 sebanding dengan tekanan CO2 (pCO2 ), sehingga persamaan ini menunjukkan bahwa Ph adalah perbandingan antara HCO3- dan pCO2 • 7,4 = 6,1 + log ( [HCO3-] / [H2CO3] ), untuk mempertahankan Ph ideal tersebut,, perbandingan antara tersebut konsentrasi garam dan asam karbonat adalah 20 : 1 10 Persamaan HendersonHenderson-Hasselbach 20 Jadi : pH = 6,1 + Log 40x0,03 20 7,4 = 6,1+ Log 1 1,3 pH ↓ = acidosis pH ↑ = alkalosis 7,4 = 7,4 Gangguan-gangguan keseimbangan Gangguanasam basa - Gangguan metabolik : - Asidosis metabolik - Alkalosis metabolik - Gangguan respirasi : - Asidosis respiratorik - Alkalosis respiratorik - setiap gangguan primer akan disertai respon skunder dari sistem berlawanan ( gangguan primer metabolik direspon dengan perubahan sistem respirasi dan sebaliknya ) - Ph dikembalikan mendekati normal tetapi tidak terjadi kompensasi berlebihan 11 Asidosis metabolik • Paling banyak ditemukan • Penurunan [ HCO3- ] , karena banyak digunakan menanggulangi kelebihan asam asam organik sisa metabolisme • Ditemukan pada penderita diabetes, gagal ginjal,, gastroenteritis ( dehidrasi ), tirotoksikosis ginjal dsb • Bila mekanisme kompensasi dapat mengembalikan PH normal → asidosis metabolik terkompensasi → konsentrasi bikarbonat meningkat 12 Kompensasi pada asidosis metabolik • Peningkatan H+ disanggah HCO3- plasma dan • • • • Hb (dtk – mnt) mnt) Peningkatan ventilasi → menurunkan PCO2 (mnt ) Peningkatan H+ disanggah HCO3- intertisial (30 mnt) mnt) Peningkatan H+ disangga protein dan fosfat intrasel ( jam ) Penghematan dan pembentukan HCO3- oleh ginjal (2 – 6 hari) hari) 13 Alkalosis metabolik • Peningkatan HCO3- karena konsumsi atau hilangnya substansi asam yang berlebihan • Ditemukan pada pamakai obatobat-obat ulkus peptikum yang lama, obstruksi usus ( muntah ) dsb • Kompensasi tubuh berupa : - Pernapasan lambat dan dangkal untuk retensi CO2 - Mengurangi ekskresi H+ dengan ekskresi garam NaHCO3 dan Na2HPO4 - Menekan pembentukan NH3 14 Asidosis respiratorik • Peningkatan PCO2 karena gangguan fungsi paru → retensi CO2 • Ditemukan pada pneumonia, emfisema, emfisema, keracunan morfin dan barbiturat dsb • Bikarbonat yang dibentuk dari CO2 yang meninggi karena asidosis respiratorik (CO2 + H2O = H2CO3 = H+ + HCO3- ) tidak dapat membantu menyangga H+ Kompensasi pada asidosis respiratorik • Peningkatan H+ disangga oleh Hb eritrosit (detik – mnt ) • Peningkatan H+ disangga oleh protein dan fosfat intrasel ( jam ) • Peningkatan ekskresi H+ dengan peningkatan pembentukan amoniak ditubuli distal dan pembentukan bikarbonat baru oleh ginjal (2 – 6 hari ) 15 Alkalosis respiratorik • Penurunan PCO2 karena gangguan fungsi paru (hiperventilasi) hiperventilasi) • Ditemukan pada keadaan keracunan salisilat, salisilat, demam tinggi, tinggi, histeria dsb • Kompensasi tubuh dengan penurunan ekskresi H+ oleh ginjal • Kompensasi respiratorik untuk gangguangangguangangguan metabolik berlangsung sempurna dalam 24 jam sedangkan kompensasi ginjal untuk gangguangangguan-gangguan respiratorik lebih lambat,, memerlukan waktu 2 – 6 hari lambat 16 Acid Base Disorders pH [H+] Metabolic acidosis ↓ ↑ ↓ [HCO3-] ↓ pCO2 Metabolic alkalosis ↑ ↓ ↑ [HCO3-] ↑ pCO2 Respiratory acidosis ↓ ↑ ↑ pCO2 ↑ [HCO3-] Respiratory alkalosis ↑ ↓ ↓ pCO2 ↓ [HCO3-] Disorder Primary disturbance Secondary response 17 18