1 BAB II TINJAUAN PUSTAKA A. Anatomi Telinga Tengah Telinga
advertisement

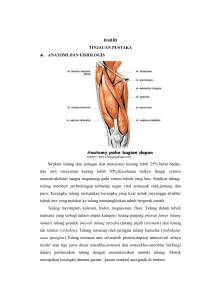
1 BAB II TINJAUAN PUSTAKA A. Anatomi Telinga Tengah Telinga tengah adalah rongga yang terdapat antara membran timpani dengan kapsul tulang labirin yang terdapat ditulang petrosus yang berisi antara lain rangkaian tulang pendengaran dengan otot-otot yang berhubungan, tuba eustakius dan sistem vaskular (Gambar 2.1) ( Probs et al., 2006; Gacek, 2009). Gambar 2.1 Anatomi telinga (Probs et al., 2006) Kavum timpani merupakan rongga, bagian lateral dibatasi oleh membran timpani, medial oleh promontorium, di sebelah superior oleh tegmen timpani dan inferior oleh bulbus jugularis dan nervus fasialis. Dinding posterior dekat ke atap, mempunyai satu saluran disebut aditus, yang menghubungkan kavum timpani dengan antrum mastoid melalui epitimpanum. Eminentia piramidalis terletak di bagian superior-medial dinding posterior dari medial ke lateral. Sinus posterior 2 membatasi eminentia piramidalis dengan tempat keluarnya korda timpani. Kavum timpani terutama berisi udara yang mempunyai ventilasi ke nasofaring melalui tuba Eustakius. Menurut ketinggian batas superior dan inferior membran timpani, kavum timpani dibagi menjadi tiga bagian, yaitu epitimpanum yang merupakan bagian kavum timpani yang lebih tinggi dari batas superior membran timpani, mesotimpanum yang merupakan ruangan di antara batas atas dengan batas bawah membran timpani, dan hipotimpanum yaitu bagian kavum timpani yang terletak lebih rendah dari batas bawah membran timpani (Gambar2.2). Di dalam kavum timpani terdapat tiga buah tulang pendengaran (maleus, inkus dan stapes), korda timpani, muskulus tensor timpani dan ligamentum muskulus stapedius (Helmi, 2005; Probs et al., 2006; Gacek, 2009). Gambar 2.2. Telinga tengah (Probs et al., 2006) B. Otitis Media Supurativa Kronik (OMSK) 1. Definisi 3 Otitis Media Supuratif Kronik (OMSK) mernupakan radang kronik mukosa telinga tengah dengan perforasi membran timpani dan riwayat keluarnya sekret dari telinga tengah (otorrhea) lebih dari 2 bulan, baik hilang timbul atau terus menerus. Sekret tersebut dapat berupa encer, kental atau berupa nanah (WHO, 2004; Djaafar et al., 2010). 2. Etiologi Bakteri penyebab OMSK dapat mencapai telinga tengah baik dari nasofaring melalui tuba eustakius atau dari kanalis akustikus eksterna melalui membran timpani yang perforasi. Bakteri yang paling banyak menyebabkan infeksi telinga tengah adalah pseudomonas aeruginosa (Nason et al., 2009). Sedangkan bakteri gram-negatif lain meliputi proteus mirabilis, klebsiella species, dan eschericia coli. Jenis bakteri gram positif penyebab OMSK adalah staphylococcus aureus, streptococcus sedangkan bakteri pyogenes, anaerob yaitu bacteroides peptostreptococcus dan proprionibacterium (Nason et al., 2009, Nia et al., 2011, Sulabh et al., 2013). 3. Klasifikasi Otitis media supuratif kronik dibagi menjadi 2 tipe, yaitu benigna dan maligna. Nama lain dari tipe benigna adalah tipe tubotimpanik karena biasanya didahului oleh gangguan fungsi tuba yang menyebabkan kelainan di kavum timpani. Selain itu, OMSK benigna disebut juga tipe mukosa karena proses peradangannya hanya mengenai mukosa telinga tengah. Nama lain dari tipe maligna adalah tipe atikoantral karena proses inflamasi dimulai di daerah atik disebut juga tipe tulang karena 4 menyebabkan erosi tulang. OMSK tipe maligna adalah OMSK yang mengandung kolesteatoma (Helmi, 2005; Djaafar et al., 2010). 4. Patogenesis OMSK OMSK ditandai oleh inflamasi irreversibel di telinga tengah dan mastoid. Disfungsi tuba eustakius memegang peranan pada otitis media akut dan otitis media kronik (Helmi, 2005; Chole dan Nason, 2009; Djaafar et al., 2010). Bila bakteri memasuki telinga tengah melalui nasofaring atau defek membran timpani, replikasi bakteri terjadi di dalam efusi serosa. Hal ini disertai dengan pelepasan mediator inflamasi dari sel imun ke dalam ruang telinga tengah. Hiperemia dan leukosit polimorfonuklear mendominasi fase inflamasi akut dan memberi jalan ke fase kronik, yang ditandai oleh mediator seluler mononuklear (makrofag, sel plasma, limfosit), edema persisten dan jaringan. Selanjutnya metaplasia di epitel telinga tengah terjadi perubahan epitel kuboid menjadi epitel kolumnar pseudostratified yang mampu meningkatkan sekret mukoid. Jaringan granulasi menjadi lebih fibrotik, kadang membentuk adesi di telinga tengah dan bahkan dapat terjadi destruksi tulang. Obstruksi kronik menyebabkan perubahan irreversibel di dalam mukosa telinga tengah dan destruksi tulang (Telian et al., 2009; Chole dan Nason, 2009). 5. Diagnosis Diagnosis OMSK ditegakkan berdasarkan anamnesis, pemeriksaan fisik dan pemeriksaan penunjang. a. Anamnesis 5 Gejala yang paling sering dijumpai adalah telinga berair dan keluar sekret di liang telinga. Untuk tipe tubotimpanal, sekret lebih banyak dan mukos, tidak berbau busuk. Sedangkan tipe atikoantral, sekret lebih sedikit, berbau busuk, kadangkala disertai pembentukan jaringan granulasi atau polip dan sekret yang keluar dapat bercampur darah. Kadang-kadang pasien datang dengan keluhan kurang pendengaran atau telinga keluar darah (Helmi, 2005; Djaafar et al., 2010). Keluhan nyeri dapat terjadi karena drainase pus tidak lancar. Nyeri dapat berarti adanya komplikasi akibat hambatan pengaliran sekret, terpaparnya durameter atau dinding sinus lateralis atau ancaman pembentukan abses otak. Nyeri merupakan tanda komplikasi OMSK seperti petrositis, subperiosteal abses atau trombosis sinus lateralis. Vertigo merupakan gejala serius lainnya. Gejala ini memberi kesan adanya fistula, berarti ada erosi pada labirin tulang seringkali pada kanalis semisirkularis horisontalis (Helmi, 2005; Djaafar et al., 2010). b. Pemeriksaan Klinis Pemeriksaan otoskopi akan menunjukan adanya dan letak perforasi, sehingga melalui otoskopi dapat dinilai kondisi mukosa telinga tengah. Beberapa tanda klinik dapat menjadi pedoman akan adanya OMSK tipe maligna, yaitu perforasi pada marginal atau pada atik. Tanda ini biasanya merupakan tanda dini dari OMSK tipe maligna, sedangkan pada kasus yang sudah lanjut dapat terlihat abses atau fistel retro aurikuler (belakang telinga), polip atau jaringan granulasi di liang telinga luar yang berasal dari dalam telinga tengah, terlihat kolesteatoma pada telinga tengah, (sering pada epitimpanum), sekret berbentuk nanah dan berbau aroma kolesteatoma (Helmi, 2005; Probs et al., 2006; Aboet, 2007). 6 c. Pemeriksaan Audiologi Evaluasi audiometri, pembuatan audiogram nada murni untuk menilai hantaran tulang dan udara, penting untuk mengevaluasi tingkat penurunan pendengaran dan untuk menentukan gap hantaran udara dan hantaran tulang. Audiometri tutur berguna untuk menilai ‘speech reception threshold’ pada kasus dengan tujuan unuk memperbaiki pendengaran (Aboet, 2007; Djaafar et al., 2010). Pada pemeriksaan audiometri pasien OMSK biasanya didapati tuli konduktif. Kekurangan pendengaran ini merupakan akibat dari perforasi membran timpani dan putusnya rantai tulang pendengaran pada telinga tengah karena proses osteomielitis sehingga suara yang masuk ke telinga tengah langsung menuju tingkap oval. Kekurangan pendengaran derajat yang lebih tinggi lagi dapat terjadi bila proses infeksi melibatkan koklea atau saraf pendengaran (Aboet, 2007; Djaafar et al., 2010). d. Pemeriksaan Radiologi Radiologi konvensional, foto polos radiologi, posisi Schuller berguna untuk menilai kasus kolesteatoma, sedangkan pemeriksaan CT scan dapat lebih efektif menunjukkan anatomi tulang temporal dan kolesteatoma. Proses ini terbentuknya selalu dihubungkan dengan mastoiditis kronik, dan biasanya ditemukan pada mastoid yang sklerotik. Gambaran yang terlihat pada foto rontgen mastoid adalah area yang densitasnya rendah dengan dikelilingi oleh area yang densitasnya tinggi. Area dengan densitas tinggi merupakan hasil dari reaksi osteotik karena proses inflamasi. Kolesteatoma biasanya timbul di regio antrum mastoid dan pada atik (Aboet, 2007; Djaafar et al., 2010). 7 6. Komplikasi Komplikasi OMSK diklasifikasikan sebagai komplikasi intratemporal dan intrakranial. Komplikasi intratemporal meliputi mastoiditis, petrositis, labirintitis, dan paralisis nervus fasialis. Komplikasi intrakranial meliputi abses ekstradural, abses otak, abses subdural, tromboflebitis sinus sigmoid, hidrosepalus otikus, dan meningitis (Djaafar et al., 2010; Arts et al., 2014). 7. Penatalaksanaan a. OMSK tipe benigna OMSK tipe benigna dibagi menjadi fase tenang dan aktif. Pada OMSK fase tenang dapat dilakukan epiteliasasi tepi perforasi melalui tindakan di poliklinik dengan melukai pinggir perforasi secara tajam atau dengan menggunakan zat kaustik seperti nitras argenti 25%, asam triklor asetat 12%, alkohol absolut dan lainlain. Hasil pengobatan yang memuaskan tercapai apabila membran timpani menutup dan tidak didapati tuli konduktif. Apabila ada tuli konduktif dan atau jika perforasi menetap, idealnya timpanoplasti dilakukan dengan atau tanpa mastoidektomi. Pada OMSK fase aktif dilakukan cuci telinga, diberikan antibiotik topikal dapat ditambahkan antibiotik sistemik sesuai kultur. Jika otore menetap lebih dari 3 bulan dilakukan operasi mastoidektomi dan timpanoplasti (Helmi, 2005). b. OMSK tipe maligna Prinsip terapi OMSK jenis maligna ialah pembedahan, yaitu mastoidektomi Jadi bila terdapat OMSK tipe maligna, maka terapi yang tepat ialah dengan melakukan mastoidektomi dengan atau tanpa timpanoplasti. Terapi konservatif 8 dengan medikamentosa hanyalah merupakan terapi sementara sebelum dilakukan pembedahan. Bila terdapat abses subperiosteal retroaurikuler, maka insisi abses sebaiknya dilakukan tersendiri sebelum kemudian dilakukan mastoidektomi (Helmi, 2005; Djaafar et al., 2007). C. Kolesteatoma 1. Definisi Kolesteatoma adalah suatu kista epitel yang dilapisi oleh epitel skuamosa berlapis yang berisi deskuamasi keratin yang terperangkap dalam rongga timpanomastoid dan dapat juga terperangkap dimanapun diantara bagian pneumatik dari tulang temporal (Louw, 2010; Frickmann et al., 2012; Meyer et al., 2014). 2. Histologi Secara histologis kolesteatoma dapat dibagi dua yaitu matriks (epithelium) dan peri-matriks (underlying connective tissue). Matriks kolesteatoma mempunyai empat lapis yang berbeda yaitu basal, spinosus, granulous dan stratum korneum, seperti pada kulit yang tipis. Peri-matriks adalah lapisan subepitelial yang berdekatan dengan jaringan ikat ditandai oleh adanya jaringan ikat longgar yang terbuat dari kolagen dan elastic fibers, fibroblas dan sel inflamasi. Analisis histologis dari matriks kolesteatoma memperlihatkan pola yang berbeda yaitu atrofi, akantosis, hiperplasia lapisan basal dan epithelial cones (Louw, 2010; Frickmann et al., 2012). 3. Patogenesis Kolesteatoma Kolesteatoma didapat secara histologi dibagi menjadi primer dan sekunder. Terdapat teori – teori sebagai etiopatogenesis kolesteatoma didapat. Beberapa teori 9 telah dikembangkan untuk menjelaskan terjadinya kolesteatomaa primer, termasuk diantaranya teori invaginasi, teori hiperplasia sel basal, teori otitis media efusi, dan teori invasi epitelial. Teori kolesteatoma didapat sekunder ada 3 yaitu teori implantasi, teori metaplasia, dan teori invasi epitelial (Louw, 2010; Frickmann et al., 2012; Meyer et al., 2014). a. Teori Implantasi Teori implantasi menjelaskan formasi kolesteatoma sebagai implantasi iatrogenik kulit ke dalam telinga tengah atau gendang telinga akibat dari pembedahan, benda asing atau trauma tekanan. Kolesteatoma dapat timbul sekunder dari miringitomi untuk pemasangan tabung ventilasi atau dari prosedur timpanoplasti. Pada teori ini kolesteatoma timbul akibat migrasi epitel atau penempatan yang salah dari miringotomi atau perubahan letak flap membran timpani ke dalam telinga tengah pada saat timpanoplasti. Kolesteatoma akuisita sekunder juga diperkirakan timbul dari perkembangan perforasi akibat otitis media akut nekrotik ketika masa kanak-kanak (Louw, 2010; Frickmann et al., 2012; Meyer et al., 2014). b. Teori Metaplasi Infeksi dan inflamasi jaringan yang kronik dapat mengalami transformasi metaplasia. Transformasi epitel kolumnar menjadi epitel skuammous berlapis berkeratinisasi dapat terjadi sekunder akibat adanya otitis media rekuren atau kronik. Epitel skumousa berkeratinisasi telah ditemukan pada biopsi telinga tengah pada pasien otitis media pada anak. Namun progresifitas dari kolesteatoma masih belum berhasil dipaparkan (Chole dan Nason, 2009; Meyer et al., 2014). 10 c. Teori Invasi Epitelial Invasi pada telinga tengah oleh kulit dari dinding meatus akustikus eksterna dari permukaan membran timpani melalui perforasi marginal dan atau perforasi atik. Ini didukung oleh bukti percobaan yang menunjukkan bahwa sel epitel bermigrasi sepanjang permukaan sampai ia menemukan epitel permukaan lain, dimana pada tempat tersebut mereka berhenti bermigrasi, ini dinamakan inhibisi kontak. Bila mukosa telinga tengah hancur karena infeksi, maka ini akan menyebabkan migrasi epitel dari perforasi marginal. Ini merupakan teori yang diterima secara umum untuk tejadinya kolesteatoma akuisita sekunder pada bagian posterior superior membrane timpani (Louw, 2010; Frickmann et al., 2012; Meyer et al., 2014). 4. Stadium dan derajat destruksi akibat Kolesteatoma Belum ada kesepakatan antara ahli tentang tingkat destruksi tulang akibat kolesteatoma. Saleh dan Mills (1999) membuat klasifikasi stadium kolesteatoma berdasarkan lokasi kolesteatoma, perluasan lesi dan komplikasi pre operasi. The Japan Otological Society (JOS) Cholesteatoma Staging System (2008) membagi stadium destruksi tulang berdasarkan perluasan lesi dan komplikasi yang menyertai (Mishiro et al., 2014). Pembagian menurut Haruyama et al. (2010), tingkat destruksi tulang berdasarkan ada atau tidaknya paparan terhadap nervus fasialis, paparan terhadap duramater, fistula kanalis semisirkularis. Derajat destruksi tulang berdasarkan Kuczkowski et al. (2011) membagi derajat invasi kolesteatoma dan jaringan granulasi berdasarkan erosi, destruksi osikel dan area yang terlibat. Pembagian ini dikatagorikan menjadi derajat ringan, sedang dan berat. 11 D. Receptor Activator of Nuclear Factor-ĸB Ligand (RANKL) RANKL diketahui juga sebagai tumor necrosis factor-related activationinduce cytokine (TRANCE), osteoclast differentiation factor (ODF), osteprotegerin ligand (OPGL), tumor necrosis factor super family (TNSF11) adalah salah satu sitokin yang berperan penting dalam metabolisme tulang karena mengatur perkembangan, pemeliharaan dan aktivasi osteoklas. Gen RANKL mengkode 316 asam amino, protein yang secara struktural monomer tapi secara fungsi homotrimerik Ekspresi RANKL ditemukan di berbagai jaringan tubuh yaitu osteoblas, stroma sel sumsung tulang, limfosit T aktivasi dan timosit CD4 CD8. Ekspresi RANKL dapat berbentuk molekul membran yang melekat pada permukaan sel dan molekul yang terlarut dalam sirkulasi oleh karena aktivitas enzim TNF-alpha convertase (TACE). Ekspresi RANKL dipicu dan dipengaruhi oleh mediator inflamasi seperti tumor necrosis factor α (TNFα), prostaglandin E2 (PGE2), interleukin (IL-6), IL-1β (Kreja et al., 2009; Haruyama et al., 2010; Kohli, 2011; Lee et al., 2012; Walsh dan Choi, 2014). Di dalam tulang, RANKL berfungsi untuk metabolisme tulang. RANKL memainkan peran penting dalam osteoklastogenesis. Selain RANKL osteoblas juga menghasilkan M-CFS yang berperan juga pada osteoklastogenesis. M-CSF mengikat reseptor precursor c-fms yang mengatur awal proliferasi, diferensiasi dan daya tahan prekursor osteoklas. Interaksi antara receptor activator of nuclear factor ĸB (RANK) dan RANKL adalah tanda awal osteklastogenesis dan aktivasi osteoklas (Gambar 2.3). Sinyal RANKL yang berlebihan menyebabkan 12 peningkatan pembentukan osteoklas dan resorbsi tulang (Kreja et al., 2009; Kohli, 2011; Arai et al., 2012; Walsh dan Choi, 2014). Osteoclast Precursor Activated Osteoclast RANK OPG RANKL osteoblast / stromal cell bone formation bone resorption Gambar 2.3 Biomolekular komplek interaksi RANKL-RANK/OPG, modifikasi gambar Kohli (2011) RANKL bersama dengan M-CSF mengaktifkan TNF reseptor associated factor (TRAF6) yang selanjutnya menginduksi dan aktivasi NFATc1 (nuclear factor of activated T cells) dan c-Fos, merupakan faktor transkripsi untuk osteoklastogenesis. NFATc1 bertindak sebagai modulator positif diferensiasi osteoklas. (Gambar 2.4) (Yucel et al., 2013; Youn et al., 2013). 13 Gambar 2.4 Jalur aktivasi RANKL/RANK dalam osteoklastogenesis, RANKL diekspresikan oleh permukaan membran osteoblas berinteraksi dengan RANK, yang diekspresikan oleh prekursor osteoklas (preOCL). Interaksi ini merekrut TRAF6 yang mengaktivasi NFĸВ dan c-Fos (Teti et al., 2010). OBL (Osteoblas), TRAF (TNF receptor ascociated factors), AP-1 (Activator Protein), MITF (microphthalmia associated factor). E. Osteoprotegerin (OPG) Osteoprotegerin dikategorikan sebagai tumor necrosis factor receptor super family 11 B (TNFRSF11B), pertama kali diidentifikasi melalui penemuan homolog tumor necrosis factor receptor super family (TNFRSF) pada tikus dan homolog manusia. OPG tikus identik dengan OPG manusia yang menunjukkan >85% homologi. Nama lain dan ditemukan identik dengan OPG adalah 14 osteoklastogenesis inhibitory factor (OCIF), TNF receptor-like molecule 1(TR1), and follicular dendritic cells-derived receptor-1 (FDCR-1) (Kohli, 2011; Suda et al., 2013; Walsh and Choi., 2014). OPG disekresikan dalam bentuk glikosilasi, secara fungsional berbentuk homodimerik dan merupakan modifikasi protein pasca traslasional. OPG merupakan reseptor larut dengan TNF-R. Reservoar selnya adalah osteoblas, stroma sel sumsung tulang, tetapi dapat diinduksi oleh limfosit B, dendritic cells (DCs) dan folikel DCs. Ekspresi OPG diregulasi positif oleh estrogen dan diregulasi negatif oleh prostaglandin E2 (PGE2) dan glukokortikoid dengan beragam faktor, yang sebagian besar terkait dengan homeostasis tulang (Kohli, 2011; Raju et al., 2011; Walsh dan Choi., 2014). OPG merupakan reseptor solubel, yang dalam persaingan dengan reseptor RANK mengikat RANKL. OPG dan RANK, keduanya merupakan reseptor yang mempunyai daya tarik menarik yang sama terhadap RANKL. OPG merupakan antagonis reseptor endogen dan setelah berikatan dengan RANKL menghambat osteoklastogenesis, sehingga menghambat proses resorpsi tulang (Kohli, 2011; Lee et al., 2012; Walsh and Choi, 2014). Kompleks OPG-RANKL mengimbangi efek kompleks RANK-RANKL, sehingga berperan penting dalam homeostasis tulang. Hal ini dapat lebih dibuktikan oleh fakta bahwa pada tikus transgenik di mana pada gen OPG tersingkir dapat terjadi osteoporosis parah dengan cepat. Fraktur spontan diamati juga pada hewan model ini karena pembentukan komplek RANKL-RANK yang berlebihan. Percobaan ini membuktikan bahwa pembentukan RANKL-OPG kompleks dan 15 RANKL-RANK kompleks adalah penting sebagai faktor dalam diferensiasi dan aktivasi osteoklas, sehingga mempengaruhi regenenerasi tulang secara kumulatif (Kohli, 2011; Walsh dan Choi., 2014). Rasio RANKL/OPG: tinggi Rasio RANKL/OPG: rendah Makrofag Makrofag Pre osteoklas Pre osteoklas Osteoklas multinuklear Pre osteoklas Osteoklas apoptosis Osteoklas aktif RANK Resorpsi tulang RANKL OPG Gambar 2.5 Rasio RANKL/OPG dalam aktivasi osteoklas modifikasi gambar Kajiya et al. (2010) F. Receptor Activator of Nuclear Factor ĸB (RANK) Receptor activator of nuclear factor ĸB (RANK), nama lainnya adalah TNFrelated activation-induced cytokine receptor (TRANCE-R) atau osteoclast differentiation and activation receptor (ODAR), merupakan reseptor untuk RANKL. RANK telah ditetapkan sebagai TNFRSF11A dan mengkode 616 asam amino heterotrimerik serta merupakan protein transmembran tipe 1 yang 16 mengandung empat ekstraseluler sistein. Gen manusia mengkode RANK pada kromosom 18q22.1. RANK terdeteksi di timus, hati, usus, kelenjar susu, postat, pankreas, sumsum tulang, jantung, paru-paru, otak, otot rangka, ginjal dan kulit. RANK diekspresikan secara primer pada monosit/makrofag termasuk prekursor osteoklas, sel T aktivasi, osteoklas matur, sel dendritik, kondrosit dan tropoblas. RANK diinduksi kuat oleh M-CSF khususnya pada sel prekursor osteoklas (Lee, 2010; Kohli, 2011; Walsh dan Choi., 2014). Interaksi antara RANK dan RANKL merupakan dimulainya osteoklastogenesis dan aktivasi osteoklas. Oleh karena, teori mekanisme molekuler terdiri dari ikatan ligan RANKL dengan reseptor umpan larut OPG, dalam kompetisinya dengan RANK, diikuti oleh penghambatan pembentukan osteoklas melalui RANKL (Kohli, 2011; Walsh and Choi, 2014). D. Peran Jaringan Granulasi, Kolesteatoma, RANKL, OPG pada Destruksi Tulang Kolesteatoma pada telinga tengah mempunyai ciri proliferasi abnormal yang mengakibatkan akumulasi debris keratin, invasi telinga tengah oleh epitel keratinisasi dan osteolisis dari tulang pendengaran, tulang temporal, invasi ke telinga dalam atau menuju intrakranial. Meskipun telah banyak penelitian mengenai mekanisme pembentukan kolesteatoma, patogenesis yang tepat dari penyakit ini belum berhasil diungkapkan. Pada awalnya disebutkan penyebab destruksi adalah tekanan yang diakibatkan akumulasi debris keratin. Teori biokemikal akhirnya diterima sebagai suatu dalil bahwa enzim dan sitokin inflamasi yang dilepaskan 17 oleh kolesteatoma akan menyebabkan lisis tulang dan destruksi (Chole dan Nason, 2009; Haruyama, 2010; Kanemaru et al., 2010). Penemuan klinis paling banyak pada otitis media kronik supurativa dengan kolesteatoma dan jaringan granulasi adalah kerusakan tulang pendengaran karena resorpsi tulang yang dimediasi oleh osteoklas. Osteoklas merupakan sel multinuklear yang khusus bertanggung jawab untuk resorpsi tulang. Osteoklas berasal dari sel-sel hemopoetik dari turunan monosit atau makrofag. Interaksi prekursor osteoklas dengan osteoblas atau sel stroma sangat penting untuk diferensiasi osteoklas (Kreja et al., 2007; Kuczkowsky et al., 2010). Patogenesis beberapa perubahan ini melibatkan tulang pada daerah yang berdekatan dengan kolesteatoma. Resorpsi tulang adalah proses yang diatur tergantung pada diferensiasi monosit osteoklas, yang diaktifkan oleh beberapa faktor pertumbuhan (growth factor) dan sitokin. Beberapa dari mereka dilepaskan ke lingkungan mikro tulang oleh sel kolesteatoma dan yang lain diekskresikan oleh sel-sel inflamasi termasuk interleukin (IL-1α-β,IL-6), tumornecrosisfactor (TNFα), neurotransmitters, nitric oxide, prostaglandin E (PGE), interferon-β, parathyroid hormone–related protein, macrophage-colony stimulating factor (MCSF), RANKL, and OPG (Kuckzkowski, 2010; Yucel et al., 2013). Menurut Kanemaru et al. (2010), (Gambar 2.6) tekanan akibat akumulasi keratin dan produk lainnya menyebabkan stres mekanik telinga luar, tengah dan dalam. Stres mekanik menginduksi produksi MIF (macrophag migration inhibitory factor). MIF menginduksi produksi MMPs (matrix-metalloproteinases). MMPs bekerja untuk angiogenesis dan proliferasi sel, disamping itu aktivasi MMPs 18 menyebabkan degradasi matrik ekstraseluler yang penting untuk perkembangan kolesteatoma (Kanemaru et al., 2010), Gambar 2.6 Mekanisme destruksi tulang oleh kolesteatoma (Kanemaru et al., 2010) Pada saat yang sama, MIF juga menginduksi makrofag untuk memproduksi sitokin pro-inflamasi dan kemokin, terutama IL-1, IL-6 dan TNF-α yang berperan dalam destruksi tulang. Oleh karena itu MIF adalah faktor kunci mekanisme destruktif tulang dari cholesteatoma (Kanemaru et al., 2010). E. Imunohistokomia Imunohistokimia adalah metode untuk mendeteksi keberadaan protein spesifik di dalam sel suatu jaringan dengan menggunakan prinsip pengikatan antara antibodi (Ab) dan antigen (Ag) (Ramos dan Miller, 2014). Teknik imunohistokimia bermanfaat untuk identifikasi, lokalisasi, dan karakterisasi suatu protein tertentu, 19 serta menunjang diagnosis, terapi, dan prognosis penyakit kanker. Langkahlangkah dalam melakukan imunohistokimia dibagi menjadi 2, yaitu preparasi sampel dan labeling. Preparasi sampel adalah persiapan untuk membentuk preparat jaringan dari jaringan yang masih segar. Preparasi sample terdiri dari pengambilan jaringan yang masih segar, fiksasi jaringan biasanya menggunakan formaldehid, embedding jaringan dengan parafin atau dibekukan pada nitrogen cair, pemotongan jaringan dengan menggunakan mikrotom, deparafinisasi dan antigen retrieval untuk membebaskan epitop jaringan, dan bloking dari protein tidak spesifik lain. Sampel labeling adalah pemberian bahan-bahan untuk dapat mewarnai preparat. Sampel labeling terdiri dari imunodeteksi menggunakan antibodi primer dan sekunder, pemberian substrat, dan counterstaining untuk mewarnai jaringan lain di sekitarnya. Ikatan antibodi-antigen divisualisasikan menggunakan senyawa label/marker (Ramos dan Miller, 2014). Terdapat dua metode dasar identifikasi antigen dalam jaringan dengan imunohistokimia, yaitu metode langsung (direct method) dan tidak langsung (indirect method). Metode langsung (direct method) merupakan metode pengecatan satu langkah karena hanya melibatkan satu jenis antibodi, yaitu antibodi yang terlabel, contohnya antiserum terkonjugasi fluorescein isothiocyanate (FITC) atau rodhamin. Di sisi lain, metode tidak langsung (indirect method) menggunakan dua macam antibodi, yaitu antibodi primer (tidak berlabel) dan antibodi sekunder (berlabel). Antibodi primer bertugas mengenali antigen yang diidentifikasi pada jaringan (first layer), sedangkan antibodi sekunder akan berikatan dengan antibodi primer (second layer). Antibodi kedua merupakan anti-antibodi primer. Pelabelan 20 antibodi sekunder diikuti dengan penambahan substrat berupa kromogen. Kromogen merupakan suatu gugus fungsi senyawa kimiawi yang dapat membentuk senyawa berwarna bila bereaksi dengan senyawa tertentu. Disamping kedua metode di atas, analisis imunohistokimia juga dapat dilakukan melalui metode Peroxidaseanti-Peroxidase dan metode Avidin-Biotin-Complexis (ABC) (Ramos dan Miller, 2014). Metode Peroxidase-anti-Peroxidase (PAP) adalah analisis imunohistokimia menggunakan tiga molekul peroksidase dan dua antibodi yang membentuk seperti roti sandwich. Teknik ini memanfaatkan afinitas antibodi terhadap antigen (enzim) untuk membentuk kompleks imun stabil sebagai perlawanan terhadap proses kimia terkonjugasi Fitur unik dari prosedur ini adalah larutan enzim-antibodi dan kompleks imun PAP. Enzim Horseradish Peroxidase, protein imunogenik, digunakan untuk menyuntik spesies tertentu dan merespon imun poliklonal yang dihasilkan terhadap enzim. Antiserum ini dipanen dan ditempatkan dalam larutan pada enzim sehingga membentuk kompleks imun yang larut. Sedangkan metode ABC adalah metode analisis imunohistokimia menggunakan afinitas terhadap molekul avidin-biotin oleh tiga enzim peroksidase. Situs pengikatan beberapa biotin dalam molekul avidin tetravalen bertujuan untuk amplifikasi dan merespon sinyal yang disampaikan oleh antigen target (Ramos dan Miller, 2014). IHC merupakan teknik deteksi yang sangat baik dan memiliki keuntungan yang luar biasa untuk dapat menunjukkan secara tepat di dalam jaringan mana protein tertentu yang diperiksa. IHC juga merupakan cara yang efektif untuk memeriksa jaringan. Kekurangan dari teknik ini adalah kurang spesifik terhadap 21 protein tertentu tidak seperti teknik imunoblotting yang dapat mendeteksi berat molekul protein dan sangat spesifik terhadap protein tertentu (Ramos dan Miller, 2014). 22 F. Penelitian Relevan Beberapa penelitian yang terkait dengan judul penelitian ini tercantum dalam tabel 1.1. Tabel 1.1 Orisinalitas Penelitian Peneliti, Judul Variabel Hasil Tahun Jeong et al. Ekpression of OMSK dengan Peningkatan ekspresi RANKL and OPG kolesteatoma, jaringan RANKL pada kolesteatoma in Middle EAR kulit postaurikular dibandingkan kulit Cholesteatoma normal ekspresi postaurikular normal Tisue RANKL, ekpresi OPG Minx et al. Expression and Kolesteatoma, kulit Tingkat ekspresi RANKL (2007) significance of kanalis auditori dan RANK meningkat di nuclear factor- normal, ekspresi perimatrik kolesteatoma, kappa B ligand and RANKL, ekspresi destruksi, yang erat correlation factor in RANK, ekspresi OPG kaitannya dengan erosi (2006) Kuczkowski et al. (2010) tissue of otitis media tulang yang disebabkan oleh with cholesteatoma kolesteatoma Expression of the OMSK dengan Rasio RANKL/OPG lebih receptor activator kolesteatoma, OMSK tinggi secara signifikan for nuclear factor- tanpa kolesteatoma, dibandingkan OMSK tanpa κB ligand and ekspresi RANKL, kolesteatoma. osteoprotegerin in ekspresi OPG Korelasi postitif rasio chronic otitis media RANKL/OPG dengan destruksi tulang pada OMSK dengan kolesteatom tetapi tidak bermakna 23 G. Kerangka Teori Infeksi bakteri telinga tengah OMSK OMSK Benigna Kolesteatom aa OMSK Maligna Stres mekanik MIF Makrofag Osteoblas/stroma sel/limfosit T IL 1β, IL-6, TNFα RANK MMPs 1,2,3,8,9,13 PGE2 RANKL OPG Prekursor osteoklas Aktivasi osteoklas Destruksi tulang 24 : sitokin yang diteliti : sitokin yang diteliti : menghambat : ligan dan : reseptor Adanya infeksi bakteri telinga tengah pada OMSK benigna dan maligana menyebabkan terbentuknya antigen. Antigen memasuki sel inang diambil oleh sel penyaji (APC: antigen precenting cell), dalam hal ini adalah makrofag. Antigen membentuk komplek dengan protein tersandi kemudian dipresentasikan pada limfosit T. Sel – sel yang terikat pada sel T tersebut menghasilkan mediator inflamasi sitokin IL1, IL6, dan TNFα. Mediator inflamasi tersebut memediasi resorpsi tulang dengan mempengaruhi osteoblast untuk memproduksi RANKL. Makrofag juga memproduksi PGE2 yang bekerja menghambat osteoblas untuk memproduksi OPG. RANK berkompetisi dengan OPG untuk mengikat RANKL, Ikatan RANK dengan RANKL akan mengaktifkan osteoklas sehingga terjadi destruksi tulang. Sebaliknya jika RANKL lebih banyak diikat oleh OPG, maka aktifasi osteoklas akan dihambat sehingga tidak terjadi destruksi tulang. Pada jalur lain adanya kolesteatoma pada OMSK tipe maligna menyebabkan stres mekanik karena tekanan cari akumulasi debris keratin dan produk lainnya. Stres mekanik menyebabkan produksi MIF, selanjutnya MIF menginduksi makrofag untuk memproduksi sitokin dan kemokin IL-1, IL-6 dan TNF-α yang berperan menginduksi produksi RANKL oleh osteoblas. MIF juga menginduksi 25 makrofag untuk memproduksi PGE2 yang bekerja menghambat produksi OPG oleh osteoblas. MIF juga menginduksi produksi MMPs 1,2,3,8,9,13 yang berperan menyebabkan destruksi tulang. H. Kerangka Konsep Tingkat 0 OMSK Rasio RANKL/OPG Tingkat Tingkat 1 Destruksi tulang Tingkat 2 Tingkat 3 I. Hipotesis Terdapat hubungan rasio ekspresi RANKL dan OPG dengan destruksi tulang pada OMSK. 26