BAB II TINJAUAN PUSTAKA 2.1. Jamur Jamur adalah suatu
advertisement

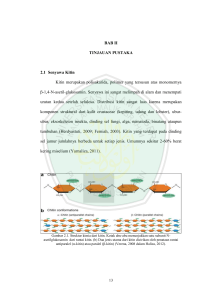
BAB II TINJAUAN PUSTAKA 2.1. Jamur Jamur adalah suatu golongan mikroorganisme yang tubuh vegetatifhya berupa thalus, dan tidak mempimyai klorofil. Sumber utama nutrisi jamur adalah senyawa-senyawa organik (Pelczar dan Chan, 1986). Jamur memerlukan kelembaban yang tinggi, persedian bahan organik dan persediaan oksigen untuk pertumbuhan. Jamur dapat hidup dari bahan organik yang mati dan mengalami pembusukan dan tumbuh baik dalam lingkungan yang mengandung banyak gula dengan kondisi asam yang tidak menguntungkan bagi bakteri. (Volk dan Wheeler, 1993). Jamur tersusun dari benang-benang sel panjang yang dihubungkan bersama dari ujung keujung. Berdasarkan struktumya, jamur dapat dibedakan menjadi dua golongan, yaitu jamur filament dan khamir. Jamur filament merupakan golongan jamur yang mempunyai miselium, yang struktur berupa benang halus bercabang yang disebut hifa. Kumpulan dari hifa disebut dengan miselium. Khamir merupakan golongan jamur yang bersel tunggal dan tidak berfilamen. Banyak jamur mempimyai dinding penyekat yang disebut septa dalam hifanya, yang kemudian membagi masing-masing hifa menjadi banyak sel dengan nukleus masing-masing dan disebut hifa bersepta. Dalam spesies jamur tertentu, benangbenang itu tidak mempunyai septa sehingga kelihatan sebagai satu sel panjang yang mengandung banyak nucleus, hifa seperti ini disebut dengan hifa senosit (Volk dan Wheeler, 1998). Jamur bereproduksi dengan membentuk spora. Spora dapat bersifat seksual maupun aseksual. Apabila spora melepaskan diri dari txmibuhan induknya dalam kondisi yang menguntungkan, maka benang-benang jamur baru akan mampu berkembang menjadi individu baru, dimana spora bersema dan benangbenang hifa akan memanjang dengan pembelahan biner (Volk dan Wheeler, 1998). 4 2.2. Jamur Trichoderma sp. Jamur Trichoderma sp. memiliki ciri morfologi sebagai berikut: miselium bersepta, konidioforanya bercabang dengan arah yang berlawanan, konidianya berbentuk bulat atau oval dan satu sel melekat satu sama lain, wama hijau terang (Devi dkk., 2000). Konidia tersebut merupakan sel tunggal yang saling melekat satu sama lain sehingga membentuk suatu kumpulan pada ujimg konidiofora. Koloni fimgi ini mudah dikenali dengan pertumbuhan yang cepat dan matang pada pertumbuhan 5 hari. Pada temperatur 25 ° C dan dalam media Potato Dextro Agar (PDA) fiingi ini tumbuh seperti bulu domba dan awalnya terlihat putih, selanjutnya konidia mulai terbentuk menjadi wama hijau (Doctorfungus, 2007). Gambar 1. Trichoderma spp. (Sumber. Doctorfungus, 2007) Jamur memerlukan kelembaban yang tinggi, persedian bahan organik dan persediaan oksigen untuk pertumbuhan. Jamur dapat hidup dari bahan organik yang mati dan mengalami pembusukan dan tumbuh baik dalam lingkimgan yang mengandung banyak gula dengan kondisi asam yang tidak menguntungkan bagi bakteri (Volk dan Wheeler, 1993). Klasifikasi taksonomi dari jamur Trichoderma sp. menurut Rejeki (2004) dan Harman (2006) adalah: 5 Kingdom : Fimgi Divisio : Deuteromycota Klas : Deuteromycetes Ordo : Moniliales Familia : Moniliacea Genus : Trichoderma Spesies : Trichoderma sp. Trichoderma sp. merupakan salah satu agen pengendali hayati yang efektif, dapat menghasilkan enzim ekstraseluler sehingga memungkinkan baginya untuk bersaing dengan jamur lain dalam memanfaatkan residu tanaman sebagai bahan nutrisi serta menghambat pertumbuhan jamur fitopatogenik seperti spesies Fusarium, Phytium, dan Rhizoctonia (Waluyo, 2004). Salah satu jenis Trichoderma sp. adalah Trichoderma asperellum merupakan salah satu jenis jamur yang mampu berperan sebagai pengendali hayati karena mempunyai aktivitas antagonistik yang tinggi terhadap jamur patogen tular tanah. Jamur ini termasuk jenis jamur tanah, sehingga sangat mudah didapatkan di berbagai macam tanah, di permukaan akar berbagai macam tumbuhan, juga dapat diisolasi dari kayu busuk. Koloni T asperellum pada awal inkubasi akan berwama putih yang selanjutnya berubah menjadi kuning dan akhimya berubah menjadi hijau tua pada umur inkubasi lanjut. Jamur Trichoderma asperellum mempunyai tingkat pertumbuhan yang cepat, spora yang dihasilkan berlimpah, mampu bertahan cukup lama pada kondisi yang kurang menguntungkan. Daya antagonistik yang dimiliki T. asperellum disebabkan oleh kemampuannya dalam menghasilkan berbagai macam metabolik toksik seperti antibiotik atau enzim yang bersifat litik serta kemampuan kompetisi dengan patogen dalam memperebutkan nutrisi, oksigen, dan ruang tumbuh (Wahyudi dkk., 2005). 6 2.3. Kitinase (EC 3.2.1.14) Kitinase merupakan enzim ekstraseluler yang dihasilkan oleh jamur, bakteri, tanaman, dan hewan serta berperan penting dalam pemecahan kitin. Enzim adalah protein yang diproduksi oleh sel hidup dan digunakan imtuk mengkatalisis reaksi kimia yang spesifik. Kitin merupakan komponen struktural dari sebagian besar dinding sel jamur pathogen. Polisakarida ini adalah komponen struktural terbesar penyusun utama kerangka luar udang dan serangga. Kitinase dapat mengkatalisis hidrolisis ikatan yff-1,4 homopolimer N-asetilglukosamin menjadi monomer N-asetilglukosamin (Wijaya, 2002). Berdasarkan cara kerjanya dalam mendegradasi substrat, kitinase dibedakan kedalam dua kelompok utama, yaitu endokitinase dan eksokitinase (Toharisman, 2007). Enzim yang mendegradasi kitin secara acak dari dalam disebut endokitinase (EC 3.2.1.14). Eksokitinase yang membebaskan N asetilglukosamina disebut N-asetil-P-Dglukosaminidase (NAGase) (EC 3.2.1.30) dan yang membebaskan lonit dimer dari P-l,4-Nasetilglukosamina (kitobiosa) disebut 1,4-p-kitobiosidase (kitobiosidase) (EC 3.2.1.14) (Nugroho, dkk., 2003). Enzim ini dapat ditemukan pada bakteri Streptomycetes sp. dan jamur seperti Trichoderma sp. dan Gliocladium sp, serta dapat disintesis oleh beberapa protozoa, nematoda, dan vertebrata lainnya (Supiandi, 1999). Berbagai organisme menghasilkan aneka jenis kitinase dengan spesifitas terhadap substrat yang bervariasi juga karakteristik yang berlainan. Bakteri mengeluarkan kitinase sebagai sarana memperoleh nutrisi dan agen parasitisme. Fungi, protozoa dan invertebrata mengeluarkan enzim tersebut imtuk proses morfogenesis (Toharisman, 2007). Enzim kitinase mempunyai banyak manfaat karena mampu menghidrolisis kitin menjadi ukuran yang beragam sehingga dapat dihasilkan produk deasetilasi kitin yaitu kitosan yang beragam. Kitosan mempimyai aplikasinya sangat luas dalam berbagai bidang, seperti industri pangan, kesehatan, kosmetik, bioteknologi, pengolahan limbah, membran, dan industri kertas (Natsir, 2000). 7 2.4. Kitin Kitin adalah polimer karbohidrat di alam yang merupakan struktur besar polisakarida yang terdiri dari unit-vmit N-asetilglukosamin dengan ikatan p-1,4. Secara formal kitin dapat berasal dari selulosa dengan menggantikan gugus hidroksil pada atom C-2 dengan gugus amino yang terasetilasi. Stabilitas kitin yang menonjol dapat dikembalikan pada jembatan hidrogen yang berasal dari gugus samping N-asetil. Kitin tidak larut dalam air, pelarut organik, basa atau mineral encer, tetapi dapat larut dalam asam mineral pekat dan dapat didegradasi secara enzimatis (Alexander, 1977). Penghilangan gugus asetil (deasetilasi) dari kitin menghasilkan kitosan. Kitin dan kitosan memiliki kandungan nitrogen sekitar 6.98%, jauh lebih tinggi dibanding polimer sintetik yang hanya 1.25%. Oleh karenanya, keduanya menarik secara komersial karena bisa dipakai sebagai agen pengkelat. Selain itu, karena kitin merupakan bahan alam maka lebih bersifat biocompatible dan biodegradable dibanding polimer sintetik (Toharisman, 2007). Pada Gambar 2 dapat dilihat struktur kitin yang dibangun oleh vmit-unit monomer N-asetilglukosamin (GlcNAc) tersusun linear dengan ikatan y5-l,4. Rantai kitin antara satu dengan yang lainnya berasosiasi dengan ikatan hidrogen yang sangat kuat antara gugus NH dari satu rantai dan gugus C=0 dari rantai yang berdekatan (Yumaliza, 2002). Gambar 2. Struktur Kitin (Toharisman, 2007) 8 2.5. Faktor-Faktor yang Mempenganihi Aktivitas Enzim Enzim adalah golongan protein, sehingga mempunyai sifat yang mirip dengan protein. Beberapa sifat enzim tidak stabil dan mudah terdenaturasi sehingga aktivitasnya hilang. Aktivitas enzim dapat dipengaruhi oleh beberapa faktor, yaitu: 1. Konsentrasi Enzim Kecepatan reaksi enzimatik tergantung dari konsentrasi enzim tersebut. Kecepatan reaksi bertambah dengan semakin bertambahnya konsentrasi enzim (Poedjiadi, 1994). 2. Konsentrasi Substrat Pada konsentrasi enzim yang tetap, kecepatan reaksi bertambah dengan bertambahnya konsentrasi substrat (Poedjiadi, 1994). 3. Suhu Reaksi berjalan lambat pada suhu rendah dan berlangsung cepat pada suhu tinggi. Kenaikan suhu juga mempenganihi kecepatan reaksi enzim (Poedjiadi, 1994). Pada suhu rendah, kemantapan enzim tinggi, tetapi aktivitasnya rendah. Sedangkan pada suhu yang tinggi, aktivitasnya tinggi, tetapi kemantapan rendah. Daerah temperatur saat kemantapan dan aktivitas enzim cukup besar disebut temperatur optimal untuk enzim tersebut (Wirahadikusumah, 1989). 4. pH Struktur enzim dipengaruhi oleh pH lingkunganya. Pada pH rendah dan tinggi dapat menyebabkan enzim terdenaturasi sehingga menurunkan aktivitas enzim tersebut (Poedjiadi, 1994). Pada keadaan aktivitas enzim paling besar, pHnya merupakan pH optimal untuk reaksi enzim tersebut (Wirahadikusumah, 1989). 5. Adanya inhibitor dan aktivator Inhibitor dapat menghambat keija enzim sedangkan aktivator dapat meningkatkan kerja enzim. Aktivator dan inhibitor dapat berupa logam ataupun senyawa organik. 9 2.6. Penentuan Konsentrasi Gula Pereduksi Metoda Nelson- Somogyi Dalam alkali semua monosakarida dan beberapa disakarida dapat bertindak sebagai senyawa-senyawa pereduksi dan dengan mudah teroksidasi oleh beberapa reagen misalnya tembaga (Cu'^^). Salah satu metode yang umum digvmakan adalah reduksi ion cupri (Cu^^) menjadi cupro (Cu*) dalam larutan alkali membentuk Cu(OH)2 yang dengan pemanasan akan diubah menjadi endapan merah bata (CU2O). Untuk mencegah pengendapan reagen Cu^* dalam larutan alkali digunakan sitrat atau tartarat. Dalam metoda Nelson-Samogyi, hasil reduksi ion cupri oleh glukosa atau gula pereduksi lainnya dalam suasana basa dengan arsenomolibdat memberikan wama bim. Absorbsi lamtan ini diukur pada panjang gelombang 500 nm (Green III dkk, 1989). Reaksi yang teijadi: 3NH4'^ + AsOz" + 12Mo04^- + 24 H* • (NH4)3H4As(Mo207)6 + 10 H2O Arsenomolibdad RCHO + 2Cu^* + 4 OH- 2CU2O + (NH4)3H4AS(M0207)6 • RCOOH + j CU2O + 2 H2O ^ CU4(NH4)3H4AS(M0207)6 + O2 Lamtan bim 10