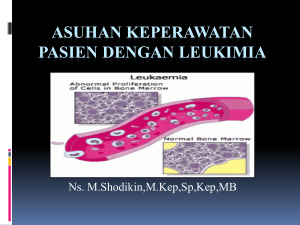
kehamilan dengan leukemia mieloid kronik
advertisement

KEHAMILAN DENGAN LEUKEMIA MIELOID KRONIK dr. I Ketut Surya Negara, SpOG (K) BAGIAN/SMF OBSTETRI DAN GINEKOLOGI FK UNUD/RSUP SANGLAH DENPASAR 2013 BAB I PENDAHULUAN Leukemia Mieloid Kronik (LMK) adalah penyakit mieloproliferatif dengan karakteristik adanya fusi gen BCR-ABL. Produk gen ini, yaitu protein Bcr-Abl, memiliki aktifitas tirosin kinase yang berperan penting dalam patogenesis penyakit.(1) Insiden leukemia dalam kehamilan sangat jarang, berkisar 1 dari 75.000100.000 kehamilan.Namun sebagian besar leukemia dalam kehamilan digolongkan akut (90%), kemudian tipe myeloid (61% LMA, 7% LMK), dimana tipe limfoid (28% LLA, 3% LLK).Kejadian leukemia dalam kehamilan di Indonesia sampai saat ini belum didapatkan data pasti. Di Bali sendiri khususnya di RSUP Sanglah Denpasar sebelumnya pernah dilaporkan satu kasus kehamilan dengan LMA pada tahun 2010. Pada review literatur, hanya 157 kasus LMK dalam kehamilan yg dilaporkan antara tahun 1990 sampai 2009.(2,3,4,5) Kehamilan pada pasien kanker yang memerlukan kemoterapi memerlukan banyak pertimbangan, yang seringkali menimbulkan dilema baik pada pasien dan keluarga, maupun dokter dan tenaga kesehatan lainnya.Masalah bertambah pelik ketika seorang wanita menjadi hamil selama atau beberapa waktu setelah menjalani kemoterapi, mengingat efek samping dari agen sitotoksik.Kebanyakan informasi mengenai hal ini didapat dari penelitian pada hewan, dan relatif sedikit data pada manusia.Imatinib masuk dalam uji klinik pada tahun 1998 dan sejak saat itu didapatkan telah meningkatkan respon hematologi dan sitogenetik yang dramatis pada pasien LMK.Apakah imatinib dapat dihentikan secara aman pada pasien yang mengalami remisi lengkap, ini tetap menjadi salah satu pertanyaan penting yang belum terjawab sampai sekarang. Dari data teratogenesitas pada tikus, direkomendasikan pada wanita yang dalam terapi imatinib untuk waspada pada efek ini, dan kontrasepsi yang efektif sebaiknya digunakan untuk mencegah kehamilan.(2) Pada kesempatan ini, kami akan mencoba membahas kasus Kehamilan dengan Leukemia Mieloid Kronik, kasus ini menarik untuk diulas karena beberapa alasan, seperti : 1. Insiden leukemia terutama tipe leukemia mieloid kronik banyak dilaporkan, namun insiden leukemia mieloid kronik dalam kehamilan sangat jarang dan masih sedikit dilaporkan, khususnya di Indonesia. 2. Pada pasien dalam laporan ini, kehamilan terjadi saat diagnosa sudah ditegakkan dan telah diterapi, dan sudah terjadi paparan kemoterapi pada fetus di trimester satu. 3. Beberapa temuan dalam pengamatan kasus ini tidak sesuai dengan data-data penelitian sebelumnya, antara lain : resiko terapi imatinib terhadap fertilitas, paparan kemoterapi saat konsepsi dan selama trimester satu, remisi hematologi pada ibu selama kehamilan walaupun terapi ditunda, luaran bayi normal, dan perkembangan bayi selama pengamatan satu tahun tidak ditemukan gangguan perkembangan. 4. Penanganan leukemia mieloid dalam kehamilan masih menjadi perdebatan, di satu sisi pertanyaan besar apakah terapi dihentikan atau diteruskan, pertanyaan lain pilihan terapi apa yang sesuai selama kehamilan. 5. Modalitas diagnostik pasti hanya dimiliki oleh beberapa pusat kesehatan dan memerlukan biaya mahal. Obat-obat kemoterapi untuk penyakit ini relatif sulit didapat dan memerlukan biaya mahal. Pemantauan efek terapi juga memerlukan pemeriksaan yang mahal. 6. Adanya keganasan dalam kehamilan, dalam hal ini leukemia mieloid kronik dalam kehamilan memberikan pengaruh pada aspek psikososial. BAB II LAPORAN KASUS IDENTITAS PASIEN Nama : Ni Wayan Pujani Umur : 32 tahun Alamat : Jl. Tukad Yeh Biu gg. Pudak no. 14 Sesetan, Denpasar Suku : Bali Agama : Hindu Pendidikan : SLTA No. Rekam Medik : 01297805 Tgl. Pemeriksaan : 20 Januari 2012 ANAMNESIS Keluhan Utama : Badan sering lemas Riwayat Penyakit Sekarang : Os mengeluh terkadang badan terasa lemas sejak sekitar 2 bulan terakhir. Os memiliki riwayat kanker darah (Leukemia) sejak tahun 2005, os merasa khawatir akan pengaruh penyakit dan obat yang diminumnya terhadap bayi. Keluhan lain tidak ada. Gerakan anak dirasakan sejak tgl. 13/12/2011. Tes kehamilan (+) tgl. 20/12/2011, tes sendiri dirumah HPHT lupa, os mengatakan terakhir menstruasi tgl, 20/2/2011 dan setelahnya tidak mendapat haid, sebelumnya os tidak mengetahui kehamilannya sampai os merasa perut bawah membesar dan terasa seperti ada yang bergerak dalam perutnya, lalu os tes kehamilan dan hasilnya (+). Riwayat menstruasi sebelumnya dikatakan teratur setiap 28 hari selama 3-4 hari.Menarche umur 13 tahun.Menikah 1x selama 11 tahun. Riwayat Obstetri : 1. Aterm, perempuan, spontan, 3000 gram, RSUP, 11 th 2. Aterm, laki-laki, spontan, 3200 gram, RSUP, 8 th 3. Ini Riwayat kontrasepsi IUD, aff 5 tahun yang lalu, Riwayat alergi disangkal. Riwayat Penyakit Dahulu : Awalnya sekitar bulan Agustus 2004 os merasakan perut membesar, pembesaran dirasakan dimulai dari sebelah kiri dan bertambah besar dalam waktu lebih kurang 2 minggu sampai memenuhi seluruh bagian perut. Kadang perut terasa nyeri dan penuh, sering mual dan nafsu makan menurun. Badan terasa lemas dan cepat lelah, Didapatkan memar-memar pada kulit tanpa sebab yang jelas namun hilang dalam beberapa hari.Badan tambah kurus (berat badan turun dari 45 kg menjadi 39 kg dalam 2 minggu). Badan sering demam dan berkeringat banyak terutama malam hari.Keluhan perdarahan spontan disangkal. Os tidak pernah periksa, hanya berobat alternatif. Tgl. 16 Juli 2006 os periksa ke Poli Interna RSUP, didapatkan pembesaran limfe (splenomegali) ~ Scuffner VI-VII.Pada pemeriksaan darah, WBC > 22.000, Hb 6 g/dL, Platelet turun (os lupa nilainya).Disarankan USG abdomen. Hasil USG : Splenomegali ( hasil USG hilang) Pemeriksaan darah ulang, WBC > 48.000. Saat itu diagnosa suspek Leukemia, disarankan MRS dan biopsi sumsum tulang, os menolak dan tidak kontrol lagi, melanjutkan terapi alternatif. Tgl. 6 Juni 2011 os periksa ke dr. Tjok DY Sp.PD. KHOM saran periksa darah ulang. Tgl. 7 Juni 2011 os periksa darah di Laboratorium RSUP, dengan hasil : WBC 480,5 HGB 6,7 PLT 513 LED 1/8 OT/PT 19/10 Bun/SC 11/0,5 UA 8,5 LDH 1.885 Na/K/Ca 136,3/ 4,41/ 8,9 UL sedimen lekosit banyak Blood Smear : kesan CML Diagnosa : CML, terapi dengan Hydrea. Perkembangan laboratoris : Tgl. 20/6/2011 : WBC/Hb/PLT : 165/7,5/715 Tgl. 14/7/2011 : WBC/Hb/PLT : 124,5/10,1/468 Tgl. 30/7/2011 : WBC/Hb/PLT : 338,6/7,9/248 Direncanakan mengganti obat namun os disarankan periksa lebih lanjut di Surabaya lewat YKI (Yayasan Kanker Indonesia).Tgl. 2/8/2011 berangkat ke Surabaya, tgl. 3/8/2011 periksa darah di Laboratorium Genetika Manusia Divisi Pemeriksaan Molekuler Kanker RSUD dr. Soetomo. Tgl. 26/8/2011 didapatkan hasil : DL : WBC/Hb/PLT 260,2/9,4/378 Diagnostik molekuler PCR Leukemia (bcr-abl) : tampak fusi gene bcr abl b3a2 pada amplicon product 385 bp menghasilkan ekspresi protein p210. Bulan September 2011 mulai mendapat terapi Glevec 1X400 mg tiap hari, malam sebelum tidur. Riwayat keganasan pada keluarga disangkal. Riwayat penyakit metabolik disangkal. Riwayat pekerjaan : os bekerja sebagai penjual tanaman, kontak dengan radiasi disangkal. Kontak dengan pestisida (+), tempat kerja didekat gardu bertegangan tinggi PLN. PEMERIKSAAN FISIK Tanggal 20/01/2012 Status present Kesadaran composmentis Tekanan darah: 120/80 mmHg Nadi : 84x/mnt Respirasi : 20x.mnt temperatur : 36,7 celcius Berat badan : 53,3 kg Tinggi Badan : 160 cm Status General Mata : anemis -/-, ikterus -/THT : kesan tenang Cor : S1S2 tunggal, reguler, murmur (-) Pulmo : vesikuler, Rh -/-, Wh -/Abdomen : distensi (-), Hepar ttb, lien trb ~ Scuffner S2-3 Nyeri tekan (-), BU (+)N ~ status obstetrik Extremitas : hangat, oedem (-) BMI : 20,8 Status Obstetri Abdomen : TFU ~ sepusat DJJ (+) 150x/menit Doppler Vagina : taa Laboratorium (19/01/2012) WBC 7,15 Hb 11.3 PLT 265 USG (poli 1.08) Janin T/H, FHB (+), FM (+) BPD 5,99 ~ 24W4D AC 20,6 ~ 25W0D FL 4,33 ~ 23W6D AVE 24W3D EDD 7/5/2012 Pasenta korpus anterior S/D 3,17 PI 0,75 RI 0,63 Air ketuban cukup Diagnosa : G3P2002 23-24 mg T/H + CML Pdx : Tx : ~ Ts. Interna SF 1xI tab Mx : kontrol 2 minggu lagi KIE Poli Hematologi Interna Dx : CML Tx : Gleevec tunda Rawat bersama Obgyn Mx : DL @ 2 minggu, kontrol 2 minggu lagi EFW 733 gr RIWAYAT ANC Tanggal 20/12/2011 (Poli 1.08) Keluhan (-) Status present Kesadaran composmentis Tekanan darah: 110/70 mmHg Nadi : 88x/mnt Respirasi : 20x.mnt temperatur : 36,5 celcius Berat badan : 43,8 kg Tinggi Badan : 160 cm Status General Dalam batas normal Status Obstetri Abdomen : TFU ~ sepusat DJJ (+) 156x/menit Doppler Vagina : insp. Flx (-), fl (-) P(-), livide (+) VT flx (-), fl (-) P (-) CU AF b/c ~ 20-22 mg APCD taa USG (poli 1.08) Janin T/H, FHB (+), FM (+) BPD 5,04 ~ 21W2D AC 13,9 ~ 20W6D FL 3,17 ~ 19W3D AVE 21W0D EDD 20/4/2012 Pasenta korpus anterior EFW 405 gr AK cukup Diagnosa : G3P2002 21 mg T/H + Leukemia (CML) Pdx : DL, LFT, RFT, USG WA Tx : konsul Interna SF 1xI tab Mx : kontrol bsk rencana USG WA BMI : 17,1 Tanggal 23/12/2011 (Poli 1.08) Keluhan (-) Status present Kesadaran composmentis Tekanan darah: 110/60 mmHg Nadi : 84x/mnt Respirasi : 20x.mnt temperatur : 36,6 celcius Berat badan : 51 kg Tinggi Badan : 160 cm BMI : 19,9 Status General Dalam batas normal Status Obstetri Abdomen : TFU ~ sepusat DJJ (+) 152x/menit Doppler Vagina : taa Laboratorium (22/12/2011) WBC 6,0 Hb 10,0 OT/PT 15/12 PLT 367 Bun/SC 9/0,49 BSP/2jPP 83/61 UA 4,7 USG WA 23/12/2011 (dr HYS SpOG(K)) Janin T/H, FHB (+), FM (+) BPD 4,84 ~ 19W2D AC 16,03 ~ 20W6D FL 2,92 ~ 18W4D HC 17,12 ~ 19W1D AVE 19W5D EDD 13/5/2012 EFW 385 gr Pasenta korpus anterior gr I AFI ~ N Kesimpulan : janin T/H 19-20 minggu, morfologi tidak tampak kelainan Diagnosa : G3P2002 21-22 mg T/H + CML Pdx : Tx : ~ Ts. Interna SF 1xI tab Mx : kontrol 2 minggu lagi Poli Hematologi Interna Dx : CML Tx : stop/tunda Glivec Rawat bersama Obgyn Mx : DL 2 @ 2 minggu, kontrol 2 minggu lagi Tanggal 05/01/2012 (Poli 1.08) Keluhan (-) EDD : 13/5/2012 (USG WA UK 19-20 mg) Status present Kesadaran composmentis Tekanan darah: 100/70 mmHg Nadi : 84x/mnt Respirasi : 20x.mnt temperatur : 36,0 celcius Berat badan : 51 kg Tinggi Badan : 160 cm Status General Dalam batas normal Status Obstetri Abdomen : TFU ~ sepusat DJJ (+) 158 x/menit Doppler Vagina : taa Laboratorium (03/01/2012) WBC 5,88 Hb 10,8 PLT 276 Diagnosa : G3P2002 21-22 mg T/H + CML Pdx : Tx : ~ Ts. Interna SF 1xI tab Mx : kontrol 2 minggu lagi Poli Hematologi Interna Dx : CML Tx : Tunda Gleevec BMI : 19,9 Rawat bersama Obgyn Mx : DL @ 2 minggu, kontrol 2 minggu lagi Tanggal 20/01/2012 Hasil pemeriksaan telah diuraikan diatas. Tanggal 06/02/2012 (Poli 1.08) Keluhan (-) Status present Kesadaran composmentis Tekanan darah: 110/70 mmHg Nadi : 80x/mnt Respirasi : 20x.mnt temperatur : 36,7 celcius Berat badan : 54 kg Tinggi Badan : 160 cm Status General Mata : anemis -/-, ikterus -/THT : kesan tenang Cor : S1S2 tunggal, reguler, murmur (-) Pulmo : vesikuler, Rh -/-, Wh -/Abdomen : distensi (-), Hepar ttb, lien trb ~ Scuffner S2 Nyeri tekan (-), BU (+)N ~ status obstetrik Extremitas : hangat, oedem (-) Status Obstetri Abdomen : TFU ~ 1 jari atas pusat His (-) DJJ (+) 145 x/menit Doppler Vagina : taa USG WA 06/02/2012 (dr SNR SpOG(K)) Janin T/H, FHB (+), FM (+) BPD 6,77 ~ 25W2D AC 22,74 ~ 26W4D BMI : 21 FL 4,81 ~ 25W4D HC 23,79 ~ 25W0D AVE 26W0D EDD 14/5/2012 EFW 1066 gr Pasenta korpus anterior gr II AK cukup Arteri umbilikalis : S/D 3,24 RI 0,69 PI 1,05 Kesimpulan : janin T/H 19-20 minggu, morfologi tidak tampak kelainan mayor. Diagnosa : G3P2002 26-27 mg T/H + CML Pdx : Tx : ~ Ts. Interna SF 1xI tab TT III Mx : kontrol 2 minggu lagi Tanggal 22/02/2012 (Poli 1.08) Keluhan (-) Status present Kesadaran composmentis Tekanan darah: 110/70 mmHg Nadi : 80x/mnt Respirasi : 20x.mnt temperatur : 36,6 celcius Berat badan : 55 kg Tinggi Badan : 160 cm Status General Mata : anemis -/-, ikterus -/THT : kesan tenang Cor : S1S2 tunggal, reguler, murmur (-) Pulmo : vesikuler, Rh -/-, Wh -/Abdomen : distensi (-), Hepar ttb, lien trb ~ Scuffner S2 Nyeri tekan (-), BU (+)N ~ status obstetrik Extremitas : hangat, oedem (-) Status Obstetri Abdomen : TFU ~ 2 jari atas pusat BMI : 21,4 His (-) DJJ (+) 154 x/menit Doppler Vagina : taa Laboratorium (22/02/2012) WBC 9,7 Hb 11,7 PLT 229 USG (poli 1.08) Janin T/H, letak kepala, FHB (+), FM (+) BPD 7,41 ~ 30W0D AC 26,7 ~ 30W6D HC 28,3 ~ 30W5D FL 5,61 ~ 29W1D AVE 30W1D EDD 01/04/2012 Pasenta korpus anterior grd II EFW 1533 gr Air ketuban cukup Diagnosa : G3P2002 28-29 mg T/H + CML Pdx : Tx : ~ Ts. Interna SF 1xI tab Mx : kontrol 2 minggu lagi Tanggal 09/03/2012 (Poli 1.08) Keluhan (-) Status present Kesadaran composmentis Tekanan darah: 100/70 mmHg Nadi : 80x/mnt Respirasi : 20x.mnt temperatur : 36,8 celcius Berat badan : 56 kg Tinggi Badan : 160 cm Status General Mata : anemis -/-, ikterus -/THT : kesan tenang Cor : S1S2 tunggal, reguler, murmur (-) Pulmo : vesikuler, Rh -/-, Wh -/Abdomen : distensi (-), Hepar ttb, lien trb ~ Scuffner S2 BMI : 21,8 Nyeri tekan (-), BU (+)N ~ status obstetrik Extremitas : hangat, oedem (-) Status Obstetri Abdomen : TFU ~ 1/2 pusat-processus xiphoideus His (-) DJJ (+) 150 x/menit Doppler Vagina : taa USG WA 09/03/2012 (dr HYS SpOG(K)) Janin Tunggal, FHB (+), FM (+) BPD 8,03 ~ 30W1D AC 27,82 ~ 31W2D FL 5,04 ~ 28W5D AVE 30W3D EDD 15/5/2012 EFW 1936 gr Pasenta korpus anterior gr II AFI ~ 13,99 Arteri umbilikalis S/D 3,15 Kesimpulan : janin T/H 30W3D, morfologi tidak tampak kelainan Diagnosa : G3P2002 30-31 mg T/H + CML Pdx : Tx : ~ Ts. Interna SF 1xI tab Mx : kontrol 2 minggu lagi Tanggal 30/03/2012 (Poli 1.08) Keluhan (-) Status present Kesadaran composmentis Tekanan darah: 110/60 mmHg Nadi : 80x/mnt Respirasi : 20x.mnt temperatur : 36,7 celcius Berat badan : 57 kg Tinggi Badan : 160 cm Status General Mata : anemis -/-, ikterus -/THT : kesan tenang Cor : S1S2 tunggal, reguler, murmur (-) Pulmo : vesikuler, Rh -/-, Wh -/Abdomen : distensi (-), Hepar ttb, lien trb ~ Scuffner S2 Nyeri tekan (-), BU (+)N ~ status obstetrik Extremitas : hangat, oedem (-) Status Obstetri Abdomen : TFU ~ 4 jari bawah processus xiphoideus (28 cm) His (-) DJJ (+) 144 x/menit Doppler Vagina : taa USG (poli 1.08) Janin T/H, letak kepala, FHB (+), FM (+) BPD 8,27 ~ 303W5D AC 30,4 ~ 34W1D FL 6,59 ~ 33W5D AVE 33W3D EDD 20/05/2012 Pasenta korpus anterior grd II Diagnosa : G3P2002 33-34 mg T/H + CML Pdx : Tx : ~ Ts. Interna SF 1xI tab Mx : kontrol 2 minggu lagi Tanggal 16/04/2012 (Poli 1.08) EFW 2229 gr BMI : 22,3 Keluhan (-) Status present Kesadaran composmentis Tekanan darah: 110/70 mmHg Nadi : 84x/mnt Respirasi : 20x.mnt temperatur : 36,0 celcius Berat badan : 57 kg Tinggi Badan : 160 cm Status General Mata : anemis -/-, ikterus -/THT : kesan tenang Cor : S1S2 tunggal, reguler, murmur (-) Pulmo : vesikuler, Rh -/-, Wh -/Abdomen : distensi (-), Hepar dan lien sulit dievaluasi Nyeri tekan (-), BU (+)N ~ status obstetrik Extremitas : hangat, oedem (-) Status Obstetri Abdomen : TFU ~ 4 jari bawah processus xiphoideus (28 cm) His (-) DJJ (+) 138 x/menit Doppler Vagina : taa USG WA 16/04/2012 (dr TS SpOG(K)) Janin T/H, FHB (+), FM (+) BPD 8,96 ~ 34W2D AC 32,23 ~ 35W5D FL 6,56 ~ 33W4D HC 32,11 ~ 34W2D AVE 36W3D EDD 19/5/2012 EFW 2916 gr Pasenta korpus anterior gr II AFI normal Arteri umbilikalis : S/D 2,6 RI 0,62 PI 0,9 BMI : 22,3 Kesimpulan : janin tunggal, letkep, 36-37 minggu, morfologi tidak tampak kelainan mayor. Diagnosa : G3P2002 35-36 mg T/H + CML Pdx : Tx : ~ Ts. Interna SF 1xI tab Mx : kontrol 2 minggu lagi Tanggal 07/05/2012 (Poli 1.08) Keluhan (-) Status present Kesadaran composmentis Tekanan darah: 100/60 mmHg Nadi : 80x/mnt Respirasi : 20x.mnt temperatur : 36,8 celcius Berat badan : 59 kg Tinggi Badan : 160 cm Status General Mata : anemis -/-, ikterus -/THT : kesan tenang Cor : S1S2 tunggal, reguler, murmur (-) Pulmo : vesikuler, Rh -/-, Wh -/Abdomen : distensi (-), Hepar dan lien sulit dievaluasi Nyeri tekan (-), BU (+)N ~ status obstetrik Extremitas : hangat, oedem (-) Status Obstetri Abdomen : TFU ~ 3 jari bawah processus xiphoideus His (-) DJJ (+) 138 x/menit Doppler Vagina : taa AT ~ Normal BMI : 23 Diagnosa : G3P2002 39-40 mg T/H + CML Pdx : Tx : ~ Ts. Interna SF 1xI tab Mx : kontrol 2 minggu lagi KIE : sakit perut, keluar air, gerak anak menurun segera ke IRD Tanggal 11/05/2012 (IRD) Keluhan : pasien mengeluh keluar air pervaginam sejak jam 06.00 wita, sakit perut tidak ada, gerak anak baik. TP : 13/05/2012 Status present Kesadaran composmentis Tekanan darah: 120/70 mmHg Nadi : 80x/mnt Respirasi : 20x.mnt temperatur axilla : 36,8 celcius Berat badan : 60 kg rectal : 37,0 celcius Tinggi Badan : 160 cm BMI : 23,4 Status General Mata : anemis -/-, ikterus -/THT : kesan tenang Cor : S1S2 tunggal, reguler, murmur (-) Pulmo : vesikuler, Rh -/-, Wh -/Abdomen : distensi (-), Hepar tidak teraba, lien Scuffner S3 Nyeri tekan (-), BU (+)N ~ status obstetrik Extremitas : hangat, oedem (-) Status Obstetri Abdomen : TFU ~ 3 jari bawah processus xiphoideus (34 cm) His (-) DJJ (+) 138 x/menit Doppler Vagina insp : tampak cairan keluar dari OUE, lakmus tes (+) VT (10.45 wita) : P 1 jari, efficement 25%, ketuban (-) jernih, sedang, anterior Teraba kepala denominator belum jelas, H I Tidak teraba bagian kecil / tali pusat Laboratorium tgl 11/05/2012 (10.36 wita) WBC 11,0 SGOT/SGPT 9,8/7,7 HGB 13,2 BUN 6,225 Hct 40,0 SC 0,445 PLT 204,6 Albumin 3,954 BT/CT 2’00”/9’30” AT ~ Normal Diagnosa : G3P2002 39-40 mg T/H + CML, KPD PBB : 3410 gram PS : 4 Pdx : Tx : - IVFD RL ~ 20 tetes/menit - Ampicillin 4x500 mg oral - Expektatif pervaginam bila AT normal/suspisius Mx : keluhan, vital sign, tanda inpartu, temperatur rectal @ 3 jam Apabila dalam 12 jam keluar air belum ada tanda inpartu, evaluasi pelvic skor Bila PS <5 : ripening misoprostol Bila PS >5 : induksi oksitosin ~ protap KIE : pasien dan keluarga rencana tindakan Perjalanan persalinan (11/05/2012) Jam 15.00 wita, evaluasi 2 jam his adekuat Abdomen : His (+) 3-4x/10 menit ~ 35-40 detik DJJ 146x/menit reguler VT (15.00) P 6 cm, efficement 50%, ketuban (-) jernih Teraba kepala ubun-ubun kecil kiri depan, H II Tidak teraba bagian kecil / tali pusat Diagnosa : G3P2002 39-40 mg T/H + CML, Partus Kala I (keluar air) Jam 16.40 wita, pasien ingin mengedan Abdomen : His (+) 4-5x/10 menit ~ 40-45 detik DJJ 152x/menit reguler VT (15.00) P lengkap, ketuban (-) jernih Teraba kepala ubun-ubun kecil depan, H III(+) Tidak teraba bagian kecil / tali pusat Diagnosa : G3P2002 39-40 mg T/H + CML, Partus Kala II Jam 16.46 wita lahir bayi laki-laki, 3600 gram, AS 8-9 Anus (+), kelainan (-) Selama pemantauan 2 jam post partum tidak didapatkan masalah, pasien dan bayi rawat gabung, laboratorium post partum dalam batas normal (WBC 17,27 / HGB 12,0 / PLT 329). Pasien diperbolehkan pulang keesokan harinya. Kontrol ke Poli Kebidanan dan poli Anak tanggal 22/05/2013 (post partum hari ke 11) Pasien tanpa keluhan, ibu dan bayi baik.Selama masa nifas tidak didapatkan keluhan ataupun masalah. BAB III HEMATOPOESIS 3.1 Fisiologi Hematopoesis Hematopoesis adalah proses pembentukan darah. Tempat hematopoesis pada manusia berpindah-pindah sesuai dengan umur, yaitu : 1. Yolk sac pada umur 0-3 bulan intrauterine. 2. Hepar dan lien pada umur 3-6 bulan intrauterine. 3. Sumsum tulang pada umur 4 bulan intrauterin sampai dewasa Perkembangan hematopoesis menurut umur ini dapat dilihat pada gambar grafik dibawah ini.(6) Gambar 3.1 Perkembangan hemopoesis menurut umur(6) Pada orang dewasa dalam keadaan fisiologik semua hematopoesis terjadi pada sumsum tulang.Dalam keadaan patologik, seperti pada mielofibrosis, hematopoesis terjadi diluar sumsum tulang, terutama di lien, disebut sebagai hematopoesis ekstramedular. Untuk kelangsungan hematopoesis diperlukan : 1. Sel induk hemopoetik (hematopoietic stem cell) Sel induk hemopoetik ialah sel-sel yang akan berkembang menjadi sel-sel darah, termasuk sel darah merah (eritrosit), sel darah putih (leukosit), butir pembeku (trombosit), dan juga beberapa sel dalam sumsum tulang seperti fibroblast. Sel induk yang paling primitif disebut sebagai pluripotent (totipotent) stem cell. Sel ini mempunyai sifat : a. Self renewal : kemampuan untuk memperbarui diri sendiri sehingga tidak akan pernah habis meskipun terus membelah. b. Proliferatif : kemampuan membelah atau memperbanyak diri. c. Diferensiatif : kemampuan untuk mematangkan diri menjadi sel-sel dengan fungsi tertentu.(6) Menurut sifat kemampuan diferensiasinya maka sel induk hemopoetik dapat dibagi menjadi : a. Pluripotent (totipotent) stem cell : sel induk yang mempunyai kemampuan untuk menurunkan seluruh jenis sel-sel darah. b. Committed stem cell : sel induk yang mempunyai komitmen untuk berdiferensiasi melalui salah satu garis turunan sel (cell line). Sel induk yang termasuk golongan ini adalah sel induk myeloid dan sel induk limfoid. c. Oligopotent stem cell : sel induk yang dapat berdiferensiasi menjadi hanya beberapa jenis sel. granulocyte/monocyte) Misalnya, CFU-GM (colony forming unit- yang dapat berkembang hanya menjadi sel-sel granulosit dan sel-sel monosit. d. Unipotent stem cell : sel induk yang hanya mampu berkembang menjadi satu jenis sel saja. Contoh, CFU-E (colony forming unit-erythrocyte) hanya dapat menjadi eritrosit, CFU-G (colony forming unit-granulocyte) hanya mampu berkembang menjadi sel-sel granulosit.(6) Gambar skematik dan hirarki susunan sel induk hematopoetik dapat dilihat pada gambar dibawah ini.Semula sel induk dianggap hanya berada dalam sumsum tulang, setelah berdiferensiasi menjadi sel matang kemudian dilepaskan ke darah tepi.Sekarang dapat dibuktikan bahwa sel induk juga beredar dalam sirkulasi, tetapi tidak dapat dideteksi dengan teknik pengecatan konvensional.Keberadaan sel ini dalam darah tepi dapat dibuktikan dengan teknik immunophenotyping. Sel induk dalam darah tepi ini dapat dipisahkan dengan teknik hemapheresis, kemudian dapat dicangkokkan pada orang lain. Teknik ini disebut sebagai peripheral blood stem cell transplantation.(6) Gambar 3.2 Diagram skematik hierarki sel induk hemopoetik menurut Hoffbrand(6) Gambar 3.3 Hierarki sel induk hemopoetik dan garis turunannya secara morfologik menurut Wintrobe(6) 2. Lingkungan mikro (microenvironment) sumsum tulang Lingkungan mikro sumsum tulang adalah substansi yang memungkinkan sel induk tumbuh secara kondusif. Komponen lingkungan mikro ini meliputi berikut ini : a. Mikrosirkulasi dalam sumsum tulang. b. Sel-sel stroma, seperti : sel endotel, sel lemak, fibroblast, makrofag, sel retikulum (blanket cell). c. Matriks ekstraseluler : fibronektin, haemonektin, laminin, kolagen, dan proteoglikan.(6) Lingkungan mikro sangat penting dalam hemopoesis karena berfungsi untuk : a. Menyediakan nutrisi dan bahan hemopoesis yang dibawa oleh peredaran darah mikro dalam sumsum tulang. b. Komunikasi antar sel (cell to cell communication), terutama ditentukan oleh adanya adhesion molecule. c. Menghasilkan zat yang mengatur hemopoesis : hematopoetic growth factor, cytokine, dan lain-lain.(6) 3. Bahan-bahan pembentuk darah Bahan-bahan yang diperlukan untuk pembentukan darah adalah : a. Asam folat dan vitamin B12, merupakan bahan pokok pembentuk inti sel. b. Besi, sangat diperlukan dalam pembentukan hemoglobin. c. Cobalt, magnesium, Cu, Zn. d. Asam amino e. Vitamin lain : vitamin C, B kompleks, dan lain-lain.(6) Sumsum tulang yang normal merupakan bagian esensial dari hemopoesis.Apabila struktur atau fungsi sumsum tulang terganggu maka dapat menimbulkan kelainan. Gangguan dapat disebabkan oleh : a. Kegagalan produksi sel : dijumpai pada anemia aplastik. b. Kegagalan maturasi sel : dijumpai pada sindroma mielodisplastik. c. Produksi sel-sel yang tidak normal : pada thalasemia, hemoglobinopati, dan lain-lain. d. Hilangnya mekanisme regulasi yang normal, seperti pada leukemia akut, penyakit mieloproliferatif, penyakit limfoproliferatif.(6) Gangguan sumsum tulang yang akan dibahas pada tulisan ini adalah terutama leukemia mieloid kronik. 4. Mekanisme regulasi Mekanisme regulasi sangat penting untuk mengatur arah dan kuantitas pertumbuhan sel dan pelepasan darah yang matur dari sumsum tulang ke darah tepi sehingga sumsum tulang dapat merespon kebutuhan darah dengan cepat.Produksi komponen darah yang berlebihan ataupun kekurangan (defisiensi) sama-sama menimbulkan penyakit. Zat-zat yang berpengaruh dalam mekanisme regulasi ini adalah : a. Faktor pertumbuhan hemopoesis (hematopoetic growth factor) Antara lain : granulocyte macrophag colony stimulating factor (GM-CSF), granulocyte colony stimulating factor (G-CSF), macrophage colony stimulating factor (M-CSF), thrombopoetin, burst promoting activity (BPA), stem cell factor (kit ligand) b. Sitokin seperti misalnya : IL-3 (Interleukin-3), IL-4, IL-5, IL-7, IL-8, IL-9, IL-10, IL-11. Growth factor dan sitokin sebagian besar dibentuk oleh sel-sel darah sendiri, seperti limfosit, monosit, atau makrofag serta sebagian oleh sel-sel penunjang seperti fibroblast dan endotel.Sitokin ada yang merangsang pertumbuhan sel induk (stimulatory cytokine), sebagian lagi menekan pertumbuhan sel induk (inhibitory cytokine). Keseimbangan kedua jenis sitokin ini sangat menentukan proses hemopoesis normal. c. Hormon hemopoetik spesifik Erythropoetin : hormon yang dibentuk diginjal khusus merangsang pertumbuhan prekursor eritroid. d. Hormon non spesifik Beberapa jenis hormon diperlukan dalam jumlah kecil untuk hemopoesis seperti : androgen sebagai stimulasi eritropoesis, estrogen menimbulkan inhibisi eritropoesis, glukokortikoid, growth hormone, hormon tiroid. Dalam regulasi hemopoesis normal terdapat feed back mechanism yaitu suatu mekanisme umpan balik yang dapat merangsang hematopoetik jika tubuh kekurangan komponen darah (positive loop) atau menekan hematopoetik jika tubuh kelebihan komponen darah tertentu (negative loop).(6) 3.2 Kelainan Hematopoesis pada Leukemia Mieloid Kronik Untuk memahami terjadinya produksi sel yang cepat pada LMK, maka terlebih dahulu kita mengingat beberapa parameter dasar dari hematopoesis di sumsum tulang. Sumsum tulang pada dewasa dengan berat 70 gram, mengandung kurang lebih 1012 sel hematopoetik yang sekitar setengahnya adalah precursor granulosit, sepertiga sampai dua perlima adalah eritroblast, dan sisanya ialah sel lain termasuk megakariosit dan limfosit. Total volume sumsum tulang pada dewasa adalah 3700 mililiter, tapi hanya seperempat dari ruang sumsum tulang ini disebut sumsum merah mengandung jaringan hematopoetik, sebagian besar berlokasi pada bagian tengah, sementara seperempat yang lain terdiri dari sumsum kuning dan lemak. Jadi sebenarnya volume dari total sel hematopoetik sendiri hanya 500-600 mililiter.(7) Bila terjadi kebutuhan yang besar, seperti pada anemia hemolitik berat dan tidak terkompensasi, terjadi ekspansi sumsum merah, menggantikan jaringan lemak dan mengisi hampir seluruh ruang tulang. Pada kasus yang ekstrem produksi sel darah merah dapat mencapai batas maksimum yaitu 10-12 kali normal.Pada stadium lanjut dan fase kronik yang tidak terkontrol dari LMK ekspansi besar-besaran dari granulopoesis dapat terjadi karena hematopoesis ekstrameduler adalah gambaran khusus dari penyakit ini. Pada pasien yang tidak mendapat terapi, tergantung dari stadium penyakit saat diagnosis, selularitas dari sumsum tulang biasanya bertambah tiga atau lima kali dibanding normal, dengan sel hampir seluruhnya menggantikan komponen lemak dan menghabiskan ruang sumsum tulang. Sebagai tambahan hematopoesis ekstramedular lazim dijumpai dan pada yang tidak terkontrol dapat menjadi ekstrem dengan pembesaran masif dari lien, hati dan organ lainnya. Jika dianggap total ekspansi dari granulopoesis melibatkan sumsum tulang rangka, darah, tempat ekstrameduler, maka tidaklah mengejutkan bahwa terjadi lima sampai sepuluh kali lipat ekspansi dari sel myeloid pada LMK yang tidak diterapi, serta ekspansi yang lebih besar dapat terjadi pada stadium lebih lanjut yang didapatkan splenomegali masif, pembesaran hati, jaringan limfe, dan organ lain.(7) Alasan utama terjadinya ekspansi masif sel mieloid adalah karena sel induk leukemia dan sel progenitor terus menerus berproliferasi walaupun telah mencapai batas densitas homeostatik sel di sumsum tulang dimana sel normal akan berhenti. Namun mekanisme spesifik yang bertanggung jawab terhadap terjadinya disregulasi ini masih belum jelas.(7) 3.3 Perubahan Hematologi Normal dalam Kehamilan dan Puerperium Pada kehamilan terjadi perubahan hematologi baik volume darah maupun komponen-komponen darah itu sendiri sebagai akibat pengaruh hormonal.Perubahan ini perlu kita ketahui untuk memahami apakah perubahan yang terjadi adalah suatu patologi atau fisiologis. Dibawah ini akan diulas perubahan dari satu komponen darah yang berkaitan dengan LMK yaitu sel darah putih (lekosit). Lekosit meningkat dalam kehamilan dengan nilai antara 6 x 109 – 25 x 109 /L. Dalam beberapa jam setelah persalinan, pada wanita sehat diketahui nilai lekosit antara 9 x 109-25 x 109 /L. Setelah empat minggu post partum, nilai lekosit kembali seperti seperti wanita sehat tidak hamil (4 x 109 - 10 x 109 /L). Telah terjadi banyak perdebatan tentang nilai normal dari berbagai tipe sel darah putih.Neutrofil menjadi penyumbang terbesar dari kenaikan jumlah lekosit.Terjadi peningkatan dari jumlah bentuk imatur dan sitoplasma menunjukkan granulasi toksik. Jumlahnya relatif konstan selama kehamilan (3 x 109 - 10 x 109 /L), dimana ditemukan peningkatan pada beberapa jam setelah persalinan (sampai 23 x 109 /L) dan kembali pada keadaan seperti sebelum hamil dalam empat minggu post partum (1,5 x 109 - 6 x 109 /L). Aktifitas kemotaksis dan fagositosis dari neutrofil tertekan, yang dihambat oleh faktor pada serum maternal. Juga didapatkan bukti terjadi peningkatan dari metabolisme oksidatif dari neutrofil selama kehamilan.(8) Jumlah limfosit menurun dalam kehamilan terutama pada trimester pertama dan kedua, meningkat pada trimester ketiga namun tetap lebih rendah sampai awal puerperium dibandingkan wanita tidak hamil. Nilai rata-rata hitung limfosit pada kehamilan adalah 1,1 x 109 - 2,8 x 109 /L, dibandingkan dengan nilai tidak hamil antara 0,8 x 109 – 4 x 109 /L. Nilai limfosit kembali ke nilai normal dalam empat minggu post partum. Studi mendalam dari limfosit T dan B dalam darah tepi dan respon proliferatif dari sel-sel ini serta aktivitas sebagai sel pembunuh (killer cell) menurun dalam kehamilan, mendukung teori adanya faktor imunosupresi dalam serum. Hitung jenis monosit meningkat dalam kehamilan, terutama pada trimester awal, namun menurun sejalan dengan bertambahnya usia kehamilan. Nilainya pada trimester tiga berkisar 0,2 x 109 – 1,0 x 109 /L, dibandingkan dengan nilai tidak hamil yaitu 0,1 x 109 – 0,8 x 109 /L. Rasio monosit terhadap limfosit meningkat dalam kehamilan. Hitung jenis eosinofil dan basofil tidak berubah secara bermakna selama kehamilan. Mielosit dan metamielosit dapat ditemukan dalam darah tepi wanita sehat yang hamil tapi tidak memiliki arti patologis yang signifikan.(8) BAB IV LEUKEMIA MIELOID KRONIK 4.1 Batasan Leukemia adalah keganasan hematologik akibat proses neoplastik yang disertai gangguan diferensiasi (maturation arrest) pada berbagai tingkatan sel induk hemopoetik sehingga terjadi ekspansi progresif dari kelompok (clone) sel ganas tersebut dalam sumsum tulang, kemudian sel leukemia beredar secara sistemik.(6) Leukemia Mieloid Kronik (LMK) atau chronic myeloid leukemia (CML) merupakan leukemia kronik, dengan gejala yang timbul perlahan-lahan dan sel leukemia berasal dari transformasi sel induk mieloid. LMK termasuk kelainan klonal (clonal disorders) dari pluripotent stem cell dan tergolong sebagai salah satu kelainan mieloproliferatif (myeloproliferatif disorders).(6) LMK terdiri atas enam jenis leukemia, yaitu : 1. leukemia mielod kronik, Ph positif (CML, Ph+) 2. leukemia myeloid kronik, Ph negatif (CML, Ph-) 3. juvenile chronic myeloid leukemia 4. chronic neutrophilic leukemia 5. eosinophilic leukemia 6. chronic myelomonocytic leukemia (CMML)(6) Pada tulisan ini hanya akan diulas jenis leukemia mieloid kronik, Ph positif (CML, Ph+). 4.2 Sejarah Leukemia Mieloid Kronik Pengetahuan tentang leukemia sebagai suatu kelompok penyakit dengan klasifikasi yang beragam telah berkembang secara progresif sejak kelainan ini pertama ditemukan dan sejalan dengan berkembangnya teknologi kedokteran sejak lebih dari 150 tahun yang lalu.Demikian juga perbedaan antara kronik dan akut, serta leukemia tipe mieloid dan limfoid tidak langsung diketahui.Adalah karakteristik post mortem dari darah beberapa penderita yang menarik perhatian para ahli. Menurut Gunz dan Henderson, deskripsi akurat tentang leukemia kemungkinan dibuat oleh Velpeau pada tahun 1827, walaupun gejala penyakit ini kemungkinan telah diketahui sejak tahun 1811. Ini diikuti oleh observasi dari Donne dan Craigie. Dan mulai dikenalnya kondisi ini sebagai suatu patologi secara hampir bersamaan dilaporkan oleh Bennet di Skotlandia dan Virchow di Jerman pada tahun 1845. Kasus klasik ini melibatkan John Meredith, seorang tukang jagal berusia 28 tahun dari Edinburgh dan Marie Straide, juru masak berumur 50 tahun di Berlin.Kedua pasien sudah merasakan sakit sejak hampir dua tahun dan kondisi mereka terus memburuk, dengan kelemahan, gejala perdarahan, dan gejala lainnya.Pada kedua kasus didapatkan saat otopsi adalah pembesaran limfa dan perubahan konsistensi darah dimana didapatkan sel darah putih yang banyak. Virchow memakai istilah “Weisses Blut” untuk menggambarkan dominannya sel darah putih pada darah pasien, kemudian tahun 1847 mulai dipakai istilah “Leukaemia”. Bennet memberi istilah “leucocythaemia”.Diagnosis pertama leukemia pada pasien hidup pertama kali dibuat oleh Fuller pada 1846, saat Virchow juga telah menemukan sembilan kasus. Kasus leukemia di Amerika pertama kali dilaporkan adalah pada seorang nelayan berusia 17 tahun pada 1852, ini diikuti oleh serangkaian laporan kasus terutama dari daerah Boston.(9) Usaha awal untuk mencari perbedaan bentuk leukemia termasuk oleh Virchow yaitu antara tipe splenik dan limfatik leukemia, yang dihubungkan dengan jenis sel darah putih. Pembagian ini mirip antara tipe myeloid dan limfoid leukemia, dengan penemuan penting dari Neumann pada 1870 menyatakan bahwa sel yang bertanggung jawab pada tipe splenik adalah dihasilkan pada sumsum tulang. Sampai dengan tahun 1889, ketika Ebstein pertama kali memakai istilah leukemia akut pada bidang klinik, penyakit ini sebelumnya dipercaya sebagai penyakit kronik.Ebstein kemudian memperkenalkan perbedaan antara de novo leukemia akut dan “acutization” dari penyakit kronik tersebut. Tidak lama setelahnya diketahui bahwa diagnosis leukemia akut membawa implikasi dari ketahanan hidup penderita yang singkat, dimana pasien leukemia kronik dapat bertahan hidup sedikit lebih lama.(9) Sumbangan selanjutnya terhadap deskripsi dari leukemia oleh Ehrlich di Jerman, yang mengembangkan metode pengecatan sel darah pada 1891. Ini kemudian mengungkapkan perbedaan morfologi dari granulosit dan limfosit, yang sebelumnya hanya diketahui dari pemeriksaan mikroskop tanpa pewarnaan sebagai granular dan agranular sel dengan perbedaan bentuk nukleus. Walaupun penemuan ini telah meletakkan dasar bagi klasifikasi morfologi dari leukemia myeloid dan limfoid, penemuan ini tidak mendapatkan perbedaan antara sel T dan sel B. Informasi tentang hal ini baru tersedia sampai tahun 1960.(9) Tahun 1878 Neumann menemukan bahwa leukemia berasal dari sumsum tulang dan menambahkan leukemia mielogenus pada tipe leukemia splenik dan limfatik yang digambarkan oleh Virchow.Erlich mengidentifikasi suatu tipe sel primitif yang menurutnya sebagai cikal bakal dari sel limfoid dan myeloid, dan kemungkinan menjadi referensi pertama dari konsep sel induk hemopoetik. Pandangan tentang perbedaan dari garis turunan sel hemopoetik didukung oleh Naegeli tahun 1900 ketika dia menemukan perbedaan antara mieloblast dan limfoblast.(9) Studi sitogenetik yang berkembang selama tahun 1950 sampai 1956 dengan ditemukannya jumlah kromosom pada tiap sel normal manusia yaitu 46. Ditemukannya kromosom Philadelphia (Ph) pada 1960 oleh Nowell dan Hungerford menyediakan penanda patognomonik bagi penyakit ini sekaligus memberi era baru.Dengan penanda ini dimungkinkan untuk menunjukkan adanya kelainan kelompok sel yang berasal dari sel induk hemopoetik. Terlebih lagi perkembangan dari pemeriksaan clonogenic assay untuk sel progenitor hemopoetik pada tahun 1970 oleh Fialkow. De Klein dan kawan-kawan menemukan bahwa translokasi Ph melibatkan pertukaran dari bagian abl onkogen dari kromosom 9 ke kromosom 22, dan setahun kemudian translokasi resiprokal dari materi genetik dari kromosom 9 ke 22 diidentifikasi. Translokasi ini menghasilkan formasi fusi gen BCR/ABL pada kromosom 22. Hal ini menghasilkan RNA mesengger dan hybrid BCR/ABL p210 protein tirosin kinase. Hal ini selanjutnya akan diuraikan pada bab selanjutnya.(9) 4.3 Epidemiologi Leukemia Mieloid Kronik 4.3.1 Epidemiologi deskriptif Pada tahun 2008, 4.830 pasien didiagnosa dengan LMK di Amerika.LMK menempati 10-15% dari seluruh kasus leukemia pada dewasa. Insidennya kurang lebih konstan diseluruh dunia, berkisar satu sampai dua kasus per 100.000 populasi dengan sedikit dominasi lebih banyak pada laki-laki dibanding wanita yaitu 1 berbanding 0,6/0,7 per 100.000 per tahun. Di Asia Pasifik dilaporkan insiden bervariasi pada beberapa negara. Berturut-turut di China 0,4; Hong Kong 0,9; Jepang 1,0; Selandia Baru 0,8; Filipina 0,7-0,9; Singapura 0,7; Korea Selatan 0,8; Taiwan 0,9; Thailand 0,5 per 100.000 populasi. Di Indonesia belum didapatkan data insidennya, hanya beberapa laporan kasus leukemia tipe lainnya.(11,12) Sejak ditemukannya terapi dengan Imatinib, angka mortalitas pertahunnya menurun dari 10% pertahunnya menjadi sekitar 1-2%. Saat ini rasio ketahanan hidup 8-10 tahun dari LMK meningkat dari sebelumnya hanya 10-15% menjadi lebih dari 80%. Usia rata-rata penderita LMK adalah 45 sampai 55 tahun, tapi lebih dari sepertiga kasus dengan usia lebih 60 tahun. LMK tidak umum didapatkan pada anakanak dan remaja, hanya berkisar 5% dari populasi leukemia.(13) Insiden leukemia dalam kehamilan sangat jarang, berkisar 1 dari 75.000100.000 kehamilan.Namun sebagian besar leukemia dalam kehamilan digolongkan akut (90%), kemudian tipe myeloid (61% LMA, 7% LMK), dimana tipe limfoid (28% LLA, 3% LLK).Kejadian leukemia dalam kehamilan di Indonesia sampai saat ini belum didapatkan data pasti. Di Bali sendiri khususnya di RSUP Sanglah Denpasar sebelumnya pernah dilaporkan satu kasus kehamilan dengan LMA pada tahun 2010. Pada review literatur, di dunia hanya 157 kasus LMK dalam kehamilan yang dilaporkan antara tahun 1990 sampai 2009.(2,3,4,5) 4.3.2 Epidemiologi Analitik Masalah utama dalam menentukan epidemiologi dari LMK adalah kasus yang sangat jarang dan sedikitnya data kejadian yang dipublikasikan. Namun dari beberapa penelitian dan laporan kasus dapat dianalisa faktor resikonya sebagai berikut : o Radiasi Ionisasi dan Kemoterapi Terdapat bukti-bukti yang cukup bermakna bahwa radiasi ionisasi dosis tinggi meningkatkan resiko terjadinya LMK (dan beberapa tipe leukemia lainnya). Bukti paling nyata adalah dari orang-orang Jepang yang selamat dari bom atom Hiroshima dan Nagasaki, LMK dan LLA adalah keganasan yang paling awal muncul dengan LMK rata-rata terjadi 5 tahun setelah ledakan pada kelompok usia muda dan beberapa tahun kemudian pada kelompok usia tua (lebih 15 tahun). Kebanyakan kejadian tidak didapatkan lagi setelah tahun 1980, dan tidak didapatkan pada mereka yang terpapar intrauterine dan anakanaknya. Tidak didapatkan resiko pada paparan dibawah 0,4 Gy dan didapatkan respon pada dosis paparan diatas 4 Gy. Resiko lebih rendah didapatkan pada pasien ankylosing spondylitis yang diterapi dengan radiasi eksternal atau radium-224.Demikian juga pada mereka yang mendapat terapi radiasi sebagai contoh kanker serviks. LMK pernah juga dilaporkan pada pasien yang mendapat kemoterapi karena kanker primer namun faktor resiko ini sangat kecil.(10) o Radiasi Non Ionisasi Berbagai penelitian tentang resiko leukemia yang berhubungan dengan medan elektromagnetik seringkali menyebutkan terjadinya LMK. Walaupun ada berbagai riset yang mendapatkan tidak ada hubungan yang bermakna antara medan magnet dan LMK, namun mereka membenarkan adanya paparan medan magnet pada penderita LMK. Hal ini masih terus diselidiki.(10) o Merokok Leukemia mieloid secara umum dihubungkan dengan faktor resiko merokok, ini ditunjukkan oleh beberapa studi pada para veteran di Amerika.Pada beberapa studi lainnya LMK secara terpisah disebutkan memiliki resiko yang berhubungan. Merokok juga didapatkan mempercepat waktu terjadinya krisis blast.(10) o Pekerjaan LMK banyak dilaporkan pada mereka yang secara terus menerus terpapar oleh senyawa benzene, seperti juga pada leukemia akut. Dari beberapa studi kohort disebutkan resiko bervariasi mulai dari tiga kali lipat sampai dengan 25 kali lipat dan menunjukkan secara tidak terperinci hubungan dengan dosis paparan yang resikonya secara signifikan terlihat pada mereka yang terpapar kurang dari 10 bagian per juta selama kurang dari lima tahun.(10) o Kehamilan Tidak didapatkan data yang menyebutkan kehamilan sebagai faktor resiko terjadinya leukemia, khususnya LMK.(10) 4.4 Patofisiologi Leukemia Mieloid Kronik 4.4.1 Kromosom Philadelphia (Ph) Secara umum telah diketahui bahwa LMK terjadi bila sebuah sel tunggal, pluripotent dari suatu sel induk hemopoetik mendapat kromosom Ph yang membawa gen fusi dari BCR-ABL, yang memberikan gen tersebut kemampuan proliferasi melebihi sel hematopoesis normal dan memungkinkan kelompok gen Ph positif untuk menggantikan fungsi hematopoesis normal. Bukti dari hipotesis ini ditemukan karena konsistensi dari abnormalitas molekuler pada semua pasien namun mekanisme bagaimana perubahan molekuler dan sitogenetik terjadi masih belum jelas. Senada dengan hal tersebut dasar molekuler dari kemampuan proliferatif belum dapat digambarkan dengan jelas, tapi dapat memiliki hubungan dengan ekspresi progenitor leukemik dari faktor stimulasi pertumbuhan, seperti IL-3 dan granulocyte colony stimulating factor, sel LMK dapat hidup lebih lama dibanding sel normal lainnya, sebagai akibat dari menurunnya respon terhadap apoptosis. Apapun mekanisme primer dari penyakit ini, jelas bahwa massa mieloid bertambah dengan cepat pada pasien yang baru terdiagnosa, karena terjadi ekspansi dari element matur dan juga bertambahnya jumlah sel progenitor dan sel induk (stem cell).(14) Pada tahun 1960, petunjuk penting tentang patogenesis dari LMK ditemukan oleh Howell dan Hungerford berupa penemuan kromosom Ph dan faktor-faktor yang berhubungan dengan penyakit ini. Dengan memakai fluoresensi Quinacrine dan pewarnaan Giemsa, Rowley dan kawan-kawan menunjukkan bahwa kromosom Ph dihasilkan dari translokasi resiprokal antara lengan panjang kromosom 9 dan 22; t(9;22) (q34; q11). Ini adalah inti patogenesis dari LMK dan ditemukan pada lebih dari 95% pasien LMK. t(9;22) (q34;q11) bergabung pada segmensegmen 3’ dari gen ABL dari kromosom 9q34 ke segmen 5’ dari gen BCR pada kromosom 22q11, menghasilkan gen hybrid BCR-ABL yang ditranskripsikan pada messenger RNA dari BCR-ABL. Gen ABL memiliki 11 exon, dimana exon pertama memiliki dua varian yaitu 1a dan 1b. gen ABL mengkode ekspresi khusus non reseptor tirosin kinase dengan berat molekul 145 kD (p145ABL). Isoform dari ABL, seperti 1a dan 1b terbentuk dari proses splicing exon pertama. Titik pemecahan dari gen ABL terjadi pada daerah lebih panjang dari 300 kilobase (kb), tapi biasanya sebelum exon 2. Exon 2 sampai 11 (disebut juga a2 sampai a11) adalah segmen yang bertukar dengan bagian 5’ dari BCR.(14) Bagian mayor dari titik daerah kluster perpecahan (Major breakpoint cluster region/ M-bcr) dari gen BCR pada kromosom 22 berlokasi diantara exon 12 dan 16 dan memanjang lebih dari 5,8 kb. Dua fusi transkripsi, e13a2 dan e14a2 (b2a2 dan b3a2) dibentuk dan keduanya ditranslasikan menjadi protein chimeric 210 kD bernama p210BCR-ABL. Pada 95% dari LMK dengan BCR-ABL positif, sel leukemik mempunyai baik b2a2 atau b3a2, tapi pada 5% kasus alternatif splicing menyebabkan ekspresi dari kedua produk fusi.(14) Bagian minor dari titik daerah kluster perpecahan (Minor breakpoint cluster region/ m-bcr) menghasilkan fusi transkripsi bernama e1a2 yang menjadi protein 190 kD, p190BCR-ABL. p190BCR-ABL jarang ditemui pada LMK namun banyak pada LLA. Fusi transkripsi lain dari dari m-bcr adalah e19a2 yang ditranslasikan menjadi protein 230 kD, p230BCR-ABL. Kromosom Ph adalah kromosom 22 yang diperpendek sebagai hasil dari translokasi segmen 3’ dari ABL pada kromosom 9 ke segmen 5’ dari BCR pada kromosom 22. Pada sebagian besar kasus titik perpecahan (breakpoint) dari gen ABL berlokasi di segmen 5’ dari exon a2. Berbagai lokasi titik perpecahan telah diidentifikasi sepanjang gen BCR pada kromosom 22. Tergantung pada dimana titik perpecahan terjadi, beberapa segmen yang berbeda ukuran dari BCR berfusi dengan segmen 3’ dari gen ABL. Ini menghasilkan molekul RNA messenger (e1a2, b2a2, b3a2, dan e19a2) yang berbeda-beda panjangnya dan ditranslokasikan menjadi produk protein chimeric yang berbeda-beda (p190, p210, p230) dengan berat molekul yang bervariasi.(14) Gambar 4.1 Translokasi dari t(9;22)(q34;q11) pada LMK.(14) 4.4.2 Protein BCR-ABL Potensi leukemogenik dari p210BCR-ABLterjadi karena aktivitas regulasi tirosin kinase diaktivasi pada fusi onkoprotein.Protein ABL adalah non reseptor tirosin kinase yang memiliki peran penting pada transduksi sinyal dan regulasi pertumbuhan sel. Ada dua isoform ABL, isoform 1a dan isoform 1b.isoform 1b diekspresikan pada tingkat lebih tinggi pada sel progenitor hematopoetik awal, mengalami myriastolasi pada glysin di Nterminal. Hilangnya myriastolasi pada ABL secara dramatis memperkuat aktifitas tirosin kinasenya.Pada daerah myriastolasi dari N-terminal segmen dari ABL, terdapat tiga domain homolog (SH3, SH2, SH1). SH2 dan SH3 meregulasi fungsi tirosin kinase dari ABL dan SH1 sebagai pengatur fungsi tirosin kinase dari ABL.(14) Defek dari integritas fungsional dari SH2 menurunkan ikatan phosphotyrosine dan mengurangi kapasitas transformasi dari ABL. C- terminal dari ABL mengandung domain binding DNA, lokasi sinyal nuklear dan binding site untuk actin. Gangguan dari protein ABL oleh fusi genetik ini bertanggung jawab terhadap meningkatnya aktifitas regulasi tirosin kinase.(14) Gambar 4.2 Domain fungsional p160BCR, p145ABL, dan p210BCR-ABL (14) 4.4.3 Jalur sinyal dari BCR-ABL Struktur dari p210BCR-ABL memungkinkan interaksi dengan banyak protein-protein yang melibatkan berbagai jalur sinyal intraseluler. Beberapa domain pada BCR-ABL dapat melekat pada protein-protein adaptor seperti growth factor receptor bound proteins 2 (GRB2), CRKlike protein (CRKL), casitas B-lineage lymphoma pro oncogen protein (CBL), dan SRC homology 2-containing protein (SHC). Domain SH2 dan GRB2 berikatan untuk memelihara residu tirosin (Y177) dari BCR pada p210BCR-ABL, yang mengikat p210BCR-ABL pada RAS, suatu guanosine triphospahate (GTP) binding protein yang terlibat dalam regulasi dari proliferasi dan diferensiasi sel dan berlokasi pada pusat dari jalur sinyal utama pada patogenesa dari LMK. Proses sinyal dari RAS selanjutnya belum diketahui pasti dan bisa melibatkan mitogen activated protein kinase (MAPKs), seperti JUN kinase (JUK). Aktivasi dari CRKL atau protein SHC yang berikatan pada domain SH2 dan SH3 dari BCR-ABL juga dapat mengaktifkan transduksi sinyal dari jalur RAS.Signal transducer and activator of transcription 5 (STAT5) dari jalur JAK/STAT5 dapat langsung difosforilasi oleh BCR-ABL, jalur sinyal dari RAS berefek pada regulasi dari anti apoptosis protein BCL yang dimediasi oleh CRKL dan CRK, jalur phosporilasi dari phosphatidylinositol-3 kinase (PI-3K) diaktivasi oleh BCR-ABL yang berefek pada meningkatnya pro mitogenik dan sinyal anti apoptotik.(14) Gambar 4.3 Jalur sinyal p210BCR-ABL(14) 4.5 Diagnosis Leukemia Mieloid Kronik 4.5.1 Gejala Klinik Perjalanan penyakit ini dibagi menjadi dua fase, yaitu : 1. Fase kronik : fase ini berjalan selama 2-5 tahun dan responsif terhadap kemoterapi. 2. Fase akselerasi atau tranformasi akut : pada fase ini gejala klinik mirip leukemia akut, proporsi sel muda meningkat dan akhirnya bisa masuk kedalam “blast crisis” atau krisis blastik.(6) Gejala klinik LMK tergantung pada fase yang kita jumpai pada saat diagnosis, yaitu : a. Fase kronik, terdiri atas : 1. Gejala hiperkatabolik : berat badan menurun, lemah, anoreksia, berkeringat malam. 2. Splenomegali hampir selalu ada, seringkali massif. 3. Hepatomegali lebih jarang dan lebih ringan. 4. Gejala gout, gangguan penglihatan. 5. Anemia pada fase awal biasanya ringan. 6. Terkadang asimptomatik ditemukan secara kebetulan pada saat check up atau pemeriksaan untuk penyakit lain.(6) b. Fase transformasi akut, terdiri atas : 1. Perubahan terjadi perlahan dengan prodormal selama enam bulan, disebut sebagai fase akselerasi. Timbul keluhan baru seperti demam, lelah, nyeri tulang (sternum) yang semakin progresif. Respon terhadap kemoterapi menurun, leukositosis meningkat, trombosit menurun dan akhirnya menjadi gambaran leukemia akut. 2. Pada sekitar sepertiga penderita, perubahan terjadi secara mendadak, tanpa didahului masa prodormal, keadaan ini disebut krisis blastik. Tanpa pengobatan adekuat penderita sering meninggal dalam 1-2 bulan.(6) 4.5.2 Pemeriksaan penunjang 1. Morfologi darah tepi Temuan umum dari pemeriksaan darah tepi pada LMK adalah leukositosis dengan gambaran shift to the left pada hitung jenis, basofil dan eosinofil. Leukositosis dengan 20-200 x 109 /L seringkali ditemukan. Lebih jarang didapatkan dengan leukositosis kurang dari 20 x 109 /L atau lebih dari 2000 x 109 /L. leukositosis dihasilkan dari proliferasi dari granulosit, aktivitas leukosit alkalin fosfatase menurun, walaupun fungsi fagositosis masih normal. Blast dapat ditemukan pada darah tepi. Nilai myeloblast dapat berkisar antara 0-10, promyelosit 04, myelosit dan metamyelosit dapat berkisar 40% dan neutrofil matur mencapai 35%. Platelet dapat normal atau naik 40-45%, kenaikan platelet lebih dari 10000 x 109 biasanya hanya diobservasi. Nilai platelet yang rendah menunjukkan prognosis yang buruk.(14) Gambar 4.4 Hapusan darah tepi pada LMK(14) 2. Aspirasi sumsum tulang (bone marrow aspiration/BMA) Gambaran sumsum tulang pada LMK adalah hiperseluler dengan sedikit sel lemak.Semua tahap dari maturasi myeloid ditemukan, dengan dominan myelosit. Pada fase kronik total myeloblast dan promyelosit biasanya bernilai kurang dari 15% dari selularitas sumsum tulang. Megakariosit dapat bertambah dan Gaucher-like cells dapat dilihat pada 10% kasus.Basofil dan eosinofil sumsum tulang seringkali ditemukan. Blast terlihat dengan karakteristik morfologi berbeda dengan myeloblast normal. Berbagai tingkat fibrosis pada sumsum tulang bisa terlihat. Sejalan dengan bertambahnya progresifitas penyakit, proporsi blast meningkat, terlihat penurunan atau kerusakan morfologi sel-sel myeloid, dan fibrosis sumsum tulang bertambah luas.(14) Gambar 4.5 Aspirasi sumsum tulang pada LMK(14) 3. Analisa sitogenetika Walaupun telah diketahui bahwa fusi BCR-ABL sebagai penyebab LMK, tapi diagnosa yang spesifik bergantung pada tes sitogenetik dan atau molekuler untuk mengidentifikasi abnormalitas gen yang spesifik. G-banding karyotiping dipakai untuk analisa sitogenetik dan biasanya 25-30 sel metafase yang diperiksa.Analisa sitogenetik mendeteksi kromosom Ph pada sekitar 95% pasien LMK saat diagnosis. Sisanya 5% disebut “masked translocation” yang hanya bisa dideteksi dengan teknik analisa molekuler, seperti Fluorescence in situ hybridization (FISH) atau reverse transcriptase polymerase chain reaction (RT-PCR).(14) Karena terbatasnya jumlah sel yang diperiksa, sensitivitas sitogenetik dalam mendeteksi sel yang tersisa post terapi hanya satu sel leukemia dalam 25-30 sel normal. Dengan kata lain sensitivitas deteksi adalah 3-4% sel Ph positif. Tetapi kemampuannya dalam kuantifikasi menjadikan analisa sitogenetik tes yang bermanfaat untuk monitoring respon terapi.Jadi metode ini akurasi masih lemah terutama ketika sel Ph positif kurang dari 10% dari total.Sitogenetik memerlukan sel yang sedang membelah untuk analisa kromosom metafase, dan spesimen terbaik adalah sumsum tulang yang mengandung lebih banyak sel proliferatif dibandingkan darah.Walaupun dengan kekurangan diatas, analisa sitogenetik tetap menjadi standar untuk monitoring pasien LMK.juga sitogenetik dapat mengungkapkan abnormalitas karyotipik.(14) 4. Fluorescence in situ hybridization (FISH) Analisa FISH umumnya dilakukan dengan ko-hibridisasi sebuah BCR dan sebuah ABL untuk mengubah sifat (denaturated) kromosom metafase atau nukleus interfase.FISH konvensional (dikenal juga dengan S-FISH atau dual-FISH) adalah teknik dua warna dimana pemeriksaan fluoresensi 5’ BCR dan juga fluoresensi 3’ ABL dengan melihat kontras dari warna untuk mendeteksi posisi dari gen bersangkutan.Superimposisi acak dari pemeriksaan fluoresensi pada nukleus interfase normal dapat berujung pada hasil false positif.Frekuensi false positif dapat mencapai 3-10%, membuat kuantifikasi dibawah 10% tidak dapat dipercaya. Pemeriksaan triple probe FISH (three colour FISH) menambah sensitifitas dari teknik two probe FISH dengan memperkenalkan probe ketiga yang menganalisa rentang titik perpecahan (breakpoint) dari BCR-ABL. Tiap probe diberi penanda terpisah, fluorokrom yang berbeda. Pada sel Ph positif sebagai tambahan dengan sinyal fusi BCR-ABL, sinyal dari probe ketiga menghilang. Proses verifikasi dua langkah ini meningkatkan sensitifitas dari deteksi sel Ph positif, dengan rata-rata false positif 0,065-0,27%.(14) Double FISH (D-FISH) memakai empat probe, selain dua yang dipakai di S-FISH yang menganalisa 3’ BCR dan 5’ ABL. Tambahan dua probe lagi mendeteksi rentang titik perpecahan dari kedua kromosom 9 dan 22. Pada translokasi BCR-ABL, D-FISH menghasilkan sinyal fusi ganda karena keempat probe mengikat masing-masing BCR-ABL dan BCR-ABL loci. Sehingga mengurangi kejadian false positif maupun false negatif dibandingkan S-FISH. Metode FISH mendeteksi BCR-ABL pada 95% dari LMK dan dapat mendeteksi hampir 5% kasus dengan “masked translocation” yang tidak terdeteksi dengan sitogenetik konvensional. Pemeriksaan FISH biasanya menganalisa 200-500 nukleus, jadi lebih akurat dan bisa dikerjakan pada sel interfase dari darah tepi ataupun sumsum tulang. FISH memakai rangkaian yang unik, fusi ganda di probe DNA untuk BCR warna merah dan daerah gen ABL warna hijau. Fusi abnormal BCR-ABL pada kromosom Ph positif berwarna kuning.(14 Gambar 4.6 D-FISH untuk deteksi fusi BCR-ABL pada sel interfase(14) 5. Quantitaive RT-PCR Metode dengan sensitivitas yang tinggi dibutuhkan untuk monitoring pasien yang sedang diterapi.Teknik PCR, seperti RT-PCR, Multiplex PCR, dan Nested PCR, yang menargetkan onkogen BCRABL telah menunjukkan sensitivitas yang tinggi untuk mendeteksi LMK.dalam beberapa tahun ini kuantitatif RT-PCR (QRT-PCR) telah dapat mengukur tingkat transkripsi BCR-ABL di darah tepi dan sumsum tulang, yang memungkinkan monitoring tiap waktu. Teknik QRT-PCR yang paling umum untuk monitoring LMK dengan memakai rangkaian probe spesifik bernama TaqMan, sebuah probe single exonuclease hydrolisis. Probe dengan rangkaian komplemen untuk BCR-ABL cDNA, label ganda. Satu fluorofor sebagai reporter dan emisi spektranya dihambat oleh fluorofor kedua (quencher). Mengikat secara spesifik pada BCR-ABL, probe memecah aktivitas exonuclease dari Taq polymerase selama reaksi PCR, yang memisahkan reporter dan quencher, dan menghasilkan emisi fluoresen yang dapat dideteksi secara real time. Tingkat transkripsi mencerminkan jumlah sel leukemik di darah dan sumsum tulang, dan dapat dipakai sebagai ukuran yang dipercaya untuk melihat respon terapi dan meramalkan prognosis.(14) Gambar 4.7 Real Time PCR dengan teknik TaqMan 4.5.3 (14) Tanda transformasi akut Perubahan LMK dari fase kronik ke fase transformasi akut ditandai oleh : 1. Timbulnya demam dan anemia yang tidak dapat dijelaskan penyebabnya. 2. Respon penurunan leukosit terhadap kemoterapi yang semula baik menjadi tidak adekuat. 3. Splenomegali membesar yang sebelumnya sudah mengecil. 4. Blast dalam sumsum tulang lebih dari 10%.(6) Diagnosis LMK pada fase akselerasi menurut WHO adalah : 1. Blast 10-19% dari leukosit pada darah tepi dan atau dari sel sumsum tulang berinti. 2. Basofil darah tepi lebih dari sama 20%. 3. Trombositopenia persisten (<100 x 109 /L) yang tidak dihubungkan dengan terapi atau trombositosis (>1000 x 109 /L) yang tidak responsif pada terapi. 4. Peningkatan ukuran lien atau leukosit yang tidak responsif pada terapi. 5. Bukti sitogenetik adanya evolusi klonal.(6) Diagnosis LMK pada fase krisis blastik menurut WHO adalah : 1. Blast lebih dari sama 20% dari leukosit pada darah tepi atau sel sumsum tulang berinti. 2. Proliferasi blast ekstrameduler. 3. Fokus besar atau cluster sel blast dalam biopsi sumsum tulang.(6) 4.5.4 Diagnosis leukemia mieloid kronik pada kehamilan Selama kehamilan tubuh wanita mengalami serangkaian perubahan fisiologis yang membuat diagnosis leukemia lebih menyulitkan.Diagnosis dapat tertunda karena tanda dan gejala dari LMK seperti lemah, cepat lelah, pucat, sesak seringkali merupakan keluhan wanita hamil normal.Selain itu kehamilan itu sendiri sering didapatkan anemia dan leukositosis seperti temuan laboratoris pada pasien LMK.Dalam hal ini untuk kecurigaan LMK memerlukan pemeriksaan morfologi dan sitogenetik analisa sumsum tulang. Pada wanita hamil biopsi sumsum tulang dapat dikerjakan dengan anestesi lokal dan aman tanpa efek merugikan pada ibu ataupun janin.(13) 4.6 Penatalaksanaan 4.6.1 Prinsip umum penatalaksanaan kanker pada kehamilan 1. Kemoterapi pada kehamilan Seperti diketahui berbagai senyawa sitotoksik memiliki berat molekul antara 250-400 kD, jadi sebenarnya semuanya dapat melewati plasenta dan mencapai janin. Tetapi hanya sedikit studi terhadap aliran trans plasenta yang dilakukan untuk mengetahui konsentrasi obat di cairan amnion, darah tali pusat, plasenta, dan jaringan janin, dengan berbagai hasilnya. Ketika merawat wanita hamil dengan kemoterapi, penting untuk memperhatikan perubahan fisiologi normal selama kehamilan meliputi peningkatan volume plasma sampai 50% dan ekskresi obat lewat ginjal, dan peningkatan oksidasi hepatik. Perubahan ini dapat menurunkan konsentrasi aktif obat dibanding wanita tidak hamil. Namun, dengan sedikitnya studi farmakokinetik pada wanita hamil yang menerima kemoterapi, masih belum diketahui pasti perbedaan dosis yang seharusnya diberikan dalam kehamilan.(13) Hampir semua agen kemoterapi dihubungkan dengan malformasi kongenital pada penelitian dengan hewan.Tapi, dosis kemoterapi pada manusia seringkali lebih rendah dari dosis teratogenik minimal pada hewan, yang menyulitkan mencari hubungan antara dosis manusia dan hewan.Kemoterapi yang diberikan selama trimester pertama dapat meningkatkan resiko abortus spontan, kematian janin, dan kelainan mayor.Usia kehamilan paling rentan adalah saat minggu 2-8 sewaktu organogenesis. Selama periode ini gangguan pada berbagai organ yang berkembang dapat mengakibatkan kematian janin, kelainan mayor.Beberapa organ meliputi mata, genitalia, sistem hematopoetik, dan sistem saraf.Resiko ditemukan lebih rendah pada kemoterapi tunggal dibandingkan yang kombinasi.Paparan pada trimester kedua dan ketiga tidak dikaitkan dengan malformasi tapi meningkatkan resiko kematian janin atau neonatus, pertumbuhan janin terhambat, dan berat lahir rendah.Namun resiko ini sangat kecil, sehingga keuntungan terapi lebih dipertimbangkan dan regimen kombinasi dapat diberikan pada periode ini.Keputusan pemberian kemoterapi harus memperhatikan keadaan ibu bila terapi ditunda.Jika memungkinkan kemoterapi harus ditunda sampai setelah trimester satu.Jika kemoterapi harus dikerjakan maka abortus terapeutik dianjurkan dilakukan.Persalinan sebaiknya direncanakan 2-3 minggu setelah terapi untuk memberi kesempatan pemulihan pada sumsum tulang.Disamping itu neonatus khususnya bayi preterm memiliki kapasitas terbatas untuk memetabolisme dan eliminasi obat karena kurang matangnya hati dan ginjal. Penundaan persalinan setelah kemoterapi akan memungkinkan eliminasi obat lewat plasenta.(13) 2. Terapi suportif Hampir 70% pasien kanker mengeluh mual dan muntah karena efek samping terapi anti kanker dan memerlukaan anti emetik seperti metoklopramide, anti histamin atau obat berbasis ondansentron.Tidak didapatkan resiko malformasi kongenital pada pemakaian obat-obat ini baik pada percobaan hewan ataupun manusia.Wanita hamil dengan terapi ini terutama pada dosis tinggi meningkatkan resiko infeksi seperti demam neutropenia dan dapat diberikan antibiotik.Penisilin, sefalosporin, dan eritromisin aman.Aminoglikosida dan metronidazole relatif aman walaupun dengan kurangnya data tentang ini.Quinolone menyebabkan arthropati, tetrasiklin yang mempengaruhi tulang dan gigi harus dihindari. Sulfonamide seperti juga semua antagonis folat dihubungkan dengan neural tube defect dan malformasi jantung,jadi harus dihindari.(13) Selain infeksi bakterial, pasien dengan neutropenia berat dapat mendapat infeksi jamur.Anti jamur sistemik yang paling sering dipakai adalah amphoterisin B. Tidak didapatkan laporan efek teratogenik pada obat ini sehingga merupakan pilihan pertama. Fluconazole pada dosis tertentu mengakibatkan efek teratogenik, jadi sebaiknya pada dosis rendah (150 mg/hari). Ketoconazole dan flucytosine dalam kehamilan diketahui berefek teratogenik dan embriotoksik jadi harus dihindari.(13) 4.6.2 Terapi leukemia mieloid kronik pada kehamilan 1. Imatinib Mesylate Imatinib mesylate (ST1571, Gleevec, Glivec) adalah tirosin kinase inhibitor yang memasuki uji klinik pada 1998 dan sejak saat itu telah menunjukkan respon hematologi dan sitogenetik yang dramatis pada pasien LMK saat fase kronik dan akselerasi. Beberapa laporan dari eksperimen pada hewan mendapatkan bahwa imatinib dapat teratogenik dan direkomendasikan pada wanita yang diterapi dengan imatinib menggunakan kontrasepsi yang sesuai.23 kasus wanita hamil dengan LMK yang diterapi imatinib telah dilaporkan diliteratur.Kecuali satu pasien pada fase akselerasi, semua pasien diterapi saat fase kronik.Lima kehamilan diakhiri pada awal kehamilan, empat karena abortus spontan, satu dengan abortus terapeutik.18 kehamilan mencapai persalinan aterm dengan 19 bayi sehat tanpa kelainan kongenital yang signifikan.Pada wanita imatinib dihentikan saat diketahui hamil (minggu 4-9 kehamilan). Pada satu pasien penyakit masuk fase akselerasi, 11 wanita memerlukan terapi lain meliputi interferon, hydroxyurea, leukapheresis, atau pemberian terapi imatinib lagi setelah kehamilan. Pada 5 pasien yang mendapat imatinib menunjukkan respon hematologi yang lengkap.(13) Konsentrasi imatinib dan metabolit aktifnya, CGP74588, ditemukan pada darah maternal, plasenta, darah tali pusat, dan air susu pada dua pasien. Konsentrasinya lebih tinggi di plasenta dibandingkan darah maternal, namun rendah bahkan tidak terdeteksi pada darah tali pusat. Temuan ini menunjukkan transfer plasenta yang minimal pada umur kehamilan lanjut. Terdapat data yang berlawanan dari akibat penghentian terapi pada prognosis pasien LMK.kebanyakan studi melaporkan kekambuhan penyakit setelah terapi dihentikan dan hanya sedikit pasien yang mengalami remisi lengkap setelah terapi dilanjutkan lagi. Ini menimbulkan pertanyaan kapan penghentian terapi dapat direkomendasikan untuk pasien dengan remisi lengkap yang ingin mempertahankan kehamilannya. Masih dipertanyakan apakah wanita hamil harus menghentikan terapi mengingat resiko progresifitas penyakit, ataukah melanjutkan dengan terapi lain. Sebaiknya, pada pasien yang didiagnosa LMK saat kehamilan, imatinib tidak menjadi obat pilihan berkaitan dengan kurangnya data dan resiko kelainan kongenital.Imatinib dapat diberikan pada kasus khusus dengan fase akselerasi yang menolak terminasi kehamilan, dan mereka yang tidak dapat mentoleransi terapi interferon. Generasi kedua inhibitor tirosin kinase oral ( seperti Dasatinib, Nilotinib) sekarang masih terus diteliti, data pemakaiannya dalam kehamilan masih sedikit dilaporkan.(13) 2. Interferon-alpha Sebelum berkembangnya Imatinib mesylate, interferon alpha adalah terapi pilihan untuk kebanyakan pasien LMK.Interferon alpha menghambat proliferasi sel dengan efeknya pada sintesa protein, degradasi RNA dan kemungkinan modulasi sistem imun.Obat ini tidak menghambat sintesis DNA. Melihat berat molekulnya (19 kD) interferon alpha tidak melewati barier plasenta. Tidak ada mutasi atau teratogenisitas yang didapatkan pada percobaan dengan hewan.Dua laporan penting tentang terapi interferon selama kehamilan menggambarkan 40 kasus, delapan diantaranya diterapi saat trimester satu.Tidak didapatkan malformasi janin ketika interferon diberikan sebagai terapi tunggal.Persalinan preterm terjadi pada 4 wanita dan pertumbuhan janin terhambat ditemukan pada 6 bayi. Beberapa laporan lain menyebutkan pasien hamil diterapi dengan interferon. Semua kehamilan mendapatkan bayi sehat tanpa kelainan dan luaran maternal yang normal. Walaupun data masih sedikit namun interferon alpha dianggap aman pada kehamilan dan merupakan obat pilihan pada pasien LMK yang hamil.(13) 3. Hydroxyurea Hydroxyurea adalah obat sitotoksik yang menghambat sintesis DNA.Umum digunakan pada pasien LMK sebelum ditemukan imatinib. Walaupun sampai 90% pasien yang mendapat hydroxyurea mengalami remisi klinik dan hematologi, terapi ini tidak memperpanjang usia penderita, dan jarang memberikan respon sitogenetik. Beberapa kasus administrasi hydroxyurea dalam kehamilan telah dilaporkan. Satu penelitian dari 31 pasien dan review terhadap 19 wanita dengan kelainan darah lain yang diterapi dengan obat ini pada berbagai umur kehamilan. Dari total 50 kasus ada dua kasus kematian janin dalam rahim (didapatkan pada pasien yang diterapi saat trimester satu), tiga dengan malformasi minor (hip dysplasia, unilateral renal dilatation, pilonidal sinus), dan 9 kasus persalinan preterm. Paparan pada trimester dua dan tiga dihubungkan dengan peningkatan resiko pre-eklampsia.Berdasarkan data yang ada, maka terapi hydroxyurea sebaiknya dihindari saat trimester satu. Dapat diberikan pada pasien yang tidak mentoleransi terapi interferon selama trimester dua dan tiga.(13) 4. Leukapheresis Leukapheresis dapat dikerjakan pada penanganan leukemia akut dan kronik untuk reduksi cepat jumlah leukosit yang tinggi pada pasien dengan ancaman oklusi vaskular.Pengalaman terapi leukapheresis dalam kehamilan sangat sedikit dan hanya didapatkan dua laporan kasus.Pada kedua kasus leukapheresis adalah terapi tunggal untuk LMK dan dapat ditoleransi dengan baik oleh ibu dan janin. Selain itu hal ini dapat merupakan alternatif terapi jangka pendek untuk pasien hamil mendekati akhir trimester satu.(13) 5. Transplantasi sumsum tulang (stem cell transplantation) Transplantasi sumsum tulang masih menjadi terapi pilihan yang penting bagi pasien LMK, utamanya usia muda yang gagal diterapi dengan imatinib. Masih belum ditemukan laporan tentang transplantasi sumsum tulang pada kehamilan dan efek samping dari terapi ini pada kehamilan.Ini masih merupakan kontra indikasi selama kehamilan.(13) 4.7 Prognosis Menilai faktor prognosis saat diagnosis perlu dilakukan.Yang terpenting adalah identifikasi dari stadium atau fase penyakit, namun pada fase kronik awal informasi prognosis yang penting didapat dari gambaran klinik dan laboratoris (terlihat pada table skor prognosis menurut Sokal atau Hasford).Sistem skor ini membedakan antara pasien dengan resiko rendah, intermediet, dan resiko tinggi.Perubahan sitogenetik seperti delesi kromosom 9 juga mempengaruhi prognosis, namun lokasi dari delesi juga menjadi perhatian. Selain itu tingkat dan waktu dari hematologi, sitogenetik, dan respon molekuler berguna sebagai informasi prognosis.(16) Gambar 4.8 Skor prognosis menurut Sokal dan Hasford(16) BAB V PERMASALAHAN Beberapa permasalahan pada kasus leukemia mieloid kronik dalam kehamilan ini antara lain : 5.1 Masalah Diagnosis Leukemia Mieloid Kronik dalam Kehamilan. 5.2 Masalah Pengaruh Kehamilan terhadap Leukemia Mieloid Kronik. 5.3 Masalah Pengaruh Leukemia Mieloid Kronik terhadap Kehamilan. 5.4 Masalah Penatalaksanaan Leukemia Mieloid Kronik dalam Kehamilan. 5.5 Masalah Pengaruh Tirosin Kinase Inhibitor pada Reproduksi dan Kehamilan. 5.5.1 Pengaruh pada fertilitas. 5.5.2 Pengaruh pada konsepsi dan kehamilan. 5.5.3 Pengaruh pada persalinan. 5.5.4 Pengaruh pada post partum. 5.5.5 Pengaruh pada perkembangan bayi baru lahir dan anak. 5.6 Masalah Perencanaan Kehamilan pada Pasien Leukemia Mieloid Kronik dalam Terapi dengan Tirosin Kinase Inhibitor. 5.6.1 Kehamilan yang tidak direncanakan. 5.6.2 Kehamilan yang direncanakan. 5.6.3 Kehamilan pada fase lanjut. 5.7 Masalah Prognosis. 5.8 Masalah Obstetri Sosial dan Aspek Psikososial. BAB VI PEMBAHASAN 6.1 Masalah Diagnosis Leukemia Mieloid Kronik dalam Kehamilan Gejala yang ditemukan pada LMK seringkali non spesifik dan banyak diantaranya seperti lelah, lemah, sesak, dan badan lemas merupakan keluhan umum dalam kehamilan yang sering menutupi gejala penyakit itu sendiri.Namun gejala paling umum dari LMK, muncul pada 90% kasus adalah splenomegali.Tanda dan gejala granulositopenia atau trombositopenia tidak selalu muncul dan biasanya menunjukkan transformasi kedalan fase akselerasi atau fase blast. Meningkatnya jumlah leukosit dan anemia, sering didapatkan saat diagnosis.(3) Pada laporan kasus ini, diagnosis sudah ditegakkan sebelum terjadinya kehamilan dengan analisa PCR, direncanakan biopsi sumsum tulang namun pasien menolak. Dan pemeriksaan PCR monitoring lanjutan belum dikerjakan, monitoring dilakukan lewat pemeriksaan serial darah lengkap tiap dua minggu, didapatkan remisi hematologi, namun profil sitogenetik tidak diketahui. Dan apakah kehamilan mempengaruhi terjadinya remisi pada pasien, belumlah jelas. 6.2 Masalah Pengaruh Kehamilan terhadap Leukemia Mieloid Kronik Pasien LMK memiliki resiko trombosis lebih rendah dibandingkan penyakit mieloproliferatif lainnya seperti polisitemia vera dan trombositopenia esensial. Walaupun kehamilan normal adalah keadaan hiperkoagulasi dengan berbagai mekanisme, perubahan pada faktor pembekuan (seperti level fibrinogen, faktor VII dan VIII) dan inhibitor koagulasi (seperti protein S).Aktivitas fibrinolitik berkurang selama kehamilan dan persalinan, dan kembali normal segera setelah plasenta lahir.Pengaruh kehamilan pada sistem koagulasi ini muncul sejak bulan ketiga gestasi. Resiko trombosis selama kehamilan adalah 0,1%, dan pada segera setelah post partum resikonya 0,2-0,4%. Namun ditemukan bukti bahwa leukosit memiliki beragam interaksi dengan platelet dan dinding pembuluh darah, dan kemungkinan mempunyai peran dalam patogenesis tombosis.Walaupun estrogen dianggap memiliki peran dalam proliferasi sel leukemia dan reseptor estrogen telah ditemukan dalam sel leukemia.Kehamilan sendiri dianggap tidak mempunyai efek merugikan pada perjalanan LMK.Median ketahanan hidup pada wanita dengan LMK yang hamil selama perjalanan penyakitnya tidak berbeda signifikan dari harapan hidup pasien LMK tidak hamil.(3,17) Walaupun pengaruh kehamilan terhadap proses kelainan hematologi ini terus diperdebatkan, tapi tidak didapatkan data jelas yang mendukung hipotesis. Perjalanan penyakit tidak terpengaruh oleh kehamilan pada sebagian besar kasus. 6.3. Masalah Pengaruh Leukemia Mieloid Kronik terhadap Kehamilan LMK terutama yang tidak terkontrol, dapat berakibat pada insufisiensi plasenta, dan meningkatkan resiko prematuritas dan mortalitas. Efek potensial dari hiperleukositosis, dan kadang trombositosis terhadap perjalanan kehamilan dan perkembangan janin menjadikan intervensi terapi diperlukan.(17) Pengaruh terbanyak pada kehamilan dan janin terbanyak disebabkan karena pemberian kemoterapi selama kehamilan, hal ini akan dibahas selanjutnya. 6.4 Masalah Penatalaksanaan Leukemia Mieloid Kronik dalam Kehamilan Kemoterapi selama kehamilan dapat memberi efek buruk pada janin, bayi baru lahir, dan ibu sendiri.Efek merugikan pada janin dan bayi baru lahir termasuk malformasi, teratogenesis, mutasi, karsinogenesis, toksisitas organ, dan perkembangan neurologi abnormal.Efek merugikan pada ibu termasuk keguguran spontan dan potensi infertilitas.Sebenarnya semua agen kemoterapi dapat melewati plasenta.Toksisitas pada janin tergantung pada waktu terapi berhubungan dengan fase dari perkembangan janin. Pada masa pre-embrionik (konsepsi sampai 17 hari setelah konsepsi), sel-sel dari konsepsi membelah dengan cepat, jika sebagian besar sel terpengaruh dapat terjadi abortus spontan, namun ketika keseimbangan regulasi sel masih dapat menggantikan sel yang rusak, mungkin tidak terjadi efek jangka panjang. Pada fase embrionik (3-8 minggu setelah konsepsi), sel berdiferensiasi dan membentuk sistem organ.Kerusakan pada fase ini dapat berakibat pada efek permanen dari organ terkait.Pada fase fetal (dari 8 minggu setelah konsepsi), pertumbuhan dan maturasi berlanjut.Korteks serebral, traktus gastrointestinal, glomerolus ginjal berlanjut untuk berdiferensiasi dan tetap rentan terhadap efek kemoterapi.Pada percobaan hewan, ditemukan semua obat kemoterapi telah dihubungkan dengan malformasi kongenital.Dosis pada manusia sebenarnya lebih rendah.Hal ini menyulitkan mengambil perbandingan dengan percobaan hewan.Kemoterapi pada trimester satu meningkatkan resiko abortus spontan dan kematian fetus, dan dihubungkan dengan 10-20% resiko malformasi.Resiko ini menurun ketika dipakai agen tunggal kemoterapi. Paparan pada trimester dua dan tiga dihubungkan dengan resiko pertumbuhan janin terhambat, kematian janin, persalinan preterm, dan berat lahir rendah, namun data tidak menunjukkan peningkatan resiko malformasi kongenital. Dengan adanya data diatas maka perlu untuk menunda kemoterapi sampai trimester kedua setelah organogenesis kecuali penundaan memperburuk keadaan ibu.Seringkali penundaan terapi tidak selalu menjadi pilihan, dan ibu dapat diberikan konseling untuk terminasi kehamilan.Kehamilan dapat menurunkan metabolisme obat sampai meningkatkan volume plasma, albumin menurun, meningkatkan metabolisme hepatik, klirens ginjal, motilitas lambung, dan amnion dapat menjadi ruang ketiga. Walaupun studi tentang penyesuaian dosis pada kehamilan masih sedikit, sebaiknya digunakan dosis standar yang telah diketahui.(8) 6.5 Masalah Pengaruh Tirosin Kinase Inhibitor pada Reproduksi dan Kehamilan 6.5.1 Pengaruh pada fertilitas Data dari penelitian dengan hewan, berkaitan dengan efek TKI pada fungsi ovarium masih sedikit.Pada tikus betina yang diberikan imatinib selama 14 hari sebelum perkawinan sampai hari keenam gestasi, fertilitas tidak terpengaruh. Tikus yang diberikan dosis lebih dari sama 45mg/kg mengalami keguguran, serta kematian dini bayinya antara post partum hari 0 sampai 4. Jika diberikan selama organogenesis pada dosis lebih dari sama 100 mg/kg mengakibatkan efek teratogenik seperti exencephaly atau encephalocele, tidak adanya tulang frontal atau parietal. Dosis lebih tinggi dari 100 mg/kg didapatkan kematian janin pada hampir semua hewan percobaan. Kematian janin tidak didapatkan pada dosis kurang dari sama 30 mg/kg (kurang lebih setara dengan dosis harian 300 mg). Pada penelitian oleh Melo dan Gosden, tikus betina diberikan imatinib 150 mg/kg per oral selama dua bulan.Ovarium diteliti mengenai perbedaan morfologi dan perubahan pada jumlah folikel di semua tahap perkembangan (primordial, primer, sekunder, dan tersier). Tidak ada perbedaan dari pengamatan antara kelompok imatinib dan kontrol dan sebagai tambahan tidak ada peningkatan dari folikel atresia pada kelompok imatinib, jadi disimpulkan tidak ada efek pada fertilitas.(18) Pada manusia berdasarkan publikasi terbaru dilaporkan adanya kegagalan ovarium prematur pada wanita usia 30 tahun yang meminum imatinib sejak dua tahun. Walau laporan ini belum ditelaah lebih lanjut, namun dianjurkan pada wanita usia reproduksi yang memiliki suami untuk dilakukan kriopreservasi embrio sebelum terapi. Bagi yang tidak memiliki pasangan perlu didiskusikan untuk pengambilan oosit untuk simpan beku oosit.(18) Pada laporan kasus ini, walaupun pasien sebelumnya mengalami periode amenorea, namun kehamilan dapat terjadi sehingga dapat diambil kesimpulan pada kasus ini fertilitasnya tidak terpengaruh. 6.5.2 Pengaruh pada konsepsi dan kehamilan Berbagai literatur menyebutkan banyak laporan kasus luaran kehamilan pada wanita yang diterapi imatinib saat konsepsi, tapi kemudian berhenti, ataupun yang tetap meneruskan terapi selama hamil, dan hampir semua dilaporkan mendapatkan luaran yang baik.Yang terbaru, data luaran lengkap dilaporkan pada 125 wanita dari total 180 orang yang diterapi imatinib. Mayoritas dari wanita ini (70%) meminum imatinib hanya pada trimester satu tapi 26% tetap dalam terapi selama kehamilan, sampai terjadi abortus spontan atau medisinalis, atau sampai kelahiran. 63 dari 125 kehamilan mendapatkan bayi hidup tanpa kelainan, dimana 18 wanita tetap mendapat imatinib selama hamil. 35 wanita (28%) menjalani terminasi elektif, tiga diantaranya setelah diketahui adanya kelainan janin. 18 kehamilan (14,4%) berakhir dengan abortus spontan, dari sisa sembilan bayi, delapan lahir hidup dan satu lahir mati dengan kelainan kongenital. Dari total 12 kehamilan yang didapatkan kelainan pada bayi, data dosis tapi tanpa data durasi terapi imatinib yang diketahui, namun tidak cukup data untuk mengetahui hubungan antara dosis kumulatif dan adanya kelainan janin.Tidak ada laporan paparan terhadap alkohol, rokok, atau obat selama hamil, dan tidak ada yang mendapat kemoterapi dosis tinggi menjelang kehamilan. Walaupun kebanyakan data ini didapatkan dari laporan kasus dan berpotensi bias namun masih dapat dipercaya sebagai data efek imatinib pada kehamilan. Informasi ini dianggap cukup untuk menganjurkan pada pasien wanita menghindari konsepsi dan kehamilan selama terapi imatinib.(18) Pada laporan kasus ini, walaupun pasien telah mendapat terapi imatinib sejak sebelum konsepsi sampai dengan umur kehamilan 23 minggu, tapi selama ANC dan monitoring dengan USG tidak didapatkan ancaman keguguran ataupun kelainan mayor pada bayi. 6.5.3 Pengaruh pada persalinan Walaupun pemberian kemoterapi pada trimester dua dan tiga telah diterima dan dianggap menimbulkan lebih sedikit komplikasi pada janin.Namun, perhatian hendaknya diberikan bila kemoterapi menjelang persalinan.Idealnya pasien harus pulih dari efek samping kemoterapi yang bisa menyebabkan pansitopenia sebelum persalinan.Jika leukemia didiagnosis pada kehamilan lanjut maka terminasi lebih dini perlu dipertimbangkan dengan pemberian terapi suportif seperti tranfusi produk darah dan penundaan kemoterapi, mengingat adanya resiko perdarahan karena anemia ataupun trombositopenia. Persalinan pervaginam bukan merupakan kontraindikasi.(19) Pada pasien dalam laporan kasus ini, pasien datang dalam keadaan belum inpartu, kemudian memasuki fase aktif dan persalinan terjadi secara pervaginam tanpa ditemukan komplikasi selama dan sesudah partus. 6.5.4 Pengaruh pada post partum Imatinib dan metabolitnya diekskresi banyak pada air susu tikus betina yang diberikan 100 mg/kg perhari. Konsentrasi di air susu lebih kurang tiga kali lebih tinggi dari konsentrasi plasma. Diperkirakan sekitar 1,5% dosis maternal diekskresi ke air susu, yang setara dosis pada bayi dari 30% dosis maternal per kilogram berat badan. Selanjutnya kandungan imatinib telah diukur dalam air susu wanita yang meminum imatinib post partum. Dua dari tiga laporan telah mengidentifikasi ekskresi substansial dari imatinib dalam air susu, dan pada satu laporan didapatkan akumulasi kandungan dari metabolit aktif N-DesM-IM sekitar tiga kali lipat pada air susu dibandingkan di plasma. Jadi mengingat adanya potensi efek samping yang serius pada bayi, maka menyusui tidak dianjurkan.(18) Pasien kami pada periode post partum dan masa nifas tidak mengalami penyulit yang berarti. Karena pertimbangan terapi Imatinib telah dihentikan sejak trimester dua maka pasien diperbolehkan menyusui. 6.5.5 Pengaruh pada perkembangan bayi baru lahir dan anak. Fakta bahwa sistem saraf pusat terus berkembang selama kehamilan menjadi alasan kekhawatiran berhubungan dengan luaran perkembangan neurologi jangka panjang pada anak-anak yang terpapar kemoterapi intra uterin pada terapi berbagai keganasan, termasuk leukemia. Keganasan pada anak dan infertilitas masa mendatang adalah kekhawatiran lain pada anak-anak ini. Data mengenai isu ini masih terbatas karena jarangnya kasus kehamilan dengan leukemia dan kesulitan dalam pengawasan jangka panjang. Monitoring jangka panjang ( sampai umur 6-29 tahun, rata-rata 18,7 tahun) pada 84 anak yang lahir dari ibu dengan keganasan hematologi, termasuk 29 pasien leukemia akut, telah melaporkan perkembangan neurologi dan psikologi yang normal. Studi ini dapat sebagian menjawab isu reproduksi yaitu semua keturunan menunjukkan perkembangan seksual normal dan 12 diantaranya telah menjadi orang tua dari anak yang berkembang normal.Akhirnya tidak didapatkan peningkatan resiko nyata dari subjek dengan populasi umum. Laporan ini didukung oleh review dari 111 kasus anak yang lahir dari ibu menderita berbagai keganasan yang mendapat kemoterapi selama hamil. Anak-anak ini, yang diikuti untuk periode waktu yang berbeda-beda (1 sampai 19 tahun) mempunyai perkembangan neurologi normal berdasarkan gambaran perkembangan umum dan tes kognitif. Jadi dapat diambil kesimpulan, walaupun berdasarkan pada data-data yang masih sedikit, bahwa kemoterapi tidak mengakibatkan akibat merugikan pada perkembangan neurologi, fertilitas, atau resiko keganasan pada masa mendatang.(13) Pada laporan kasus ini didapatkan luaran bayi aterm, dengan berat lahir normal, bayi lahir tanpa asfiksia.Pada pemantauan sampai dengan satu tahun pada bayi tidak didapatkan gangguan pertumbuhan maupun perkembangan neurologi, pemantauan lebih lanjut masih diperlukan. 6.6 Masalah Perencanaan Kehamilan pada Pasien Leukemia Mieloid Kronik dalam Terapi dengan Tirosin Kinase Inhibitor 6.6.1 Kehamilan yang tidak direncanakan Dalam kasus kehamilan yang tidak direncanakan saat dalam terapi imatinib, mempertimbangkan resiko pada janin bila obat dilanjutkan dibandingkan resiko pada ibu bila pengobatan dihentikan atau ditunda masih menjadi pilihan sulit.Dari pandangan janin imatinib seharusnya dihentikan mengingat resiko potensial adanya kelainan perkembangan janin, tapi dari pandangan maternal hal ini bertentangan. Pilihan lain adalah melanjutkan imatinib dan kehamilan dimonitor ketat, mengingat keputusan terminasi dikerjakan bila didapatkan kelainan janin. Pada keadaan ini orang tua hendaknya waspada terhadap terhadap resiko akibat paparan yang terjadi pada trimester pertama. Pertimbangan termasuk keinginan pasien, status penyakit ibu, respon awal terhadap imatinib, ketersediaan terapi alternatif yang sesuai, dan kemampuan menimbulkan lagi respon imatinib setelah dihentikan dalam periode tertentu.(18) 6.6.2 Kehamilan yang direncanakan Nasehat yang diberikan pada wanita yang ingin hamil setelah diagnosis dan terapi awal dari penyakitnya mungkin berbeda-beda tergantung respon terhadap terapi.Adanya hubungan kelainan kongenital dengan dengan paparan imatinib di trimester pertama, obat hendaknya tidak dilanjutkan sebelum mulai hubungan seksual tanpa kontrasepsi.Terdapat kontroversi tentang lama waktu antara penghentian terapi dan hubungan seksual tanpa kontrasepsi namun sepertinya cukup beralasan untuk menganjurkan beberapa hari agar kandungan obat telah dikeluarkan tubuh.Pada pasien dengan respon yang optimal, termasuk remisi molekuler lengkap, pasien dapat langsung menghentikan terapi untuk memungkinkan bila terjadi konsepsi.Mengingat pasien tidak minum imatinib selama kehamilannya, maka dianjurkan agar periode berhenti minum obat sampai menjadi hamil tidak melebihi enam bulan.Pasien dengan respon terapi yang baik sepertinya tidak memerlukan terapi sampai setelah persalinan, walaupun monitoring dengan RT-PCR hendaknya dikerjakan. Bila respon terhadap TKI kurang baik, maka penundaan terapi dapat menyebabkan relaps baik sitogenetik dan hematologik.(18) Ault dan kawan-kawan melaporkan 10 wanita yang menghentikan terapi imatinib karena kehamilan. Sembilan orang mengalami respon hematologi yang lengkap ketika imatinib dihentikan, enam mengalami peningkatan metafase Ph-positif dan lima tidak lagi menunjukkan respon hematologi lengkap. Pada median 18 bulan sejak sembilan wanita ini memulai lagi terapinya, semuanya didapatkan respon hematologi lengkap, walaupun hanya tiga yang didapatkan respon sitogenetik lengkap.Data yang lebih melegakan didapatkan dari laporan Rousselot dan kawankawan.Imatinib dihentikan pada 12 pasien yang telah mengalami respon molekuler lengkap dalam periode sedikitnya dua tahun. Enam menunjukkan relaps molekuler dalam lima bulan sejak obat dihentikan, dan enam lainnya tetap dalam remisi lengkap pada monitoring 18 bulan. Dari mereka yang relaps, mayoritas mendapatkan kembali respon molekuler lengkap dalam periode relatif singkat setelah terapi dimulai kembali.(18) 6.6.3 Kehamilan pada fase lanjut Hal ini biasanya kehamilan tidak terencana dan penanganannya sangat sulit dan bermasalah.Data yang berhubungan banyak didapatkan pada pasien yang menderita leukemia akut selama kehamilan.Dalam usaha untuk memberi pasien kesempatan mendapatkan remisi (atau dalam kasus LMK, fase kronik yang kedua), perawatan harus dikerjakan dengan tepat dan pemilihan waktu terminasi yang sesuai.Kebanyakan pasien pada fase lanjut telah sebelumnya mendapat imatinib.Jika kehamilan di trimester satu saat diagnosis, menunda terapi sampai setelah persalinan bukan merupakan pilihan.Kemoterapi pada trimester pertama membawa resiko tinggi terhadap kelainan kongenital, sekitar 10-23% pada studi pasien leukemia akut.Resiko yang bisa terjadi harus dijelaskan pada ibu, dan pasien harus menyadari konsekuensi pada kesehatannya sendiri bila menunda terapi, pada situasi ini kebanyakan wanita memilih menghentikan kehamilannya.Pemberian kemoterapi pada trimester dua dan tiga telah diterima dan dianggap menimbulkan lebih sedikit komplikasi pada janin.(18) 6.7 Masalah Prognosis Ketahanan hidup (survival) wanita hamil dengan leukemia mieloid akut maupun kronik, telah bertambah dengan adanya kemoterapi modern dan perawatan intensif. Angka remisi 70-75% dan median ketahanan hidup meningkat 6-12 bulan telah dilaporkan pada literatur dan tidak memiliki perbedaan bermakna antara wanita hamil dan tidak hamil.(20) 6.8 Masalah Obstetri Sosial dan Aspek Psikososial Sebagai seorang calon ibu, adanya kanker dalam kehamilan seperti LMK adalah sebuah pengalaman yang dramatis ketika dua kenyataan yang bertentangan bertemu, yaitu proses terbentuknya kehidupan dan proses menghancurkan kehidupan. Bersamaan dengan keadaan bahagia dan penuh harapan, datang pukulan besar bersama dengan kekhawatiran akan kematian. Dengan berbagai pertimbangan medis, psikologis, religius, sosial, dan standar moral yang melanda baik pasien maupun dokter akan terjadi pergulatan untuk mencari solusi terbaik untuk menemukan kombinasi terbaik demi keuntungan pasien yang maksimal dan kerugian janin yang minimal. Kadangkala, ini sulit didapatkan.Kehamilan bisa saja diakhiri, terutama pada trimester satu, atau ibu dapat memilih opsi menunda obat anti kanker sampai saat persalinan dengan resiko peningkatan biaya dan resiko pada kesehatannya sendiri. Penanganan multidisiplin meliputi onkologis, obstetrikus, ahli bedah, neonatologis, ahli genetika, perawat, psikiater, psikologis, dan pekerja sosial hendaknya merangkul pasien dan keluarganya, mengetahui keadaan intelektual dan psikologis serta kebutuhan mereka, memberi informasi cukup, dan mendampingi mereka selama proses pengambilan keputusan dan selama terapi. Beberapa pendekatan bersifat individual dan menghormati pilihan dan keinginan pasien. Keputusan akhir yang dicapai hendaknya sebuah gabungan dari pemahaman akan proses penyakit dan pilihan terapinya, saran medis, pengakuan akan nilai personal dan kepercayaan, menenangkan konflik yang terjadi pada keluarga, dan kesadaran terhadap dukungan yang tersedia.(21) Berdasarkan pada keputusan yang diambil, pasien hamil dapat diliputi oleh perasaan takut, depresi, kehilangan harapan, kemarahan, rasa bersalah, dan malu.Terkejut, marah, penolakan, dan penerimaan adalah tahap yang biasanya terjadi dimana pasien bisa ada di tahap mana saja.Dukungan psikososial dari berbagai disiplin ilmu harus bermuara pada keterlibatan aktif dari pasien dan keluarga pada pengobatannya. Berubahnya cara hidup, serta komunikasi yang lebih baik antara pasien dan lingkungannya. Mengurangi perasaan bersalah dan memfasilitasi perubahan emosi juga bermanfaat. Berbagai program intervensi psikososial hendaknya menyebar tidak hanya di rumah sakit, tapi berbagai tempat seperti lingkungan kerja, rumah tangga, dan masyarakat.(21) BAB VII KESIMPULAN DAN SARAN 7.1 Kesimpulan Seorang wanita usia 32 tahun, suku Bali, agama Hindu, pekerjaan petani anggrek. Keluhan awal perut membesar, pemeriksaan fisik didapatkan splenomegali (Scuffner VI-VII), pemeriksaan penunjang didapatkan dengan leukositosis, blood smear kesan LMK. Diagnostik molekuler PCR Leukemia (bcr-abl) : tampak fusi gene bcr abl b3a2 pada amplicon product 385 bp menghasilkan ekspresi protein p210.Didiagnosa dengan leukemia mieloid kronik, kromosom Ph positif.Terapi Gleevec sejak September 2011 dosis 1x400 mg. Setelah terapi dalam pemantauan terjadi remisi hematologik. Datang ke Poliklinik Kebidanan dan Kandungan, didapatkan dengan hamil G3P2002 23-24 minggu, tunggal/hidup, riwayat LMK dalam terapi tirosin kinase inhibitor (Gleevec). Selama kehamilan trimester kedua sampai partus terapi Gleevec ditunda dengan monitoring pemeriksaan darah lengkap tiap dua minggu.Selama ANC tidak didapatkan keluhan, pemantauan laboratorium, monitoring janin dengan USG tidak didapatkan kelainan dengan pertumbuhan janin dalam batas normal.Kehamilan mencapai aterm.Datang ke IRD dengan diagnosa G3P2002 39-40 mg, tunggal/hidup, CML, KPD. Dalam observasi pasien inpartu, persalinan spontan pervaginam dengan lahir bayi laki-laki, 3600 gram, AS 8-9, tanpa kelainan. Masa nifas tidak didapatkan masalah, pasien menyusui bayinya. Sampai umur anak satu tahun pertumbuhan dan perkembangan anak dalam batas normal. Enam bulan setelah partus didapatkan kembali leukositosis, dengan WBC terakhir pada bulan Mei 2013 37,82. Pasien direncanakan melanjutkan kembali terapi tirosin kinase inhibitor. Yang menarik dari kasus ini adalah selama kehamilan didapatkan remisi hematologik, walaupun remisi secara sitogenetik tidak dapat diketahui karena kendala alat dan biaya.Janin yang terpapar kemoterapi selama trimester satu, mengalami perkembangan normal dan lahir tanpa kelainan. 7.2 Saran Kehamilan dengan leukemia mieloid kronik merupakan kasus yang sangat jarang terjadi.Diagnosa pasti dan pengobatan masih membutuhkan biaya yang mahal.Keberhasilan pengobatan bergantung pada kepatuhan pasien, keteraturan terapi, dan monitoring berkala sampai terjadi remisi baik hematologik dan sitogenetik.Sebaiknya pada wanita dengan LMK yang merencanakan hamil diberikan konseling yang adekuat tentang resiko-resiko pada bayi dan juga ibu sendiri. Pada yang terlanjur hamil dianjurkan penghentian kemoterapi dengan monitoring ketat, terminasi dapat dikerjakan bila didapatkan kelainan pada janin.Idealnya selama terapi wanita disarankan memakai kontrasepsi yang adekuat.Untuk meningkatkan pelayanan disarankan melengkapi alat penunjang diagnostik seperti RT-PCR serta penyediaan obat dengan biaya yang terjangkau.Kerjasama yang baik sangat diperlukan antara dokter ahli kebidanan, dokter ahli penyakit dalam khususnya hemato onkologi, dokter anak, dokter patologi klinik, dan pihak-pihak terkait dalam perawatan pasien hamil dengan LMK. DAFTAR PUSTAKA 1. Skoumalova, I., Vondrakova, J., Rohon, P., Rozmanova, S., Jarosova, M., Indrak, K., Prochazka, M., Santava, A., Faber, E. Successful Childbirth in a Patient with Chronic Myelogenous Leukemia Treated with Imatinib Mesylate during Early Pregnancy. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub, 2008, 152, (1), pp.121-123. 2. Brenner, B., Avivi, I., Lishner, M. Haematological Cancers in Pregnancy. Lancet, 2012, 379, pp.580-87. 3. Hurley, T.J., McKinnell, J.V., Irani, M.S. Hematologic Malignancies in Pregnancy. Obstet Gynecol Clin N Am, 2005, 32, pp. 595-614. 4. Sukrawan, G., Adnyana, W.L., Suega, K. Seorang Penderita Hamil dengan Leukemia Mieloid Akut. J Peny Dalam, 2011, 12, pp.134-141. 5. Vandenbriele, C., Dierickx, D., Amant, F., Delforge, M. The Treatment of Hematologic Malignancies in Pregnacy. F, V & V in Obgyn, 2010, 2 (2), pp.74-87 6. Bakta, I.M., Hematologi Klinik Ringkas. Jakarta: EGC, 2007. 7. Clarkson, B., Strife, A., Wisniewski, D., Lambek, C.L., Liu, C. Chronic Myelogenous Leukemia as a Paradigm of Early Cancer and Possible Curative Strategies. Leukemia, 2003, 17, pp.1211-1262. 8. El-Hemaidi, I., Robinson, S.E. Management of Haematological Malignancy in Pregnancy. Best Practice & Research Clinical Hematology, 2012, 26, pp.149160. 9. Goldman, J.M., Gordon, M.Y. A History of the Chronic Leukemias. In: Wiernik, P.H., Goldman, J.M., Dutcher, J.P., Kyle, R.A. Neoplastic Disease of the Blood, Fourth Ed. London: Cambridge University Press, 2009. p.3-8 10. Cartwright, R. Epidemiology of the Chronic Leukemias. In: Wiernik, P.H., Goldman, J.M., Dutcher, J.P., Kyle, R.A. Neoplastic Disease of the Blood, Fourth Ed. London: Cambridge University Press, 2009. 11. Garcia-Manero, G., Faderl, S., O’Brien, S., Cortes, J., Talpaz, M., Kantarjian, H.M. Chronic Myelogeous Leukemia: A Review and Update of Therapeutic Strategies. American Cancer Society, 2003, 98 (3), pp.437-457. 12. Kim, D.W., Banavali, S.D., Bunworasate, U., Goh, Y.T., Ganly, P., Huang, H., Irving, I., Jootar, S., Goh, H.G., Koh, L.P., Li, W., Naoe, T., Ng, S.C., Purushotaman, V., Reksodiputro, H., Shih, L.Y., Tang, J.L., Tojo, A., Wang, J., Wong, R. Chronic Myeloid Leukemia in the Asia-Pacific Region: Current Practice, Challenges and Opportunities in the Targeted Therapy Era. Leukemia Research, 2010, 34, pp.1459-1471. 13. Kantarjian, H.M., Deisseroth, A., Kurzrock, R., Estrov, Z., Talpaz, M. Chronic Myelogenous Leukemia: A Concise Update. Blood, 1993, 82 (3), pp 691-703. 14. John, B. Hematological and Molecular Response Evaluation of Patients with Chronic Myeloid Leukemia on Treatment with Imatinib. Dissertation. Bangalore: Department of general medicine St John’s Medical College and Hospital, 2010. 15. Shapira, T., Pereg, D., Lishner, M. How I Treat Acute and Chronic Leukemia in Pregnancy. Blood Reviews, 2008, 22, pp.247-259. 16. Hehlmann, R., Hochhaus, A., Baccarani, M. Chronic Myeloid Leukaemia. Lancet, 2007, 370, pp.342-50 17. Griesshammer, M., Bergmann, L., Pearson, T. Fertility, Pregnancy and the Management of Myeloproliferative Disorders. Bailliere’s Clinical Haematology, 1998, II (4), pp.859-874. 18. Apperley, J. CML in Pregnancy and Childhood. Best Practice & Research Clinical Hematology, 2009, 22, pp.455-474. 19. Ali, R., Ozkalemkas, F., Ozcelik, T., Ozkocaman, V., Ozan, U., Kimya, Y., Koksal, N., Gulten, T., Yakut, T., Tunali, A. Pregnancy under Treatment of Imatinib and Successful Labor in a Patient with Chronic Myelogenous Leukemia (CML), Outcome of Discontinuation of Imatinib Therapy after Achieving a Molecular Remission. Leukemia Research, 2005, 29, pp.971-973. 20. Klamova, H., Markova, M., Moravcova, J., Siskova, M., Cetkovsky, P., Polakova, K.M. Response to Treatment in Women with Chronic Myeloid Leukemia during Pregnancy and after Delivery. Leukemia Research, 2009, 33, pp.1567-1569. 21. Pentheroudakis, G., Pavlidis, N. Cancer and Pregnancy: Poena Magna, not Anymore. European journal of Cancer, 2006, 42, pp. 126-140.