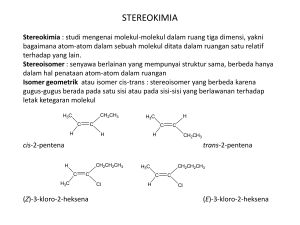
STEREOKIMIA
advertisement

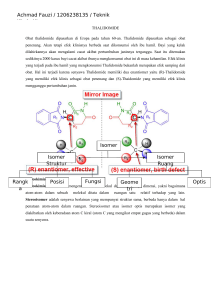
STEREOKIMIA Enantiomer dan Karbon Tetrahedral Gambaran karbon tetrahedral dan pencerminannya Molekul bayangan cermin yang tidak dapat dihimpitkan disebut enantiomer (dalam bahasa Yunani enantio berarti berlawanan/opposite). Superimposed dari asam laktat Kiralitas • Jika suatu molekul tidak dapat dihimpitkan dengan bayangan cerminnya berarti kedua senyawa enantiomer disebut kiral/chiral (ky-ral dalam bahasa Yunani cheir, berarti “tangan”). • Molekul yang mempunyai sisi simetri dalam berbagai kemungkinan dalam konformasinya identik dengan bayangan merupakan senyawa nonkiral atau biasa disebut akiral. • Penyebab adanya kiralitas pada suatu senyawa dikarenakan adanya atom karbon yang mengikat 4 gugus berbeda. Atom karbon tersebut diistilahkan sebagai pusat kiralitas (chirality centers). Aktivitas Optikal • Studi mengenai stereokimia diawali pada abad XIX oleh ilmuwan Prancis, Jean Batiste Biot. • Biot menemukan sifat alami cahaya terpolarisasi bidang (planepolarized light). • Ketika sebuah berkas cahaya melewati polarizer, hanya gelombang terosilasi pada sebuah bidang yang dapat melewatinya sehingga dinamakan cahaya terpolarisasi bidang. • Ternyata beberapa molekul optik aktif dapat memutar bidang polarisasi. • Molekul optik aktif yang memutar bidang polarisasi ke kanan (clockwise) disebut dekstrorotatori (dextrorotatory) atau diberi notasi (+). • Sebaliknya, bila molekul optis aktif memutar bidang polarisasi ke kiri (counterclockwise) dikatakan levorotatori atau diberi notasi negetif (-). Aturan Konfigurasi Spesifik • Aturan Cahn Ingold Prelog : 1. Urutkan prioritas berdasarkan nomor atom substituen 2. Jika (1) tdk bisa, maka urutkan prioritas berdasarkan nomor atom kedua substituen 3. Multibonding atom adl sama dg atom ikatan tunggal 4. Urutkan prioritas dan lihat arah perputarannya • R = rectus = bila arah perputaran ke kanan atau searah jarum jam • S = sinister = bila arah perputaran ke kiri atau berlawanan arah jarum jam Diastereomer Pasangan diastereomer asam 2-amino-3-hidroksibutanoat Diastereomer adalah stereoisomer yang bukan bayangan Cerminnya, contoh : 2R,3R dg 2R,3S • Diastereomer kiral mempunyai konfigurasi yang berlawanan pada beberapa pusat kiral namun mempunyai konfigurasi yang sama dengan yang lainnya. • Sebagai pembandingnya, enantiomer yang mempunyai konfigurasi berlawanan pada semua pusat kiral. Senyawa Meso • Senyawa akiral yang mememiliki 2 pusat kiral Pusat kiral Bayangan Cermin Molekul yg memiliki > 2 pusat kiral • Sebuah pusat kiral dlm satu molekul akan memberikan 2 stereoisomer atau sepasang enantiomer • Dua pusat kiral akan memberikan maksimal 4 stereoisomer atau 2 pasang enantiomer • Secara umum, sebuah molekul dengan n pusat kiral mempunyai maksimum 2n stereoisomer atau 2n-1 pasang enantiomer, walaupun mungkin bisa kurang karena mungkin beberapa stereoisomer adalah senyawa meso Kolesterol memungkinkan memiliki 28 = 256 stereoisomer Sifat Fisika Stereoisomer Campuran Rasemat • Campuran rasemat adalah campuran yang terdiri jumlah yang sama enantiomer (+) dan (-) dari substansi kiral. • Campuran rasemat menunjukkan zero optical rotation karena rotasi (+) dari satu enantiomer dilawan oleh rotasi (-) dari enantiomer yang lain Review Stereoisomerisme Kiralitas selain pada atom karbon Kiralitas Senyawa Alam Prokiralitas • Molekul akiral yang dapat diubah menjadi molekul kiral dengan reaksi kimia sederhana. • Contohnya adalah 2-butanon merupakan prokiral karena dapat diubah menjadi kiral alkohol 2-butanol dengan adisi hidrogen Isomer geometrik Alkena • Diakibatkan oleh ketegaran (rigidity) dalam molekul • Hanya ditemui pada senyawa alkena dan siklik • Atom dan gugus yang terikat pada ikatan sigma dapat berotasi bentuk keseluruhan molekul selalu berubah berkesinambungan • Gugus-gugus yang terikat pada ikatan rangkap tidak dapat berputar, untuk berputar butuh energi 68 kkal/mol untuk memutus ikatan pi • Ketegaran (rigidity) ikatan pi inilah maka gugus-gugus yang terikat pada karbon berikatan pi terletak tetap dalam ruang relatif satu sama lain. • Dua gugus atau atom yang terletak pada satu sisi ikatan pi disebut cis (latin : pada sisi yang sama) • Gugus-gugus atau atom-atom yang terletak pada sisisisi yang berlawanan disebut trans (latin : bersebrangan) • Syarat : tiap atom karbon yang terlibat dalam ikatan pi mengikat dua gugus yang berlainan. Aturan penandaan E dan Z • Digunakan bila terdapat 3 atau 4 substituen berbeda pada alkena • Urutan prioritas substituen dibutuhkan untuk penomoran pada substituen • Substituen dengan prioritas yang sama pada sisi-sisi yang sama pada ikatan pi diberi tanda Z (Zusammen, Jerman : bersama-sama) ; bila posisinya bersebrangan pada ikatan pi diberi tanda E (Entgegen, Jerman : bersebrangan) Aturan Chan-Ingold-Prelog • Lihat pada atom yang terikat langsung pada karbon ikatan rangkap lalu urutkan substituen tersebut berdasarkan nomor atomnya. • Jika atom-atom itu adalah isotop satu sama lain, maka isotop dengan nomor massa tinggi memperoleh prioritas Naiknya prioritas • Jika kedua atom itu identik, maka nomor atom (dari) atom-atom berikutnya digunakan untuk memberikan prioritas atau prioritas ditentukan pada titik pertama kali dijumpai perbedaan dalam menyusuri rantai. (E)-3-metil-pentena (Z)-5-butil-8-kloro-4-desena • Atom-atom yang terikat oleh ikatan rangkap atau ikatan rangkap 3 diberi kesetaraan ikatan tunggal. Naiknya prioritas Latihan • Beri nama senyawa di bawah ini dengan sistem (E) dan (Z) :