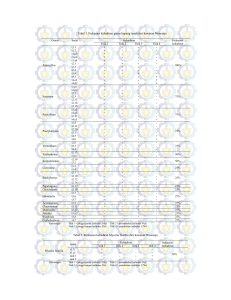
ISOLASI DAN IDENTIFIKASI GLIKOSIDA
advertisement

PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI ISOLASI DAN IDENTIFIKASI GLIKOSIDA SAPONIN PADA HERBA KROKOT ( Portulaca oleracea L. ) SKRIPSI Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.) Program Studi Ilmu Farmasi Oleh : Puspita Ayu Kristianti 028114075 FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA YOGYAKARTA 2007 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI HALAMAN PERSEMBAHAN Tuhanku. . . . . . . . . . Bicaralah padaku bila aku kesepian Bisikkanlah dukungan-Mu bila aku dirudung kecemasan Dengarkanlah suaraku bila aku jatuh Sudilah menjadi bagiku penghiburan dalam perjalanan Tempat bernaung diwaktu panas Tempat berteduh di kala hujan Tongkat penuntun dalam kelelahan Dan penolong dalam bahaya Semoga aku berhasil mencapai tujuanku Sekarang, dan juga nanti pada akhir hidupku Karya ini kupersembahkan untuk ALLAH SWT Bapak dan Ibuku tercinta, ungkapan rasa hormat dan baktiKu Kakakku Andika Almamaterku Aku sudah belajar bahwa prestasi terbesar tidak selalu berupa penghargaan atau hadiah. Prestasi terbesarku tidak berupa materi, melainkan pelajaran berharga tentang semangat manusia. Penghargaan bisa memudar, hadiah bisa kehilangan kilaunya, tapi pelajaran yang kita peroleh akan tinggal untuk selamanya (Leslie Herrel). Every story has an end. But in life, every ending is just the new beginning. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI . PRAKATA Bismillahirrahmanirrahim. Assalammualaikum wr.wb. Puji syukur penulis panjatkan ke hadirat Allah Swt yang telah memberikan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan skripsi dengan judul “ Isolasi dan Identifikasi Glikosida Saponin pada Herba Krokot ( Portulaca oleracea L. ) “ sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi. Penyusunan skripsi ini tidak terlepas dari bantuan dan dukungan dari berbagai pihak. Oleh karena itu, penulis menyampaikan terima kasih kepada : 1. Allah Swt, baik buruk yang Dia berikan adalah yang terbaik, tergantung dari kita yang memilih untuk belajar atau tidak. 2. Ibu Rita Suhadi, M.Si, Apt., selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta. 3. Bapak Yohanes Dwiatmaka, M.Si., selaku dosen pembimbing yang telah memberikan bimbingan, saran, pengarahan, pengetahuan dan kesabaran dalam membimbing selama penelitian dan penulisan skripsi ini. 4. Ibu Erna Tri Wulandari, M.Si, Apt., selaku dosen penguji yang telah bersedia menguji, memberikan saran dan masukan yang sangat berguna dalam penyelesaian skripsi ini. 5. Ibu Christine Patramurti, M.Si, Apt., selaku dosen penguji yang telah bersedia menguji, memberikan saran dan masukan yang sangat berguna dalam penyelesaian skripsi ini. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 6. Bapak dan Ibu ku, atas doa, dukungan, pengorbanan dan kasih sayangnya. Terima kasih sudah mau menjadi kedua sayapku selama ini, tanpa kalian aku tidak mungkin bisa terbang sejauh ini. 7. Sahabat-sahabatku, Lena, Ulin, Elly, Puri, Asti, Leni, terima kasih sudah mau berbagi tawa dan air mata denganku. Terima kasih juga karena selama ini sudah berjalan bersamaku menapaki jalan yang sama. 8. Shinta dan Prima, atas kerjasama dan semangatnya selama penyelesaian skripsi ini. Terima kasih juga karena sudah mau berjuang bersamaku. Akhirnya kita bisa melewati semua ini. 9. Semua teman yang melakukan penelitian di Lab.FF, Christin, Yuni, Titien, Rosa, Wira, Vivi. Terima kasih atas kebersamaan, kerjasama dan informasi yang diberikan selama penelitian di Lab. 10. Teman-teman satu angkatan (2002), terutama kelompok C, Meta, Ina, Asti, Lia, Riasa, Ricka, Maria, Tepe, Yiyin, Haryu, Elly, Puri, Wenny, Peter, Shinta, Nowo, Rika, Ulin, Prima, Leni. Terima kasih sudah menjadi pelangi dalam hidupku selama masa kuliah. 11. Sarah, Beni, Devi, Didit, Ardian, Yiyin, Vita, atas bantuan dan dukungannya selama penyelesaian skripsi ini. 12. Mas Wagiran, mas Sigit, mas Sarwanto, mas Andre dan Pak Mukmim, terima kasih atas semua bantuan dan informasi yang diberikan selama penelitian. 13. Mas Minto, mas Jianto dan mas Purwanto, terima kasih atas bantuannya mencarikan krokot untuk bahan penelitianku. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 14. Sahabatku eks-SMUDA, Vida dan Setyo, terima kasih atas dukungan, semangat, dan persahabatan yang diberikan sejak SMA. 15. Semua orang-orang yang kutemui baik secara sengaja atau tidak, yang telah banyak memberikan pelajaran hidup yang berharga. 16. Semua pihak yang tidak dapat penulis sebutkan satu persatu yang telah banyak memberikan bantuan, dukungan, dan doanya selama ini. Semoga Allah Swt membalas semua kebaikan, kasih, dan ketulusan yang selama ini telah dirasakan penulis. Penulis menyadari bahwa penyusunan skripsi ini masih jauh dari sempurna dan masih banyak kekurangan yang harus diperbaiki. Hal tersebut dikarenakan keterbatasan kemampuan dan pengalaman yang penulis miliki. Maka dari itu, penulis menerima segala saran maupun kritik yang bersifat membangun, dan yang dapat membantu dan mendukung skripsi ini agar dapat menjadi lebih sempurna. Semoga skripsi ini dapat bermanfaat bagi masyarakat luas dan bagi perkembangan ilmu pengetahuan terutama di bidang kefarmasian. Wassalammualaikum wr.wb Yogyakarta, 10 Februari 2007 Penulis PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI INTISARI Krokot (Portulaca oleracea L.) dapat dikonsumsi sebagai sayuran, dan dapat juga digunakan sebagai tanaman obat karena memiliki kandungan kimia yang cukup bermanfaat. Salah satu golongan senyawa kimia metabolit sekunder yang terkandung di dalam herba krokot adalah glikosida saponin. Saponin merupakan senyawa kimia yang mempunyai aktivitas hemolisis, mempunyai sifat antimikroba, antibakteri, antiinflamasi dan lain-lain. Penelitian ini bertujuan untuk memperoleh isolat dan identitas golongan glikosida saponin herba krokot dalam isolat secara Kromatografi Lapis Tipis (KLT) dan Spektrofotometri UV. Melalui penelitian non eksperimental ini diharapkan diperoleh informasi mengenai golongan saponin yang terkandung di dalam herba krokot. Sebagai langkah awal dilakukan determinasi tumbuhan krokot, pengumpulan bahan, uji pendahuluan glikosida saponin, penyarian glikosida saponin herba krokot dengan pelarut etanol 70%, pemeriksaan KLT ekstrak etanol dan identifikasi glikosida saponin, isolasi glikosida saponin dengan metode KLT Preparatif, pemeriksaan kemurnian isolat dengan KLT multi eluen, identifikasi isolat dengan spektrofotometri UV. Hasil penelitian menunjukkan bahwa herba krokot mengandung glikosida saponin golongan triterpenoida. Pada uji KLT pendahuluan ada dua bercak yang diprediksi sebagai glikosida saponin. Sehingga dari dua bercak tersebut diisolasi dan diuji kemurniannya. Isolat 1 dan isolat 2 hasil isolasi menunjukkan 1 macam bercak pada kromatogram KLT multi eluen, sehingga kedua macam isolat tersebut dapat dipastikan kemurniannya. Hasil pengukuran pada spektrofotometer diketahui bahwa isolat 1 memiliki λ (panjang gelombang) maksimum 224nm, sedangkan isolat 2 memiliki λ maksimum 221nm. Hasil identifikasi isolat tersebut menunjukkan bahwa isolat 1 dengan λ maksimum 224 nm memiliki bentuk spektra yang hampir sama dengan isolat 2 (λ maksimum 221 nm), sehingga keduanya merupakan jenis senyawa yang sama yaitu senyawa glikosida saponin golongan triterpenoid Kata kunci : Krokot, Glikosida saponin, KLT, Spektrofotometri UV PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI ABSTRACT Krokot (Portulaca oleracea L) can consumed as vegetable, and can be use for medicine (plant drug) because containing chemical compound that very usefull. One of the chemical compound from secondary metabolit group that contained in krokot herb is saponin glycoside. Saponin is a chemical compound which has hemolisis activity, has characteristic as antimikroba, antibacteri, antiinflamation, etc. This research to get isolate and identify the group saponin glycoside krokot herb in isolate by using Thin Layer Chromatography (TLC) and Spectrofotometri ultra violet (UV). Trough non eksperimental research, it is hoped to get information about the kind of saponin which is contained in krokot herb. There are many steps to do this research. First, doing determination of krokot plant, gathering material, introduction test including saponin with simple test, extracting saponin glycoside krokot herb with etanol 70%, after that checking TLC extract etanol and identifying compound, isolate saponin glycoside using TLC Preparative method. At least cheeking the purity of isolate with TLC multi eluen and identify isolate with spectrofotometri UV. The result of this research show that krokot herb contains saponin glycoside with triterpenoid group. In the first TLC test, there are two spot which predicted the saponin glycoside. And then, the two of spot had been isolated and cheeked the purity of isolate. Isolate 1 and isolate 2 showed one spot on TLC multi eluen chromatogram, so that both of isolate have certainly for those purity. The result in spectrophotometer UV known that, isolate 1 has λ (wave length) maximum 224 nm, and the isolate 2 has λ (wave length) maximum 221 nm. The result of the isolate identification shows that isolate 1 with λ maximum 224 nm has same spectra with isolate 2 which has λ maximum 221 nm, so both of them is a same compound that including a saponin glycoside with triterpenoid group. Keyword : Krokot, Saponin glycoside, TLC, Spectofotometri UV PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI DAFTAR ISI Halaman HALAMAN JUDUL ........................................................................... ii HALAMAN PERSETUJUAN PEMBIMBING................................... iii HALAMAN PENGESAHAN .................................................................. iv HALAMAN PERSEMBAHAN ..................................................................... v PRAKATA .................................................................................................... vi PERNYATAAN KEASLIAN KARYA.......................................................... ix INTISARI ..................................................................................................... x ABSTRACT .................................................................................................... xi DAFTAR ISI ................................................................................................. xii DAFTAR TABEL.......................................................................................... xv DAFTAR GAMBAR ..................................................................................... xvi DAFTAR LAMPIRAN .................................................................................. xvii BAB I . PENGANTAR ............................................................................... 1 A. Latar Belakang ................................................................................ 1 1. Permasalahan ...................................................................... 3 2. Keaslian penelitian ............................................................. 3 3. Manfaat penelitian .............................................................. 4 B. Tujuan Penelitian ............................................................................ 4 BAB II PENELAAHAN PUSTAKA ....................................................... 5 A. Tumbuhan Krokot ........................................................................... 5 Keterangan botani............................................................... 5 2. Deskripsi. ............................................................................ 5 1. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 3. Ekologi ................................................................................ 6 4. Khasiat dan kegunaan ........................................................ 6 5. Kandungan kimia ............................................................... 6 B. Glikosida Saponin ........................................................................... 6 C. Penyarian. ........................................................................................ 12 D. Kromatografi Lapis Tipis (KLT) ................................................... 15 E. Kromatografi Lapis Tipis Preparatif (KLTP) ............................... 18 F. Spektrofotometri Ultraviolet .......................................................... 20 G. Keterangan Empiris ........................................................................ 24 BAB III METODOLOGI PENELITIAN ................................................. 25 A. Jenis dan Rancangan Penelitian ..................................................... 25 B. Definisi Operasional ....................................................................... 25 C. Bahan dan Alat penelitian .............................................................. 25 D. Tahapan Penelitian .......................................................................... 26 1. Determinasi tanaman krokot .............................................. 26 2. Persiapan bahan .................................................................. 26 3. Pemeriksaan organoleptik dan makroskopik .................... 27 4. Uji pendahuluan.................................................................. 27 5. Penyarian glikosida saponin dari herba krokot dan dari buah lerak yang digunakan sebagai pembanding...... 28 6. Pemeriksaan pendahuluan glikosida saponin dengan KLT ........................................................................ 28 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 7. Isolasi glikosida saponin herba krokot dengan metode KLTP ........................................................ 29 8. Pemeriksaan kemurnian dengan KLT multi eluen ........... 30 9. Spektrofotometri ultraviolet............................................... 30 E. Tata Cara Analisis Hasil ................................................................. 31 BAB IV. HASIL DAN PEMBAHASAN .................................................. 32 A. Determinasi. .................................................................................... 32 B. Persiapan Bahan .............................................................................. 32 C. Hasil Pemeriksaan Organoleptik dan Makroskopik ..................... 33 D. Uji Pendahuluan .............................................................................. 33 E. Penyarian Senyawa Glikosida Saponin ......................................... 38 F. Pemeriksaan Glikosida Saponin dengan KLT .............................. 39 G. Isolasi Glikosida Saponin Herba Krokot dengan KLTP .............. 45 H. Pemeriksaan Kemurnian dengan Metode KLT multi eluen ......... 48 Spektrofotometri Ultraviolet (UV) ................................................ 55 BAB V. KESIMPULAN DAN SARAN ................................................... 61 A. Kesimpulan...................................................................................... 61 B. Saran ................................................................................................ 61 DAFTAR PUSTAKA ................................................................................. 62 LAMPIRAN ................................................................................................ 64 BIOGRAFI PENULIS ................................................................................ 81 I. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI DAFTAR TABEL Tabel I . Hasil kromatogram KLT pendahuluan ................................... 40 Tabel II . Hasil kromatogram KLTP ...................................................... 46 Tabel III . Hasil isolat yang diperoleh dari KLTP .................................. 47 Tabel IV . Hasil kromatogram KLT multi eluen .................................... 49 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI DAFTAR GAMBAR Gambar 1 . Struktur kimia dua macam golongan glikosida saponin .... 10 Gambar 2. Mekanisme terbentuknya buih ......................................... 34 Gambar 3 Adsorpsi molekul-molekul saponin pada batas antar permukaan air-udara ........................................................ 35 Gambar 4. Reaksi Liebermann-Burchard........................................... 36 Gambar 5. Reaksi Salkowski............................................................. 37 Gambar 6 . Hasil kromatogram KLT pendahuluan ............................. 41 Gambar 7. Reaksi antara saponin triterpenoid dengan deteksi Anisaldehida-asam sulfat .................................................. 43 Gambar 8 . Hasil kromatogram KLTP sampel (ekstrak etanol herba krokot)............................................ 46 Gambar 9 . Hasil kromatogram KLTmulti eluen isolat 1 .................... 50 Gambar 10 . Hasil kromatogram KLT multi eluen isolat 1 .................. 51 Gambar 11 . Hasil kromatogram KLTmulti eluen isolat 2 ................... 52 Gambar 12 . Hasil kromatogram KLTmulti eluen isolat 2 ................... 53 Gambar 13. Hasil spektra isolat 1........................................................ 58 Gambar 14. Hasil spektra isolat 2........................................................ 59 Gambar 15. Hasil spektra etanol 70%................................................... 60 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI DAFTAR LAMPIRAN Lampiran 1 . Surat determinasi........................................................... 64 Lampiran 2 . Foto herba krokot.......................................................... 65 Lampiran 3 . Foto hasil uji pendahuluan glikosida saponin................. 66 Lampiran 4 . Foto hasil kromatogram KLT pendahuluan.................... 67 Lampiran 5 . Foto hasil kromatogram KLT multi eluen pada isolat 1 dengan fase gerak etil asetat, metanol, air (100:16,5:13,5 v/v) ....................................................... 68 Lampiran 6 . Foto hasil kromatogram KLT multi eluen pada isolat 1 dengan fase gerak kloroform, metanol (95 : 5 v/v) ..................................................................... 70 Lampiran 7 . Foto hasil kromatogram KLT multi eluen pada isolat 1 dengan fase gerak kloroform, metanol, air ( 70 : 30 : 4 v/v ) ........................................................... 72 Lampiran 8 . Foto hasil kromatogram KLT multi eluen pada isolat 2 dengan fase gerak etil asetat, metanol, air ( 100 : 16,5 : 13,5 v/v )................................................... 74 Lampiran 9 . Foto hasil kromatogram KLT multi eluen pada isolat 2 dengan fase gerak kloroform, metanol ( 95 : 5 v/v ) ................................................................... 76 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Lampiran 10 . Foto hasil kromatogram KLT multi eluen pada isolat 2 dengan fase gerak kloroform, metanol, air ( 70 : 30 : 4 v/v ) ........................................................... 78 Lampiran 11. Foto alat yang digunakan untuk penyarian..................... 80 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI BAB I PENGANTAR A. Latar Belakang Manusia sering memanfaatkan berbagai macam tanaman untuk kelangsungan hidupnya. Dalam hal ini, bukan saja tanaman pangan tetapi juga tanaman obat yang mengandung metabolit sekunder yang cukup bermanfaat dalam pengobatan. Berbagai jenis senyawa kimia yang terkandung dalam tumbuhan memiliki khasiat dan manfaat yang spesifik. Tanaman obat merupakan tanaman yang dapat digunakan dalam pengobatan baik sebagai pemeliharaan kesehatan maupun untuk penyembuhan penyakit. Hal ini telah dikenal sejak jaman dahulu dan digunakan berdasarkan pengalaman secara turun temurun. Salah satu jenis tanaman obat yang belum begitu dikenal oleh masyarakat adalah krokot (Portulaca oleracea L.). Selama ini masyarakat mengenal krokot sebagai sayuran atau gulma bukan sebagai tanaman obat. Krokot merupakan tanaman gulma yang pada daerah tertentu sering dikonsumsi sebagai sayuran. Tanaman ini merupakan gulma pada tanaman semusim, palawija, sayuran, maupun tanaman perkebunan (Djauhariya,2004). Selain dikonsumsi sebagai sayuran, ternyata krokot juga dapat digunakan untuk pengobatan pada beberapa penyakit, seperti disentri, radang usus buntu, sakit perut, radang gusi, demam, digigit binatang berbisa, eczema, jantung berdebar, kencing darah dan bisul. Cara penggunaanya bisa dengan di makan langsung ataupun dengan direbus bersama bahan lain (Djauhariya,2004). PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Tanaman krokot diperkirakan memiliki kandungan kimia berupa KCl, K2SO4, KNO3, asam nikotinat, tanin, saponin, vitamin A, vitamin B, vitamin C, 1-Noradrenalin, noradrenalin, dopamine, dan dopa (Djauhariya,2004). Berdasarkan hal tersebut, krokot memiliki dua fungsi yaitu selain dikonsumsi sebagai sayuran ternyata dapat juga digunakan sebagai tanaman obat karena memiliki kandungan kimia yang cukup bermanfaat. Biasanya masyarakat mengenal tanaman obat sebagai jamu yang memiliki rasa yang tidak enak, sehingga membuat mereka malas untuk menggunakannya. Tetapi lain halnya jika tanaman obat tersebut dapat dimakan sebagai sayuran sekaligus dapat mengobati penyakit seperti yang telah disebutkan diatas, tentu masyarakat akan merasa lebih diuntungkan. Dalam setiap bagian tanaman pasti terdapat metabolit sekunder. Metabolit sekunder ini biasanya mempunyai efek fisiologis yang dapat dimanfaatkan untuk pengobatan. Salah satu senyawa kimia yang termasuk dalam golongan metabolit sekunder yang terkandung di dalam herba krokot adalah glikosida saponin. Glikosida saponin adalah glikosida yang terdiri dari gugus gula yang berikatan dengan aglikon berupa sapogenin. Menurut struktur aglikonnya, saponin dapat dibedakan menjadi dua macam tipe yaitu tipe steroida dan triterpenoida (Evans,2002). Saponin steroid dapat digunakan untuk pengobatan pada penyakit syphilis, reumatik, penyakit kulit, psoriasis, eczema, pada anemia, diabetes, gastritis, dan impotensi (Evans, 1989). Sedangkan saponin triterpenoid dapat digunakan sebagai emulsifying agent, sebagai stimulant expectoran pada bronkhitis kronik dan sebagai antiinflamasi, antifungi, antibakteri (Evans, 1989). PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Seperti yang telah disebutkan diatas, krokot dapat digunakan untuk pengobatan penyakit disentri. Hal ini mungkin dikarenakan adanya glikosida saponin yang memiliki aktivitas sebagai antimikroba dan antibakteri. Demikian juga dengan digunakannya krokot sebagai obat untuk bisul, radang gusi, radang usus buntu. Karena saponin memiliki sifat sebagai antiinflamasi, antieksudatif dan antibakteri (Brotosisworo,1979; Djauhariya,2004). Untuk lebih mendalami dan mengetahui golongan glikosida saponin yang terkandung di dalam herba krokot, maka akan dilakukan penelitian ini. 1. Permasalahan Apakah glikosida saponin herba krokot dapat diisolasi kemudian selanjutnya diidentifikasi untuk mengetahui golongan glikosida saponinnya dengan menggunakan Kromatografi Lapis Tipis (KLT) dan Spektrofotometri ultraviolet ? 2. Keaslian penelitian Isolasi dan identifikasi aglikon saponin herba lerak (Sapindus rarak D.C) pernah dilakukan oleh Yanuarsih (2001). Perbedaan dari penelitian ini adalah tanaman yang digunakan. Penelitian tentang isolasi dan identifikasi glikosida saponin pada herba krokot belum pernah dilakukan. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 3. Manfaat penelitian Hasil penelitian ini diharapkan dapat memberi sumbangan baru bagi perkembangan ilmu kefarmasian, kedokteran, maupun kesehatan pada umumnya. Hal tersebut dapat berupa manfaat teoritis dan manfaat praktis. a. Manfaat secara teoritis Untuk melengkapi informasi mengenai golongan glikosida saponin yang terkandung dalam herba krokot dan juga dapat memberikan pengetahuan dalam bidang fitofarmaka. b. Manfaat secara praktis Untuk melengkapi informasi tentang penggunaan herba krokot berdasarkan dari efektivitas golongan glikosida saponin yang terkandung dalam herba krokot. B. Tujuan Penelitian Tujuan dilakukannya penelitian tentang isolasi dan identifikasi glikosida saponin herba krokot ada dua yaitu : 1. Umum : Untuk lebih mendalami pengetahuan tentang herba krokot dalam hal fitokimia. 2. Khusus : Untuk memperoleh isolat dan identitas golongan glikosida saponin herba krokot dalam isolat secara Kromatografi Lapis Tipis (KLT) dan Spektrofotometri UV PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI BAB II PENELAAHAN PUSTAKA A. Tumbuhan Krokot 1. Keterangan botani Krokot memiliki nama ilmiah Portulaca oleracea L. , termasuk dalam suku Portulacaceae. Tanaman krokot juga dikenal dengan berbagai nama daerah seperti Krokot (Jawa), Gelang (Sunda), Re-serejan (Madura), Gelang (Sumatera), Jalujalu kiki (Ternate) (Anonim,1995). 2. Deskripsi Krokot memiliki daun tunggal, tersebar atau berhadapan, umumnya rontok, dalam keadaan segar berdaging dan berwarna hijau. Helaian daun berbentuk bundar telur atau bundar telur terbalik, ujung dan pangkal membundar atau tumpul, panjang tiap helaian sampai 10 mm dan lebar sampai 4 mm (Anonim,1995). Ujung daun melekuk ke dalam. Pangkal daun meruncing, tepi daun rata, panjang 1-4 cm. Permukaan atas daun warna hijau tua sedangkan bagian bawah merah tua. Bunga berkelompok, keluar dari ujung-ujung cabang, mahkota bunga kecil, berjumlah 5, warna kuning. Bunga mekar dari jam 8-10 pagi, layu menjelang sore. Buah berkotak, biji banyak, kecil. Buah yang sudah matang bijinya warna hitam. Tumbuhan ini berkembang biak dengan biji. Krokot merupakan tumbuhan berumur setahun, batang merebah, bentuk bulat, lunak dan berair, tidak berkayu, kulit batang warna coklat keunguan, panjang batang 10-50 cm (Djauhariya, 2004). PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 3. Ekologi Krokot tumbuh liar di tempat terbuka, tempat agak terlindung, dan pada tanah agak lembab seperti di pekarangan, pinggiran kampung, pinggir selokan, dan pinggir jalan (Djauhariya, 2004). 4. Khasiat dan kegunaan Krokot berkhasiat sebagai obat disentri, radang usus buntu, sakit perut, radang gusi, demam, digigit binatang berbisa, eksim, jantung berdebar, kencing darah, dan bisul (Djauhariya,2004). Dalam MMI, disebutkan bahwa krokot dapat digunakan sebagai obat gatal dan memperbaiki pencernaan. 5. Kandungan kimia Diperkirakan krokot mempunyai kandungan kimia berupa KCl, K2SO4, KNO3, asam nikotinat, tannin, saponin, vitamin A, vitamin B, vitamin C, 1-noradrenalin, noradrenalin, dopamine, dan dopa (Djauhariya, 2004). B. Glikosida Saponin Saponin adalah senyawa aktif permukaan yang kuat yang menimbulkan busa jika dikocok dalam air dan pada konsentrasi yang rendah sering menyebabkan hemolisis sel darah merah. Dalam larutan yang sangat encer saponin sangat beracun untuk ikan, dan tumbuhan yang mengandung saponin telah digunakan sebagai racun ikan selama beratus-ratus tahun. Beberapa saponin bekerja sebagai antimikroba (Robinson,1995). Saponin adalah glikosida, yaitu metabolit sekunder yang banyak terdapat di alam, terdiri dari gugus gula yang berikatan dengan aglikon atau sapogenin. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Sifat-sifat saponin : berasa pahit, berbusa dalam air, mempunyai sifat deterjen yang baik, beracun bagi binatang berdarah dingin, mempunyai aktivitas haemolisis, merusak sel darah merah, tidak beracun bagi binatang berdarah panas, mempunyai sifat antieksudatif, mempunyai sifat antiinflamasi. Beberapa daya kerja dan pemakaian dari saponin adalah sebagai berikut: 1. Semua saponin menyebabkan hemolisa, karena itu beracun untuk semua organisme bila diberikan secara parenteral setengah sampai beberapa mg per kg berat badan ,dapat mematikan pada pemberian intravena. 2. Pengaruh terhadap alat pernafasan dapat dibuktikan dengan kenyataan dengan digunakannya obat yang mengandung saponin untuk mencari ikan oleh rakyat yang primitif. Kadar saponin yang sangat kecil melumpuhkan fungsi pernafasan dari insang. 3. Kegunaan saponin dalam pengobatan nampaknya terutama oleh sifatnya yang berpengaruh terhadap absorbsi zat aktif secara farmakologi. Beberapa contoh untuk menggambarkan sifat tersebut antara lain: Penggunaan secara simultan digitoksin dan saponin digitonin, meningkatkan efek digitoksin sampai kurang lebih 50 kali bila diberikan secara oral terhadap katak. 4. Saponin juga menaikkan permeabilitas kertas saring. Filter dengan pori yang cukup kecil untuk menahan partikel yang berukuran tertentu akan dapat meloloskan partikel tersebut karena adanya saponin. 5. Secara teknik saponin digunakan sebagai emulsifier. 6. Saponin menimbulkan iritasi berbagai tingkat terhadap selaput lendir mulut, perut, dan usus bergantung dari sifat masing-masing saponin. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 7. Saponin merangsang keluarnya secret dari bronchial, hal ini diterangkan dengan begitu banyak penggunaan obat semacam senega dan Liquiritse sebagai ekspektoran dan bahan sekretolitik dalam pengobatan penyakit alat pernafasan. 8. Saponin juga meningkatkan absorbsi zat diuretika (garam-garam) dan nampaknya juga merangsang ginjal untuk lebih aktif. Hal ini mungkin menerangkan kenyataan mengapa obat saponin sangat sering digunakan untuk rematik dalam pengobatan rakyat. 9. Dalam industri, saponin digunakan dalam jumlah besar sebagai emulsifier terutama dalam pemadam kebakaran, pekerjaan pencucian, dan lain-lain (Brotosisworo,1979). Adanya saponin dalam tanaman juga dapat ditunjukkan dengan beberapa cara antara lain: a . Indeks buih (foam index) Indeks buih menunjukkan angka pengenceran dari zat atau obat yang diperiksa yang akan memberikan suatu lapisan buih yang tingginya 1 cm sampai 10 cm, bila larutan digojok dalam gelas ukur selama 15 detik dan selanjutnya dibiarkan dulu selama 10 menit sebelum dilakukan pembacaan (Anonim,1995). b. Haemolisa Campur bahan yang akan diperiksa dengan larutan dapar fosfat pH 7,4 , panaskan,dinginkan, saring. Ambil filtrat campur dengan suspensi darah. Diamkan selama 30 menit, terjadi haemolisa total berarti menunjukkan adanya saponin (Anonim,1995). PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI c. Reaksi warna Reaksi warna dapat digunakan untuk menggolongkan saponin (sapogenin) yang digunakan untuk membuktikan identitas dari suatu obat, dan jika perlu untuk memonitor pada waktu pemisahan. Tidak ada reaksi warna yang secara spesifik untuk tiap jenis saponin. Reaksi berikut ini dapat digunakan yaitu: 1) Dengan menggunakan asam asetat anhidrat dan asam sulfat ( disebut reaksi Liebermannn-Burchard). Hasilnya ditunjukkan dengan adanya perubahan warna yang bergantung dari aglikonnya yaitu, merah muda sampai merah berarti termasuk golongan triterpenoid. Sedangkan jika warnanya biru hijau maka menunjukkan adanya senyawa golongan steroid (Bruneton,1999). 2) Dengan menggunakan vanillin, anisaldehid, dan aldehid aromatik lainnya yang ditambah dengan asam mineral kuat. Senyawa yang mengandung saponin akan berwarna kuat, yang kemungkinan hasil reaksi antara aldehid dan aglikon (Bruneton,1999). Dikenal dua jenis saponin yaitu, glikosida triterpenoid alkohol dan glikosida struktur steroid tertentu yang mempunyai rantai samping spiroketal. Kedua jenis saponin ini larut dalam air dan etanol tetapi tidak larut dalam eter (Robinson,1995). Menurut struktur aglikon atau sapogenin, saponin dapat dibedakan menjadi dua macam tipe yaitu tipe steroida dan triterpenoida. Kedua macam senyawa tersebut mempunyai hubungan glikosidal pada C-3 dan mempunyai asal-usul biogenetika yang sama melalui asam mevalonat dan satuan isoprenoid. (Brotosisworo,1979; Evans,2002). PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 21 26 O 25 23 22 20 24 18 E O 12 17 13 15 11 D C 19 R1 16 14 1 9 R2 2 8 10 A B H 3 7 5 4 6 OH H Kerangka steroid 29 30 20 21 19 E 12 22 18 13 17 28 11 C COOH D 25 9 14 16 26 15 1 R1 8 2 10 A 27 B 3 7 5 4 6 OH H 23 24 R2 Kerangka triterpenoid Gambar 1. Struktur kimia dua macam golongan glikosida saponin Sterol adalah triterpena yang kerangka dasarnya sistem cincin siklopentana perhidrofenantrena. Dahulu sterol terutama dianggap sebagai senyawa satwa (sebagai hormon kelamin, asam empedu, dan lain-lain), tetapi pada tahun-tahun terakhir ini makin banyak senyawa tersebut yang ditemukan dalam jaringan PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI tumbuhan (Harborne, 1987). Nama sterol digunakan khusus untuk steroid alkohol, tetapi karena ternyata semua steroid tumbuhan adalah alkohol dengan sebuah hidroksi group pada C-3, maka steroid tumbuhan sering disebut sterol. Triterpenoida adalah senyawa yang kerangka karbonnya berasal dari enam satuan isoprene dan secara biosintetis diturunkan dari hidrokarbon C30 asiklik, yaitu skualena. Senyawa ini berstruktur siklik yang nisbi rumit, kebanyakan berupa senyawa tidak berwarna, berbentuk kristal, seringkali titik leleh tinggi dan aktif optik, yang umumnya sukar dicirikan karena tidak ada kereaktifan kimianya (Harborne, 1987). Saponin triterpenoida dapat dibedakan dalam tiga golongan yang diwakili oleh α–amirin, β -amirin, dan lupeol. Saponin steroid kebanyakan ditemukan di dalam famili monokotil, terutama Liliaceae (Allium, Smilax, Asparagus), Agavaceae (Agave, Yucca) dan Dioscoreaceae (Dioscorea). Selain itu juga ditemukan dalam Fabaceae (fenugrek), Solanaceae (tobacco), atau Scrophulariaceae (foxgloves). Berbeda dengan steroid, saponin triterpenoid jarang terdapat pada monokotil. Sebagian besar terdapat dalam famili dikotil seperti Araliaceae, Caryophyllaceae, Cucurbitaceae, Fabales, Primulaceae, Ranunculaceae, Rosaceae dan Sapindaceae (Bruneton,1999). Saponin steroid mempunyai peran penting pada bidang pharmaceutical karena hubungannya dengan beberapa senyawa seperti hormon sex, kortison, diuretic steroid, vitamin D dan glikosida jantung. Beberapa saponin digunakan sebagai starting material pada sintesis senyawa tersebut. Selain itu kandungan saponin steroid dalam akar Sarsaparilla dapat digunakan untuk pengobatan pada penyakit syphilis, reumatik, penyakit kulit, psoriasis, dan eczema. Saponin steroid pada PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI akar Ginseng sering digunakan untuk pengobatan pada anemia, diabetes, gastritis, dan impotensi (Evans, 1989). Saponin triterpenoid pada kulit kayu Quillaia dapat digunakan sebagai emulsifying agent. Sedangkan pada akar Senega dan akar Primula digunakan sebagai stimulant expectoran pada bronkhitis kronik. Selain itu saponin triterpenoid juga digunakan sebagai antiinflamasi, antifungi, antibakteri (Evans, 1989). C. Penyarian Penyarian adalah kegiatan pengambilan zat yang dapat larut dari bahan yang tidak dapat larut dengan pelarut cair. Simplisia yang disari ,mengandung zat aktif yang dapat larut dan zat yang tidak larut seperti serat, karbohidrat, protein dan lain-lain. Beberapa golongan zat aktif yang terdapat dalam simplisia adalah alkaloida, glikosida dan flavonoid. Stuktur kimia yang berbeda-beda akan mempengaruhi kelarutan serta stabilitas senyawa-senyawa terhadap pemanasan, logam berat, udara, cahaya, dan derajat keasaman. Jika zat aktif yang dikandung simplisia diketahui maka akan lebih mudah dalam pemilihan cairan penyari dan cara penyariannya. Penyarian disamping memperhatikan sifat-sifat fisik simplisia dan sifat zat aktifnya, harus juga memperhatikan zat-zat yang sering terdapat dalam simplisia seperti protein, karbohidrat, lemak, dan gula. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Penyarian dipengaruhi oleh: 1. Derajat kehalusan serbuk Simplisia yang terlalu halus akan mempersulit pada proses penyarian. Hal ini karena jika serbuknya terlalu halus maka ruang antar selnya akan berkurang. Padahal ruang antar sel ini merupakan jalan yang mudah ditembus oleh cairan. Serbuk yang terlalu halus dapat membentuk suspensi yang sulit dipisahkan dengan hasil penyarian. Dengan demikian hasil penyarian tidak murni lagi tetapi bercampur dengan partikel-partikel halus tadi. Jadi untuk masingmasing simplisia perlu ditetapkan derajat halus yang paling tepat untuk memperoleh hasil penyarian yang baik. 2. Perbedaan konsentrasi yang terdapat mulai dari pusat butir serbuk simplisia sampai ke permukaannya, maupun pada perbedaan konsentrasi yang terdapat lapisan batas, sehingga suatu titik akan dicapai, oleh zat-zat yang tersari jika ada daya dorong yang cukup untuk melanjutkan pemindahan massa. Makin besar perbedaan konsentrasi, makin besar daya dorong tersebut hingga makin cepat penyarian. Cairan penyari yang baik harus memenuhi kriteria berikut ini: murah dan mudah diperoleh, stabil secara fisika dan kimia, bereaksi netral, tidak mudah menguap dan tidak mudah terbakar, selektif yaitu hanya menarik zat berkhasiat yang dikehendaki, tidak mempengaruhi zat berkhasiat, diperbolehkan oleh peraturan (Anonim,1986). PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Cara penyarian dapat dibedakan menjadi beberapa macam yaitu: a. Infudasi Infus adalah sediaan cair yang dibuat dengan menyari simplisia dengan air pada suhu 900C selama 15 menit (Anonim,1986). Infudasi adalah proses penyarian yang biasanya digunakan untuk menyari kandungan zat aktif yang larut dalam air dari bahan-bahan nabati. Penyarian dengan cara ini menghasilkan sari yang tidak stabil dan mudah tercemar oleh kuman dan kapang. Maka dari itu, sari yang diperoleh tidak boleh disimpan lebih dari 24 jam. b. Maserasi Maserasi dilakukan dengan cara merendam serbuk simplisia dalam cairan penyari. Cairan penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif, zat aktif akan larut dan karena adanya perbedaan konsentrasi antara larutan zat aktif di dalam sel dengan yang di luar sel, maka larutan yang terpekat didesak keluar. Peristiwa tersebut berulang sehingga terjadi keseimbangan konsentrasi antara larutan diluar sel dan di dalam sel (Anonim,1986). Maserasi digunakan untuk penyarian simplisia yang mengandung zat aktif yang mudah larut dalam cairan penyari, tidak mengandung zat yang mudah mengembang dalam cairan penyari, tidak mengandung benzoin, stirak dan lain-lain. c. Perkolasi Perkolasi adalah penyarian yang dilakukan dengan mengalirkan cairan penyari melalui serbuk simplisia yang telah dibasahi. Prinsip perkolasi adalah serbuk PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI simplisia ditempatkan dalam suatu bejana silinder, yang bagian bawahnya diberi sekat berpori (Anonim,1986). Cairan penyari dialirkan dari atas ke bawah melalui serbuk tersebut, cairan penyari akan melarutkan zat aktif sel-sel yang dilalui sampai mencapai keadaan jenuh. Gerak ke bawah disebabkan oleh kekuatan gaya berat sendiri dan cairan diatasnya, dikurangi dengan daya kapiler yang cenderung untuk menahan. d. Penyarian berkesinambungan Penyarian berkesinambungan menggabungkan antara proses menghasilkan ekstrak cair dan proses penguapan. Penyarian berkesinambungan dapat dilakukan dalam skala laboratorium dan skala besar tergantung dari keperluannya dan alat yang digunakan. Intinya cairan penyari dipanaskan hingga mendidih, uap penyari akan naik keatas melalui serbuk simplisia. Uap penyari mengembun karena didinginkan oleh pendingin balik. Embun turun melalui serbuk simplisia sambil melarutkan zat aktifnya dan kembali ke labu. Cairan akan menguap kembali dan prosesnya akan berulang (Anonim,1986) . D. Kromatografi Lapis Tipis (KLT) Kromatografi adalah suatu teknik pemisahan tertentu. Pada dasarnya semua cara kromatografi menggunakan dua fasa yaitu fasa tetap (stationary) dan fasa bergerak (mobile). KLT dapat digunakan untuk keperluan yang luas dalam pemisahan-pemisahan senyawa yang berwarna maupun tidak berwarna. Selain itu juga memberikan hasil pemisahan yang lebih baik dan juga membutuhkan waktu yang lebih cepat (Harborne,1987) . PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Secara garis besar KLT dapat dilakukan dengan cara membuat lempeng kromatografi, yaitu untuk membentangkan penjerap dalam lapis tipis yang berkelakuan sebagai penyokong yang inert. Penjerap padat yang berbentuk bubukan halus biasanya dibuat menjadi bubur (slurry) dengan air dan dibentangkan di atas plat gelas. Pembuatan lapis tipis di atas kaca ada beberapa cara yaitu dengan jalan penyemprotan atau pencelupan, disamping dikerjakan dengan tangan dapat juga dengan mesin. Plat yang telah dilapisi dipanaskan atau diaktifkan dengan jalan memanaskannya pada suhu kira-kira 1000C selama waktu tertentu. Campuran yang akan dikromatografi harus dilarutkan di dalam pelarut yang agak nonpolar untuk ditotolkan pada lempang KLT. Pada umumnya, dipakai larutan 0,1-1%. Hampir segala macam pelarut dapat dipakai, tetapi yang terbaik yang bertitik didih antara 500-1000C. Pelarut yang demikian mudah ditangani dan mudah menguap dari lempeng. Larutan cuplikan dalam pelarut yang akan diidentifikasi ditotolkan dengan menggunakan pipet kapiler atau pipet mikro. Bila bercak hasil penotolan telah kering plat diletakkan secara vertikal dalam bejana yang sesuai dengan tepi yang dibawah dicelupkan dalam fase bergerak yang dipilih, maka pemisahan kromatografi akan diperoleh. Pada akhir pengembangan, pelarut dibiarkan menguap dari plat dan bercak yang terpisah dilokalisir dan diidentifikasi dengan cara-cara fisika dan kimia (Sastrohamidjojo, 2002). Penjerap yang dipakai untuk KLT ialah silika gel, alumina, kiselgur, dan selulosa. Silika gel merupakan penjerap yang paling banyak dipakai dalam KLT dan Kromatografi Cair Kinerja Tinggi (KCKT). Karena sebagian besar silika gel PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI bersifat sedikit asam, maka asam sering agak mudah dipisahkan. Jadi meminimumkan reaksi asam-basa antara penjerap dan senyawa yang dipisahkan. Alumina, berbeda dengan silika gel alumina bersifat sedikit basa dan sering dipakai untuk pemisahan basa. Cara ini juga meminimumkan reaksi asam-basa. Kiselgur dan selulosa merupakan bahan penyangga lapisan zat cair yang dipakai dalam sistem Kromatografi Cair-cair (KCC). Kromatografi jenis ini selalu dipakai untuk pemisahan senyawa polar seperti asam amino, karbohidrat, nukleotida, dan berbagai senyawa hidrofil alam lainnya (Gritter, 1985). Lapisan penjerap dapat terikat dan melekat pada pelat kaca karena adanya berbagai pengikat. Pengikat yang paling umum digunakan adalah kalsium sulfat (CaSO4) yang ditambahkan ke dalam penjerap sampai 10-15%. Maka nama dari penjerap biasanya diberi tanda G, misal silica gel G (Redja, 1980). Lapisan penjerap sering mengandung indikator fluoresensi yang ditambahkan untuk membantu penampakan bercak tidak berwarna pada lapisan yang telah dikembangkan. Indikator fluoresensi adalah senyawa yang memancarkan sinar tampak jika disinari dengan sinar berpanjang gelombang lain, biasanya sinar ultraviolet. Dan biasanya penjerap yang dicampur dengan indikator fluoresensi diberi tanda F, misalnya silica gel GF. Jika senyawa pada bercak yang ditampakkan mengandung ikatan rangkap terkonjugasi atau cincin aromatis, maka sinar UV yang mengeksitasi tidak dapat mencapai indikator fluoresensi sehingga tidak ada cahaya yang dipancarkan. Dengan demikian hasilnya ialah bercak gelap dengan latar belakang yang bersinar. Cara ini sangat peka dan tidak merusak senyawa yang ditampakkan. Indikator fluoresensi yang paling sering digunakan PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI adalah sulfida anorganik, yang dapat memancarkan cahaya jika disinari pada 254 nm (Gritter, 1985). Identifikasi dari senyawa-senyawa yang terpisah pada KLT lebih baik dikerjakan dengan pereaksi kimia dan reaksi-reaksi warna. Tetapi dapat juga menggunakan harga Rf, hal ini dapat didefinisikan sebagai berikut : Jarak titik pusat bercak dari titik awal penotolan Harga Rf = Jarak pengembangan Harga-harga Rf untuk senyawa-senyawa murni dapat dibandingkan dengan harga Rf standar. Faktor-faktor yang mempengaruhi gerakan bercak dalam KLT yang juga mempengaruhi harga Rf adalah struktur kimia dari senyawa yang sedang dipisahkan, sifat dari penjerap dan derajat aktifitasnya, tebal dan kerataan dari lapisan penjerap, pelarut (dan derajat kemurnian) fasa bergerak, derajat kejenuhan dari uap dalam bejana pengembangan yang digunakan, teknik percobaan, jumlah cuplikan yang digunakan, suhu, kesetimbangan antara atmosfer dalam bejana jenuh dengan uap pelarut (Sastrohamidjojo, 2002). E. Kromatografi Lapis Tipis Preparatif (KLTP) KLTP adalah salah satu metode yang paling mudah dan murah yang digunakan untuk isolasi komponen suatu senyawa. Tetapi membutuhkan kerja yang lebih intensif dan tiap-tiap fraksi yang diperoleh hanya dalam jumlah kecil. Sebenarnya prinsip dasar KLTP sama dengan KLT pada umumnya. Tetapi ada perbedaan yang paling mendasar yaitu tentang ukuran ketebalan penjerap dan PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI metode penotolannya. Pada KLTP, cuplikan yang akan dipisahkan ditotolkan berupa garis lurus mendatar pada salah satu sisi pelat lapisan besar dan dikembangkan secara tegak lurus pada garis cuplikan sehingga campuran akan terpisah menjadi beberapa pita. Pita akan nampak dengan cara yang tidak merusak jika senyawa itu berwarna. Setelah itu penjerap yang mengandung pita dikerok dari pelat kaca. Kemudian cuplikan dielusi dari penjerap dengan pelarut polar (Gritter, 1985). Ukuran ketebalan penjerap pada pelat KLTP yang paling sering dipakai adalah 0,5-2 mm. Sedangkan ukuran pelat yang sering digunakan biasanya 20 x 20 cm atau 20 x 40 cm (Hostettmann, 1995). Adanya pembatasan ketebalan lapisan dan ukuran pelat tentu saja akan mengurangi jumlah bahan yang dapat dipisahkan dengan KLTP. Penjerap yang paling umum dipakai ialah silica gel dan dipakai untuk pemisahan campuran senyawa lipofil maupun campuran senyawa hidrofil. Untuk pembuatan lapisan tanpa retak dianjurkan memakai penjerap niaga yang tersedia. Penotolan cuplikan pada pelat KLTP dapat dilakukan dengan tangan menggunakan pipa kapiler atau pipet mikroliter, tetapi lebih baik jika menggunakan penotol otomatis. Pada KLTP kita harus menyebarkan larutan cuplikan yang volumnya agak besar (sampai 2ml) berbentuk pita seragam yang tipis (lebar 1-5 mm) tanpa mengganggu permukaan lapisan (Gritter,1985). Pelarut apa saja yang mempunyai titik didih antara 500C dan 900C cocok untuk pelarut cuplikan. Konsentrasi cuplikan harus sekitar 5-10%. Cuplikan tersebut ditotolkan PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI berupa pita yang harus sesempit mungkin karena pemisahan bergantung pada lebar pita. Pada umumnya penjerap pada KLTP mengandung indikator fluoresensi yang membantu mendeteksi kedudukan pita yang terpisah, asalkan senyawa yang akan dipisahkan menyerap sinar UV. Pita penjerap yang diperkirakan mengandung komponen campuran murni, kemudian dari pelat kaca dengan spatula, silet, atau pengaduk karet pipih dan selanjutnya hasi kerokan ditampung. Penjerap diletakkan di dalam corong kaca memakai kertas saring lalu diekstraksi (di elusi) beberapa kali dengan pelarut yang cocok. Pelarut yang digunakan harus cukup polar untuk mengekstraksi cuplikan (Gritter, 1985). F. Spektrofotometri Ultraviolet Di bidang farmasi, analisa spektrofotometri cahaya tampak dan ultraviolet telah dikenal sebagai metode utama baik untuk identifikasi, karakterisasi, pemeriksaan kemurnian maupun penetapan kadar obat. Metode ini disamping dapat dipakai untuk analisis zat dalam jumlah atau kadar kecil, cepat, sederhana, spesifik, sensitif dan non destruktif. Selain itu dalam batas-batas tertentu dapat juga dilakukan analisa zat campuran (Redja, 1980). Spektrofotometri ultraviolet merupakan tehnik analisis spektroskopik yang memakai sumber radiasi elektromagnetik ultraviolet dekat 190-380 nm. Satuan yang akan digunakan untuk memberikan panjang gelombang ini adalah nanometer ( 1nm = 10-9 m) (Fessenden & Fessenden, 1986). PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Spektrum ultraviolet adalah suatu gambar antara panjang gelombang atau frekuensi serapan lawan intensitas serapan (transmitasi atau absorbansi). Kromofor merupakan gugus yang bertanggung jawab atas peresapan cahaya pada daerah UV-Vis. Sedangkan auksokrom merupakan gugus dengan ikatan jenuh yang bila terikat pada sebuah kromofor akan merubah baik panjang gelombang maupun intensitas serapan maksimum (Redja, 1980). Panjang gelombang di mana terjadi eksitasi elektronik yang memberikan absorban maksimum disebut panjang gelombang maksimum. Penentuan panjang gelombang maksimum dapat digunakan untuk mengidentifikasi molekul (Mulja & Suharman, 1995). Panjang gelombang maksimum sangat berkaitan dengan puncak absorbsi. Pada panjang gelombang maksimum, perubahan absorbansi persatuan konsentrasi paling besar sehingga diperoleh sensitivitas yang maksimum (Skoog, Holler & Noeman, 1998). Spektrum serapan kandungan tumbuhan dapat diukur dalam larutan yang sangat encer dengan pembanding blangko pelarut serta menggunakan spektrofotometer yang merekam otomatis. Senyawa tak berwarna diukur pada panjang gelombang 200-400 nm, senyawa berwarna pada panjang gelombang 200-700 nm. Panjang gelombang serapan maksimum dan minimum pada spektrum serapan yang diperoleh direkam (dalam nm), demikian juga kekuatan absorbansi. Bahan yang diperlukan hanya sedikit saja karena sel spektrofotometri baku (1 x 1 cm) hanya dapat diisi 3 ml larutan. Pengukuran spektrum yang demikian penting pada identifikasi kandungan tumbuhan, yaitu untuk memantau PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI eluat dari kolom kromatografi sewaktu pemurnian dan untuk mendeteksi golongan senyawa tertentu (Harborne, 1987). Karakteristik serapan suatu zat dalam pelarut tertentu, yaitu panjang gelombang pada serapan maksimum dan daya serapnya dapat dipakai untuk identifikasi atau penetapan kemurniannya. Tetapi cara ini tidak mutlak dapat dijadikan kesimpulan akhir untuk menetapkan identitas suatu zat, karena zat yang berbeda dapat menunjukkan serapan maksimum pada panjang gelombang yang sama. Jadi uji yang lain, seperti uji kimia dan fisika juga harus dilakukan untuk memastikannya (Redja, 1980). Pelarut yang banyak digunakan untuk spekstroskopi UV adalah etanol 95%. Karena kebanyakan golongan senyawa larut dalam pelarut tersebut. Dan sebaiknya alkohol mutlak niaga harus dihindari karena mengandung benzena yang menyerap di daerah UV pendek (Harborne, 1987). Komponen-komponen pokok dari spektrofotometer meliputi : (1) sumber tenaga radiasi yang stabil, (2) sistem yang terdiri atas lensa-lensa, cermin, celahcelah, dan lain-lain, (3) monokromator untuk mengubah radiasi menjadi komponen-komponen panjang gelombang tunggal, (4) tempat cuplikan yang transparan, dan (5) detektor radiasi yang dihubungkan dengan sistem meter atau pencatat (Sastrohamidjojo, 2001). Dari spektrum serapan maka identifikasi suatu senyawa dapat dilakukan sebagai berikut: PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 1. Membandingkan panjang gelombang (λ) maksimum. Panjang gelombang pada serapan maksimum dari zat yang diperiksa dibandingkan dengan data yang dimuat di literatur, atau zat pembanding. 2. Membandingkan serapan. Serapan atau turunannya yang dinyatakan dengan daya serap, daya serap molar, atau serapan jenis E (1%,1cm) dari larutan zat yang diperiksa dibandingkan dengan data literatur atau zat pembanding. 3. Membandingkan harga resapan relatif. Disamping menetapkan panjang gelombang serapan maksimum, dihitung juga harga resapan relatif yaitu perbandingan serapan dari dua panjang gelombang serapan maksimum. 4. Membandingkan spektrun serapan. Spektrum serapan zat yang diperiksa dibandingkan dengan zat pembanding (Redja, 1980). Spektrokopi UV digunakan terbatas pada sistem-sistem terkonjugasi. Keuntungan yang selektif dari serapan UV yaitu gugus-gugus yang karakteristik dapat dikenal didalam molekul-molekul yang sangat kompleks. Glikosida saponin dapat diidentifikasi dengan menggunakan spektrofotometer UV karena dilihat dari strukturnya mempunyai ikatan rangkap terkonjugasi, sehingga glikosida saponin mempunyai pita serapan didaerah UV. Selain itu glikosida saponin juga memiliki kromofor sederhana yaitu gugus tidak jenuh kovalen yang dapat menyerap sinar tampak dan UV, hal ini disebabkan adanya transisi elektronik. Kromofor PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI digunakan pada sistem yang menyebabkan terjadinya warna pada suatu senyawa (Sastrohamidjojo, 2001 ). G. Keterangan empirik yang diharapkan Melalui penelitian ini, diharapkan dapat diketahui golongan glikosida saponin dalam herba krokot. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI BAB III METODOLOGI PENELITIAN A. Jenis dan Rancangan Penelitian Penelitian ini termasuk dalam penelitian non eksperimental, karena di dalam penelitian ini tidak dilakukan manipulasi atau intervensi terhadap subjek uji. B. Definisi Operasional 1. Tanaman krokot yang digunakan untuk penelitian ini adalah krokot yang mempunyai batang berwarna merah yang diperoleh dari sawah di Jampirejo, Temanggung, Jawa Tengah. 2. Uji saponin secara sederhana adalah uji untuk memastikan adanya glikosida saponin dengan menggunakan uji indeks buih, reaksi Lieberman-Burchard dan reaksi Salkowski. 3. Isolasi glikosida saponin adalah pengambilan glikosida saponin pada herba krokot dengan menggunakan metode KLTP. 4. Identifikasi glikosida saponin secara kualitatif dilakukan dengan menggunakan metode KLT dan Spektrofotometri UV. C. Bahan dan Alat Penelitian Bahan dan alat yang digunakan selama penelitian adalah sebagai berikut : 1. Bahan utama penelitian yaitu tumbuhan krokot yang segar diperoleh dari sawah di Jampirejo, Temanggung, Jawa Tengah, dan bahan-bahan kimia PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI dengan derajat pro analisis, produksi MERCK yaitu anisaldehida, asam sulfat, asam asetat anhidrida, etil asetat, kloroform, metanol, etanol, dan silika gel GF254. Bahan pembanding sekunder glikosida saponin yaitu buah lerak (Sapindi rarak Fructus). 2. Alat penelitian Alat-alat gelas (Pyrex), neraca analitik (Metler Toledo), oven, seperangkat alat refluks, Rotary vacuum evaporator ( Janke & Kunkel RV 05-ST), sintered glass, waterbath, pipet mikroliter, seperangkat alat KLT dan KLTP, seperangkat alat spektrofotometer ultra violet (Genesis TM 6), alat fotografi. D. Tahapan Penelitian Penelitian dilakukan dengan tahap-tahap sebagai berikut: 1. Determinasi tanaman krokot. Determinasi dilakukan menggunakan buku acuan determinasi menurut Van Stennis (1992). 2. Persiapan bahan Persiapan yang dilakukan meliputi, pengumpulan herba, pencucian, dan perajangan. Pengumpulan herba krokot dilakukan dan diambil dari sawah di Jampirejo, Temanggung pada bulan Febuari 2006. Pada penelitian ini semua bagian tanaman dapat digunakan mulai dari akar, batang, daun dan bunga. Sebelum dilakukan penelitian, terlebih dahulu dilakukan sortasi awal yaitu memisahkan herba dari bahan asing seperti kotoran hewan, tanah, kerikil, rumput, bagian tanaman lain yang mungkin melekat atau ikut terambil pada waktu PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI pengumpulan herba krokot, dan juga bahan pengotor lain yang akan mengacaukan penelitian dan mempengaruhi hasil penelitian. Setelah itu herba krokot dicuci dengan air mengalir agar kotoran yang sudah lepas dari herba tidak menempel kembali sehingga herba yang akan digunakan benar-benar bersih. Herba yang sudah dicuci dengan air mengalir dirajang halus untuk memperoleh ukuran herba yang lebih kecil. 3. Pemeriksaan organoleptik dan makroskopik Pemeriksaan organoleptik dan makroskopik dilakukan berdasarkan pengamatan terhadap rasa, warna, bau, dan bentuk herba krokot. Pemeriksaan ini diharapkan dapat memberikan informasi mengenai ciri khas yang dapat digunakan untuk pengenalan terhadap tanaman krokot. 4. Uji pendahuluan a. Uji indeks buih Sebanyak 500 mg herba segar yang akan diperiksa, dihancurkan, kemudian dimasukkan dalam tabung reaksi, ditambahkan air kemudian dikocok kuat-kuat selama 10 detik. Terbentuk buih yang mantap selama tidak kurang dari 10 menit (Anonim,1995). b. Reaksi Lieberman- Burchard Diambil sebanyak 3 mg bahan (herba segar yang sudah dihancurkan), dipanasi dengan 1 ml asam asetat anhidrida lalu ditetesi dengan asam sulfat pekat 2 tetes, jika terbentuk warna hijau biru menandakan adanya senyawa steroid dan jika terbentuk warna merah muda sampai merah menandakan adanya senyawa triterpenoid (Bruneton,1999). PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI c. Reaksi Salkowski Sebanyak 3 mg krokot yang sudah dihancurkan, ditambah kloroform, kemudian ditambahkan 2 ml asam sulfat pekat. Apabila terbentuk warna kuning yang lama-kelamaan berubah menjadi merah tua membuktikan adanya senyawa triterpenoid (Paech and Tracey,1955). 5. Penyarian glikosida saponin dari herba krokot dan buah lerak (Sapindi rarak Fructus) yang digunakan sebagai pembanding. Sebanyak 20 gram herba krokot diekstraksi menggunakan pemanasan dengan refluks selama 10 menit dengan 50ml etanol 70%. Kemudian filtrat yang didapat diuapkan. Lalu 25-40 μl dari fraksi etanol tersebut digunakan untuk Kromatografi Lapis Tipis (Wagner, 1984). Sebanyak 2 gram buah lerak diekstraksi menggunakan pemanasan dengan refluks selama 10 menit dengan 10ml etanol 70%. Kemudian filtrat yang didapat diuapkan. Lalu 25-40 μl dari fraksi etanol tersebut digunakan sebagai pembanding pada uji Kromatografi Lapis Tipis (Wagner, 1984). 6. Pemeriksaan pendahuluan glikosida saponin dengan KLT Pemisahan dengan metode KLT ini menggunakan fase diam silika gel GF254 dan fase gerak etil asetat, metanol, air (100:16,5:13,5 v/v). Pada titik pertama lempeng ditotolkan ekstrak etanol buah lerak (pembanding) sebanyak 25 μl dan pada titik kedua ditotolkan ekstrak etanol herba krokot dengan jumlah yang sama. Jarak penotolan 1,5 cm dari tepi bawah lempeng dengan jarak pengembangan 10 cm. Setelah elusi mencapai batas tersebut, lempeng diangkat dan dikeringkan di udara selama 10 menit, lalu diamati dengan sinar tampak, dibawah lampu UV 254 nm dan 365 nm. Kemudian, disemprot dengan pereaksi anisaldehida-asam sulfat PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI LP, dipanaskan pada suhu 1100C selama 5-10 menit lalu diamati dengan sinar tampak. 7. Isolasi glikosida saponin herba krokot dengan metode KLT Preparatif Isolasi atau pemisahan glikosida saponin dari senyawa-senyawa lain dilakukan dengan metode Kromatografi Lapis Tipis Preparatif (KLTP). Tebal penjerap yang digunakan adalah 0,6 mm dengan ukuran pelat kaca 15 x 10 cm. Metode ini menggunakan fase diam silika gel GF254 dan fase geraknya adalah etil asetat, metanol, air (100:16,5:13,5 v/v). Ekstrak etanol dari herba krokot ditotolkan berupa pita atau garis di pelat KLTP dengan menggunakan pipet mikroliter 5µl. Jumlah totolan pada satu baris ada 10 totolan. Jumlah cuplikan yang ditotolkan adalah 25µl tiap totolan. Karena jika jumlah cuplikan yang ditotolkan terlalu sedikit dikhawatirkan bercak yang timbul sulit diidentifikasi karena kurang tebal. Setelah dikembangkan dengan menggunakan fase geraknya, dilihat pada sinar UV 254nm dan 365nm. Pita penjerap yang diperkirakan mengandung glikosida saponin dikerok. Hasil kerokannya dikumpulkan untuk kemudian dilarutkan dengan etanol Pa dan disaring dengan sintered glass. Hasil yang diperoleh diuapkan sampai kering. Kemudian dihitung bobot keringnya. Filtrat yang diperoleh itu diperkirakan isolat glikosida saponin. Filtrat yang merupakan isolat glikosida saponin herba krokot kemudian diuji kemurniannya dengan KLT multi eluen dan diidentifikasi dengan spektrofotometri ultra violet. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 8. Pemeriksaan kemurnian dengan metode KLT multi eluen Uji kemurnian dengan metode KLT multi eluen pada penelitian ini menggunakan silika gel GF254 sebagai fase diam dan menggunakan 3 fase gerak yang berbeda. Ketiga fase gerak yang digunakan adalah : 1. etil asetat, metanol, air dengan perbandingan volume 100:16,5:13,5 v/v. 2. kloroform, metanol dengan perbandingan volume 95 : 5 v/v. 3. kloroform, metanol, air dengan perbandingan volume 70: 30: 4 v/v Pada lempeng ditotolkan isolat glikosida saponin yang sebelumnya telah dilarutkan dengan etanol. Cuplikan ditotolkan sebanyak 50 µl dengan jarak 1,5 cm dari tepi bawah lempeng. Selanjutnya ketiga lempeng dielusi dengan ketiga fase gerak tersebut dalam bejana yang sudah dijenuhkan dengan batas elusi 10 cm. Setelah elusi mencapai batas tersebut, lempeng diangkat dan dikeringkan di udara selama 10 menit, lalu diamati dengan sinar tampak, dibawah lampu UV 254 nm dan 365 nm. Selanjutnya disemprot dengan pereaksi anisaldehida-asam sulfat LP, dipanaskan pada suhu 1100 C selama 5-10 menit lalu diamati dengan sinar tampak. 9 Spektrofotometri Ultra Violet (UV) Isolat yang berisi glikosida saponin herba krokot diencerkan dengan etanol sesuai dengan kadar pengenceran yang di butuhkan, larutan ini kemudian dibaca serapannya dengan spektrofotometer UV pada panjang gelombang 200-350 nm. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI E. Tata Cara Analisis Hasil Data yang telah diperoleh berupa data kualitatif dan akan dipaparkan secara eksploratif deskriptif. Analisis kandungan kimia herba krokot, dalam hal ini untuk mengetahui golongan glikosida saponin dilakukan dengan cara uji pendahuluan yang berupa uji indeks buih dan reaksi warna (reaksi Liebermann-Burchard dan reaksi Salkowski). Selain itu untuk analisis golongan glikosida saponin pada herba krokot dilakukan juga KLT, dengan cara membandingkan warna bercak dan hRf dari ekstrak herba krokot dan ekstrak buah lerak (yang digunakan sebagai pembanding ) secara kualitatif. Isolasi glikosida saponin herba krokot dilakukan dengan metode KLT preparatif, sedangkan uji kemurnian isolat dengan menggunakan metode KLT multi eluen. Analisis hasil KLT multieluen dilihat dari kromatogramnya yang hanya menghasilkan satu macam bercak. Untuk menambah data dilakukan juga analisis secara kualitatif dengan menggunakan spektrofotometri UV untuk melihat identitas dari isolat. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI BAB IV HASIL DAN PEMBAHASAN A. Determinasi Tanaman krokot yang akan digunakan dalam penelitian ini dideterminasi terlebih dahulu. Determinasi tanaman dilakukan untuk memastikan bahwa tanaman yang diteliti sesuai dengan yang dimaksud sehingga tidak terjadi kekeliruan pada jenis tanaman yang digunakan dalam penelitian ini. Determinasi dilakukan menggunakan buku acuan determinasi menurut Van Stennis (1992). Berdasarkan hasil determinasi dapat disimpulkan bahwa tanaman yang digunakan dalam penelitian ini benar yaitu Portulaca oleracea L. (krokot) (lampiran 1). B. Persiapan bahan Tanaman krokot yang digunakan sebagai bahan penelitian diambil di daerah sawah karena tanaman krokot merupakan tanaman liar berupa gulma yang biasanya banyak tumbuh di daerah sawah (lampiran 2). Herba yang digunakan pada penelitian ini digunakan herba segar, dengan alasan bahwa herba krokot sulit untuk dikeringkan karena mengandung banyak air. Jika dipaksakan dikeringkan maka herba tersebut justru akan busuk. Untuk itu lebih dipilih menggunakan herba segar untuk penelitian ini, walaupun bahan yang digunakan menjadi semakin banyak dibandingkan jika menggunakan herba kering. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Herba krokot dirajang halus dimaksudkan untuk memperkecil ukuran diameter herba, agar luas permukaan herba yang kontak dengan pelarut semakin besar sehingga zat aktif atau senyawa aktif yang terlarut dalam pelarut lebih banyak. C. Hasil Pemeriksaan Organoleptik dan Makroskopik Pemeriksaan organoleptik dan makroskopik herba krokot dilakukan berdasarkan pengamatan terhadap bentuk, rasa, warna, dan bau dari herba tersebut. Dari hasil pemeriksaan didapat hasil: Rasa : asam agak sepet Warna : akar berwarna coklat ; batang berwarna coklat ungu kemerahan ; daun berwarna hijau tua bunga berwarna kuning. Bau : baunya seperti sayuran pada umumnya Bentuk : daun berbentuk bundar telur ; bunga berkelompok, keluar dari ujung-ujung cabang ; mahkota bunga kecil, berjumlah 5 ; batang merebah, bentuk bulat, lunak dan berair, tidak berkayu. D. Uji pendahuluan 1. Uji indeks buih Dari uji tersebut dihasilkan data bahwa setelah dibiarkan lebih kurang 10 menit buih mencapai tinggi lebih kurang 5 cm. Hal tersebut menunjukkan bahwa herba krokot mengandung saponin. Hasil uji yang diperoleh tersebut sudah sesuai dengan ketentuan yang digunakan sebagai panduan (Anonim,1995) yaitu PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI terbentuknya buih yang mantap selama tidak kurang dari 10 menit. Dapat terbentuk buih dikarenakan oleh sifat saponin yang dapat menurunkan tegangan permukaan air. Seperti sabun atau detergen, saponin mempunyai molekul besar yang mengandung gugus hidrofilik dan lipofilik (hidrofobik). Dalam air, molekul saponin mensejajarkan atau meluruskan diri secara vertikal pada permukaannya, dengan gugus lipofilik (hidrofobik) menjauhi air (gambar 2 ). k i ofil li p s u g gu 29 30 20 21 19 gu g u E s hi 12 drof 22 il ik 18 13 17 28 11 C COO H D 25 9 14 16 gugus hidrofilik 26 15 1 R1 8 2 10 A B 27 3 7 5 O 4 6 H H OH H 23 R2 24 O H H Gambar 2. Mekanisme terbentuknya buih Dengan adanya air, gugus hidrofil akan berikatan dengan air sedangkan gugus hidrofob akan menjauhi air atau mengarah ke atas (udara). Bagian polar (hidrofil) dapat bergabung dengan molekul air, tetapi bagian nonpolar (hidrofob) ditolak karena gaya adhesif yang dapat terjadi dengan air lebih kecil dibandingkan dengan gaya kohesif antara molekul-molekul air. Akibatnya zat tersebut diadsorpsi pada antarmuka air-udara (Martin,1993) ( gambar 3 ). PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Gambar 3. Adsorpsi molekul-molekul saponin padabatas antar permukaan air-udara. Adsorpsi molekul saponin pada permukaan air dapat mengakibatkan penurunan tegangan permukaan air yang dapat menimbulkan buih. Buih merupakan suatu struktur yang relatif stabil yang terdiri dari kantong-kantong udara terbungkus dalam lapisan tipis cairan, dispersi gas dalam cairan yang distabilkan oleh suatu zat penurun tegangan permukaan. Dengan adanya alasan ini saponin diklasifikasikan sebagai zat penurun tegangan permukaan (Mills,2000). 2. Reaksi Liebermann-Burchard Uji reaksi ini dilakukan untuk membuktikan ada tidaknya senyawa triterpenoid atau steroid dalam herba krokot. Karena reaksi ini positif dengan kebanyakan triterpenoid dan steroid. Hasil dari uji reaksi ini menunjukkan bahwa herba krokot mengandung senyawa triterpenoid, karena setelah dipanasi dengan asam asetat anhidrat sebagai pereaksi menghasilkan warna kuning kecoklatan yang berubah menjadi merah keunguan setelah ditetesi dengan asam sulfat yang berfungsi sebagai oksidator (gambar 4 ). PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 29 30 20 21 19 E 12 22 18 13 17 28 11 C H 2SO 4 COO H D 25 9 14 16 26 + (CH 3 CO)2O 15 1 R1 8 2 10 A 27 B 3 7 5 4 6 OH H 23 24 R2 Asam asetat anhidrat Glikosida saponin triterpenoid 29 30 20 21 19 E 12 22 18 13 17 28 11 C COOH D CH 3 COOH 25 9 14 16 + 26 15 1 R1 8 2 10 A B 27 3 7 5 4 6 H CH3 COO 23 24 R2 Glikosida saponin triterpenoid ( Warna merah keunguan ) Gambar 4. Reaksi Liebermann-Burchard Dimana R1 dan R2 , merupakan rantai samping dari struktur saponin triterpenoid yang biasanya berbeda satu sama lain tergantung jenisnya. Misalnya Hederagenin : R1 = H , R2 = CH2OH Gypsogenin : R1 = H , R2 = CHO Asam oleat : R1 = H , R2 = CH3 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Reaksi Salkowski 3. Reaksi warna lain yang digunakan adalah reaksi Salkowski. Reaksi ini untuk menentukan atau mempertegas bahwa senyawa yang terdapat dalam herba krokot adalah triterpenoid. Hal tersebut dapat dilihat dari hasil positif adanya warna kuning kecoklatan yang lama-kelamaan berubah menjadi merah tua setelah ditambah dengan asam sulfat pekat. Kloroform digunakan sebagai pelarut, karena aglikon yang terdapat dalam herba krokot larut dalam kloroform. Sedangkan asam sulfat pekat yang ditambahkan digunakan sebagai katalis dalam reaksi tersebut. Dari warna yang terbentuk herba krokot mengandung saponin golongan triterpenoid (gambar 5). 29 30 20 21 19 E 12 22 18 13 17 28 11 C COO H D 25 9 14 16 + H 2 SO 4 26 15 -H + 1 R1 8 2 10 A B 27 3 7 5 4 6 OH H 23 24 R2 Glikosida saponin triterpenoid 29 30 20 21 19 E 12 22 18 13 17 28 11 C COO H D 25 9 14 16 26 15 1 R1 8 2 10 A B 3 27 7 5 4 6 H O 23 24 R2 Glikosida saponin triterpenoid ( warna merah tua ) Gambar 5. Reaksi Salkowski PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Dari hasil uji pendahuluan ini dapat disimpulkan bahwa senyawa ini merupakan saponin jenis triterpenoid (lampiran 3). E. Penyarian Senyawa Glikosida Saponin Pelarut polar yang digunakan pada proses penyarian ini adalah etanol 70%. Digunakan pelarut etanol karena kedua jenis saponin (triterpenoid dan steroid) larut dalam air dan etanol (Robinson,1995). Penyarian glikosida saponin dalam penelitian ini menggunakan cara penyarian digesti. Digesti merupakan cara maserasi yang dimodifikasi, yaitu dengan menggunakan pemanasan. Cara ini hanya dapat dilakukan untuk simplisia yang zat aktifnya tahan terhadap pemanasan (Anonim,1986). Prinsip dasar dari penyarian yang dilakukan yaitu pemanasan pada bahan herba segar krokot di dalam pelarut etanol 70% selama 10 menit setelah suhu pemanasan dicapai yaitu 0 sekitar 78 C. Digunakan pemanasan dalam penyarian ini, karena sifat saponin yang tahan terhadap pemanasan. Dilihat dari strukturnya yang rigid dan planar maka saponin bersifat sangat stabil dalam keadaan apapun. Herba krokot yang digunakan untuk penyarian ini sebanyak 20 gram di dalam cairan penyari (etanol 70%) sebanyak 50 ml. Ekstrak yang diperoleh dari proses penyarian disaring dan dikumpulkan, kemudian diuapkan di atas waterbath untuk memperoleh ekstrak etanol herba krokot yang lebih pekat sebanyak 5 ml yang akan digunakan untuk proses penelitian lebih lanjut. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI F. Pemeriksaan Pendahuluan Glikosida Saponin dengan KLT Pemeriksaan glikosida saponin pada herba krokot dilakukan untuk mengetahui saponin jenis apa yang terkandung di dalam ekstrak etanol herba krokot. Hal tersebut dapat ditentukan berdasarkan harga hRf dan warna bercak yang ditimbulkan dibandingkan dengan pembanding yang digunakan. Pembanding sekunder yang digunakan disini adalah buah lerak, digunakan pembanding tersebut karena sesuai dengan penelitian yang lalu bahwa buah lerak mengandung saponin triterpenoid golongan β-amirin (Yanuarsih, 2001). Hal tersebut diperkuat dengan adanya jurnal yang menyebutkan bahwa buah lerak mengandung sekitar 12% saponin triterpenoid (Siti,1998). Fase diam yang digunakan adalah silika gel GF254 dan fase gerak yang digunakan dalam penelitian ini adalah etil asetat, metanol, air (100:16,5:13,5 v/v) yang bersifat non polar. Sehingga KLT pada penelitian ini termasuk kromatografi fase normal, karena fase diam bersifat polar dan fase gerak bersifat non polar (tabel 1, gambar 6). PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Tabel I . Hasil kromatogram KLT pendahuluan dengan menggunakan fase diam silika gel GF245 dan fase gerak etil asetat, metanol, air (100:16,5:13,5 v/v) Warna bercak No Nama bercak hRf bercak A1 UV254nm UV365nm hijau kuning muda terang 10 Sinar tampak (deteksi anisaldehide-asam sulfat) ungu tua A2 28 kuning kelabu ungu coklat A3 42 hijau kelabu Ungu biru A4 55 hijau kelabu hijau A5 89 hijau kelabu hijau keunguan B1 11 kelabu kuning A (Pembanding) merah muda hijau B B2 38 kelabu coklat terang (Sampel) merah B3 51 hijau hijau orange B4 89 hijau kelabu Keterangan : A (pembanding) = ekstrak etanol buah lerak B (sampel) = ekstrak etanol herba krokot hijau keunguan PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Gambar 6. Hasil kromatogram KLT pendahuluan denganmenggunakan fase diam silika gel GF245 dan fase gerak etil asetat, metanol, air (100:16,5:13,5 v/v), dengan deteksi pereaksi anisaldehid-asam sulfat dipanaskan pada suhu 1100C selama 5 – 10 menit Keterangan gambar : A = ekstrak etanol buah lerak B = ekstrak etanol herba krokot PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Dari hasil kromarogram dapat dilihat bahwa terdapat 5 bercak yang berasal dari cuplikan pembanding (ekstrak buah lerak) dan 4 bercak dari cuplikan sampel (ekstrak herba krokot). Dari bercak tersebut terdapat 2 bercak yang mempunyai harga hRf dan warna bercak yang hampir sama. Bercak tersebut adalah bercak A4 dan B3, begitu juga dengan kedua bercak dari A5 dan B4. Dari tabel dapat dilihat untuk bercak A4 dan B3, mempunyai hRf 55 dan 51 dengan warna bercak setelah disemprot dengan pereaksi anisaldehid-asam sulfat dan dipanaskan 1100C selama 5-10 menit, keduanya menghasilkan warna hijau. Begitu juga dengan bercak A5 dan B4, mempunyai hRf 89 dengan warna bercak setelah disemprot dengan pereaksi anisaldehid-asam sulfat dan dipanaskan 1100C selama 5-10 menit, keduanya menghasilkan warna hijau keunguan. Warna tampak meredam pada sinar UV 254 yang berarti bahwa terdapat gugus kromofor dan ikatan rangkap terkonjugasi atau cincin aromatik jenis apa saja pada senyawa tersebut. Sebenarnya tidak ada saponin yang dapat dideteksi atau diamati secara spesifik dengan menggunakan sinar lampu UV 254 dan 365 nm, kecuali asam glycyrrhetic (Wagner, 1984). Jadi untuk memperjelas identifikasi saponin harus menggunakan pereaksi semprot seperti anisaldehidasam sulfat. Digunakan pereaksi tersebut karena berdasarkan dari hasil orientasi yang dapat menunjukkan intensitas warna yang lebih baik (gambar 7). PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI H + + HSO 4 - H2SO 4 29 30 20 21 19 OCH3 E 12 22 18 13 17 28 11 C H+ COOH D + 25 9 14 16 26 15 1 R1 8 2 10 A 27 B C 3 7 5 4 6 OH H O- 23 H 24 R2 Saponin triterpenoid anisaldehid 29 30 20 OCH3 21 19 E 12 22 18 13 17 28 11 C COOH + D 25 9 14 16 26 15 1 R1 +C 8 2 10 A 27 B 3 7 5 4 6 H OH OH H 23 R2 24 29 30 20 21 19 E 12 22 -H+ 18 13 17 28 11 C COOH D 25 9 OCH3 14 16 26 OH 15 1 R1 8 2 10 A B 3 6 O C H 23 24 R2 H H 27 7 5 4 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 29 30 20 21 19 E 12 22 18 13 17 28 11 C CO OH D 25 9 14 OCH 3 16 26 15 OH 1 R1 8 2 10 A B 27 3 7 5 4 6 O C H 23 [O ] 24 R2 H 29 30 20 21 19 E 12 22 18 13 17 28 11 C C OOH D 25 9 14 16 + OCH 3 H2 26 15 1 O R1 8 2 10 A 27 B 3 7 5 4 6 O C H 23 24 R2 warna hijau Gambar 7. Reaksi antara saponin triterpenoid dengan deteksi anisaldehid-asam sulfat Disimpulkan bahwa bercak B3 dan B4 merupakan glikosida saponin triterpenoid dilihat dari hasil hRf dan warna bercak yang hampir mirip dengan pembanding. Hal tersebut ditunjang juga dengan adanya literatur, yang menyatakan bahwa glikosida saponin triterpenoid memiliki rentang hRf sekitar 50-89 (Stahl, 1973). Selain itu dari hasil penelitian sebelumnya tentang aglikon saponin yang menyatakan bahwa hRf saponin triterpenoid golongan β-amirin sekitar 55 dengan warna hijau setelah dideteksi dengan anisaldehid-asam sulfat (Yanuarsih, 2001). Bercak tersebut diyakini sebagai saponin triterpenoid dan bukannya saponin steroid, karena dari literatur disebutkan bahwa saponin steroid PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI mempunyai hRf pada rentang 60-69, 83-87 yang dengan pereaksi asam kebanyakan menghasilkan warna kuning (Tarigan,1980). G. Isolasi Glikosida Saponin Herba Krokot dengan Metode KLT Preparatif Ekstrak etanol glikosida saponin di isolasi secara KLTP untuk mendapatkan jumlah yang memadai yang nantinya digunakan untuk analisis saponin tahap selanjutnya. Digunakan metode isolasi secara KLTP, karena merupakan cara yang baik jika dikerjakan dengan benar dan tepat. Isolasi dilakukan dengan menggunakan fase diam silika gel GF254 dan fase gerak etil asetat, metanol, air (100:16,5:13,5 v/v), karena pada KLT sebelumnya menghasilkan bercak dengan pemisahan yang lebih baik secara visibel, dibawah sinar UV 365 dan UV 254 dan setelah disemprot dengan deteksi. Cuplikan yang akan dipisahkan ditotolkan pada pelat dan dikembangkan secara tegak lurus pada pita penotolan cuplikan sehingga campuran akan terpisah menjadi beberapa pita. Jumlah cuplikan yang ditotolkan adalah 25µl tiap totolan. Karena jika jumlah cuplikan yang ditotolkan terlalu sedikit dikhawatirkan bercak yang timbul sulit diidentifikasi karena kurang tebal. Pemisahan dari KLTP ini menghasilkan 4 bercak berupa pita dengan hRf 18, 24, 51, 79 dilihat pada sinar UV 254nm dan 365nm. Untuk analisis lebih lanjut diambil 2 bercak pada hRf 51 dan 79 yang memiliki intensitas warna lebih kuat dan diprediksi sebagai saponin karena mendekati nilai hRf pada KLT pendahuluan. Hasil KLTP orientasi dapat dilihat pada kromatogram (Tabel II dan gambar 8). PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Tabel II . Hasil kromatogram KLTP dengan menggunakan fase diam silica gel GF245 dan fase gerak etil asetat, metanol, air (100:16,5:13,5 v/v), dengan 0 deteksi pereaksi anisaldehid-asam sulfat dipanaskan pada suhu 110 C selama 5 – 10 menit. Warna bercak Nama bercak B (sampel) Keterangan : No hRf bercak B1 18 B2 B3 B4 24 51 79 UV 254 nm Merah muda kelabu hijau hijau UV 365 nm Sinar tampak (deteksi Anisaldehid-Asam sulfat) kelabu orange kelabu kelabu kelabu Ungu keabu-abuan Hijau tua Hijau keunguan B (sampel) = ekstrak etanol herba krokot Gambar 8. Hasil kromatogram KLTP sampel (ekstrak etanol herba krokot) dengan menggunakan fase diam silica gel GF245 dan fase gerak etil asetat, metanol, air (100:16,5:13,5 v/v), dengan deteksi pereaksi anisaldehid 0 asam sulfat dipanaskan pada suhu 110 C selama 5 – 10 menit. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Dari hasil kromatogram tersebut yang dikerok adalah bercak B3 dan B4 dengan intensitas warna hijau dilihat pada UV 254 nm. Hal tersebut sesuai dari hasil KLT pendahuluan yang diprediksi merupakan saponin. Maka untuk analisis lebih lanjut, untuk bercak B3 diberi nama isolat 1 dan untuk bercak B4 diberi nama isolat 2. Kedua bercak yang membentuk pita tersebut dikerok dan dilarutkan dalam etanol. Setelah dilarutkan dengan etanol, kedua isolat tersebut diuapkan untuk memperoleh bobot keringnya. Dari 10 lempeng KLTP yang dilakukan diperoleh hasil (tabel III). Tabel III . Hasil isolat glikosida saponin yang diperoleh dari KLTP Nama isolat Berat isolat kering Isolat 1 6,8 mg Isolat 2 3,2 mg Dari hasil bobot kering yang diperoleh, dapat diprediksi bahwa dari 2,5 ml (2500μl) ekstrak etanol herba krokot mengandung 10 mg (6,8mg + 3,2mg) glikosida saponin triterpenoid. Walaupun harga tersebut tidak mutlak sepenuhnya, karena tidak bisa dipastikan. Isolat 1 dibuat konsentrasi 0,2 % sedangkan untuk isolat 2 dibuat konsentrasi 0,1%. Konsentrasi isolat dibuat demikian dengan pertimbangan agar jumlah kedua isolat tersebut cukup untuk digunakan analisis lebih lanjut. Selanjutnya dari hasil isolat 1 dan 2 masing-masing dianalisis untuk uji kemurnian dengan menggunakan metode KLT multi eluen. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI H. Pemeriksaan Kemurnian dengan Metode KLT multi eluen Uji kemurnian ini dilakukan untuk memastikan apakah senyawa yang telah dipisahkan benar-benar murni hasil dari isolasi senyawa yang diinginkan, dan tidak tercampur dengan senyawa lain. Masing-masing isolat 1 dan 2 diuji kemurniannya dengan 3 macam fase gerak yang berbeda, jika isolat tersebut murni dari 1 senyawa maka hanya akan menimbulkan satu macam bercak. Pemilihan 3 fase gerak tersebut berdasarkan dari sifat saponin yang bersifat polar, maka agar dapat mengelusi saponin dengan baik digunakan fase gerak yang bersifat lebih non polar. Ketiga macam fase gerak yang digunakan tersebut juga sesuai dengan literatur yang ada, yang pernah diterapkan sebelumnya (Wagner,1984). Masing-masing isolat ditotolkan sejumlah 50 µl, karena jumlah tersebut dapat menghasilkan intensitas warna bercak yang cukup jelas sehingga mudah dalam identifikasinya (tabel IV dan gambar 9,10,11,12). PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Tabel IV. Hasil kromatogram KLTmultieluen dengan menggunakan fase diam silica gel GF245 dengan deteksi pereaksi anisaldehid-asam sulfat dipanaskan pada suhu 1100C selama 5 – 10 menit Warna bercak Nama Sinar tampak (deteksi No Fase gerak hRf isolat Anisaldehid -Asam 254 nm 365 nm sulfat) Hijau etil asetat,metanol,air 85 1 Ungu muda kuning Ungu kemerahan (100:16,5:13,5 v/v) terang Hijau Kloroform,metanol 2 81 Ungu Ungu muda kuning ISOLAT (95 : 5 v/v) 1 terang Hijau Kloroform,metanol, 3 83 Ungu Ungu muda kuning air (70: 30: 4 v/v) terang Hijau Ungu etil asetat,metanol,air 1 83 Ungu kemerahan kuning (100:16,5:13,5 v/v) muda terang Hijau Kloroform,metanol 2 Ungu 82 Ungu kemerahan kuning ISOLAT (95 : 5 v/v) muda 2 terang Hijau Kloroform,metanol, 3 Ungu 81 Ungu kemerahan kuning air (70: 30: 4 v/v) muda terang PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 1 2 Gambar 9. Hasil kromatogram KLTmulti eluen isolat 1 dengan menggunakan fase diam silica gel GF245 dengan deteksi pereaksi anisaldehid0 asam sulfat dipanaskan pada suhu 110 C selama 5 – 10 menit Keterangan gambar : 1 = isolat 1 dengan fase gerak etil asetat, metanol, air (100:16,5:13,5 v/v) 2 = isolat 1 dengan fase gerak kloroform, metanol (95 : 5 v/v) PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 3 Gambar 10. Hasil kromatogram KLT multi eluen isolat 1 dengan menggunakan fase diam silica gel GF245 dengan deteksi pereaksi anisaldehid-asam sulfat dipanaskan pada suhu 1100C selama 5 – 10 menit Keterangan gambar : 3 = isolat 1 dengan fase gerak kloroform, metanol, air (70: 30: 4 v/v) PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 1 Gambar11. 2 Hasil kromatogram KLTmulti eluen isolat 2 dengan menggunakan fase diam silica gel GF245 dengan deteksi 0 pereaksi anisaldehid-asam sulfat dipanaskan pada suhu 110 C selama 5 – 10 menit Keterangan gambar : 1 = isolat 2 dengan fase gerak etil asetat, metanol, air (100:16,5:13,5 v/v) 2 = isolat 2 dengan fase gerak kloroform, metanol (95 : 5 v/v) PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI 3 Gambar12.Hasil kromatogram KLTmulti eluen isolat 2 dengan menggunakan fase diam silica gel GF245 dengan deteksi pereaksi anisaldehidasam sulfat dipanaskan pada suhu 100C selama 5 – 10 menit Keterangan gambar : 3 = isolat 2 dengan fase gerak kloroform, metanol, air (70: 30: 4 v/v) PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Dari hasil KLT multi eluen tersebut dapat dilihat bahwa, dari kedua isolat tersebut sama-sama menghasilkan satu macam bercak pada kromatogramnya. Sehingga dapat disimpulkan bahwa kedua isolat tersebut merupakan senyawa murni hasil isolasi. Tetapi dari hasil kromatogram tersebut terdapat suatu kejanggalan, yaitu dari kedua isolat tersebut setelah diuji kemurniannya ternyata menghasilkan hRf dan warna bercak yang hampir mirip (setelah disemprot menggunakan pereaksi anisaldehid-asam sulfat dan dipanaskan selama 5-10 menit dan dilihat pada sinar tampak). Padahal dari hasil KLT pendahuluan dan hasil KLT preparatif kedua isolat tersebut memiliki hRf dan warna bercak yang berbeda satu sama lain, walaupun keduanya diprediksi sebagai glikosida saponin. Untuk isolat 1 , hRf dari ketiga kromatogramnya adalah 85, 81, 83 dengan warna bercak ungu, hal tersebut ternyata berbeda dengan hasil KLT pendahuluan dan KLTP yang mempunyai hRf 51 dengan warna bercak hijau. Sedangkan untuk isolat 2 , hRf ketiga kromatogram KLT multi eluen 83, 82, 81 dengan warna bercak merah keunguan., hasil tersebut hampir mirip jika dibandingkan dengan KLT pendahuluan dan KLT preparatif, yaitu hRf 89 dengan warna bercak pada sinar tampak hijau keunguan. Hasil KLT multi eluen dari isolat 1 bisa berbeda dari KLT pendahuluan, diprediksikan karena ketidakstabilan dari rantai samping yang terdapat dalam struktur kimia saponin triterpenoid. Seperti yang telah disebutkan diatas, bahwa struktur kimia saponin triterpenoid sangat rigid dan planar, sehingga dengan kondisi apapun tidak mungkin berubah. Tetapi dalam struktur kimia saponin terdapat rantai samping (R1 dan R2 ) yang berbeda-beda tergantung jenisnya. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Dengan adanya ketidakstabilan rantai samping tresebut dapat mempengaruhi hasil bercak pada KLT multi eluen. Untuk memastikan lebih dalam lagi tentang hal ini, maka perlu dilakukan penelitian lebih lanjut. Maka dari itu dapat disimpulkan, untuk isolat 2 dapat dipastikan kemurnian senyawanya dan disimpulkan bahwa isolat 2 termasuk glikosida saponin jenis triterpenoid. Sedangkan untuk isolat 1, walaupun hasilnya berbeda dari yang diprediksikan tetapi dapat dipastikan kemurniannya dan kemungkinan termasuk glikosida saponin jenis triterpenoid. Karena hasil dari uji kemurnian isolat 1 hampir mirip dengan hasil isolat 2, dilihat dari hRf dan warna bercaknya. I. Spektrofotometri Ultra Violet (UV) Pemeriksaan spektra dengan spektrofotometer UV ini dilakukan untuk melihat identitas atau pencirian dari kedua isolat, yaitu dengan cara melihat panjang gelombang (λ) maksimum dari isolat 1 dan isolat 2 dan bentuk spektra yang dihasilkan dari kedua isolat. Dari hasil KLT pendahuluan dan KLTP, warna bercak dan hRf nya berbeda dari hasil KLT multi eluen, sehingga pemeriksaan spektra ini dilakukan untuk memastikan apakah kedua isolat tersebut merupakan jenis senyawa yang sama. Pemeriksaan spektra dengan spektrofotometer UV ini dilakukan pada panjang gelombang 200 – 350 nm karena senyawa tersebut tidak berwarna. Blangko yang digunakan adalah etanol, yang disesuaikan dengan pelarut senyawanya. Etanol memenuhi persyaratan pelarut untuk spektrofotometri UV, yaitu tidak mengandung sistem ikatan rangkap terkonjugasi, tidak terjadi interaksi PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI dengan molekul senyawa yang dianalisis, dan kemurnian atau derajat untuk analisisnya tinggi. Hasil spektra isolat 1 menunjukkan puncak tunggal pada panjang gelombang 224 nm. Untuk isolat 2 menunjukkan puncak tunggal pada panjang gelombang 221 nm. Dilihat dari selisih panjang gelombang isolat 1 dan isolat 2 sebesar 3 nm (masih dalam batas toleransi), dan bentuk spektra kedua isolat yang hampir mirip, maka dapat dikatakan bahwa isolat 1 dan isolat 2 merupakan dua jenis senyawa yang sama. Sehingga disimpulkan kedua isolat tersebut merupakan senyawa golongan saponin triterpenoid (gambar 13, 14). Dari jurnal yang diperoleh, disebutkan bahwa absorbansi maksimum isolat triterpenoid dalam tumbuhan krokot pada panjang gelombang 209,0 nm (Efendi, 1995). Hasil spektra panjang gelombang maksimum tersebut berbeda dengan hasil spektra panjang gelombang maksimum yang diperoleh dari penelitian ini (221 nm dan 224 nm). Hal tersebut dikarenakan dalam jurnal tersebut hanya mencantumkan hasil absorbansi maksimum isolat triterpenoid secara umum dan bukannya saponin triterpenoid. Selain itu penelitian dalam jurnal tersebut menggunakan pelarut yang berbeda dengan yang digunakan dalam penelitian ini. Dalam penelitian ini menggunakan pelarut etanol yang bersifat lebih polar, sedangkan penelitian yang disebutkan dalam jurnal tersebut menggunakan pelarut eter minyak tanah yang bersifat lebih nonpolar. Polaritas semakin tinggi maka akan mempengaruhi bentuk, intensitas, dan letak serapan maksimum dari spektrum peresapan suatu zat (Redja,1980). Spektrofotometri UV merupakan metode yang spesifik dan sensitif, sehingga dengan adanya perbedaan pelarut, PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI kadar larutan, tebal larutan, kalibrasi alat, dan lain sebagainya akan dapat menyebabkan perbedaan panjang gelombang maksimum yang didapat (Redja,1980). Isolat 1 dengan konsentrasi 0,02% menunjukkan puncak tunggal dengan panjang gelombang maksimum (224 nm) dengan absorbansi sekitar 0,7. Sedangkan untuk isolat 2 dengan konsentrasi 0,01% baru dapat menunjukkan puncak tunggal gelombang maksimum (221 nm) dengan absorbansi sekitar 0,8. Adanya perbedaan konsentrasi dan absorbansi yang diperoleh dikarenakan perbedaan kandungan senyawa yang terkandung di dalam isolat. Selain itu konsentrasi yang digunakan untuk pengukuran spektra berbeda, karena didasarkan pada perolehan absorbansi yang lebih baik jika berada pada rentang 0,2 – 0,8 (Skoog,1998). PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Gambar 13. Hasil spektra λ max isolat 1 PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Gambar 14. Hasil spektra λ max isolat 2 Untuk memastikan bahwa kedua spektra isolat tersebut memang benarbenar spektra isolat hasil isolasi yang dilakukan, dan bukannya spektra pelarut yang digunakan maka dapat dilihat bentuk spektra etanol 70% sebagai berikut : PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Gambar 15. Hasil spektra λ max. etanol 70% Bentuk spektra dan panjang gelombang maksimum dari isolat 1 dan 2, jika dibandingkan dengan bentuk spektra dan panjang gelombang maksimum dari etanol sangat berbeda, sehingga dapat dipastikan bahwa hasil spektra isolat 1 dan 2 merupakan spektra isolat murni hasil isolasi. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI BAB V KESIMPULAN DAN SARAN A. Kesimpulan Herba krokot mengandung glikosida saponin golongan triterpenoid. B. Saran 1. Perlu dilakukan penelitian lebih lanjut tentang uji stabilitas dari isolat 1 senyawa tersebut dengan menggunakan metode KLT. Dengan cara setelah isolasi, isolat diperiksa hasil kromatogramnya tiap hari dengan metode KLT. 2. Perlu dilakukan penelitian lebih lanjut untuk menentukan golongan saponin triterpenoid ( α-amirin, β-amirin, Lupeol ) yang terkandung dalam herba krokot. 3. Isolasi glikosida saponin dalam herba krokot dengan menggunakan metode lain, misal kromatografi kolom. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI DAFTAR PUSTAKA Anonim, 1986, Sediaan Galenik, 4-27, Departemen Kesehatan RI , Jakarta. Anonim, 1995, Materia Medika Indonesia, 210-215,336, Departemen Kesehatan RI, Jakarta. Brotosisworo, S, 1979, Obat Hayati Golongan Glikosida, 44-45, Fakultas Farmasi UGM, Yogyakarta. Bruneton, J, 1999, Pharmacognosy Phytochemistry Medical Plant,2nd edition, 677-680, translated by Caroline K. Halton, Intercept Ltd., New York. Djauhariya, E, 2004, Gulma Berkhasiat Obat, 96-99, Penebar Swadaya, Jakarta. Efendi, Irwan, 1995, Pemeriksaan Pendahuluan Kandungan Kimia Tumbuhan Krokot (Portulaca oleracea Linn.), Available from http://iptek.apjii.or.id/artikel/ttg tanaman_obat/depkes/buku 1/1-25 , Di akses pada 17 Desember 2006, 20:18:52 . Evans, W.C, 2002, Pharmacognosy, fifteenth edition, W.B SAUNDERS, 289299, New York. Fessenden, J.R., & Fessenden, S.J., 1986, Organic Chemistry, Third Edition, 136137, diterjemahkan oleh Aloysius Hadyana Pudjaatmaka, Ph.D, Erlangga, Jakarta. Gritter, J.R, Bobbit, J.M, Schwarting, A.E., 1985, Introduction to Chtomatography, Terbitan ke-2, diterjemahkan oleh Kosasih Padmawinata, 107-115, 141-147, ITB, Bandung. Harborne, JB, 1987, Phytochemical Methods, Terbitan kedua diterjemahkan oleh Padmawinata.K dan Soediro L, 14-15, 21-24,147-156, ITB, Bandung. Hostettmann, K, Hostettmann, M, Marston, A , 1995, Preparatif Chromatography Techniques, diterjemahkan oleh Kosasih Padmawinata, 9-11, ITB, Bandung. Martin, Alfred, Swarbrick,James, Cammarata,Arthur, 1993, Physical Pharmacy, diterjemahkan oleh Yoshita, 922-951, UI-Press, Jakarta. Mills, S, 2000, Principles and Practise of Phytoteraphy, 43-47, Churchill Livingstone, China. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI Mulja, M.H., Soeharman, 1995, Analisis Instrumental, 6-11, 26-32, 236-238, 244, Airlangga University Press, Surabaya. Paech, K and Tracey, M.V, 1995, Modern Methoden der Pflanzenanalyse, vol III, 64, Springer-Verlag, Berlin. Robinson, T, 1995, The Organic Constituent of Higher Plants, diterjemahkan oleh Kosasih Padmawinata dan Iwang Soediro, edisi VI, 156-158, ITB, Bandung. Redja, W., 1980, Teori Dasar Analisa Farmasi, Ed I, 99-102, 109, Sekolah Tinggi Laboratorium Kimia Farmasi, Departemen Kesehatan RI, Jakarta. Sastrohamidjojo, H, 2001, Spektroskopi, 11-12, 22-23, 39, Lieberty Yogyakarta, Yogyakarta. Sastrohamidjojo, H, Yogyakarta. 2002, Kromatografi, 26-36, Lieberty Yogyakarta, Siti, Nunik, 1998, Penggunaan Buah Lerak Sapindus Rarak De Candole sebagai Insektisida, Available from http://digilib.litbang.depkes.go.id , Di akses pada 17 Desember 2006, 20:36:04 . Skoog, D.A., Holler, F.J., Noeman, T.A., 1998, Principles of Instrumental Analysis, Fifth Ed., 11-14, 314-316, 329-332, Harcout Brace College, Philadelphia. Stahl, E, 1973, Drug Analisis by Chromatography, diterjemahkan oleh Kosasih Padmawinata dan Soediro L, 119-123, ITB-Press, Bandung. Tarigan, Ponis, 1980, Sapogenin Steroid, 151, Penerbit Alumni, Bandung. Van Steenis, C.G.G.J, 1992, Flora, cetakan ke-6, 34-37,48-56,182-183, PT. Pradnya Paramita, Jakarta. Wagner, H , Bladt, S, Zgainski, E.M, 1984, Plant Drug Analysis, 225-227, translated by Th.A.Scott, Springer-Verlag, Berlin. William,Dudley H, Fleming, Ian, 1980, Spectroskopic Methods in Organic Chemistry, 24-25, McGrow-Hill book company, UK. Yanuarsih, Sri Siswati, 2001, Isolasi dan Identifikasi Aglikon Saponin Herba Lerak (Sapindus rarak D.C), Skripsi Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta. PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI