BAB II TINJAUAN PUSTAKA 2.1 Biomarker pada Pneumonia
advertisement

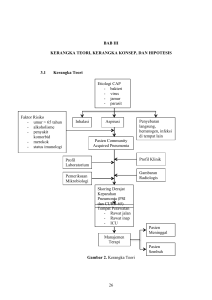
BAB II TINJAUAN PUSTAKA 2.1 Biomarker pada Pneumonia Pneumonia merupakan kumpulan gejala (demam, nyeri pleuritik, sesak nafas) dan tanda (infiltrat paru) yang berasal dari sistem pernapasan namun dapat mempengaruhi penderitanya secara sistemik (Lim dkk, 2009). Sebagai penyakit infeksi yang terjadi di parenkim paru, PK dapat menstimulasi proses inflamasi dimana terjadi pelepasan sitokin pro inflamasi dan mediator lipid ke sistemik serta menyebabkan gangguan sistem hemostasis yang ditandai dengan keadaan hiperkoagulasi (Kaplan dkk, 2003). Selain masalah morbiditas dan mortalitas yang tinggi, seringkali pneumonia tidak memberi tanda klinik yang jelas.Hal ini menimbulkan hambatan diagnosis yang akhirnya menyebabkan keterlambatan terapi (Capelastegui A dkk, 2006).Dalam suatu analisis receiving operating characteristic (ROC) yang bertujuan untuk menilai akurasi diagnostik dalam membedakan PK yang dikonfirmasi melalui radiologik dengan kondisi medik lainnya. Didapatkan kelemahan gambaran klinik (seperti: demam, batuk, produksi sputum, temuan auskultasi yang abnormal) dalam mendiagnosis PK dengan area under curve (AUC) sebesar 0,79 (Christ-Crain M dkk, 2010), (Muller B dkk, 2007). Hingga saat ini, biomarker belum memiliki definisi yang universal. Akan tetapi, biomarker dipahami sebagai suatu biomolekul yang timbul akibat suatu proses fisiologik maupun patologik. Biomarker yang ideal adalah suatu biomarker yang tidak dapat dideteksi atau yang nilainya sangat rendah dalam keadaan non inflamasi dan akan meningkat dalam keadaan inflamasi yang selanjutnya akan mengalami penurunan saat proses inflamasi mereda (Capelastegui A dkk, 2006). Dalam hal membantu tegaknya diagnosis pneumonia, beberapa biomarker telah dikenal, seperti: CRP, leukosit total, immunoglobulin, PCT dan Triggering receptor expressed on myeloid cell-1 (TREM-1). Beberapa biomarker lain yang masih dalam tahap studi untuk penggunaannya pada pneumonia antara lain: copeptin, kortisol, endotoksin dan proadrenomedullin (Capelastegui A dkk, 2006). Selain petanda inflamasi, sistem koagulasi juga dikatakan memiliki potensi dalam menilai risiko kematian penderita PK. Aktifasi sistem koagulasi dan aktifitas fibrinolisis merupakan gambaran yang dijumpai pada keadaan sepsis berat (Christ-Crain M dkk, 2010), (Mira JP dkk, 2008). 4 Universitas Sumatera Utara Dalam beberapa tahun terakhir, berbagai studi telah mencoba meneliti dalam respon host terhadap bakteri terutama terhadap aktivasi koagulasi. Respon terhadap infeksi yang memberikan dampak terhadap sistem koagulasi yang mungkin berperan adalah patogenesis disfungsi organ. Beberapa studi epidemiologi memperlihatkan bahwa gangguan yang umum pada sepsis berat akan mengaktivasikan atau menyebabkan gangguan pada sistem koagulasi (Kaplan dkk, 2003). Pneumonia yang awalnya infeksi lokal, mengakibatkan aktivasi koagulasi sistemik, ini disebabkan aktivasi lokal dari sistem koagulasi yang terjadi pada pneumonia dengan deposisi fibrin dalam kompartemen alveolar yang terinfeksi, meningkatkan permeabilitas pembuluh darah, merangsang proinflamasi sitokin dan meningkatkan akumulasi neutrophil (Milbrandt dkk,2009). Aktivasi koagulasi lokal yang muncul akan didorong terutama oleh tissue factor (Rijneveld dkk, 2006). Biasanya, sangat sedikit tissue factor yang keluar dari sirkulasi darah namun alveolar makrofag, neutrofil, dan sel endotel dapat mengeluarkan tissue factor pada permukaan dimana dapat membentuk thrombogenic tissue factor yang selanjutnya berkembang menjadi gangguan koagulasi sistemik selama infeksi paru (Abraham E dkk, 2000). Ribelles dkk (2004) mencoba menghubungkan nilai plasma D-dimer terhadap mortalitas pada 302 pasien PK. Hasilnya adalah kematian lebih banyak terjadi pada pasien dengan D-dimer yang tinggi ( 3.786 vs 1.609 ng/ml dengan p< 0,00001). Hasil ini membuka peluang untuk penelitian terhadap petanda koagulasi lainnya seperti prothrombin fragment 1.2 (PF1.2), thrombin-antithrombin complex dan fibrinogen dalam hubungannya terhadap PK. Agapakis dkk(2010) melaporkan bahwa AT-III memiliki sensitivitas 80% dan spesifisitas 75% dengan nilai cut-off 85% sedangkan DD sebagai biomarker koagulasi pada PK memiliki sensitivitas 90% dan spesifitas 78% untuk menentukan perlunya perawatan di rumah sakit. 5 Universitas Sumatera Utara 2.2 Fisiologi dan Jalur (Pathway) Koagulasi Pada Gambar 1 menunjukan jalur (pathway) koagulasi, yang terdiri dari dua jalur yakni jalur instinsik, dan jalur ekstrinsik.Dimana pada jalur insrinsik yang ditimbulkan oleh adanya fase kontak dan pembentukan kompleks activator FX. Kemudian jalur ini akan meliputi diaktifkannya F XII, F XI, F IX, F VIII, High Molecular Weight Kiminogen (HMWK), Pre Kalikrein, PF 3 (platelet factor 3) dan ion kalsium. Sedangkan pada jalur ekstrinsik terdiri dari reaksi tunggal yaitu dengan adanya ion kalsium ,faktor kalikrein dan faktor tromboplastin jaringan oleh karena adanya pembuluh darah yang luka, maka faktor VII akan teraktifasi menjadi faktor VIIa. Kemudian kedua jalur ini akan bergabung menjadi jalur bersama, yaitu faktor VIIa (jalur ekstrinsik), faktor IXa, PF3, ion Ca (jalur instrinsik) akan mengaktifkan faktor X menjadi faktor Xa serta melibatkan Faktor V, PF3, protrombin dan fibrinogen. Rangkaian reaksi koagulasi ini akan membentuk thrombin dan mengubah fibrinogen menjadi benang-benang fibrin yang tidak larut. Fibrin sebagai hasil akhir dari proses pembekuan darah akan menstabilkan sumbatan trombosit (Jerry B L dkk, 2008), (Suharti, 2009). 6 Universitas Sumatera Utara AT-III Gambar2.2.1 Escobar CE, et al., Introduction to hemostasis. In: Harmening DM, ed. Clinical Hematology and Fundamentals of Hemostasis. 4th ed. Philadelphia, PA: FA Davis Company; 2002:441-470. 7 Universitas Sumatera Utara 2.3 Antithrombin III (AT-III) Sistem koagulasi diatur oleh sejumlah inhibitor.Inhibitor ini berfungsi membatasi reaksi koagulasi yang berlebihan, agar pembentukan fibrin terbatas disekitar daerah yang mengalami injuri saja, untuk mencegah terjadinya kondisi patologi.Beberapa inhibitor penting dalam sistem koagulasi yaitu antithrombin III (AT-III), Protein C, ProteinS (Singanayagam, 2009). Antithrombin III (AT-III) merupakan inhibitor koagulasi fisiologik yang kuat , terdiri atas glikoprotein yang disintesa oleh hepar. Antithrombin III (AT-III) menghambat aktivitas FXa, FIIa (thrombin) dan dalam tingkatan yang lebih rendah juga menghambat faktor IXa, XIa,XIIa dan kalikrein. Fungsi inhibitor ini menjadi semakin kuat dengan adanya heparin.Antithrombin memiliki waktu paruh dalam plasma darah dari sekitar 3 hari.Konsentrasi nilai antithrombin III normal pada plasma darah manusia sekitar 75–125 U/dl atau 75–125% (Suharti, 2009). Temuan pertama yang penting dari penelitian Agapakis adalah bahwa nilai AT-III menurun secara bermakna pada pasien dengan PK berat, meskipun nilai AT-III tidak berbeda antara semua pasien PK dengan subjek kontrol sehat. AT-III mengikat dan menghambat aktivasi protein koagulasi dan menurunnya nilai AT-III dihubungkan dengan peningkatan risiko thrombosis (Agapakis dkk, 2010). Hal ini diketahui bahwa endotelium pembuluh darah paru memainkan peranan penting dalam katabolisme AT-III (Proletta M dkk, 2007). Di sisi lain, gangguan proses di alveolar yang disebabkan gangguan pembentukan fibrin telah dilaporkan pada pasien dengan pneumonia (Idell S dkk, 2003). Pembentukan fibrin yang berisi agen infeksi saat terjadi infeksi paru dapat mempengaruhi kekebalan pejamu dan juga mempengaruhi pemeliharaan dan perbaikan endotel-epitel barrier.Namun, hasil akhir koagulasi seperti trombin dan fibrin merupakan proinflamator signifikan yang dapat mengganggu fungsi paru, seperti yang mungkin terjadi pada ARDS berat (Levi M, 2003). Choi dkk (2004) melaporkan bahwa ventilator-terkait pneumonia (VAP) ditandai dengan keadaan protrombotik di lokasi infeksi. Namun hubungan antara AT-III dengan PK berat tidak ada yang spesifik telah dilaporkan pada studi sebelumnya. Penelitian ini menunjukkan bahwa rendahnya nilai AT-III saat masuk dapat mengidentifikasi pasien beresiko PK berat.Oleh karena itu, AT-III mungkin merupakan biomarker baru untuk memprediksi tingkat keparahan PK. Penurunan antikoagulan alami ini dapat memfasilitasi terjadinya thrombosis (Agapakis dkk, 2010). Universitas Sumatera Utara 8 2.4 Skor Klinis Pneumonia Meskipun sistem untuk memeriksa keparahan penyakit dan resiko kematian pada PK telah ada dan dipakai secara luas seperti PSI, PORT sistem ,CURB 65, namun sistem tersebut terlalu rumit untuk digunakan dalam praktek sehari-hari sehingga diperlukan biomarker yang potensial dapat memberikan informasi mengenai prognosis yang setara dengan sistem skoring yang telah ada (Mandell LA dkk, 2007), (Muller, 2007) Penilaian derajat keparahan pneumonia merupakan komponen penting dalam tatalaksana PK. Hal ini membuat munculnya berbagai sistem skoring PSI, CURB-65, modified ATS (m-ATS) dsb. Beberapa studi di Amerika Serikat dan Inggris telah mengeksplorasi sebagai faktor-faktor yang memprediksi kematian pada pasien rawat inap dengan PK, Skor Curb-65 dan PSI adalah sistem penilaian yang paling umum digunakan untuk memprediksi mortalitas (Mandell LA dkk, 2007). 2.5 CURB-65 SCORE Curb-65, juga dikenal sebagai Curb kriteria, merupakan aturan prediksi klinis yang telah divalidasi untuk memprediksi kematian pada pneumonia komunitas dan infeksi lainnya.CURB-65 didasarkan pada Curb skor sebelumnya dan direkomendasikan oleh British Thoracic Society (BTS) untuk penilaian keparahan pneumonia (Lim WS dkk, 2009). Skor CURB-65 (Tabel 2.5.1) diperkenal oleh British Thoracic Society (BTS) pada tahun 2003 yang melibatkan 12.000 penderita pneumonia, terdiri atas 5 kategori yang dihubungkan dengan risiko kematian dalam 30 hari. Skor 0-1 masuk dalam kategori skor kematian rendah dimana skor 0= 0,7% dan skor 1= 3,2%. Skor 2= 13% masuk kategori risiko kematian sedang dan skor >3 masuk dalam skor kematian tinggi ( 3= 17%, 4= 41,5% dan 5= 57%). Kemampuan prediksi dari skor ini hampir sama dengan PSI yaitu dengan AUC: 0,73 0,83. Keunggulan CURB-65 terletak pada variabel yang digunakan lebih praktis dan mudah diingat. ATS dalam guideline PK yang terbaru menyadari kompleksitas dari skor PSI dan akhirnya merekomendasikan penggunaan CURB-65, (S. Ewig dkk, 2000), (Capelastegui dkk, 2006). 9 Universitas Sumatera Utara Tabel 2.5.1 Skor CURB- 65 Clinical Factor Points C Confusion 1 U Blood urea nitrogen > or = 20 mg/dL 1 R Respiratory rate > or = 30 breaths/min 1 B Systolic BP < 90 mm Hg or Diastolic BP < or = 60 mm Hg 1 65 Age > or = 65 1 Total Score Mortality % 0 0.6% Low Outpatient 1 2.7% Low Outpatient 2 6.8% Moderate Short inpatient / supervised outpatient 3 14.0% Moderate to High Inpatient 4 or 5 27.8% High Inpatient / ICU Risk Level Suggested Site-of-Care Dikutip dari Q J Med 2009; 102:379–388 Baik skor PSI maupun CURB-65 sama-sama memiliki kelemahan yang sama, yaitu masih bergantung pada hasil pemeriksaan laboratorium. Keadaan ini melahirkan skor CRB 65 yang menghilangkan unsur ureum.Manfaat dari skor CRB-65 ini adalah dapat digunakan oleh dokter umum di tingkat layanan primer. Skor ini dikatakan memiliki peforma yang sama dengan PSI dan CURB-65 dengan AUC: 0,69 – 0,78. Sayangnya, penggunaan skor ini belum teruji dengan jumlah sampel yang besar seperti pendahulunya sehingga validasinya masih perlu diuji (Capelastegui dkk, 2006), (S. Ewig dkk, 2000), (Thomas M dkk, 2011). 2.6 Sepsis Akibat Pneumonia Komunitas Di Amerika Serikat, lebih dari 1 juta penderita PK setiap tahunnya dan 10% dari penderita harus dirawat di ICU (intensive care unit). Pada PK yang dirawat jalan mortalitas sebesar diperkirakan < 5%, jika penderita PK dirawat inap maka mortalitas meningkat hingga 12% dan akan semakin meningkat menjadi 22% jika pasien dipindahkan ke ICU. Keadaan ini disebabkan perjalanan PK menjadi sepsis berat (PK berat) yang ditandai dengan adanya disfungsi organ (Laterre PF dkk, 2005). Sepsis merupakan suatu respon inflamasi sistemik terhadap infeksi, dimana lipolisakarida atau toksin dilepaskan ke dalam sirkulasi darah sehingga terjadi aktivasi proses inflamasi. Sepsis ditandai dengan perubahan suhu tubuh, perubahan jumlah lekosit, Universitas Sumatera Utara 10 tachycardiadantachypnea. Sedangkan sepsis berat adalah sepsis yang ditandai dengan hipotensi atau disfungsi organ atau hipoperfusi organ (ACCP, 1992). Pada tahun 1992, menurut The American College of Chest Physician (ACCP) and The Society for Critical Care Medicine (SCCM) Consensus Conference on Standardized Definitions of Sepsis, telah mempublikasikan suatu konsensus dengan definisi baru dan kriteria diagnosis untuk sepsis dan keadaan-keadaan yang berkaitan dan menetapkan kriteria Systemic Inflammatory Response Syndrome (SIRS), sepsis berat dan syok sepsisdibawah ini: - Bakteremia : adanya bakteri dalam darah, yang dibuktikan dengan kultur darah positif. - SIRS : respon tubuh terhadap inflamasi sistemik, ditandai dua atau lebih keadaan berikut: 1. Suhu > 38ºC atau < 36ºC 2. Takikardia (HR > 90 kali/menit) 3. Takipneu (RR > 20 kali/menit) atau PaCO2 < 32 mmHg 4. Leukosit darah > 12.000/µL, < 4.000/µL atau netrofil batang > 10% - Sepsis : SIRS yang dibuktikan atau diduga penyebabnya kuman. - Sepsis berat : sepsis yang disertai dengan disfungsi organ, hipoperfusi atau hipotensi termasuk asidosis laktat, oliguria dan penurunan kesadaran. - Syok sepsis : sepsis dengan hipotensi meskipun telah diberikan resusitasi cairan secara adekuat, bersama dengan disfungsi organ. - Hipotensi : tekanan darah sistolik < 90 mmHg atau berkurang 40 mmHg dari tekanan darah normal pasien. - Multiple Organ Dysfunction Syndrome : disfungsi dari satu organ atau lebih, memerlukan intervensi untuk mempertahankan homeostasis (Kasper dkk, 2005). 2.7 Antithrombin III pada Sepsis Pada keadaan sepsis, endotoksin yang dihasilkan oleh bakteri menstimulasi sitokin proinflamasi. Endotoksin yang menstimulasi sitokin proinflamasi menyebabkan kerusakan langsung pada endotel, menginduksi adhesi leukosit ke sel endotel dan produksinitric oxide, dan mengaktifkan komplemen dan jalur koagulasi. Aktivasi jalur koagulasi ini berkaitan dengan terjadinya kerusakan endotel, bekuan intravaskular dan trombosis mikrovaskuler, serta terjadi konsumsi faktor antikoagulan alami seperti Antithrombin III (AT-III), protein C, dan protein S (Marianne N dkk, 2003). Universitas Sumatera Utara 11 ii Dari penelitian Fourrier F dkk (1992) mendapatkan bahwa secara signifikan nilai Antithrombin III yang rendah pada pasien sepsis baik yang hidup dengan persentase (61±3) maupun yang tidak hidup (35 ±2) dengan p<0.000l. Penelitian Pettila V dkk (2002) juga menunjukkan bahwa nilai Antithrombin III yang rendah pada pasien sepsis antara pasien yang hidup ( 66%) maupun yang tidak hidup (46%) secara signifikan dengan p<0.001. Pada penelitian yang dilakukan Arash dkk (2007) menyimpulkan bahwa menurunnya konsentrasi nilai Antithrombin III sekitar 20-40% pada keadaaan sepsis dan ini sejalan dengan berat keparahan penyakit. 2.8 Kultur Sputum Dalam Infectious Disease Society of American (IDSA) dan American Thoracic Society Guidelines (ATS, 2007) menunjukkan bahwa penyebab PK terbanyak disebabkan bakteri Gram positif oleh kuman Streptococcus Pneumoniae. Sedangkan kuman patogen penyebab PK lainnya mencakup Hemophilus Influenza, Mycoplasma Pneumoniae, Chlamydia Pneumoniae, Staphylococcus Aureus, Streptococcus Pyogenes, Neisseria Meningitides, Moraxella Catarrhalis, Klebsiella Pneumoniae, Legionella sp dan batang gram negatif lainnya. Menurut British Thoracic Society Guidelines (BTS, 2009) menyatakan bahwa kuman patogen penyebab PK yang banyak ditemukan , yaitu Streptococcus Pneumoniae dan diikuti kuman patogen lainnya Mycoplasma Pneumoniae, Chlamydia Pneumoniae dan kuman gram negatif lainnya. Di Asia Tenggara, Streptococcus Pneumoniae juga paling sering ditemukan kemudian diikuti Chlamydia Pneumonia dan bakteri gram negatif (Wattanathum dkk, 2003). Di Cina kuman patogen Streptococcus Pneumoniae paling banyak ditemukan lalu kuman- kuman lainnya seperti Mycoplasma Pneumoniae dan H Influenza (Huang HH dkk, 2006). Begitu juga di Jepang, Streptococcus Pneumoniae paling umum ditemukan dan diikuti oleh H Influenza (Saito A dkk, 2006). Berdasarkan dari pedoman diagnostik dan penatalaksanaan pneumonia komunitas di Indonesia (PDPI, 2003) dilaporkan bahwa kuman patogen penyebab PK yang paling umum diidentifikasi , yakni Streptococcus Pneumoniae dan diikuti kuman patogen gram postif lainnya, seperti Klebsiella Pneumoniae, Staphylococcus Aureus, Streptococcus Viridans,Pseudomonas Aeuroginosa serta kuman patogen gram negatif lainnya. 12 Universitas Sumatera Utara ii 2.9 Kultur Darah Kultur darah dianjurkan untuk semua pasien pada PK sedang dan berat, sebaiknya dilakukan pemeriksaan sebelum pemberian terapi antibiotik dimulai. Jika diagnosis PK telah pasti dikonfirmasi dan pasien dengan keparahan PK ringan tanpa komorbiditas penyakit, kultur darah boleh tidak dianjurkan. Kultur darah dapat membantu untuk mengidentifikasi bakteremia dan patogen resisten, dimana kuman Streptococcus Pneumoniae menjadi patogen yang paling umum yang diidentifikasi (BTS, 2009). ATS dan IDSA merekomendasikan indikasi kuat untuk kultur darah pada PK berat. Pasien dengan PK berat lebih mungkin terinfeksi dengan kuman patogen selain Streptococcus Pneumoniaee,termasuk Staphylococcus Aureus, PseudomonasAeruginosa, dan gram-negatif lainnya. Kultur darah yang positif pada Pneumonia hanya pada 5-16% kasus.Dimana kuman patogen yang paling umum ditemukan adalah Streptococcus Pneumoniae (ATS, 2007). Christ-Crain M dkk (2006) medapatkan bahwa adanya bakteri patogen di dalam darah (bloodstream infection/ BSI) erat kaitannya terhadap tingginya mortalitas pasien sepsis. Keadaan ini disebabkan terlambatnya pemberian antibiotik yang seharusnya sudah dapat dimulai saat awal pasien masuk. Umumnya antibiotik diberikan pada pasien dengan gejala infeksi yang nyata (demam dan leukositosis), yang sensitifitas dan spesifisitasnya rendah dan jika harus menunggu hasil kultur akan memperpanjang masa penundaan pemberian antibiotik. 13 ii Universitas Sumatera Utara