Termodinamika Termodinamika adalah kajian tentang kalor (panas
advertisement

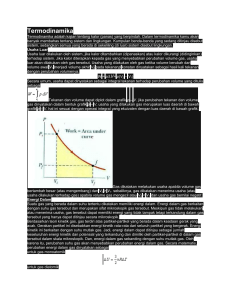
Termodinamika Termodinamika adalah kajian tentang kalor (panas) yang berpindah. Dalam termodinamika kamu akan banyak membahas tentang sistem dan lingkungan. Kumpulan benda-benda yang sedang ditinjau disebut sistem, sedangkan semua yang berada di sekeliling (di luar) sistem disebut lingkungan. Usaha Luar Usaha luar dilakukan oleh sistem, jika kalor ditambahkan (dipanaskan) atau kalor dikurangi (didinginkan) terhadap sistem. Jika kalor diterapkan kepada gas yang menyebabkan perubahan volume gas, usaha luar akan dilakukan oleh gas tersebut. Usaha yang dilakukan oleh gas ketika volume berubah dari volume awal V1 menjadi volume akhir V2 pada tekanan p konstan dinyatakan sebagai hasil kali tekanan dengan perubahan volumenya. W = p∆V= p(V2 – V1) Secara umum, usaha dapat dinyatakan sebagai integral tekanan terhadap perubahan volume yang ditulis sebagai Tekanan dan volume dapat diplot dalam grafik p – V. jika perubahan tekanan dan volume gas dinyatakan dalam bentuk grafik p – V, usaha yang dilakukan gas merupakan luas daerah di bawah grafik p – V. hal ini sesuai dengan operasi integral yang ekuivalen dengan luas daerah di bawah grafik. Gas dikatakan melakukan usaha apabila volume gas bertambah besar (atau mengembang) dan V2 > V1. sebaliknya, gas dikatakan menerima usaha (atau usaha dilakukan terhadap gas) apabila volume gas mengecil atau V2 < V1 dan usaha gas bernilai negatif. Energi Dalam Suatu gas yang berada dalam suhu tertentu dikatakan memiliki energi dalam. Energi dalam gas berkaitan dengan suhu gas tersebut dan merupakan sifat mikroskopik gas tersebut. Meskipun gas tidak melakukan atau menerima usaha, gas tersebut dapat memiliki energi yang tidak tampak tetapi terkandung dalam gas tersebut yang hanya dapat ditinjau secara mikroskopik. Berdasarkan teori kinetik gas, gas terdiri atas partikel-partikel yang berada dalam keadaan gerak yang acak. Gerakan partikel ini disebabkan energi kinetik rata-rata dari seluruh partikel yang bergerak. Energi kinetik ini berkaitan dengan suhu mutlak gas. Jadi, energi dalam dapat ditinjau sebagai jumlah keseluruhan energi kinetik dan potensial yang terkandung dan dimiliki oleh partikel-partikel di dalam gas tersebut dalam skala mikroskopik. Dan, energi dalam gas sebanding dengan suhu mutlak gas. Oleh karena itu, perubahan suhu gas akan menyebabkan perubahan energi dalam gas. Secara matematis, perubahan energi dalam gas dinyatakan sebagai untuk gas monoatomik untuk gas diatomik Dimana ∆U adalah perubahan energi dalam gas, n adalah jumlah mol gas, R adalah konstanta umum gas (R = 8,31 J mol−1 K−1, dan ∆T adalah perubahan suhu gas (dalam kelvin). Hukum I Termodinamika Jika kalor diberikan kepada sistem, volume dan suhu sistem akan bertambah (sistem akan terlihat mengembang dan bertambah panas). Sebaliknya, jika kalor diambil dari sistem, volume dan suhu sistem akan berkurang (sistem tampak mengerut dan terasa lebih dingin). Prinsip ini merupakan hukum alam yang penting dan salah satu bentuk dari hukum kekekalan energi. Gambar Sistem yang mengalami perubahan volume akan melakukan usaha dan sistem yang mengalami perubahan suhu akan mengalami perubahan energi dalam. Jadi, kalor yang diberikan kepada sistem akan menyebabkan sistem melakukan usaha dan mengalami perubahan energi dalam. Prinsip ini dikenal sebagai hukum kekekalan energi dalam termodinamika atau disebut hukum I termodinamika. Secara matematis, hukum I termodinamika dituliskan sebagai Q = W + ∆U Dimana Q adalah kalor, W adalah usaha, dan ∆U adalah perubahan energi dalam. Secara sederhana, hukum I termodinamika dapat dinyatakan sebagai berikut. Jika suatu benda (misalnya krupuk) dipanaskan (atau digoreng) yang berarti diberi kalor Q, benda (krupuk) akan mengembang atau bertambah volumenya yang berarti melakukan usaha W dan benda (krupuk) akan bertambah panas (coba aja dipegang, pasti panas deh!) yang berarti mengalami perubahan energi dalam ∆U. Proses Isotermik Suatu sistem dapat mengalami proses termodinamika dimana terjadi perubahan-perubahan di dalam sistem tersebut. Jika proses yang terjadi berlangsung dalam suhu konstan, proses ini dinamakan proses isotermik. Karena berlangsung dalam suhu konstan, tidak terjadi perubahan energi dalam (∆U = 0) dan berdasarkan hukum I termodinamika kalor yang diberikan sama dengan usaha yang dilakukan sistem (Q = W). Proses isotermik dapat digambarkan dalam grafik p – V di bawah ini. Usaha Usah yang dilakukan sistem dan kalor dapat dinyatakan sebagai Dimana V2 V dan V11 adalah volume akhir dan awal gas. Proses Isokhorik Jika gas melakukan proses termodinamika dalam volume yang konstan, gas dikatakan melakukan proses isokhorik. Karena gas berada berad dalam volume konstan (∆V V = 0), gas tidak melakukan usaha (W = 0) dan kalor yang diberikan sama dengan perubahan energi dalamnya. Kalor di sini dapat dinyatakan sebagai kalor gas pada volume konstan QV. QV = ∆U Proses Isobarik Jika gas melakukan proses termodinamika dengan menjaga tekanan tetap konstan, gas dikatakan melakukan proses isobarik. Karena gas berada dalam tekanan konstan, gas melakukan usaha (W ( = p∆V). ). Kalor di sini dapat dinyatakan sebagai kalor gas pada tekanan konstan Qp. Berdasarkan hukum I termodinamika, pada proses isobarik berlaku Sebelumnya telah dituliskan bahwa perubahan energi dalam sama dengan kalor yang diserap gas pada volume konstan QV =∆U Dari sini usaha gas dapat dinyatakan sebagai W = Qp − QV Jadi, usaha yang dilakukan oleh gas (W) ( ) dapat dinyatakan sebagai selisih energi (kalor) yang diserap gas pada tekanan konstan ((Qp)) dengan energi (kalor) yang diserap gas pada volume konstan (QV). Proses Adiabatik Dalam proses adiabatik tidak ada kalor yang masuk (diserap) ataupun keluar (dilepaskan) oleh sistem (Q = 0). Dengan demikian, usaha yang dilakukan gas sama dengan perubahan energi dalamnya (W = ∆U). Jika suatu sistem berisi gas yang mula-mula mula mula mempunyai tekanan dan volume masing-masing masing p1 dan V11 mengalami proses adiabatik sehingga sehingga tekanan dan volume gas berubah menjadi p2 dan V2, 2, usaha yang dilakukan gas dapat dinyatakan sebagai Dimana γ adalah konstanta yang diperoleh perbandingan kapasitas kalor molar gas pada tekanan dan volume konstan dan mempunyai nilai yang lebih bes besar dari 1 (γ > 1). Proses adiabatik dapat digambarkan dalam grafik p – V dengan bentuk kurva yang mirip dengan grafik p – V pada proses isotermik namun dengan kelengkungan yang lebih curam. Sebuah sistem termodinamika Termodinamika (bahasa Yunani: thermos = 'panas' and dynamic = 'perubahan') adalah fisika energi , panas, kerja, entropi dan kespontanan proses. Termodinamika berhubungan dekat dengan mekanika statistik di mana banyak hubungan termodinamika berasal. Pada sistem di mana terjadi proses perubahan wujud atau pertukaran energi, termodinamika klasik tidak berhubungan dengan kinetika reaksi (kecepatan suatu proses reaksi berlangsung). Karena alasan ini, penggunaan istilah "termodinamika" biasanya merujuk pada termodinamika setimbang. imbang. Dengan hubungan ini, konsep utama dalam termodinamika adalah proses kuasistatik, yang diidealkan, proses "super pelan". Proses termodinamika bergantung-waktu bergantung waktu dipelajari dalam termodinamika tak-setimbang. tak Karena termodinamika tidak berhubungan den dengan gan konsep waktu, telah diusulkan bahwa termodinamika setimbang seharusnya dinamakan termostatik. Hukum termodinamika kebenarannya sangat umum, dan hukum hukum-hukum hukum ini tidak bergantung kepada rincian dari interaksi atau sistem yang diteliti. Ini berarti merek merekaa dapat diterapkan ke sistem di mana seseorang tidak tahu apa pun kecual perimbangan transfer energi dan wujud di antara mereka dan lingkungan. Contohnya termasuk perkiraan Einstein tentang emisi spontan dalam abad ke-20 20 dan riset sekaran ini tentang termodinamika termodinamika benda hitam. Konsep dasar dalam termodinamika Pengabstrakan dasar atas termodinamika adalah pembagian dunia menjadi sistem dibatasi oleh kenyataan atau ideal dari batasan. Sistem yang tidak termasuk dalam pertimbangan digolongkan sebagai lingkungan. gan. Dan pembagian sistem menjadi subsistem masih mungkin terjadi, atau membentuk beberapa sistem menjadi sistem yang lebih besar. Biasanya sistem dapat diberikan keadaan yang dirinci dengan jelas yang dapat diuraikan menjadi beberapa parameter. Sistem termodinamika Sistem termodinamika adalah bagian dari jagat raya yang diperhitungkan. Sebuah batasan yang nyata atau imajinasi memisahkan sistem dengan jagat raya, yang disebut lingkungan. Klasifikasi sistem termodinamika berdasarkan pada sifat batas sistem-lingkungan dan perpindahan materi, kalor dan entropi antara sistem dan lingkungan. Ada tiga jenis sistem berdasarkan jenis pertukaran yang terjadi antara sistem dan lingkungan: 1. sistem terisolasi: tak terjadi pertukaran panas, benda atau kerja dengan lingkungan. Contoh dari sistem terisolasi adalah wadah terisolasi, seperti tabung gas terisolasi. 2. sistem tertutup: terjadi pertukaran energi (panas dan kerja) tetapi tidak terjadi pertukaran benda dengan lingkungan. Rumah hijau adalah contoh dari sistem tertutup di mana terjadi pertukaran panas tetapi tidak terjadi pertukaran kerja dengan lingkungan. Apakah suatu sistem terjadi pertukaran panas, kerja atau keduanya biasanya dipertimbangkan sebagai sifat pembatasnya: - pembatas adiabatik: tidak memperbolehkan pertukaran panas. - pembatas rigid: tidak memperbolehkan pertukaran kerja. 3. sistem terbuka: terjadi pertukaran energi (panas dan kerja) dan benda dengan lingkungannya. Sebuah pembatas memperbolehkan pertukaran benda disebut permeabel. Samudra merupakan contoh dari sistem terbuka. Dalam kenyataan, sebuah sistem tidak dapat terisolasi sepenuhnya dari lingkungan, karena pasti ada terjadi sedikit pencampuran, meskipun hanya penerimaan sedikit penarikan gravitasi. Dalam analisis sistem terisolasi, energi yang masuk ke sistem sama dengan energi yang keluar dari sistem. Keadaan termodinamika Ketika sistem dalam keadaan seimbang dalam kondisi yang ditentukan, ini disebut dalam keadaan pasti (atau keadaan sistem). Untuk keadaan termodinamika tertentu, banyak sifat dari sistem dispesifikasikan. Properti yang tidak tergantung dengan jalur di mana sistem itu membentuk keadaan tersebut, disebut fungsi keadaan dari sistem. Bagian selanjutnya dalam seksi ini hanya mempertimbangkan properti, yang merupakan fungsi keadaan. Jumlah properti minimal yang harus dispesifikasikan untuk menjelaskan keadaan dari sistem tertentu ditentukan oleh Hukum fase Gibbs. Biasanya seseorang berhadapan dengan properti sistem yang lebih besar, dari jumlah minimal tersebut. Pengembangan hubungan antara properti dari keadaan yang berlainan dimungkinkan. Persamaan keadaan adalah contoh dari hubungan tersebut. Hukum Termodinamika Hukum pertama Termodinamika adalah bentuk lain dari hukum kekekalan energi yang diaplikasikan pada perubahan energi dalam yang dialami oleh suatu sistem. Maka : - Sistem adalah sejumlah zat dalam suatu wadah, yang menjadi pusat perhatian untuk dianalisis. - Lingkungan adalah segala sesuatu diluar sistem. - Batas , perantara lingkungan dan sistem. Pengertian Usaha, Kalor dan Energi. Kalor = Usaha, yaitu hanya muncul juka terjadi perpindahan energi antara system dan lingkungan . Kalor muncul ketika energi dipindahkan akibat adanya perbedaan suhu atau perubahan wujud zat. Energi terbagi atas dua yaitu energi dalam dan energi luar , dibawah ini beberapa asumsi mengenai energi tersebut. - Energi kinetik dan energi potensial = energi luar ( external energy ) - Energi yang tidak nampak dari luar adalah energi dalam. - Energi dalam berhubungan dengan aspek mikroskopik zat. - Jumlah energi kinetic dan energi potensial yang berhubungan dengan atom –atom atau molekul – molekul zat disebut energi dalam. Oleh karena itu, pengertian dari energi dalam adalah suatu sifat mikroskopik zat, sehingga tidak dapat diukur secara langsung. Yang dapat diukur secara tidak langsung adalah perubahan energi dalam (notasi ) , yaitu ketika suatu system berubah dari keadaan awal ke keadaan akhir. Secara Sistematis Perubahan Energi Dalam delta U = U2-U1 Perubahan Energi Dalam u = u(vT) Dimana : du : perubahan energi dalam (kJ/kg) cv : panas spesifik pada volume konstan (0,707kJ/kg.K) dT : perubahan suhu (K) Formulasi Usaha Proses Isobarik adalah proses yang terjadi pada tekanan tetap. Secara Sistematis Usaha pada proses Isobarik W = p . deltaV = p ( V2 - V1 ) Rumus pada persamaan diatas hanya dapat digunakan untuk menghitung usaha gas pada tekanan tetap (proses Isobarik). Jika tekanan gas berubah, usaha W harus dihitung dengan cara integral. Secara umum, usaha dihitung dengan cara integral berikut. Rumus umum Usaha W = V1 - V2 pdV Oleh Karena itu, jika grafik tekanan terhadap Volume diberikan , maka arti geometris dari persamaan adalah luas dibawah kurva. Usaha dalam proses siklus Pengertian usaha dalam proses siklus ialah usaha yang dilakukan oleh atau pada system gas yang menjalani suatu proses siklus sama dengan luas daerah yang dimuat oleh siklus tersebut. Hukum-hukum Dasar Termodinamika Terdapat empat Hukum Dasar yang berlaku di dalam sistem termodinamika, yaitu: Hukum Awal (Zeroth Law) Termodinamika Hukum ini menyatakan bahwa dua sistem dalam keadaan setimbang dengan sistem ketiga, maka ketiganya dalam saling setimbang satu dengan lainnya. Hukum Pertama Termodinamika Hukum ini terkait dengan kekekalan energi. Hukum ini menyatakan perubahan energi dalam dari suatu sistem termodinamika tertutup sama dengan total dari jumlah energi kalor yang disuplai ke dalam sistem dan kerja yang dilakukan terhadap sistem. Energi dalam suatu system berubah dari nilai awal U1 ke nilai akhir U2 sehubungan dengan kalor Q dan usaha W, Maka ; Oleh karena itu, Hukum Pertama termodinamika berbunyi, energi dalam suatu system berubah dari nilai U2 sehubungan dengan kalor Q dan usaha W; dimana Q adalah positif jika system memperoleh kalor dan negative jika kehilangan kalor, usaha W positif jika usaha dilakukan oleh system dan negative jika usaha dilakukan pada system.Hukum kedua Termodinamika Hukum kedua termodinamika terkait dengan entropi. Hukum ini menyatakan bahwa total entropi dari suatu sistem termodinamika terisolasi cenderung untuk meningkat seiring dengan meningkatnya waktu, mendekati nilai maksimumnya. Maka, Hukum Kedua Termodinamika berbunyi, tidak mungkin untuk membuat sebuah mesin kalor yang bekerja dalam suatu siklus yang semata – mata mengubah energi panas yang diperoleh dari suatu sumber pada suhu tertentu seluruhnya menjadi energi mekanik. Hukum ketiga Termodinamika Hukum ketiga termodinamika terkait dengan temperatur nol absolut. Hukum ini menyatakan bahwa pada saat suatu sistem mencapai temperatur nol absolut, semua proses akan berhenti dan entropi sistem akan mendekati nilai minimum. Hukum ini juga menyatakan bahwa entropi benda berstruktur kristal sempurna pada temperatur nol absolut bernilai nol.