percobaan ii - WordPress.com
advertisement

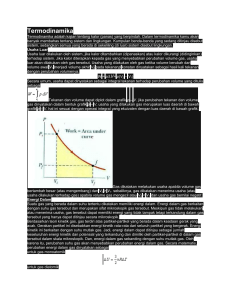
ABSTRAK Telah dilakukan praktikum mengenai termokimia, dimana pada percobaan ini, untuk menentukan kalor penguapan dari CCl4 maka diperhatikan waktu yang diperlukan oleh CCl4 untuk menguap. Penguapan cairan terjadi karena cairan meninggalkan cairan. Molekul-molekul ini memiliki tenaga yang lebih besar dari pada rata-rata cairan. Penguapan tidak terjadi secara terus menerus sebab sebagian dari uap akan kembali dalam cairan. Tekanan uap cairan tergantung pada temperatur semakin besar temperatur maka semakin besar pula tekanan uapnya dan mempunyai harga maksimal pada temperatur kritis. Ketika CCl4 dimasukkan ke dalam tutup porselin yang suhubungan 30oC, terjadi pertukaran kalor antara system dan lingkungan. Bardasarkan hasil pengamatan , pada temperature 30oC, waktu rata-rata yang diperlukan oleh CCl4 untuk menguap adalah 43,57 s. Ketika temperatur dinaikkan 40oC maka waktu rata-rata yang diperlukan semakin berkurang menjadi 32,21 s. Ketika pada temperature 50oC, waktu rata-taranya yaitu 22,99 s, dan ketika dinaikkan sampai 60oC maka waktu rata-rata untuk penguapannya turun sampai 17,24 s. Kata kunci : Termokimia, CCl4, dan Tekanan uap BAB 1 PENDAHULUAN I. Latar Belakang Kimia termo mempelajari perubahan panas yang mengikuti reaksi kimia dan perubahan-perubahan fisika (pelarutan, peleburan, dan sebagainya). Satuan tenaga panas biasanya dinyatakan dengan kalori, Joule atau kilo kalori. 1 joule = 107 erg = 0,24 kal Atau 1 kal = 4,184 joule. Untuk menentukan perubahan panas yang terjadi pada reaksireaksi kimia, dipakai calorimeter. Besarnya panas reaksikimia, dapat dinyatakan pada tekanan tetap dan volume tetap. Termodinamika, termasuk termokimia, merupakan salah satu segi penting, yaitu menghubungkan energy kalor dengan bentuk energy yang lain yang dikenal sebagai kerja. Bagian alam semesta yang yang dipilih untuk penelitian termodinamika disebut system dan bagian dari alam semesta yang berinteraksi dengan system disebut keadaan sekeliling lingkungan dari system. Interaksi mengacu pada perpindahan energy atau materi antara system dan lingkungannya; interaksi-interaksi inilah yang umumnya menjadi pusat penelitian termodinamika. Perpindahan energy dapat berupa kalor (q) atau dalam beberapa bentukl lainnya yang secara keseluruhan disebut kerja (w). Perpindahan energy berupa kalor atau kerja atau mempengaruhi jumlah keseluruhan energy di dalam system, yang disebut energy dalam (E). Kalor dapat dipirkan sebagai energy yang dipindahkan karena perbedaan suhu. Energi sebagai kalor mengalir dari benda yang lebih panas (suhu lebih tinggi) ke benda yang lebih dingin (suhu lebih rendah). Pada tinkat molekul ini berarti bahwa molekul-molekul dari bagian yang lebih panas kehilangan energimkinetiknya dan berpindah kebagian yang lebih dingin ketika kedua bagian tersebut bersentuhan. Akibatnya energy kinetic transisi rata-rata dari molekul-molukul benda yang lebih panas menurun atau dikatakan suhunya turun. Pada benda yang lebih dingin suhunya meningkat. Energi telah berpindah, atau kalor mengalir, diantara ke dua benda tersebut sampai terjadi suhu yang sama. Pada kondisi ketika cairan mendidih sistem berada dalam kesetimbangan. Energi yang diperlukan untuk mengubah cairan menjadi gas disebut dengan kalor penguapan. Ketika panas ditambahkan untuk suatu condensed-phase unsur, temperatur nya meningkat sampai suatu temperatur perubahan fase dicapai. Dengan pemanasan lebih lanjut, temperatur tetap selagi peralihan fase berlangsung. Jumlah unsur yang berubah adalah suatu fungsi penambahan jumlah panas. Setelah transisi lengkap, terjadi peningkatan panas pada temperatur tersebut. Dengan kata lain, entalpi suatu unsur ber;ubah secara isotermis ketika mengalami suatu perubahan fisik, untuk perubahan entalpi dari cair ke gas disebut entalpi penguapan (∆Hvap). II. Tujuan Praktikum Tujuan dari melakukan percobaan ini adalah untuk menentukan kalor penguapan karbon tetraklorida. III. Prinsip Percobaan Prinsip dari percobaan ini yaitu penentuan kalor penguapan dapat ditentukan dengan cara menguapkan CCl4 pada variasi temperature tertentu. BAB II TEORI PENDUKUNG Teori –teori Bagian dari ilmu kimia yang mempelajari perubahan kalor atau panas suatu zat yang menyertai suatu reaksi atau proses kimia dan fisika disebut termokimia. Secara operasional termokimia berkaitan dengan pengukuran dan pernafsiran perubahan kalor yang menyertai reaksi kimia, perubahan keadaan, dan pembentukan larutan. Termokimia merupakan pengetahuan dasar yang perlu diberikan atau yang dapat diperoleh dari reaksi-reaksi kimia, tetapi juga perlu sebagai pengetahuan dasar untuk pengkajian teori ikatan kimia dan struktur kimia. Fokus bahasan dalam termokimia adalah tentang jumlah kalor yang dapat dihasilkan oleh sejumlah tertentu pereaksi serta cara pengukuran kalor reaksi (Nasrudin, 2004). Bagian alam semesta yang yang dipilih untuk penelitian termodinamika disebut system dan bagian dari alam semesta yang berinteraksi dengan system disebut keadaan sekeliling lingkungan dari system. Interaksi mengacu pada perpindahan energy atau materi antara system dan lingkungannya; interaksi-interaksi inilah yang umumnya menjadi pusat penelitian termodinamika. Perpindahan energy dapat berupa kalor (q) atau dalam beberapa bentukl lainnya yang secara keseluruhan disebut kerja (w). Perpindahan energy berupa kalor atau kerja atau mempengaruhi jumlah keseluruhan energy di dalam system, yang disebut energy dalam (E). Kalor dapat dipirkan sebagai energy yang dipindahkan karena perbedaan suhu. Energi sebagai kalor mengalir dari benda yang lebih panas (suhu lebih tinggi) ke benda yang lebih dingin (suhu lebih rendah). Pada tinkat molekul ini berarti bahwa molekul-molekul dari bagian yang lebih panas kehilangan energimkinetiknya dan berpindah kebagian yang lebih dingin ketika kedua bagian tersebut bersentuhan (Petrucci, 1987). Energi dalam suatu zat/sistem juga dapat berubah jika zat/sistem melakukan atau menerima kerja (usaha luar). Jenis kerja yang sering menyertai perubahan kimia atau proses fisika (perubahan wujud) adalah kerja ekspansi, yaitu kerja yang berhubungan dengan perubahan volume. Jika suatu zat/sistem mengembang, maka zat itu mengusir udara atau mengangkat beban diatasnya. Untuk melakukan hal itu diperlukan sejumlah energi yang disebut kerja. Jadi, zat/sistem melakukan kerja maka energi dalamnya akan berkurang walaupun zat/sistem itu tidak melepas kalor. Sebaliknya sistem menerima kerja (volume berkurang), maka energi dalam sistem bertambah (Purba, 1999). Sistem adalah bagian dari alam yang akan kita fokuskan. Lingkungan termasuk segala sesuatu yang ada didalam. Dalam hal ini kita mendefenisikan sistem ini dengan reaktan dan hasil dari reaktan. Lingkungan terdiri dari bahan ruang dan segala sesuatu diluar reaktan dan hasil (Steven, 1992). Kapasitas kalor suatu larutan tergantung dari besar suhu. Kapasitas kalor molar yaitu suatu kalor kemolaran konfersi energi jumlah kalor yang sama kembali kesuhu semula, sehingga suhu kalor yang diserap zat padat meleleh atau zat cair mengalami penguapan (Sukartono, 1983). BAB III METODE PRAKTIKUM I. Alat dan bahan yang digunakan Alat yang digunakan dalam praktikum viskositas adalah sebagai berikut : 1. Gelas kimia 400 ml 2 buah 2. Tutup Krus porselin 1 buah 3. Pipet tetes 3 batang 4. Botol semprot 1 buah 5. Stopwach (Hp) 3 buah 6. Termometer 1 batang Bahan yang digunakan dalam praktikum viskositas adalah sebagai berikut : 1. Aquades 2. Kloroform II. Prosedur Kerja Aquades Dimasukan dalam gelas kimia kira-kira stengah penuh Diapungkan tutup krus porselin secara terbalik Dipanaskan hingga suhu 60ºC Diatur suhunya agar tetap konstan 1 tetes CCl4 Diteteskan di atas permukaan tutup krus Diamati Dilakukan sebanyak tiga kali dan dalam perhitungan digunakan harga rata-rata Hasil pengamatan BAB IV HASIL DAN PEMBAHASAN I. Data Pengamatan Suhu o C 300C 400C 500C 600C 700C Perlakuan 1 T1 T2 T3 47,47 47,42 47,99 31,20 32,24 32,38 24,56 23,45 24,16 16,69 16,49 16,05 11,61 10,87 10,44 t (s)1 t (s)2 t (s)3 47,72 31,94 24,05 16,41 10,37 44,78 32,54 22,61 18,07 9,51 38,32 32,17 22,32 17,24 9,29 Perlakuan 2 T1 T2 T3 44,86 44,59 44,89 32,40 32,75 32,47 23,58 21,21 23,06 17,95 18,22 18,05 9,54 9,61 9,38 T ratarata 43,57 32,21 22,99 17,24 9,27 Suhu (K) 303 313 323 333 343 Perlakuan 3 T1 T2 T3 38,52 38,,33 38,12 32,22 32,08 32,21 22,63 22,20 22,15 16,37 17,71 17,65 9,27 9,26 9,36 1/K Log t 0,0033 0,0032 0,0031 0,0030 0,0029 1,639 1,507 1,361 1,236 0,987 II. Perhitungan Menghitung kalor penguapan CCl4 dalam kJ/mol Grafik Hubungan antara log T terhadap 1/T Log T 2 1,8 1,6 1,4 1,2 y = 1368,9x - 2.7693 1 0,8 0,6 0,4 0,2 0 0,00295 0,003 0,00305 0,0031 0,00315 0,0032 0,00325 0,0033 0,00335 1/T (1/K) Berdasarkan grafik yang ada, maka persamaan : log ΔH v 1 tetapan t 2,3 RT log t ΔH v tetapan 2,3 RT dapat dianalogikan dengan persamaan regresi linear y = bx + a log t ΔH v 1 x tetapan 2,3 RT T log t tetapan Misal : y = log t ; ΔH v 1 x 2,3 RT T b= ΔH v 2,3 RT ; dan Dimana a adalah tetapan sehingga, b ΔΗ v 2,3 RT x = 1 T Berdasarkan grafik yang telah dibuat, dapat diperoleh nilai b (1575). Sehungga nilai kalor penguapan CCl4 dapat dihitung dengan persamaan berikut : ΔΗv = b x 2,3 R = 1575 x 2,3 (8,314 J/mol K) = 300117.465 kJ/mol K Jadi kalor penguapan CCl4 yang didapatkan adalah 300117.465 kJ/mol K. III. Pembahasan Termokimia merupakan cabang dari termodinamika karena pada tabung reaksi dan isinya membentuk system. Jadi kita dapat mengukur (secara temperature) energi yang dihasilkan oleh reaksi sebagai kalor. Selanjutnya penerapan hukum pertama termodinamika terhadap peristiwa kimia disebut termokimia, yang membahas tentang kalor yang menyertai reaksi kimia . jika suhu air dalam lingkungan meningkat maka terjadi reaksi eksotermik, dan jika suhu air menurun maka terjadi reaksi endotermik. Pada perubahan kimia selalu terjadi perubahan entalpi. Perubahan entalpi ini diperoleh dari selisih jumlah entalphi hasil reaksi dan jumlah entalphi pereaksi. Bila harga perubahan entalphi positif, maka reaksinya adalah reaksi endoterm, sebaliknya jika harga perubahan entalphi negatif maka reaksinya adalah reaksi endoterm. Jadi entalphi pembentukan standar suatu zat adalah entalphi reaksi standar untuk pembentukan zat itu dan unsur-unsurnya dalam keadaan standar. Nilai H keseluruhan jumlah dari entalphi penguraian kebalikan dari pembentukan. Entalpi pembentukan zat-zat, mempunyai informasi yang cukup untuk menghitung entalphi reaksi apapun. Entalphi suatu zat bertambah jika zat di panaskan. Oleh karena itu entalphi reaksi berubah dengan perubahan temperatur karena entalphi setiap zat dalam suatu reaksi bervariasi dengan cara yang khas. Termokimia merupakan penerapan hukum pertama termodinamika pada sistem-sistem kimia yang membahas banyaknya energi panas yang diserap atau dilepaskan pada waktu reaksi kimia berlangsung perubahan isolator suatu zat yang menyertai suatu reaksi. Termodanamika adalah suatu kajian yang mempelajari hubungan bermacam-macam bentuk energi dalam suatu sistem dimana dalam termodinamika ini hanya mempelajari hubungan antara energi awal dan akhir dari sistem tersebut. Energi dari sistem yaitu jumlah energi potensial dan energi kinetiknya. Interaksi anatara perpindahan panas energi atau materi antara sistem dan lingkungan umumnya menjadi pusat penelitian termodinamika. Perpindahan energi dapat berupa kalor. Kalor yaitu energi yang mengalir karena adanya perbedaan temperatur. Adanya kalor yang masuk sistem merupakan salah satu penyebab perubahan keadaan sistem. Dalam suatu proses penguapan terjadi pemutusan ikatan antara molekul-molekul dari fase cair ke fase gas, energi yang diperlukan untuk itu disebut kalor penguapan atau entalpi penguapan yang bergantung pada suhu, semakin tinggi suhu pada lingkungan, maka senyawa tetraklorida (CCl4) akan semakin cepat menguap, di karenakan energi ikatannya semakin cepat putus, sedangkan jika suhu pada lingkungan rendah, maka tetraklorida membutuhkan waktu yang lebih lama untuk menguap, di karenakan energi ikatannya yang semakin lama putus. Berdasarkan grafik hubungan antara log t dengan 1/T, maka di peroleh nilai b sebesar 1242,583 dan nilai a sebesar -2,42902 sehingga HV yang di dapatkan sebesar 23,838 kJ/K.mol BAB V PENUTUP 1. Kesimpulan Kesimpulan yang didapatkan dari percobaan ini yaitu bahwa karbon tetraklorida (CCl4) merupakan zat yang mudah menguap, sehingga semakin tinggi temperaturnya maka semakin sedikit waktu yang diperlukan dalam menguapkan CCl4. Kalor penguapan CCl4 yang didapatkan adalah 300117.465 kJ/mol K. II. Saran Adapun saran yang dapat saya ajukan pada percobaan kali ini yaitu hendaknya dalam melakukan praktikum teman-teman praktikan bekerja sama secara aman dan teratur. DAFTAR PUSTAKA Nasrudin, Harun. 2004. Termokimia. Departemen Pendidikan Nasional. Jakarta. http://pustakamaya/files.com (diakses tanggal 12 September 2013). Petrucci,R.H., 1987. Kimia Dasar. Erlangga. Jakarta. Purba.M.. 1999. Kimia 2000. Erlangga. Jakarta. Steven,S.Z., 1992. Chemistry Principle. Comeney Publishing. Amerika Serikat. Sukartono , 1983 . Kimia Universitas . PT Aksara Pratama . Jakarta LAPORAN PRAKTIKUM KIMIA FISIK 1 PERCOBAAN I “TERMOKIMIA” OLEH : NAMA : LA ODE INSAKTIAR STAMBUK : A1C4 12 040 PROGRAM STUDI : PENDIDIKAN KIMIA JURUSAN : PENDIDIKAN MIPA KELOMPOK : VI (ENAM) NAMA ASISTEN : TRI SULISTYAWATI LABORATORIUM PENGEMBANGAN UNIT KIMIA FAKULTAS KEGURUAN DAN ILMU PENDIDIKAN UNIVERSITAS HALU OLEO KENDARI 2013