Termodinamika
advertisement

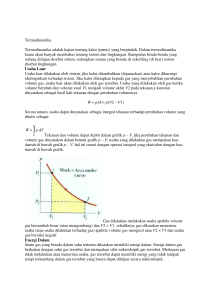
Termodinamika Termodinamika adalah kajian tentang kalor (panas) yang berpindah. Dalam termodinamika kamu akan banyak membahas tentang sistem dan lingkungan. Kumpulan benda-benda yang sedang ditinjau disebut sistem, sedangkan semua yang berada di sekeliling (di luar) sistem disebut lingkungan. Usaha Luar Usaha luar dilakukan oleh sistem, jika kalor ditambahkan (dipanaskan) atau kalor dikurangi (didinginkan) terhadap sistem. Jika kalor diterapkan kepada gas yang menyebabkan perubahan volume gas, usaha luar akan dilakukan oleh gas tersebut. Usaha yang dilakukan oleh gas ketika volume berubah dari volume awal V1 menjadi volume akhir V2 pada tekananp konstan dinyatakan sebagai hasil kali tekanan dengan perubahan volumenya. W = p∆V= p(V2 – V1) Secara umum, usaha dapat dinyatakan sebagai integral tekanan terhadap perubahan volume yang ditulis sebagai Tekanan dan volume dapat diplot dalam grafik p – V. jika perubahan tekanan dan volume gas dinyatakan dalam bentuk grafik p – V, usaha yang dilakukan gas merupakan luas daerah di bawah grafik p – V. hal ini sesuai dengan operasi integral yang ekuivalen dengan luas daerah di bawah grafik. Gas dikatakan melakukan usaha apabila volume gas bertambah besar (atau mengembang) dan V2 > V1. sebaliknya, gas dikatakan menerima usaha (atau usaha dilakukan terhadap gas) apabila volume gas mengecil atau V2 < V1 dan usaha gas bernilai negatif. Energi Dalam Suatu gas yang berada dalam suhu tertentu dikatakan memiliki energi dalam. Energi dalam gas berkaitan dengan suhu gas tersebut dan merupakan sifat mikroskopik gas tersebut. Meskipun gas tidak melakukan atau menerima usaha, gas tersebut dapat memiliki energi yang tidak tampak tetapi terkandung dalam gas tersebut yang hanya dapat ditinjau secara mikroskopik. Berdasarkan teori kinetik gas, gas terdiri atas partikel-partikel yang berada dalam keadaan gerak yang acak. Gerakan partikel ini disebabkan energi kinetik rata-rata dari seluruh partikel yang bergerak. Energi kinetik ini berkaitan dengan suhu mutlak gas. Jadi, energi dalam dapat ditinjau sebagai jumlah keseluruhan energi kinetik dan potensial yang terkandung dan dimiliki oleh partikel-partikel di dalam gas tersebut dalam skala mikroskopik. Dan, energi dalam gas sebanding dengan suhu mutlak gas. Oleh karena itu, perubahan suhu gas akan menyebabkan perubahan energi dalam gas. Secara matematis, perubahan energi dalam gas dinyatakan sebagai untuk gas monoatomik untuk gas diatomik Dimana ∆U adalah perubahan energi dalam gas, n adalah jumlah mol gas, R adalah konstanta umum −1 −1 gas (R = 8,31 J mol K , dan ∆T adalah perubahan suhu gas (dalam kelvin). Hukum I Termodinamika Jika kalor diberikan kepada sistem, volume dan suhu sistem akan bertambah (sistem akan terlihat mengembang dan bertambah panas). Sebaliknya, jika kalor diambil dari sistem, volume dan suhu sistem akan berkurang (sistem tampak mengerut dan terasa lebih dingin). Prinsip ini merupakan hukum alam yang penting dan salah satu bentuk dari hukum kekekalan energi. Gambar Sistem yang mengalami perubahan volume akan melakukan usaha dan sistem yang mengalami perubahan suhu akan mengalami perubahan energi dalam. Jadi, kalor yang diberikan kepada sistem akan menyebabkan sistem melakukan usaha dan mengalami perubahan energi dalam. Prinsip ini dikenal sebagai hukum kekekalan energi dalam termodinamika atau disebut hukum I termodinamika. Secara matematis, hukum I termodinamika dituliskan sebagai Q = W + ∆U Dimana Q adalah kalor, W adalah usaha, dan ∆U adalah perubahan energi dalam. Secara sederhana, hukum I termodinamika dapat dinyatakan sebagai berikut. Jika suatu benda (misalnya krupuk) dipanaskan (atau digoreng) yang berarti diberi kalor Q, benda (krupuk) akan mengembang atau bertambah volumenya yang berarti melakukan usaha W dan benda (krupuk) akan bertambah panas (coba aja dipegang, pasti panas deh!) yang berarti mengalami perubahan energi dalam ∆U. Proses Isotermik Suatu sistem dapat mengalami proses termodinamika dimana terjadi perubahan-perubahan di dalam sistem tersebut. Jika proses yang terjadi berlangsung dalam suhu konstan, proses ini dinamakan proses isotermik. Karena berlangsung dalam suhu konstan, tidak terjadi perubahan energi dalam ( ∆U = 0) dan berdasarkan hukum I termodinamika kalor yang diberikan sama dengan usaha yang dilakukan sistem (Q = W). Proses isotermik dapat digambarkan dalam grafik p – V di bawah ini. Usaha yang dilakukan sistem dan kalor dapat dinyatakan sebagai Dimana V2 dan V1 adalah volume akhir dan awal gas. Proses Isokhorik Jika gas melakukan proses termodinamika dalam volume yang konstan, gas dikatakan melakukan proses isokhorik. Karena gas berada dalam volume konstan ( ∆V = 0), gas tidak melakukan usaha (W = 0) dan kalor yang diberikan sama dengan perubahan energi dalamnya. Kalor di sini dapat dinyatakan sebagai kalor gas pada volume konstan QV. QV = ∆U Proses Isobarik Jika gas melakukan proses termodinamika dengan menjaga tekanan tetap konstan, gas dikatakan melakukan proses isobarik. Karena gas berada dalam tekanan konstan, gas melakukan usaha (W = p∆V). Kalor di sini dapat dinyatakan sebagai kalor gas pada tekanan konstan Qp. Berdasarkan hukum I termodinamika, pada proses isobarik berlaku Sebelumnya telah dituliskan bahwa perubahan energi dalam sama dengan kalor yang diserap gas pada volume konstan QV =∆U Dari sini usaha gas dapat dinyatakan sebagai W = Qp − QV Jadi, usaha yang dilakukan oleh gas (W) dapat dinyatakan sebagai selisih energi (kalor) yang diserap gas pada tekanan konstan (Qp) dengan energi (kalor) yang diserap gas pada volume konstan (QV). Proses Adiabatik Dalam proses adiabatik tidak ada kalor yang masuk (diserap) ataupun keluar (dilepaskan) oleh sistem (Q = 0). Dengan demikian, usaha yang dilakukan gas sama dengan perubahan energi dalamnya (W = ∆U). Jika suatu sistem berisi gas yang mula-mula mempunyai tekanan dan volume masingmasing p1 dan V1 mengalami proses adiabatik sehingga tekanan dan volume gas berubah menjadi p2 dan V2, usaha yang dilakukan gas dapat dinyatakan sebagai Dimana γ adalah konstanta yang diperoleh perbandingan kapasitas kalor molar gas pada tekanan dan volume konstan dan mempunyai nilai yang lebih besar dari 1 (γ > 1). Proses adiabatik dapat digambarkan dalam grafik p – V dengan bentuk kurva yang mirip dengan grafik p – V pada proses isotermik namun dengan kelengkungan yang lebih curam. Definisi Hukum Termodinamika Pada umumnya hukum termodinamika sangat berkaitan dengan energi dan lingkungan yang kita ditinggali. Hal ini berkaitan dengan asal kata termodinamika yang diambil dari bahasa Yunani. Thermos yang artinya panas dan dinamic yang berarti perubahan. Sehingga bisa disimpulkan bahwa hukum termodinamika adalah hukum yang berkaitan dengan kekekalan energi. Dan menentukan bahwa adanya peristiwa perpindahan panas merupakan suatu bentuk lain dari perpindahan energi tersebut. Sistem Termodinamika Sejak ditemukan hukum termodinamika, hukum ini telah menjadi salah satu hukum terpenting dalam lingkup ilmu fisika. Sehingga hukum ini sering dikaitkan dengan konsep – konsep yangbersifat universal. Hal ini dikarenakan hukum termodinamika memiliki kebenaran yang bersifat umum. Dan tidak dibatasi dengan adanya rincian dari konsep atau sistem yang mengacu pada penggunaan hukum termodinamika. Untuk sistem termodinamika sendiri telah diklasifikasikan menjadi 3 jenis sistem yang didasarkan pada pertukaran yang terjadi antara sistem dan lingkungannya. Jenis – jenis sistem termodinamika adalah : Sistem terbuka : dimana pada sistem ini terjadi pertukaran benda, energi (panas dan kerja) dengan lingkunganya. Contoh dari sistem ini adalah samudra Sistem tertutup : yaitu keadaan di mana terjadi pertukaran energi (panas dan kerja) namun tidak ada pertukaran yang terjadi antara benda dan lingkungannya, contoh dari sistem ini adalah rumah hijau Sistem terisolasi : sistem isolasi bisa dikatakan merupakan kebalikan dari sistem terbuka, karena dalam sistem ini tidak terjadi pertukaran energi (panas dan kerja) ataupun pertukaran benda dengan lingkungannya. Walaupun pada kenyataannya sebuah sisten tidak mungkin terisolasi sepenuhnya dari pertukaran energi, bahkan dalam wadah terisolasi seperti tabung gas. Karena pada dasarnya tetap ada gaya gravitasi bumi dalam wadah tersebut. Dalam analisisnya, pada sistem isolasi biasanya energi yang masuk sama dengan energi yang keluar. Sehingga energi yang tersisa dalam sistem ini adalah nol, atau bisa dikatakan seperti tidak ada pertukaran benda, energi dengan ligkungannya. HUKUM TERMODINAMIKA 2 Hukum ini sangat berkaitan dengan entropi atau keseimbangan termodinamis, yang menyatakan bahwa pada umumnya energi hanya bisa berpindah dari tempat yang mengandung banyak energi ke tempat yang kurang mengandung energi. Hukum kedua ini bisa digambarkan dengan terjadinya angin. Proses yang tidak dapat dibalik arahnya dinamakan proses irreversibel. Proses yang dapat dibalik arahnya dinamakan proses reversibel. Peristiwa di atas mengilhami terbentuknya hukum II termidinamika. Hukum II termodinamika membatasi perubahan energi mana yang dapat terjadi dan yang tidak dapat terjadi. Pembatasan ini dapat dinyatakan dengan berbagai cara, antara lain, hukum II termodinamika dalam pernyataan aliran kalor: “Kalor mengalir secara spontan dari benda bersuhu tinggi ke benda bersuhu rendah dan tidak mengalir secara spontan dalam arah kebalikannya”; hukum II termodinamika dalam pernyataan tentang mesin kalor: “ Tidak mungkin membuat suatu mesin kalor yang bekerja dalam suatu siklus yang sematamata menyerap kalor dari sebuah reservoir dan mengubah seluruhnya menjadi usaha luar”; hukum II termodinamika dalam pernyataan entropi: “Total entropi semesta tidak berubah ketika proses reversibel terjadi dan bertambah ketika proses ireversibel terjadi”. Penerapan Hukum II Termodinamika Hukum I termodinamika menyatakan bahwa energi adalah kekal, tidak dapat diciptakan dan tidak dapat dimusnahkan. Energi hanya dapat berubah dari satu bentuk ke bentuk lainnya. Berdasarkan teori ini, Anda dapat mengubah energi kalor ke bentuk lain sesuka Anda asalkan memenuhi hukum kekekalan energi. Namun, kenyataannya tidak demikian. Energi tidak dapat diubah sekehendak Anda. Misalnya, Anda menjatuhkan sebuah bola besi dari suatu ketinggian tertentu. Pada saat bola besi jatuh, energi potensialnya berubah menjadi energi kinetik. Saat bola besi menumbuk tanah, sebagian besar energi kinetiknya berubah menjadi energi panas dan sebagian kecil berubah menjadi energi bunyi. Sekarang, jika prosesnya Anda balik, yaitu bola besi Anda panaskan sehingga memiliki energi panas sebesar energi panas ketika bola besi menumbuk tanah, mungkinkah energi ini akan berubah menjadi energi kinetik, dan kemudian berubah menjadi energi potensial sehingga bola besi dapat naik? Peristiwa ini tidak mungkin terjadi walau bola besi Anda panaskan sampai meleleh sekalipun. Hal ini menunjukkan proses perubahan bentuk energi di atas hanya dapat berlangsung dalam satu arah dan tidak dapat dibalik. Proses yang tidak dapat dibalik arahnya dinamakan proses irreversibel. Proses yang dapat dibalik arahnya dinamakan proses reversibel. Peristiwa di atas mengilhami terbentuknya hukum II termidinamika. Hukum II termodinamika membatasi perubahan energi mana yang dapat terjadi dan yang tidak dapat terjadi. Pembatasan ini dapat dinyatakan dengan berbagai cara, antara lain, hukum II termodinamika dalam pernyataan aliran kalor: “Kalor mengalir secara spontan dari benda bersuhu tinggi ke benda bersuhu rendah dan tidak mengalir secara spontan dalam arah kebalikannya”; hukum II termodinamika dalam pernyataan tentang mesin kalor: “Tidak mungkin membuat suatu mesin kalor yang bekerja dalam suatu siklus yang semata-mata menyerap kalor dari sebuah reservoir dan mengubah seluruhnya menjadi usaha luar”; hukum II termodinamika dalam pernyataan entropi: “Total entropi semesta tidak berubah ketika proses reversibel terjadi dan bertambah ketika proses ireversibel terjadi”. Hukum II Termodinamika memberikan batasan-batasan terhadap perubahan energi yang mungkin terjadi dengan beberapa perumusan. 1. Tidak mungkin membuat mesin yang bekerja dalam satu siklus, menerima kalor dari sebuah reservoir dan mengubah seluruhnya menjadi energi atau usaha luas (Kelvin Planck). 2. Tidak mungkin membuat mesin yang bekerja dalam suatu siklus mengambil kalor dari sebuah reservoir rendah dan memberikan pada reservoir bersuhu tinggi tanpa memerlukan usaha dari luar (Clausius). 3. Pada proses reversibel, total entropi semesta tidak berubah dan akan bertambah ketika terjadi proses irreversibel (Clausius). a. Pengertian Entropi Dalam menyatakan Hukum Kedua Termodinamika ini, Clausius memperkenalkan besaran baru yang disebut entropi (S). Entropi adalah besaran yang menyatakan banyaknya energi atau kalor yang tidak dapat diubah menjadi usaha. Ketika suatu sistem menyerap sejumlah kalor Q dari reservoir yang memiliki temperatur mutlak, entropi sistem tersebut akan meningkat dan entropi reservoirnya akan menurun sehingga perubahan entropi sistem dapat dinyatakan dengan persamaan ΔS = Q/T tersebut berlaku pada sistem yang mengalami siklus reversibel dan besarnya perubahan entropi (ΔS) hanya bergantung pada keadaan akhir dan keadaan awal sistem. Ciri proses reversibel adalah perubahan total entropi ( ΔS = 0) baik bagi sistem maupun lingkungannya. Pada proses irreversibel perubahan entropi semesta ΔSsemestea > 0 . Proses irreversibel selalu menaikkan entropi semesta. ΔSsistem + ΔSlingkungan = ΔSseluruhnya > 0 b. Mesin Pendingin Mesin yang menyerap kalor dari suhu rendah dan mengalirkannya pada suhu tinggi dinamakan mesin pendingin (refrigerator). Misalnya pendingin rungan (AC) dan almari es (kulkas). Perhatikan Gambar 9.9! Kalor diserap dari suhu rendah T2 dan kemudian diberikan pada suhu tinggi T1. Berdasarkan hukum II termodinamika, kalor yang dilepaskan ke suhu tinggi sama dengan kerja yang ditambah kalor yang diserap (Q1 = Q2 + W) Gambar 9.9 Siklus mesin pendingin. Hasil bagi antara kalor yang masuk (Q1) dengan usaha yang diperlukan (W) dinamakan koefisien daya guna (performansi) yang diberi simbol Kp. Secara umum, kulkas dan pendingin ruangan memiliki koefisien daya guna dalam jangkauan 2 sampai 6. Makin tinggi nilai Kp, makin baik kerja mesin tersebut. Kp = Q2 /W Untuk gas ideal berlaku: Keterangan Kp : koefisien daya guna Q1 : kalor yang diberikan pada reservoir suhu tinggi (J) Q2 : kalor yang diserap pada reservoir suhu rendah (J) W : usaha yang diperlukan (J) T1 : suhu reservoir suhu tinggi (K) T2 : suhu reservoir suhu rendah (K) ENTROPI DAN HUKUM KEDUA TERMODINAMIKA ~ Pengalaman sehari-hari menunjukkan bahwa sebuah kolam tidak membeku di musim panas. Jika sebuah benda panas berinteraksi dengan benda dingin, maka tak terjadi bahwa benda panas tersebut semakin panas dan benda dingin semakin dingin, meskipun proses-proses tersebut tidaklah melanggar hukum kekekalan energi yang dinyatakan sebagai hukum pertama termodinamika. Hukum kedua termodinamika berkaitan dengan apakah proses-proses yang dianggap taat azas dengan hukum pertama, terjadi atau tidak terjadi di alam. Hukum kedua termodinamika seperti yang diungkapkan oleh Clausius mengatakan, “Untuk suatu mesin siklis maka tidak mungkin untuk menghasilkan efek lain, selain dari menyampaikan kalor secara kontinu dari sebuah benda ke benda lain pada temperatur yang lebih tinggi". Bila ditinjau siklus Carnot, yakni siklus hipotesis yang terdiri dari empat proses terbalikkan: pemuaian isotermal dengan penambahan kalor, pemuaian adiabatik, pemampatan isotermal dengan pelepasan kalor dan pemampatan adiabatik; jika integral sebuah kuantitas mengitari setiap lintasan tertutup adalah nol, maka kuantitas tersebut yakni variabel keadaan, mempunyai sebuah nilai yang hanya merupakan ciri dari keadaan sistem tersebut, tak peduli bagaimana keadaan tersebut dicapai. Variabel keadaan dalam hal ini adalah entropi. Perubahan entropi hanya gayut keadaan awal dan keadaan akhir dan tak gayut proses yang menghubungkan keadaan awal dan keadaan akhir sistem tersebut. Hukum kedua termodinamika dalam konsep entropi mengatakan, "Sebuah proses alami yang bermula di dalam satu keadaan kesetimbangan dan berakhir di dalam satu keadaan kesetimbangan lain akan bergerak di dalam arah yang menyebabkan entropi dari sistem dan lingkungannya semakin besar". Jika entropi diasosiasikan dengan kekacauan maka pernyataan hukum kedua termodinamika di dalam proses-proses alami cenderung bertambah ekivalen dengan menyatakan, kekacauan dari sistem dan lingkungan cenderung semakin besar. Di dalam ekspansi bebas, molekul-molekul gas yang menempati keseluruhan ruang kotak adalah lebih kacau dibandingkan bila molekul-molekul gas tersebut menempati setengah ruang kotak. Jika dua benda yang memiliki temperatur berbeda T 1 dan T2 berinteraksi, sehingga mencapai temperatur yang serba sama T, maka dapat dikatakan bahwa sistem tersebut menjadi lebih kacau, dalam arti, pernyataan "semua molekul dalam sistem tersebut bersesuaian dengan temperatur T adalah lebih lemah bila dibandingkan dengan pernyataan semua molekul di dalam benda A bersesuaian dengan temperatur T1 dan benda B bersesuaian dengan temperatur T 2". Di dalam mekanika statistik, hubungan antara entropi dan parameter kekacauan adalah, pers. (1): S = k log w dimana k adalah konstanta Boltzmann, S adalah entropi sistem, w adalah parameter kekacauan, yakni kemungkinan beradanya sistem tersebut relatif terhadap semua keadaan yang mungkin ditempati. Jika ditinjau perubahan entropi suatu gas ideal di dalam ekspansi isotermal, dimana banyaknya molekul dan temperatur tak berubah sedangkan volumenya semakin besar, maka kemungkinan sebuah molekul dapat ditemukan dalam suatu daerah bervolume V adalah sebanding dengan V; yakni semakin besar V maka semakin besar pula peluang untuk menemukan molekul tersebut di dalam V. Kemungkinan untuk menemukan sebuah molekul tunggal di dalam V adalah, pers. (2): W1 = c V dimana c adalah konstanta. Kemungkinan menemukan N molekul secara serempak di dalam volumeV adalah hasil kali lipat N dari w. Yakni, kemungkinan dari sebuah keadaan yang terdiri dari Nmolekul berada di dalam volume V adalah, pers.(3): N N w = w1 = (cV) . Jika persamaan (3) disubstitusikan ke (1), maka perbedaan entropi gas ideal dalam proses ekspansi isotermal dimana temperatur dan banyaknya molekul tak berubah, adalah bernilai positip. Ini berarti entropi gas ideal dalam proses ekspansi isotermal tersebut bertambah besar. Definisi statistik mengenai entropi, yakni persamaan (1), menghubungkan gambaran termodinamika dan gambaran mekanika statistik yang memungkinkan untuk meletakkan hukum kedua termodinamika pada landasan statistik. Arah dimana proses alami akan terjadi menuju entropi yang lebih tinggi ditentukan oleh hukum kemungkinan, yakni menuju sebuah keadaan yang lebih mungkin. Dalam hal ini, keadaan kesetimbangan adalah keadaan dimana entropi maksimum secara termodinamika dan keadaan yang paling mungkin secara statistik. Akan tetapi fluktuasi, misal gerak Brown, dapat terjadi di sekitar distribusi kesetimbangan. Dari sudut pandang ini, tidaklah mutlak bahwa entropi akan semakin besar di dalam tiap-tiap proses spontan. Entropi kadang-kadang dapat berkurang. Jika cukup lama ditunggu, keadaan yang paling tidak mungkin sekali pun dapat terjadi: air di dalam kolam tiba-tiba membeku pada suatu hari musim panas yang panas atau suatu vakum setempat terjadi secara tiba-tiba dalam suatu ruangan. Hukum kedua termodinamika memperlihatkan arah peristiwa-peristiwa yang paling mungkin, bukan hanya peristiwa-peristiwa yang mungkin. Hukum pertama Termodinamika Pada prinsipnya , energy tidak dapat diciptakan atau dimusnahkan, hanya dapat mengubah dari satu bentuk ke bentuk energy yang lain. Contoh, perubahan bentuk energy adalah energy listrik diubah menjadi energy kalor, energy angin diubah menjadi energy mekanik, dan energy mekanik diubah menjadi kalor. Definisi energy dalam merupakan jumlah total semua energy molekul pada system. Energi dalam system akan naik jika usaha dilakukan padanya atau kalor ditambahkan pada system. Energi dalam akan menurun jika kalor keluar dari system atau usaha dilakukan oleh system pada yang lainnya. Perubahan energy dalam ( ∆U ) pada system yang tertutup akan sama dengan kalor yang ditambahkan ke system dikurangi usaha yang dilakukan oleh system. Secara matematis dapat ditulis : ∆U = Q – W Keterangan : Q = Kalor yang diberikan ∆U = Perubahan energy dalam W = Usaha yang dilakukan Tanda ( W ) merupakan usaha yang dilakukan oleh system, maka ( W ) bernilai negative dan U akan bertambah. Untuk Q bernilai positif jika kalor ditambahkan ke system dan jika kalor meninggalkan system, Q akan bernilai negative. Kalor ( Q ) dan usaha ( W ) menyatakan energy yang ditransfer kedalam atau keluar system, energy dalam ( U ) juga ikut bertambah. Berarti, Hukum 1 Termodinamika merupakan pernyataan hukum kekekalan energy. - Inti dari Hukum 1 Termodinamika adalah energy bersifat kekal yang berbunyi : “ Meskipun energy kalor telah berubah menjadi energy mekanik, usaha luar dan energy dalam jumlah seluruhnya adalah tetap yang dinyatakan dengan rumus : ∆Q = ∆U + ∆W ∆Q = Kalor yang diberi atau dilepas pada system joule ∆U = Perubahan energy dalam ∆W = Usaha luar yang dilakukan oleh gas joule Catatan : ∆W bertanda positif → bila system melakukan kerja. ∆W bertanda negative → bila system menerima kerja. ∆Q bertanda positif → bila system menerima kalor. ∆Q bertanda negative → bila system melepas kalor. - Sistem adalah sejumlah gas yang terdapat dalam wadah tertutup. Penerapan Hukum 1 Termodinamika : Pada proses Isotermis = Berlangsung pada suhu tetap ∆T = 0 → ∆U = 0 ∆Q = ∆W - Pada proses Isokhorik = Berlangsung pada volume tetap ∆V = 0 → ∆W = 0 ∆Q = ∆U - Pada proses Isobarik = Berlangsung pada tekanan tetap ∆P = 0 → ∆W = P∆V = P(V₂ - V₁) dan berlaku ∆U = Q + P(V₂ - V₁) - Pada proses Adiabatik = Berlangsung tanpa ada perpindahan panas antara system lingkungan ∆Q = 0 ∆U = - ∆W - Sistem Carnot adalah proses dimana satu gas yang melakukan proses dapat dikembalikan ke keadaan semula, sehingga gas dapat melakukan usaha kembali. Kerja yang dilakukan oleh mesin carnot : W = Q₁ [1 - T₂/T₁ ] Atau W = Q₁ - Q₂ Efisiensi mesin carnot : η = [1 - T₂/T₁ ] x 100 % Sedangkan Efisiensi mesin : η= [1 - Q₂/Q₁ ] x 100 % Q₁ = Kalor yang diberikan pada gas oleh reservoir suhu T₁ Q₂ = Kalor yang dilepas oleh gas pada reservoir suhu rendah T₂ TUGAS FISIKA NAMA :R. MIRZA IMAMI KLS XII TPM