Studi regenerasi tanaman jeruk keprok batu 55
advertisement

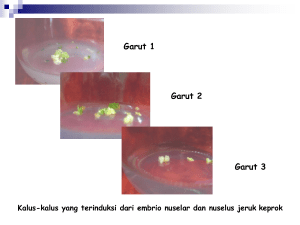
5 TINJAUAN PUSTAKA Botani Tanaman Jeruk Keprok Batu 55 Tanaman jeruk keprok (citrus reticulata. L) varietas Batu 55 merupakan tanaman subtropik yang dapat tumbuh dan berproduksi secara optimal pada suhu optimum 25 - 30 °C. Curah hujan optimal untuk pertumbuhan dan produksi adalah 1.900 -2.400 mm/tahun dengan rata-rata 2 - 4 bulan basah dan 3 - 5 bulan kering. Tanah yang cocok bertekstur gembur, berpasir, hingga lempung berliat dengan kedalaman efektif lebih dari 60 cm. Tingkat keasaman tanah (pH) yang optimum sekitar 5 - 7, cocok adalah ditanam di daerah dengan ketinggian 700 1300 m dpl. Untuk dataran rendah tanaman jeruk keprok dapat tumbuh pada ketinggian 100 – 400 m dari permukaan laut (dpl). Jeruk keprok menghendaki iklim relatif kering dengan lama masa kering sekitar 3 bulan untuk proses pembungan dan berada di tempat terbuka. Klasifikasi Citrus reticulata L. dalam sistematika tumbuhan (Van Steenis 1975) adalah sebagai berikut: Divisi : Spermatophyta Subdivisio : Angiospermae Class : Dicotyledonae Ordo : Rutales Familia : Rutaceae Subfamili : Aurantioidae Genus : Citrus Spesies : Citrus reticulata L Tumbuhan ini merupakan jenis pohon dengan tinggi 2 - 5 meter. Tajuknya tidak beraturan, dahan kecil, cabangnya banyak, dan tajuknya rindang. Daun berbentuk tunggal, kecil, helaian daun berbentuk bulat telur memanjang, elliptic atau berbentuk lanset dengan ujung tumpul, sedikit melekuk ke dalam. Tepi daun bergerigi beringgit sangat lemah dengan panjang 3,5 - 8 cm bertangkai pendek. Daun berwarna hijau tua, pada permukaan atas daun mengkilat. Tangkai daun bersayap sangat sempit sampai tidak bersayap, dengan panjang 0,5 - 1,5 cm. 6 Tanaman ini berbunga majemuk dimana bunga keluar dari ketiak daun atau pada ujung. Daun berbentuk cawan bulat telur dan tajuk bunga umumnya berjumlah lima lembar. Bekal buah berbentuk seperti bola dengan diameter rata-rata 0,1 - 0,2 cm. Buah yang sudah jadi bentuknya agak besar hampir seragam menyerupai bentuk bola tertekan dengan diameter cabang, bentuk bunga bulat telur panjang ke arah pangkal seragam dan berbau harum. Tangkai bunga pendek dengan bunga pelindungnya kecil, kelopak 5 - 8 cm dengan ruang buah (septa buah) 9 - 19. Tebal kulitnya 0,2 - 0,3 cm mudah dikupas, penuh pori-pori dan daging buahnya berwarna oranye dan sedikit berbau harum. Daging buah banyak mengandung air, tiap sapta mengandung banyak biji lebih kurang 10 - 30 biji (Badan Litbang Departement Pertanian 2006). Perkembangan Jeruk Keprok Karakter tanpa biji, muda dikupas, penampilan yang menarik, dan rasa yang manis merupakan karakteristik utama untuk pasar buah jeruk segar pada saat ini (Ladaniya 2008). Selain untuk dikonsumsi sebagai buah segar, karakter unggul tersebut sangat diharapkan oleh industri yang bergerak dibidang pembuatan jus, suplemen vitamin, dan senyawa aromatik. Masalah yang dijumpai pada buah jeruk sering dikaitkan dengan senyawa aromatik yang tidak menguntungkan, tingkat kepahitan akibat jumlah biji yang banyak dan tampilan yang kurang menarik (Singh & Rajam 2009). Perkembangan jeruk keprok di Indonesia mengalami ketidakstabilan bahkan cenderung mengalami penurunan, hal tersebut ditandai dengan masih tinginya angka impor jeruk keprok tersebut. Penurunan produksi jeruk keprok tersebut diakibatkan oleh beberapa faktor seperti serangan hama dan penyakit yang ditimbulkan akibat perubahan iklim. Gencarnya impor buah khususnya jenis keprok juga mengakibatkan konsumen jeruk keprok lokal beralih untuk mengkonsimsi jeruk keprok impor yang memiliki karakter-karakter unggul atau beralih ke jeruk jenis Siam. Perbaikan sifat genetik sangat penting dilakukan untuk perbaikan mutu buah jeruk terutama untuk perakitan buah unggul. Program pemuliaan tersebut dilakukan melalui pemuliaan konvensional (hibridisasi), pemuliaan, mutasi dan teknik bioteknologi. Namun, pemuliaan untuk jeruk keprok masih dihadapkan 7 dengan beberapa tingkat kesulitan seperti inkompatibilitas dan heterosigositas yang tinggi. Karakter unggul pada jeruk sangat dipengaruhi oleh aksesi jeruk dan faktor lingkungan (Mayer et al. 2009) Jeruk Mukaku Kishiu merupakan salah satu jenis jeruk yang benar-benar tanpa biji walau dalam kondisi lingkungan apapun, sementara pada Navel orange dan Mandarin Satsuma pada umumnya tanpa biji, namun jika dilakukan penyerbukan pada lingkungan yang berbeda akan menghasilkan biji (Olitrault et al. 2007). Perbaikan sifat secara konvensional telah lama dikembangkan untuk perbaikan karakter akan tetapi masih terkendala oleh beberapa faktor seperti sifat inkompatibilitas pada tanaman. Selain itu, waktu yang digunakan untuk persilangan secara konvensional masih tergolong lama. Persilangan konvensianal pada intergeneric antara jeruk kultivar Kiyomi Tangor dengan jeruk Meiwa Kumquat untuk membentuk triploid dibutuhkan waktu ± 6 tahun (Yasuda et al. 2010). Sulitnya mendapatkan tanaman bebas virus juga menjadi kendala dalam perbaikan sifat tanaman. Terlepas dari teknik pemuliaan yang digunakan, beberapa varietas komersial penting jeruk keprok seperti Batu 55, Garut, SoE, dan Konde telah dikembangan melalui teknik induksi mutasi. Teknik induksi seperti iradiasi atau mutagen kimia dapat meningkatkan keragaman dalam spesies tanaman. Sifat acak yang dimiliki induksi mutasi yang menyebabkan arah mutasi tidak bisa diatur sehingga sulit dalam memperbaiki sifat genetik secara khusus (Sutarto 2009). Untuk mengatasi kelemahan-kelemahan pemuliaan jeruk keprok di atas maka perlu adanya sentuhan bioteknologi melalui teknik kultur jaringan. Perbaikan sifat melalui teknik kultur jaringan pada jeruk khususnya embrio somatik telah lama dikembangkan dan terbuki memberikan hasil yang baik (Husni 2010). Perkembangan Jeruk Keprok Batu 55 Jeruk keprok Batu 55 banyak disukai karena beberapa sifat unggul yang secara alami telah dimiliki seperti aroma dan rasa yang khas yang tidak terdapat pada jeruk manis pada umumnya. Manfaat lain dari jeruk keprok tidak hanya terfokus pada daging buah saja akan tetapi pada bagian kulit juga terkandung beberapa senyawa metabolit sekunder (Copriady et al.2005). Kulit jeruk jenis keprok mempunyai berbagai macam senyawa diantaranya tangeraxanthin, 8 tangeritin, terpinen-4-ol, terpineolene, tetradecanal, threonine, thymol, thymylmethyl-ether, tryptophan, tyrosine, nobiletin, cis-3-hexenol, cis-carveol, citricacid, citronellal, citronellic-acid, citronellyl-acetate, cystine, decanal, decanoicacid, decanol. Senyawa dalam kulit jeruk keprok yang memiliki aktivitas antikanker adalah tangeritin dan nobiletin. Tangeritin merupakan senyawa methoxyflavone yang mempunyai potensi sebagai agen antikanker (Ardiani et al. 2008). Gambar 2. Jeruk keprok Batu 55 (sumber dokumen pribadi) Gambar 2 menunjukkan bahwa jeruk keprok batu 55 memiliki penampilan yang menarik dengan karakter warna kulit orange dengan daging berwarna kuning kemerahan. Selain rasa yang manis dan tanpa biji karakter panampilan yang menarik merupakan syarat untuk pasar buah segar. Perkembangan jeruk keprok Batu 55 masih mengalami hambatan, terutama dalam memproduksi bibit yang bebas penyakit. Sulitnya mendapatkan bibit yang bebas virus dan seragam menjadi kendala dalam usaha peningkatan produksi jeruk keprok Batu 55. Menurut Deptan (2010) luas area pertanaman jeruk keprok Batu 55 di kota Batu mencapai 25 Ha. Dari 25 Ha area pertanaman hanya 5 Ha area terluas ditanami jeruk keprok Batu 55 yang terletak di dusun Dresel kecamatan Batu. Selain itu ada juga yang ditanam di area tempat tinggal penduduk. Tidak tersedianya bibit yang bebas penyakit menjadikan para petani jeruk keprok tidak optimum dalam usaha peningkatkan produksi jeruk tersebut. 9 Penyediaan bibit secara seperti: okulasi, cangkok, stek, dan perbanyakan melalui biji masih memiliki kelemahan sehingga perlu adanya peran teknik bioteknologi untuk mengatasi kelemahan tersebut. Teknik ES sangat membantu program peerbaikan sifat pada tanaman jeruk. Melalui teknik ES banyak kegiatan pemuliaan yang bisa dilakukan seperti mendapatkan tanaman bebas dari penyakit yang disebabkan oleh virus (D'Onghia et al. 2001), ketahanan terhadap salinitas (Carimi 2007), micro grafting (Germana et al. 2000), bahan fusi protoplas (Husni 2010), bahan transformasi gen (Bond et al. 1998) dan mutasi (Ling et al. 2000). Perbanyakan bibit secara massal dan bebas dari virus dan seragam juga dapat diusahakan melalui jalur embrio somatik (Sutanto & Azzis 2006). Kultur Jaringan Tanaman Jeruk Perbanyakan tanaman secara kultur jaringan dikembangkan berdasarkan teori sel yang pertama kali dikemukakan oleh Scheleiden dan Schawn, yaitu totipotensi sel. Namun kemudian pada perkembangannya teknik kultur jaringan menjadi sarana penting dalam bidang fisiologi tumbuhan dan dalam aspek biokimia tumbuh-tumbuhan serta pemuliaan tanaman (zulkarnain 2009). Totipotensi didefinisikan sebagai kemampuan setiap sel yang dari manapun sumbernya untuk berdeferensiasi dan tumbuh membentuk individu yang sempurna apabila sel tersebut ditumbuhkan pada lingkungan yang sesuai untuk pertumbuhannya dan terkendali (Doyle & Griffiths 1999). Teknik kultur jaringan pada tanaman jeruk berguna dalam mendapatkan tanamanan atau bibit dalam jumlah banyak dalam waktu singkat, mendapatkan tanaman yang bebas penyakit terutama virus, preservasi plasma nutfah yang bebas penyakit, terutama yang digunakan untuk pemuliaan (Alkhyari & Albahrany 2001). Selain itu perbaikan sifat juga dapat dilakukan dengan seleksi, transfer gen dan produksi senyawa–senyawa kimia yang bernilai ekonomi tinggi. Copriady et al. (2005) menyatakan bahwa pada jeruk mengandung senyawa metabolit skunder kumarin yang berfungsi sebagai antikoagulan darah dan dapat menghambat efek karsinogenik. Sedangkan kandungan flavanoid dan limbonoid juga ditemukan pada berbagai fase pertumbuhan jeruk Kalamondin dan purut (Devy et al. 2010). Keberhasilan teknik kultur jaringan pada tanaman berkayu khususnya tanaman jeruk sangat dipengaruhi oleh beberapa faktor penting seperti 10 bahan tanaman (eksplan), medium pertumbuhan, zat pengatur tumbuh yang digunakan (auksin, sitokinin, giberelin, zat inhibitor) dan asam amino (Carimi 2005). Ladaniya (2008) menyatakan bahwa kultur jaringan pada jeruk telah lama dipergunakan sebagai metode untuk propagasi dan perbaikan sifat. Perbaikan sifat jeruk melalui kultur jaringan dapat dilakukan dengan berbagai cara seperti teknik ES, induksi mutasi, fusi protoplas, variasi somaklonal, dan seleksi in vitro (Yuwono 2008). Eksplan merupakan faktor utama yang menentukan keberhasilan suatu teknik kultur jaringan. Penggunaan eksplan dalam teknik kultur jaringan pada dasarnya adalah pemanfaatan sifat totipotensi sel yang terdapat pada eksplan (Wetter & Constabel 1992). Sifat tersebut mungkin terdapat pada semua jaringan tanaman akan tetapi ekspresinya terbatas pada kondisi tertentu yaitu sel yang meristematik. Ada lima faktor yang harus diperhatikan dalam regenerasi in vitro dari eksplan, yaitu: organ yang digunakan, umur fisiologis, musim pada saat pengambilan eksplan, ukuran eksplan dan kualitas tanaman asal. Hampir semua jaringan tanaman dapat dijadikan eksplan akan tetapi memerlukan kajian khusus untuk mempelajari sistem perkembangan sel hingga menjadi jaringan. Daun, kotiledon, hipokotil, bagian dari embrio, struktur repoduktif, tunas aksilar dan tunas lateral merupakan organ yang umum untuk regenerasi secara in vitro. Media tanam yang digunakan dalam teknik kultur jaringan berperan sangat penting. Media kultur pada prinsipnya harus dapat menyediakan unsur–unsur hara untuk pertumbuhan seperti tanaman di lapang. Umumnya media pada teknik kultur jaringan terdiri dari campuran garam-garam anorganik, karbon, vitamin, asam amino, dan zat pengatur tumbuh. Beberapa kasus tertentu penggunaan arang aktif biasa digunakan pada media tanam. Dalam kultur jaringan dikenal beberapa jenis media yang umum digunakan diantaranya media solid dan cair. Pemilihan jenis media tergantung pada jenis tanaman, faktor aerasi, bentuk pertumbuhan dan diferensiaisi yang diinginkan. Sukrosa merupakan persenyawaan yang paling sering digunakan sebagai sumber energi dalam media kultur. Ammirato (1983) menyatakan embriogenesis somatik in vitro tanaman dikotil menggunakan sukrosa pada konsentrasi 2-4 %. 11 Persenyawaan lain yang dapat digunakan adalah glukosa, maltosa dan fruktosa (Altaf et al. 2009). Tomaz et al. (2001) menyatakan bahwa jenis dan konsentrasi gula sebagai sumber energi sangat mempengaruhi inisiasi kalus embriogenik jeruk keprok. Vitamin yang paling sering digunakan dalam media kultur jaringan tanaman adalah thiamin, niacin, dan pyridoxine (Gunawan 1992). Beberapa media juga mengandung pantotenat dan biotin (Gamborg & Shyluk 1981). Penambahan myoinositol pada media kultur dapat memperbaiki pertumbuhan dan morfogenesis, sehingga sering dipandang sebagai golongan vitamin untuk tanaman (George & Sherrington 1984). Asam-asam amino merupakan sumber nitrogen organik yang lebih cepat tersedia dari pada nitrogen yang terdapat dalam bentuk nitrogen anorganik media (shiaty et al. 2004). Asam amino yang umum digunakan pada media kultur adalah sistein, L-glutamin, asparagin, L-arigin, l-tirosin, glisin serta campuran glutamin dan asparagin serta campuran asam amino kompleks seperti kasein hidrolisat, ekstak mal dan yeast ekstrak. Konsentrasi glutamin dan asparagin yang umum digunakan 100 mg/l, L-argini dan sistein 10 mg/l, L-tirosin 100 mg/l, glisin 2 mg/l dan asam amino kompleks 0.05% - 0.1% (Wattimena 1999). Zat pengatur tumbuh (ZPT) merupakan faktor yang menentukan arah perkembangan eksplan. ZPT memainkan peranan yang sangat penting terhadap pertumbuhan dan perkembangan, pembelahan, pembesaran dan diferensiasi sel (Zulkarnain 2009; Davies 2004). Tanpa ZPT pertumbuhan dan perkembangan tanaman dapat terganggu sebab untuk pembelahan sel dan pembesaran volume sel suatu jaringan memerlukan ZPT tertentu terutama dari golongan auksin dan sitokinin (Wattimena 1998). Interaksi dan perimbangan antara ZPT yang diberikan dalam media dan yang diproduksi secara endogen menentukan arah perkembangan suatu kultur. Pemberian auksin yang lebih tinggi dari sitokinin akan menyebabkan diferensiasi mengarah kepada pertumbuhan akar, sebaliknya jika sitokinin lebih tinggi dari auksin, diferensiaisi akan mengarah kepada pertumbuhan tunas (Santoso dan Nursandi 2001). ZPT merupakan senyawa organik bukan nutrisi yang dalam konsentrasi rendah dapat bersifat mendorong, menghambat atau secara kualitatif mengubah pertumbuhan dan perkembangan tanaman (Watimena 1992). ZPT dapat menstimulasi pembelahan dan 12 perkembangan sel, terkadang jaringan atau eksplan dapat memproduksi ZPT sendiri (endogen). Menurut Gunawan (1992) pemberian ZPT dari luar adalah untuk mengubah nisbah ZPT yang ada pada tanaman. Perubahan nisbah selanjutnya dapat mengubah laju pertumbuhan dan perkembangan tanaman. Penggunaan konsentrasi ZPT yang tepat dapat menghasilkan perkembangan sel ke arah yang dikehendaki. Berdasarkan kegunanya ZPT digolongkan kedalam lima golongan yaitu: auksin, sitokinin, asam absisik (ABA), giberelin dan etilen. Menurut Wattimena (1998) 2,4-D merupakan salah satu auksin yang mempunyai aktivitas tinggi jika dibandingkan dengan auksin alami seperti IAA. Senyawa 2,4-D digunakan secara luas dalam kultur jaringan terutama untuk merangsang pembentukan kalus yang bersifat embriogenik. Hal tersebut disebabkan karena 2,4-D merupakan auksin sintesis yang sangat aktif dan kuat, cukup resisten terhadap degradasi ensimatik dan proses konjungasi dengan senyawa lain (Moore 1979). Sedangkan kelompok sitokinin yang sering digunakan untuk membantu penginduksian kalus yaitu BAP dan kinetin. Sitokinin berperan dalam pembelahan sel pada jaringan yang digunakan sebagai eksplan. Menurut Wattimena (1992) pada beberapa tanaman sitokinin sangat dibutuhkan untuk proliferasi kalus. Husni (2010) menyatakan bahwa pemberian BAP dapat digunakan untuk proliferasi kalus embriogenik jeruk Siam. Sitokinin di dalam kultur jaringan tanaman dapat berfungsi antara lain untuk proses pembelahan sel. Selain meningkatkan pembelahan sel dan inisiasi tunas, sitokinin terlibat pula di dalam kontrol perkecambahan biji, mempengaruhi absisi daun dan transpor auksin (Davies 2004). Terdapat kisaran interaksi yang luas antara kelompok auksin dan sitokinin. Keduanya berinteraksi pula dengan senyawa-senyawa kimia lainnya yang dipengaruhi oleh faktor lingkungan seperti suhu dan cahaya (Gunawan 2002). Auksin pada kondisi tertentu dapat bersifat seperti sitokinin ataupun sebaliknya. Meskipun demikian, baik auksin dan sitokinin keduanya seringkali digunakan secara bersamaan pada media kultur untuk menginduksi pola morfogenesis tertentu, walaupun rasio untuk menginduksi perakaran maupun tunas tidak selalu bersamaan (Zulkarnain 2009). 13 Kelompok ZPT GA3 merupakan kelompok ZPT yang paling banyak dijumpai di dalam tanaman. Hampir pada setiap perkembangan tanaman GA3 berperan aktif termasuk pada proses perkecambahan benih, pembentukan trikoma pada daun, pemanjangan batang dan daun, induksi pembungaan, perkembangan anter dan buah serta perkembangan benih (Acar et al 2010). Penggunaan GA3 pada kultur jaringan khususnya untuk elongasi tunas. GA3 akan mendorong percepatan pertumbuhan dari setiap sel jaringan sehingga perkembangan tanaman menjadi optimal. Ricci et al. 2001 menyatakan bahwa penambahan GA3 pada media kultur dapat memperbesar peluang jeruk untuk melakukan proses elongasi tunas. Embriogenesis Somatik Perkembangan media kultur jaringan dalam perbanyakan sel dan jaringan vegetatif telah sampai pada level yang memungkinkan untuk melakukan industrialisasi perbenihan dan penyediaan bahan dasar industri. Selain mampu menghasilkan tanaman yang sama dengan induknya, menghasilkan tanaman yang bebas patogen sistemik, memungkinkan untuk propagasi tanaman secara masal, dan mengatasi perbanyakan tanaman yang tidak dapat diperbanyak secara konvensional (zulkarnain 2009). Teknologi ini kemudian dikenal dengan istilah teknologi embriogenesis somatik. Embriogenesis somatik merupakan teknologi yang sangat efisien dan memiliki potensi propagasi secara massa yang komersil dengan biaya yang relatif murah. Embrio somatik berpotensi dikembangkan dalam sistem regenerasi tanaman karena kapasitas proliferasi yang tinggi, memungkinkan untuk mendapatkan sel tunggal yang dapat menghindarkan dari resiko kimera pada pemuliaan mutasi dan teknologi rekombinan DNA ( Lou et al. 1999) Embriogenesis somatik merupakan suatu proses berkembangnya sel somatik menjadi suatu jaringan tanpa melalui adanya fusi gamet. Selama fase awal embriogenesis, sel-sel somatik harus memulai beberapa fase perkembangan seperti dediferensiasi, induksi dan arah perkembangan . Pierk (1987) menyatakan bahwa embrio somatik bisa terjadi secara langsung dan tidak langsung. Secara langsung yaitu proses terbentuknya embrio tanpa melalui proses kalus sedangkan tidak langsung dimana proses pembentukan embrio melalui proses pembentukan 14 kalus. Proses embrio somatik dimulai dengan terbentuknya sel-sel yang embriogenik berukuran kecil dengan isi sitoplasma yang penuh, nukleus yang besar, vakuola yang kecil dan kaya akan butiran-butiran pati yang padat, kemudian sel-sel tersebut berubah menjadi pre embrio yang bekembang menjadi fase globular, jantung, dan kotiledon. Tahapan perkembangan dari embrio somatik sama dengan perkembangan sel pada embrio zigotik dimana pada embrio somatik terdapat ciri struktur bipolar yaitu mempunyai dua calon meristem yaitu meristem akar dan meristem tunas (Husni et al.2010). Embrio somatik juga bermanfaat sebagai model untuk mempelajari fungsi gen yang terlibat dalam embriogenesis karena ada persamaan antara regenerasi tanaman secara in vitro ataupun in vivo. Secara umum perkembangan embrio somatik terjadi pada dua tahapan, tahap pertama disebut morfogenetik yaitu pembentukan stuktur dasar sel yang mengarah ke arah pembentukan bipolar dan pembentukan jaringan-jaringan primer yang meristem (Husni et al. 2010). Tahap kedua yaitu perkembangan embrio pada fase ini terjadi pematangan sel yang ditandai dengan adanya aktifitas perkembangan jaringan menjadi organ dan penyimpanan makro molekul seperti protein dan karbohidrat yang diperlukan selama proses perkecambahan dan pertumbuhan (Carimi 2005). Embrio somatik merupakan salah satu teknik in vitro yang dapat membantu konservasi tanaman dengan penyediaan bibit yang cepat. Kunitake et al. (2005) menyatakan bahwa penelitian embrio somatik pada jeruk sangat penting dalam aplikasi teknik rekayasa sel untuk meningkatkan hasil produksi. Embriogenesis Somatik pada Jeruk Teknik embriogenesis somatik pada tanaman jeruk telah banyak diteliti baik digunakan untuk mendapatkan tanaman yang seragam dan bebas virus ataupun sebagai bahan untuk perbaikan sifat genetik. Pentingnya mendapatkan bibit tanaman jeruk yang bebas penyakit terutama virus menjadikan embrio somatik pada jeruk terus berkembang (Sawi et al. 2005). Selain mendapatkan tanaman bebas virus teknologi embrio somatik juga dimafaatkan untuk memproduksi jeruk untuk batang bawah. Ricci et al. (2001) melaporkan bahwa penggunaan embrio somatik pada jeruk dengan menggunakan eksplan embrio nuselus dapat memproduksi secara masal untuk jenis jeruk batang bawah yang seragam. 15 Perbaikan sifat tanaman melalui embrio somatik juga telah banyak dilakukan pada tanaman jeruk salah satu metode yang dapat dilakukan dengan hibrida somatik (Saito et al. 1994 ; Guo & Deng 1998 ; Guo & Grosser 2005; Husni 2010), studi protoplas (Kunitake et al. 2005), serta uji ketahan (Gmiter & Moore 2005; Carimi et al. 2007). Konsep regenerasi tanaman melalui embrio somatik pada tanaman jeruk tidak berbeda halnya pada tanaman dikotil lainya. Keberhasilan regenerasi dari embrio somatik juga dipengaruhi oleh beberapa faktor, yaitu: eksplan, ZPT, media tanam serta arah tujuan perkembangan yang diinginkan (Yujin & Xiuyin 2002). Nuselus pada tanam jeruk merupakan eksplan yang mempunyai peluang lebih besar dalam mengiduksi sel yang embriogenik (Saito et al. 1994; Ricci et al 2001; Altaf et al. 2009; Husni 2010). Adapun beberapa keuntungan menggunakan jaringan nuselus sebagai eksplan antara lain: memiliki struktur genetik identik dengan tanaman induk (true to type), tingkat keberhasilan menghasilkan kalus yang embrionik lebih tinggi jika dibandingkan dengan organ vegetatif lainnya, tidak dipengaruhi oleh mutasi secara alami sebagai mana yang dialami oleh kebanyakan embrio zigotik (Krueger & Navarro 2007). Jaringan nuselus berkembang dari jaringan ovul yang mengelilingi atau menyelimuti kantung embrio seksual (embryo sac) dan mempunyai materi genetik yang sama dengan indukya (Kepiro & Roose 2007). Jaringan nuselus umumnya terdapat pada bji yang diperoleh dari buah yang muda. Gambar 3. Bagian nuselus dan embrio pada jeruk (sumber Carimi F 2005) Gambar 3 menunjukan bahwa perkembangan jaringan nuselus tidak terlalu berbeda dengan perkembangan embrio zigotik. Perkembangan nuselus akan terhenti jika buah telah memasuki fase masak. Nuselus yang terdapat pada buah muda lebih mudah untuk diinduksi karena pada fase ini jaringan memiliki sel-sel 16 yang aktif membelah (Obukosia & Waithaka 2000). Embrio yang dihasilkan dari jaringan nuselus mempunyai vigor yang tinggi (Iwamasa et al. 2007). Donghia et al. (2001) dan Carimi (2007) menambahkan bahwa embrio yang dihasilkan dari jaringan nuselus sebagai bahan eksplan sering dimanfaatkan pada teknik kultur jaringan khususnya untuk perbanyakan tanaman jeruk bebas dari virus (Obukosia & Waithaka 2000). Penggunaan eksplan nuselus pada jeruk pertama kali digunakan pada kultur jaringan untuk mengembangkan tanaman yang bebas virus (Tomaz et al. 2000). Nuselus yang digunakan sebagai sumber eksplan haruslah dari tanaman yang sehat dan tidak dalam keadaan stress atau mengalami mutasi secara spontan, dan umur buah saat diisolasi. Hal tersebut penting diperhatikan karena pembentukan kalus sangat tergantung pada status jaringan. Inisiasi kalus lebih mudah terjadi pada jaringan yang masih muda karena eksplan masih mengandung sel-sel yang aktif membelah (Carimi 2007). Nuselus merupakan eksplan yang sangat baik untuk penginduksian kalus embriogenik (Ricci et al. 2007). Christopani (1991) menyatakan bahwa nuselus sangat baik digunakan sebagai eksplan karena memiliki peluang yang lebih besar dalam menghasilkan jumlah sel yang embriogenik. Faktor lingkungan tumbuh, genotipe, umur eksplan, komposisi media tanam juga merupakan faktor yang sangat mempengaruhi dalam induksi kalus embriogenik pada eksplan nuselus (Grosser & Gmiter 1990). Selain faktor eksplan ZPT juga merupakan hal yang penting dimana ZPT berperan penting dalam proses induksi kalus embriogenik. Setelah terbentuk kalus embriogenik peran ZPT selanjutnya adalah mendewasakan serta menumbuhkan embrio tersebut. Selama proses pendewasaan embrio akan menyimpan cadangan protein dan karbon untuk selanjutnya memasuki fase perkecambahan pada media perkecambahan. Ricci et al. (2007) dan Tomaz et al. (2001) menggunakan konsentrasi gula yang berbeda-beda untuk proses pendewsaan embrio somatik jeruk. Pendewasaan embrio somatik dengan menggunakan ABA pada tanaman berkayu telah banyak diteliti seperti: Husni (2010) pada hasil fusi Siam Simadu dengan Mandarin Satsuma; Husni et al. (2011) pada Siam Pontianak; George et al. (2008) dengan eksplan daun pada jeruk; Gutman et al. (2006) pada pinus; Kong et al. (1994) pada cemara.