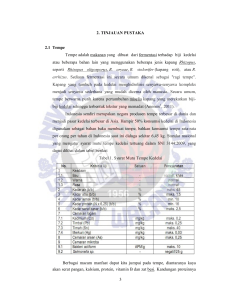
PERUBAHAN KOMPOSISI ASAM AMINO DAN
advertisement

PERUBAHAN KOMPOSISI ASAM AMINO DAN MINERAL BELUT SAWAH (Monopterus albus) AKIBAT PROSES PENGGORENGAN IKA ASTIANA PROGRAM STUDI TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR BOGOR 2012 RINGKASAN IKA ASTIANA. C34080034. Perubahan Komposisi Asam Amino dan Mineral Belut Sawah (Monopterus albus) Akibat Proses Penggorengan. Dibimbing oleh NURJANAH dan RUDDY SUWANDI. Belut sawah (Monopterus albus) merupakan salah satu jenis ikan air tawar yang banyak dikenal dan dikonsumsi oleh masyarakat. Belut sawah sering dikonsumsi setelah dilakukan proses pengolahan. Proses pengolahan belut yang umum dilakukan adalah penggorengan. Belut memiliki kandungan gizi (asam amino dan mineral) yang tinggi, akan tetapi proses penggorengan akan mempengaruhi kandungan gizi tersebut. Kajian ini bertujuan untuk mengetahui perubahan komposisi gizi, asam amino, dan mineral yang terdapat pada belut sawah setelah pemasakan dengan cara digoreng. Tahap awal penelitian ini adalah memperoleh informasi mengenai asal sampel. Tahap selanjutnya adalah pengukuran morfometrik belut sawah segar yang meliputi panjang, diameter, lingkar badan, dan berat total, pengukuran rendemen yang meliputi daging, kepala, kulit, tulang dan jeroan, analisis proksimat, analisis asam amino dan analisis mineral pada belut sawah segar dan setelah penggorengan dengan suhu 180 oC selama 5 menit. Hasil penelitian menunjukkan bahwa rendemen belut segar yang paling tinggi yaitu daging sebesar 55,08 %. Komposisi gizi yang mengalami penurunan jumlah di dalam daging belut sawah setelah penggorengan adalah kadar air sebesar 55,43 %, kadar protein 2,56 %, dan kadar karbohidrat 12,41 % sedangkan komposisi gizi yang mengalami kenaikan setelah penggorengan adalah kadar lemak sebesar 12,69 % dan kadar abu 2,56 %. Belut sawah segar dan goreng memiliki kandungan 9 asam amino esensial dan 6 asam amino non esensial. Asam amino esensial yang terdapat pada belut sawah segar adalah histidin, treonin, tyrosin, metionin, valin, fenilalanin, I-leusin, leusin, dan lisin. Asam amino nonesensial belut sawah adalah asam aspartat, asam glutamat, serin, glisin, arginin, dan alanin. Asam amino esensial terbanyak adalah lisin dan asam amino nonesensial terbanyak adalah asam glutamat. Asam amino pembatas pada belut sawah segar dan goreng adalah histidin yang jumlahnya masing-masing 1,54 g/100g dan 1,18 g/100g. Asam amino belut sawah setelah penggorengan secara keseluruhan mengalami penurunan jumlah antara 0,33-3,38 g/100g. Mineral yang mengalami penurunan jumlah setelah penggorengan adalah kalsium 95,98 mg/kg, magnesium 65,70 mg/kg, natrium 2397,73 mg/kg, seng 18,37 mg/kg, dan besi 36,92 mg/kg, sedangkan mineral tembaga mengalami kenaikan sebesar 0,38 mg/kg. PERUBAHAN KOMPOSISI ASAM AMINO DAN MINERAL BELUT SAWAH (Monopterus albus) AKIBAT PROSES PENGGORENGAN IKA ASTIANA C34080034 Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Departemen Teknologi Hasil Perairan Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR BOGOR 2012 Judul : Perubahan Komposisi Asam Amino dan Mineral Belut Sawah (Monopterus albus) Akibat Proses Penggorengan Nama : Ika Astiana NRP : C34080034 Program studi : Teknologi Hasil Perairan Menyetujui, Pembimbing I Dr. Ir. Nurjanah, M.S. NIP: 19591013 198601 2 002 Pembimbing II Dr. Ir. Ruddy Suwandi MS, M.Phil NIP: 19580511 198503 1 002 Mengetahui, Ketua Departemen Teknologi Hasil Perairan Dr. Ir. Ruddy Suwandi MS.,Mphil NIP : 19580511 198503 1 002 Tanggal lulus : PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI Dengan ini saya menyatakan bahwa skripsi dengan judul “Perubahan Komposisi Asam Amino dan Mineral Belut Sawah (Monopterus albus) Akibat Proses Penggorengan” adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini. Bogor, 20 April 2012 Ika Astiana C34080034 KATA PENGANTAR Segala puji dan syukur penulis panjatkan kehadirat Allah SWT, karena berkat rahmat serta hidayah-Nya, sehingga penulis dapat menyelesaikan skripsi dengan judul “Perubahan Komposisi Asam Amino dan Mineral Belut Sawah (Monopterus albus) Akibat Proses Penggorengan” Skripsi ini merupakan salah satu syarat memperoleh gelar sarjana perikanan di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam penulisan skripsi ini, terutama kepada : 1. Ibu Dr. Ir. Nurjanah, MS. selaku dosen pembimbing I, atas segala bimbingan dan pengarahan yang diberikan kepada penulis. 2. Bapak Dr. Ir. Rudy Suwandi, MS. M.Phil. selaku dosen pembimbing II, dan kepala departemen Teknologi Hasil Perairan atas bimbingan dan pengarahan yang diberikan kepada penulis. 3. Ayah dan Ibu atas doa, dorongan, dan dukungan baik moril maupun materiil kepada penulis. 4. Anggraeni Ashory Suryani selaku partner dalam pengerjaan penelitian, atas kebersamaan dan semangat yang diberikan. 5. Teman-teman THP 45 atas kebersamaan dan semangat yang diberikan. 6. Kakak kelas THP 43 dan 44 yang telah membantu penulis atas informasi yang mendukung penyelesaian skripsi ini. 7. Semua pihak yang telah membantu penulis yang tidak dapat disebutkan satu pesatu. Penulis menyadari bahwa Skripsi ini masih jauh dari sempurna. Penulis mengharapkan saran dan kritik yang bersifat membangun untuk perbaikan usulan ini. Semoga tulisan ini bermanfaat bagi semua pihak yang memerlukannya. Bogor, 20 April 2012 Penulis DAFTAR RIWAYAT HIDUP Penulis dilahirkan di Kendal, Jawa Tengah pada tanggal 28 Mei 1990. Penulis merupakan anak pertama dari 3 bersaudara dari pasangan Bapak Ir. Agus Hasto Yuwono M.Si. dan Ibu Isnindyah S.Pd. Penulis telah menempuh jalur pendidikan SDN 1 Patukangan lulus pada tahun 2002, SLTPN 2 Kendal lulus pada tahun 2005 dan SMAN 1 Kendal lulus pada tahun 2008. Penulis diterima sebagai mahasiswa Institut Pertanian Bogor pada tahun 2008 melalui jalur Undangan Seleksi Masuk IPB (USMI) sebagai mahasiswa Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan. Selama menjadi mahasiswa, penulis aktif di dalam kegiatan organisasi mahasiswa daerah (OMDA Kendal) dan Himpunan Mahasiswa Hasil Perikanan (HIMASILKAN). Penulis juga aktif sebagai Asisten Luar Biasa pada Mata Kuliah Ekologi Perairan di Departemen Manajemen Sumber Daya Perairan dan Pengolahan Hasil Perairan di Departemen Teknologi Hasil Perairan. Penulis telah melaksanakan penelitian dengan judul “Perubahan Komposisi Asam Amino dan Mineral Belut Sawah (Monopterus albus) Akibat Proses Penggorengan” sebagai salah satu syarat untuk memperoleh gelar sarjana pada Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor dibawah bimbingan Dr. Ir. Nurjanah, MS. dan Dr. Ir. Ruddy Suwandi, MS, M.Phil. DAFTAR ISI DAFTAR TABEL …........................................................................................ viii DAFTAR GAMBAR…………………………………………………………. ix DAFTAR LAMPIRAN..................................................................................... x 1 PENDAHULUAN ..................................................................................... 1 1.1 Latar Belakang .................................................................................... 1 1.2 Tujuan ................................................................................................. 2 2 TINJAUAN PUSTAKA ............................................................................. 3 2.1 Klasifikasi dan Deskripsi Belut ............................................................ 3 2.2 Protein .................................................................................................. 5 2.3 Asam Amino ........................................................................................ 6 2.4 Mineral ................................................................................................. 7 2.4.1 Mineral makro .............................................................................. 8 2.4.2 Mineral mikro ............................................................................... 10 2.4 Penggorengan ....................................................................................... 11 2.5 High Performance Liquid Chromatography (HPLC) ............................ 12 2.6 Atomic Absorption Spectrophotometer (AAS)....................................... 14 3 METODOLOGI ........................................................................................ 16 3.1 Waktu dan Tempat ............................................................................. 16 3.2 Bahan dan Alat .................................................................................... 16 3.3 Metode Penelitian ................................................................................. 17 3.3.1 3.3.2 3.3.3 3.3.4 Rendemen .................................................................................. Analiasis proksimat .................................................................... Analisis asam amino................................................................... Analisis total mineral ................................................................. 18 18 21 22 4 HASIL DAN PEMBAHASAN .................................................................. 24 4.1 Karakteristik Bahan Baku .................................................................... 24 4.2 Rendemen ............................................................................................ 24 4.3 Hasil Analisis Proksimat ...................................................................... 26 4.3.1 4.3.2 4.3.3 4.3.4 4.3.5 Kadar air ................................................................................... Kadar abu .................................................................................. Kadar protein ............................................................................ Kadar lemak .............................................................................. Kadar karbohidrat ...................................................................... 27 28 30 31 33 4.4 Komposisi Asam Amino ..................................................................... 34 4.5 Komposisi Mineral ............................................................................. 39 5 KESIMPULAN DAN SARAN .................................................................. 44 5.1 Kesimpulan ........................................................................................ 44 5.2 Saran .................................................................................................. 44 DAFTAR PUSTAKA ................................................................................... 45 LAMPIRAN ................................................................................................ 48 DAFTAR TABEL Nomor Halaman 1 Komposisi zat gizi belut…………………………………………......... 4 2 Komposisi kimia daging segar dan goreng belut sawah……………… 27 3 Komposisi asam amino belut sawah dalam basis kering……………… 35 4 Kandungan beberapa jenis mineral belut sawah segar dan goreng……. 39 DAFTAR GAMBAR Nomor Halaman 1 Belut (Monopterus albus)………………………………………..……….. 3 2 Struktur umum asam amino….………………………………………… 16 3 Komponen-komponen dalam HPLC…………………………………... 14 4 Diagram alir metode penelitian………………………………………… 18 5 Persentasi rendemn belut sawah……………………………………….. 25 6 Grafik perbandingan asam amino belut sawah segar dan belut sawah goreng basis kering…………………………………………………….. 35 DAFTAR LAMPIRAN Nomor Halaman 1 Gambar proses preparasi belut...…………………………………......... 49 2 Data dan ukuran berat belut…………………………...……………….. 50 3 Data komposisi kimia daging belut…………………….……………… 51 4 Peak asam amino belut segar…………………………………….……. 52 5 Peak asam amino belut goreng…...…………………………………… 54 6 Area HPLC asam amino………………………………………………. 56 7 Konsentrasi asam amino (%b/b basis basah)………………………….. 57 8 Hasil uji mineral Ca………………………………………………….... 58 9 Hasil uji mineral Mg ..……………………………………………….... 59 10 Hasil uji mineral Na………………………………………………….... 60 11 Hasil uji mineral K…………………………………………………...... 61 12 Hasil uji mineral Zn………………………………………………….... 62 13 Hasil uji mineral Fe………………………………………………….... 63 14 Hasil uji mineral Cu………………………………………………….... 64 1 PENDAHULUAN 1.1 Latar Belakang Belut merupakan salah satu jenis ikan air tawar yang banyak dikenal dan dikonsumsi oleh masyarakat. Jenis belut yang banyak dikonsumsi adalah belut sawah (Monopterus albus), karena jenis belut ini yang paling banyak terdapat di perairan dibandingkan jenis belut lain seperti belut rawa (Synbrancus bengalensis) maupun belut laut (Macrotema caligans). Hewan ini banyak ditemukan di sawah maupun rawa yang berlumpur. Belut termasuk makanan sumber protein dan mineral (Roy 2009). Permintaan belut terus meningkat dari tahun ke tahun. Pada tahun 2008 volume ekspor belut mencapai 2.676 ton meningkat dibandingkan tahun 2007 yang hanya 2.189 ton. Tahun 2009 ekspor belut terus meningkat menjadi 4.744 ton atau meningkat 77,2 % dibandingkan tahun 2008. Permintaan belut tidak hanya datang dari luar tetapi permintaan dalam negeri pun melimpah seperti Jakarta yang membutuhkan belut 20 ton per hari dan Yogjakarta yang membutuhkan belut 30 ton per hari (WPI 2010). Protein dari ikan lebih mudah dicerna oleh tubuh dibandingkan dengan protein dari hewan terestrial. Protein memiliki fungsi sebagai bahan pembangun dan membantu pertumbuhan sel-sel tubuh. Protein tersusun atas dua puluh monomer-monomer asam amino yang berbeda. Mutu protein dinilai dari perbandingan asam-asam amino yang terkandung dalam protein tersebut (Winarno 2008). Tubuh manusia tidak dapat mensintesis beberapa jenis asam amino seperti isoleusin, leusin, lisin, methionin, fenilalanin, threonin, triptofan, valin, dan histidin. Asam amino tersebut merupakan asam amino esensial yang hanya di dapat dengan mengkonsumsi sejumlah makanan (DGKM et al. 2008). Beberapa jenis asam amino yang terkandung dalam belut sangat berperan dalam karakterisasi rasa spesifik belut. Jenis-jenis asam amino tersebut adalah glisin, valin, alanin, methionin, dan asam glutamat. Selain itu pula nukleotida dari jenis IMP (inosin mono phosphat) dan GMP (guanosin mono phosphat) juga ikut mempengaruhi karakterisasi rasa, terutama dalam pembentukan rasa ”umami”, yaitu rasa khas seperti golongan daging (Subagio et al. 2004). 2 Belut merupakan sumber makanan yang kaya dengan mineral yaitu besi (Fe), seng (Zn), selenium (Se), kalsium (Ca), kalium (K), fosfor (P), dan flour (F), selain itu, mineral dari ikan lebih mudah diserap tubuh dibandingkan mineral yang berasal dari kacang-kacangan dan serealia. Mineral berperan dalam berbagai tahap metabolisme, terutama sebagai kofaktor dalam aktivitas enzim. Keseimbangan ion-ion mineral di dalam cairan tubuh diperlukan untuk pengaturan pekerjaan enzim, pemeliharaan keseimbangan asam-basa, membantu transfer ikatan-ikatan penting melalui membran sel dan pemeliharaan kepekaan otot dan saraf terhadap rangsangan (Almatsier 2006). Jenis olahan belut yang sering dijumpai adalah belut goreng. Penggorengan merupakan suatu proses pemanasan bahan pangan menggunakan medium minyak goreng sebagai pengantar panas. Tujuan proses penggorengan adalah untuk melakukan pemanasan pada bahan pangan, pemasakan, dan pengeringan. Menggoreng dengan minyak atau lemak mampu meningkatkan cita rasa dan tekstur makanan dan jumlah kalori akan meningkat setelah digoreng. Bahan yang digoreng akan menghasilkan produk yang kering, renyah, dan tahan lama. Jenis makanan yang digoreng tidak mudah dicerna karena adanya lemak yang terserap dalam makanan (Winarno 1999). Proses pemasakan akan mempengaruhi kadar asam amino dan mineral yang terkandung di dalam bahan makanan. Kadar asam amino dan mineral akan berkurang akibat adanya proses pemanasan saat pemasakan, oleh karena itu perlu diketahui seberapa besar kandungan asam amino dan mineral yang hilang selama penggorengan. 1.2 Tujuan Penelitian ini bertujuan untuk mengetahui perubahan kadar asam amino dan mineral yang terdapat pada belut setelah pemasakan dengan cara digoreng, sehingga dapat diketahui kadar gizi belut goreng saat dikonsumsi. 2 TINJAUAN PUSTAKA 2.1 Klasifikasi dan Deskripsi Belut Klasifikasi belut (Monopterus albus) menurut Saanin (1968) adalah sebagai berikut: Filum : Vertebrata Kelas : Pisces Sub kelas : Teleostei Ordo : Synbranchoidea Famili : Synbranchoidae Genus : Monopterus Spesies : Monopterus albus Secara taksonomi, belut termasuk kedalam Kelas Pisces, akan tetapi ciri fisiknya sedikit berbeda dengan Kelas Pisces lainnya. Tubuh belut hampir menyerupai ular, yaitu gilig (silindris) memanjang, tidak bersisik, hanya dilapisi kulit yang hampir mirip dengan plastik. Kulit belut berwarna kecoklatan, mulut dilengkapi dengan gigi-gigi runcing kecil-kecil berbentuk kerucut dengan bibir berupa lipatan kulit yang lebar di sekitar mulut. Belut merupakan hewan karnivora, oleh karena itu memiliki lambung yang besar, palsu, tebal, dan elastis. Panjang tubuhnya mencapai 90 cm. Belut hidup di perairan dangkal dan berlumpur, tepian sungai, kanal, serata danau dengan kedalaman kurang dari 3 meter. Belut di habitat aslinya hidup pada media berupa 80% lumpur dan 20% air (Roy 2009). Morfologi ikan belut dapat dilihat pada Gambar 1. Gambar 1 Belut sawah (Monopterus albus) Belut merupakan kelompok air breathing fishes, yaitu ikan yang mampu mengambil oksigen langsung dari udara selama musim kering tanpa air di sekelilingnya. Belut memiliki alat pernapasan tambahan yakni berupa kulit tipis 4 berlendir yang terdapat di rongga mulut. Alat tersebut berfungsi menyerap oksigen secara langsung dari udara (Sarwono 2003). Belut beraktivitas pada malam hari (nocturnal) dan cenderung bersembunyi di lubang atau di celah-celah tanah liat. Belut memangsa berbagai jenis serangga dan merupakan predator bagi berbagai jenis hewan kelas ikan, cacing-cacingan, siput, dan hewan kecil yang hidup di perairan (Roy 2009). Belut termasuk hewan hemaprodit protogini, yaitu sebutan bagi ikan yang mengalami masa hidup sebagai betina pada awalnya dan kemudian berubah menjadi jantan. Belut memiliki kelenjar kelamin (gonad) yang mampu melakukan proses diferensiasi, dari fase betina ke fase jantan. Kelamin belut saat muda adalah betina namun ketika berumur 9 bulan (fase dewasa) belut akan mengalami pergantian kelamin menjadi jantan (Bahri 2000). Belut yang masih muda memiliki gonad testes dan ovarium, setelah jaringan ovariumnya berfungsi dan dapat mengeluarkan telur, kemudian terjadi masa transisi yaitu membesarnya jaringan testes dan ovariumnya mengecil. Belut yang telah tua, telurnya telah tereduksi sehingga sebagian besar gonadnya terisi oleh jaringan testes (Effendie 1997). Komposisi gizi belut (Monopterus albus) tidak kalah jika dibandingkan dengan sumber protein hewani lainnya. Belut memiliki kandungan protein, lemak, mineral, dan vitamin terutama vitamin A yang tinggi. Komposisi zat gizi belut dapat dilihat pada Tabel 1. Tabel 1 Komposisi zat gizi belut Zat Gizi Belut Protein (g) 14,0 Lemak (g) 27,0 Karbohidrat (g) 0,0 Kalori (kal) 303 Kalsium (mg) 20 Fosfor (mg) 200 Besi (mg) 1,0 Vitamin A (SI) 1600 Kadar Air (g) 58,0 Sumber: Sarwono (2003) 5 2.2 Protein Protein adalah molekul makro yang mempunyai berat molekul antara lima ribu hingga beberapa juta. Protein terdiri atas rantai-rantai panjang asam amino yang terikat dalam ikatan peptida (Almatsier 2006). Protein adalah sumber asam-asam amino yang mengandung unsur-unsur C, H, O, dan N yang tidak dimiliki oleh lemak atau karbohidrat. Molekul protein mengandung pula fosfor, belerang, dan ada jenis protein yang mengandung unsur logam seperti besi dan tembaga. Protein sebagai pembentuk energi akan menghasilkan 4 kalori tiap gram protein. Fungsi protein di dalam tubuh adalah sebagai enzim, alat pengangkut, alat penyimpan, pengatur pergerakan, penunjang mekanis, pertahanan tubuh, media perambatan impuls saraf, dan pengendalian pertumbuhan (Budiyanto 2002). Protein terdapat dalam bentuk serabut, globular, dan konjugasi. Protein dalam bentuk serabut terdiri dari beberapa rantai peptida berbentuk spiral yang terjalin satu sama lain seperti batang yang kaku. Karakteristik protein serabut adalah rendahnya daya larut, mempunyai kekuatan mekanis yang tinggi, dan tahan terhadap enzim pencernaan. Protein jenis ini adalah kolagen, elastin, keratin, dan myosin. Protein globular berbentuk bola, terdapat dalam cairan jaringan tubuh, larut dalam larutan garam dan asam encer, mudah berubah di bawah pengaruh suhu, serta mudah mengalami denaturasi. Protein jenis ini adalah albumin, globulin, histon dan protamin. Protein konjugasi adalah protein sederhana yang terikat dengan bahan-bahan non asam amino. Gugus non asam amino ini disebut gugus prostetik. Protein ini terdiri dari nukleoprotein, lipoprotein, fosfoprotein, dan metsloprotein (Almatsier 2006) Protein sebagai salah satu komponen penyusun bahan pangan mempunyai peranan yang sangat besar dalam menentukan mutu produk pangan. Protein mampu berinteraksi dengan senyawa-senyawa lain, baik secara langsung maupun tidak langsung, sehingga berpengaruh pada aplikasi proses, mutu, dan penerimaan produk. Sifat-sifat inilah yang disebut sifat fungsional protein, seperti water binding, kelarutan, viskositas, pembentukan gel, flavor binding, dan aktivitas permukaan. Protein dari berbagai sumber dapat dikembangkan menjadi produk yang mempunyai sifat-sifat fungsional tinggi menjadi emulsifier, flavor enhancer, texturizer stabilizer, dan pembentuk gel (Subagio et al. 2004). 6 Kebutuhan manusia terhadap protein dapat diketahui dengan jumlah nitrogen yang hilang (obligatory nitrogen). Setiap harinya nitrogen yang keluar dari tubuh rata-rata 54 mg/kg berat badan. Terbuangnya protein bervariasi tergantung individu, ukuran badan, jenis kelamin, dan umur (Budiyanto 2002). Secara umum, kebutuhan protein adalah 0,8 sampai 1,0 g/kg BB/hari, tetapi bagi mereka yang bekerja berat kebutuhan protein bertambah (Irianto 2006). 2.3 Asam Amino Asam amino merupakan komponen penyusun protein yang dihubungkan oleh ikatan peptida (Sitompul 2004). Awal pembentukan protein hanya tersusun dari 20 asam amino yang dikenal sebagai asam amino dasar atau asam amino baku. Struktur asam amino secara umum adalah satuan atom C yang mengikat empat gugus, yaitu gugus amina (NH2), gugus karboksil (COOH), atom hidrogen (H) dan satu gugus sisa (R dari residu) atau disebut juga gugus rantai samping yang membedakan satu asam amino dengan asam amino lain (Winarno 2008). Asam amino memiliki atom C pusat yang mengikat empat gugus yang berbeda, maka asam amino memiliki dua konfigurasi yaitu konfigurasi D dan konfigurasi L. Molekul asam amino mempunyai konfigurasi L apabila gugus –NH2 terdapat disebelah kiri atom karbon alfa dan bila posisi gugus NH2 disebelah kanan (Lehninger 1982). Molekul asam amino dapat dilihat pada Gambar 2. Gambar 2 Struktur umum asam amino Sumber: Winarno (2008) Asam amino biasanya larut dalam air dan tidak larut dalam pelarut organik non polar yaitu eter, aseton dan kloroform (Sitompul 2004). Berdasarkan sifat kimia rantai sampingnya, asam amino dapat dibedakan menjadi empat kelompok, yaitu asam amino yang bersifat basa lemah, asam lemah, hidrofilik jika polar dan hidrofobik jika nonpolar (Almatsier 2006). 7 Terdapat tiga jenis asam amino yang menyusun protein yaitu asam amino esensial, semi esensial dan non-esensial (Kartasapoetra dan Marsetyo 2008). Asam amino esensial merupakan asam amino yang tidak dapat disintesa oleh tubuh sehingga harus dimasukkan dari luar tubuh manusia (Suryaningrum et al. 2010). Asam amino jenis ini yaitu leusin, isoleusin, metionin, fenilalanin, treonin, triptofan, lisin, dan valin (DGKM et al. 2009). Asam amino semi esensial yaitu asam amino yang dapat menjamin proses kehidupan jaringan orang dewasa, tetapi tidak mencukupi untuk masa pertumbuhan anak-anak. Terdapat 6 asam amino semi esensial yaitu arginin, histidin, tirosin, sistin, glisin dan serin (Kartasapoetra dan Marsetyo 2008). Asam amino non esensial adalah asam amino yang dapat disintesa oleh tubuh manusia dengan bahan baku asam amino lainnya (Suryaningrum et al. 2010). Asam amino jenis ini adalah alanin, asparagin, asam aspartat, sistin, asam glutamat, glutamin, glisin, hidroksi prolin, prolin, serin, dan tirosin (DGKM et al. 2009). Mutu protein dinilai dari perbandingan asam-asam amino yang terkandung dalam protein tersebut. Protein yang mengandung asam amino esensial menyamai kebutuhan manusia, memiliki mutu yang lebih baik daripada protein yang kekurangan satu atau lebih asam amino esensial. Jumlah asam amino non-esensial tidak dapat digunakan sebagai pedoman karena asam amino tersebut dapat disintesis oleh tubuh. Asam amino yang biasanya sangat kurang dalam bahan makanan disebut asam amino pembatas (Budiyanto 2002). 2.4 Mineral Mineral merupakan bagian dari tubuh yang memegang peranan penting dalam pemeliharaan fungsi tubuh, baik pada tingkat sel, jaringan, organ, maupun fungsi tubuh secara keseluruhan. Mineral berperan dalam berbagai tahap metabolisme, terutama sebagai kofaktor dalam aktivitas enzim-enzim. Keseimbangan ion-ion mineral di dalam cairan tubuh diperlukan untuk pengaturan pekerjaan enzim-enzim, pemeliharaan keseimbangan asam-basa, membantu transfer ikatan-ikatan penting melalui membran sel dan pemeliharaan kepekaan otot dan saraf terhadap rangsangan (Almatsier 2006). Sifat keasaman dan kebasaan suatu bahan makanan tergantung jumlah dan jenis mineral yang dikandungnya. Bahan makanan yang banyak mengandung 8 mineral Na, K, Ca, Fe, dan Mg yang di dalam tubuh akan membentuk komponen basa (basa forming foods). Mineral Cl, P, dan S membentuk sifat asam (acid forming foods) (DGKM et al. 2009). Mineral digolongkan kedalam mineral makro dan mineral mikro. Mineral makro adalah mineral yang dibutuhkan tubuh dalam jumlah lebih dari 100 mg sehari, sedangkan mineral mikro dibutuhkan kurang dari 100 mg sehari. Jumlah mineral mikro dalam tubuh kurang dari 15 mg (Almatsier 2006). 2.3.1 Mineral makro Mineral makro adalah unsur mineral yang dibutuhkan dalam jumlah besar, yaitu lebih dari 100 mg sehari. Kelompok mineral makro terdiri dari natrium, kalium, kalsium, magnesium, sodium, potassium, dan fosfor. Kebutuhan harian mineral makro dalam tubuh. Mineral makro berperan sebagai zat pembangun tubuh, selain itu mineral ini juga berperan dalam mempertahankan tekanan osmotik dan keseimbangan asam basa tubuh (DGKM et al. 2009). a. Kalsium (Ca) Kalsium merupakan mineral yang paling banyak terdapat dalam tubuh, yaitu 1,5-2% dari berat badan orang dewasa atau kurang lebih sebanyak 1 kg. Berdasarkan jumlah tersebut, 99% berada dalam jaringan keras, yaitu tulang dan gigi terutama dalam bentuk hidroksiapatit dan sisanya tersebar di dalam tubuh (Almatsier 2006). Kalsium berperan dalam proses pembentukan gigi dan tulang, selain itu kalsium yang berada dalam sirkulasi darah dan jaringan berperan dalam transmisi impuls syaraf, kontraksi otot, penggumpalan darah, pengaturan permeabilitas membran sel, serta keaktivan enzim (Winarno 2008). Konsumsi makanan sangat berpengaruh terhadap absorpsi kalsium. Konsumsi fosfor dan protein yang tidak seimbang dengan kalsium cenderung akan menurunkan penyerapan kalsium. Konsumsi serat dan lemak yang berlebihan juga akan menurunkan absorpsi kalsium jika dikonsumsi bersamaan dengan kalsium. Sumber kalsium utama adalah susu dan produk olahannya, yaitu keju, yoghurt, es krim, serta ikan. Beberapa sayur, brokoli dan bayam juga mengandung kalsium, namun absorpsinya tidak setinggi kalsium pada susu karena sayur umumnya berserat tinggi (DGKM et al. 2009). 9 b. Natrium (Na) Natrium dan klorida biasanya berhubungan sangat erat baik sebagai bahan makanan maupun fungsinya dalam tubuh. Sebagian besar natrium terdapat dalam plasma darah dan cairan di luar sel (ekstraseluler), beberapa diantaranya juga terdapat dalam tulang. Jumlah natrium dalam tubuh manusia diperkirakan 100-110 g (Winarno 2008). Natrium merupakan bagian terbesar dari cairan ekstraseluler dan berfungsi mengatur tekanan osmotik, yaitu menjaga cairan tidak keluar dari darah dan masuk ke dalam sel-sel. Natrium juga berfungsi menjaga keseimbangan asam basa tubuh, transmisi saraf, kontraksi otot, absorpsi glukosa, dan alat angkut zat gizi lain melalui membran (Almatsier 2006). Tanda pertama kekurangan natrium adalah rasa haus. Kekurangan natrium juga menyebabkan kejang dan kehilangan nafsu makan. Kelebihan natrium akan menyebabkan hipertensi (tekanan darah tinggi). Kasus hipertensi banyak ditemukan pada masyarakat Asia yang sudah terbiasa mengkonsumsi natrium dalam jumlah besar pada makanannya (7,6-8,2 g/hari) (Winarno 2008). c. Magnesium (Mg) Magnesium merupakan kation nomor dua paling banyak setelah natrium dalam cairan ekstraseluler. Kurang lebih 60% dari 20-28 mg magnesium dalam tubuh terdapat pada tulang dan gigi, 26% di dalam otot, dan sisanya di jaringan lunak lainnya serta cairan tubuh (Almatsier 2001). Magnesium merupakan aktivator enzim peptidase dan enzim lain yang berfungsi memecah dan memindahkan gugus fosfat (fosfatase) (Winarno 2008). Sumber magnesium diantaranya sayuran hijau, daging, susu dan turunannya, biji-bijian, dan kacang-kacangan. Kekurangan magnesium terjadi apabila kurangnya konsumsi protein dan energi, yang dapat mengakibatkan gangguan dalam pertumbuhan, kurangnya nafsu makan, kejang, gangguan sistem saraf pusat, koma, dan gagal jantung. Kelebihan magnesium biasanya terjadi pada penyakit gagal ginjal (Almatsier 2006). d. Kalium Kalium memegang peranan penting dalam pemeliharaan keseimbangan cairan dan elektrolit serta keseimbangan asam basa. Kalium berperan dalam transmisi saraf dan relaksasi otot. Kalium berfungsi sebagai katalisator dalam 10 reaksi biologi didalam sel, terutama dalam metabolisme energi dan sintesis glikogen dan protein. Kalium banyak terdapat dalam bahan makanan baik tumbuh-tumbuhan maupun hewan. Kebutuhan minimum akan kalium ditaksir sebanyak 2000 mg sehari (Almatsier 2006). 2.3.2 Mineral mikro Mineral mikro adalah unsur mineral pada tubuh manusia yang dibutuhkan dalam jumlah sedikit. Mineral mikro dibutuhkan tubuh dalam jumlah kurang dari 100 mg sehari. Kelompok mineral mikro terdiri dari besi, seng, tembaga, selenium, iodium, mangan, seng, kobalt, dan fluor. Mineral mikro berfungsi dalam proses metabolisme tubuh serta merupakan bagian dari enzim, hormon dan vitamin (DGKM et al. 2009). a. Besi (Fe) Besi adalah mineral mikro yang paling banyak terdapat dalam tubuh manusia. Besi merupakan bagian penting dari hemoglobin, mioglobin, dan enzim. Besi tergolong zat gizi essensial sehingga harus disuplai dari makanan. Sumber utama besi adalah pangan hewani terutama berwarna merah, yaitu hati, daging, ayam, dan ikan, sedangkan sumber lain adalah sayuran berdaun hijau (DGKM et al. 2009). Besi mempunyai beberapa fungsi penting di dalam tubuh, yaitu sebagai alat angkut oksigen dari paru-paru ke jaringan tubuh, sebagai alat angkut elektron di dalam sel dan sebagai bagian terpadu berbagai reaksi enzim di dalam jaringan tubuh. Defisiensi besi merupakan defisiensi gizi yang paling umum terjadi, baik di negara maju maupun negara berkembang. Defisiensi gizi secara klasik selalu dikaitkan dengan anemia gizi besi. Kelebihan besi jarang terjadi karena makanan, tetapi karena konsumsi suplemen besi. Kelebihan besi dapat menyebabkan muntah, diare, sakit kepala, denyut jantung meningkat, dan pingsan (Almatsier 2006). Zat besi dapat diabsorpsi sekitar 5-15% dari makanan oleh tubuh dalam kondisi normal, sedangkan dalam kondisi kekurangan zat besi dapat mencapai 50%. Absorpsi besi dalam pencernaan dipengaruhi oleh simpanan serta hal-hal lain terkait dengan cara besi dikonsumsi. Zat penghambat absorpsi besi diantaranya adalah tanin (teh), phitat (serelia), dan serat. Zat peningkat absorpsi 11 besi adalah sistein (daging), vitamin C, sitrat, malat, dan laktat yang umum terdapat dalam buah-buahan (DGKM et al. 2009). b. Seng (Zn) Seng memiliki peranan penting dalam banyak fungsi tubuh, diantaranya dalam berbagai aspek metabolisme, sintesis dan degradasi kolagen, pengembangan fungsi reproduksi laki-laki serta berperan dalam fungsi kekebalan tubuh (Almatsier 2006). Dalam tubuh, zat gizi ini terdapat dalam jumlah yang sangat sedikit dan banyak tersimpan di dalam pankreas, hati, ginjal, paru, otot, tulang, dan mata. Seng dapat diperoleh dari pangan hewani, terutama daging, telur, kerang, dan serelia (DGKM et al. 2009). Kekurangan seng dapat terjadi pada golongan rentan, yaitu anak-anak, ibu hamil dan menyusui serta orang tua. Kekurangan seng dapat menyebabkan fungsi pencernaan terganggu, gangguan pertumbuhan dan kematangan seksual, gangguan sistem saraf dan fungsi otak serta gangguan pada fungsi kekebalan tubuh. Kelebihan seng dapat menurunkan absorpsi tembaga serta mempengaruhi metabolisme kolesterol (Almatsier 2006). c. Tembaga (Cu) Tembaga dalam tubuh manusia umumnya terdapat pada hati, ginjal, dan rambut. Tembaga berperan dalam beberapa kegiatan enzim pernapasan, yaitu sebagai kofaktor enzim tiroksinase dan sitokrom oksidase. Tembaga juga diperlukan dalam proses pertumbuhan sel-sel darah merah yang masih muda (Winarno 2008). Kekurangan tembaga pernah dilihat pada anak-anak kekurangan protein dan menderita anemia kurang besi serta pada anak-anak yang mengalami diare. Kelebihan tembaga secara kronis menyebabkan penumpukan tembaga di dalam hati yang dapat mengakibatkan nekrosis hati atau serosis hati (Almatsier 2006). 2.5 Penggorengan Penggorengan merupakan suatu proses pemanasan bahan pangan menggunakan medium minyak goreng sebagai pengantar panas. Tujuan proses penggorengan adalah untuk melakukan pemanasan pada bahan pangan, pemasakan, dan pengeringan. Menggoreng dengan minyak atau lemak mampu meningkatkan cita rasa dan tekstur makanan dan jumlah kalori akan meningkat 12 setelah digoreng. Bahan yang digoreng akan menghasilkan produk yang kering, renyah, dan tahan lama. Jenis makanan yang digoreng tidak mudah dicerna karena adanya lemak yang terserap dalam makanan (Winarno 1999). Bahan mengalami perubahan fisik, kimia dan sensoris selama proses penggorengan. Penggorengan pada teanan atmosfir dengan suhu tinggi akan mengakibatkan kerusakan pada bahan (Sutarsi et al. 2009). Jenis minyak yang umum dipakai untuk menggoreng adalah minyak nabati seperti minyak sawit, minyak kacang tanah, dan minyak wijen. Minyak merupakan campuran dari ester asam lemak dan gliserol. Minyak goreng jenis ini mengandung 80% asam lemak tak jenuh jenis asam oleat dan linoleat, kecuali minyak kelapa. Proses penyaringan minyak kelapa sawit sebanyak 2 kali (penegambilan lapisan jenuh) menyebabkan kandungan asam lemak tak jenuh menjadi lebih tinggi. Tingginya kandungan asam lemak tak jenuh menyebabkan minyak mudah rusak oleh proses penggorengan., karena selama proses menggoreng minyak akan dipanaskan terus menerus pada suhu tinggi serta terjadinya kontak dengan oksigen dari udara luar yang memudahkan terjadinya oksidasi pada minyak (Khomsan 2003 diacu dalam Sartika 2009). Makanan yang digoreng mempunyai struktur yaitu lapisan permukaan, lapisan tengah, dan lapisan dalam. Lapisan dalam makanan masih mengandung air, lapisan tengah makanan adalah bagian luar makanan yang merupakan hasil dehidrasi saat menggoreng. Minyak yang diserap untuk mengempukkan makanan sesuai dengan jumlah air yang menguap pada makanan saat digoreng. Jumlah yang terserap tergantung dari perbandingan antara lapisan tengah dan lapisan dalam. Semakin tebal lapisan tengah maka semakin banyak minyak yang akan terserap. Lapisan permukaan merupakan hasil reaksi Maillard yang terdiri dari polimer yang larut, dan tidak larut dalam air serta berwarna coklat kekuningan. Biasanya senyawa polimer ini terbentuk bila makanan jenis gula dan asam amino, protein serta senyawa yang mengandung nitrogen digoreng secara bersamaan (Sartika 2009). 2.6 High Performance Liquid Chromatography (HPLC) Metoda HPLC menggunakan kolom C18 dan sistem deteksi UV. HPLC merupakan suatu metode yang sensitive dan akurat untuk penentuan kuantitatif 13 dan pemisahan senyawa yang tidak mudah menguap seperti asam amino dan protein. HPLC diopersikan pada suhu kamar, dimana senyawa yang tidak tahan panas dapat ditentukan dengan mudah dan sifat fase gerak dapat diubah dengan merubah komposisi dari fase gerak yang digunakan (Nurhamidah 2005). Teknik HPLC memerlukan pre-collum derivatization untuk analisis asam amino, biasanya dengan menggunakan densil klorida. Turunan densil fluoresens dapat dipisahkan oleh sebuah reverse phase column dengan menggunakan multistep non linear elution. Asam amino dianalisis dengan fluorescene detector. Bahan yang digunakan dalam kolom ialah gel silika yang mengandung gugus fungsional nonpolar hidrokarbon sebagai fase stasioner, dan cairan elusi digunakan campuran asetonitril dan air. Cara fluoresens mampu mendeteksi sampai kisaran psikogram (Budiyanto 2002). Pemisahan dengan HPLC mempunyai beberapa keuntungan yaitu waktu analisis cepat, biaya rendah, mudah dioperasikan, kepekaan tinggi, mampu memisahkan molekul-molekul dari suatu campuran, dapat menghindari kerusakan bahan yang dianalisis, resolusi yang baik, dapat digunakan bermacam-macam detektor, kolom dapat digunakan kembali dan kemungkinan untuk menganalisis sampel yang tidak stabil (Putra 2004). Analisis dengan HPLC, fase gerak yang digunakan harus bebas dari gas, sehingga perlu dilakukan proses penghilangan gas (degassing) terlebih dahulu sebelum alat dioperasikan. Proses penghilangan gas ini diperlukan untuk menghindari noise pada detektor terutama fasa organik berair. Proses penghilangan gas ini juga diperlukan untuk menghindari terbentuknya gelembung udara jika pelarut yang berbeda dicampurkan. Degassing dapat dilakukan dengan beberapa cara seperti pemakuman diatas fasa gerak, pemanasan sambil diaduk, ultrasonik, dan lain-lain (Nurhamidah 2005). Komponen-komponen penting yang harus ada dalam HPLC adalah pompa, injektor, kolom, detektor, elusi gradien, pengolahan data, dan fase gerak. Suatu larutan dapat digunakan sebagai fase gerak jika memenuhi syarat murni, tidak bereaksi dengan wadah, sesuai dengan detektor, melarutkan sampel, dan memiliki viskositas rendah. Penentuan fase gerak juga dapat dilihat dari kelarutan sampel. Sampel yang larut air, dapat menggunakan air sebagai fase gerak, bila 14 dapat larut dalam pelarut organik maka digunakan pelarut organik sebagai fase gerak (Putra 2004). Komponen-komponen dalam HPLC dapat dilihat pada Gambar 3. Gambar 3 Komponen-komponen dalam HPLC Sumber: Putra (2004) 2.7 Atomic Absorption Spectrophotometer (AAS) Atomic absorption spectrophotometer (AAS) merupakan salah satu teknik analisis untuk mengukur jumlah unsur berdasarkan jumlah energi cahaya yang diserap oleh unsur tersebut dari sumber cahaya yang dipancarkan (Arifin 2008). atomic absorption spectrophotometer merupakan suatu metode yang digunakan untuk mengukur kandungan logam dan metalloid. Metode ini sangat tepat untuk analisis zat pada konsentrasi rendah. Instrumen ini dapat mendeteksi hingga satuan ppm. Khusus untuk logam-logam yang mudah menguap (mempunyai titik didih yang lebih rendah) sulit dianalisa dengan AAS (Cahyady 2009). Prinsip kerja alat ini berdasarkan penguapan larutan sampel, kemudian logam yang terkandung di dalamnya diubah menjadi atom bebas. Atom tersebut mengabsorbsi radiasi dari sumber cahaya yang dipancarkan dari lampu katoda (hallow cathode lamp) yang mengandung unsur yang akan dianalisis. Banyaknya penyerapan radiasi kemudian diukur pada panjang gelombang tertentu (Arifin 2008). Komponen-komponen penting yang terdapat pada AAS adalah sumber radiasi untuk memancarkan spektrum atom dari unsur yang ditentukan, nyala untuk mengubah sampel yang berupa padatan atau cairan menjadi bentuk uap atomnya, system pembakar-pengabut yang mengubah larutan uji menjadi atomatom dalam bentuk gas, monokromator berfungsi memisahkan garis resonansi dari 15 semua garis yang tak diserap yang dipancarkan oleh sumber radiasi, detektor untuk mengubah intensitas radiasi yang dating menjadi arus listrik, dan read out merupakan sistem pencatat hasil (Cahyady 2009). Gangguan pada AAS secara luas dikelompokkan menjadi gangguan spektral dan gangguan kimia. Gangguan spektral disebabkan terjadinya tumpang tindih absorbsi antara apesies pengganggu dengan yang diukur. Adanya hasil pembakaran pada nyala dapat menyebabkan gangguan spektral. Gangguan kimia dapat berupa pembentukan senyawa volatilitas rendah, dan kesetimbangan disosiasi ionik dalam nyala. Biasanya anion membentuk senyawa dengan volatilitas rendah dan menurunkan laju atomisasi. Pembentukan senyawa yang stabil menyebabkan tidak sempurnanya disosiasi zat yang akan dianalisa. Gangguan tersebut dapat dieliminasi dengan meningkatkan temperatur nyala, pemakaian reagensia pelepas, dan ekstraksi analit unsur-unsur pengganggu (Cahyady 2009). 3 METODOLOGI 3.1 Waktu dan Tempat Penelitian ini dilaksanakan pada bulan November 2011 sampai Januari 2012. Preparasi sampel dilakukan di Laboratorium Karakteristik Bahan Baku Hasil Perairan, proses penggorengan dilakukan di Laboratorium Preservasi dan Pengolahan Hasil Perairan, dan uji proksimat dilakukan di Laboratorium Biokimia Hasil Perairan, Departemen Teknologi Hasil Perairan Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Analisis asam amino dilakukan di Laboratorium Terpadu Kimia Pascasarjana Institut Pertanian Bogor. Analisis mineral dilakukan di Laboratorium Pengujian Nutrisi Pakan, Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor. 3.2 Bahan dan Alat Bahan utama yang digunakan dalam penelitian ini adalah daging belut sawah segar dan digoreng. Bahan pembantu yang digunakan adalah minyak goreng kelapa sawit, air, es, abu, garam dan dalam analisis proximat menggunakan bahan aquades, H2SO4, NaOH, HCl, H3BO4 dan pelarut heksana. Bahan yang digunakan dalam analisis asam amino adalah natrium hidroksida, asam borat, larutan brij-30 30 %, 2-merkaptoetanol, larutan standar asam amino 0,5 mikromol/ml, Na EDTA, methanol, aquades, Na-asetat, tetrahidrofuran (THF) dan larutan ortoftalaldehid. Bahan yang digunakan untuk analisis mineral adalah HNO3, HClO4, H2SO4 dan HCl. Alat yang digunakan dalam penelitian ini adalah deep frying, pisau, talenan, meteran, aluminium foil, baskom, thermometer, timbangan analitik, kertas label, plastik tahan panas, alat pendingin, dan botol jar. Analisis proksimat menggunakan alat berupa cawan porselen, oven, desikator (analisis kadar air); tabung reaksi, gelas erlenmeyer, tabung kjeldhal, tabung sokhlet, pemanas (analisis kadar lemak); tabung kjeldhal, desikator, destilat, dan buret (analisis kadar protein); cawan porselen, tanur, dan desikator (analisis kadar abu). Analisis asam amino menggunakan alat labu takar, ampul, oven, syringe, pipet mikro, timbangan digital, erlenmeyer, water bath, mortar, kertas saring milipore, vial, dan 17 hight performace liquid chromatrografi (HPLC). Analisis mineral menggunakan alat hotplate, labu takar, timbangan dan alat AAS. 3.3 Metode Penelitian Penelitian diawali dengan pengumpulan data-data berupa asal, ukuran belut, dan pengukuran rendemen tubuh (daging, tulang dan jeroan), selanjutnya dilakukan analisis proksimat, asam amino dan mineral total. Pengumpulan datadata berupa asal, ukuran, dan pengukuran rendemen belut dilakukan pada kondisi segar sedangkan analisis proksimat, asam amino, dan mineral dilakukan pada kondisi segar dan setelah digoreng. Belut (Monopterus albus) diperoleh dari kolam budidaya PKBM Baitul Ilmi Desa Cipambuan RT 3 RW 3 Babakan Madang Bogor. Belut yang diambil adalah ukuran konsumsi dengan size 20. Bahan baku belut yang diambil diberi pakan berupa cacing tanah. Kolam tempat 2 1,5x2 m budidaya belut berukuran dengan dilengkapi penutup. Bahan baku selanjutnya dianalisis morfometrik meliputi berat total, panjang, dan diameter. Belut sawah yang digunakan dalam pengukuran morfometrik berjumlah 30 ekor. Setelah pengukuran morfometrik, belut kemudian dipreparasi dengan cara mengeluarkan jeroan, dan memisahkan bagian kepala, kulit dan daging untuk mengetahui rendemennya. Daging belut yang sudah dipisahkan dari tulang, kulit, kepala, dan jeroan kemudian digoreng. Proses penggorengan dilakukan dengan menggunakan metode deep frying sehingga seluruh badan belut dapat terendam minyak. Belut yang akan digoreng memiliki ukuran yang hampir seragam yaitu panjang 4 cm, lebar 3 cm dan tebal 0,5 cm. Belut yang akan digoreng dipreparasi terlebih dahulu dengan membuang jeroan, tulang, dan kulitnya. Belut kemudian digoreng menggunakan minyak kelapa sawit dengan kedalaman minyak 6 cm suhu penggorengan 180 oC, waktu penggorengan 5 menit. Belut segar dan goreng kemudian masing-masing dihancurkan dan dihomogenkan, kemudian dibagi menjadi tiga bagian yaitu untuk analisis proksimat, analisis asam amino dan analisis mineral. Diagram alir penelitian dapat dilihat pada Gambar 4. 18 Belut Pengukuran berat dan morfometrik Preparasi sampel (pemisahan jeroan, kulit, kepala, daging, dan tulang) Pengukuran rendemen Penggorengan sebanyak 1 kg suhu 180 oC selama 5 menit Segar Analisis proksimat, mineral, asam amino Gambar 4 Diagram alir metode penelitian 3.3.1 Rendemen Rendemen dihitung sebagai presentase bobot bagian tubuh belut yang digunakan dari bobot belut total. Bobot bagian tubuh yang digunakan diperoleh dengan metode by different, yaitu menghitung bobot total belut, kemudian menghilangkan jeroan. Bagian tubuh belut yang di pisahkan adalah kepala, jeroan, dan kulit. Selisih antara bobot total dengan jeroan merupakan bobot yang digunakan sehingga rendemennya dapat dihitung dengan oresentase bobot bagian tubuh yang digunakan per bobot total. 3.3.2 Analisis proksimat Analisis proksimat yang dilakukan meliputi uji kadar air dan kadar abu menggunakan metode oven, uji kadar lemak menggunakan metode sokhlet dan uji kadar protein menggunakan metode kjeldhal. 19 (1) Analisis kadar air (AOAC 2005) Cawan yang akan digunakan dioven terlebih dahulu selama 30 menit pada suhu 100-150 oC, kemudian didinginkan di dalam desikator untuk menghilangkan uap air dan ditimbang (A). Sampel ditimbang sebanyak 2 g dalam cawan yang sudah dikeringkan (B), kemudian dioven pada suhu 100-150 oC selama 6 jam lalu didinginkan dalam desikator selama 30 menit dan ditimbang (C). Tahap ini diulangi hingga dicapai bobot konstan. Keterangan: A=Berat cawan kosong (g) B=Berat cawan dengan daging belut (g) C=Berat cawan dengan daging belut setelah dikeringkan (g) (2) Analisis kadar abu (AOAC 2005) Cawan yang akan digunakan dioven terlebih dahulu selama 30 menit pada suhu 100-150 oC, kemudian didinginkan dalam desikator untuk menghilangkan uap air dan ditimbang. Sampel ditimbang sebanyak 2 g dalam cawan yang sudah dikeringkan, kemudian dibakar diatas nyala pembakar sampai tidak berasap dan dilanjutkan dengan pengabuan di dalam tanur dengan suhu 550-600 oC sampai pengabuan sempurna. Sampel yang sudah diabukan didinginkan dalam desikator dan ditimbang. Kadar abu dihitung dengan rumus: Keterangan : A= Berat cawan abu porselen kosong (g) B= Berat cawan abu porselen dengan daging belut (g) C=Berat cawan abu porselen dengan daging belut setelah dikeringkan (g) (3) Analisis kadar lemak (AOAC 2005) Daging belut seberat 3 g (W1) dimasukkan ke dalam selongsong lemak, kemudian dimasukkan ke dalam labu lemak yang sudah ditimbang berat tetapnya (W2), dan disambungkan dengan tabung sokhlet. Selongsong lemak dimasukkan ke dalam ruang ekstraktor tabung sokhlet lalu dipanaskan pada suhu 40 oC dengan menggunakan pemanas listrik selama 6 jam. Pelarut lemak yang ada dalam labu lemak didestilasi hingga semua pelarut dikeluarkan sehingga tidak kembali ke 20 dalam labu lemak, selanjutnya labu lemak dikeringkan dalam oven pada suhu 105 oC, setelah itu labu didinginkan dalam desikator sampai beratnya konstan (W3). Perhitungan kadar lemak pada daging belut: Keterangan: W1= Berat belut (g) W2= Berat labu lemak tanpa lemak (g) W3= Berat labu lemak dengan lemak (g) (4) Analisis kadar protein (AOAC 2005) Tahap-tahap yang dilakukan dalam analisis protein terdiri dari tiga tahap yaitu destruksi, destilasi dan titrasi. a) Tahap destruksi Daging belut ditimbang seberat 0,5 g kemudian dimasukkan ke dalam tabung kjeltec. Satu butir kjeltab dimasukkan ke dalam tabung tersebut dan ditambahkan 10 ml H2SO4. Tabung yang berisi larutan tersebut dimasukkan ke dalam alat pemanas dengan suhu 410 oC ditambahkan 10 ml air. Proses dekstruksi dilakukan sampai larutan bening. b) Tahap destilasi Isi labu dituangkan ke dalam alat destilasi, labu dibilas dengan akuades 20 ml. Air bilasan juga dimasukkan ke dalam alat destilasi dan ditambahkan larutan NaOH 40-60 % sebanyak 20 ml. Cairan dalam ujung tabung ditampung dengan Erlenmeyer 125 ml berisi larutan H3BO4 dan 3 tetes indikator (campuran metal merah 0,2 % dan metal biru 0,2 % dalam alkohol dengan perbandingan 2:1) yang ada dibawah kondensor. Destilasi dilakukan sampai diperoleh kira-kira 200 ml destilat yang bercampur dengan H3BO4 dan indikator dalam erlenmeyer. c) Tahap titrasi Titrasi dilakukan dengan menggunakan HCL 0,1 N sampai larutan berwarna merah muda. Perhitungan kadar protein pada daging belut: % Kadar Protein = % Nitrogen x factor konversi 21 3.3.3 Analisis asam amino (AOAC 2005) Komposisi asam amino ditentukan dengan menggunakan HPLC. Perangkat HPLC harus dibilas terlebih dahulu dengan eluen yang akan digunakan selama 2-3 jam. Begitu pula dengan syringe yang akan digunakan dibilas dengan akuades sampai syringe benar-benar bersih. Analisis asam amino dengan menggunakan HPLC terdiri dari empat tahap, yaitu: tahap pembuatan hidrolisat protein, tahap pengeringan, tahap derivatisasi dan tahap injeksi serta analisis asam amino. a. Tahap pembuatan hidrolisat protein Preparasi sampel, yaitu tahap pembuatan hidrolisat protein, sampel ditimbang, sebanyak 0,1 gram dan dihancurkan. Sampel yang telah hancur ditambahkan HCl 6 N sebanyak 10 ml yang kemudian dipanaskan dalam oven pada suhu 100 o C selama 24 jam. Pemanasan dilakukan untuk mempercepat reaksi hidrolisis. b. Tahap pengeringan Sampel disaring dengan kertas saring milipore. Penyaringan ini bertujuan agar larutan yang dihasilkan benar-benar bersih, terpisah dari padatan. Hasil saringan diambil sebanyak 30 mikroliter dan ditambahkan dengan 30 mikroliter larutan pengering. Larutan pengering dibuat dari campuran methanol, pikotiosianat dan trietilamin dengan perbandingan 4:4:3. c. Tahap derivatisasi Larutan derivatisasi sebanyak 30 mikroliter ditambahkan pada hasil pengeringan, larutan derivatisasi dibuat dari campuran metanol, natrium asetat dan trietilamin dengan perbandingan 3:3:4. Proses derivatisasi dilakukan agar detektor mudah untuk mendeteksi senyawa yang ada pada sampel, selanjutnya dilakukan pengenceran dengan cara menambahkan 20 ml asetonitrit 60 % atau buffer natrium asetat 1M, lalu dibiarkan selama 20 menit. d. Tahap injeksi ke HPLC Hasil saringan diambil sebanyak 40 mikroliter untuk diinjeksikan ke dalam HPLC. Perhitungan konsentrasi asam amino yang ada pada bahan dilakukan dengan pembuatan kromatogram standar dengan menggunakan asam amino 22 yang telah siap dipakai yang mengalami perlakuan yang sama dengan sampel. Kandungan asam amino pada bahan dapat dihitung dengan rumus: Keterangan : C = Konsentrasi standar asam amino (µg/ml) Fp = faktor pengenceran BM = Bobot molekul dari masing-masing asam amino (g/mol) Kondisi HPLC pada saat berlangsungnya hidrolisis asam amino adalah sebagai berikut: Kolom : Ultra techspere Laju aliran fase mobil : 1 ml/menit Detektor : Fluoresensi Fase mobil : Bufer A(Na-Asetat, Na-EDTA, Metanol, THF), Bufer B (methanol 95 % dan air) Panjang gelombang : 350-450 nm 3.3.4 Analisis total mineral (K, Na, Ca, Mg, Zn, Fe, Cu) Sampel yang akan diuji kadar mineralnya dilakukan pengabuan basah terlebih dahulu. Proses pengabuan basah dilakukan dengan sampel ditimbang sebanyak 1 g, kemudian dimasukkan ke dalam erlenmeyer 150 ml. Ke dalam labu ditambahkan 5 ml HNO3 dan dibiarkan selama 1 jam. Labu ditempatkan di atas hotplate selama ± 4 jam dan ditambahkan 0,4 ml H2SO4 pekat, campuran (HClO4 dan HNO3) sebanyak 3 tetes, 2 ml akuades dan 0,6 ml HCl pekat. Larutan contoh kemudian diencerkan menjadi 100 ml dalam labu takar. Sejumlah larutan stok standar dari masing-masing mineral diencerkan dengan menggunakan akuades sampai konsentrasinya berada dalam kisaran kerja logam yang diinginkan. Larutan standar, blanko dan contoh dialirkan ke dalam atomic absorption spectrophotometer (AAS). Kemudian diukur absorbansi atau tinggi puncak dari standar, blanko dan contoh pada panjang gelombang dan parameter yang sesuai untuk masing-masing mineral dengan spektrofotometer. Kadar mineral di dalam bahan dihitung dengan rumus: 23 Kadar mineral (mg/100g basis basah (bb)) = Kadar mineral (mg/100g basis kering (bk)) = Keterangan: a = konsentrasi larutan sampel (ppm) b = konsentrasi larutan blanko (ppm) fp = faktor pengenceran w = berat sampel (g) x 100 % 4 HASIL DAN PEMBAHASAN 4.1 Karakteristik Bahan Baku Karakteristik bahan baku merupakan sifat penting untuk mengetahui potensi yang terdapat pada bahan tersebut. Berdasarkan hasil pengukuran, diperoleh data mengenai ukuran dan bobot belut sawah (Monopterus albus) yang terdiri atas parameter panjang, diameter badan, dan berat total. Belut sawah memiliki panjang rata-rata 42,63±2,03 cm, diameter rata-rata 1,05±0,13 cm, lingkar badan rata-rata 1,61±0,11 cm dan berat rata-rata 62,33±8,01 gr. Pertumbuhan dipengaruhi oleh faktor dalam dan faktor luar. Faktor dalam merupakan faktor yang tidak dapat dikontrol misalnya genetik. Faktor luar merupakan faktor yang dapat dikontrol misalnya pemberian nutrisi, suhu, air, pH, jenis kelamin dan umur. Belut sawah yang digunakan dalam penelitian ini hanya bagian dagingnya saja. Daging segar yang digunakan berwarna putih, tekstur kompak, dan aroma spesifik belut. Daging yang digoreng berwarna coklat keemasan, tekstur agak krispi, dan aroma lezat. Daging segar dan goreng masing-masing dilumatkan kemudian dibungkus dengan alumunium foil dan disimpan ke dalam lemari es agar tidak mengalami kemunduran mutu saat dianalisis komposisi gizinya. 4.2 Rendemen Rendemen digunakan untuk memperkirakan berapa bagian dari bobot tubuh yang dapat dimanfaatkan sebagai bahan pangan. Rendemen merupakan parameter yang paling penting untuk mengetahui nilai ekonomis dan efektivitas suatu produk atau bahan terutama bahan pangan. Semakin tinggi rendemen, maka semakin tinggi pula nilai ekonomisnya. Perhitungan rendemen didapatkan dengan membandingkan berat masing-masing bagian tubuh dengan bobot totalnya. Rendemen dari belut terdiri dari daging, kulit, kepala dan jeroan. Belut ditimbang utuh kemudian dipreparasi dengan membagi menjadi daging, kulit, kepala, dan jeroan, kemudian ditimbang. Persentasi rendemen belut dapat dilihat pada Gambar 5. 25 Tulang 14,72 % Kulit 10,39 % Daging 55,09 % Jeroan 9,69 % Kepala 10,12 % Gambar 5 Persentasi rendemen belut sawah Rendemen tertinggi terdapat pada daging belut yaitu 55,09 % dari berat totalnya. Bagian tubuh belut yang paling banyak dimanfaatkan adalah bagian dagingnya untuk diolah sebagai lauk sumber protein. Berdasarkan perhitungan rendemen daging belut di atas, belut memiliki nilai potensi yang baik untuk dimanfaatkan dagingnya sebagai makanan sumber protein. Hasil lain yang didapat yaitu rendemen tulang belut. Tulang belut memiliki rendemen 14,72 % dari berat total tubuhnya. Tulang ikan saat ini banyak dimanfaatkan sebagai bahan baku pembuatan gelatin. Gelatin yang terbuat dari tulang ikan memiliki respon yang baik di pasaran. Produksi gelatin dunia terbesar berasal dari bahan baku kulit babi. Gelatin yang berasal dari kulit babi ini tidak menguntungkan bila dipasarkan di negara-negara yang mayoritas penduduknya muslim, sehingga penggunaan tulang ikan sebagai bahan baku gelatin merupakan alternatif yang prospektif (Astawan et al. 2002). Tulang belut juga dapat dimanfaatkan sebagai bahan baku pembuatan tepung tulang ikan. Tepung tulang ikan memiliki keunggulan dibandingkan tepung ikan biasa. Tepung tulang ikan memiliki kandungan mineral seperti kalsium dan fosfor yang tinggi, sehingga dapat menjadi sumber pemenuhan kebutuhan akan kalsium dan fosfor (Kaya et al. 2007). Rendemen kulit belut sebesar 10,39 %. Kulit belut memiliki tektur yang licin, plastis dan tidak bersisik. Kulit ikan biasa dimanfaatkan sebagai kerupuk kulit, bahan baku pembuatan gelatin, dan penyamakan kulit ikan. Rendemen kepala belut sebesar 10,12 %. Kepala belut dapat dimanfaatkan sebagai bahan baku pembuatan pupuk tanaman. Kepala belut memiliki kandungan protein yang 26 tinggi, sehingga dapat digunakan sebagai perangsang pertumbuhan tanaman. Rendemen jeroan belut sebesar 9,69 %. Jeroan banyak dimanfaatkan sebagai pupuk dan diambil ekstrak enzimnya. Enzim yang dapat diambil dari jeroan ikan antara lain protease, kolagen dan katepsin. Berat belut sawah segar mengalami penurunan bobot setelah proses penggorengan. Penyusutan bobot belut sawah segar setelah digoreng adalah 74 % dari bobot awal. Penyusutan ini terjadi karena kandungan air menguap dari bahan dan digantikan oleh minyak (Ketaren 1986). Banyaknya kandungan minyak yang masuk ke dalam belut adalah 23 ml per 100 gram. Jumlah ini diperoleh dari pengurangan minyak yang digunakan sebelum penggorengan dan setelah penggorengan. 4.3 Hasil Analisis Proksimat Bahan pangan memiliki komposisi gizi tertentu yang menyusunnya. Sifat komposisi gizi pada bahan pangan perlu diketahui untuk pemanfaatan dan pengembangan bahan makanan tersebut. Bahan pangan berupa daging, biasa dikonsumsi dalam bentuk olahan. Bahan baku segar maupun olahan perlu diketahui kandungan gizinya agar dapat diketahui perubahan kandungan gizi di dalam bahan tersebut akibat pengolahan. Hal tersebut perlu dilakukan mengingat pengolahan dapat menyebabkan perubahan nilai gizi dari suatu bahan baku segar. Salah satu proses pengolahan belut yang banyak dilakukan adalah penggorengan. Penggorengan merupakan suatu proses pemanasan bahan pangan menggunakan medium minyak goreng sebagai pengantar panas. Tujuan proses penggorengan adalah untuk melakukan pemanasan pada bahan pangan, pemasakan, dan pengeringan. Menggoreng dengan minyak atau lemak mampu meningkatkan cita rasa dan tekstur makanan dan jumlah kalori akan meningkat setelah digoreng. Bahan yang digoreng akan menghasilkan produk yang kering, renyah, dan tahan lama (Winarno 1999). Bahan pangan yang digoreng biasanya digoreng menggunakan sistem deep frying. Proses penggorengan dapat merubah karakter bahan pangan. Lapisan luar akan berwarna coklat keemasan karena adanya reaksi browning. Komposisi gizi dari bahan pangan juga berubah karena ada beberapa zat gizi makanan yang 27 tidak tahan panas. Suhu pemanasan saat menggoreng berkisar antara 163-200 oC (Ketaren 1986). Salah satu metode yang paling lazim digunakan untuk mengetahui kandungan gizi suatu bahan adalah analisis proksimat. Analisis proksimat dilakukan untuk mengetahui kandungna gizi secara kasar (crude) yang meliputi kadar air, abu, protein, lemak, dan karbohidrat. Kandungan karbohidrat dihitung secara by different. Komposisi kimia daging segar dan goreng belut sawah dapat dilihat pada Tabel 2. Tabel 2 Komposisi kimia daging segar dan goreng belut sawah Komposisi kimia rata-rata (%) Kadar air Kadar abu Kadar protein Kadar lemak Kadar karbohidrat Segar Basis basah Basis kering (%) (%) 78,90 0 0,33 1,56 15,90 75,32 0,12 0,58 4,75 22,54 Goreng Basis basah Basis kering (%) (%) 23,47 0 3,15 4,12 55,47 72,48 11,52 15,05 6,39 8,35 Nilai gizi suatu bahan dipengaruhi oleh kadar air. Kandungan kadar air yang rendah pada bahan pangan akan menyebabkan bahan menjadi lebih padat sehingga konsentrasi zat gizi akan terlihat lebih besar dibandingkan bahan pangan yang memiliki kadar air yang lebih tinggi. Nilai kandungan gizi yang sebenarnya dilakukan dengan pengasumsian perhitungan kandungan gizi tanpa kandungan air atau kandungan air diabaikan yang disebut basis kering, sehingga dapat terlihat perbandingan nilai gizi bahan baku segar dan bahan baku setelah digoreng. 4.3.1 Kadar air Air merupakan komponen penting dalam bahan makanan karena air dapat mempengaruhi penampakan, tekstur, serta cita rasa makanan. Bahan makanan mengandung air dalam jumlah yang berbeda-beda. Kandungan air dalam bahan pangan ikut menentukan acceptability, kesegaran, dan daya tahan bahan itu. Air dalam bahan makanan biasanya terbagi dua yaitu air imbibisi dan air kristal. Air imbibisi merupakan air yang masuk ke dalam bahan pangan dan akan menyebabkan pengembangan volume, tetapi air ini tidak termasuk komponen penyusun bahan tersebut. Air kristal adalah semua air yang terikat di bahan pangan maupun nonpangan yang berbentuk kristal (Winarno 2008). 28 Kandungan air dan aktivitas air mempengaruhi perkembangan reaksi pembusukan secara kimia dan mikrobiologi dalam makanan. Makanan yang dikeringkan mempunyai kestabilan tinggi pada penyimpanan, biasanya dengan rentang kadar air antara 5-15 %. Makanan semi basah memiliki kadar air 20-40 %. Makanan semi basah memiliki aktivitas air 0,5. Berbagai mikroorganisme mempunyai aw minimum agar dapat tumbuh dengan baik, yaitu bakteri aw 0,9, khamir aw 0,8-0,9, dan kapang aw 0,6-0,7 (deMan 1997). Penetapan kandungan air pada belut segar dan belut goreng dilakukan dengan mengeringkan bahan dalam oven pada suhu 110 oC sampai beratnya konstan. Selisih berat sebelum dan sesudah pengeringan adalah banyaknya air yang diuapkan (Winarno 2008). Kandungan air dalam belut sawah yang segar adalah 78,90 % dan belut sawah goreng 23,47 %. Kandungan air belut sawah segar lebih besar daripada belut sawah goreng. Kadar air pada hewan diikat oleh protein otot. Kemampuan otot mengikat air disebabkan oleh aktomiosin komponen utama myofibril (deMan 1997). Kandungan air belut sawah goreng lebih kecil bila dibandingkan dengan kandungan air belut sawah segar. Penggorengan dengan suhu 180 oC selama 5 menit menyebabkan 55,43 % kadar air belut segar menguap. Pemanasan saat penggorengan menyebabkan pori-pori permukaan bahan terbuka, sehingga air dalam bahan akan menguap. Kekosongan air pada bahan pangan kemudian digantikan oleh minyak yang berdifusi ke dalam bahan makanan (Ketaren 1986). Belut sawah yang digoreng memiliki kadar air 23,47 %. Kadar air tersebut menandakan bahwa bahan makanan tersebut termasuk dalam golongan makanan semi basah. Menurut deMan (1997) makanan semi basah memiliki aktivitas air 0,5 dimana bakteri, kamir dan kapang tidak bisa hidup pada jangka waktu tertentu. Hal ini menunjukkan bahwa belut goreng memiliki waktu simpan lebih lama daripada belut segar apabila disimpan pada suhu ruang. 4.3.2 Kadar abu Kandungan mineral pada bahan pangan hewani sekitar 4 % yang dalam analisis bahan makanan tertinggal sebagai kadar abu, yaitu sisa yang tertinggal bila suatu sempel bahan makanan dibakar sempurna di dalam suatu tungku. Kadar abu menggambarkan banyaknya mineral yang tidak terbakar menjadi zat yang 29 menguap (Sediaoetama dan Achmad 2008). Unsur mineral disebut sebagai zat anorganik. Pembakaran akan menguapkan bahan-bahan organik, tetapi zat organik tetap utuh (Winarno 2008). Penentuan kadar abu dengan cara tersebut, abu tidak mengandung nitrogen yang terdapat pada protein, sehingga berbeda dengan kandungan mineral yang sebenarnya pada bahan. Anion organik menghilang selama pembakaran, dan logam diubah menjadi oksidanya (deMan 1997). Mineral di dalam tubuh ada yang bergabung dengan zat organik, dan ada yang berbentuk ion bebas. Mineral yang bergabung dengan zat organik berasosiasi dengan bagian daging non lemak misalnya protein. Daging tidak berlemak biasanya memiliki kandungan mineral yang tinggi (deMan 1997). Daging ikan memiliki kadar abu berkisar antara 1-2 % dari berat totalnya (Ruiter 1995). Kadar abu pada belut sawah segar dalam basis kering adalah 1,56 %, sedangkan kadar abu belut sawah goreng adalah 4,12 %. Kadar abu belut sawah segar setelah penggorengan naik sebesar 2,56 %. Menurut Ghidurus et al. (2010), penggorengan tidak mengurangi secara signifikan kandungan mineral bahan pangan karena beberapa jenis mineral tidak larut di dalam minyak tetapi larut di dalam air. Mineral bukan merupakan senyawa volatile, sehingga tidak mudah menguap. Kenaikan kandungan mineral ini dapat disebabkan oleh minyak yang digunakan saat penggorengan mengandung sejumlah mineral, sehingga mineral dari minyak terdifusi ke dalam bahan pangan. Minyak yang berasal dari kelapa sawit memiliki beberapa kandungan mineral seperti Cu, P, dan Fe yang kadarnya masing-masing 0,0200-0,047 ppm, 0,35-0,89 ppm, dan 0,0157-0,093 ppm. (Hasibuan dan Nuryanto 2011). Selain mineral di atas, dimungkinkan masih terdapat beberapa mineral yang terdapat pada minyak goreng yang belum terdeteksi. Kenaikan jumlah kadar abu setelah penggorengan, hampir dua kali lipat dibandingkan kadar abu belut sawah segar. Hal ini juga dapat disebabkan oleh proses penggorengan. Menurut Winarno (2008) bahan yang dipanaskan akan kehilangan bahan organiknya dan yang tersisa adalah bahan anorganiknya. Proses penggorengan akan menghilangkan sejumlah bahan organik di dalam bahan makanan, sehingga secara proporsional akan meningkatkan kadar abu tersebut karena berat total bahan setelah digoreng lebih ringan dibandingkan bahan yang 30 masih segar. Kandungan abu dan komponennya tergantung pada jenis bahan dan proses pengabuannya (Sudarmadji dan Suhardi 1989 dalam Jacoeb et al. 2008). 4.3.3 Kadar protein Protein merupakan makromolekul yang paling berlimpah di dalam sel dan menyusun lebih dari setengah berat kering pada hampir semua organisme. Protein terdiri dari 20 asam amino baku, yang molekulnya sendiri tidak memiliki aktivitas biologi (Lehninger 1982). Protein dibagi menjadi protein struktural dan protein metabolik. Protein struktural merupakan bagian integral dari struktur sel dan tidak dapat diekstraksi tanpa menyebabkan disintegrasi sel tersebut. Protein metabolik ikut serta dalam reaksi-reaksi biokimiawi dan mengalami perubahan bahkan destruksi atau sintesa protein baru. Protein metabolik dapat diekstraksi tanpa merusak integritas struktur sel tersebut (Sediaoetama dan Achmad 2008). Kandungan protein ikan erat kaitannya dengan kandungan lemak dan air. Ikan yang mengandung lemak rendah rata-rata memiliki protein dalam jumlah besar (deMan 1997). Kandungan protein ikan umumnya lebih tinggi jika dibandingkan dengan hewan darat. Kandungan protein ikan cukup tinggi yaitu 8-25 % dan tersusun atas sejumlah asam amino yang berpola mendekati pola kebutuhan asam amino tubuh. Protein yang terkandung di dalam ikan terdiri dari tiga jenis yaitu protein myofibril, sarkoplasma, dan kolagen yang masing-masing sebesar 65-80 %, 15-25 %, dan 1-12 % dari total protein (Ruiter 1995). Daging ikan mempunyai nilai biologis sebesar 90 %. Nilai biologis adalah nilai perbandingan antara jumlah protein yang diserap dengan jumlah protein yang dikeluarkan. Protein ikan mengandung sedikit sekali tendon, sehingga sangat mudah dicerna. Tendon ini terdiri atas serat-serat pendek myosin, aktin, aktomyosin, dan tropomiosin (deMan 1997). Kandungan protein belut sawah segar adalah 15,90 % dan kandungan protein belut sawah goreng adalah 55,47 % pada berat basah. Kandungan protein belut sawah goreng lebih tinggi disebabkan kadar air pada belut sawah goreng lebih rendah dibandingkan belut sawah segar, sehingga secara proposional akan meningkatkan kadar proteinnya. Semakin rendah kadar air, maka konsentrasi protein di dalam bahan semakin pekat, sehingga presentasinya akan terlihat lebih besar. Kandungan protein yang sebenarnya dapat dilihat pada perhitungan basis 31 kering dimana kadar air dianggap tidak ada. Kandungan protein belut sawah segar basis kering adalah 75,32 % dan belut sawah goreng sebesar 72,48 %. Penurunan kadar protein belut sawah setelah penggorengan adalah 2,84 %. Penurunan kandungan protein belut sawah setelah digoreng tidak terlalu tinggi. Penurunan ini disebabkan oleh suhu penggorengan yang tinggi yaitu 180 o C. Menurut deMan (1997), pemanasan bahan makanan dengan suhu 180 oC selama 5 menit akan mendenaturasi protein sebesar 50 %. Protein mengalami perubahan selama penggorengan. Proses perubahan yang terjadi selama penggorengan pada protein adalah deaminasi, interaksi dengan basa-basa volatil dari aldehid, dan terbentuknya reaksi maillard. Proses perubahan ini akan mempengaruhi rasa dari produk yang digoreng. Senyawasenyawa yang mempengaruhi rasa dari produk yang digoreng adalah aldehid, pirazin, dan turunan dari senyawa amina (Ghidurus et al. 2010). 4.3.4 Kadar lemak Lemak adalah sekelompok ikatan organik yang terdiri atas unsur karbon, hydrogen dan oksigen yang mempunyai sifat tidak larut dalam air tetapi dapat diekstrak dengan pelarut nonpolar (Lehninger 1982). Lemak di dalam makanan yang memegang peranan paling penting disebut lemak netral, atau triglicerida, yang molekulnya terdiri dari satu molekul gliserol dan tiga molekul asam lemak, yang diikatkan pada gliserol tersebut dengan ikatan ester. Jaringan lemak di dalam tubuh dianggap tidak aktif, sehingga tidak ikut di dalam proses-proses metabolisme dan merupakan simpanan energi yang tidak terpakai (Sediaoetama dan Achmad 2008). Lemak hewani mengandung banyak sterol yang disebut kolesterol. Lemak hewani ada yang berbentuk padat yang biasanya berasal dari lemak hewan darat. Lemak hewan laut berbentuk cair dan disebut minyak. Lemak dalam jaringan hewan terdapat pada jaringan adipose (Winarno 2008). Kandungan lemak setiap bahan pangan berbeda, bergantung pada asal dari bahan pangan tersebut (deMan 1997). Lemak daging ikan mengandung asam lemak jenuh dengan panjang rantai C14-C22 dan asam lemak tidak jenuh dengan jumlah ikatan 1-6. Meskipun daging ikan memiliki kandungan lemak yang cukup tinggi (0,1-8%), akan tetapi 25 % dari jumlah tersebut merupakan asam lemak tak jenuh yang 32 sangat dibutuhkan manusia dan kadar kolesterol yang sangat rendah (Ruiter 1995). Berdasarkan kandungan lemaknya, ikan dikategorikan menjadi tiga yaitu ikan kurus dengan kandungan lemak lebih dari 2 %, ikan lemak sedang dengan kandungan lemak antara 2-5 %, dan ikan berlemak dengan kandungan lemak diatas 5 % (Sun 2006). Belut sawah segar memiliki kandungan lemak pada basis basah sebesar 0,13 %. Berdasarkan pengelompokan Sun (2006), belut sawah tergolong kedalam ikan kurus. Kandungan lemak belut sawah segar basis kering adalah 0,58 % dan kandungan lemak belut sawah goreng basis kering adalah 15,05 %. Proses penggorengan akan meningkatkan kadar lemak pada bahan pangan dikarenakan minyak goreng merupakan lemak cair yang berfungsi sebagai penghantar panas dan penambah kalori bahan pangan (Winarno 2008). Selama proses penggorengan, maka sebagian minyak akan masuk ke dalam bahan pangan untuk menggantikan kadar air yang menguap akibat panas yang ditimbulkan saat penggorengan (Ketaren 1986). Kandungan minyak yang masuk ke dalam belut goreng tersebut adalah 14,47 % yang didapatkan dari selisih lemak setelah penggorengan dan lemak belut segar. Lemak mengalami perubahan bentuk selama penggorengn. Proses perubahan lemak yang terjadi selama proses penggorengan adalah oksidasi, pengikatan dengan gugus amina dan komponen sulfur, hidrolisis, dan polimerisasi. Proses perubahan ini akan mempengaruhi rasa dari produk yang digoreng. Senyawa-senyawa dari lemak yang mempengaruhi rasa dari produk yang digoreng adalah aldehid, pirol, tiol, dan sulfida (Ghidurus et al. 2010). Lemak terdiri dari asam lemak yang menyusunnya. Asam lemak dibagi dua golongan yaitu asam lemak jenuh dan tak jenuh. Asam lemak jenuh bertitik leleh lebih tinggi dibandingkan asam lemak tak jenuh (deMan 1997). Tingginya kandungan asam lemak tak jenuh menyebabkan lemak menjadi mudah rusak oleh proses penggorengan, karena lemak akan dipanaskan dengan suhu tinggi serta terjadinya kontak dengan oksigen dari udara luar yang memudahkan terjadinya oksidasi. Umumnya kerusakan oksidasi terjadi pada asam lemak tak jenuh, tetapi bila dipanaskan pada suhu 100 oC atau lebih, asam lemak jenuh pun dapat teroksidasi. Proses penggorengan akan merubah ikatan rangkap cis yang 33 terisomerisasi menjadi konfigurasi trans yang secara termodinamik sifatnya lebih stabil daripada cis. Secara kimiawi, konfigurasi asam lemak tak jenuh trans mengikat atom hidrogen secara berseberangan (opposite), sedangkan bentuk cis sebaliknya (Sartika 2009). Ikatan trigliserol pada lemak akan terputus selama proses penggorengan dan membentuk di- dan monoasilgliserol, gliserol, dan asam lemak bebas. Hidrolisis lemak, lebih reaktif pada lemak dengan asam lemak tak jenuh rantai pendek dibandingkan dengan asam lemak jenuh rantai panjang dikarenakan asam lemak tak jenuh rantai pendek lebih mudah terpecah oleh air dibandingkan asam lemak jenuh rantai panjang. Air dari bahan makanan akan mudah diikat pada asam lemak rantai pendek (Choe dan Min 2007). 4.3.5 Kadar karbohidrat Karbohidrat memegang peranan penting sebagai sumber energi utama bagi manusia dan hewan. Karbohidrat terdiri dari gula sederhana yang mudah larut dalam air dan mudah diangkut ke seluruh sel-sel guna penyedian energi (Almatsier 2006). Karbohidrat memiliki peranan penting dalam menentukan karakteristik bahan makanan misalnya rasa, warna, dan tekstur. Karbohidrat di dalam tubuh manusia dapat dibentuk dari beberapa asam amino dan sebagian gliserol lemak (Winarno 2008). Karbohidrat dalam daging ikan merupakan polisakarida yaitu glikogen. Glikogen terdapat di dalam sarkoplasma di antara myofibril, dan terkadang membentuk senyawa komplek dengan protein myosin dan miogen. Glikogen dalam daging bersifat tidak stabil, mudah berubah menjadi asam laktat melalui proses glikolisis (deMan 1997). Hasil perhitungan by difference pada belut sawah segar dalam basis kering didapatkan kandungan karbohidrat sebesar 22,54 % sedangkan belut sawah goreng memiliki kandungan karbohidrat sebesar 8,35 %. Kandungan karbohidrat pada belut sawah segar cukup tinggo dikarenakan masih ada kandungan lain selain karbohidrat karena tidak dilakukan pengujian khusus. Karbohidrat mengalami perubahan bentuk selama penggorengan. Proses perubahan karbohidrat yang terjadi selama proses penggorengan adalah pirolisis (karamelisasi), reaksi Maillard, dan dekomposisi karbohidrat. Proses perubahan ini akan mempengaruhi rasa dari produk yang digoreng. Senyawa-senyawa dari 34 karbohidrat yang mempengaruhi rasa dari produk yang digoreng adalah turunan furan dan pirol (Ghidurus et al. 2010). Proses pirolisis atau karamelisasi adalah proses yang terjadi ketika gula sukrosa dipanaskan terus menerus hingga kandungan airnya hilang sehingga membentuk karamel sukrosa. Titik lebur sukrosa adalah 160 oC. Reaksi Maillard adalah reaksi terjadi antara gula pereduksi dan amina primer ketika dipanaskan (Winarno 2008). 4.4 Komposisi Asam Amino Kualitas suatu protein dapat dinilai dari perbandingan asam-asam amino yang menyusun protein tersebut. Terdapat dua jenis asam amino yang menyusun protein yaitu asam amino esensial dan asam amino non esensial. Asam amino esensial merupakan asam amino yang tidak dapat disintesis oleh tubuh yaitu leusin, isoleusin, metionin, fenilalanin, treonin, triptofan, lisin, dan valin. Asam amino nonesensial adalah asam amino yang dapat disintesis oleh tubuh. Asam amino jenis ini adalah alanin, asparagin, asam aspartat, sistin, asam glutamat, glutamin, glisin, hidroksi prolin, prolin, serin, dan tirosin (Suryaningrum et al. 2010). Kandungan asam amino pada masing-masing spesies memiliki proses fisiologis yang berbeda. Perbedaan kandungan asam amino ini juga dapat disebabkan oleh umur, musim penangkapan serta tahapan dalam daur hidup organisme (Litaay 2005). Asam amino dikelompokan berdasarkan sifat kimia rantai sampingnya yang dapat bersifat polar dan nonpolar. Kandungan bagian asam amino polar yang tinggi dalam protein meningkatkan kelarutannya dalam air. Asam amino yang yang disambungkan dengan ikatan peptida membentuk struktur ikatan primer protein. Susunan asam amino menentukan sifat struktur sekunder dan tersier. Jumlah asam amino esensial yang terdapat dalam protein menentukan kualitas gizi protein (deMan 1997). Komposisi asam amino belut sawah segar dan goreng pada Tabel 3, dan grafik perbandingan asam amino belut sawah segar dan goreng dapat dilihat pada Gambar 6. 35 Tabel 3 Komposisi asam amino belut sawah dalam basis kering Hasil (g/100g) Belut Belut Kehilangan Clarias Kebutuhan Jenis asam amino sawah sawah asam amino gariepinus (g/100g)*** segar goreng segar** Asam aspartat 7,39 5,39 2,00 6,20 ~ Asam glutamat 12,89 9,06 3,83 9,12 ~ Serin 3,22 2,34 0,88 2,30 ~ Histidin* 1,54 1,18 0,36 1,60 1,9 Glisin 3,90 2,43 1,47 3,00 ~ Treonin* 3,12 2,35 0,77 2,59 2,8 Arginin 5,02 3,53 1,49 3,86 ~ Alanin 4,82 3,29 1,53 3,70 ~ Tirosin* 2,55 1,90 0,65 2,30 2,2 Methionin* 2,22 1,62 0,60 1,43 2,2 Valin* 3,34 2,29 1,05 3,24 2,5 Fenilalanin* 3,88 2,01 1,87 2,79 2,2 I-leusin* 3,27 2,28 0,99 2,63 2,8 Leusin* 5,99 4,12 1,87 5,22 4,4 Lisin* 7,13 4,91 2,22 6,12 4,4 Keterangan: * asam amino esensial ** Rosa et al. (2007) *** FAO/WHO (1985) diacu dalam Almatsier (2006) 14 12 10 8 g/ 100g 6 4 2 0 Asam amino Gambar 6 Grafik asam amino belut segar dan belut goreng basis kering. Hasil analisis asam amino belut sawah segar dan goreng didapatkan 15 asam amino yang terdiri atas 9 asam amino esensial dan 6 asam amino non esensial. Asam amino esensial yang terdapat pada belut sawah segar adalah histidin, treonin, tirosin, metionin, valin, fenilalanin, I-leusin, leusin, dan lisin. Asam amino nonesensial belut sawah adalah asam aspartat, asam glutamat, serin, glisin, arginin, dan alanin. Asam amino esensial yang tidak terdapat pada belut 36 sawah adalah sistin dan triptofan. Kehilangan dua asam amino ini tidak terlalu berpengaruh terhadap gizi di dalam tubuh bila mengkonsumsi makanan yang mengandung asam amino tadi. Hal tersebut dijelaskan oleh Almatsier (2006) bahwa jika dua protein yang memiliki jenis asam amino yang berbeda dikonsumsi bersama-sama, maka kekurangan asam amino dari suatu protein dapat ditutupi oleh asam amino sejenis yang berlebihan pada protein lain. Dua protein tersebut saling mendukung sehingga mutu gizi menjadi lebih tinggi. Asam amino esensial dan nonesensial belut sawah segar lebih tinggi dibandingkan belut sawah setelah proses penggorengan (Gambar 3). Proses penggorengan dengan suhu 180 oC dapat merusak asam amino yang terkandung dalam bahan pangan. Kandungan asam amino yang hilang pada belut sawah setelah penggorengan bervariasi antara 22-48 % dari berat awal asam amino pada belut sawah segar. Hal ini dapat disebabkan oleh ketahanan masing-masing asam amino terhadap suhu tinggi. Menurut penelitian Ito et al. (2009), asam amino akan mengalami kerusakan apabila dipanaskan lebih dari 100 oC, akan tetapi bila dipanaskan dalam larutan alkali, maka kestabilan asam amino dapat dinaikkan sampai suhu 200 oC. Proses penggorengan akan menyebabkan terjadinya reaksi Maillard. Reaksi Maillard adalah reaksi yang terbentuk antara gula pereduksi dan gugus asam amino yang menyebabkan warna coklat pada bahan makanan yang digoreng (Winarno 2008). Kandungan asam amino di dalam belut sawah yang digoreng sebagian diubah menjadi pigmen melanoid, sehingga jumlahnya di dalam bahan pangan menjadi berkurang. Jenis asam amino yang paling banyak berkurang setelah penggorengan adalah asam glutamat dan lisin. Asam amino yang paling berperan dalam pembentukan reaksi Maillard adalah lisin dan asam glutamate karena asam amino ini merupakan asam amino yang paling reaktif dan merupakan gugus amino bebas. Kecepatan dan pola reaksi dipengaruhi oleh sifat asam amino atau protein yang bereaksi dan sifat karbohidrat. Hal ini berarti bahwa setiap jenis makanan dapat menunjukkan pola pencoklatan yang berbeda. Faktor lain yang mempengaruhi reaksi pencoklatan adalah suhu, pH, kandungan air, oksigen, logam, fosfat, belerang oksida, dan inhibitor lainnya. Kandungan asam amino yang menurun setelah proses penggorengan juga disebabkan beberapa 37 asam amino dapat teroksidasi oleh radikal bebas yang terbentuk karena oksidasi lipid (deMan 1997). Penelitian ini menggunakan ikan lele segar sebagai pembanding kandungan asam amino belut sawah segar. Ikan lele memiliki beberapa kesamaan dengan belut sawah diantaranya adalah hidup di perairan tawar berlumpur, memiliki kulit yang plastik, licin dan tanpa sisik, dan merupakan ikan karnivora. Berdasarkan hasil analisis asam amino esensial yang paling tinggi pada belut sawah segar dan goreng adalah lisin. Kandungan asam amino lisin yang terdapat pada belut sawah segar adalah 7,13 g/100g dan belut sawah goreng adalah 4,91 g/100g. Ikan lele segar juga memiliki kandungan asam amino esensial tertinggi yaitu lisin dengan jumlah 6,12 g/100g (Rosa et al. 2007). Lisin merupakan asam amino esensial yang sangat dibutuhkan sebagai bahan dasar antibodi darah, memperkuat sistem sirkulasi, dan mempertahankan pertumbuhan sel-sel normal. Lisin bersama prolin dan vitamin C akan membentuk jaringan kolagen dan menurunkan kadar trigliserida darah yang berlebih. Kekurangan lisin menyebabkan mudah lelah, sulit konsentrasi, rambut rontok, anemia, pertumbuhan terhambat, dan kelainan reproduksi (Suryaningrum et al. 2010). Kandungan asam amino non esensial yang paling besar pada belut sawah segar dan goreng adalah asam glutamat yaitu 12,89 g/100g pada belut sawah segar dan 9,06 g/100g pada belut sawah goreng. Ikan lele segar juga memiliki kandungan asam amino non esensial tertinggi yaitu asam glutamat yang berjumlah 9,12 g/100g (Rosa et al. 2007). Hal ini dapat disebabkan oleh asam amino glutamin yang mengalami deaminasi membentuk asam glutamat (Murray et al. 2003). Asam glutamat merupakan salah satu sumber rasa umami (gurih) yang dominan pada bahan pangan, yang merupakan rasa dasar kelima disamping rasa manis, asin, asam dan pahit (Suryaningrum et al. 2010). Bahan pangan yang mengandung protein memiliki asam amino pembatas. Asam amino pembatas adalah asam amino yang jumlahnya paling sedikit di dalam bahan pangan. Asam amino pembatas pada belut sawah segar dan goreng adalah histidin dengan nilai masing-masing 1,54 g/100g dan 1,18 g/100g. Asam amino histidin juga merupakan asam amino pembatas pada asam amino essensial belut sawah baik segar maupun goreng. Asam amino nonesensial pembatas pada belut 38 sawah segar dan goreng adalah serin dengan kandungan masing-masing 3,22 g/100g dan 2,34 g/100g. Asam amino pembatas pada ikan lele segar adalah methionin dengan jumlah 1,43 g/100g. Asam amino metionin juga merupakan asam amino pembatas pada asam amino essensial ikan lele segar. Asam amino nonesensial pembatas pada ikan lele segar adalah serin dengan jumlah 2,30 g/100g (Rosa et al. 2007). Beberapa kebutuhan asam amino esensial yang diperlukan oleh anak sekolah usia 10-12 tahun menurut FAO/WHO (1985) diacu dalam Almatsier (2006) yang terdapat pada Tabel 3 menunjukkan bahwa asupan asam amino esensial yang berasal dari belut sawah dapat kurang dapat mencukupi kebutuhan asam amino esensial baik dalam bentuk goreng. Proses penggorengan menyebabkan belut sawah kehilangan asam amino yang cukup besar yaitu berkisar 30% dari asam amino awal, sehingga untuk pemasakan belut goreng lebih baik menggunakan suhu yang lebih rendah. Karakteristik belut sawah setelah digoreng yaitu renyah dan agak kering. Oleh karena itu, disarankan untuk tidak melakukan proses penggorengan ikan yang menghasilkan tekstur yang terlalu renyah dan kering apabila ingin mendapatkan manfaat dari kandungan asam amino dari ikan belut sawah. Hampir semua asam amino mempunyai fungsi khusus. Triptofan adalah prekursor vitamin niasin dan pengantar saraf serotonin. Metionin memberikan gugus metal guna sintesis kolin dan kreatinin. Metionin juga merupakan prekursor sistein dan ikatan yang mengandung sulfur lainnya. Fenilalanin adalah prekursor tirosin dan bersama-sama membentuk hormon-hormon tiroksin dan epinefrin. Tirosin merupakan prekursor bahan yang membentuk pigmen kulit dan rambut. Arginin dan sentrulin terlibat dalam sintesis ureum dalam hati. Glisin mengikat bahan-bahan toksik dan mengubahnya menjadi bahan yang tidak berbahaya. Glisin juga digunakan dalam sintesis porfirin nukleus hemoglobin dan merupakan bagian dari asam empedu. Histidin diperlukan untuk sintesis histamin. Kreatinin yang disintesis dari arginin, glisin, dan metionin bersama fosfat membentuk kreatinin fosfat, suatu simpanan penting fosfat berenergi tinggi didalam sel. Glutamin yang dibentuk dari asam glutamat dan asparagin dari aspartat 39 merupakan simpanan asam amino di dalam tubuh. Asam glutamat juga merupakan prekursor pengantar saraf gamma amino-asam butirat (Almatsier 2006). 4.5 Komposisi Mineral Bahan makanan mengandung 96 % bahan organik dan air, dan sisanya terdiri dari unsur-unsur mineral, yang didalam bahan pangan tertinggal sebagai kadar abu, yaitu sisa yang tertinggal bila suatu sampel bahan makanan dibakar sempurna didalam suatu tungku (Sediaoetama 2010). Bahan mineral dapat berupa garam anorganik atau organik, atau gabungan dari keduanya seperti fosfoprotein dan logam yang digabung dengan enzim. Mineral dikelompokkan menjadi dua golongan, komponen mineral makro (garam utama) dan mineral mikro (sesepora). Komponen mineral makro mencakup kalium, natrium, kalsium, fosfat, magnesium, klorida, sulfat, dan bikarbonat. Mineral mikro mencakup Fe, Cu, I, Co, Mn, Zn. Unsur ini biasanya ditemukan dalam jumlah kurang dari 50 ppm di dalam tubuh (deMan 1997). Kandungan mineral di dalam setiap bahan makanan berbeda-beda bergantung kepada jenis dan kondisi hidupnya. Kandungan beberapa jenis mineral belut sawah segar dan goreng dapat dilihat pada Tabel 4. Tabel 4 Kandungan beberapa jenis mineral belut sawah segar dan goreng Mineral Makro Ca Mg Na K Mikro Zn Fe Cu Daging belut sawah segar Daging belut sawah goreng 542,25 446,28 148,27 82,57 2.745,69 347,96 8.049,45 5.025,08 99,79 75,09 1,92 Hasil (mg/kg) Clarias Kehilangan gariepinus mineral segar* Clarias gariepinus goreng* Kehilangan mineral 95,98 65,70 2.397,73 3.924,37 121,00 420,00 - 37,00 232,00 - 84,00 188,00 - 18,37 36,92 0,38 22,00 12,20 - 14,00 8,00 - 8,00 4,20 81,41 38,17 2,30 Keterangan: * Salawu et al. (2005) Kandungan mineral yang diteliti pada belut sawah segar dan goreng adalah mineral makro yaitu Ca, Mg, Na, dan K, sedangkan mineral mikro adalah Zn, Fe, dan Cu. Kandungan mineral makro paling tinggi pada belut sawah dan goreng adalah Kalium, yang masing-masing 8.949,45 mg/kg dan 5.025,28 mg/kg. 40 Kandungan kalium tinggi di dalam bahan makanan karena mineral ini terdapat didalam jaringan otot dan setiap cairan intrasel (deMan 1997). Bersama natrium, kalium memegang peranan penting dalam pemeliharaan keseimbangan cairan dan elektrolit serta keseimbangan asam-basa. Kalium juga berfungsi sebagai katalisator dalam banyak reaksi biologis, terutama dalam metabolisme energi, pertumbuhan sel, dan sintesis glikogen dan protein (Almatsier 2006). Kalium mudah diserap oleh tubuh, diperkirakan 90 % dari yang dicerna akan diserap di dalam usus halus. Kalium mempunyai fungsi yang hampir sama dengan natrium dan terkadang saling mendukung dalam melakukan fungsinya di dalam tubuh sehingga kandungan natrium di dalam tubuh juga tinggi (Winarno 2008). Kandungan kalium yang tinggi pada belut dapat mencegah hipokalemia. Hipokalemia adalah gejala kekurangan kalium pada tubuh yang ditandai badan yang lemah, kelelahan otot, tidak nafsu makan, dan muntah (Widjajanti dan Agustini 2005). Kandungan natrium di dalam tubuh sekitar setengah dari kandungan kalium. Penyerapan natrium di dalam tubuh juga tinggi yaitu berkisar antara 95 % (Winarno 2008). Fungsi kalium dan natrium di dalam tubuh yang sangat besar dan daya serapnya yang tinggi di dalam pencernaan menyebabkan kandungannya di dalam tubuh juga tinggi. Kandungan natrium di dalam belut sawah segar berada di urutan kedua terbesar setelah kalium yaitu 2.745,69 mg/kg. Menurut Winarno (2008), kebutuhan kalium perhari adalah 2-6 gram perhari dan natrium 2,5-3 gram perhari. Berdasarkan kandungan kalium dan natrium di dalam belut sawah segar dan goreng, untuk mencukupi kebutuhan kalium dan natrium tubuh, memerlukan 500 g sampai 1.000 g per hari belut untuk dikonsumsi. Kandungan mineral makro lain yaitu kalsium yang terdapat pada belut sawah segar yaitu 542,25 mg/kg dan belut sawah goreng adalah 446,28 mg/kg. Kandungan mineral kalsium pada belut sawah segar lebih tinggi bila dibandingkan dengan ikan lele baik segar maupun goreng yang masing-masing bernilai 121 mg/kg dan 37 mg/kg. Menurut Salawu et al. (2005) kalsium pada lele setelah proses penggorengan turun sebesar 84,00 mg/kg dari jumlah kalsium awal, sedangkan pada penelitian ini belut setelah digoreng kehilangan 95,98 mg/kg dari jumlah kalsium awal. Menurut Osaki et al. (2003) minyak kelapa sawit 41 mengandung mineral kalsium di dalamnya. Dimungkinkan minyak goreng mempengaruhi kandungan kalsium pada makanan yang digoreng. Kalsium yang berada di dalam jaringan tubuh berperan dalam transmisi impuls saraf, kontraksi otot, penggumpalan darah, pengaturan permeabilitas membran sel, serta keaktifan enzim. Kebutuhan kalsium di dalam tubuh adalah 800-1.000 mg/hari, dan daya serapnya berkisar antara 10-40 % pada orang dewasa (Winarno 2008). Berdasarkan kandungan kalsium di dalam belut sawah segar dan goreng, untuk mencukupi kebutuhan kalsium tubuh, memerlukan 1.000 g/hari belut untuk dikonsumsi. Kandungan kalsium dapat ditambah dengan memberikan asupan gizi dari makanan lain yang mengandung kalsium tinggi misalnya susu. Kandungan mineral makro paling kecil yang diteliti adalah Mg yaitu 148,27 mg/kg pada belut sawah segar dan 82,57 mg/kg pada belut sawah goreng. Kandungan magnesium pada belut sawah lebih kecil dibandingkan dengan lele pada penelitian Salawu et al. (2005). Penurunan kandungan magnesium pada belut dan lele setelah digoreng masing-masing adalah 65,70 mg/kg dan 188 mg/kg. Magnesium memegang peranan penting dalam lebih dari tiga ratus jenis sistem enzim di dalam tubuh. Magnesium bertindak di dalam reaksi biologis termasuk reaksi yang berkaitan dengan metabolisme energi, karbohidrat, lemak, protein, dan asam nukleat. Peran magnesium di dalam cairan ekstraseluler yaitu dalam transmisi saraf, kontraksi otot, dan pembekuan darah. Kecukupan magnesium untuk orang dewasa yaitu 250-280 mg/hari, sedangkan daya serapnya di dalam tubuh 30-60 % (Almatsier 2006). Berdasarkan kandungan magnesium di dalam belut sawah segar dan goreng, untuk mencukupi kebutuhan magnesium tubuh, memerlukan 1.000-1.500 g belut perhari untuk dikonsumsi. Kandungan mineral mikro yang paling tinggi pada belut sawah segar dan goreng adalah seng, dengan nilai masing-masing 99,79 mg/kg dan 81,41 mg/kg. Kandungan seng pada belut sawah lebih tinggi bila dibandingkan dengan ikan lele (Salawu et al. 2005). Penurunan kadar seng setelah penggorengan pada belut sawah lebih besar bila dibandingkan dengan lele yaitu 18,37 mg/kg pada belut sawah dan 8,00 mg/kg pada lele. Seng memiliki fungsi sebagai bagian dari enzim atau kofaktor pada kegiatan lebih dari 200 enzim, berkaitan dengan sintesis dan degradasi karbohidrat, protein, lipid, dan asam nukleat (Almatsier 2006). Seng 42 dalam daging terikat kuat pada myofibril dan diduga mempengaruhi daya ikat airdaging (deMan 1997). Kecukupan seng untuk orang dewasa adalah 5,5-12 mg/hari (Winarno 2008). Berdasarkan kandungan seng di dalam belut segar dan goreng, untuk mencukupi kebutuhan seng tubuh, memerlukan 100-170 g belut perhari untuk dikonsumsi. Seng ditemukan hampir diseluruh jaringan hewan. Seng lebih banyak terakumulasi di dalam tulang dibanding dalam hati yang merupakan organ utama penyimpan mineral mikro. Jumlah terbanyak terdapat dalam jaringan epidermal dan sedikit dalam tulang, otot, darah, dan enzim (Arifin 2008). Kandungan mineral mikro lain yang terdapat pada belut sawah segar dan goreng adalah besi (Fe), dengan nilai masing-masing adalah 75,09 mg/kg dan 38,17 mg/kg. Kandungan mineral besi pada belut sawah lebih besar dibandingkan dengan ikan lele pada penelitian Salawu et al. (2005). Pengurangan jumlah besi pada belut sawah yaitu 36,92 mg/kg dan ikan lele yang digoreng yaitu 4,20 mg/kg. Kandungan besi dalam tubuh hewan bervariasi bergantung pada status kesehatan, nutrisi, umur, jenis kelamin, dan spesies. Besi di dalam tubuh berasal dari tiga sumber yaitu perusakan sel darah merah, penyimpanan dalam tubuh, dan pencernaan (Arifin 2008). Besi memiliki beberapa fungsi esensial tubuh yaitu sebagai alat angkut oksigen dari paru-paru ke seluruh tubuh, alat angkut elektron di dalam sel, dan sebagai bagian terpadu berbagai reaksi enzim di dalam jaringan tubuh. Kebutuhan tubuh akan besi adalah 10-26 mg/hari, sedangkan daya penyerapan besi oleh tubuh adalah 5-15 % (Almatsier 2006). Berdasarkan kandungan besi di dalam belut segar dan goreng, untuk mencukupi kebutuhan besi tubuh, memerlukan 1.000 g belut perhari untuk dikonsumsi. Kandungan mineral paling rendah pada belut sawah segar dan goreng yang diteliti adalah tembaga (Cu), dengan nilai masing-masing 1,92 mg/kg dan 2,30 mg/kg. Tembaga berperan dalam beberapa kegiatan enzim pernafasan, sebagai kofaktor bagi enzim tirosinase, dan sitokrom oksidase. Tembaga juga diperlukan dalam proses pertumbuhan sel-sel darah merah yang masih muda (Winarno 2008) jumlah tembaga yang aman untuk dikonsumsi adalah 1,5-3 mg/hari, sedangkan daya serapnya 35-70 %. Berdasarkan kandungan tembaga di dalam belut segar 43 dan goreng, untuk mencukupi kebutuhan tembaga tubuh, memerlukan 1.000 g belut perhari untuk dikonsumsi. Kandungan mineral belut sawah setelah dilakukan proses penggorengan akan berubah. Ada mineral yang berkurang setelah penggorengan dan ada pula yang mengalami peningkatan. Mineral yang mengalami penurunan jumlah setelah penggorengan adalah kalsium (Ca) 95,98 mg/kg, magnesium (Mg) 65,70 mg/kg, natrium (Na) 2.397,73 mg/kg, kalium (K) 3.924,37 mg/kg, seng (Zn) 18,37 mg/kg, dan besi (Fe) 36,92 mg/kg. Mineral yang mengalami penurunan paling tinggi setelah penggorengan adalah natrium. Natrium terutama terdapat dalam cairan ekstraseluler bersama-sama dengan klorida dan bikarbonat. Jika cairan di dalam daging hilang, maka unsur utama yang hilang adalah natrium (deMan 1997). Selama proses penggorengan, sebagian besar air akan menguap karena panas dan digantikan oleh minyak, sehingga mineral natrium juga sebagian menguap bersama air. Kalium, magnesium, dan kalsium berada di dalam cairan ekstraseluler dan intraseluler bersama dengan natrium, sehingga kandungannya juga berkurang akibat pemanasan (deMan 1997). Mineral besi bersifat kurang stabil, dan mudah berubah menjadi ferro dan ferri (Arifin 2008). Perubahan ini kemungkinan akan mengurangi kandungan besi di dalam belut sawah setelah digoreng, selain faktor pemanasan yang juga merusak kandungan besi di dalam bahan makanan. Mineral seng juga mengalami penurunan kandungan setelah proses penggorengan, akan tetapi jumlahnya tidak terlalu tinggi bila dibandingkan mineral lain. Hal ini dimungkinkan karena seng lebih stabil terhadap panas dibandingkan mineral lain. Mineral yang mengalami peningkatan kadar pada belut sawah setelah digoreng adalah tembaga yaitu sebesar 0,38 mg/kg. Peningkatan kandungan tembaga pada belut sawah goreng adalah sebesar 19,81 %. Hal ini dapat disebabkan oleh minyak yang digunakan mengandung sejumlah mineral tembaga yang dapat meningkatkan kandungan tembaga dalam belut goreng. Minyak yang berasal dari kelapa sawit memiliki beberapa kandungan mineral seperti Cu, P, dan Fe yang kadarnya masing-masing 0,0200-0,047 ppm, 0,35-0,89 ppm, dan 0,01570,093 ppm. Sedangkan kadar Fe dan P belum dicantumkan dalam standar tersebut (Hasibuan et al. 2011). 5 KESIMPULAN DAN SARAN 5.1 Kesimpulan Rendemen belut sawah (Monopterus albus) terdiri dari kepala, daging, kulit, dan jeroan. Rendemen daging belut sebesar 55,08 %. Proses penggorengan merubah komposisi gizi belut sawah. Komposisi gizi yang mengalami penurunan jumlah didalam daging belut sawah setelah penggorengan adalah kadar air sebesar 55,43 %, kadar protein 2,56 %, dan kadar karbohidrat 14,19 % sedangkan komposisi gizi yang mengalami kenaikan setelah penggorengan adalah kadar lemak sebesar 14,47 % dan kadar abu 2,56 %. Asam amino esensial yang terdapat pada belut sawah segar adalah histidine, threonine, tyrosine, methionin, valin, phenilalanin, I-leucine, leucine, dan lysine sedangkan asam amino nonesensial adalah asam aspartat, asam glutamate, serin, glysin, arginin, dan alanin. Komposisi asam amino pada belut goreng secara keseluruhan mengalami penurunan. Asam amino esensial terbanyak adalah lisin dengan penurunan sebesar 2,22 g/100g. Asam amino nonesensial terbanyak adalah asam glutamat dengan penurunan sebesar 3,83 g/100g. Asam amino pembatas pada belut sawah segar dan goreng adalah histidin yang jumlahnya masing-masing 1,54 g/100g dan 1,18 g/100g. Kandungan mineral yang diteliti pada belut sawah segar dan goreng adalah mineral makro yaitu Ca, Mg, Na, dan K, sedangkan mineral mikro adalah Zn, Fe, dan Cu. Mineral yang mengalami penurunan jumlah setelah penggorengan adalah kalsium 95,98 mg/kg, magnesium 65,70 mg/kg, natrium 2.397,73 mg/kg, kalium 3.024,37 mg/kg, seng 18,37 mg/kg, dan besi 36,92 mg/kg. Mineral tembaga mengalami kenaikan sebesar 0,38 mg/kg. 5.2 Saran Saran untuk penelitian selanjutnya adalah penggunaan berbagai teknik pemasakan yang berbeda seperti pengukusan dan presto untuk mendapatkan teknik pemasakan yang paling efisien agar pemanfaatan gizi belut optimal saat dikonsumsi. Selain itu dapat digunakan suhu yang berbeda untuk mengetahui jumlah kandungan gizi yang rusak tiap kenaikan suhu tertentu. DAFTAR PUSTAKA Almatsier S. 2006. Prinsip Dasar Ilmu Gizi. Jakarta: Gramedia Pustaka Utama [AOAC] Association of Official Analytical Chemyst. 2005. Official Method of Analysis of The Association of Official Analytical of Chemist. Arlington, Virginia, USA: Association of Official Analytical Chemist, Inc. Arifin Z. 2008. Beberapa unsur mineral esensial mikro dalam sistem biologi dan metode analisisnya. Jurnal Litbang Pertanian. Vol 27 (3) : 99-105. Astawan M, Hariyadi P, Mulyani A. 2002. Analisis reologi gelatin dari kulit ikan cucut. Jurnal Teknologi dan Industri Pangan. Vol 13 (1): 38-46. Bahri F. 2000. Studi mengenai aspek biologi ikan belut sawah (Monopterus albus) di Kecamatan Parung, Kabupaten Bogor, Jawa Barat. [Skripsi]. Bogor: Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Budiyanto MAK. 2002. Dasar-Dasar Muhammadiyah Malang. Ilmu Gizi. Malang: Universitas Cahyady B. 2009. Studi tentang kesensitifan spektrofotometer serapan atom (SSA) teknik vapour hydride generation accessories (VGHA) dibandingkan dengan SSA nyala pada analisa unsure arsen (As) yang terdapat dalam air minum. [Tesis]. Medan: Universitas Sumatra Utara. Choe E, Min DB. 2007. Chemistry of deep fat frying oils. Journal of Food Science. Vol 72 (5): 77-86. deMan JM. 1997. Kimia Makanan. Penerjemah: Kosasih P. Bandung: ITB. [DGKM] Departemen Gizi dan Kesehatan Masyarakat. 2009. Gizi dan Kesehatan Masyarakat. Jakarta: Rajawali Press. Effendie MI. 1997. Biologi Perikanan. Bogor: Yayasan Pustaka Nusatama. Ghidurus M, Turtoi M, Boskou G, Niculita P, Stan V. 2010. Nutritional and health aspects related to frying. Romanian Biotechnological Letters. Vol 15 (6): 5675-5682. Hasibuan HA, Nuryanto E. 2011. Kajian kandungan P, Fe, Cu dan Ni pada minyak sawit, minyak inti sawit dan minyak kelapa selama proses rafinasi. Jurnal Standardisasi. Vol 13 (1): 67-71. Ito M, Yamaoka K, Masuda H, Kawahata H, Gupta L. 2009. Thermal stability of amino acid in biogenic sediments and aqueous solutions at seafloor hydrothermal temperatures. Geochemical Journal. Vol 43: 331-341 46 Irianto DP. 2006. Panduan Gizi Lengkap Keluarga dan Olahraga. Yogyakarta: Andi Jacoeb AM, Hamdani M, Nurjanah. 2008. Perubahan komposisi kimia dan vitamin daging udang ronggeng (Harpiosquilla raphidea) akibat perebusan. Buletin Teknologi Hasil Perikanan. Vol 11 (2): 76-89. Kartasapoetra G, Marsetyo H. 2008. Ilmu Gizi (Korelasi Gizi, Kesehatan, dan Produktivitas Kerja. Jakarta: Rineka Cipta. Kaya AOW, Santoso J, Salamah E. 2007. Pemanfaatan tepung tulang ikan patin Pangasius sp sebagai sumber kalsium dan fosfor dalam pembuatan biskuit. Ichthyos. Vol 7 (1): 9-14. Ketaren S. 1986. Pengantar Teknologi Minyak dan Lemak Pangan. Jakarta: UI Press. Lehninger A. 1982. Dasar-dasar Biokimia. Penerjemah: Maggy T. Jakarta: Erlangga. Litaay M. 2005. Peranan nutrisi dalam siklus reproduksi abalone. Oseana. Vol 3:1-7. Murray KK. Granner DK, Mayes PA, Rodwell VW. 2003. Biokimia Harper. Jakarta: Buku kedokteran EGC. Nurhamidah. 2005. Penentuan kondisi optimum HPLC untuk pemisahan residu pestisida imidakloprid, profenofos dan deltametrin pada cabai (Capsicumannum). Jurnal Ilmu-Ilmu Pertanian Indonesia. Vol 7 (2): 87-93. Osaki M, Watanabe T, Ishizawa T, Nilnod C, Nuyim T, Shinano T, Urayama M, Tuah SJ. 2003. Nutritional characteristics of the leaves of native plants growing in adverse soils of humid tropical lowlands. Plants Foods for Human Nutrition. Vol 58 (2): 93-115. Putra EDL. 2004. Kromatografi cair kinerja tinggi dalam bidang farmasi. [Makalah]. Fakultas Ilmu pengetahuan Alam. Universitas Sumatra Utara. Rosa R, Bandarra NM, Nunes ML. 2007. Nutritional quality of African catfish Clarias gariepinus (Burchell 1822): a positive criterion for the future development of the Europian production of Siluroidei. International Journal of Food Science and Technology. Vol 42: 342-351. Roy R. 2009. Budi Daya dan Bisnis Belut. Jakarta: Agromedia Pustaka. Ruiter A. 1995. Fish and Fishery Product: Composition, Nutritive, Properties, and Stability. Wllingford: CABI. Saanin H. 1968. Taksonomi dan Kunci Identifikasi Ikan I. Jakarta: Binacipta. 47 Salawu SO, Adu OC, Akindahunsi AA. 2005. Nutritive value of fresh and brackish water catfish as a function of size and processing methods. Eur Food Res Technol. Vol 220: 531-534. Sartika RAY. 2009. Pengaruh suhu dan lama proses menggoreng (Deep Frying) terhadap pembentukan asam lemak trans. Makara Sains. Vol (13) 1: 23-28. Sarwono B.2003. Budi Daya Belut dan Sidat. Jakarta: PT. Penebar Swadaya. Sediaoetama, Achmad Djaeni. 2008. Ilmu Gizi untuk Mahasiswa dan Profesi di Indonesia. Jakarta: Dian Rakyat Sitompul S. 2004. Analisis asam amino tepung ikan dan bungkil kedelai. Buletin Teknik Pertanian. Vol 9 (1): 33-37. Subagio A, Windrati WS, Fauzi M, Witono Y. 2004. Karakteristik protein myofibril dari ikan kuniran (Upeneus moluccensis) dan ikan mata besar (Selar crumenophthalmus). Jurnal Teknologi dan Industri Pangan. Vol 12 (1): 70-78. Sun DW. 2006. Thermal Food Processing: New Technologies and Quality Issues. Boca Rason: CRC Press Taylor and Francis Group. Suryaningrum TD, Muljanah I, Tahapari E. 2010. Profil sensori dan nilai gizi beberapa jenis ikan patin dan hybrid nasutus. Jurnal Pascapanen dan Bioteknologi Kelautan dan Perikanan. Vol 5 (2): 153-164. Sutarsi, Rahardjo B, Hasuti P. 2009. Difusivitas air pada wortel selama penggorengan hampa udara. Agritech. Vol 29 (3): 184-188. Widjajanti A, Agustini SM. 2005. Hipokalemik periodic paralisis. Indonesian Journal of Critical Pathology and Medical Laboratory. Vol 12 (1): 19-22 Winarno FG. 1999. Minyak Goreng dalam Menu Makanan Masyarakat. Jakarta: Balai Pustaka. Winarno FG. 2008. Kimia Pangan dan Gizi. Bogor: MBrio Press. [WPI] Warta Pasar Ikan. 2010. Belut dan Sidat Permintaanya Semakin Meningkat. Edisi April Vol. 80. Jakarta: Direktorat Pemasaran Dalam Negeri. LAMPIRAN 49 Lampiran 1 Gambar proses preparasi belut Habitat belut sawah Pengukuran diameter belut Daging belut setelah diskinless Pencacahan belut Pematian belut dengan abu Pengukuran panjang belut Penggorengan belut deepfrying Pengukuran asam amino dengan HPLC 50 Lampiran 2 Data dan ukuran berat belut No. Bobot (g) Badan (g) Kepala (g) Jeroan (g) Kulit (g) Tulang (cm) Panjang (cm) Lebar (cm) 1 57 30 6 6 6 9 39 1 2 59 31 6 6 7 9 43 1 3 71 40 7 6 8 10 44 1 4 75 45 6 6 7 11 43,5 1,5 5 58 31 6 6 7 8 42 1,2 6 66 36 7 7 7 9 44 1 7 53 29 5 6 5 8 41 1 8 74 44 6 7 7 10 43 1 9 71 42 6 6 7 10 42,5 1 10 50 25 6 6 5 8 40 1 11 49 24 5 6 6 8 41 1 12 62 34 7 6 6 9 44 1 13 57 31 6 5 6 9 39,5 1 14 50 25 6 5 6 8 40 1 15 59 32 6 6 6 9 41,5 1 16 70 39 7 7 7 10 43 1 17 59 33 5 5 7 9 42,5 1 18 63 35 7 6 6 9 43 1 19 50 25 5 6 6 8 43 1 20 77 45 7 7 8 10 45 1,3 21 52 28 5 5 6 8 39 0,8 22 60 34 6 5 6 9 42 1 23 72 40 7 7 7 11 44 1 24 51 26 6 6 5 8 40,5 1 25 72 42 7 7 7 9 47 1,3 26 69 40 7 6 6 10 42 1,2 27 70 39 7 6 7 11 45 1,2 28 69 38 7 6 8 10 44 1 29 61 31 7 7 7 9 45 1 30 62 35 8 5 5 9 46 1 Jumlah 1868 1029 189 181 194 275 1279 31,5 48,43 rerata standar dev. 62,27 34,30 6,30 6,03 6,47 9,17 42,63 1,05 1,61 8,59 6,36 0,79 0,67 0,86 0,95 2,04 0,13 0,11 Contoh perhitungan rendemen kepala: Diameter (cm) 1,52 1,52 1,75 1,75 1,75 1,59 1,46 1,68 1,65 1,52 1,52 1,56 1,59 1,49 1,59 1,59 1,56 1,59 1,43 1,56 1,43 1,75 1,91 1,52 1,75 1,71 1,81 1,68 1,49 1,59 51 Lampiran 3 Data komposisi kimia daging belut Kadar air jenis belut Ulangan 1 2 1 2 Segar Goreng berat cawan (g) 28, 68 19,63 27,96 25,42 berat sampel (g) 5,04 5,01 3,05 3,00 berat sth dioven (g) 29,75 20,68 30,29 27,72 berat cawan (g) 23,85 40,19 22,90 19,57 berat sampel (g) 3,10 3,01 3,03 3,01 berat sth ditanur (g) 23,86 40,20 23,00 19,66 berat labu (g) 88,56 80,69 82,50 82,72 berat sampel (g) 30,16 31,02 43,45 44,01 berat sth dioven (g) 88,74 80,87 89,08 89,27 berat sampel (g) 0,16 0,16 0,16 0,16 Titrasi H2SO4 (ml) Kadar abu jenis belut Ulangan 1 2 1 2 Segar Goreng Kadar lemak jenis belut Ulangan 1 2 1 2 Segar Goreng Kadar protein jenis belut Segar Goreng Ulangan 1 2 1 2 Contoh perhitungan kadar air: Berat cawan : 28,68 g Berat sampel : 5,04 g Berat cawan setelah di oven : 29,75 g = 78,77 % 13,6 12,8 Protein (%) 29,75 20,68 30,29 27,72 52 Lampiran 4 Peak asam amino belut segar 53 54 Lampiran 5 Peak asam amino belut goreng. 55 56 Lampiran 6 Area HPLC asam amino Area No 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 NO 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Asam amino Aspartat Bobot Mol 133,1 Glutamat 147,1 Serina 105,09 Histidina 155,16 Glysina 75,07 Threonina 119,12 Arginina 174,2 Alanina 89,09 Tyrosina 181,19 Methionina 149,21 Valina 117,15 Fenilalanin 165,19 Ileusina 131,17 Leusina 131,17 Lysina 146,19 Bobot contoh (ug) Standar Segar1 37429970 29324751 Segar 2 36692649 45152476 43804052 19023276 29080232 4089514 50858010 35544928 48316437 18036295 46272318 18568264 44855388 33918461 46468949 9235344 50493960 10612217 53857813 21865870 48402503 19114541 54878978 19285539 47864526 30732217 24084988 15516468 32700 Rumus Bbt Mol Aspartat 133,1 Glutamat 1471 Serina 105,09 Histidina 155,16 Glysina 75,07 Threonina 119,12 Arginina 174,2 Alanina 89,09 Tyrosina 181,19 Methionina 149,21 Valina 117,15 Fenilalanina 165,19 Ileusina 131,17 Leusina 131,17 Lysina 146,19 Bobot contoh (ug) Area Standar 37791636 36829377 44548792 29493410 49697619 49503956 46632422 45193054 46360593 50412484 53553269 43017002 54785645 47404979 23137182 Segar2 28732365 44242150 18609078 4058046 37386912 17609297 18568212 33439807 8999251 10221648 20457099 11094604 18692478 29770088 16398279 33100 Goreng1 Goreng2 80340138 11936756 4 51795942 11778170 88185655 50056323 49416919 87661353 25810984 29067242 55855347 31282298 50271489 78275148 43481748 33600 72152454 10782921 3 46390047 10478700 77196158 45773197 44887004 79171190 23213342 25951521 49980386 28157072 45654259 72777658 37863116 32000 57 Lampiran 7 Konsentrasi asam amino (% b/b basis basah) Kons. % b/b No 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Rumus Aspartat Glutamat Serina Histidina Glysina Threonina Arginina Alanina Tyrosina Methionina Valina Fenilalanina lleusina Leusina Lysina Bbt Kons. Mol Std Segar1 Segar2 Goreng1 Goreng2 133,1 0,5 1,59 1,53 4,25 4,01 147,1 0,5 2,77 2,67 7,12 6,75 105,09 0,5 0,70 0,66 1,85 1,74 155,16 0,5 0,33 0,32 0,94 0,87 75,07 0,5 0,80 0,85 1,94 1,78 119,12 0,5 0,68 0,64 1,84 1,76 174,2 0,5 1,07 1,05 2,77 2,64 89,09 0,5 1,03 1,00 2,59 2,46 181,19 0,5 0,55 0,53 1,50 1,41 149,21 0,5 0,48 0,46 1,28 1,20 117,15 0,5 0,73 0,68 1,81 1,70 165,19 0,5 1,00 0,64 1,59 1,50 131,17 0,5 0,70 0,68 1,79 1,71 131,17 0,5 1,29 1,24 3,19 3,12 146,19 0,5 1,44 1,57 3,93 3,59 15,16 14,51 38,37 36,24 Contoh perhitungan asam amino basis basah ug AA= (area AA sampel/area AA standar) x kons. Std x volume tera % AA = (ug AA x bm AA x 100)/ug sampel contoh perhitungan: Asam aspartat belut A ug AA = (29324751/37429970) x 0,5 x 10 % AA = (3,917282194 x 133,1 x 100)/32700 % AA = 1,59 % 58 Lampiran 8 Hasil uji mineral Ca Standar (ppm) Absorban 0 0 2 0,0703 4 0,1378 8 0,2628 12 0,428 16 0,5158 Kode Sampel Belut segar I 1 Belut segar I 2 Belut segar I 3 Bobot ppm ppm x FP / Kadar sampel Absorban sampel ppm x FP gr sampel Ca(mg/kg) 2,649 0,1166 3,412121 341,2121 128,8078978 129,1892119 2,649 0,1169 3,421212 342,1212 129,1510805 2,649 0,1173 3,433333 343,3333 129,6086574 Belut segar II 1 Belut segar II 2 Belut segar II 3 2,679 2,679 2,679 0,0919 0,0932 0,0912 2,663636 2,70303 2,642424 266,3636 270,303 264,2424 99,426516 100,8969878 98,63472349 99,65274243 Belut goreng I 1 Belut goreng I 2 Belut goreng I 3 2,627 2,627 2,627 0,2746 0,2697 0,2725 8,2 8,051515 8,136364 820 805,1515 813,6364 312,143129 306,4908699 309,7207323 309,4515771 Belut goreng II 1 Belut goreng II 2 Belut goreng II 3 2,77 2,77 2,77 0,3452 0,3447 0,3467 10,33939 10,32424 10,38485 1033,939 1032,424 1038,485 373,2633191 372,716333 374,9042774 373,6279765 59 Lampiran 9 Hasil uji mineral Mg Standar (ppm) Absorban 0 0 0,2 0,2326 0,4 0,4284 0,6 0,6176 0,8 0,7903 1,2 1,1162 Kode Sampel Belut segar I 1 Belut segar I 2 Belut segar I 3 Bobot sampel Absorban 2,649 0,1872 2,649 0,1928 2,649 0,1877 ppm ppm x FP / Kadar sampel ppm x FP gr sampel Mg(mg/kg) 0,161822 80,91106 30,54400261 30,96026359 0,167896 83,94794 31,6904263 0,162364 81,18221 30,64636187 Belut segar II 1 Belut segar II 2 Belut segar II 3 2,679 2,679 2,679 0,1945 0,16974 0,1961 0,171475 0,192 0,167028 84,86985 31,67967456 85,73753 32,00355622 83,5141 31,17360947 31,61894675 Belut goreng I 1 Belut goreng I 2 Belut goreng I 3 2,627 2,627 2,627 0,1647 0,137419 0,165 0,137744 0,1687 0,141757 171,7733 65,38763566 172,18 65,54246037 177,1963 67,45196512 66,12735371 Belut goreng II 1 Belut goreng II 2 Belut goreng II 3 2,77 2,77 2,77 0,1577 0,129826 0,1633 0,1359 0,1624 0,134924 162,2831 58,58594955 169,8753 61,32681269 168,6551 60,88631683 60,26635969 60 Lampiran 10 Hasil uji mineral Na Standar (ppm) 0 0,1 0,2 0,4 0,6 0,8 Kode Sampel Belut segar I 1 Belut segar I 2 Belut segar I 3 Absorban 0 0,0766 0,1613 0,3546 0,5297 0,7143 Bobot ppm ppm x ppm x FP / Kadar sampel Absorban sampel FP gr sampel Na(mg/kg) 2,649 0,2572 0,29545 1477,248 557,6623265 578,8208144 2,649 0,2619 0,300666 1503,33 567,5083555 2,649 0,2828 0,323862 1619,312 611,2917613 Belut segar II 1 Belut segar II 2 Belut segar II 3 2,679 2,679 2,679 0,2778 0,2778 0,2572 0,318313 1591,565 0,318313 1591,565 0,29545 1477,248 594,0891855 594,0891855 551,4175076 579,8652928 Belut goreng I 1 Belut goreng I 2 Belut goreng I 3 2,627 2,627 2,627 0,1283 0,1234 0,1279 0,152386 761,9312 0,146948 734,7392 0,151942 759,7114 290,0385183 279,6875442 289,1935408 286,3065345 Belut goreng II 1 Belut goreng II 2 Belut goreng II 3 2,77 2,77 2,77 0,1167 0,1125 0,1126 0,139512 697,5583 0,13485 674,2508 0,134961 674,8058 251,8260897 243,4118529 243,6121918 246,2833781 61 Lampiran 11 Hasil Uji mineral K Standar (ppm) 0 0,2 0,4 0,8 1,2 2 Kode Sampel Belut segar I 1 Belut segar I 2 Belut segar I 3 Absorban 0 0,1152 0,2241 0,4297 0,631 1,0083 Bobot ppm ppm x ppm x FP / Kadar sampel Absorban sampel FP gr sampel K(mg/kg) 2,649 0,5238 1,011554 5057,769 1909,312542 1910,315201 2,649 0,5245 1,012948 5064,741 1911,944521 2,649 0,5239 1,011753 5058,765 1909,688539 Belut segar II 1 Belut segar II 2 Belut segar II 3 2,679 2,679 2,679 0,5099 0,983865 4919,323 0,5088 0,981673 4908,367 0,5353 1,034462 5172,311 1836,253344 1832,163693 1930,687106 1866,368048 Belut goreng I 1 Belut goreng I 2 Belut goreng I 3 2,627 2,627 2,627 1,081 2,121514 10607,57 1,0559 2,071514 10357,57 1,0529 2,065538 10327,69 4037,902444 3942,736856 3931,362483 3970,667261 Belut goreng II 1 Belut goreng II 2 Belut goreng II 3 2,77 2,77 2,77 1,0413 2,04243 10212,15 1,0587 2,077092 10385,46 1,0523 2,064343 10321,71 3686,697254 3749,262876 3726,250234 3720,736788 62 Lampiran 12 Hasil uji mineral Zn standar (ppm) 0 0,4 0,8 1,4 2,5 3 Kode Sampel Belut segar I 1 Belut segar I 2 Belut segar I 3 Absorban 0 0,0987 0,2176 0,3828 0,627 0,8306 Bobot ppm ppm x ppm x FP / Kadar sampel Absorban sampel FP gr sampel Ca(mg/kg) 2,649 0,148 0,559701 55,97015 21,12878417 20,97383975 2,649 0,147 0,55597 55,59701 20,9879256 2,649 0,1457 0,551119 55,11194 20,80480947 Belut segar II 1 Belut segar II 2 Belut segar II 3 2,679 2,679 2,679 0,1503 0,568284 0,1538 0,581343 0,1452 0,549254 56,82836 58,13433 54,92537 21,21252639 21,70001059 20,50219229 21,13824309 Belut goreng I 1 Belut goreng I 2 Belut goreng I 3 2,627 2,627 2,627 0,4502 1,687313 0,4477 1,677985 0,4512 1,691045 168,7313 167,7985 169,1045 64,22967007 63,8745746 64,37170826 64,15865098 Belut goreng II 1 Belut goreng II 2 Belut goreng II 3 2,77 2,77 2,77 0,4517 1,69291 0,4428 1,659701 0,446 1,671642 169,291 165,9701 167,1642 61,11590064 59,91702139 60,3480791 60,46033371 63 Lampiran 13 Hasil uji mineral Fe Standar (ppm) 0 1 2 3 4 6 Kode Sampel Belut segar I 1 Belut segar I 2 Belut segar I 3 Absorban 0 0,0698 0,1388 0,1994 0,252 0,3955 Bobot ppm ppm x ppm x FP / Kadar sampel Absorban sampel FP gr sampel Fe(mg/kg) 2,649 0,0277 0,385938 38,59375 14,56917705 14,35290047 2,649 0,0278 0,3875 38,75 14,62816157 2,649 0,0265 0,367188 36,71875 13,86136278 Belut segar II 1 Belut segar II 2 Belut segar II 3 2,679 2,679 2,679 0,0334 0,475 0,0324 0,459375 0,0324 0,459375 47,5 45,9375 45,9375 17,73049645 17,14725644 17,14725644 17,34166978 Belut goreng I 1 Belut goreng I 2 Belut goreng I 3 2,627 2,627 2,627 0,0602 0,89375 89,375 0,0591 0,876563 87,65625 0,0604 0,896875 89,6875 34,02169775 33,36743434 34,14065474 33,84326228 Belut goreng II 1 Belut goreng II 2 Belut goreng II 3 2,77 2,77 2,77 0,0476 0,0462 0,046 25,15794224 24,36823105 24,25541516 24,59386282 0,696875 0,675 0,671875 69,6875 67,5 67,1875 64 Lampiran 14 Hasil uji mineral Cu Standar (ppm) 0 0,2 0,4 0,8 1,2 2 Kode Sampel Belut segar I 1 Belut segar I 2 Belut segar I 3 Absorban 0 0,0195 0,04 0,0728 0,1078 0,1817 Bobot ppm ppm x ppm x FP / Kadar sampel Absorban sampel FP gr sampel Cu(mg/kg) 2,649 0,0026 0,017978 1,797753 0,678653382 0,636237546 2,649 0,0022 0,013483 1,348315 0,508990037 2,649 0,0027 0,019101 1,910112 0,721069218 Belut segar II 1 Belut segar II 2 Belut segar II 3 2,679 2,679 2,679 0,0012 0,0015 0,0016 0,002247 0,224719 0,005618 0,561798 0,006742 0,674157 0,08388171 0,209704275 0,25164513 0,181743705 Belut goreng I 1 Belut goreng I 2 Belut goreng I 3 2,627 2,627 2,627 0,008 0,0073 0,0072 0,078652 7,865169 0,070787 7,078652 0,069663 6,966292 2,993973559 2,694576203 2,651805152 2,780118305 Belut goreng II 1 Belut goreng II 2 Belut goreng II 3 2,77 2,77 2,77 0,0028 0,0027 0,003 0,020225 2,022472 0,019101 1,910112 0,022472 2,247191 0,730134264 0,689571249 0,811260293 0,743655268