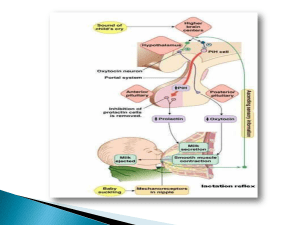
PEMBERIAN SUSU FORMULA KACANG KEDELAI
advertisement

TESIS PEMBERIAN SUSU FORMULA KACANG KEDELAI (Glycine max) MENINGKATKAN KADAR HORMON ESTROGEN DAN MENURUNKAN KADAR HORMON TESTOSTERON PADA BAYI TIKUS PUTIH GALUR WISTAR (Rattus norvegicus) JANTAN EVELINE MARGO NIM 1390761005 PROGRAM MAGISTER PROGRAM STUDI ILMU BIOMEDIK PROGRAM PASCASARJANA UNIVERSITAS UDAYANA DENPASAR 2015 i PEMBERIAN SUSU FORMULA KACANG KEDELAI (Glycine max) MENINGKATKAN KADAR HORMON ESTROGEN DAN MENURUNKAN KADAR HORMON TESTOSTERON PADA BAYI TIKUS PUTIH GALUR WISTAR (Rattus norvegicus) JANTAN Tesis untuk Memperoleh Gelar Magister Pada Program Magister, Program Studi Ilmu Biomedik Program Pascasarjana Universitas Udayana EVELINE MARGO NIM 1390761005 PROGRAM MAGISTER PROGRAM STUDI ILMU BIOMEDIK PROGRAM PASCASARJANA UNIVERSITAS UDAYANA DENPASAR 2015 ii Lembar Pengesahan TESIS INI TELAH DISETUJUI PADA TANGGAL 09 APRIL 2015 Pembimbing I, Pembimbing II, Prof.Dr.dr.Wimpie I.Pangkahila,Sp.And.FAACS NIP. 194612131971071001 Pembimbing II Prof.dr. I Gusti Made Aman, Sp.FK NIP.194606191976021001 Mengetahui Ketua Program Studi Ilmu Biomedik Program Pascasarjana Universitas Udayana, Direktur Program Pascasarjana Universitas Udayana, Prof.Dr.dr.Wimpie I.Pangkahila,Sp.And.FAACS NIP. 194612131971071001 Prof.Dr.dr.A.A.Raka Sudewi, Sp.S(K) NIP. 195902151985102001 iii Tesis Ini Telah Diuji pada Tanggal 09 April 2015 Panitia Penguji Tesis Berdasarkan SK Rektor Universitas Udayana, No : 797/UN14.4/HK/2015, Tanggal 12 Maret 2015 Ketua : Prof. Dr.dr. Wimpie I. Pangkahila, Sp.And.FAACS Anggota : 1. Prof. dr. I. Gusti Made Aman, Sp.FK. 2. Dr.dr.Ida Sri Iswari,Sp.MK.M.Kes. 3. Prof. Dr. dr. J. Alex Pangkahila, M.SC., Sp.And. 4. Prof. Dr. dr. A.A. Gede Budhiarta, Sp.PD-KEMD. iv SURAT PERNYATAAN BEBAS PLAGIAT Nama : dr. Eveline Margo NIM : 1390761005 Program Studi : Magister Ilmu Biomedik (Anti-Aging Medicine) Judul : Pemberian Susu Formula Kacang Kedelai (Glycine max) Meningkatkan Kadar Hormon Estrogen dan Menurunkan Kadar Hormon Testosteron pada Bayi Tikus Putih Galur Wistar (Rattus norvegicus) Jantan Dengan ini menyatakan bahwa karya ilmiah Tesis ini bebas plagiat. Apabila di kemudian hari terbukti terdapat plagiat dalam karya ilmiah ini, maka saya bersedia menerima sanksi sesuai peraturan Mendiknas RI no.17 tahun 2010 dan Peraturan Perundang – undang yang berlaku. Denpasar,........................... Yang membuat pernyataan, (dr. Eveline Margo) v UCAPAN TERIMA KASIH Pertama-tama perkenankanlah penulis memanjatkan puji syukur yang sedalam-dalamnya kepada Tuhan Yang Maha Esa atas berkat, dan karunia-Nya sehingga penulis dapat menyelesaikan tesis ini. Tulisan ini disusun untuk memenuhi persyaratan tugas akhir studi yang telah dijalankan oleh penulis untuk memperoleh gelar Magister pada program Magister Studi Ilmu Kedokteran Program Studi Ilmu Kedokteran Biomedik, Kekhususan Anti-Aging Medicine, Program Pascasarjana Universitas Udayana. Pada kesempatan ini perkenankanlah penulis mengucapkan terima kasih yang sebesar-besarnya kepada Rektor Universitas Udayana Prof. Dr. dr. Ketut Suastika, Sp.PD. KEMD dan Prof. dr. A.A. Raka Sudewi, Sp.S (K) sebagai Direktur Program Pascasarjana atas kesempatan yang diberikan kepada penulis untuk mengikuti dan menyelesaikan pendidikan Program Pascasarjana di Universitas Udayana. Terima kasih kepada Prof. Dr. dr.Wimpie I. Pangkahila, Sp.And. FAACS., selaku pembimbing utama yang dengan penuh perhatian dan kesabaran memberikan petunjuk, dorongan, pengarahan dan bimbingan dalam penyusunan tesis ini. Terima kasih sebesar-besarnya juga penulis sampaikan kepada Prof. Dr. I Gusti Made Aman, Sp.FK, selaku pembimbing I yang sudah meluangkan waktu dan dengan sabar, teliti memberikan arahan, masukan, pengetahuan serta bimbingan yang sangat bermanfaat dalam penyusunan tesis ini. Ucapan terima kasih yang sebesar-besarnya juga penulis sampaikan kepada para penguji tesis ini, yaitu Dr.dr.Ida Sri Iswari, Sp.MK.M.Kes, Prof. Dr. dr. J. vi Alex Pangkahila, M.Sc., Sp.And., dan Prof. Dr. dr. A.A. Gede Budhiarta, Sp.PDKEMD yang telah dengan sabar memberikan masukan, saran, sanggahan, bimbingan dan koreksi sehingga penulis dapat menyelesaikan tesis ini. Penulis juga menyampaikan rasa terima kasih kepada Prof. Dr. Ir. I.B. Putra Manuaba, M.Phil dari UPT laboratorium Analitik Universitas Udayana, Bukit Jimbaran, I Gede Wiranatha, S.Si, dari bagian Laboratory Animal Unit Farmakologi Universitas Udayana, dan Drs. I Ketut Tunas, M.Si yang telah membantu penyelesaian tesis ini. Ucapan terima kasih juga penulis sampaikan kepada seluruh dosen Ilmu Kedokteran Biomedik, Kekhususan Anti-Aging Medicine, Program Pascasarjana Universitas Udayana atas memberikan ilmu pengetahuan selama masa pendidikan yang sangat bermanfaat untuk masa depan penulis, dan kepada seluruh staf biomedik untuk bantuan yang diberikan kepada penulis selama studi, serta kepada semua teman-teman selama perkuliahan yang telah membantu dan mendukung penulis sepanjang menempuh pendidikan ini. Akhirnya penulis juga sampaikan terima kasih kepada suamiku tercinta Dr. Dedy, Sp.An. serta ketiga anak-anakku tercinta Jayden Adriano Chendana, Javier Edward Chendana dan Jason Marco Chendana, serta kedua orang tua dan saudara penulis atas doa, pengorbanan dan kesabaran yang luar biasa dalam memberikan dukungan moril sehingga penulis dapat menyelesaikan studi dan tesis ini. Penulis menyadari bahwa tesis ini masih jauh dari sempurna, untuk itu segenap kritik, saran dan masukan sangat diharapkan. Semoga apa yang tertulis dalam tesis ini dapat bermanfaat bagi kita semua. vii Akhir kata, semoga Tuhan Yang Maha Kuasa, senantiasa melimpahkan berkat dan rahmat-Nya kepada semua pihak yang telah membantu dalam pelaksanaan dan penyelesaian tesis ini . Denpasar, 4 Maret 2015 Penulis viii ABSTRAK PEMBERIAN SUSU FORMULA KACANG KEDELAI (Glycine max) MENINGKATKAN KADAR HORMON ESTROGEN DAN MENURUNKAN KADAR HORMON TESTOSTERON PADA BAYI TIKUS PUTIH GALUR WISTAR (Rattus norvegicus) JANTAN Sistem kekebalan tubuh anak relatif lebih rendah pada tahun pertama sehingga pada bayi dengan bakat atopi mudah terjadi sensitisasi dan menjadi alergi. Idealnya pada bayi baru lahir diberikan air susu ibu (ASI) sebagai makanan utama pada 6 bulan pertama, tetapi sering kali digantikan dengan susu sapi formula yang dapat mencetuskan penyakit Alergi Susu Sapi (ASS). Salah satu pengganti susu tersebut dapat menggunakan susu formula kacang kedelai yang mengandung fitoestrogen dari klas isoflavon yang dapat bekerja seperti hormon estrogen. Tujuan penelitian ini untuk mengetahui pemberian susu formula kacang kedelai dapat meningkatkan kadar hormon estrogen dan menurunkan kadar hormon testosteron pada bayi tikus putih galur Wistar (Rattus norvegicus) jantan. Penelitian ini menggunakan metode post test only control group design. Sampel terdiri dari 36 ekor bayi tikus putih galur Wistar jantan usia 7 hari, berat badan 10–15 gr yang dibagi menjadi dua kelompok, yaitu kelompok kontrol yang diberi susu sapi formula dan kelompok perlakuan yang diberi susu formula kacang kedelai dengan dosis masing-masing kelompok 5% BB (gr), diberikan dua kali sehari per oral selama 21 hari setelah itu, bayi tikus diambil darahnya pada pagi hari untuk pemeriksaan kadar hormon estrogen dan testosteron. Analisis data menggunakan uji t-independent. Hasil analisis data didapatkan kadar estrogen pada kelompok perlakuan lebih tinggi bermakna (p<0,05) dibandingkan dengan kelompok kontrol dengan nilai rerata estrogen kelompok kontrol adalah 0,55±0,03pg/ml dan rerata kelompok perlakuan adalah 0,82±0,01pg/ml, sedangkan kadar testosteron didapatkan lebih rendah bermakna pada kelompok perlakuan dibandingkan dengan kelompok kontrol (p<0,05) dengan rerata testosteron kelompok kontrol adalah 3,250,15ng/ml dan rerata kelompok perlakuan adalah 2,360,22ng/ml. Dari hasil penelitian dapat disimpulkan pemberian susu formula kacang kedelai dapat meningkatkan kadar hormon estrogen dan menurunkan kadar hormon testosteron pada bayi tikus putih galur Wistar (Rattus norvegicus) jantan. Kata kunci: susu sapi formula, susu formula kacang kedelai, estrogen, testosteron, bayi tikus jantan ix ABSTRACT ADMINISTRATION OF SOYMILK FORMULA (Glycine max) INCREASES ESTROGEN LEVEL AND REDUCES TESTOSTERONE LEVEL IN INFANT MALE WHITE WISTAR RATS (Rattus norvegicus) Children’s immunity system is relatively lower on first year of life, causing atopic babies to be more prone to sensitization, leading to allergy. Ideally, newborn babies are given breast milk as main food source on the first 6 months, but often being replaced with cow milk formula which can induce Cow’s Milk Protein Allergy (CMPA). One of the replacements for that milk is soymilk formula which contains phytoestrogen from isoflavon class, which works just like estrogen. This research aimed to determine whether administration of soymilk formula is capable on increasing estrogen level and reducing testosterone level on male infant white Wistar rats (Rattus norvegicus). This research used post test only control group design. Samples were consisted of 36 infant male white Wistar rats aged 7 days, weighing from 10-15 grams, divided into 2 groups, control group which was given cow’s milk formula and intervention group which was given soymilk formula. Each group were given intervention with the dose 5% of BW (grams), given twice-a-day orally for 21 days, and subsequently in the morning their blood samples were taken to examine the level of estrogen and testosterone hormone. The data was analyzed using tindependent test. The result of the analysis showed that the level of estrogen on intervention group was significantly higher (p<0.05) than the control group with mean estrogen level of 0.55±0.03pg/ml in the control group and 0.82±0.01pg/ml in the intervention group, while the mean testosterone level was significantly lower on intervention group compared with control group (p<0.05) with 3.250.15ng/ml on control group and 2.360.22 ng/ml on intervention group. From this research it was concluded that the administration of soymilk formula was able to increase estrogen level and reduce testosterone level on infant male white Wistar rats (Rattus norvegicus). Keywords: cow’s milk formula, soymilk formula, estrogen, testosterone, infant male rats. x DAFTAR ISI Halaman SAMPUL DALAM ........................................................................................... i PERSYARATAN GELAR ................................................................................ ii LEMBAR PENGESAHAN ............................................................................... iii PENETAPAN PANITIA PENGUJI .................................................................. iv SURAT PERNYATAAN BEBAS PLAGIAT .................................................. v UCAPAN TERIMA KASIH ............................................................................. vi ABSTRAK ........................................................................................................ ix ABSTRACT ...................................................................................................... x DAFTAR ISI ..................................................................................................... xi DAFTAR TABEL ............................................................................................. xvi DAFTAR GAMBAR ........................................................................................ xvii DAFTAR ARTI LAMBANG, SINGKATAN, DAN ISTILAH ...................... xviii DAFTAR LAMPIRAN .................................................................................... xix BAB I PENDAHULUAN ................................................................................. 1 1.1 Latar Belakang ................................................................................... 1 1.2 Rumusan Masalah ............................................................................. 8 1.3 Tujuan Penelitian ............................................................................... 8 1.3.1 Tujuan Umum .......................................................................... 8 xi 1.3.2 Tujuan Khusus ......................................................................... 8 1.4 Manfaat Penelitian ............................................................................. 8 1.4.1 Manfaat Ilmiah ......................................................................... 8 1.4.2 Manfaat Praktis ........................................................................ 9 BAB II TINJAUAN PUSTAKA .......................................................................10 2.1 Anti-Aging Medicine (AAM) ............................................................. 10 2.1.1 Konsep Dasar AAM ................................................................. 10 2.1.2 Teori Proses Penuaan ................................................................11 2.1.2.1 Teori Pakai dan Rusak ...................................................... 11 2.1.2.2 Teori Program .................................................................... 11 2.1.3 Faktor yang mempercepat Penuaan ..........................................12 2.2 Fisiologi Sistem Reproduksi pada Laki-laki ..................................... 14 2.2.1 Hormon Seks Steroid pada Laki-laki ....................................... 14 2.2.2 Struktur Testosteron ................................................................ 18 2.2.3 Struktur Estrogen ..................................................................... 18 2.2.4 Kontrol Fungsi Testosteron ...................................................... 19 2.2.5 Pengukuran Hormon Steroid pada laki-laki ............................. 21 2.2.6 Efek dan Fungsi Hormon Seks Steroid pada Laki-laki ........... 23 2.2.6.1 Efek dan Fungsi Testosteron .............................................. 24 2.2.6.2 Efek dan Fungsi Estrogen .................................................. 25 2.2.7 Defisiensi Androgen ................................................................ 26 xii 2.2.8 Reseptor Estrogen .................................................................... 27 2.3 Susu Sapi Formula .............................................................................. 28 2.4 Penyakit Alergi Susu Sapi (ASS) ....................................................... 30 2.5 Kacang Kedelai .................................................................................. 33 2.5.1 Kandungan Isoflavon dalam Kacang Kedelai .......................... 33 2.5.2 Metabolisme dan Bioavailabilitas ............................................ 36 2.5.3 Aktivitas Biologik .................................................................... 36 2.5.4 Cara Kerja Isoflavon ................................................................ 36 2.5.5 Susu Formula Kacang Kedelai ................................................. 40 2.6 Hewan Coba ....................................................................................... 48 2.6.1 Tikus Wistar (Rattus Norvegicus ) ........................................... 49 2.6.2 Pemantauan Keselamatan Tikus di Laboratorium ................... 51 BAB III KERANGKA BERPIKIR, KONSEP, DAN HIPOTESIS PENELITIAN 3.1 Kerangka Berpikir ............................................................................. 53 3.2 Konsep Penelitian ............................................................................... 54 3.3 Hipotesis Penelitian ............................................................................ 55 BAB IV METODE PENELITIAN .................................................................... 56 4.1 Rancangan Penelitian ......................................................................... 56 4.2 Lokasi dan Waktu Penelitian ............................................................. 57 4.2.1 Lokasi Penelitian ...................................................................... 57 4.2.2 Waktu Penelitian ...................................................................... 57 xiii 4.3 Penentuan Sumber Data ..................................................................... 57 4.3.1 Variabilitas Populasi ................................................................ 57 4.3.2 Kriteria Subjek ......................................................................... 58 4.4 Besaran Sampel dan Teknik Pengambilan Sampel ........................... 58 4.4.1 Besaran Sampel ........................................................................ 58 4.4.2 Teknik Pengambilan Sampel ................................................... 59 4.5 Variabel Penelitian ............................................................................. 59 4.5.1 Klasifikasi Variabel ................................................................. 59 4.5.2 Hubungan Antar Variabel ....................................................... 60 4.5.3 Definisi Operasional Variabel .................................................. 60 4.6 Bahan dan Instrumen Penelitian, Hewan Percobaan ........................ 62 4.6.1 Bahan Penelitian ...................................................................... 62 4.6.2 Instrumen Penelitian ................................................................. 63 4.6.3 Hewan Percobaan ..................................................................... 64 4.7 Prosedur Penelitian ............................................................................ 64 4.7.1 Pembuatan Susu ....................................................................... 64 4.7.2 Persiapan Hewan Uji ............................................................... 65 4.7.3 Jalannya Penelitian .................................................................. 65 4.7.4 Proses Pengambilan Darah ...................................................... 66 4.7.5 Analisis Susu Formula Kacang Kedelai .................................. 66 4.7.6 Prosedur Pengukuran Kadar Hormon ..................................... 67 xiv 4.7.6.1 Prosedur Pengukuran Kadar Hormon Estrogen ................ 67 4.7.6.2 Prosedur Pengukuran Kadar Hormon Testosteron ........... 68 4.7.7 Alur Penelitian .......................................................................... 70 4.8 Analisis Data ...................................................................................... 70 BAB V HASIL DAN PEMBAHASAN ............................................................ 72 5.1 Subjek Penelitian ................................................................................ 72 5.2 Distribusi dan Homogenitas Data Hasil Penelitian ............................ 72 5.2.1 Uji Normalitas Data ................................................................. 72 5.2.2 Uji Homogenitas Data .............................................................. 73 5.3 Uji Efek Perlakuan ..............................................................................73 5.3.1 Kadar Hormon Estrogen ...........................................................73 5.3.2 Kadar Hormon Testosteron ...................................................... 75 BAB VI SIMPULAN DAN SARAN .................................................................80 7.1 Simpulan ............................................................................................ 80 7.2 Saran ................................................................................................... 80 DAFTAR PUSTAKA ....................................................................................... 82 LAMPIRAN ...................................................................................................... 87 xv DAFTAR TABEL Halaman 2.1 Kadar Hormon Normal pada Laki-laki dewasa ...................................... 22 2.2 Pola Jaringan dari Reseptor Estrogen α (RE α) dan Reseptor Estrogen β (RE β) pada Tikus Jantan ........................................................................ 28 2.3 Kandungan Isoflavon Kacang Kedelai .................................................... 35 2.4 Indikator Maturasi Seksual dan Gangguan Endokrin pada Hewan Penggerat yang diberi Preparat Isoflavon ................................................ 48 2.5 Perkembangan dan Kebutuhan Tikus Jantan ........................................... 50 2.6 Kadar Hormon Estrogen dan Testosteron Normal pada Tikus Jantan...... 51 5.1 Hasil Uji Normalitas Data Estrogen dan Testosteron Sesudah Perlakuan .................................................................................................................. 73 5.2 Homogenitas Data Estrogen dan Testosteron antar Kelompok ............... 73 5.3 Perbedaan Rerata Estrogen antar Kelompok Sesudah Diberikan Susu Sapi Formula dan Susu Formula Kacang Kedelai ...................................74 5.4 Perbedaan Rerata Testosteron antar Kelompok Sesudah Diberikan Susu Sapi Formula dan Susu Formula Kacang Kedelai ....................................75 xvi DAFTAR GAMBAR Halaman 2.1 Jalur Biosintesis Androgen dan Estrogen ............................................... 15 2.2 Mekanisme Kerja Androgen ....................................................................17 2.3 Struktur Testosteron ..................................................................................18 2.4 Struktur Estrogen .......................................................................................19 2.5 Aksis Hipothalamus – Hipofise Anterior – Testis . ...................................20 2.6 Kadar Testosteron (T) pada Laki-laki Muda dalam 24 jam .................... 21 2.7 Sumber dan Target Estrogen .................................................................... 26 2.8 Klasifikasi Fitoestrogen ........................................................................... 34 2.9 Kacang Kedelai ........................................................................................ 34 2.10 Struktur Molekul Daidzein dan Genistein .............................................. 35 3.1 Kerangka Konsep ......................................................................................54 4.1 Skema Rancangan Penelitian ....................................................................56 4.2 Hubungan Antar Variabel ........................................................................ 60 4.3 Alur Penelitian ..........................................................................................70 5.1 Perbandingan Estrogen antar Kelompok Kontrol dan Kelompok Perlakuan ...................................................................................................................74 5.2 Perbandingan Testosteron antar Kelompok Kontrol dan Kelompok Perlakuan ..................................................................................................76 xvii DAFTAR ARTI LAMBANG, SINGKATAN, DAN ISTILAH AAM : Anti-Aging Medicine ASI : Air Susu Ibu ASS : Alergi Susu Sapi UK : United Kingdom Ig : Imunoglobulin DNA : Deoxyribonucleic Acid GH : Growth Hormone IGF-1 : Insulin-like Growth Factor 1 LH : Luteinizing Hormone FSH : Folicel Stimulating Hormone GnRH : Gonadotropin-Releasing Hormone RNA : Ribonucleic Acid ABP : Androgen Binding Protein SHBG : Sex Hormone-Binding Globulin DHT : Dihidrotestosteron RE : Reseptor Estrogen AA : Asam Arakhidonat DHA : Asam Dokosaheksaenoat USA : United State of America ELISA : Enzym-Linked Immunosobent Assay xviii DAFTAR LAMPIRAN Halaman Lampiran 1 Ethical Clearance .........................................................................87 Lampiran 2 Hasil Analisis Susu Formula Kacang Kedelai ............................. 88 Lampiran 3 Tabel Daftar Volume Maksimal Larutan Sediaan Uji yang Dapat Diberikan pada Berbagai Hewan ..................................................89 Lampiran 4 Foto-Foto Penelitian .....................................................................89 Lampiran 5 Uji Normalitas Data Estrogen dan Testosteron pada Masingmasing Kelompok..........................................................................92 Lampiran 6 Uji t-independent Data Estrogen dan Testosteron antara Kelompok Kontrol dengan Kelompok Perlakuan ...........................................92 xix BAB I PENDAHULUAN 1.1 Latar Belakang Setiap manusia akan melalui proses kehidupan yang dimulai dari terjadinya pembuahan, lahir, bayi, balita, remaja, dewasa, menjadi tua dan akhirnya meninggal. Setiap manusia sebenarnya ingin hidup dengan umur panjang dan sehat. Bertambahnya umur setiap tahun dan menjadi tua, merupakan sesuatu proses yang tidak dapat dihindari. Penuaan merupakan suatu kejadian yang pasti terjadi secara alamiah pada setiap manusia, dan disertai penurunan berbagai fungsi tubuh. Dalam upaya memperlambat proses tersebut, sebaiknya dilakukan sedini mungkin, bahkan bisa dari usia dalam kandungan. Untuk menghindari hal tersebut, maka banyak para ilmuwan terus belajar mencari bebagai cara untuk memperlambat dan menghambat proses tersebut sehingga mencapai umur panjang dalam keadaan sehat. Proses penuaan ini dipengaruhi oleh berbagai faktor, yaitu faktor eksternal (berasal dari luar) dan faktor internal (berasal dari dalam tubuh) (Pangkahila, 2011). Faktor eksternal yang utama adalah gaya hidup yang tidak sehat, diet yang tidak sehat, kebiasaan yang salah, polusi lingkungan, stress, dan kemiskinan. Beberapa faktor internal adalah terbentuknya radikal bebas, hormon yang berkurang, proses glikosilasi, metilasi, apoptosis, sistem yang menurun dan genetik (Pangkahila, 2011). xx 1 kekebalan tubuh Faktor – faktor yang disebutkan diatas, apabila dapat dicegah, diperlambat dan bahkan jika dapat dihindari, maka proses penuaan dapat diperlambat dan kualitas hidup seseorang dapat ditingkatkan. Hal ini yang menjadi dasar konsep dari Anti-Aging Medicine (AAM) (Pangkahila, 2011). Kebanyakan orang bersikap menerima keadaan menjadi tua seakan-akan merupakan takdirnya dan tidak dapat dihindari. Seringkali yang terjadi adalah apabila sudah muncul keluhan atau gangguan semakin berat barulah mencari pengobatan, padahal alangkah baiknya bila dilakukan tindakan pencegahan sebelum semua keluhan tersebut muncul sehingga kualitas hidup seseorang dapat ditingkatkan. Apabila berbagai faktor penyebab proses penuaan dapat dicegah maka dapat memperlambat proses penuaan tersebut (Pangkahila, 2011). Salah satu faktor internal penyebab proses penuaan adalah sistem kekebalan tubuh yang menurun dan adanya faktor genetik. Sistem kekebalan tubuh seorang anak lebih rentan pada usia tahun pertama, sehingga bila mempunyai keturunan bakat atopik, maka akan sangat mudah tersensitisasi dan berkembang menjadi penyakit alergi terhadap alergen tertentu, misalnya pada makanan (Munasir dan Siregar, 2010; Pangkahila, 2011). Pada awal kelahiran untuk membentuk sistem kekebalan tubuh anak dianjurkan dengan pemberian air susu ibu (ASI) yang mengandung berbagai imunoglobulin (Ig) untuk memberikan proteksi bagi bayi yang baru dilahirkan. ASI merupakan makanan pertama ideal yang seyoganya diberikan pada bayi-bayi yang baru lahir terutama dalam 6 bulan pertama. Tetapi ada saat dimana ASI xxi tersebut tidak dapat diberikan atau tidak dapat mencukupi kebutuhan bayi, maka dapat digantikan atau ditambah dengan susu formula (Munasir dan Siregar, 2010). Protein asing utama yang dikenalkan pertama kali kepada bayi adalah protein susu sapi, sehingga sering merupakan penyebab penyakit alergi susu sapi (ASS). Diperkirakan prevalensi ASS sekitar 2-3% di antara keseluruhan bayi. Di antara bayi usia 1 tahun dengan dermatitis atopik, 30-45% disebabkan oleh penyakit ASS (Munasir dan Siregar, 2010). Salah satu diagnosis alergi susu sapi dapat ditegakkan dengan amamnesis riwayat keluarga atopi dan dengan pemeriksaan IgE spesifik susu sapi. Tatalaksana penyakit ASS mencakup menghindari minum dan makan makanan yang mengandung susu sapi, karena itu dianjurkan dapat dengan pemberian susu sapi hipoalergenik dengan terhidrolisis atau susu formuls asam amino sintetis, bahkan dapat juga dengan pemberian susu formula kacang kedelai sampai terjadi toleransi terhadap susu sapi. Sekitar 85%, dikatakan ASS akan menjadi toleran sebelum usia 3 tahun (Merrit dan Jenks, 2004; Munasir dan Siregar, 2010; Koletzko et al., 2012). Idealnya dikatakan dapat diberikan susu sapi hipoalergenik dengan terhidrolisis atau pemberian susu formula asam amino sintetis pada bayi yang menderita ASS, tetapi dengan harga yang sulit dijangkau, maka sebagai alternatif dapat digunakan susu formula kacang kedelai sehingga dapat menjangkau seluruh lapisan masyarakat (Merrit dan Jenks, 2004). Menurut John Ruhrah, pemberian susu formula kacang kedelai untuk bayi sudah dilakukan sejak tahun 1909, sudah sejak 100 tahun yang lalu. Kemudian pada tahun 1929 baru direkomendasikan pemberian susu formula kacang kedelai xxii bagi bayi penderita eksema. Awalnya susu formula kacang kedelai berasal dari tepung kacang kedelai yang juga mengandung karbohidrat dari kacang, serat, phytates dan protease inhibitors yang pada akhir-akhir ini kandungan tersebut dihilangkan. Pada tahun 1960an berkembanglah isolat kacang kedelai untuk menggantikan. Kandungan isolat dari kacang kedelai mengandung paling sedikit 90% protein dengan berat dasar kering dan kemampuan untuk didigesti 97% dan tinggi konsentrasi asam amino. Pada tahun 1970an banyak diberikan nutrisi tambahan seperti iodine, methionine, carnitine, taurine, choline dan inositol (Merrit dan Jenks, 2004; Dinsdale dan Ward, 2010). Susu formula kacang kedelai dapat digunakan pada keadaan alergi susu, diare akibat intoleransi laktosa, galaktosemia, pengganti susu sapi pada vegetarian, terapi gangguan saluran pencernaan seperti kembung, muntah, dan sebagainya (Bhatia dan Greer, 2008). Menurut Australian College of Pediatrics, terdapat perbedaan nutrisi bila dibandingkan dengan susu sapi, dimana lebih rendah kadar protein, vitamin, ion dan mineral serta membutuhkan kalori lebih banyak pada bayi yang menggunakan susu formula kacang kedelai, tetapi penelitian yang dilakukan oleh Fomon dan Zeigler di University of Iowa, menyatakan kebalikannya, tidak terdapat perbedaan, baik yang diberikan susu sapi maupun yang diberikan susu formula kacang kedelai (Merrit dan Jenks, 2004). Kacang kedelai (glycine max) termasuk dalam keluarga Leguminosae (kacang-kacangan). Kandungan kacang kedelai terdiri dari flavonoid, isoflavonoid, asam phenolic, phytoalexin, phytosterol, protein dan saponin, selain itu juga mengandung folat, vitamin B2 dan K, magnesium, besi, omega 3, xxiii kalsium, mangan, serat dan sebagainya. Kacang kedelai terutama mengandung isoflavon, yang merupakan salah satu senyawa fitokimia. Isoflavon primer dari kacang kedelai adalah genistein (paling banyak dijumpai), genistin, daidzein, sedangkan glycitein, glycoside dan glycitin ada dalam jumlah yang lebih kecil. Isoflavon mempunyai struktur kimia menyerupai estrogen. Isoflavon dapat bergabung dengan reseptor estrogen dan mempunyai efek seperti estrogen (agonis) atau dapat pula bersifat berlawanan (antagonis). Isoflavon mengacu pada fitoestrogen karena ditemukan dari tumbuhan (fito) dan kemampuannya untuk bereaksi seperti hormon estrogen pada tubuh manusia (Messina, 2001). Perubahan hormonal seperti peningkatan kadar estrogen atau penekanan kadar testosteron terutama pada saat masa fetus akan menyebabkan terjadinya berbagai kelainan reproduksi, seperti penurunan jumlah sperma, kanker sel germinal testis, kriptorkismus, hypospadia (Hughes, 2007). Penelitian yang dilakukan di Iowa, dimana para peserta diberikan susu formula kacang kedelai dan susu sapi formula kemudian pada usia mencapai 20 – 34 tahun diperiksa maturasi pubertas, menstruasi dan riwayat reproduksi, tinggi dan berat badannya kemudian dibandingkan antar dua kelompok ini. Hasil penelitian ini sebagai berikut: pada kelompok yang diberikan susu formula kacang kedelai didapatkan durasi menstruasi yang lebih panjang dan mempunyai rasa tidak nyaman atau nyeri selama menstruasi (Strom et al., 2001). Penelitian yang dilakukan oleh Bernbaum et al.(2008) pada bayi perempuan usia 6 bulan, diberikan susu formula kacang kedelai dilaporkan terjadi xxiv peningkatan maturasi sel vagina sebagai efek dari estrogenik (Dinsdale dan Ward, 2010). Penelitian yang dilakukan oleh Adgent (2010) di UK menyatakan pada anak perempuan yang lebih dini mendapatkan susu formula kacang kedelai mendapatkan menarche lebih dini dan penelitian lain yang melakukan pemberian dosis tinggi isoflavon pada anak perempuan, didapatkan hasil perkembangan payudara yang terlambat (Kim dan Park, 2012). Tetapi karena penelitian yang menggunakan manusia, memerlukan waktu pengamatan yang lama, dana yang besar, dipengaruhi oleh lingkungan, dan mempunyai keterbatasan dalam pengukuran yang bersifat noninvasif, seperti kadar serum hormon, ukuran dan morfologi organ reproduktif, maka banyak peneliti yang menggunakan binatang untuk mengetahui lebih jauh efek isoflavon terhadap manusia (Dinsdale dan Ward, 2010). Penelitian yang menggunakan tikus betina yang diberikan genistin secara oral, genistein secara oral dan subkutan, didapatkan hasil ketiga-tiganya terdapat kenaikan berat basah uterin dan gen menjadi lebih responsif terhadap estrogen dan laktoferrin. Khusus untuk pemberian genistin secara oral juga didapatkan peningkatan folikel multioosit pada ovarium, perlambatan pembukaan vaginal, penurunan kesuburan, keterlambatan nifas (Dinsdale dan Ward, 2010). Pada penelitian dengan melakukan aromatase knockout pada tikus jantan, sehingga tikus tersebut tidak dapat mensintesis estrogen endogen, kemudian diberikan isoflavon, ditemukan tidak terjadi kelainan spermatogenesis pada xxv kelompok yang diberikan isoflavon dibandingkan dengan yang tidak diberikan asupan isoflavon (Robertson et al., 2002). Kemudian penelitian lain yang juga menggunakan tikus jantan dewasa yang diberikan isolat isoflavon, didapatkan adanya penurunan kadar hormon testosteron, penurunan berat testis, penurunan diameter tubulus seminiferus dan penurunan spermatogenesis. Penelitian lain yang menggunakan bayi tikus jantan dengan memberikan genistein baik secara oral maupun subkutan, didapatkan hasil yang tidak konsisten terhadap serum FSH, LH dan testosteron (Dinsdale dan Ward, 2010). Akhir-akhir ini, fitoestrogen banyak menarik perhatian masyarakat dan banyak penelitian yang mempelajari keuntungan dari fitoestrogen yang baik untuk kesehatan, namun karena mempunyai efek seperti estrogen, maka perlu juga untuk dipelajari lebih lanjut terutama apabila diberikan sejak sedini mungkin. Penting untuk mengetahui kapan waktu terpapar memberikan efek pada kesehatan dan berapa lama pemaparan dapat mempengaruhi perkembangan organ-organ tubuh, terutama dalam perkembangan organ reproduksi (Dinsdale dan Ward, 2010). Berdasarkan hal tersebut di atas, maka dilakukan penelitian dengan menggunakan susu formula kacang kedelai yang banyak dipakai di Indonesia diberikan pada bayi tikus putih jantan untuk mengetahui efek dari susu formula tersebut pada kadar hormon estrogen dan testosteron. xxvi 1.2 Rumusan Masalah Dari uraian latar belakang di atas, dapat dibuat rumusan masalah penelitian sebagai berikut: 1. Apakah pemberian susu formula kacang kedelai meningkatkan kadar hormon estrogen pada bayi tikus putih galur Wistar (Rattus norvegicus) jantan? 2. Apakah pemberian susu formula kacang kedelai menurunkan kadar hormon testosteron pada bayi tikus putih galur Wistar (Rattus norvegicus) jantan? 1.3 Tujuan Penelitian 1.3.1 Tujuan Umum Untuk mengetahui efek pemberian susu formula kacang kedelai terhadap kadar hormonal pada bayi tikus putih galur Wistar jantan. 1.3.2 Tujuan Khusus 1. Untuk membuktikan pemberian susu formula kacang kedelai meningkatkan kadar hormon estrogen pada bayi tikus putih galur Wistar jantan. 2. Untuk membuktikan pemberian susu formula kacang kedelai menurunkan kadar hormon testosteron pada bayi tikus putih galur Wistar jantan. 1.4 Manfaat Penelitian 1.4.1 Manfaat Ilmiah 1. Untuk memperoleh informasi ilmiah mengenai pemberian susu formula kacang kedelai meningkatkan kadar hormon estrogen pada bayi tikus putih galur Wistar jantan. xxvii 2. Untuk memperoleh informasi ilmiah mengenai pemberian susu formula kacang kedelai menurunkan kadar hormon testosteron pada bayi tikus putih galur Wistar jantan. 3. Sebagai dasar untuk penelitian lebih lanjut pada manusia. 1.4.2 Manfaat Praktis Diharapkan dapat menjadi dasar pengkajian ulang bagi masyarakat luas, apabila diketahui pemberian susu formula kacang kedelai meningkatkan kadar hormon estrogen dan menurunkan kadar hormon testosteron. xxviii BAB II TINJAUAN PUSTAKA 2.1 ANTI-AGING MEDICINE (AAM) Anti-Aging Medicine (AAM) adalah bagian ilmu kedokteran yang menggunakan ilmu pengetahuan dan teknologi kedokteran terkini untuk melakukan deteksi dini, pencegahan, pengobatan, dan perbaikan ke keadaan semula berbagai disfungsi, kelainan, dan penyakit yang berkaitan dengan penuaan, dengan tujuan untuk memperpanjang hidup dalam keadaan sehat (Pangkahila, 2011). 2.1.1 Konsep Dasar AAM Ilmu Kedokteran Anti-Aging Medicine (AAM) telah membawa konsep baru yang menyebabkan perubahan paradigma dalam dunia kedokteran. Pertama, penuaan dianggap sebagai suatu penyakit, sehingga dapat dicegah, diobati, bahkan dikembalikan ke keadaan seperti waktu muda. Kedua, manusia bukanlah orang hukuman yang terperangkap dalam takdir genetiknya. Ketiga, manusia mengalami keluhan atau ada gejala penuaan karena level hormonnya menurun, bukan sebaliknya, level hormon menurun karena manusia menjadi tua. Bila berbagai faktor penyebab dapat dihindari, maka proses penuaan dapat dicegah, diperlambat, bahkan dapat dihambat, sehingga kualitas hidup dapat dipertahankan sehingga usia harapan hidup. Dalam upaya memperlambat proses penuaan tersebut, maka sebaiknya dilakukan tindakan pencegahan sedini mungkin, xxix 10 sehingga fungsi berbagai organ tubuh dapat dipertahankan tetap optimal, dengan demikian kualitas hidup seseorang menjadi lebih baik (Pangkahila, 2011). 2.1.2 Teori Proses Penuaan Banyak teori yang berusaha menjelaskan proses penuaan dan dalam perkembangannya timbul berbagai macam teori-teori yang berusaha menjelaskan hal tersebut (Stuckelberger, 2008). Pada dasarnya, teori proses penuaan dibagi menjadi dua kelompok, yaitu teori pakai dan rusak (wear and tear theory) dan teori program (Pangkahila, 2011). 2.1.2.1 Teori pakai dan rusak Prinsipnya teori pakai dan rusak menyatakan tubuh menjadi lemah kemudian meninggal sebagai akibat dari terlalu sering digunakan dan disalahgunakan. Penyalahgunaan organ tubuh dapat membuat kerusakan organ lebih cepat dari waktu sebenarnya. Kerusakan terjadi dalam sel sampai organ. Pada usia muda, kerusakan yang terjadi dapat diatasi atau dikompensasi karena sistem perbaikan dan pemeliharan yang masih baik tetapi seiring dengan bertambahnya umur, tubuh mulai kehilangan kemampuan tersebut Teori ini meyakini dengan pemberian suplemen dan pengobatan yang tepat dapat membantu mengembalikan proses penuaan dengan cara merangsang kemampuan tubuh untuk memperbaiki dan mempertahankan organ tubuh. Teori pakai dan rusak terdiri dari kerusakan DNA, glikosilasi, dan radikal bebas. 2.1.2.2 Teori Program Teori ini meyakini dalam tubuh manusia terdapat jam biologik, yang dimulai dari proses konsepsi sampai kematian sebagai suatu hal yang sudah terprogram. xxx Program ini dimulai dari sel sampai embrio, janin, masa bayi, kanak-kanak, remaja, dewasa dan menjadi tua sampai akhirnya meninggal. Teori ini terdiri dari teori terbatasnya replikasi sel, proses imun, dan teori hormon. 2.1.3 Faktor yang mempercepat penuaan Faktor-faktor yang dapat mempercepat proses penuaan (Wibowo, 2003) yaitu: 1) Faktor lingkungan a. Pencemaran lingkungan, misalnya: bahan-bahan polutan dan kimia sebagai hasil pembakaran pabrik, otomotif, dan rumah tangga akan mempercepat penuaan. b. Pencemaran lingkungan dengan suara bising. Ternyata suara bising mampu meningkatkan kadar hormon prolaktin dan mampu menyebabkan apoptosis di berbagai jaringan tubuh. c. Kondisi lingkungan hidup kumuh serta kurangnya penyediaan air bersih akan meningkatkan pemakaian energi tubuh untuk meningkatkan kekebalan. d. Pemakaian obat-obat/jamu yang tidak terkontrol sehingga menyebabkan turunnya kadar hormon tubuh baik secara langsung maupun tidak langsung melalui mekanisme umpan balik hormonal. e. Sinar matahari secara langsung yang dapat mempercepat penuaan kulit dengan cara menghilangnya elastisitas dan rusaknya kolagen kulit. xxxi 2) Faktor diet/makanan Jumlah nutrisi yang cukup, jenis, dan kualitas makanan yang tidak menggunakan pengawet, pewarna, perasa dari bahan kimia terlarang. Zat beracun di dalam makanan tersebut dapat menimbulkan kerusakan berbagai organ tubuh, antara lain organ hati. 3) Faktor genetik Genetik seseorang sangat ditentukan oleh genetik orang tuanya. Tetapi faktor genetik ternyata dapat berubah karena infeksi virus, radiasi, dan zat racun dalam makanan/minuman/kulit yang diserap oleh tubuh. 4) Faktor psikik Faktor stres mampu memacu proses apoptosis di berbagai organ/jaringan tubuh. 5) Faktor organik Secara umum, faktor organik adalah : rendahnya kebugaran/fitness, pola makan kurang sehat, penurunan GH dan IGF-I, penurunan testosteron, penurunan melatonin secara konstan setelah usia 30 tahun dan menyebabkan gangguan circandian clock (ritme harian) selanjutnya kulit dan rambut akan berkurang pigmentasinya dan terjadi pula gangguan tidur, peningkatan prolaktin yang sejalan dengan perubahan emosi dan stress, perubahan Follicle Stimulating Hormone (FSH) dan Luteinizing Hormone (LH). xxxii 2.2 FISOLOGI SISTEM REPRODUKSI PADA LAKI-LAKI 2.2.1 Hormon Seks Steroid pada Laki-laki Hormon-hormon steroid seks yang terpenting dalam reproduksi pada laki-laki adalah : testosteron, dihidrotestosteron (DHT) dan estradiol. Hormon seks pada laki-laki adalah androgen. Hormon testosteron merupakan hormon androgen utama. Testosteron merupakan sebuah hormon steroid dari kelompok androgen yang dapat ditemukan pada mamalia, reptil, burung, dan vertebrata yang lain (Braunstein, 2011). Testosteron pada umumnya dikaitkan dengan aspek seksual dan reproduksi dalam hidup manusia. Meskipun ini benar, tetapi tidak berarti testosteron hanya berfungsi pada sistem seksual dan reproduksi, selain itu juga pada otak, tulang, otot, lemak, sistem hematopoesis, dan sistem imun (Sherwood, 2011). Hormon testosteron 95% dihasilkan oleh sel Leydig dalam testis dan 5% dihasilkan oleh kortex adrenal pada laki-laki. Hormon seks wanita dalam jumlah kecil ditemukan juga pada laki-laki dan sebaliknya hormon seks laki-laki dijumpai dalam jumlah kecil pada wanita (Baziad, 2002; Braunstein, 2011). Testis juga mengsekresi sebagian kecil dari DHT yang merupakan androgen poten dan dehidroepiandrosteron (DHEA) yang merupakan androgen lemah. Selain itu, sel Leydig juga mengsekresi sebagian kecil dari estradiol, estrone, pregnenolon, progesteron, 17α-hidroksipregnenolon, dan 17α-hidroksiprogesteron (Braunstein, 2011). xxxiii Gambar 2.1 Jalur Biosintesis Androgen dan Estrogen (Straus III, 2009) Keterangan gambar : 3βHSD = 3β-hidroksisteroid dehidrogenase;17βHSD =17β- hidroksi streoid oksidorektase Dihidrotestosteron (DHT) dan estradiol bukan hanya dihasilkan dari testis, tetapi juga dapat dihasilkan dari konversi di jaringan perifer dari androgen dan prekursor estrogen yang disekresi baik oleh testis maupun adrenal (Braunstein, 2011). Testosteron yang dihasilkan oleh testis akan disekresikan ke dalam darah, dimana 98% berikatan dengan protein plasma, yaitu: dengan sex hormone-binding protein (SHBG) (40%) atau dengan albumin (48%), dan 2% sisanya tidak berikatan dalam plasma dan bebas untuk masuk dalam sel dan mempunyai efek metabolik. SHBG disintesis di dalam hepar. Kadarnya dapat meningkat oleh pengaruh estrogen, tamoxifen, fenitoin, hormon tiroid, keadaan hipertiroidism dan sirosis, sedangkan kadarnya menurun apabila terdapat pengaruh androgen xxxiv eksogen, glukokortikoid, growth hormone (GH), keadaan hipotiroidism, akromegali, obesitas dan hiperinsulinemia (Braunstein, 2011; Pangkahila, 2011). Testis hanya mengsekresikan 25% estradiol. Estradiol terutama dihasilkan dari konversi perifer dari testosteron dan androstenedione. Estrogen membantu mengatur sekresi Gonadotropin-Releasing Hormone (GnRH) dan LH. Konversi perifer dari testosteron oleh 5-alfa-reduktase menghasilkan DHT, suatu hormon androgen yang juga poten, bekerja pada jaringan spesifik. Kebanyakan testosteron yang tidak terikat pada jaringan, akan diubah terutama oleh hepar menjadi bermacam-macam metabolit, seperti androsteron dan etiocholanolon, yang setelah berkonjungasi dengan glukoronid dan sulfat dikeluarkan melalui urin dalam bentuk 17-ketosteroid. Namun, hanya 20-30% dari 17-ketosteroid urin berasal dari metabolisme testosteron, sisanya berasal dari metabolisme steroid adrenal, sehingga hal ini tidak dapat dipakai untuk mengukur sekresi steroid dari testis (McCance dan Huether, 2006; Braunstein, 2011; Pangkahila, 2011). Pada sel target androgen, testosteron secara enzimatik dikonversi menjadi DHT oleh isoenzim mikrosomal 5α-reduktase-2 pada pH ± 5,5, sedangkan isoenzim lain 5α-reduktase-1 bekerja pada kulit dengan sekitar pH 8,0, tetapi tidak aktif pada traktus urogenital. Setelah itu, DHT dan testosteron akan berikatan dengan reseptor protein spesifik di intraseluler. Gen yang mengkode protein ini berada pada kromosom X. Ketika testosteron atau DHT berikatan dengan reseptor, terjadi perubahan sehingga dapat terjadi translokasi ke dalam nukleus berikatan dengan importins (Rn). Di dalam nukleus, kompleks reseptor androgen berikatan dengan elemen respon androgen di DNA sehingga mengaktivasi proses xxxv transkripsi. Hasil ini kemudian disintesis oleh messenger RNA (mRNA), kemudian di transport ke sitoplasma, dimana terjadi sintesis protein baru dan terjadi respon androgen (Braunstein, 2011). Gambar 2.2 Mekanisme kerja androgen (Braunstein, 2011) Keterangan Gambar : DHT = Dehidrotestosteron; m RNA = messenger RNA; Rc, reseptor inaktif; Rn, resptor nukleus aktif; T = Testosteron Estrogen pada laki-laki dihasilkan dari aromatisasi testosteron dan oleh sel Leydig, dan sel germinal. Apabila dibandingkan dengan sel Leydig, maka sel germinal lebih banyak memproduksi estrogen. Konsentrasi tinggi estrogen berada dalam cairan testis dan seminal, sebagai hasil dari konversi tetosteron menjadi estradiol melalui mekanisme aromatisasi sitokrom P450 yang terdapat pada testis, selain itu juga terdapat dalam jumlah tinggi di sistem limfatik dan darah tepi sebagai hasil dari sel Leydig dan sel germinal. Pada laki-laki, jumlah kadar estrogen berada dalam konsentrasi kecil dalam darah tepi sekitar 2 – 180 pg/ml. Konsentrasi estrogen tinggi pada vena testicular dan pembuluh limfenya, serta tinggi pada sistem reproduksi, tinggi pada semen dan cairan testis. Ada 3 jenis xxxvi estrogen utama di dalam tubuh, yaitu: estron (E4), estradiol (E2), yang merupakan estrogen paling kuat dan estriol (E3) (Hess, 2003; Pangkahila, 2011). Pada laki-laki, estrogen bekerja berkoordinasi dengan hormon-hormon androgen, tetapi dapat juga berfungsi secara independen menghasilkan efek antiandrogenik. Efek fisiologik testosteron merupakan gabungan efek testesteron dengan estrogen, namun efek androgeniknya lebih dominan karena rasio androgen dengan estrogen sangat tinggi (250:1). Penurunan rasio androgen : estrogen plasma akan mengakibatkan timbulnya gejala feminisasi (genikomastia) (Kumar, 2013). 2.2.2 Struktur Testosteron Seperti hormon steroid lain, testosteron juga berasal dari derivat kolesterol dengan nama sistematik (memakai sistem IUPAC) : (8R,9S,10R,13S,14S,17S)17-hydroxy-10,13-dimethyl-1,2,6,7,8,9,11,12,14,15,16,17 dodecahydrocyclopenta[a]phe nanthren-3-one (Braunstein, 2011). Gambar 2.3 Struktur Testosteron (Braunstein, 2011) 2.2.3 Struktur Estrogen Estrogen adalah hormon steroid dengan 18 atom C dan dibentuk terutama dari 17-ketosteroid androstenedion. Estrogen dibagi menjadi dua jenis, yaitu estrogen xxxvii alamiah dan sintetik. Jenis estrogen alamiah yang terpenting adalah estradiol (E2), estriol (E3) dan estron (E4). Untuk penghantaran dalam darah estrogen diikat oleh protein yang khas, yaitu SHBG. Estrogen baru dapat bekerja secara aktif setelah terlebih dahulu diubah menjadi estradiol (Baziad, 2002). Gambar 2.4 Struktur Estrogen ( Baziad, 2002) 2.2.4 Kontrol Fungsi Testosteron Regulasi dari produksi androgen dan spermatogenesis diatur oleh sistem kompleks mekanisme umpan balik, dimana terlibat sistem saraf pusat ekstrahipothalamus, hipothalamus, hipofise anterior, testis, dan androgensenstive ends organs. Terlibatnya sistem saraf pusat ekstrahipothalamus dapat berupa stres fisiologik dan psikologis. Dalam hipothalamus, neurotransmiter akan meregulasi sintesis dan pelepasan pulsasi GnRH, yang dilakukan setiap 3 jam masuk dalam vena portal hipofise. Setelah mencapai hipofise anterior, maka GnRH akan merangsang sekresi LH dan FSH. LH mempengaruhi sel Leydig yang berikatan dengan reseptor spesifik membran dan menyebabkan sekresi testosteron. Sebagai inhibisi, peningkatan kadar androgen akan menghambat sekresi LH dari hipofise anterior melalui efek langsung pada hipofise dan hipothalamus. Hipothalamus dan hipofise mempunyai reseptor androgen dan estrogen. Efek inhibisi terutama yang diperantarai oleh estradiol yang dihasilkan dari aromatisasi testosteron. FSH berikatan dengan reseptor spesifik pada sel-sel Sertoli di tubulus seminiferus dan xxxviii merangsang pembentukan Androgen Binding Protein (ABP). FSH mempengaruhi tubulus seminiferus sel Sertoli untuk merangsang terjadinya spermatogenesis. Sekresi FSH dihambat oleh inhibin yang dihasilkan oleh sel Sertoli. Begitu juga yang terjadi pada LH, sekresi LH akan dihambat oleh inhibin yang dihasilkan oleh sel Leydig (McCance dan Huether, 2006; Pangkahila, 2011). Gambar 2.5 Aksis Hipothalamus – Hipofise Anterior – Testis (Mc.Cance dan Huether, 2006) Keterangan gambar: E2 = Estrogen; T = Testosteron Fungsi testis dikontrol oleh 2 hormon gonadotropik yang disekresikan oleh hipofisis anterior yaitu: LH dan FSH. Kedua hormon ini bekerja pada bagian testis yang berbeda. LH bekerja pada sel Leydig (intersisial) untuk mensekresi xxxix testosteron, sedangkan FSH bekerja pada tubulus seminiferus sel Sertoli yang berpengaruh terhadap spermatogenesis (Sherwood, 2011). 2.2.5 Pengukuran Hormon Steroid pada Laki-laki Semua pengukuran steroid gonadal harus dilakukan dengan pemeriksaan khusus. Pada individu normal, terjadi peningkatan serum testosteron pada pagi hari, karena itu sebaiknya pengambilan sampel darah sebaiknya dilakukan tiga kali dengan interval 20 – 40 menit pada pagi hari. Pada laki-laki, produksi hormon seks tergantung dari variasi diurnal (Hess, 2003; Braunstein, 2011; Pangkahila, 2011; Sherwood, 2013). Gambar 2.6 Kadar Testosteron (T) pada Laki-laki Muda dalam 24 jam (Mc.Cance dan Huether, 2006) Kadar Testosteron puncak terlihat pada pagi hari, sekitar 20-30% lebih tinggi kadarnya dari pada malam hari (Kumar, 2013). Pengukuran immunoassays testosteron dan estrogen mengukur konsentrasi kadar total serum. Metode yang dipercaya adalah dengan immunoassays spesifik xl dikuti ekstraksi dari serum atau gas chromatography (GC) atau dengan liquid chromatography (LC) digabung dengan spektroskopi (Braunstein, 2011). Tabel 2.1 Kadar Hormon Normal pada Laki-laki Dewasa (Braunstein, 2011) Hormon Testosteron, total Testosterone, free Dihidrostenedione Androstenedione Estradiol Estrone Batas Normal 260 – 1000 ng/dL ( 9,0 – 34,7 nmol/L) 50 – 210 pg/mL ( 173 – 729 pmol/L) 27 – 75 ng/dL ( 0,9 – 2,6 nmol/L) 50 – 250 ng/dL (1,7 – 8,5 nmol/L) 10 – 50 pg/mL (3,67 – 18,35 pmol/L) 15 – 65 pg/mL ( 55,5 – 240 pmol/L) Nilai normal kadar hormon tetosteron total pada laki-laki berviariasi antara 241 – 827 ng/dl, yang diukur pada pagi hari. Apabila terjadi penurunan dibawah 500 ng/dl sudah menimbulkan gejala defisiensi. Pada anak-anak, baik anak lakilaki maupun anak permpuan kadar testosteron berkisar antara 5 ng/dl, yang akan meningkat sesuai dengan umurnya. Anak perempuan bila mencapai usia 10 – 15, kadar testosteronya dapat mencapai kira-kira 15 – 35 ng/dl. Pada saat anak perempuan berusia mencapai 17 tahun meningkat sedikit menjadi 20 – 38 ng/dl, dan pada awal usia 20 tahun normal kadar testosteron total terendah antara 6 – 24 ng/dl dan batas tertinggi 47 – 86 ng/dl. Kadar estrogen pada anak laki-laki berkisar antara 5 – 20 pg/ml, dan laki-laki pada usia dewasa kadar normalnya berkisar antara 8 – 43 pg/ml. Kadar normal pada anak perempuan antara 6 – 27 pg/ml. Pada wanita dewasa kadar estrogen bervariasi tergantung pada fasenya. Pada fase folikular mencapai 13 – 166 pg/ml, pada fase ovulasi 86 – 498 pg/ml, pada fase luteal 44 – 211 pg/ml. Menjelang kehamilan, pada saat trisemester pertama mencapai 38 – 3175 pg/ml. Pada xli trisemester kedua 678 – 16633 pg/ml dan saat trisemester ketiga mencapai 43 – 33781 pg/ml. Pada saat menopause, kadar estrogen akan menurun <5 – 55 pg/ml (Ryan, 2007). 2.2.6 Efek dan Fungsi Hormon Seks Steroid pada Laki-laki Androgen dihasilkan dalam jumlah yang sedikit pada keadaan sebelum pubertas, kemudian jumlahnya meningkat tinggi pada saat pubertas untuk perkembangan organ seksual. Pada saat pubertas, androgen akan merangsang pertumbuhan skrotum, epididimis, vas deferens, vesika semilunaris, prostat, dan penis (Braunstein, 2011). Sebelum pubertas, perkembangan dari payudara laki-laki sama dengan payudara perempuan, tetapi saat pubertas dimana kadar estrogen dan progesteron yang tidak tinggi menyebabkan payudara laki-laki tidak berkembang lebih jauh. Normal, payudara laki-laki ukurannya kecil, mempunyai nipple yang tidak berkembang, strukturnya terdiri dari lemak, jaringan fibrosa dan mempunyai struktur menyerupai duktus di daerah subareolar. Pada laki-laki gemuk, payudara bisa menjadi lebih besar disebabkan karena terjadi penumpukan jaringan lemak. Pada saat pubertas, bila seorang laki-laki mengalami ginekomastia, hal ini bisa disebabkan karena gangguan fluktuasi hormon, salah satunya peningkatan estrogen (McCance dan Huether, 2006; Rhen dan Cidlowski, 2009). xlii 2.2.6.1 Efek dan Fungsi Testosteron Efek dari testosteron adalah (Sherwood, 2013): 1. Efek sebelum dilahirkan Sebelum lahir, testosteron mempunyai efek maskulinisasi sistem reproduktif, dan genitalia ekternal, serta memfasilitasi penurunan testis masuk dalam skrotum. 2. Efek pada jaringan seks spesifik setelah dilahirkan Masa pubertas adalah masa di mana terjadi maturasi dari sistem reproduktif yang sebelumnya non fungsional untuk mencapai puncaknya dan mempunyai kemampuan untuk bereproduksi. Biasanya dimulai pada usia 10-14 tahun. Pada masa pubertas, sel Leydig sekali lagi mulai mensekresi testosteron. Testosteron inilah yang bertanggung jawab untuk pertumbuhan dan perkembangan seluruh sistem reproduksi laki-laki. Di bawah pengaruh sekresi testosteron, terjadi pembesaran testis dan dimulailah produksi sperma untuk pertama kalinya, terjadi pembesaran glandula seksual aksesoris, dan pembesaran penis serta skrotum. Setelah masa pubertas, sekresi testosteron dan spermatogenesis terjadi secara terus-menerus seumur hidup seorang laki-laki, meskipun produksinya akan berkurang secara bertahap setelah umur 45 atau 50 tahun ke atas. 3. Efek lain yang berkaitan dengan sistem reproduksi Testosteron membantu perkembangan libido dan mempertahankan libido pada laki-laki dewasa, namun pada manusia, libido juga dipengaruhi oleh interaksi sosial dan faktor emosional. Testosteron juga membantu xliii mengkontrol sekresi hormon gonadotropin dari hipofise anterior, sebagai mekanisme umpan balik. 4. Efek pada karakteristik seksual sekunder Testosteron mempengaruhi pertumbuhan rambut pola laki-laki (contoh: rambut janggut, dada, perut dan punggung) dan pertambuhan rambut ambisexual (contoh: pada axilla dan pubis), meningkatkan aktivitas galndula sebasea, perubahan suara yang lebih rendah akibat dari pembesaran laring dan penebalan pita suara, dan bertanggung jawab terhadap pertumbuhan otot (massa dan kekuatan otot) untuk konfigurasi tubuh laki-laki. 5. Efek pada aksi non reproduktif Testosteron mempunyai efek protein anabolik, menstimulasi pertumbuhan tulang pada saat pubertas, mempunyai peranan dalam mempertahankan integritas dan densitas tulang, penutupan dasar kartilago epifise setelah dikonversi membentuk estrogen melalui aromatase, membantu produksi sel darah merah, meningkatkan energi, dan membantu fungsi kognitif. 2.2.6.2 Efek dan Fungsi Estrogen Walaupun estrogen dianggap sebagai hormon perempuan, ternyata hormon ini ada di kedua jenis kelamin. Estrogen pada laki-laki mempunyai peranan dalam proses fertilitas. Pada testis, estradiol mempunyai peranan membantu fungsi testis. Estradiol bila bekerja sendiri, tidak mampu menstimulasi steroidogenesis sel Leydig. Estrogen pada proses perkembangan testis, mempunyai kemampuan untuk membangun fungsi sel Sertoli dan membantu adesi sel Sertoli dan germinal. xliv Selain itu, estradiol bertanggung jawab untuk inisiasi spermatogenesis atau pembentukan dan maturasi sperma pada laki-laki. Estrogen juga mempunyai peranan pada duktus efferent yang membawa sperma dari testis ke epididimis. Duktus efferent mempunyai fungsi utama untuk reabsorpsi lebih dari 90% cairan testis sehingga terjadi pemekatan sperma untuk memasuki lumen epididimis. Estrogen juga mempunyai peranan membantu kekuatan tulang, maturasi seksual dan metabolisme kolesterol (Hess, 2003). Gambar 2.7 Sumber dan Target Estrogen (Hess, 2003) Keterangan Gambar: E2=Estradiol; Sel Leydig = LC; Sel Germinal =GC 2.2.7 Defisiensi Androgen Tanda dan gejala yang timbul apabila terjadi defisiensi androgen sejak usia kanak-kanak adalah (Kumar, 2013): 1. Berkurangnya pertumbuhan rambut aksila, pubis, fasial dan badan. 2. Rendah atau hilangnya libido. 3. Berkurangnya kekuatan otot ketika dibandingkan dengan orang sebayanya. 4. Kegagalan lonjakan pertumbuhan/ growth spurt pada usia pubertas 5. Suara yang nyaring/ tinggi. 6. Testis, skrotum dan penis yang kecil. xlv 2.2.8 Reseptor Estrogen (RE) Beberapa sel atau jaringan tidak sensitif terhadap hormon steroid karena kurangnya reseptor yang sesuai, sebaliknya beberapa sel atau jaringan yang mempunyai reseptor dalam jumlah besar menjadi lebih sensitif terhadap hormon dalam konsentrasi kecil. Sebagai tambahan, respon suatu hormon tergantung dari regulasi reseptor yang meningkat atau menurun. Efek biologik dari estrogen awalnya dipercaya diperantarai oleh reseptor tunggal, yaitu: reseptor estrogen α (RE α) sampai didapatkan adanya reseptor kedua, reseptor estrogen β (RE β). RE α dan RE β diproduksi oleh gen yang berbeda. Kedua RE ini terdapat pada beragam jaringan mamalia, namun terdapat perbedaan distribusinya. Efek dari hormon estrogen diperantarai oleh RE α dan RE β. Kedua reseptor ini mempunyai peranan dalam signal estrogen dan gen yang mengkode RE α dan RE β akan diekspresikan pada jaringan yang berbeda. RE α banyak terdapat pada uterus, dan dalam jumlah sedikit terdeteksi pada ovarium, sel Leydig dari testis, glandula mammae perempuan, tulang, dan hipotalamus. Ekspresi RE β paling tinggi dijumpai pada sel granulosa ovarium, traktus gastrointestinal, kemudian dalam jumlah sedikit sampai sedang pada organ sperma, prostat, epididimis, glandula mammae perempuan, hipotalamus, dan hipofise (Rhen dan Cidlowski, 2009; Kim dan Park, 2012). xlvi Tabel 2.2 Pola Jaringan dari Reseptor Estrogen α (RE α) dan Reseptor Estrogen β (RE β) pada Tikus Jantan (Rhen dan Cidlowski, 2009) RE α +++ + +++ Jaringan Epididimis Prostat Testis Keterangan : + = rendah RE β + +++ + ; ++ = sedang; +++ = tinggi Pada laki-laki, RE terdapat pada jaringan epididimis, epitel duktus efferent, testis, dan prostat. Pada epididimis yang terbanyak adalah RE α. Pada testis lebih banyak dijumpai RE β yang ditemukan hampir pada semua tipe sel dari interstisium dan tubulus seminiferus, sedangkan RE α hanya ditemukan pada interstisium. Selain pada testis, RE β juga ditemukan duktus efferent, prostat dan di epididimis. Namun, fungsi dari RE β dalam sistem reproduktif laki-laki sampai sekarang masih memerlukan penelitian lebih lanjut (Hess, 2003). 2.3 SUSU SAPI FORMULA Susu sapi formula adalah sumber protein hewani berbentuk cair, yang diharapkan dapat dengan mudah dicerna oleh usus. Walaupun ASI dipandang lebih unggul dibandingkan susu sapi formula, tetapi kenyataannya banyak bayi mendapatkan susu sapi formula sejak lahir. Pada kondisi tertentu, susu formula diperlukan untuk mengganti peran ASI pada bayi. Susu formula diberikan bila ibu dalam keadaan sakit dan tidak dapat menyusui bayinya, atau bila ASI yang di produksi sangat sedikit hingga tidak mencukupi kebutuhan bayi. Pola perubahan sosial dan budaya juga ikut berperan mendorong pemberian susu sapi formula. Beberapa orang menganggap penambahan berat dan kehilangan tonus payudara xlvii menjadi tidak menarik lagi sehingga menjadikan susu sapi formula sebagai alternatif pemberian. Apapun alasan yang ada, sekarang pemberian susu sapi formula menjadi bahan pertimbangan ( Barness dan Curran, 2000; Kurniasih et al., 2010; Judarwanto, 2011). Susu sapi murni atau bentuk modifikasinya merupakan dasar pada kebanyakan susu sapi formula, walau ada juga terdapat susu lain yang tersedia bagi bayi yang tidak dapat mentoleransi susu sapi formula tersebut. Sterilisasi dan pendinginan susu formula sangat mengurangi morbiditas dan mortalitas infeksi gastrointestinal. Pengelolahan susu, termasuk pemasakan sederhana di rumah sampai teknik pasteurisasi dapat mengubah kasein menjadi kecil dan bentuk dadih sehingga mudah dicerna dalam lambung sehingga diharapkan dapat menghilangkan penyebab utama protein susu sapi yang tidak mudah dicerna (Barness dan Curran, 2000). Susu sapi formula saat ini umumnya memiliki komposisi mikronutrien (vitamin dan mineral), makronutrien (protein, lemak, karbohidrat) untuk membantu pertumbuhan, prebiotik serta probiotik untuk mempertahankan fungsi saluran cerna, asam linolenat dan asam linoleat sebagai asam lemak essential, phosphatidilkolin yang berperan sebagai bahan penting dalam membran sel. Setiap 100 gr susu sapi formula mengandung 70,5 kkal dengan protein sebanyak 3,4 gr, lemak 3,7 gr dan mikronutrien (Judarwanto, 2011). Kebutuhan kalori bayi cukup bulan rata-rata sekitar 45-55 kkal/lb atau 80-120 kkal/kg selama beberapa bulan pertama. Kebutuhan cairan selama masa bayi tinggi, sekitar 2-3oz/lb/24 jam atau 130-190 ml/kg/24 jam untuk usia 6 bulan xlviii pertama dan dapat meningkat apabila cuaca panas. Interval pemberian makanan bervariasi antar bayi, tetapi umumnya berkisar antara 3-5 jam selama 1 tahun pertama. Jumlah susu yang dihabiskan setiap minum akan bertambah disesuaikan dengan kebutuhan pola aktivitas harian (Barness dan Curran, 2000). Susu sapi formula mengandung komposisi laktosa, minyak nabati, bubuk whey terdemineralisasi, susu skim, maltodekstrin, konsentrat whey protein yang diperkaya alfa laktalbumin, lemak susu, AA, DHA, susu butter, natrium kaseinat, laktulosa, laktoferin, taurin, nukleotida, mineral dan vitamin (Barness dan Curran, 2000). 2.4 PENYAKIT ALERGI SUSU SAPI (ASS) Penyakit ASS adalah penyakit berdasarkan reaksi imunologis, yang timbul setelah pemberian susu sapi atau makanan yang mengandung produk susu sapi, dan reaksi ini dapat terjadi segera atau lambat (Munasir dan Siregar, 2010). Prevalensi ASS diperkirakan sekitar 2-3% pada keseluruhan bayi, dimana pada anak usia 1 tahun dengan dermatitis atopik, 30-45% disebabkan oleh ASS. Prevalensi ini menurun mencapai <1% pada anak-anak yang mencapai usia 6 tahun atau yang lebih tua (Vandenplas et al., 2007, Munasir dan Siregar, 2010; Koletzko et al., 2012). Pada anak-anak, protein susu sapi merupakan alergen tersering yang menyebabkan reaksi hipersensitivitas. Kandungan susu sapi terdapat 20 komponen protein yang dapat merangsang pembentukan antibodi anak. βlaktoglobulin merupakan antigen utama yang ada pada susu sapi, tetapi tidak ada pada ASI. Kurang lebih 3% anak-anak yang diberi susu sapi alergi terhadap xlix antigen ini. Antigen ini dapat melewati barier usus dipengaruhi oleh immunoglobulin (Ig). Pada neonatus terjadi defisiensi sintesis IgA, tetapi IgA ini dapat diperoleh dari ibu melalui pemberian ASI (Verhasselt, 2010). Gejala penyakit ASS timbul 28% pada 3 hari setelah minum susu sapi, 41% setelah 7 hari, dan 68% timbul setelah 1 bulan. Rata-rata pada usia 6 bulan pertama. Biasanya reaksi timbul dari beberapa menit sampai 2 jam setelah alergen tercerna, dan biasanya hal ini disebabkan oleh mediator IgE (reaksi tipe cepat) dan reaksi tipe lambat dapat timbul dalam 48 jam dan mencapai 1 minggu setelah dicerna. Organ tubuh yang paling sering terkena adalah sistem gastrointestinal (50 – 60%), kulit (50 – 60%), dan saluran pencernaan (20 – 30%). Bila yang terkena ≥ 2 sistem organ tubuh, maka kemungkinan besar adalah ASS (Vandenplas et al.2007; Koletzko et al.,2012). Reaksi cepat diperantarai oleh IgE biasanya timbul pada sebagian besar anakanak, dengan gejala utama adalah ruam kulit, eritema peroral, angioedema, urtikaria dan anafilaksis. Reaksi lambat biasanya bukan diperantarai oleh IgE dan biasa mengenai saluran cerna berupa kolik, muntah dan diare (Vandenplas et al., 2007; Munasir dan Siregar, 2010; Koletzko et al, 2012). Diagnosis ASS harus dengan tes Chalenge atau tes eliminasi provokasi. Penatalaksanaan ASS apabila diagnosis sudah ditegakkan adalah mengeliminasi susu sapi dan makanan yang mengandung susu sapi selama 6 – 18 bulan, kemudian mengganti penggunaan susu sapi formula. Bila gejala menghilang, maka dapat dicoba provokasi setelah eliminasi selama 6 bulan. Bila gejala tidak l timbul, artinya sudah toleran. Bila timbul gejala kembali, maka dilanjutkan eliminasi kembali sampai 1 tahun (Munasir dan Siregar, 2010). Penatalaksanaan ASS dilaksanakan apabila diagnosis ASS sudah ditegakkan. Caranya yaitu dengan melakukan diet eliminasi semua produk susu sapi, termasuk produk olahannya. Penggunaan susu sapi formula digantikan dengan penggunaan susu kacang kedelai, susu sapi terhidrolisis atau susu asam amino sintetis. Pada penderita ASS yang diberi susu formula kacang kedelai, dilaporkan juga terjadi alergi terhadap susu tersebut sekitar 10-14%, dimana angka kejadiannya paling sering terjadi pada bayi dibawah 6 bulan. Bila terjadi alergi terhadap susu sapi dan susu formula kacang kedelai, maka dapat diberikan susu sapi terhidrolisis. Umumnya bayi akan toleran sekitar umur 3 tahun, 50% pada usia 2 tahun, 60% pada usia 4 tahun dan 80% pada usia 6 tahun (Munasir dan Siregar, 2010). Meskipun bayi dengan ASS mempunyai kadar IgE meningkat terhadap susu sapi, tetapi sebaiknya diberikan susu sapi terhidrolisis atau asam amino sintetis dibandingkan dengan pemberian susu kacang kedelai, walaupun mempunyai toleransi yang bagus. Seringkali kesalahan terjadi pada setiap anak yang mengalami tanda dan gejala alergi dianjurkan untuk menggunakan susu terhidrolisat sebagian seperti NAN HA®, Nutrilon HA® atau EnfaHA®, padahal susu tersebut hanya dapat digunakan untuk pencegahan bukan untuk penderita susu sapi. Sensitisasi terhadap susu kedelai juga dapat ditemukan sekitar 10–14% pada bayi yang alergi susu sapi, walau jarang dijumpai reaksi anafilaksis berat, terutama pada bayi (Bhatia dan Greer, 2008). li Susu formula kacang kedelai secara signifikan lebih murah dibandingkan dengan susu sapi terhidrolisis atau asam amino sintetis, tetapi penggunaan susu formula kacang kedelai ini tidak dianjurkan sebagai terapi utama pada bayi dibawah 6 bulan. Penggunaan susu formula kacang kedelai sebaiknya juga dipertimbangkan karena kandungannya yang tinggi phytate, aluminium, dan fitoestrogen (isoflavon). Penggunaan susu formula kacang kedelai menimbulkan efek kontroversi, khususnya karena ada kandungan fitoestrogen dan penggunaan transgenik soya dalam susu formula kacang kedelai, selain juga karena masih didapatkan kemungkinan alergi kacang kedelai. Tetapi penggunaan susu formula kacang kedelai dapat dipertimbangkan apabila bayi menolak untuk meminum susu sapi terhidrolisis atau asam amino sintetis, disebabkan karena rasanya yang cenderung pahit (Vandenplas et al., 2007; Koletzko et al., 2012). 2.5 KACANG KEDELAI 2.5.1 Kandungan Isoflavon dalam Kacang Kedelai Kacang kedelai (glycine max) termasuk dalam keluarga Leguminosae (kacang-kacangan). Tanaman yang mempunyai aktivitas estrogenik dinamakan dengan fitoestrogen. Fitoestrogen adalah senyawa yang diturunkan dari tanaman non steroid yang memiliki aktivitas estrogen. Fitoestrogen terdiri dari beberapa grup yang mengandung estrogen non steroid, yang termasuk di dalamnya adalah golongan isoflavon (Walsh, 2003). lii Gambar 2.8 Klasifikasi Fitoestrogen (Kim dan Park, 2012) Isoflavon banyak dijumpai pada jenis kacang-kacangan dan terbanyak didapatkan pada kacang kedelai. Bagian tanaman kedelai yang mengandung senyawa isoflavon lebih tinggi pada biji kedelai, khususnya pada bagian hipokotil (germ) yang akan tumbuh menjadi tanaman. Sebagian lagi terdapat pada kotiledon yang akan menjadi daun pertama dari tanaman (Walsh, 2003; Cao et al.,2009; Drake, 2009). Gambar 2.9 Kacang Kedelai Isoflavon terdiri atas struktur dasar C6-C3-C6, secara alami disintesa oleh tumbuh-tumbuhan dan senyawa asam amino aromatik fenilalanin atau tirosin. Biosintesa tersebut berlangsung bertahap, dan berdasarkan hasil biosintesa tersebut, maka isoflavon digolongkan sebagai senyawa metabolit sekunder. liii Gambar 2.10 Struktur Molekul Daidzein dan Genistein (Kim dan Park, 2012) Kandungan isoflavon dalam kacang kedelai berkisar 2 – 4 mg/g kedelai. Senyawa isoflavon itu, pada umumnya berupa senyawa kompleks atau konjungasi dengan senyawa ikatan glukosida. Dalam kacang kedelai, isoflavon yang dalam bentuk glukosida berikatan dengan molekul gula. Fermentasi atau digesti dari kacang kedelai atau produknya, akan menyebabkan lepasnya molekul gula, menjadi aglikon. Yang termasuk isoflavon glukosida disebut genistin, daidzin dan glycitin, sementara yang termasuk aglikon disebut genistein, daidzein, dan glycitein. Kacang kedelai merupakan sumber isoflavon yang sering dikonsumsi oleh manusia dan konsentrasi tinggi isoflavon dalam kacang kedelai itu adalah genistein dan daidzein (Walsh, 2003; Cao et al., 2009; Drake, 2009). Tabel 2.3 Kandungan Isoflavon Kacang Kedelai (Norris, 2011) Isoflavon Genistin Daidzin Glycitin Fermentasi Genistein Daidzein Glycitein % dari Total ~ 40 % ~ 40% ~ 5 – 10 % Selain ketiga kandungan yang disebutkan diatas, terdapat juga equol, yang diproduksi dari daidzin oleh bakteri yang terdapat dalam traktus digestivus. Equol liv ini dilaporkan mempunyai aktifitas estrogenik yang lebih kuat daripada daidzein dan genistein (Norris, 2011). 2.5.2 Metabolisme dan Bioavailabilitas Efek biologi isoflavon dari kacang kedelai tergantung dari metabolisme, hal ini tergantung dari aktifitas bakteri yang berada dalam usus halus. Begitu dicerna, isoflavon akan berubah bentuk menjadi aktif dengan melepasnya glukosida menjadi aglikon. Selain itu perbedaan individu dalam metabolisme isoflavon juga mempunyai peranan dalam akitivitas biologik isoflavon (Drake, 2009). Setelah dicerna, konsentrasi genistein dan daidzein mencapai puncak setelah 5,5 dan 7,4 jam didalam darah. Waktu paruh mereka sekitar 8 jam, artinya 50% akan hilang setelah 8 jam, 75% setelah 16 jam dan 88% setelah 1 hari. Namun, bila dikonsumsi setiap hari, maka kadarnya akan tetap berada dalam aliran darah (Norris, 2011). 2.5.3 Aktivitas Biologik Kacang kedelai mengandung phytic acid, atau yang lebih dikenal phytate, yang dapat menghambat absorpsi kalsium, zinc, besi dan magnesium. Tetapi keuntungan dari terdapatnya phytic acid ini, dapat menghambat terjadinya peroksidasi lipid, oksidasi besi dalam jaringan colorectal, dan pembentukan batu kalsium di ginjal (Norris, 2011). 2.5.4 Cara Kerja Isoflavon Isoflavon mempunyai kemiripan struktur kimia dengan estrogen pada mamalia. Isoflavon dari kacang kedelai dikenal mempunyai efek estrogenik lemah atau aktivitas seperti hormon. Cincin fenolat pada isoflavon, yang merupakan lv struktur penting pada komponen isoflavon berfungsi untuk berikatan dengan RE, sehingga mempunyai efek sama (agonis) seperti estrogen pada beberapa jaringan dan antagonis pada jaringan lain. Isoflavon sebagai senyawa yang menyerupai estrogen, mengawali kerjanya dengan meniru cara kerja estrogen dan juga bersifat antiandrogenik. Pada saat kadar estrogen menurun, akan terdapat banyak kelebihan RE yang tidak terikat, sehingga walau afinitasnya rendah, isoflavon dapat berikatan dengan reseptor tersebut (Kim dan Park, 2012). Isoflavon berikatan dengan RE di hipofise anterior mensintesis GnRH untuk menstimulus sekresi FSH dan LH. LH merangsang sel Leydig menyebabkan peningkatan sekresi testosteron, yang kemudian akan menghambat sekresi LH. Hipothalamus dan hipofise mempunyai resptor androgen dan estrogen. Namun efek inhibisi terutama diperantarai oleh estradiol yang dihasilkan dari aromatisasi testosteron sehingga menyebabkan sekresi FSH dan sekresi LH menurun. Jika sekresi LH terhambat, maka pertumbuhan dan pematangan sel Leydig terganggu sehingga jumlah kadar testosteron akan berkurang. Penurunan sekresi FSH akan menyebabkan gangguan sprematogenesis, selain itu karena kekurangan testosteron, maka akan terjadi gangguan pematangan spermatozoa. Seperti yang diketahui, testosteron berasal dari derivat kolesterol yang akan membentuk pregnenolon dan asam isocarpoat, dimana pemecahan ini selain dibantu oleh enzim 20β-hidroksilasi dan 22β-hidroksilasi, juga dibantu oleh LH untuk meningkatkan aktivitas enzim tersebut. Dengan demikian, jika LH menurun, maka pemecahan rantai samping menjadi pregnenolon dan asam isocarpoat akan terganggu dan hasil akhirnya testosteron tidak terbentuk. Selain itu, isoflavon lvi menghambat kerja enzim 17-β-hidroksisteroidoksidorektase yang dibutuhkan untuk sintesis testosteron, sehingga walaupun pregnenolon terbentuk tetapi tidak dapat dikonversi menjadi testosteron (Drake, 2009; Braunstein, 2011). Struktur dan fungsi dari genistein dan daidzein menyerupai 17β-estradiol. Umumnya 17β-estradiol berikatan dengan RE kemudian menyebabkan terjadinya ekspresi gen dan sintesis protein spesifik, tetapi genistein dan daidzein juga dapat berikatan dengan RE sehingga dapat mengganggu proses tersebut. Di dalam serum isoflavon mempunyai kemampuan lebih besar berikatan dengan RE bila bersaingan dengan estradiol, karena estradiol dapat dengan mudah berikatan dengan protein serum, seperti α-fetoprotein, sedangkan isoflavon tidak dapat (Adgent, 2010). Aktivitas isoflavon tergantung dari konsentrasi estradiol endogen. Di lingkungan dengan tinggi kadar estradiol menyebabkan isoflavon bereaksi sebagai estrogen antagonis (inhibitor aktivitas estrogen), pada keadaan sebaliknya, dimana kadar estrogen yang rendah, isoflavon dapat bekerja sebagai estrogen agonis (menyerupai estrogen). Afinitas isoflavon dengan RE lebih rendah daripada dibanding estrogen endogen sel epitel dari jaringan reproduksi seperti: kelenjar mamae, ovarii, testis (Robertson, 2002; Adgent, 2010). RE α banyak terdapat pada uterus, dan dalam jumlah sedikit terdeteksi pada ovarium, sel Leydig dari testis, glandula mammae perempuan, tulang, dan hipotalamus. Ekspresi RE β paling tinggi dijumpai pada sel granulosa ovarium, traktus gastrointestinal, kemudian dalam jumlah sedikit sampai sedang pada organ lvii sperma, prostat, epididimis, glandula mammae perempuan, hipotalamus, dan hipofise (Rhen dan Cidlowski, 2009; Kim dan Park, 2012). Pada laki-laki, RE terdapat pada jaringan epididimis, epitel duktus efferent, testis, dan prostat. Pada epididimis yang terbanyak adalah RE α. Pada testis lebih banyak dijumpai RE β yang ditemukan hampir pada semua tipe sel dari interstisium dan tubulus seminiferus, sedangkan RE α hanya ditemukan pada interstisium. Selain pada testis, RE β juga ditemukan duktus efferent, prostat dan di epididimis. Namun, fungsi dari RE β dalam sistem reproduktif laki-laki sampai sekarang masih memerlukan penelitian lebih lanjut (Hess, 2003). Genistein dan daidzein dapat berikatan dengan kedua RE. Afinitas pengikatan genistein untuk RE β adalah 87%, sementara dengan RE α adalah 4%, sedangkan untuk afinitas pengikatan daidzein untuk RE α dan RE β adalah 0,5% dan 0,1%. Walaupun genistein mempunyai potensi lebih rendah daripada estradiol, tetapi konsentrasi tinggi makanan kacang kedelai merupakan sumber pengganti estrogen pada wanita perimenopause (Cao et al., 2009; Kim dan Park, 2012). Genistein selain dapat berikatan dengan RE, juga dapat berikatan secara aktif dengan SHBG, hampir sama kekuatannya seperti estradiol. Akibat berikatan dengan SHBG, genistein dapat dibawa masuk kedalam plasma dan meningkatkan konsentrasi estradiol bebas (Chen dan Rogan, 2004). Isoflavon juga dapat bekerja melalui mekanisme non-hormonal, yaitu: melalui inhibisi tirosin kinase yang berperan dalam proliferasi sel sehingga menyebabkan pertumbuhan terhambat dan terjadi apoptosis, sebagai tambahan lviii isoflavon juga mempunyai efek sebagai antioksidan (Chen dan Rogan, 2004; Drake, 2009). Perubahan hormonal seperti peningkatan kadar estrogen atau penekanan kadar testosteron terutama pada saat masa fetus akan menyebabkan terjadinya berbagai kelainan reproduksi, seperti penurunan jumlah sperma, kanker sel germinal testis, kriptorkismus, hypospadia (Hughes, 2007; Diamanti-Kandarakis, 2009). Pada beberapa studi yang dilakukan pada manusia, pemberian diet mengandung protein kacang kedelai secara signifikan memberikan efek pada siklus menstruasi, berupa perpanjangan masa siklus menstruasi dan menurunkan resiko terjadinya kanker payudara (Diamanti-Kandarakis, 2009). 2.5.5 Susu Formula Kacang Kedelai Susu formula kacang kedelai adalah susu formula bebas laktosa yang menggunakan isolat kacang kedelai yang digunakan untuk bayi dan anak. Susu formula kacang kedelai sudah digunakan diseluruh dunia lebih dari 100 tahun. Susu ini dapat digunakan untuk alternatif bagi bayi yang mengalami alergi susu sapi yang dimediasi oleh kadar alergi IgE, diare pasca infeksi, intoleransi laktosa, galaktosemia, pada bayi yang orang tuanya lebih memilih diet vegetarian (Bhatia dan Greer, 2008; Dinsdale dan Ward, 2010). Pada mulanya, susu formula kacang kedelai dibuat dari tepung kacang kedelai, kemudian pada tahun 1960an dibuatlah dari isolat kacang kedelai yang kemudian lebih lanjut dimodifikasi dengan penambahan methionine, iodine, carnitine, taurine, choline dan inositol. Susu formula kacang kedelai lix menggunakan isolat protein kedelai sebagai bahan dasar. Isolat protein kedelai tersebut memiliki kandungan protein tinggi yang setara dengan susu sapi. Karbohidrat pada susu formula ini adalah maltodextrin, yaitu sejenis karbohidrat yang dapat ditoleransi oleh sistem pencernaan bayi yang mengalami diare atau yang alergi susu sapi. Nutrisinya kurang lebih sama dengan susu sapi terhirolisis, tetapi harganya lebih murah dan rasanya lebih familier (Merrit dan Jenks, 2004; Dinsdale dan Ward, 2010). Pemberian susu formula kacang kedelai mempunyai efek nutrisi yang sama bila dibandingkan dengan susu sapi dan demikian juga sama efeknya terhadap mineralisasi tulang bila dibandingkan dengan susu sapi dan pemberian ASI. Seperti halnya pada ASI, kalsium dan fosfor pada susu formula ini memiliki perbandingan 2:1 untuk menunjang pembentukan tulang dan gigi. Susu ini juga mengandung asam lemak esensial, yaitu omega 6 dan omega 3 dengan rasio yang tepat sebagai bahan dasar pembentukan AA dan DHA untuk tumbuh kembang otak yang optimal. Begitu juga efeknya terhadap perilaku neurobehavior dan sistem imun, hanya pada awal tahun 1990 dilaporkan terjadi goiter pada bayi yang diberikan susu formula kacang kedelai sebelum ada iodine terfortifikasi dalam susu (Strom et al., 2001; Merrit dan Jenks, 2004). Susu formula kacang kedelai mengandung maltodekstrin, minyak nabati, isolat protein kedelai, AA, DHA, lesitin kedelai, sistin, metionin, taurin, nukleotida, karnitin, mineral dan vitamin. Pemberian susu pada bayi perlu mendapatkan perhatian, terutama dari usia 0–6 bulan, yang hanya mendapatkan ASI atau susu formula saja. Dari data lx Amerika Utara, didapatkan rata-rata bayi (37,2% - 43,8%) diberikan susu formula dari usia 3–6 bulan (Dinsdale dan Ward, 2010). Susu formula kacang kedelai mengandung fitoestrogen dari klas isoflavon dengan potensi aktivitas seperti hormon estrogen, karena mempunyai cincin fenolat yang dapat berikatan dengan RE. Kandungan susu formula ini mempunyai 2 (dua) tipe isoflavon kacang kedelai yang dominan, yaitu: genistein (67,1% dari total kadar isoflavon) dan daidzein (28,7% dari total isoflavon), yang dapat berikatan dengan RE α dan RE β ( Dinsdale dan Ward, 2010). Orang dewasa jarang melebihi 25% dari total kalori yang mereka dapatkan dari protein kacang kedelai, sedangkan pada bayi yang menggunakan susu formula kacang kedelai mendapatkan 100% dari total kalori. Pada bayi intake harian susu formula kacang kedelai sekitar 4 mg/kgBB – 11 mg/kgBB. Rata-rata pemberian susu formula kacang kedelai pada bayi sama dengan jumlah makanan kacang kedelai yang dikomsumsi oleh orang dewasa, namun konsentrasi isoflavon di dalam plasma lebih besar pada bayi dibandingkan orang dewasa. Data klinis menyebutkan 0 – 3% fitoestrogen yang berada dalam plasma pada bayi yang mengkonsumsi susu formula kacang kedelai adalah dalam bentuk aktif (Cao et al., 2009; Leung dan Otley, 2009). Walaupun isoflavon kacang kedelai mempunyai efek estrogenik lemah, dimana kira-kira 102 – 103 kali kurang poten daripada estrogen endogen, tetapi bayi yang mengkonsumsi susu formula kacang kedelai mempunyai kadar serum isoflavon tinggi. Konsentrasi total kadar isoflavon dari susu formula kacang kedelai yang disediakan untuk bayi sekitar 32 – 47 mg/L, sementara konsentrasi lxi isofalvon dalam ASI hanya rata-rata 5,6 µg/L. Karena itu, bayi yang diberi susu formula kacang kedelai terpapar 5,7 – 11, 9 mg isoflavon/kg BB atau 22 – 45 mg isoflavon per hari selama 4 bulan pertama, sementara yang diberi ASI kadar tersebut dapat diacuhkan (<0,01 mg/L). Apabila dibandingkan dengan orang dewasa yang mengkonsumsi makanan kaya kacang kedelai yang diperkirakan jumlahnya sekitar 0,71 mg/kg BB, maka pada bayi yang diberi dengan susu formula ini terpapar 6 – 11 kali lebih tinggi kadar isoflavon dibandingkan dengan orang dewasa. Konsentrasi isoflavon dalam plasma pada bayi usia 4 bulan yang diberikan susu formula kacang kedelai sekitar 654 – 1775 µg/L, lebih tinggi daripada yang diberikan ASI atau yang diberikan susu sapi. Konsentrasi isoflavon yang beredar pada bayi yang diberikan susu formula kacang kedelai 13.000 – 22.000 kali lipat lebih tinggi daripada kadar 17β-estradiol yang berada dalam sirkulasi pada awal kehidupan, namun kadar isoflavon plasma tidak menggambarkan status estrogen pada bayi. Walaupun isoflavon mempunyai aktivitas estrogen yang lemah bila dibandingkan dengan estradiol, tetapi sampai sekarang tidak diketahui efek konsentrasi yang tinggi dari isoflavon berhubungan dengan ikatan protein serum ( Cao et al., 2009; Dinsdale dan Ward, 2010 ). Isoflavon genistein, daidzein, dan glikosida ditemukan dalam konsentrasi tinggi pada kacang kedelai dan makanan kacang kedelai, hal ini mungkin memiliki efek yang menguntungkan dalam pencegahan atau pengobatan penyakit yang tergantung pada hormon, tetapi efek samping dapat terjadi pada bayi yang diberi susu formula kacang kedelai (Cao et al., 2009). lxii Penelitian fitoestrogen telah berkembang sangat pesat dalam beberapa tahun terakhir ini karena penelitian epidemiologi menunjukkan bahwa diet kaya kacang kedelai berkaitan dengan manfaat kesehatan, tetapi terdapat kekurangan data tentang efek endokrin fitokimia kacang kedelai selama masa bayi yang merupakan masa paling sensitif untuk induksi toksisitas. Keamanan isoflavon dalam susu formula dipertanyakan karena kemungkinan laporan efek hormonal. Isoflavon dalam susu formula kacang kedelai merupakan estrogen yang relatif lemah, sekitar 1/1000 sampai 1/10.000 dari potensi estradiol dalam uji uterotrophic tikus, namun jumlahnya yang relatif besar dalam susu formula kacang kedelai. Akibatnya, timbul kekhawatiran bahwa isoflavon dapat meniru tindakan estradiol atau mengubah metabolisme estradiol dan akibatnya memodifikasi proses yang dipengaruhi oleh estradiol. Ada beberapa kekhawatiran isoflavon mempengaruhi sistem kekebalan tubuh, tiroid dan sistem reproduksi. Terhadap perkembangan reproduksi, dapat mempengaruhi gonadal steroid berhubungan dengan fitoestrogen dapat mempengaruhi estrogen atau reseptor modulator estrogen selektif (Strom et al., 2001). Kadar testosteron pada bayi laki-laki selama beberapa bulan pertama tinggi, mungkin setinggi pada seorang pria dewasa. Selama periode ini, bayi tersebut diprogram untuk mengekspresikan karakteristik pria setelah pubertas, tidak hanya dalam perkembangan organ seksual dan ciri-ciri fisik maskulin, tetapi juga pengaturan pola di otak supaya sesuai karakteristik perilaku laki-laki. Beberapa dokter anak memperhatikan jumlah yang lebih besar pada anak laki-laki yang fisik pematangannya tertunda atau tidak terjadi sama sekali, termasuk kurang lxiii berkembangnya organ seksual dan ketidakmampuan untuk belajar. Hal ini dikatakan sudah mencapai proporsi epidemi (Judarwanto, 2014). Strom et al. (2001) melakukan sebuah studi dengan melibatkan dewasa muda baik pria maupun wanita yang diberikan susu formula kacang kedelai dan susu sapi yang diberikan seperti bayi dan ditemukan tidak ada perbedaan dalam antropometrik, sistem non reproduktif dan reproduktif, tidak ada perbedaan menarche, sebaliknya yang diberikan susu sapi mengalami nyeri haid dan menstruasi lebih lama (Strom et al., 2001; Merrit dan Jenks, 2004; Chen dan Rogan, 2004). Penelitian yang melibatkan 2.884 anak perempuan dilakukan oleh Adgent, 2010 menyatakan terjadi menarche dini pada kelompok anak perempuan yang mendapatkan susu formula kacang kedelai. Sebuah penelitian lain melaporkan terjadi peningkatan maturasi sel vagina pada bayi perempuan yang diberikan susu formula kacang kedelai dari awal kelahiran sampai 6 bulan. Penelitian lain yang dilakukan di Arkansas Children’s Nutrition Centre, menyatakan terdapat perbesaran volume ovarium, peningkatan kista ovarium per ovarii, dan penurunan volume testis, walaupun penemuan ini juga terjadi pada 32% bayi yang tidak diberikan langsung susu formula kacang kedelai sampai 4 – 8 minggu umur mereka. Karena waktu pemaparan mungkin berperan penting dalam kesehatan nantinya, maka diperlukan penelitian yang lebih lanjut (Dinsdale dan Ward, 2010). Penelitian cross-sectional yang dilakukan pada anak perempuan Puerto Rico dari usia 6 bulan sampai 8 tahun didapatkan perkembangan payudara lebih cepat lxiv pada anak yang diberi susu formula kacang kedelai, sedangkan penelitian yang dilakukan pada anak laki-laki memberikan efek yang bervariasi (Kim dan Park, 2012). Bayi yang diberikan susu formula kacang kedelai dapat mengabsorpsi dan mengekskresikan estrogenik isoflavon. Penelitian yang dilakukan Cao et al. (2009) dikatakan konsentrasi genistein dan daidzein di urin 500 kali lebih besar pada infant yang diberi susu formula kacang kedelai dibandingkan yang diberi susu sapi dan lebih besar 6 – 10 kali dibandingkan dengan ASI, yang diikuti dengan peninggian konsentrasi genistein dan daidzein dalam darah dan terakhir saliva. Walaupun studi menunjukkan susu formula kacang kedelai dapat menurunkan insidens penyakit ASS dengan riwayat keluarga alergi dibandingkan dengan penggunaan susu sapi, tetapi studi lanjut gagal menemukan keuntungan susu formula kacang kedelai sebagai profilaksis penyakit alergi (Chen dan Rogan, 2004; Cao et al., 2009). Sampai sekarang, masih terjadi perdebatan apakah perlu diberi peringatan tentang penggunaan susu formula kacang kedelai bila diberikan kepada bayi. Di negara-negara maju, seperti Canada, USA, UK, menyatakan paling baik dengan pemberian ASI kepada bayi baru lahir, penggunaan susu formula kacang kedelai hanya digunakan atas pertimbangan kesehatan, atau alasan budaya dan agama, bahkan di negara-negara Eropa, susu formula kacang kedelai ini hanya bisa diperoleh dengan persetujuan dan pengawasan dokter (Dinsdale dan Ward, 2010). Hanya satu penelitian yang melaporkan adanya gangguan reproduksi pada masa remaja, hal ini bisa disebabkan diperlukan pengamatan yang lama, sehingga lxv kurang data lengkap pada manusia, sehingga diperlukan penelitian dengan menggunakan binatang sebagai model penelitian untuk mengetahui efeknya pada manusia (Dinsdale dan Ward, 2010). Penelitian dengan melakukan aromatase knockout pada tikus jantan sehingga tikus tersebut tidak dapat mensintesa estrogen endogen, kemudian diberikan isoflavon, ditemukan tidak terjadi kelainan spermatogenesis pada kelompok yang diberikan isoflavon dibandingkan dengan yang tidak diberikan asupan isoflavon (Robertson et al., 2002). Penelitian lain yang juga menggunakan tikus jantan dewasa yang diberikan isolat isoflavon, didapatkan adanya penurunan kadar hormon testosteron, penurunan berat testis, penurunan diameter tubulus seminiferus dan penurunan spermatogenesis. Salah satu penelitian lagi yang menggunakan bayi tikus jantan dengan memberikan genistein baik secara oral maupun subkutan, didapatkan hasil yang tidak konsisten terhadap serum FSH, LH dan testosteron (Dinsdale dan Ward, 2010). lxvi Tabel 2.4 Indikator Maturasi Seksual dan Gangguan Endokrin pada Hewan Pengerat yang diberi Preparat Isoflavon (Dinsdale dan Ward, 2010) Maturasi Seksual Perpisahan Preputial Pembukaan Vagina Gangguan Endokrin Jarak Anogenital Histologi Organ Seksual Berat Organ Seksual Hormon Serum Aktivitas Reseptor Estrogen Siklus Estrogen Lordosis Quotient Perpisahan kulit penis dari glan, perpisahan preputial merupakan tanda awal langkah pubertas Tanda ini muncul akibat sirkulasi estrogen, yang merupakan tanda/ onset pubertas dan terjadinya ovulasi pertama sebagai tanda mulainya siklus estrogen Perbedaan jarak antara anus dengan protuberance genital pada hewan penggerat baru lahir, termasuk tikus dan kucing merupakan petanda perbedaan jenis kelamin (lebih panjang pada jantan dibandingkan yang betina) dan dapat digunakan untuk menentukan apakah gangguan endokrin telah muncul. Bila terjadi under-masculinization maka jarak anogenital menjadi lebih pendek daripada kontrol. Perubahan morfologi kelenjar mammae, ovari, uterus, tetis merupakan indikator efek estrogen yang dapat meningkatkan atau mengurangi fertilitas. Bertambah berat uterus, ovarium, testis, prostat merupakan indikator efek estrogen akibat penambahan proliferasi sel. Diukur hormon seks steroid (LH, FSH, GnRH, estradiol, progesteron, testosteron) menunjukkan efek estrogenik pada sistem endokrin Peningkatan transkripsi β-reseptor estrogen atau α-reseptor estrogen Waktu setiap fase siklus estrogen menjadi lebih panjang dan dapat digunakan sebagai petanda fertilitas, jika di hewan didapatkan perpanjangan, maka terjadi penurunan fertilitas Pengukuran untuk kelakuan seksual dan diukur melalui pembagian jumlah dari lordosisnya (posisi lengkung ke dalam dari colum vertebra) 2.6 HEWAN COBA Pada penelitian obat atau alat baru terdapat tahap dimana zat atau alat baru tersebut harus diujikan terlebih dahulu pada hewan coba sebelum diujikan pada manusia. Hewan coba yang banyak digunakan adalah mencit dan tikus putih, karena mudah didapat dalam jumlah banyak, berespon cepat, dapat memberikan lxvii gambaran ilmiah yang mungkin terjadi pada manusia dan harganya relatif murah (Sihombing dan Raflizar, 2010). 2.6.1 Tikus Wistar (Rattus norvegicus) Penelitian dengan menggunakan tikus galur Wistar (Rattus norvegicus) lebih banyak dilakukan oleh peneliti karena banyak yang menganggap aspek perilaku dan fisiologis tikus lebih relevan dengan manusia dan lebih mudah diamati, mudah dipelihara bila dibandingkan dengan mencit. Pemeliharaan dan makanan tikus lebih mahal daripada mencit, tetapi tikus dapat berbiak sebaik mencit. Hewan ini juga lebih besar daripada mencit, maka untuk beberapa macam percobaan, tikus lebih menguntungkan. Terdapat beberapa galur tikus yang dapat digunakan untuk percobaan, antara lain: Wistar albino, Long-Evans, Sprague Dawley, namun yang sering digunakan luas berasal dari tikus Wistar albino (Widiartini et al., 2013). Tikus galur Wistar (Rattus norvegicus) lebih besar daripada famili tikus pada umumnya, dimana tikus ini dapat mencapai 40 cm diukur dari hidung sampai ujung ekor dengan berat 140 – 500 gram. Tikus betina biasanya mempunyai ukuran yang lebih kecil daripada tikus jantan dan memiliki kematangan seksual pada umur 4 bulan dan dapat hidup selama 4 tahun (Kusumawati, 2004). lxviii Tabel 2.5 Perkembangan dan Kebutuhan Tikus Jantan (Anonim, 2010) Bobot Kelahiran : 5 – 6 gram Menyapih : 30 – 55 gram Pubertas : 150 – 200 gram Pada usia 12 minggu jantan : 200 – 400 gram Dewasa laki-laki : 300 – 800 gram Usia penyapihan : 20 – 21 hari (setelah 2 geraham tumbuh) Masa pubertas jantan : 39 – 47 hari Kedewasaan : 160 – 180 hari (5 – 6 bulan) Konsumsi makanan Konsumsi makanan sehari-hari: 5 gr/100 gr BB/hari Konsumsi air sehari-hari : 8 – 11 ml/100 gr BB/hari Menurut International Wildlife Rehabilitation Council and the National Wildlife Rehabilitator Association, bayi tikus memerlukan intake susu sebesar 5% dari berat badan (gr) yang dianggap sama dengan ml setiap kali pemberian. Kelebihan pemberian dapat menyebabkan perut kembung, diare, kerusakan fisik dan akhirnya kematian, tetapi sebaliknya bila kekurangan pemberian dapat menyebabkan dehidrasi, gangguan perkembangan tulang, penambahan berat badan yang lambat dan kesulitan-kesulitan perkembangan yang lain. Penggunaan susu pengganti bagi bayi tikus bisa berbagai macam jenis susu, bisa berupa susu kambing segar, susu khusus untuk kucing atau anjing, bahkan dapat digunakan susu untuk manusia, seperti Enfamil® atau Soyalac® (Robbins, 1998). Tikus menyusu untuk 21 hari pertama kehidupan, dengan demikian pemaparan isoflavon harus berlangsung selama masa menyusui untuk meniru tahap perkembangan dimana bayi manusia dapat diberi makan tetapi tikus mencapai kematangan seksual lebih pendek, yaitu pada usia 6 minggu, sedangkan manusia lebih memakan waktu panjang. Idealnya pemberian pemaparan isoflavon lxix harus diberikan secara oral untuk melewati tahap melalui traktus digestivus dan pemaparan dimulai dari hari pertama, selama menyusui dan terpapar lebih dari satu kali dalam satu hari (Dinsdale dan Ward, 2010). Tabel 2.6 Kadar Hormon Estrogen dan Testosteron Normal pada Tikus Jantan (Hess dan Carnes, 2004; ALPCO, 2013) Darah Vena Estradiol Testosteron Kadar 2,48 – 2,94 pg/ml 0,66 – 5,4 ng/ml Tikus memasuki masa pubertas pada 50-60 hari setelah kelahiran. Usia pubertas pada hewan betina ditandai dengan pembukaan liang vagina (vaginal opening) dan pada hewan jantan ditandai dengan adanya penurunan testis dari abdominal ke skrotum (Kusumawati, 2004). 2.6.2 Pemantauan Keselamatan Tikus di Laboratorium Pemantauan keselamatan tikus di laboratorium antara lain (Ngatidjan, 2006) : 1. Kandang tikus sebaiknya dari bahan yang kuat, tidak mudah rusak, mudah dibersihkan (satu kali seminggu), tidak berkarat, mudah dipasang lagi, hewan tidak mudah lepas. Ukuran kandang harus diperhatikan, agar tikus bisa bergerak bebas tanpa ada ketegangan yang diakibatkan oleh kandang yang terlalu sempit. 2. Alas tidur harus dapat menyerap air kemih supaya kandang tetap kering. Syarat bahan alas tidur adalah dapat menghisap air, tidak melukai hewan coba, tidak menarik untuk dimakan, tidak berbau dan tidak mengandung zat yang dapat mengganggu kesehatan hewan coba. Umumnya dipakai sekam padi atau serbuk gergaji. lxx 3. Menciptakan suasana lingkungan yang stabil dan sesuai dengan keperluan fisiologi tikus (suhu, kelembaban, dan kecepatan pertukaran udara yang ekstrim harus dihindari). 4. Tikus harus diperlakukan dengan kasih sayang. lxxi BAB III KERANGKA BERPIKIR, KONSEP, DAN HIPOTESIS PENELITIAN 3.1. Kerangka Berpikir Sistem imum seorang anak relatif masih rentan pada usia tahun pertama kehidupan. Bila salah satu atau kedua orang tuanya mempunyai penyakit alergi, maka anak tersebut dapat mempunyai bakat atopik yang akan mudah tersensitisasi dan berkembang menjadi penyakit alergi. Biasanya protein susu sapi yang pertama kali diperkenalkan kepada seorang bayi dan penyebab dari penyakit ASS. Tatalaksana penyakit ASS dengan menghindari susu sapi dan produknya dan diberikan susu sapi hipoalergenik dengan hidrolisis, susu formula asam amino atau susu formula kacang kedelai sampai terjadi toleransi terhadap susu sapi. Kadar hormon estrogen dan testosteron dipengaruhi oleh faktor eksternal dan faktor internal. Faktor internal yang mempengaruhi antara lain berupa: faktor genetik, metabolisme, usia, jenis kelamin, hormonal, sedangkan yang termasuk faktor eksternal adalah diet makanan dan gaya hidup. Kacang kedelai (Glycine max) termasuk dalam keluarga Leguminosae (kacang-kacangan) yang mempunyai esterogenik karena kandungan isoflavonnya. Isoflavon ini termasuk golongan fitoestrogen (berasal dari tumbuh-tumbuhan) dan mempunyai kemampuan untuk bereaksi seperti hormon estrogen didalam tubuh. Kandungan utama isoflavon yang terdapat di kacang kedelai adalah genistein, daidzein, dan sedikit glycitein. lxxii 53 Susu formula kacang kedelai yang diperuntukan bagi bayi dibuat dari komponen kacang kedelai dan digunakan untuk menggantikan atau sebagai tambahan ASI atau pengganti susu sapi. Struktur kimia isoflavon yang menyerupai estrogen dan cincin fenolat dalam isoflavon berfungsi untuk berikatan dengan RE. Isoflavon dapat bersifat agonis dan antagonis terhadap RE. Ketika kadar estrogen menurun, maka akan bekerja sebagai estrogen agonis, sehingga dapat menstimulasi respon estrogen. Sekresi FSH dan LH juga akan menurun akhirnya produksi testosteron juga menurun. 3.2 Konsep Penelitian Faktor Internal - Susu formula kacang kedelai Genetik Metabolisme Usia Jenis kelamin Hormonal Faktor Eksternal - Bayi tikus jantan Kadar estrogen Kadar testosteron Gambar 3.1 Kerangka Konsep lxxiii Diet makanan Gaya hidup 3.3 Hipotesis Penelitian Berdasarkan kerangka berpikir dan konsep penelitian di atas, maka dapat dirumuskan hipotesis penelitian sebagai berikut: 1. Pemberian susu formula kacang kedelai meningkatkan kadar hormon estrogen pada bayi tikus putih galur Wistar (Rattus norvegicus) jantan. 2. Pemberian susu formula kacang kedelai menurunkan kadar hormon testosteron pada bayi tikus putih galur Wistar (Rattus norvegicus) jantan. lxxiv BAB IV METODE PENELITIAN 4.1 Rancangan Penelitian Penelitian ini merupakan penelitian eksperimental dengan menggunakan post test only control group design (Marczyk et al., 2005). Skema rancangan penelitian adalah sebagai berikut: R P P0 O1 S P1 O2 Gambar 4.1 Skema Rancangan Penelitian Keterangan: P = Populasi S = Sampel R = Randomisasi P0 = Perlakuan pada kelompok kontrol dengan menggunakan susu sapi formula dengan dosis 5% dari berat badan (gr) tiap kali pemberian (Robbin, 1998). P1 = Perlakuan pada kelompok perlakuan dengan menggunakan susu formula kacang kedelai dosis 5% dari berat badan (gr) tiap kali pemberian. lxxv 56 O1 = Observasi kadar estrogen dan kadar testosteron pada kelompok kontrol (P0) O2 = Observasi kadar estrogen dan kadar testosteron pada kelompok perlakuan (P1) 4.2 Lokasi dan Waktu Penelitian 4.2.1 Lokasi Penelitian Penelitian dilakukan di Laboratory Animal Unit, Bagian Farmakologi Fakultas Kedokteran Universitas Udayana, Denpasar, Bali. Pengambilan darah dilakukan pada pagi hari dan pemeriksaan kadar estrogen dan testosteron dilakukan Laboratorium Patologi Klinik Veteriner Fakultas Kedokteran Hewan Universitas Udayana. Pemeriksaan kadar estrogen dan testosteron dilakukan di Laboratorium Analitik Universitas Udayana, Kampus Bukit Jimbaran. 4.2.2 Waktu Penelitian Penelitian dilakukan selama 21 hari, dimulai dari tanggal 22 November 2014 sampai 06 Februari 2015. Pengambilan darah dilakukan pada pagi hari, tanggal 07 Februari 2015. 4.3 Penentuan Sumber Data 4.3.1 Variabilitas Populasi Populasi pada penelitian ini adalah bayi tikus putih galur Wistar (Rattus norvegicus) jantan yang jumlahnya sesuai dengan sampel yang telah ditentukan dalam penelitian. Bayi tikus putih galur Wistar (Rattus norvegicus) jantan ini diperoleh dari Laboratory Animal Unit, Bagian Farmakologi Fakultas Kedokteran Universitas Udayana, Denpasar, Bali. lxxvi 4.3.2 Kriteria Subjek Sampel penelitian ini adalah bayi tikus yang memenuhi kriteria sebagai berikut: Kriteria Inklusi : 1. Bayi tikus putih galur Wistar (Rattus norvegicus) sehat. 2. Jenis kelamin jantan. 3. Umur bayi tikus 7 hari. 4. Berat badan 10 – 15 gr. Kriteria Drop Out : Bayi tikus mati saat penelitian sedang berlangsung. 4.4 Besaran Sampel dan Teknik Pengambilan Sampel 4.4.1 Besaran Sampel Besar sampel dihitung dengan menggunakan rumus Federer (2011): ( n-1) ( t-1) ≥ 15 ( n-1) ( 2-1) ≥ 15 ( n-1) ≥ 15 n ≥ 16 Keterangan : n = Banyaknya sampel setiap perlakuan t = Banyaknya perlakuan Berdasarkan perhitungan dengan rumus diatas, maka diperoleh n = 16. Pada penelitian ini terdapat dua kelompok, maka jumlah sampel seluruhnya adalah 32. lxxvii Sampel ditambah 10% untuk menjaga kemungkinan drop out, sehingga jumlah keseluruhan sampel menjadi 36. 4.4.2 Teknik Pengambilan Sampel Semua sampel yang memenuhi kriteria penelitian dimasukkan dalam sampel penelitian. Bayi tikus putih galur Wistar (Rattus norvegicus) jantan dibagi menjadi dua kelompok secara random. Satu kelompok merupakan kelompok kontrol dan satu kelompok lagi merupakan kelompok perlakuan. Kelompok kontrol diberikan susu sapi formula, sedangkan pada kelompok perlakuan diberi susu formula kacang kedelai. Kedua kelompok ini diberikan selama 21 hari (sesuai dengan masa sapih) (Widiartini et al., 2013). 4.5 Variabel Penelitian 4.5.1 Klasifikasi Variabel 1. Variabel bebas adalah variabel yang akan mempengaruhi hasil penelitian secara langsung, yaitu: susu formula kacang kedelai. 2. Variabel tergantung adalah variabel yang merupakan hasil perlakuan variabel bebas, yaitu kadar hormon estrogen dan testosteron. 3. Variabel kendali adalah variabel yang dapat dikendalikan, antara lain: jenis tikus, umur, sehat, jenis kelamin yang sama, berat badan, makanan dan minuman, temperatur, tempat tinggal. lxxviii 4.5.2 Hubungan Antar Variabel Variabel Tergantung: Variabel Bebas : Susu formula kacang kedelai Estrogen Testosteron Variabel Kendali : - Umur tikus Jenis tikus Jenis kelamin Berat badan Makanan & Minuman Temperatur Tempat tinggal Gambar 4.2 Hubungan Antar Variabel 4.5.3 Definisi Operasional Variabel Pemeriksaan darah dilakukan setelah pemberian susu formula dengan prosedur pemberian sebagai berikut: 1. Susu formula kacang kedelai adalah susu bubuk bebas laktosa yang terbuat dari isolat kacang kedelai dengan merek Morinaga BMT Soya® tahap 1 untuk bayi usia 0–6 bulan. Dosis yang diberikan adalah 5% dikalikan dengan berat badan (gr) setiap kali pemberian. Pemberian susu dilakukan dua kali sehari, pada pagi dan sore hari. Berat badan bayi tikus diukur setiap pagi dalam keadaan perut kosong. Hasil analisis susu formula kacang kedelai merek Morinaga BMT soya® tahap 1, didapatkan kadar lxxix isoflavon 12,09 mg/100gr, sehingga 1 gr susu kedelai mengandung 0,12 mg isoflavon (lampiran 2). 2. Susu sapi formula adalah susu bubuk yang dibuat dari sumber protein hewani, yang diharapkan dapat dengan mudah di cerna oleh usus. Susu sapi yang digunakan adalah merek Morinaga BMT® tahap 1 untuk bayi usia 0–6 bulan, diberikan dengan dosis 5% dikalikan dengan berat badan (gr) setiap kali pemberian dengan dua kali pemberian dalam sehari, pada pagi dan sore hari. Berat badan bayi tikus diukur setiap pagi dalam keadaan perut kosong. 3. Estrogen adalah konsentrasi estradiol bebas dalam darah yang merupakan estrogen alami yang paling kuat secara biologis. Pemeriksaan estrogen merupakan pengukuran kadar hormon estradiol yang dilakukan dengan metode Enzym-linked Immunosobent Assay (ELISA) dengan alat spektrofotometer 450 nm. Pengambilan darah tikus sebanyak 0,5 cc dilakukan pada bagian medial kantus sinus orbitalis kanan dan diambil pada hari ke 21 perlakuan. 4. Testosteron adalah konsentrasi testosteron total yang terikat pada protein plasma dan yang beredar bebas dalam darah tikus. Pemeriksaan dilakukan dengan metode ELISA dengan alat spektrofotometer 450 nm. Pengambilan darah tikus sebanyak 0,5 cc dilakukan pada bagian medial kantus sinus orbitalis kanan dan diambil pada hari ke 21 perlakuan. lxxx 5. Tikus yang digunakan adalah bayi tikus putih galur Wistar (Rattus norvegicus) dengan jenis kelamin jantan, sehat, berusia 7 hari dengan berat badan 10 – 15 gr. 6. Umur tikus ditentukan dengan melihat tanggal kelahiran yang dicatat oleh Dokter Hewan pada kandang hewan percobaan. 7. Berat badan adalah berat bayi tikus galur Wistar jantan yang diukur dengan timbangan khusus merk Tanita yang tersedia di Laboratory Animal Unit bagian Farmakologi Universitas Udayana. 8. Kondisi kandang adalah ruangan dengan ukuran 40 x 30 x 20 cm terbuat dari besi, disertai lampu dengan temperatur antara 240C – 320C dengan kelembaban berkisar 50%. Satu kandang dihuni maksimal oleh 5 ekor bayi tikus disertai oleh indukannya. Kandang harus cukup kuat, tidak mudah rusak, tahan gigitan, dan hewan harus tampak jelas dari luar. 9. Makanan yang diberikan sesuai dengan penelitian, yaitu pada kelompok kontrol diberi susu sapi formula dan pada kelompok perlakuan diberi susu formula kacang kedelai yang disesuaikan dengan dosis kebutuhan. Minuman yang diberikan adalah aquadest ad libitum. 4.6 Bahan dan Instrumen Penelitian, Hewan Percobaan 4.6.1 Bahan Penelitian Bahan yang dipakai dalam penelitian ini adalah: 1. Susu formula kacang kedelai dengan merek Morinaga BMT soya® tahap 1 untuk bayi usia 0–6 bulan. lxxxi 2. Susu sapi formula dengan merek Morinaga BMT® tahap 1 untuk bayi usia 0–6 bulan. 3. Aquadest. 4. Kit untuk pemeriksaan hormon estrogen dan testosteron. 4.6.2 Instrumen Penelitian Alat yang digunakan pada penelitian ini adalah: 1. Kandang tikus yang berukuran 40 x 30 x 20 cm berisi 5 ekor tikus, yang terbuat dari besi yang didalamnya terdapat sekam untuk alas dan botol minuman. 2. Kandang diberi lampu, ditempatkan pada ruangan dengan ventilasi baik, cukup cahaya, tidak bising, temperatur antara 240C – 320C dengan kelembaban berkisar 50%. Kandang dibersihkan tiap 3 hari sekali. 3. Spuit dengan jarum ukuran 22 atau 24, tumpul. 4. Gelas ukur. 5. Timbangan digital merek Tanita. 6. Buku tabel untuk mencatat. 7. Kapas dan alkohol 70%. 8. Spuit 1 cc dan 3 cc. 9. Sarung tangan. 10. Kamera digital. 11. Sentrifuge merek Kitman. 12. Pipet kapiler hematokrit. 13. Tabung EDTA. lxxxii 14. Ependorf. 15. Spektrofotometer 450 nm merek Biotek Instruments. 4.6.3 Hewan Percobaan Dalam penelitian ini, digunakan bayi tikus putih galur Wistar (Rattus norvegicus) jantan berusia 7 hari. Sebelumnya induk tikus diberi pakan ayam standar 594® dari PT Pokphand dengan komposisi protein 20-25%, lemak 5%, pati 45-50%, serat kasar kira-kira 5%, dan abu 4-5 %, serta diberi minum ad libitum (Smith dan Mongkoewidjojo, 1988). Setelah lahir, bayi tikus diadaptasi selama 7 hari dengan diberi minum susu dari indukan. Setelah berusia 7 hari, bayi tikus dipilih secara random. Bayi tikus yang dipilih harus tikus jantan, sehat, dengan berat badan 10 – 15 gr, diberi susu sesuai kebutuhan selama 21 hari. Bayi tikus diperoleh dan dipelihara di Laboratorium Animal Unit Bagian Farmakologi Fakultas Kedokteran Universitas Udayana Denpasar dengan prasyaratan sesuai dengan penelitian eksperimental. 4.7 Prosedur Penelitian 4.7.1 Pembuatan Susu 1. Susu formula kacang kedelai merek Morinaga BMT soya® tahap 1 untuk bayi usia 0–6 bulan dengan dosis 5% dikalikan dengan berat badan (gr) yang diencerkan dengan aquadest. Untuk 500 mg susu formula kacang kedelai diencerkan dengan menggunakan 2 cc aquadest. 2. Susu sapi formula merek Morinaga BMT® tahap 1 untuk bayi usia 0–6 bulan dengan dosis 5% dikalikan dengan berat badan (gr) yang diencerkan lxxxiii dengan aquadest. Untuk 500 mg susu sapi formula diperlukan aquadest sebanyak 2 cc. 4.7.2 Persiapan Hewan Uji 1. Sebanyak 20 ekor indukan diberi pakan ayam standar 594® dari PT Pokphand, masing-masing indukan menempati satu kandang tersendiri. 2. Setelah habis melahirkan, bayi tikus putih galur Wistar jantan sebanyak 36 ekor diadaptasi selama 7 hari dengan diberikan susu indukannya. 3. Setelah 7 hari, secara random bayi tikus putih galur Wistar jantan dibagi menjadi dua kelompok, dimana kelompok P0 adalah kelompok kontrol yang diberi susu sapi formula merek Morinaga BMT® tahap 1 untuk bayi usia 0–6 bulan sedangkan kelompok P1 adalah kelompok perlakuan yang diberi susu formula kacang kedelai merek Morinaga BMT soya® tahap 1 untuk bayi usia 0–6 bulan. 4.7.3 Jalannya Penelitian 1. Bayi tikus putih galur Wistar jantan sebanyak 36 ekor, sehat, berusia 7 hari dengan berat badan 10 – 15 gr. 2. Bayi tikus dibagi menjadi 2 kelompok secara random. 3. Bayi tikus dipelihara di kandang yang berukuran 40 x 30 x 20 cm dengan pada ruangan dengan ventilasi baik, cukup cahaya, tidak bising, temperatur antara 240C – 320C dengan kelembaban berkisar 50%. Kenyamanan kandang dijaga dan bayi tikus diperlakukan dengan kasih sayang. lxxxiv 4. Setelah itu diberi perlakuan: P0 = perlakuan terhadap kelompok kontrol yang diberi susu sapi formula merek Morinaga BMT ® tahap 1 dengan dosis 5% dari BB (gr) setiap kali pemberian dan diberikan menggunakan sonde. Pemberian dilakukan dua kali, pada pagi dan sore hari. P1 = perlakuan terhadap kelompok perlakuan yang diberi susu formula kacang kedelai merek Morinaga BMT soya® tahap 1 dengan dosis 5% dari BB (gr) tiap kali pemberian dan dilakukan dua kali, pada pagi dan sore hari menggunakan sonde. 5. Setelah 21 hari penelitian, kedua kelompok tersebut diambil darah. Pengambilan darah dilakukan pada bagian medial kantus sinus orbitalis mata kanan sebanyak 0,5 cc untuk pemeriksaan kadar hormon estrogen dan testosteron dengan menggunakan metode ELISA. 4.7.4 Proses Pengambilan Darah 1. Pengambilan sampel darah dilakukan pada semua bayi tikus putih galur Wistar jantan di bagian medial kantus sinus orbitalis mata kanan. 2. Darah yang diambil sebanyak 0,5 cc pada hari ke 21. 3. Pengambilan darah dilakukan pada pagi hari. 4.7.5 Analisis Susu Formula Kacang Kedelai Analisis susu formula kacang kedelai merek Morinaga BMT soya® tahap 1 untuk bayi usia 0–6 bulan dilakukan pada UPT Lab. Analitik Universitas Udayana, Kampus Bukit Jimbaran pada tanggal 20 Oktober 2014 dengan hasil lxxxv 12,09 mg isoflavon/100 gr susu, sehingga 1 gr susu mengandung 0,12mg isoflavon (lampiran 2). 4.7.6 Prosedur Pengukuran Kadar Hormon Pemeriksaan kadar estrogen dan testosteron dilakukan di laboratorium dengan menggunakan alat spektrofotometer 450 nm dengan metode ELISA. Sampel darah tikus diambil pada hari ke 21 untuk dilakukan pemeriksaan post test. Darah tikus diambil sebanyak 0,5 cc dari medial kantus sinus orbitalis mata kanan, sebelum pengambilan darah dilakukan tindakan asepsis dan antiseptik dengan pengusapan alkohol sekitar daerah yang akan diambil darahnya. Darah yang diambil kemudian dimasukkan ke dalam serum separator tube, diendapkan selama 2 jam pada temperatur kamar, kemudian disentrifuge selama 15 menit kecepatan 3000 rpm. Kemudian serum diambil dan dimasukkan ke dalam ependorf, disimpan pada suhu - 21° C dan dilakukan pemeriksaan dengan spektrofotometer 450 nm dengan metode ELISA. 4.7.6.1 Prosedur Pengukuran Kadar Hormon Estrogen Pemeriksaan dengan metode ELISA untuk estrogen yang akan dilakukan adalah sebagai berikut: 1. Reagen diletakkan di suhu ruang 30 menit sebelum digunakan. 2. Dilakukan pengambilan 50 µl standar, sampel, dan quality control dengan menggunakan pipet, kemudian dimasukkan ke dalam well. 3. Ditambahkan 200 µl enzim konjugat kemudian dilakukan pengocokkan, setelah itu diinkubasi pada suhu ruang (370C) selama 120 menit, tanpa menutup plate. lxxxvi 4. Cairan dibuang dan dicuci sebanyak 3x dengan larutan wash buffer sebanyak 400 µl, ditambahkan lagi 100 µl substrat solution, diinkubasikan kembali pada suhu ruang selama 15 menit, kemudian ditambahkan kembali 50 µl stopping solution. 5. Pembacaan dilakukan pada spektrofotometer pada panjang gelombang 450nm, maksimum dilakukan dalam 10 menit. 6. Hasil kadar estrogen dalam satuan pg/ml. 4.7.6.2 Prosedur Pengukuran Kadar Hormon Testosteron Pemeriksaan dengan metode ELISA untuk testosteron yang akan dilakukan adalah sebagai berikut: 1. Reagen diletakkan di suhu ruang 30 menit sebelum digunakan. 2. Dilakukan pengambilan 50 µl standar, sampel, dan quality control dengan menggunakan pipet, kemudian dimasukkan ke dalam well. 3. Dilakukan penambahkan 100 µl Testosterone-HRP Conjugate ke masingmasing well kecuali pada well quality control dan standar, kemudian dikocok selama 1-2 menit dan diinkubasi pada suhu ruang (37ᵒC) selama 60 menit. 4. Cairan dibuang dan dicuci sebanyak 5x dengan larutan wash buffer sebanyak 250µL, kemudian balik plate dan residu cairan dikeringkan dengan paper towel. Setelah itu dilakukan penambahan 100 µL TMB substrate solution kedalam masing-masing well. Plate diinkubasi pada suhu ruang (37 ᵒC) selama 20 menit. lxxxvii 5. Dilakukan penambahkan 50 µL stopping solution ke dalam masing-masing well dan larutan dihomogenkan selama 30 menit, yang terlihat dari perubahan warna larutan dari biru menjadi kuning. 6. Kemudian microwell dibaca dengan spektrofotometer pada panjang gelombang 450nm. Hasil dari pembacaan tersebut berupa mean absorbance value dari masing-masing set standar, sampel dan kontrol. 7. Hasil mean absorbance value tersebut kemudian diplot pada kurva standar untuk mendapatkan hasil kadar testosteron dalam satuan ng/ml. lxxxviii 4.7.7 Alur Penelitian 36 ekor bayi tikus putih galur Wistar baru lahir, sehat, jantan Diberi susu indukannya Adaptasi 7 hari Randomisasi Kontrol 18 ekor Perlakuan 18 ekor Perlakuan selama 21 hari diberi susu formula kacang kedelai dosis 5% dikalikan BB (gr) tiap kali pemberian, diberikan 2 kali sehari Perlakuan selama 21 hari diberi susu sapi formula dengan dosis 5% dikalikan BB (gr) tiap kali pemberian, diberikan 2 kali sehari Pemeriksaan Post test Pemeriksaan kadar hormon estrogen dan testosteron Analisis Gambar 4.3 Alur Penelitian 4.8 Analisis Data Seluruh data hasil penelitian dianalisis dengan menggunakan program SPSS for window versi 16.0. Analisis data meliputi (Dahlan, 2012): 1. Analisis deskriptif. lxxxix 2. Analisis normalitas data. Uji normalitas data tiap kelompok dilakukan dengan Shapiro-Wilk test oleh karena data kurang dari 50. Distribusi kadar estrogen dan testosteron sesudah perlakuan pada masing-masing kelompok berdistribusi normal (p >0,05). 3. Analisis homogenitas. Uji homogenitas varian antar kelompok dengan Levene’s test. Varian data kadar estrogen dan testosteron sesudah perlakuan pada masing-masing kelompok homogen (p>0,05). 4. Analisis komparasi. Karena data berdistribusi normal dan homogen, maka uji kemaknaan menggunakan uji t-independent. xc BAB V HASIL DAN PEMBAHASAN 5.1 Subyek Penelitian Penelitian eksperimental dengan Post Test Only Control Group Design, menggunakan 36 ekor bayi tikus jantan galur Wistar (Rattus norvegicus) berusia 7 hari, sehat dengan berat badan 10 – 15 gram sebagai sampel. Penelitian ini dibagi dua kelompok, yaitu: kelompok kontrol (P0) yang diberi susu sapi formula dan kelompok perlakuan (P1) yang diberi susu formula kacang kedelai dengan dosis masing-masing kelompok 5% dari berat badan (gr). Hasil analisis susu formula kacang kedelai didapatkan kadar isoflavon 12,09 mg/100gr, sehingga 1 gr susu kedelai mengandung 0,12 mg isoflavon (lampiran 2). Pemberian dilakukan dua kali dalam sehari selama 21 hari (sesuai dengan masa sapih). Dalam bab ini akan diuraikan uji normalitas data, uji homogenitas data, dan uji efek perlakuan. 5.2 Distribusi dan Homogenitas Data Hasil Penelitian Sebelum dilakukan analisis lebih lanjut, data hasil penelitian estrogen dan testosteron dilakukan uji distribusi dan variannya. 5.2.1 Uji Normalitas Data Data estrogen dan testosteron sesudah perlakuan pada masing-masing kelompok diuji normalitasnya dengan menggunakan uji Shapiro-Wilk. Hasilnya menunjukkan data berdistribusi normal (p>0,05), disajikan pada Tabel 5.1 berikut. xci 72 Tabel 5.1 Hasil Uji Normalitas Data Estrogen dan Testosteron Sesudah Perlakuan Kelompok Subjek Estrogen Kontrol Estrogen Perlakuan Testosteron Kontrol Testosteron Perlakuan n 18 18 18 18 p 0,106 0,051 0,616 0,073 Ket. normal normal normal normal Berdasarkan hasil analisis di atas, didapatkan bahwa masing-masing kelompok berdistribusi normal (p>0,05). 5.2.2 Uji Homogenitas Data Data kadar hormon estrogen dan testosteron diuji homogenitasnya dengan Levene’s test. Hasilnya menunjukkan data homogen (p>0,05), disajikan pada Tabel 5.2 berikut. Tabel 5.2 Homogenitas Data Estrogen dan Testosteron antar Kelompok Variabel Estrogen Testosteron F 1,310 0,719 p 0,346 0,402 Keterangan Homogen Homogen Berdasarkan hasil analisis di atas, didapatkan varian data masing-masing kelompok homogen (p>0,05). 5.3 Uji Efek Perlakuan 5.3.1 Kadar Hormon Estrogen Analisis efek perlakuan diuji berdasarkan rerata estrogen antar kelompok sesudah diberikan perlakuan berupa susu sapi dan susu formula kacang kedelai. Hasil analisis kemaknaan dengan uji t-independent disajikan pada Tabel 5.3 berikut. xcii Tabel 5.3 Perbedaan Rerata Estrogen antar Kelompok Sesudah Diberikan Susu Sapi Formula dan Susu Formula Kacang Kedelai Kelompok Subjek Kontrol Perlakuan n Rerata Estrogen ( pg/ml) SB t p 18 18 0,55 0,82 0,03 0,01 35,76 0,001 Berdasarkan Tabel 5.3 di atas, menunjukkan bahwa rerata estrogen kelompok kontrol adalah 0,550,03 dan rerata kelompok perlakuan adalah 0,820,01. Analisis kemaknaan dengan uji t-independent menunjukkan bahwa nilai t = 35,76 dan nilai p = 0,001. Hal ini berarti bahwa rerata estrogen pada kedua kelompok sesudah diberikan perlakuan berbeda secara bermakna (p < 0,05). p = 0,001 Gambar 5.1 Perbandingan Estrogen antara Kelompok Kontrol dengan Kelompok Perlakuan xciii 5.3.2 Kadar Hormon Testosteron Analisis efek perlakuan diuji berdasarkan rerata testosteron antar kelompok sesudah diberikan perlakuan berupa susu sapi dan susu formula kacang kedelai. Hasil analisis kemaknaan dengan uji t-independent disajikan pada Tabel 5.4 berikut. Tabel 5.4 Perbedaan Rerata Testosteron antar Kelompok Sesudah Diberikan Susu Sapi Formula dan Susu Formula Kacang Kedelai Kelompok Subjek Kontrol Perlakuan n Rerata Testosteron ( ng/ml ) SB t p 18 18 3,25 2,36 0,15 0,22 14,32 0,001 Berdasarkan Tabel 5.4 di atas, menunjukkan bahwa rerata testosteron kelompok kontrol adalah 3,250,15 dan rerata kelompok perlakuan adalah 2,360,22. Analisis kemaknaan dengan uji t-independent menunjukkan bahwa nilai t = 14,32 dan nilai p = 0,001. Hal ini berarti bahwa rerata testosteron pada kedua kelompok sesudah diberikan perlakuan berbeda secara bermakna (p<0,05). xciv p = 0,001 Gambar 5.2 Perbandingan Testosteron antara Kelompok Kontrol dengan Kelompok Perlakuan Berdasarkan hasil penelitian di atas, didapatkan bahwa pada kelompok perlakuan terjadi peningkatan estrogen sebesar 48,09% dan terjadi penurunan testosteron sebesar 27,44% dibandingkan dengan kelompok kontrol. Hal ini disebabkan karena kelompok kontrol yang diberi susu sapi formula tidak mengandung isoflavon sehingga tidak terjadi kenaikan estrogen dan penurunan testosteron. Susu formula kacang kedelai merek Morinaga BMT soya® tahap 1 untuk usia 0–6 bulan dilakukan analisis di UPT Lab. Analitik Universitas Udayana, Kampus Bukit Jimbaran dan didapatkan hasil 12,09 mg isoflavon/100 gr susu sehingga 1 gr susu mengandung 0,12 mg isoflavon (lampiran 2). Susu formula kacang kedelai mengandung isoflavon yang merupakan senyawa fitoestrogen sehingga memiliki aktivitas estrogen. Isoflavon mempunyai struktur menyerupai struktur kimia estrogen dan dapat berkerja seperti hormon xcv (hormone like activity). Cincin fenolat pada isoflavon berfungsi untuk berikatan dengan reseptor estrogen (RE) sehingga dapat mempunyai efek yang sama seperti estrogen (agonis). RE α dan RE β dapat ditemukan di hipotalamus dan pada jaringan epididimis, prostat dan testis, sedangkan pada hipofise hanya ditemukan RE β. Genistein dan daidzein dapat berikatan dengan kedua RE (Hess, 2003; Cao et al., 2009; Kim dan Park, 2012). Isoflavon berikatan dengan RE di hipofise anterior sehingga merangsang sekresi FSH dan LH. Sekresi LH yang meningkat mengakibatkan peningkatan sekresi sel Leydig dan sel germinal, sehingga mengakibatkan tingginya kadar testosteron dan estrogen. Kadar estrogen yang meningkat menyebabkan terjadinya feed back mechanism yang menyebabkan penurunan kadar testosteron (Kim dan Park, 2012). Testosteron berasal dari prekursor kolesterol, sehingga gangguan sekresi LH juga menyebabkan gangguan pada enzim 20β-hidroksilasi dan 22β-hidroksilasi akibatnya pemecahan rantai samping menjadi pregnenolon dan asam isocarpoat akan terganggu dan hasil akhirnya testosteron tidak terbentuk. Isoflavon juga menghambat kerja enzim 17-β-hidroksisteroidoksidorektase yang dibutuhkan untuk sintesis testosteron, sehingga walaupun pregnenolon terbentuk tetapi tidak dapat dikonversi menjadi testosteron (Drake, 2009; Braunstein, 2011). Kadar testosteron yang menurun menyebabkan aromatisasi estrogen endogen juga ikut menurun, sehingga menyebabkan isoflavon bekerja sebagai estrogen agonis (menyerupai estrogen) akibatnya bekerja dengan meniru cara kerja estrogen dan berikatan dengan RE. Kandungan isoflavon yaitu, genistein dan xcvi daidzein dapat berikatan dengan kedua RE α dan RE β pada jaringan epididimis, prostat dan testis sehingga dapat merangsang peningkatan sekresi estrogen, dimana sel Leydig dan sel germinal akan meingkatkan kadar estrogen dalam sistem limfatik dan perifer. Pemberian isoflavon yang terjadi terus menerus dapat meningkatkan jumlah RE sehingga lebih banyak lagi isoflavon yang dapat berikatan dengan RE. Peningkatan jumlah estrogen akan mengakibatkan penurunan sekresi testosteron akibat dari inhibisi LH (Hess, 2003; Cao et al., 2009; Kim dan Park, 2012). Genistein selain dapat berikatan dengan RE, juga dapat berikatan secara aktif dengan SHBG, hampir sama kekuatannya seperti estradiol. Akibat berikatan dengan SHBG, genistein dapat dibawa masuk kedalam plasma dan meningkatkan konsentrasi estradiol bebas (Chen dan Rogan, 2004). Hasil penelitian ini sesuai dengan penelitian yang dilakukan oleh Strom et al. (2001), dimana diperoleh hasil pada kelompok yang diberikan susu formula kacang kedelai didapatkan durasi menstruasi yang lebih panjang dan mempunyai rasa tidak nyaman atau nyeri selama menstruasi. Penelitian yang dilakukan oleh Bernbaum et al. (2008) pada bayi perempuan usia 6 bulan, diberikan susu formula kacang kedelai dilaporkan terjadi peningkatan maturasi sel vagina sebagai efek dari estrogenik, sedangkan pada penelitian yang menggunakan tikus jantan dewasa yang diberi isolat isoflavon, didapatkan hasil penurunan kadar hormon testosteron, penurunan berat testis, penurunan diameter tubulus seminiferus dan gangguan spermatogenesis (Dinsdale dan Ward, 2010). xcvii Hasil penelitian ini menimbulkan pertanyaan dan sekaligus kekhawatiran mengenai kemungkinan terjadi hambatan perkembangan organ reproduksi pada bayi laki-laki dan pada bayi perempuan ditakutkan terjadi precox puberty apabila diberikan susu formula kacang kedelai pada manusia, khususnya anak-anak. Diperlukan penelitian pada anak yang mengalami hambatan perkembangan organ reproduksi dalam kaitannya dengan pemberian susu ini. Berdasarkan hasil penelitian ini, perlu dipertimbangkan penggunaan susu formula kacang kedelai yang dimodifikasi sedemikian rupa dengan menghilangkan komponen isoflavon sehingga tidak mempengaruhi kadar hormon. xcviii BAB VI SIMPULAN DAN SARAN 7.1 Simpulan Berdasarkan hasil penelitian pemberian susu formula kacang kedelai didapatkan simpulan sebagai berikut: 1. Pemberian susu formula kacang kedelai (Glycine max) meningkatkan kadar estrogen pada bayi tikus putih galur Wistar (Rattus norvegicus) jantan sebesar 48,09%. 2. Pemberian susu formula kacang kedelai (Glycine max) menurunkan kadar testosteron pada bayi tikus putih galur Wistar (Rattus norvegicus) jantan sebesar 27,44%. 7.2 Saran Sebagai saran dalam penelitian ini adalah: 1. Melakukan penelitian lebih lanjut tentang efek lanjut pemberian susu formula kacang kedelai pada perkembangan organ reproduksi. 2. Melakukan penelitian lebih lanjut tentang pengaruh pemberian susu formula kacang kedelai pada hormon endokrin lainnya, seperti FSH, LH. 3. Melakukan penelitian pada anak laki-laki yang mengalami hambatan perkembangan organ genital dengan kaitannya terhadap pemberian susu formula kacang kedelai. xcix 80 4. Apabila terbukti pada manusia, maka pemberian susu formula kacang kedelai perlu dipertimbangkan lebih lanjut terutama bila diberikan pada bayi, khususnya pada bayi yang mengalami penyakit ASS. 5. Perlu dipertimbangkan susu formula kacang kedelai yang dimodifikasi sedemikian rupa dengan menghilangkan komponen isoflavon sehingga tidak mempengaruhi kadar hormon. c DAFTAR PUSTAKA Adgent, M.A. 2010. Early Life Soy Exposure and Child Development : an assessment of language acquisition, play behavior and time-to-menarche. Available from http://dc.lib.unc.edu/cdm/ref/collection/etd/id/3971. th Accessed: March 4 , 2014. Adgent, M.A., Daniels, J.L., Edwards, L.J., Siega-Riz, A.M., Rogan, W.J. 2011. Early-Life Soy Exposure and Gender-Role Play Behavior in Children. Environ Health Perspect. Vol : 119(12). p.1811 – 16. Anonim. 2010. Tikus: Berbagi Tak Pernah Rugi. Available http://isroi.com/category/tikus/. Accessed: October 27th, 2014. at Barness, L.A. and Curran, J.S. 2000. Nutrisi. In : Wahab, A.S., editor. Nelson: Ilmu Kesehatan Anak. 15thed. Jakarta: EGC. Vol : 1 . hal: 197 – 205. Baziad, A. 2002. Kontrasepsi hormonal. Edisi Pertama. Jakarta: Yayasan Bina Pustaka Sarwono Prawirohardjo. Hal 1-10. Bhatia, J. and Greer, F. 2008. Use of Soy Protein-Based Formulas in Infant Feeding. Pediatrics. Vol: 121. p. 1062 – 68. Bo, Y.S. and Hyun, P.K. 2005. Inhibition of Naturally-Occuring Flavonoids. Arch Pharm Res. Vol: 28, No. 10. p. 1152 – 55. Braunstein, G.D. 2011. Testes. In: Gardner, D.G., and Shoback, D., editors. Greenspan’s: Basic & Clinical Endocrinology. 9thed. McGraw-Hill. p. 395401. Cao, Y., Calafat, A.M., Doerge, D.R., Umbach, D.M., Bernbaum, J.C., Twaddle, N.C., Ye, X., Rogan, W.J. 2009. Isoflavone in Urine, Saliva, and Blood of Infants: Data from a Pilot Study on the Estrogenic Activity of Soy Formula. JES. Vol: 19. p.223-34. Chen, A. and Rogan, W.J. 2004. Isoflavones in Soy Infant Formula: A Review of Evidence for Endocrine and Other Activity in Infants. Annu. Rev. Nutr. Vol: 24.p.33 – 54. Dahlan, M.S. 2012. Statistik untuk Kedokteran dan Kesehatan. Jakarta: Salemba Medika. hal:1-80. Diamanti-Kandarakis, E., Bourguignon, J., Giudice, L.C., Hauser, R., Prins, G.S., Soto, A.M., Zoeller, R.T., Gore, A.C. 2009. Endocrine-Disrupting Chemicals: An Endocrine Society Scientific Statement. Endocrine Reviews. Vol: 30(4).p. 293-342. ci 82 Dinsdale, E.C.and Ward, W.E. 2010. Early Exposure to Soy Isoflavones and Effects on Reproductive Health: A Review of Human and Animal Studies. Nutrients. Vol:2.p.1156 – 87. Drake, V.J. 2009. Isoflavones. Linus Pauling Institute. Oregon State University. Avaliable from http://lpi.oregonstate.edu/infocenter/ phytochemicals /soyiso /#. Accessed: August 30th, 2014. Federer, W.T. 2011. Statistical Design and Analysis for Intercropping Experiments. New York: Springer. p 30 – 33. Hees, R.A. and Carnes, K. 2004. The Role of Estrogen in Testis and the Male Reproductive Tract: a review and species comparison. Anim. Reprod. Vol: 1.p 5 – 30. Hess, R.A. 2003. Estrogen in the Adult Male Reproductive Tract: A Review. Reproductive Biology and Endocrinology. Reproductive Biology and Endocrinology. Vol:1(52).p.1-14. Hughes, I. 2007. Variability and Uncertainty inToxicology of Chemicals in Food, Consumer Products and the Environment. Committee on Toxicity. London. Food Standars Agency.p.83-92. Judarwanto, W. 2011. Inilah Susu Formula Terbaik Bagi Anak. Indonesia Medicine. Available from http://growupclinic.com/. Accessed: Maret 17th, 2015. Judarwanto, W. 2014. Keamanan Penggunaan Susu Formula Kedelai (Soya) dan Kontroversinya. Indonesia Medicine. Available from st http://allergycliniconline.com/. Accessed: January 31 , 2015. Kim, S.H. and Park, M.J. 2012. Effects of Phytoestrogen on Sexual Development. Korean J Pediatr. Vol: 55(8).p.265 – 71. Koletzko, S., Niggemann, B., Arato,A., Dias, J.A., Heuschkel, R., Mearin, M.L., Papadopoulou, A., Ruemmele, F.M., Staiano, A., Schäppi, M.G., Vandenplas, Y. 2012. Diagnostic Approach and Management of Cow’s Milk Protein Allergy in Infants and Children: ESPGHAN GI Committee Practical Guidelines. JPGN. Vol: 55.p. 221 – 29. Konkle, A.T.M. and McCarthy, M.M. 2011. Development Time Course of Estradiol, Testosterone, and Dihydrotestosterone Levels in Discrete Regions of Male and Female Rat Brain. J.Endocrinology. Vol:52(1).p.223 – 35. Kumar, R. 2013. Testis. In: Tunru, I.S.A., editor. Dasar-dasar Patofisiologi Penyakit. Tangerang: Binarupa Aksara Publisher. hal: 462 – 468. cii Kurniasih, D., Hilmansyah, H., Astuti, M.P., Imam, S. 2010. Sehat & Bugar Berkat Gizi Seimbang. In : Soekirman, Afriansyah, N., Erikania, J., editors. Jakarta: PT Penerbitan Sarana Bobo Kompas Gramedia. hal : 7 – 120. Kusumawati, D. 2004. Bersahabat dengan Hewan Coba. Yogyakarta : Gajah Mada University Press. Leung, A. and Otley, A. 2009. Concerns for the Use of Soy-Based Formulas in Infant Nutrition. Peadiatr Child Health. Vol: 14 (3).p. 109 – 13. Marczyk., Geoffrey, R., Dematteo, D., Festinger, D. 2005. Experimental Design. In: Dematteo, D., David., editors. Essential of Research Design and Methodology. 1stedition. New Jersey: John-Wiley.p. 48 – 56. McCance, K.L. and Huether, S.E. 2006. Pathophysiology. The Biologic Basis for Disease in Adults and Children. 5thed. Elsevier. p.755 – 59. Merritt, R.J. and Jenks, B. H. 2004. Safety of Soy-Based Formulas Cointaning Isoflavones: The Clinical Evidence. J.Nutr. Vol: 134. p. 1220S – 24S. Messina, M. 2001. Soy & Health. Available from http://extension.agron.iastate.edu/soybean/uses_isoflavones.htm/Isoflavone FactSheet USB.pdf. Accessed : January 1st, 2014. Munasir, Z. and Siregar, S.P. 2010. Alergi Susu Sapi. Alergi-Imunologi Anak. Edisi II. Jakarta: Badan Penerbit IDAI. hal: 284 – 93. Ngatidjan. 2006. Metode Laboratorium dalam Toksikologi. Yogyakarta: Bagian Farmakologi dan Toksikologi Fakultas Kedokteran UGM. hal : 68 – 81. Norris, J. 2011. Soy: What’s the Harm? Available from http://www.veganhealth.org/articles/soy_wth. Accessed : Oktober 17th, 2014. Pangkahila, W. 2011. Anti-Aging Tetap Muda dan Sehat. Jakarta: Kompas Media Nusantara. hal: 11 – 43. Rhen, T. and Cidlowski, J.A. 2009. Steroid Hormones Action. In : Thomas, S.J., and McGonigal, C., editors. Yen and Jaffe’s Reproductive Endocrinology: Physiology, Pathophysiology, and Clinical Management. 6thed. Philadelphia. Elsevier. p.108 – 23. Robbins, K. 1998. Caring for Rat & Mouse Orphans. Available from http://www.afrma.org/orphanrm.htm. Accessed: 27th October, 2014. ciii Robertson, K.M., O’Donnell, L., Simpson, E.R., Jones, M.E. 2002. The Phenotype of Aromatase Knockout Mouse Reveals Dietary Phytoestrogens Impact Significantly on Testis Function. Endrocrinology. Vol : 143(8)p. 2913 – 21. Ryan, R. 2007. Dialed in The Health and Fitness Program That will Change Your Life. Available from http://books.google.co.id. Accessed: 17th Maret 2015. Santoso, M.I.E. 2011. Buku Ajar Etika Penelitian Kesehatan. Malang: Universitas Brawijaya Press (UB Press). Hal 1 – 270. Setchell, K.D.R., Brown, N.M., Lyedeking-Olsen, E. 2002. The Clinical Importance of the Metabolic Equol – A Clue to the Effectiveness of Soy and Its Isoflavones. J. Nutr. Vol: 132. p. 3577 – 74. Sherwood, L. 2013. The Reproductive System. In : Intoduction to Human Physiology. 8thed. Nelson Education, Ltd. Canada. p.781 – 789. Sihombing, M. and Raflizar. 2010. Status Gizi dan Fungsi Hati Mencit (Galur CBS-Swiss) dan Tikus Putih (Galur Wistar) di Laboratorium Hewan Percobaan PUSLITBANG Biomedis dan Farmasi. Media Litbang Kesehatan. Vol. XX.p. 33 – 40. Smith, J.B. and Mangkoewidjojo, S. 1988. Pemeliharaan, Pembiakan dan Penggunaan Hewan Percobaan di Daerah Tropis. Jakarta: Penerbit Universitas Indonesia. hal 1 – 276. Strauss III, J.F. 2009. The Synthesis and Metabolism of Steroid Hormones. In : Thomas, S.J., and McGonigal, C., editors. Yen and Jaffe’s Reproductive Endocrinology: Physiology, Pathophysiology, and Clinical Management. 6thed. Philadelphia. Elsevier. p.82 – 107. Strom, B. L., Schinnar, R., Zieger, E.E., Barnhart, K.T., Sammel, M.D., Macones, G.A., Stallings, V.A., Drulis, J. M., Nelson, S.E., Hanson, S.A. 2001. Exposure to Soy-based Formula in Infancy and Endocrinological and Reproductive Outcomes in Young Adulthood. JAMA. Vol:286(7). p. 807 – 14. Stuckrlberger, A. 2008. Anti-Ageing Medicine: Myths and Chances. vdf Hochschulverlag. Die Deuthsche Nationalbibliothek. p.30 – 34. Suhardjono, D. 1995. Percobaan Hewan Laboratorium. Yogyakarta: Gajah Mada University Press. p. 207. civ Vandenplas, Y., Brueton, M., Dupont, C., Hill, D., Isolauri, E., Koletzko, S., Oranje, A. P., Staiano, A. 2007. Guidelines for the Diagnosis and Management of Cow’s Milk Protein allergy in Infants.Arch Dis Child. Vol: 92.p.902 – 8. Verhasselt, V. 2010. Oral Tolerance in Neonates: From Basics to Potential Prevention of Allergic Disease. Mucosal Immunology. Vol: 3(4). p.326 – 33. Walsh, K.R., Yu, C.Z.,Vodovotz, Y., Schwartz, S. J., Failla, M. L. 2003. Stability and Bioaccessibility of Isoflavones from Soy Bread during In Vitro Digestion. J. Agric. Food Chem. Vol: 51.p.4603 – 9. Wibowo, 2003. The Concepts of Anti Aging and How To Make Without Disorder. Jakarta:FKUI.p.11-17. Widiartini, W., Siswati, E., Setiyawati, A., Rohmah, I.M., Prastyo, E. 2013. Pengembangan Usaha Produksi Tikus Putih (Rattus norvegicus) Tersertifikasi Dalam Upaya Memenuhi Kebutuhan Hewan Laboratorium. Available from http://artikel.dikti.go.id/index.php/PKMK/article/ download /149/150. Accessed : September 1st, 2014. cv Lampiran 1 cvi Lampiran 2 KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN UNIVERSITAS UDAYANA UPT. LAB. ANALITIK Kampus Bukit Jimbaran, Telp. 0361701954, HP.081803134550 Nomor Hal : 249/UN.14.24/UPTLA/2014 : Hasil Laboratorium KEPADA YTH: Prof. Dr. dr. Wimpie I. Pangkahila, Sp.And., FAACS. di Denpasar Jumlah sampel: 2 sampel No PARAMETER 1 Sampel 1 (Nutribaby soya) 2 Sampel 2 (BMT soya) SATUAN FITOESTROGEN (TOTAL ISOFLAVON) METODE mg/100 g 11,25 HPLC mg/100 g 12,09 HPLC Bukit Jimbaran, 20 Oktober 2014 Kepala UPT Laboratorium Analitik Universitas Udayana (Prof. Dr. Ir. Ida Bagus Putra Manuaba, M.Phil) cvii Lampiran 3. Tabel Daftar Volume Maksimal Larutan Sediaan Uji yang Dapat Diberikan pada Berbagai Hewan Lampiran 4 Foto-foto Penelitian Kandang tikus Kandang tikus Indukan & Bayi tikus Indukan & Bayi tikus cviii Pemberian susu melalui sonde P Pemberian susu melalui sonde Kit pengambilan darah Anestesi Lokal Pengambilan darah Pengambilan darah cix Susu sapi Formula Morinaga BMT tahap 1 Komposisi susu sapi formula Morinaga BMT tahap 1 Susu formula kacang kedelai Morinaga BMT soya tahap 1 Komposisi susu formula kacang kedelai Morinaga BMT soya tahap 1 cx Lampiran 5 Uji Normalitas Data Estrogen dan Testosteron pada Masing-masing Kelompok Tests of Normality Kolmogorov-Smirnova Kelompok Statistic Df Shapiro-Wilk Sig. Statistic df Sig. Estrogen Susu Sapi .206 18 .041 .915 18 .106 .173 18 .164 .897 18 .051 Testosteron Susu kedelai Susu Sapi .129 18 * .961 18 .616 Susu kedelai .179 18 .130 .906 18 .073 .200 a. Lilliefors Significance Correction *. This is a lower bound of the true significance. Lampiran 6 Uji t-independent data Estrogen dan Testosteron antara Kelompok Kontrol dengan Kelompok Perlakuan Group Statistics Kelompok Estrogen Testosteron N Mean Std. Deviation Std. Error Mean Susu Sapi 18 .5511 .02784 .00656 Susu kedelai 18 .8161 .01461 .00344 Susu Sapi 18 3.2472 .14966 .03527 Susu kedelai 18 2.3561 .21745 .05125 Independent Samples Test Levene's Test for Equality of Variances F Estrog Equal variances en assumed 1.310 Equal variances not assumed Testos Equal variances teron assumed Equal variances not assumed Sig. t-test for Equality of Means t df .346 -35.759 Sig. Std. 95% Confidence Interval of the (2- Mean Error Difference taile Differe Differe d) nce nce Lower Upper 34 .000 -.26500 .00741 -.28006 -.24994 -35.759 25.70 .000 -.26500 .00741 -.28024 -.24976 .719 .402 14.322 34 .000 .89111 .06222 .76467 1.01756 14.322 30.15 .000 .89111 .06222 .76407 1.01815 cxi Independent Samples Test Levene's Test for Equality of Variances F Estrog Equal variances en assumed 1.310 Equal variances not assumed Testos Equal variances teron assumed Sig. t-test for Equality of Means t df .346 -35.759 Sig. Std. 95% Confidence Interval of the (2- Mean Error Difference taile Differe Differe d) nce nce Lower Upper 34 .000 -.26500 .00741 -.28006 -.24994 -35.759 25.70 .000 -.26500 .00741 -.28024 -.24976 .719 .402 14.322 cxii 34 .000 .89111 .06222 .76467 1.01756 cxiii