aminasi - HMTK UPN V Yogya
advertisement

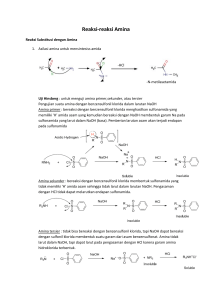
AMINASI MKA PROSES KIMIA Oleh SRI WAHYU MURNI PRODI TEKNIK KIMIA FTI UPN ‘VETERAN” YOGYAKARTA Jenis-jenis Amina • Amina adalah turunan amoniak, dimana 1 atom H atau lebih diganti dengan gugus alkil (R), aril, hidroatil atau heterosiklik. Ada tiga macam amina yaitu : • Amina primer NH2 O NH 2 H N R O H anilin 1- aminoantraquinon • amina sekunder NH H N CH3 H N R R difenil amina dimetilamina • amina tersier H 3C N CH 3 N R N R R trifenil amina dimetil anilin • Proses pembentukan amina dapat dilakukan dengan dua macam cara, yaitu: 1. aminasi secara reduksi : yaitu proses pembuatan amina berdasarkan reaksi reduksi 2. amonolisis : yaitu proses pembuatan amina dari reaksi dengan amonia. Aminasi Secara Reduksi Zat yang dapat direduksi adalah senyawa-senyawa yang telah mengandung atom N, yaitu : 1. Senyawa nitro (R-NO2) 2. Senyawa nitroso (R-NO) 3. Senyawa hidroksilamin (R-NH-OH) 4. Senyawa hidraso (R-NH-NH-R) 5. Senyawa azoxybenzena (R-NH-NO-R) 6. Senyawa nitril (R-C≡N), azida, amida (RCO-NH2) Zat-zat yang digunakan sebagai pereduksi adalah : 1. Logam dan asam Logam yang digunakan adalah : Fe, Zn, Sn, Al sebagai sumber elektron Asam yang digunakan adalah : HCl, H2SO4 sebagai sumber ion H+. HNO3 jarang digunakan karena mempunyai sifat sebagai oksidator kuat. 2. Logam dan basa Logamnya adalah : Fe, Zn, Sn, Al Basa : NaOH, KOH 3. Sulfida Untuk mereduksi sebagian senyawa polinitro aromatik menjadi nitro amina dan mereduksi aminoantraquinon menjadi antraquinon. 4. Sulfit (Na-sulfit dan bisulfit) Zat-zat yang digunakan sebagai pereduksi adalah : (lanjutan) 5. Hidrogen (H2) dengan katalis Penggunaan hidrogen sebagai reduktor, biasanya dengan katalisator. Reduksi dengan hidrogen disebut hidrogenasi. 6. Elektrolisa Ion hidrogen dihasilkan dari elektrolisa. Hidrogen inilah yang kemudian melakukan reduksi. 7. Na-hidrosulfit 8. Metal hidrida 9. Natrium dan Na-alkoholat • Pereduksi tersebut di atas memiliki kekuatan mereduksi yang berbeda. Yang paling banyak digunakan adalah logam dan asam. Dengan memilih reduktor yang sesuai dan mengatur kondisi operasi, maka reduksi dapat dihentikan tidak sampai hasil akhir. • Pengaruh kekuatan zat pereduksi tersebut dapat dilihat pada hasil reduksi nitrobenzena sebagai berikut : Zn + asam NH 2 anilin NO 2 Zn + air NHOH fenilhidroksilamina nitrobenzena Zn + basa N N H H hidrazobenzena NH2 p-amino asetanilida NO 2 Fe + asam asetat NHCOCH 3 NH2 NHCOCH3 p-nitroasetanilida Fe + HCl p-fenildiamina NH2 NH 2 Fe + asam NO 2 NH 2 m-fenildiamina NO 2 NO 2 dinitrobenzena m-nitroanilina Alkali sulfida NH 2 Berbagai hasil reduksi nitrobenzena ditunjukkan skema berikut ini : Reduksi menggunakan Besi dan Asam. • Disebut juga reduksi Bechamp. Reaksi : 2RNO2 + FeCl2 + 6Fe + 10H2O RNO2 + 6Fe(OH)2 + 4H2O 2RNH3Cl + 7Fe(OH)2 RNH2 + 6Fe(OH)2 • Apabila reaksi dijalankan pada bejana gelas, maka mulamula terbentuk endapan kehijauan dari Fe(OH)2, kemudian endapan coklat dari Fe(OH)3; kemudian endapan coklat dari Fe3O4. Reaksi: Fe(OH)2 + 2Fe(OH)3 Fe3O4 + H2O • Aminahidroklorida bereaksi dengan besi dan nitrobenzena: 6RNH3Cl + 3Fe + RNO2 RNH2 + FeCl2 + H2O • Mekanisme Elektronik : RN=O atau O R:N .. : .. : : O :O .. : o Penataan ulang : .. R:N : O .. .. : :O .. : R:N .. : .. : : O :O .. : :::: e F + .. R:N :H .. H + + R:N .. : H H + H 2 + :::: e F + + + .. H:O .. : H O 2 H + H .. R:N .. H .. .. R:N :O : .. .. H H 2 e F + (3) .. .. R:N :O : .. .. H H + .. .. R :N : O : .. .. R:N ::O .. : 2 e F + (2) H 2 + : e F + (1) H 2 + H .. .. R:N .. : .. : O :O .. : .. R:N :O : .. .. :O .. : + 2 e F + • Jadi ada 3 tahap reaksi, yang setiap tahapannya membutuhkan 2 mol H2 dan 3 atom Fe yang menjadi ion Fe2+. Hidrogen juga dihasilkan dari reaksi samping berikut ini : R(NH3)+ + 2Cl- + Fe RNH2 +FeCl2 + H2 3Fe + 6H2O 3Fe(OH)2 + 3H2 Termodinamika • Usaha Memperbesar hasil : 1. 2. 3. 4. Logam berlebih (2,5-5 mol/mol senyawa nitro) HCl berlebih H2O berlebih H2O hasil samping tidak diusir karena berfungsi sebagai pensuspensi 5. Suhu dicari yang optimum Kinetika • Untuk mempercepat Reaksi : 1. Memperbesar A 2. Logam dan asam diperbesar 3. Suhu dinaikkan sampai optimum 4. Ditambahkan zat pelarut untuk memudahkan pencampuran. Mis : alkohol, piridin dll. Reduksi menggunakan Logam dan Alkali • • • • • • • • • • • • • NaOH Reaksi adalah sebagai berikut : NaOH RNO2 + Zn RNO + ZnO nitroso NaOH RNO + Zn + H2O RNHOH + ZnO hidroksilamin NaOH RNO + RNHOH + H2O azooksibenzena + Zn RN=NR + ZnO azobenzena NaOH RN=NR + Zn + H2O R-NH-NH-R + ZnO hidrazobenzena Bila alkalinya pekat maka : Zn + H2O H2ZnO2 H2ZnO2 + 2NaOH Na2ZnO2 + 2 H2O R : dapat berupa fenil, metoksi fenil, klorofenil dll. Reduksi dengan gas Hidrogen (Hidrogenasi) • Pada reduksi senyawa dengan gas hidrogen digunakan katalisator. Fungsi katalisator adalah mengganggu kestabilan hidrogen, sehingga mudah menjadi ion H+. Katalisator berfungsi mengikat elektron, sehingga H2 dapat menjadi 2H+. • katalisator • Reaksi-reaksi : • katalisator • RNO2 + 3H2 RNH2 + 2H2O • katalisator • RCN + 3H2 RCH2N2 • katalisator • RCONH2 + 2H2 RCH2NH2 + 2H2O • katalisator • 2RR’C=NOH + 5H2 2(RR’CH2NH2) + H2O RCSNH2 + 2H2 RCH2NH2 + H2S – Katalisator yang digunakan adalah : Ni, Co, Cu, Fe, Pd, Wo, Pt, Sn, Ag, dan lainlain. Logam dalam keadaan murni atau merupakan logam oksida. Katalisator Ni paling banyak digunakan karena reaktivitasnya tinggi serta bekerja dengan baik pada suhu operasi yang lebih rendah dari pada katalisator Sn ataupun Cu. – Cara membuat H2 (lihat proses hidrogenasi) • • • • – Keuntungan cara ini : • Kapasitas besar, H2 murah (apabila merupakan hasil samping) • Range kondisi operasi luas – Tekanan : 14,7 psi – beberapa ribu psi – Suhu : 20-300oC – Katalisator banyak macamnya • Tidak ada hasil buangan, kecuali katalisator [tidak ada masalah limbah]. Reduksi dengan Elektrolisa • Secara umum reduksi dengan cara ini terkontrol dengan baik, yield tinggi dan produk samping sedikit. Proses ini digunakan untuk mereduksi senyawa alifatik, senyawa mono, di, dan trinitro aromatik menjadi nitroso, hidroksilamina, azoksi, azo, hidrazo dan amino. • Elektroda : • Anoda : C, Cu, Zn, Cd, Hg, Ni, Pt, Pb, Sn, amalgam Pb dan Zn. • Katoda : Fe, Ni, Pt, C dan Pb. • Elektrolit : H2SO4, HCl, NaOH, garam-garam anorganik dan garamgaram organik. • Sel : yang tahan korosi, misalnya : misal : kaca • Faktor penting yang berpengaruh pada yield adalah : densitas arus, konsentrasi arus, suhu, komposisi elektroda, elektrolit dan promotor. • Contoh reaksi untuk senyawa nitro: • RNO2 + 6H+ + 6e RNH2 + H2O • Sebagai contoh, reduksi nitrobenzena menggunakan elektrolit asam sulfat pekat : • C6H5NO2 + 4H+ + 4e p-HOC6H4NH2 + H2O • Apabila densitas arus diturunkan ¼ nya, maka dihasilkan hidrazo sebagai berikut : • RNO2 + 6H+ + 6e + H2O • + 2H+ + 2e R-N=N-R + H2O • • R-N=N-R + 2H+ + 2e R-NH-NH-R Reduksi dengan Garam Sulfida • Garam-garam sulfida yang dipakai adalah : natrium sulfida (Na2S), Natrium hidrosulfit, natrium polisulfida,amonium sulfida dll. • Proses ini digunakan untuk produksi : • nitroamina dari senyawa dinitro, contoh : m-dinitrobenzena nitroanilin • reduksi nitrofenol • reduksi nitroantraquinon • pembuatan senyawa aminoazo m- • Reduksi senyawa nitro oleh alkali sulfida, berlangsung sesuai reaksi sebagai berikut : • 4RNO2 + 6Na2S + 7H2O RNH2 + Na2S2O3 + NaOH • RNO2 + Na2S2 + H2 O RNH2 + Na2S2O3 • 4RNO2 + 6NaHS + H2O 4RNH2 + 3 Na2S2O3 Amonolisis Amonolisis didefinisikan sebagai proses pembentukan amina dari reaksi dengan amonia. RX + NH3 RNH2 + HX Dimana X dapat berupa : halogen, NO2, SO3H dan lain-lain Bahan yang digunakan untuk pengaminasi adalah : 1. NH3 gas atau cair 2. NH3 dalam air (NH4OH) atau dalam pelarut organik 3. senyawa yang mengandung amonia ((NH4)2SO4 dll Pemilihan zat pengaminasi didasarkan pada : o o o o o suhu dan tekanan jenis katalisator yang dipakai kelarutan dan stabilitas zat yang diaminasi kemungkinan adanya hasil samping kemungkinan terbentuknya amina sekunder Cara masuknya NH3 dalam senyawa : (lanjutan) 1. Substitusi d. Konversi senyawa Karbonil : Hidroamonolisis Memasukkan NH3 serta H2 ke dalam senyawa. RCOOH + NH3 + H2 RCH2NH2 + H2O RCHO + NH3 + H2 RCH2NH2 + H2O RCOOR NH3 + H2 RCONH2 + H2O e. Alkohol RCH2OH + NH3 RCH2NH2 + H2O 2. Adisi a. pada pembuatan urea NH 2 CO2 + 2 NH3 + H2O C=O NH2 b. etilen oksida CH 2 CH2 O + NH3 H2N-CH2-CH2-OH Ada dua macam reaksi amonolisa yaitu : 1. amonolisa : memasukkan NH3 ke dalam senyawa 2. hidroamonolisa : memasukkan NH3 dan H2 dalam senyawa Cara masuknya NH3 dalam senyawa : 1. Substitusi a. alkana RCH3 + NH3 RCN RCH2NH2 Untuk memperoleh RNH2 suhu harus tinggi dan katalisator kuat. b. substitusi halogen RCH2X + NH3 RCH2NH2 + HX c. substitusi sulfat atau sulfat RSO3H + NH3 RNH2 + H2SO3 Amonolisis Alkana • Untuk mengamonolisis alkana, zat pengolah yang digunakan adalah gas amoniak, karena amonolisis berlangsung pada fase gas dan suhu tinggi. Sebagai contoh adalah amonolisis metana dengan gas amonia. Reaksi : CH4 + NH3 O2 HCN + 3 H2 o Reaksi berlangsung pada T= 1000oC, P = 1 atm, katalisator : Ni, Pt, Pd. Reaksi bersifat endotermis. o Adanya oksigen dalam campuran pereaksi akan mengoksidasi hidrogen menjadi H2O. H2 + ½ O2 H2O. o Reaksi ini bersifat eksotermis. Kebutuhan panas pada reaksi endotermis dapat dipenuhi dari reaksi oksidasi hidrogen ini. Amonolisis Alkana (lanjutan) • Untuk amonolisis alkana yang lebih panjang reaksi sulit, sebab untuk memecah hidrokarbon menjadi sianida memerlukan panas yang banyak. • Keperluan panas pada amonolosis metana dicukupi dengan mengoksidasi sebagian metana : CH4 + 2O2 CO2 + 2H2O • Kalau sudah ada panas yang cukup baru gas amoniak direaksikan dengan metana. Reaksi amonolisis ini digunakan akatalis Ni, Pt dan Pd. Amonolisis Senyawa Halogenida RCH2X + NH3 RCH2NH2 + HX o X dapat berupa Cl, Br atau F. Yang paling banyak adalah Cl karena paling murah. o R dapat berupa alifatik maupun aromatik. • Contoh: C6H5Cl + NH3 C6H5NH2 + HCl o Untuk menghindari reaksi bergeser kekiri maka HCl harus diikat dengan amoniak. o Jadi diperlukan amoniak berlebihan untuk mengikat asam klorida yang terbentuk. o HCl + NH3 NH4Cl o Apabila ada gugus lain dalam inti benzena maka akan mempengaruhi mudah tidaknya reaksi amonolisis. Amonolisis senyawa Sulfonat atau Sulfat • Reaksi penggantian gugus SO3H ini sebetulnya lebih mudah dari pada reaksi substitusi halogen, sebab SO3H lebih besar molekulnya. • Tetapi harga RCH2SO3H lebih mahal dari pada RCH2NH2 sehingga jarang dibuat RCH2NH2 dari alkil sulfonat. H2N-CH2-CH2- OSO3H + NH3 amino etilenasulfat H2N-CH2-CH2-NH2 + H2SO4 etilen diamin • Reaksi ini mahal sehingga jarang dipakai apabila tidak terpaksa, meskipun reaksinya tidak sulit. Amonolisis Alkohol • RCH2OH + NH3 RCH2NH2 + H2O amina primer • Reaksi berjalan mudah, tetapi hasil yang diperoleh juga reaktif, bahkan lebih reaktif dari amoniaknya sendiri. • Akibatnya kalau amina bertemu alkohol yang diolah, akan terjadi reaksi berikut ini : RCH2NH2 + RCH2OH RCH2NHCH2R + H2O amina sekunder • Amina sekunder ini lebih reaktif lagi, sehingga kalau masih ada alkohol akan terjadi reaksi lebih lanjut. RCH2NHCH2R + RCH2OH RCH2-N-CH2R + H2O CH2R amina tertier Amonolisis Alkohol (lanjutan) • Reaksi tersebut terjadi jika amoniak yang tersedia sedikit, namun alkoholnya banyak. • Untuk menghindarkan reaksi lanjutan jika diinginkan hasinya adalah amina primer maka: o amoniak harus sangat berlebih (ratio amoniak: alkohol besar. o Selain itu dalam reaksi terbentuk air, air harus diikat supaya tidak membentuk NH4OH yang apabila terjadi maka berarti amoniak pengolah berkurang. • Bila dibandingkan reaktivitas RCH2X, RCH2OH dan RCH2SO3H maka pada reaksi amonolisis yang paling reaktif adalah RCH2X. Amonolisis Senyawa Karbonil • Meliputi : aldehid, keton, ester dan asam karboksilat. • Yang paling sering diamonolisis adalah kelompok ester. • Hasil yang diperoleh adalah amida. RCH2COOR1 + NH3 RCH2CONH2 + R1OH Amida • Sebagai contoh adalah amonolisis etil asetat CH3COOC2H5 + NH3 Etil asetat CH3CO NH2 + C2H5OH etilamida etanol Amonolisis dengan Cara Adisi • Reaksi ini dijumpai pada pembuatan mono etanol amina (MEA) dari etilen oksida. CH 2 CH2 O + NH3 H2N-CH2-CH2-OH monoetanolamina (MEA) • Hasil monoetanolamina bersifat lebih reaktif daripada amoniak. Sehingga apabila NH3 kurang tetapi etilenoksida masih banyak maka akan terjadi reaksi lanjutan : MEA + CH 2 CH2 O HO-CH2-CH2-HN-CH2-CH2-OH dietanolamina (DEA) • Jika etilena oksida masih ada, maka DEA akan melanjutkan reaksi membentuk trietanolamina (TEA) DEA + CH 2 CH2 O HO-CH2-CH2-N-CH2-CH2-OH CH 2 CH2 OH Trietanolamina (TEA) • Oleh karenanya jika hanya diinginkan MEA sebagai hasil atau DEA atau TEA, maka perbandingan pereaksi harus diatur. Ratio amoniak/etilena oksida menentukan hasil yang diperoleh. • Contoh lain adalah reaksi pembetukan urea CO2 + NH3 NH 2 C=O ONH4 P>, T< P>, T< NH 2 C=O ONH4 NH 2 C=O NH2 urea amonium karbamat + H2O Faktor-faktor yang Mempenaruhi Amonolisa 1. 2. 3. 4. 5. 6. Kelarutan Pengadukan Efek derivat halogen Efek gugus nitro Suhu Konsentrasi NH3 Penggunaan Katalis dalam Reaksi Aminasi • Amonolisis senyawa halogen dengan katalis logam : Cu, As, Ag, CuO dan garam-garam Cu • Katalisator dehidrasi : alumina, silika gel, aluminium fosfat dalam gel alumina, Ni, Co dll. • Katalisator hidrogenasi berupa logam campuran (alloy) • katalisator hidroamonolisis : logam Ni, Co, Cu, Ni-A, dll. • Katalisator campuran logam (Alloy) Alloy Komposisi Alloy Komposisi Cu-Al 55:45 Cu:Ni:Al 40:10:30 Ni-Al 42:58 Cu:Al:Ni 25:50:25 Co-al 30:70 Cu:Ni:Al 15:35:50 Fe-Al 51:49 • Keuntungan menggunakan katalis logam campuran : o Konversi dan hasil lebih tinggi o Harga katalisator lebih murah o Perbandingan hasll amina pada kisaran yang besar. Termodibamika dan kinetika Termodinamika 1. Usaha Untuk Memperbesar Hasil : 2. NH3 berlebihan 3. Tekanan 4. Suhu Kinetika Usaha Untuk Mempercepat Reaksi : r = k [NH3] [RX] 1. Konsentrasi NH3 dibuat tinggi, caranya adalah dengan NH3 cair. 2. Pengadukan Pengadukan diperlukan karena reaktan tidak saling larut. 3. Suhu Reaksi eksotermik, jadi harus dicari suhu optimum.