Over-Ekspresi Gen OsDREB1A Guna Perbaikan
advertisement

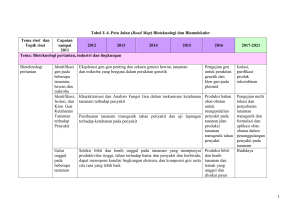
TRANSFORMASI GEN OsDREB1A DENGAN Agrobacterium tumefaciens DAN REGENERASI TANAMAN PADI ABSTRAK Kekeringan merupakan salah satu faktor yang berdampak pada penurunan produksi tanaman padi. Salah satu usaha untuk menanggulangi masalah kekeringan adalah menanam varietas toleran. Perakitan varietas padi toleran terhadap cekaman kekeringan dapat dilakukan menggunakan teknik rekayasa genetik dengan mengintroduksikan gen ke genom padi melalui Agrobacterium tumefaciens. Penelitian ini bertujuan untuk mendapat tanaman padi putatif transgenik yang mengandung gen OsDREB1A yang ekspresinya dikendalikan oleh promoter 35S. Kalus yang berasal dari biji padi varietas Nipponbare ditransformasi dengan konstruk 35S::OsDREB1A melalui Agrobacterium, kemudian diregenerasikan dan diaklimatisasi hingga menghasilkan tanaman padi putatif transgenik. Hasil penelitian menunjukkan bahwa konstruk 35S::OsDREB1A dapat ditransformasikan ke genom padi Japonica Nipponbare dengan metode A. tumefaciens dan seleksi higromisin. Hasil analisis PCR menggunakan primer HPTII memperlihatkan bahwa semua tanaman padi yang dianalisis positif mengandung transgen. Terdapat variasi morfologi pada tanaman padi putatif transgenik generasi T0. Kata kunci : Transformasi, regenerasi, padi, gen OsDREB1A ABSTRACT Drought is a critical factor affecting the reduction in rice production. One of the efforts to overcome the problem of drought is to grow tolerant varieties. Creating of rice varieties tolerant to drought stress can be made using genetic engineering techniques by introducing genes into rice genome by Agrobacterium tumefaciens. The aim of this study was to obtain putative transgenic rice plants containing OsDREB1A gene under the promoter 35S. Calli derived from seeds of rice variety Nipponbare were transformed using 35S::OsDREB1A construct mediated by Agrobacterium, then regenerated and acclimatized to generate putative transgenic rice plants. The results showed the 35::OsDREB1A construct could be transformed into Japonica rice cv. Nipponbare genome with A. tumefaciens method and hygromycine selection. PCR analysisi using the primers HPTII showed that all analyzed rice plants contained transgene. There were variation on the morphology of putative transgenic rice T0 plants. Key words: Transformation, regeneration, rice, gene OsDREB1A 14 Pendahuluan Perakitan varietas padi toleran kekeringan dapat dilakukan melalui pemuliaan klasik maupun menggunakan teknologi transformasi genetik. Sifat toleransi kekeringan pada padi dikendalikan oleh banyak gen (Kasuga et al. 1999, Shinozaki dan Yamaguchi-Shinozaki 2004), sehingga sulit untuk merakit varietas toleran bila menggunakan pemuliaan klasik. Perakitan varietas padi dengan menggunakan teknik transformasi genetik diharapkan dapat menghasilkan varietas padi unggul dengan sifat-sifat yang dikehendaki. Transfomasi genetik dengan perantaraan Agrobacterium tumefaciens merupakan salah satu teknik transformasi yang banyak dilakukan oleh para peneliti dan telah berhasil dengan baik. Agrobacterium merupakan bakteri yang berperanan untuk membantu menyisipkan gen ke dalam genom tanaman, misalnya pada transformasi tanaman kentang dengan gen RB untuk meningkatkan ketahanan terhadap penyakit hawar daun ( Song et al. 2003), tanaman padi dengan gen CBF3/DREB1A dan ABF3 dari Arabidobsis untuk meningkatkan toleransi terhadap cekaman abiotik (Oh et al. 2005). Gen DREB1A termasuk gen faktor transkripsi yang berperan dalam meregulasi sejumlah gen lain yang berhubungan dengan karakter kekeringan ( Liu et al. 1998). Hasil penelitian Dubouzet et al. (2003) menunjukkan bahwa over ekspresi dari gen OsDREB1A yang berasal dari genom padi pada tanaman Arabidopsis transgenik dapat menginduksi over ekspresi gen target DREB1A, dan menghasilkan tanaman Arabidopsis yang lebih toleran terhadap cekaman kekeringan, kadar garam tinggi, dan suhu rendah. Gen-gen yang berbasis DREB (Dehydration Response Element Binding) yang telah diisolasi oleh Dubouzet et al. (2003) dari genom padi adalah OsDREB1A, OsDREB1B, OsDREB1C, OsDREB1D, dan OsDREB2A. Beberapa tanaman hasil rekayasa transgenik yang menggunakan gen DREB antara lain tanaman tomat transgenik (gen CBF1/DREB1B) yang lebih toleran terhadap kekeringan (Hsieh et al. 2002). Gen DREB1B ini homolog dengan gen DREB1A yang responsif terhadap suhu rendah dan defisit air (Gilmour et al. 1998). Pada tanaman gandum transgenik, gen DREB1A meningkatkan toleransi terhadap kekurangan air (Pellegrineschi et al. 2004). 15 Tanaman padi subgroup japonica yang ditransfomasi dengan 35S::OsDREB1A memperlihatkan lebih toleran terhadap kekeringan (Ito et al. 2006). Namun, efek over-ekspresi gen OsDREB1A pada toleransi kekeringan taanaman padi subgroup indica belum diketahui. Tujuan Penelitian Untuk mendapatkan tanaman padi cv. Nipponbare yang mengandung konstruk 35S::OsDREB1A. Metodologi Penelitian a. Bahan Genetik Gen 35S::OsDREB1A yang dikonstruk oleh Mulyana (2010) ditransformasi ke genom padi Nipponbare melalui Agrobacterium tumefaciens. b. Bahan tanaman Benih padi genotipe Nipponbare yang digunakan dalam penelitian ini diperoleh dari International Rice Research Institute. c. Pelaksanaan Penelitian Penelitian ini dilaksanakan di Laboratorium Biologi Molekuler dan Rumah kaca Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian, Bogor, Februari 2008 – Maret 2010. Transformasi Transformasi dan regenerasi tanaman dilaksanakan berdasarkan metode Greco et al. (2001). Sebanyak 200 biji padi varietas Nipponbare steril digunakan untuk sekali proses transformasi dan sepuluh biji padi ditanam pada setiap petridis yang mengandung media induksi kalus (media basal NB + 30 g/l sukrosa (pH 5,8) + 3 g/l phytagel + 2,5 mg/l 2,4-D). Jaringan kalus yang embriogenik dimasukkan dalam media ko-kultivasi cair (Media dasar R2 + 10 g/l glukosa (pH 5,2) + 2,5 mg/l 2.4-D + 100 μM acetosyringone) yang mengandung Agrobacterium tumefaciens (strain Agl-1) yang mengandung plasmid pCambia1301-35S::OsDREB1A. Kalus kemudian ditanam pada media kokultivasi padat (Media dasar R2 + 10 g/l glukosa (pH 5,2) + 3g/l phytagel + 2,5 mg/l 2.4-D + 100 μM acetosyringone) dan diinkubasi selama tiga hari dalam keadaan gelap pada suhu 25oC. Kalus yang segar dipindahkan ke media seleksi 16 (Media dasar R2 + 30 g/l glukosa (pH 6,0) + 3g/l phytagel + 2,5 mg/l 2.4-D + 400 mg/l cefotaxime + 100 mg/l vancomycine + 50 mg/l hygromycine), kemudian diinkubasikan dalam ruang gelap (28oC) selama dua minggu dan disubkultur pada media dan kondisi tumbuh yang sama selama 2 minggu. Kalus yang embriogenik dipindahkan ke dalam media induksi embrio (Media dasar LS + 30 g/l sukrosa (pH 5,8) + 100 ml/l air kelapa + 3g/l phytagel + 2,5 mg/l 2.4-D + 400 mg/l cefotaxime + 100 mg/l vancomycine + 50 mg/l hygromycine) dan diinkubasi dalam ruang gelap (28oC) selama dua minggu. Regenerasi Tanaman. Kalus embriogenik yang terseleksi dipindahkan pada media regenerasi embrio (Media dasar LS + 40 g/l sukrosa (pH 5,8) + 3g/l phytagel + 0,5 mg/l IAA + 0,3 mg/l BAP + 400 mg/l cefotaxime + 100 mg/l vancomisin + 50 mg/l higromisin) dan diinkubasikan dalam ruang kultur dengan cahaya kontinyu selama dua minggu pada suhu 25oC. Kalus yang ada bercak hijau disubkultur pada media yang sama. Kalus yang sudah tumbuh daun/tunas sepanjang minimal sekitar 1 cm disubkultur pada media perakaran (Media dasar LS + 30 g/l sukrosa (pH 5,8) + 3 g/l phytagel, diautoklaf + 40 g/l higromisin). Planlet disimpan dalam ruang kultur dengan cahaya kontinyu pada suhu ruang (280C). Aklimatisasi Tanaman. Planlet (tunas) yang berakar dan tinggi tajuk minimal 5 cm dipindahkan ke media air selama satu minggu dan disimpan pada suhu ruang. Planlet selanjutnya dipindahkan ke media tanah dalam bak plastik untuk pembibitan selama dua sampai tiga minggu. Bibit tanaman padi dipindahkan pada media tanah dalam ember dirumah kaca dan dipelihara sampai menghasilkan biji. Pengamatan dilakukan terhadap tinggi tanaman, jumlah anakan, panjang malai, jumlah gabah. Analisis Molekuler dengan Teknik PCR Isolasi DNA yang berasal dari serbuk daun muda tanaman padi berdasarkan prosedur Shure et al. (1983). DNA hasil isolasi diuji integritasinya dengan elektroforesis dan diukur konsentrasinya menggunakan spektrofotometer. Selanjutnya DNA diencerkan dengan ddH2O untuk mencapai konsentrasi 10 ng/μl. Campuran reaksi ( 2µl buffer PCR + 1,2 µl MgCl2 + 0,4 µl DNTPs + 2 µl primer mix HPT + 0,16 µl Taq DNA polimerase + 9,24 µl ddH2O + 5 µl sampel 17 DNA) diamplifikasi menggunakan mesin PCR. Profil suhu yang digunakan adalah predenaturasi 94 oC selama 5 menit, dilanjutkan dengan 35 siklus meliputi pemisahan (denaturation) pada suhu 94oC selama 1 menit, penempelan primer (annealing) pada suhu 55oC selama 1 menit, pemanjangan primer (extension) pada suhu 72 oC selama 2 menit. Pada tahap akhir PCR dilakukan pemanjangan akhir pada 72 o C selama 5 menit. Produk amplifikasi diseparasi pada elektrofloresis gel agarose. Fragmen-fragmen DNA pada gel agarose direndam dalam larutan ethidium bromida dan divisualisasi menggunakan Chemidoc gel system. Hasil Penelitian Plasmid pCambia 1301 yang mengandung 35S::OsDREB1A berukuran sekitar 12,6 kb. Pemotongan plasmid tersebut menggunakan enzim EcoRI dihasilkan dua fragmen yang berukuran 11 kb dan 1,6 kb, yang masing-masing adalah vektor biner bakcbone pCambia 1301 dan kaset pr35S:OsDREB1A::T35S ( Gambar 6). Konfirmasi ini bertujuan untuk memastikan bahwa plasmid yang akan digunakan untuk transformasi sudah benar. Gambar 5. Profil plasmid pCambia 1301 (11 kb) dan pr35S::OsDREB1A::T35S (1,6 kb) yang digunakan untuk transformasi Transformasi dilakukan sebanyak tiga kali dengan jumlah eksplan yang sama untuk setiap periodenya. Jumlah kalus embriogenik, jumlah planlet, dan jumlah tanaman padi putatif transgenik (T0) yang dihasilkan untuk setiap periode transformasi ditampilkan pada Tabel 1. 18 Tabel 1. Hasil transformasi dan regenerasi tanaman padi varietas Nipponbare putatif transgenik (T0) dengan menggunakan 35S::OsDREB1A Transformasi periode 1 (B) 2 (C) 3 (D) Total Jumlah Eksplan Jumlah kalus embriogenik Jumlah planlet 200 200 200 600 133 (66,50%) 152 (76,00%) 105 (52,50%) 390 (65,00%) 67 (63,50%) 81 (40,50%) 57 (23,50%) 205 (34,17%) Jumlah tanaman padi putatif transgenik (T0) 27 (13,50%) 35 (17,50%) 19 (9,50%) 81 (13,50%) Semua tanaman padi transgenik (T0) dianalisis secara molekuler menggunakan PCR dengan primer HPTII. Hasil analsis memperlihatkan bahwa semua tanaman padi transgenik menunjukkan adanya pita DNA berukuran 500 bp yang merupakan ukuran pita DNA yang diharapkan (Gambar 6). M 1 2 3 4 5 6 7 8 9 10 11 12 13 14 K+ K‐ 1000bp 500bp Gambar 6. Hasil amplifikasi PCR DNA 14 genotipe tanaman padi Nipponbare putatif transgenik (T0) dengan menggunakan primer HPTII. Tinggi tanaman padi transgenik (T0) yang berasal dari kultur jaringan pada umumnya lebih rendah dari padi Nipponbare non-transgenik yang berasal dari biji (Gambar 7). Tanaman padi transgenik pada umumnya inferior dibanding tanaman padi non-transgenik untuk karakter-karakter komponen hasil, seperti panjang malai, jumlah malai per rumpun jumlah gabah isi per rumpun, persentase gabah hampa per rumpun, dan jumlah gabah total per rumpun (Gambar 8 – 10). Gambar 7. Distribusi frekuensi tinggi tanaman padi transgenik (T0) 19 Gambar 8. Distribusi frekuensi rerata panjang malai per rumpun dan jumlah malai per rumpun tanaman padi transgenik (T0) Gambar 9. Distribusi frekuensi jumlah gabah isi per rumpun dan persentase gabah hampa per rumpun tanaman padi transgenik (T0) Gambar 10. Distribusi frekuensi jumlah gabah total per rumpun tanaman transgenik (T0) Pembahasan Induksi kalus yang berasal dari biji padi varietas Nipponbare dilakukan untuk menghasilkan kalus sebagai bahan transformasi (Gambar 11a). Kalus yang telah ditransformasi dengan gen 35S::OsDREB1A ditanam pada media seleksi yang mengandung higromisin dan mengalami perubahan warna menjadi coklat dan putih (Gambar 11b). 20 a b Gambar 11. Induksi dan seleksi kalus padi Nipponbare. a. Induksi kalus padi Nipponbare b. Kalus padi pada media seleksi Kalus yang berwarna putih berkembang semakin membesar, kemudian dipindahkan pada media regenerasi dan berkembang menjadi planlet yang memiliki tunas dan akar (Gambar 12a). Planlet selanjutnya dipindah ke media perakaran yang mengandung 40 mg/l higromisin dengan tujuan untuk memperkuat perakaran dan sebagai tahap akhir seleksi. Planlet yang akarnya berwarna putih pada media ini menunjukkan bahwa planlet tersebut benar-benar transgenik, sedangkan berwarna coklat merupakan planlet non transgenik yang lolos seleksi (Gambar 12b). a b Gambar 12. Regenerasi kalus padi Nipponbare. a. Kalus padi dalam media regenerasi b. Planlet padi dalam media perakaran Jalur regenerasi tanaman yang digunakan dalam penelitian ini adalah embriogenesis somatik yang memiliki keuntungan bahwa tanaman transgenik yang dihasilkan berasal dari satu sel tunggal yang tertransformasi, sehingga mencegah terjadinya khimera. Hal ini berbeda dengan jalur organogenesis, dimana tanaman transgenik berasal dari kumpulan sel yang sebagian tertransformasi dan sebagian tidak. 21 Jumlah kalus embriogenik yang dihasilkan untuk setiap periode transformasi berbeda, demikian juga untuk jumlah planlet maupun tanaman putatif transgenik. Kalus embriogenik yang dapat menjadi plantlet dan akhirnya menjadi tanaman transgenik pada semua periode transformasi cenderung menurun. Jumlah tanaman transgenik yang dihasilkan berkisar 9,5 – 17,5% (Tabel 1), variasi ini mungkin disebabkan oleh kualitas eksplan yang digunakan. Hasil amplifikasi PCR semua sampel DNA padi transgenik yang dianalisis menggunakan primer HPTII (Gambar 6) menunjukkan bahwa semua sampel yang dianalisis menghasilkan fragmen atau pita DNA berukuran 500 bp. Kaset pr35S::HPTIIT35S terletak lebih dekat dengan Left Border dibanding kaset pr35S::OsDREB1A::T35S pada plasmid biner yang ditransformasi ke kalus padi. Karena integrasi T-DNA dimulai dari Right Border dan diakhiri pada Left Border, apabila kaset pr35S::HPTII::T35S terintegrasi dalam genom padi maka kemungkinan besar kaset pr35S::OsDREB1A::T35S juga sudah terintegrasi dalam genom, kecuali terjadi delesi yang cukup panjang mulai dari Right Border sampai kaset pr35S::OsDREB1A::T35S yang kemungkinannya sangat kecil. Pada tanaman transgenik yang memberikan hasil amplifikasi yang diharapkan pada PCR menggunakan primer HPTII kemungkinan besar juga mengandung 35S::OsDREB1A. Tanaman padi transgenik Nipponbare 35S::OsDREB1A generasi T0 pada umumnya lebih pendek dan menunjukkan keragaan yang lebih jelek untuk karakter-karakter komponen hasil dibanding tanaman Nipponbare non-transgenik yang ditanam dari biji. Kekerdilan dan keragaan yang lebih jelek ini mungkin disebabkan oleh pengaruh dari over-ekspresi gen OsDREB1A dengan promoter kuat 35S, barangkali karena ekspresi terus-menerus dari OsDREB1A mengaktifkan ekspresi yang kuat secara terus-menerus dari gen-gen target yang menyebabkan energi tanaman terkuras sehingga mempengaruhi pertumbuhan tanaman. Namun hal ini masih perlu dikonfirmasi pada generasi T1, mengingat proses transformasi tanaman menyebabkan jaringan tanaman mengalami cekaman selama periode infeksi Agrobacterium maupun selama periode seleksi pada media kultur jaringan, yang biasanya menyebabkan tanaman transgenik generasi T0 menunjukkan pertumbuhan yang terhambat. 22 Simpulan 1. Gen 35S::OsDREB1A dapat ditransformasikan ke genom padi Japonica Nipponbare dengan A. tumefaciens dan seleksi higromisin. 2. Diperoleh 81 genotipe padi Nipponbare transgenik yang mengandung gen OsDREB1A berdasarkan analisis PCR menggunakan primer HPTII 3. Secara umum tanaman padi putatif transgenik generasi T0 menunjukkan kekerdilan dan keragaan yang lebih jelek untuk karakter-karakter komponen hasil dibanding tanaman padi Nipponbare non-transgenik. Daftar Pustaka Dubouzet JG, Sakuma YZY, Ito YY, Kasuga M, Dubouzet EG, Miura ZS, Seki M, Shinozaki K, and Shinozaki KY. 2003. OsDREB genes in rice, Oryza sativa L., encode transcription activators that function in drought-, highsalt- and cold-responsive gene expression. Plant 33: 751–763 Gilmour SJ, Zarka DG, Stockinger EJ, Salazar MP, Houghton JM, and Thomashow MF. 1998. Low temperature regulation of the Arabidopsis CBF family of AP2 transcriptional activators as an early step in coldinduced COR gene expression. Plant J. 16: 433–442 Greco R, Ouwerkerk PBF, Taal AJC, Favalli C, Beguiristan T, Puigdomenech P, Colombo L, Hoge JHC, Pereira A. 2001. Early and multiple A transposition in rice suitable for efficient insertion mutagenesis. Plant Molecular Biology. 67(1): 16-37. Hsieh TT, Lee J-t, Chang Y-y, and Chan MT. 2002. Tomato Plants Ectopically Expressing Arabidopsis CBF1 Show Enhanced Resistance to Water Deficit Stress. Plant Physiology 130: 618–626. Ito Y, Katsura K, Maruyama K, Taji T, Kobayashi M, Seki M, Shinozaki K, and Yamaguchi-Shinozaki K. 2006. Functional Analysis of Rice DREB1/CBFtype Transcription Factors Involved in Cold-responsive Gene Expression in Transgenic Rice. Plant Cell Physiol. 47(1):141-163 Kasuga M, Liu Q, Miura S, Yamaguchi-Shinozaki K, and Shinozaki K. 1999. Improving plant drought, salt, and freezing tolerance by gene transfer of a single stress-inducible transcription factor. Nature Biotechnology 17: 287291 23 Liu Q, Kasuga M, Sakuma Y, Abe H, Miura S, Yamaguchi-Shinozaki K, Shinozaki K. 1998. Two transcription factors, DREB1 and DREB2, with an EREBP/AP2 DNA binding domain separate two cellular signal transcription pathways in drought- and low-temperature-responsive gene expression, recspectively, in arabidopsis. Plant Cell 10: 1931-1406. Mulyana NS. 2010. Over-ekkspresi gen OsDREB1A (Oryza sativa DehydrationResponsive Element Binding protein 1A) untuk perbaikan sifat toleran kekeringan pada tanaman tembakau (Nicotiana tabacum L.) (skripsi). Universutas Gajah Mada. Oh, S-J, Song SI, Kim YS, Jang H-J, Kim SY, Kim M, Kim Y-K, Nahm BH, and Kim J-K. 2005. Arabidopsis CBF3/DREB1A and ABF3 in transgenic Rice increased tolerance to abiotic stress without stunting growth. Plant Physiology Preview 11 p. Pellegrineschi A, Reynolds M, Pacheco M, Brito RM, Almeraya R, YamaguchiShinozaki K, and Hoisington D. 2004. Stress-induced expression in wheat of the Arabidopsis thaliana DREB1A gene delays water stress symptoms under greenhouse conditions. Genome 47:493-500. Shinozaki K, Yamaguchi-Shinozaki K. 2004. Plant response to stress: regulation of plant gene expression to drought. Encyclopedia of Plant and Crop Science. DOI:10.1081/E-EPCS 120010660, Marcel Dekker, Inc. New York. Pp 99-101. Shure M, Wessler S, and Fedoroff N. 1983. Molecular identification and isolation of the Waxy locus in Maize. Cell 35:225-233. Song J, Bradeen JM, Naess SK, Raasch JA, Wielgus SM, Haberlach GT, Liu J, Kuang H, Austin-Phillips S, Buell CR, Helgeson JP, Jiang J. 2003. Gene RB cloned from Solanum bulbocastanum confers broad spectrum resistance to potato late blight. Proc Natl Acad Sci US' 100:9128-9133.