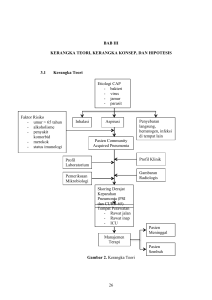
BAB II Tinjauan Pustaka
advertisement

II. TINJAUAN PUSTAKA II.1 Ciri-ciri Morfologi Macaca fascicularis II.1.1 Klasifikasi dan Morfologi Menurut Lang (2006) taksonomi monyet ekor panjang (Macaca fascicularis) sebagai berikut : Kelas : Mamalia Ordo : Primata Sub Ordo : Anthropoidea Infra Ordo : Catarrhini Super Famili : Cercopithecoidea Famili : Cercopithecidae Genus : Macaca Spesies : Macaca fascicularis Sub Spesies : M. f. atriceps, M. f. aurea, M. f. condorensis, M. f.fascicularis, M. f. fusca, M. f. karimondjawae, M. f. lasiae, M. f. philipines, M. f. tua, M. f. umbosa. Monyet ekor panjang sering disebut juga long-tailed macaque, crab eating monkey, dan cinomolgus monkey. Nama lokal monyet ekor panjang di berbagai daerah di Indonesia adalah Cigaq (Minangkabau), Karau (Sumatera), Warik (Kalimantan), Warek (Dusun), Bedes (Tengger), Ketek (Jawa), Kunyuk (Sunda), Motak (Madura) dan Belo (Timor) (Supriatna dan Wahyono 2000). Monyet ekor panjang (Macaca fascicularis) adalah satwa primata yang menggunakan kaki depan dan belakang dalam berbagai variasi untuk berjalan dan berlari (quandrapedalisme), memiliki ekor yang lebih panjang dari panjang kepala dan badan. Disamping itu memiliki bantalan duduk (ischial sallosity) yang melekat pada tulang duduk (ischial) dan memiliki kantong makanan di pipi (cheek pouches) (Napier and Napier 1985). Lekagul and McNeely (1988) juga menjelaskan Macaca fascicularis dinamakan monyet ekor panjang karena memilki ekor yang panjang, dan berkisar antara 80% hingga 110% dari total panjang kepala dan tubuh. Ukuran panjang badan dan kepala 360-508 mm, ekor 450-630 mm, kaki belakang 120-155 mm, 5 telinga 30-45 mm, bobot 2400-6500 gram (Suyanto, 2002). Monyet ekor panjang dapat dilihat pada Gambar 1. Gambar 1. Monyet Ekor Panjang (Macaca fascicularis) Sumber: NBII (2009) Supriatna dan Wahyono (2000) menyatakan bahwa monyet ekor panjang (Macaca fascicularis) memiliki panjang tubuh berkisar antara 385 mm hingga 668 mm. Bobot tubuh jantan dewasa berkisar antara 3,5 kg hingga 8,0 kg, sedangkan bobot tubuh rata-rata betina 3 kg. Smith dan Mangkoewidjojo (1988) menyatakan bahwa monyet jantan dewasa mempunyai bobot badan berkisar antara 5,5 kg hingga 10,9 kg dan betina antara 4,3 kg hingga 10,6 kg Monyet ekor panjang (Macaca fascicularis) mempunyai dua warna utama yaitu coklat keabu-abuan dan kemerah-merahan dengan berbagai variasi warna menurut musim, umur dan lokasi (Lekagul and McNeely 1988). Napier and Napier (1985) secara umum menyatakan warna bulu monyet ekor panjang (Macaca fascicularis) agak kecoklatan sampai abu-abu, pada bagian punggung lebih gelap dibanding dengan bagian perut dan dada, rambut kepalanya pendek tertarik kebelakang dahi, rambut-rambut sekeliling wajahnya berbentuk jambang yang lebat, ekornya tertutup bulu halus. II.1.2 Pemanfaatan Macaca fascicularis Satwa primata adalah salah satu sumber daya alam yang memiliki peranan penting dalam kehidupan manusia. Hal ini disebabkan karena secara anatomis dan fisiologis satwa primata memiliki kemiripan dengan manusia dibandingkan 6 dengan hewan model lainnya (Sajuthi et al. 1993). Menurut Sulaksono (2002), bahwa variasi nilai rujukan parameter faal Macaca fascicularis menurut sentra hewan dan jenis kelamin, masih dalam batas yang dapat ditolerir untuk hewan percobaan yang dipelihara dengan kondisi pemeliharaan konvensional, sehingga dengan demikian para peneliti Indonesia yang menggunakan kera sebagai model penelitiannya dapat menggunakan nilai rujukan tersebut sebagai salah satu referensinya. II.1.3 Habitat Pemeliharaan monyet sebagai hewan penelitian harus memenuhi persyaratan yang telah diatur oleh sebuah komisi kesejahteraan hewan. Menurut Moss (1992) kesejahteraan dalam arti luas yaitu menyangkut masalah fisik atau mental dari hewan dan dapat bertingkah laku sesuai dengan kebiasaannya di alam bebas. Komisi kesejahteraan memperhitungkan keselamatan hewan, orang disekitarnya dan kemungkinan terjadi kecelakaan kerja. Komisi tersebut memutuskan yang terbaik bagi hewan yaitu mendapat cukup kebebasan dalam bergerak tanpa kesulitan berputar, merawat diri, berdiri, berbaring dan merengangkan badan. Komisi ini juga mempertimbangkan keadaan pakan yang diberikan. Hewan harus terbebas dari rasa lapar dan haus. Habitat monyet ekor panjang (Macaca fascicularis) tersebar mulai dari hutan hujan tropika, hutan musim sampai hutan rawa-mangrove, dan di hutan iklim sedang (Cina dan Jepang) (Napier and Napier 1985). Supriatna dan Wahyono (2000) menyatakan bahwa monyet ekor panjang (Macaca fascicularis) hidup pada habitat hutan primer dan sekunder mulai dari dataran rendah sampai dataran tinggi sekitar 1.000 m di atas permukaan laut. Pada umumnya, habitat asli Macaca fascicularis selalu berada disepanjang lembah yang berbatasan dengan air, baik di daratan terbuka maupun pinggiran sungai ataupun hutan, sehingga monyet ekor panjang ini dapat menyesuaikan diri pada semua peringkat ekologi (Ecologically diverse). Aktivitas fisik monyet ekor panjang ini secara teratur dimulai dari matahari terbit hingga tenggelam lagi, hidupnya berkelompok dengan jumlah kelompok sekitar 20 – 50 ekor dan selalu berpindah-pindah mengikuti ketersediaan pakan. Dengan menilik habitat aslinya diatas tadi, kemungkinan suhu 7 yang cukup baik bagi kehidupan Macaca fascicularis berkisar diantara 25-27°C. Namun, perubahan suhu yang tidak menentu disaat sekarang ini menyebabkan kondisi lingkungan bagi Macaca fascicularis tidaklah nyaman serta pakan yang diperoleh dialam juga semakin menipis akibat dari kerusakan alam yang dilakukan oleh manusia yang tidak bertanggungjawab. Menurut Napier and Napier (1985), habitat dan penyebarannya ditentukan oleh beberapa hal yang dibutuhkan untuk bertahan hidup yaitu sumber makanan, sungai atau mata air, dan pohon untuk tidur dan beristirahat. Keterbatasan sumber makanan dan minuman menyebabkan kemungkinan adanya daerah tertentu yang merupakan daerah jelajah dari dua kelompok atau lebih. Perkelahian kelompok sering terjadi untuk memperebutkan wilayah jelajah tersebut. Kandang monyet harus dipertimbangkan untuk keperluan tingkah laku, emosi, dan sosial. Monyet ekor panjang (Macaca fascicularis) tidak boleh dikandangkan sendirian dan terpencil, karena akan menimbulkan suatu bentuk cekaman yang mengganggu proses tingkah laku dan fisiologi normal (Smith dan Mangkoewidjojo 1988). Satwa primata harus dikandangkan di ruang atau daerah sejauh mungkin dari kandang hewan lain. Syarat ini untuk mengurangi resiko penularan penyakit dan keamanan dalam memelihara (Smith dan Mangkoewidjojo 1988). Kandang monyet harus dibuat dengan konstruksi yang kuat untuk mencegah terjadinya kerusakan yang disebabkan dari monyet itu sendiri. Jenis kandang kelompok yang terbuat dari ram kawat perlu dilengkapi tempat peristirahatan yang agak tinggi dan bentuknya harus memadai. Kandang individu harus dilengkapi dinding belakang geser (kandang jepit), sehingga monyet dapat didorong ke bagian depan kandang. Fungsi kandang tersebut untuk mempermudah dalam melakukan pemeriksaan, pemberian obat atau penyuntikan dan penanganan lain yang harus dilakukan terhadap monyet tersebut. Setiap jenis kandang baik kandang kelompok maupun kandang individu harus dilengkapi dengan tempat makan dan minum yang memadai dan cukup kuat (Sajuthi 1984). 8 II.2 Parameter Fisiologis Macaca fascicularis II.2.1 Glukosa Glukosa merupakan hasil akhir dari pencernaan karbohidrat dalam saluran pencernaan. Fungsi utama karbohidrat adalah sebagai bahan bakar utama untuk oksidasi dan menyediakan energi untuk proses metabolisme. Bila karbohidrat yang masuk ke dalam tubuh lebih banyak daripada yang digunakan untuk menyediakan energi, maka kelebihannya dengan segera akan disimpan dalam bentuk glikogen yang disimpan dalam hati dan otot. Apabila masih terdapat kelebihan karbohidrat, maka karbohidrat akan diubah menjadi trigliserida dan kemudian disimpan di dalam jaringan adiposa (Guyton and Hall 1993). Jumlah glukosa yang diambil dan dilepaskan oleh hati dan dipergunakan oleh jaringan-jaringan perifer tergantung dari keseimbangan fisiologis dari beberapa hormon. Hormon-hormon ini dapat diklasifikasikan sebagai 1) hormon yang merendahkan kadar glukosa darah yaitu, insulin 2) hormon yang meningkatkan kadar glukosa darah yaitu, glukagon, epinefrin, glukokortikoid dan hormon pertumbuhan. Insulin disekresikan oleh sel beta pulau Langherhans pankreas. Sedangkan hormon yang meningkatkan kadar glukosa darah, antara lain 1) Glukagon yang disekresikan sel alpha pulau Langherhans pankreas, 2) Epinefrin yang disekresikan oleh medula adrenal dan jaringan kromafin, 3) Glukokortikoid yang disekresikan oleh korteks adrenal, dan 4) hormon pertumbuhan yang disekresikan oleh kelenjar hipofisis anterior. Hormon yang meningkatkan glukosa membentuk suatu mekanisme counter–regulator yang mencegah timbulnya hipoglikemia akibat pengaruh insulin (Wilson and Price 1995). Organ hati, jaringan ekstrahepatik dan hormon berperan untuk mempertahankan kadar glukosa dalam darah agar tetap stabil (Girindra 1988). Pengaturan konsentrasi gula darah sangat erat hubungannya dengan hormon insulin dan hormon glukagon yang dihasilkan oleh pankreas. Kecepatan pengangkutan glukosa juga dengan pengangkutan beberapa monosakarida lain ditingkatkan oleh insulin, kecepatan pengangkutan glukosa ke dalam sebagian besar sel meningkat sampai 10 kali lipat atau lebih dibandingkan kecepatan pengangkutan bila insulin tidak disekresikan (Guyton and Hall 1996). Pengaruh 9 konsentrasi glukosa darah terhadap sekresi glukagon bertentangan dengan efek glukosa terhadap insulin. Glukagon adalah hormon yang disekresikan oleh sel alpha pankreas, apabila konsentrasi gula darah turun sangat rendah, glukagon merangsang pembentukan siklik AMP terutama di dalam sel-sel hati. Pengaruh utama glukagon adalah mengubah glikogen hati menjadi glukosa dan melepaskannya ke dalam darah (Guyton and Hall 1996). Masuknya glukosa ke dalam darah setelah makan akan meningkatkan kadar glukosa darah menyebabkan insulin diekskresikan dengan cepat yang menyebabkan absorb glukosa untuk kemudian disimpan di hati dalam bentuk glikogen. Mekanisme insulin menurut Guyton and Hall 1993 yang menyebabkan absorb dan penyimpanan glukosa di dalam hati meliputi: 1. Menghambat fosforilase, enzim yang menyebabkan glikogen hati dipecah menjadi glukosa. 2. Meningkatkan ambilan glukosa dari darah oleh sel-sel hati. 3. Meningkatkan aktivitas enzim yang meningkatkan sintesis glikogen. Peningkatan kadar glukosa setelah makan menyebabkan peningkatan pengambilan glukosa oleh hati, otot dan jaringan lemak. Glukosa yang disimpan di dalam hati nantinya akan dikonversi menjadi asam lemak dan asam lemak ini diangkut ke dalam jaringan adiposa. Selain dikonversi menjadi asam lemak, kelebihan glukosa akan ditransportasikan ke dalam sel otot dalam bentuk glikogen otot. Glikogen otot berbeda dengan glikogen hati karena tidak dapat dikonversi kembali menjadi glukosa dan dilepaskan ke dalam cairan tubuh (Guyton and Hall 2008). Ketika masuknya proses penyerapan glukosa dari saluran pencernaan terhenti, maka kadar glukosa darah mulai menurun dan memberi isyarat untuk mengambil proses kebalikan dari mekanisme sekresi hormon pankreas (Linder 1992). Mekanisme pengaturan glukosa darah menurut Ganong 1999, meliputi : a. Fungsi hati sebagai buffer glukosa, yaitu apabila glukosa darah meningkat setelah makan menjadi konsentrasi yang sangat tinggi maka kecepatan sekresi insulin juga meningkat. Sebanyak duapertiga glukosa diabsorbsi oleh usus dan segera disimpan dalam hati dalam bentuk glikogen, maka hati melepaskan glukosa ke dalam darah. 10 b. Fungsi insulin dan glukagon sebagai umpan balik terpisah dan sangat penting untuk mempertahankan konsentrasi glukosa darah yang normal. c. Pada keadaan hipoglikemia efek glukosa darah yang rendah pada hipotalamus akan merangsang susunan saraf simpatis. Sebaliknya epinefrin yang disekresikan oleh kelenjar adrenal menyebabkan pelepasan glukosa lebih lanjut ke hati, hal ini untuk mengatasi hipoglikemia berat. d. Hormon pertumbuhan dan kortisol disekresikan dalam respon terhadap hipoglikemia yang berkepanjangan, yang akan menurunkan kecepatan pengunaan glukosa oleh bagian terbesar sel-sel tubuh. Kadar glukosa darah adalah suatu indikator klinis dari kurang atau tidaknya asupan makanan sebagai sumber energi. Faktor yang menentukan kadar glukosa adalah kesimbangan antara jumlah glukosa yang masuk dan yang dikeluarkan melalui aliran darah. Hal ini dipengaruhi oleh masuknya makanan, kecepatan masuk ke dalam sel otot, jaringan lemak dan organ lain serta aktivitas sintesi glikogen dari glukosa oleh hati (Ganong 1999). Kadar gula darah merupakan refleksi dari keadaan nutrisi, emosi dan fungsi endokrin (Girindra 1988). Pada keadaan kadar glukosa dalam darah menurun maka secara bertahap hati akan mengubah persediaan glikogen menjadi glukosa yang menggantikan glukosa yang berkurang dalam sirkulasi. Setelah glikogen berkurang, tubuh mulai mengubah asam-asam amino dari jaringan otot menjadi glukosa dan energi. Sebelum persediaan asam amino berkurang, tubuh mulai mengurangi lemak yang tersimpan di dalam jaringan hati menjadi asam lemak. Meski termasuk sumber energi, asam lemak tidak dapat diubah menjadi glukosa. Hampir semua sel pada tubuh mampu memetabolisir asam lemak, kecuali sel-sel otak dan sistem saraf pusat yang hanya mengandalkan glukosa darah. Agar tidak terjadi kekurangan energi lebih lanjut pada sistem saraf pusat, hati akan mengubah asam lemak menjadi keton sebagai pengganti glukosa. Biasanya keton mulai diproduksi pada hari ketiga puasa atau pada saat persediaan sudah sangat berkurang. Begitu kadar keton dalam darah meningkat (disebut juga ketosis), otak dan organ-organ lain akan memanfaatkannya sebagai energi (Gunawan 2004). 11 Kadar glukosa plasma pada suatu saat ditentukan oleh keseimbangan antara jumlah glukosa yang masuk ke dalam aliran darah dan yang keluar dari aliran darah. Penentu utama masuknya glukosa ke dalam aliran darah adalah: a. Diet nutrisi yang masuk. b. Kecepatan pemasukan ke dalam sel otot, jarigan adiposa dan organ lain. c. Aktivitas glukostatik hati. Konsentrasi glukosa darah harus dijaga agar tidak terlalu tinggi karena: a. Glukosa sangat berpengaruh terhadap tekanan osmotik cairan ekstraseluler dan apabila meningkat akan menimbulkan dehidrasi selular. b. Konsentrasi glukosa yang tinggi menyebabkan keluarnya glukosa dari urin. c. Keadaan di atas menimbulkan dieresis osmotik oleh ginjal, yang dapat mengurangi jumlah cairan tubuh dan elektrolit yang dapat menimbulkan berbagai macam penyakit (Guyton and Hall 1996). Glukagon dengan konsentrasi abnormal yang sangat besar akan menimbulkan efek, yaitu: a. Meningkatnya kekuatan jantung. b. Meningkatnya sekresi empedu. c. Menghambat sekresi asam lambung (Ganong 1999). II.2.2 Kolesterol Lemak atau lipid merupakan senyawa kimia dalam makanan yang terdiri dari lemak netral (trigliserida), fosfolipid, kolesterol, dan beberapa senyawa lain. Di dalam tubuh, lemak berfungsi sebagai sumber energi yang efisien ketika disimpan dalam jaringan adiposa. Sejumlah kecil lemak dapat dicerna di dalam lambung di bawah pengaruh lipase lambung. Namun, sebagian besar lemak dicerna di dalam usus halus yang dipengaruhi lipase pankreas. Tahap awal pencernaan lemak adalah emulsifikasi lemak oleh asam empedu. Kemudian lemak yang teremulsi tersebut akan dipecah menjadi asam lemak (trigliserida dan fosfolipid), gliserol, dan gliserida (Guyton and Hall 1993). Lemak di hati disintesis dari karbohidrat dan protein yang berlebih. Setelah lemak disintesis dalam hati, lemak ditransport dalam lipoprotein ke seluruh jaringan lemak untuk disimpan (Guyton and Hall 1997). 12 Kolesterol diklasifikasikan ke dalam golongan lemak berkomponen alkohol steroid. Kolesterol sangat larut dalam lemak dan mampu membentuk ester dengan asam lemak. Hampir 70% kolesterol dalam lipoprotein plasma adalah bentuk ester kolesterol. Kolesterol diperoleh melalui dua jalur, yaitu eksogen dan endogen (Guyton and Hall 1997). Kolesterol eksogen yaitu kolesterol yang diperoleh dari hasil absorbs saluran pencernaan setiap hari. Sedangkan kolesterol endogen adalah kolesterol yang diperoleh dari hasil pembentukan dalam sel tubuh. Pada dasarnya kolesterol endogen yang beredar dalam lipoprotein plasma dibentuk oleh hati, tetapi semua sel lain dalam tubuh juga sedikit membentuk kolesterol. Sesuai dengan kenyataan bahwa banyak struktur membran sel terbentuk dari kolesterol. Sebagian kolesterol dalam darah berasal dari hasil sintesis dalam tubuh kurang lebih 1 gram/hari, sedangkan 0,3 gram/hari diperoleh dari makanan (Harper et al. 1988; Clarenburgh 2001; Bachorik et al. 2001). Kolesterol yang bersifat endogen dipengaruhi oleh proses sintesis asam lemak jenuh, lipoprotein, dan energi yang digunakan. Sedangkan kolesterol eksogen dipengaruhi oleh konsumsi kolesterol dalam makanan (Sitopoe 1992; Clarenburgh 2001; Bachorik et al. 2001). Kadar kolesterol juga dipengaruhi oleh faktor individu terhadap kemampuan mensintesis kolesterol serta kemampuan mensekresi sterol dan garam empedu dari tubuh (Harper et al. 1988; Clarenburgh 2001; Bachorik et al 2001). Dalam tubuh kolesterol diabsorbsi oleh usus dan diangkut oleh kilomikron yang kemudian dibawa ke hati untuk dimetabolisme. Dalam hati terjadi peristiwa umpan balik negatif untuk mengatur kolesterol tubuh, bila pemasukan kolesterol dalam diet meningkat maka sintesis menurun, begitu pula sebaliknya (Guyton and Hall 1997). Sekitar satu gram kolesterol dieliminasi dari tubuh setiap hari. Kurang lebih separuhnya akan diekskresikan ke dalam feces setelah dikonversi menjadi asam empedu, sisanya akan diekskresikan sebagai kolesterol. Sejumlah besar kolesterol yang disekresikan ke dalam empedu akan direabsorbsi, dan diyakini bahwa sebagian kolesterol merupakan precursor senyawa sterol feces dari mukosa intestinal. Koprostanol merupakan sterol utama di dalam feces, senyawa ini dibentuk dari kolesterol oleh bakteri yang ada di usus besar. Sejumlah besar ekskresi asam empedu akan direabsorbsi kembali ke dalam sirkulasi portal, 13 kemudian diambil oleh hati untuk diekskresikan kembali ke empedu, keadaan ini dikenal sebagai sirkulasi enterohepatik. Asam empedu atau derivatnya yang tidak direabsorbsi akan diekskresikan ke dalam feces (Harper et al. 2003). Asam empedu primer (asam kolat dan asam kenodeoksikolat) disintesis dari kolesterol. Reaksi 7α-hidroksilasi pada kolesterol merupakan tahap awal pada biosintesis asam empedu, dan reaksi ini membatasi laju pada sintesis asam empedu tersebut. Reaksi tersebut dikatalis oleh enzim mikrosomal yaitu enzim 7α-hidroksilase. Reaksi 7α-hidroksilasi ini memerlukan oksigen, NADPH serta sitrokom P450. Defisiensi vitamin C akan mengganggu pembentukan asam empedu pada tahap 7α-hidroksilasi dan menyebabkan akumulasi kolesterol serta aterosklerosis. Asam empedu primer kemudian akan memasuki getah empedu sebagai konjugat glisin dan taurin. Karena getah empedu mengandung kalium dan natrium dalam jumlah cukup besar, maka asam empedu dan konjugatnya akan membentuk garam empedu. Sebagian asam empedu primer di dalam usus mengalami beberapa perubahan oleh aktivitas bakteri usus. Perubahan ini meliputi reaksi dekonjugasi dan 7α-hidroksilasi yang menghasilkan asam empedu sekunder, yaitu asam deoksikolat dari asam kolat, dan asam litokolat dari asam kenodeoksikolat (Harper et al 2003). Kolesterol diedarkan dalam plasma dalam bentuk lipoprotein, dapat pula dinamakan kompleks antara lipid dengan apoliprotein. Sejumlah kolesterol dalam makanan dapat diserap dalam berbagai bentuk tergantung dari macam-macam spesies dan makanan (Clarenburgh 2001). Kolesterol merupakan prekursor hormon steroid antara lain progesteron, glukokortikoid, mineralokortikoid, androgen dan estrogen, selain itu kolesterol juga sebagai prekursor asam empedu dan vitamin D (Harper et al. 1988; Clarenburgh 2001; Bachorik et al. 2001). Kolesterol merupakan pengatur permeabilitas membran untuk mempertahankan integritas sel tubuh sehingga dapat mencegah penguapan air secara berlebihan pada permukaan kulit. Selain itu kolesterol adalah pembentuk sel otak dan vitamin D (Hutapea 1993; Guyton and Hall 1997; Clarenburgh 2001). 14 II.2.3 Trigliserida Trigliserida atau lemak netral adalah asam organik hidrokarbon sederhana berantai panjang. Trigliserida terbentuk dari suatu ester gliserol, dibentuk oleh reaksi dua molekul asil-lemak-KoA dengan gliserol 3-fosfat membentuk asam fosfatidat, yang mengalami defosforilasi menjadi diasilgliserol. Sebagian besar lemak dan minyak di alam terdiri atas 98-99% trigliserida. Molekul ini kemudian diasilasi oleh molekul ketiga asil-lemak-KoA menjadi triasilgliserol. Apabila terdapat satu asam lemak dalam ikatan dengan gliserol maka dinamakan monogliserol. Fungsi utama trigliserida adalah sebagai penyedia energi. Lemak disimpan di dalam tubuh dalam bentuk trigliserida. Apabila sel membutuhkan energi, enzim lipase dalam lemak akan memecah trigliserida menjadi gliserol dan asam lemak serta melepasnya ke pembuluh darah. Oleh sel-sel yang membutuhkan kemudian dibakar dan menghasilkan energi, karbondioksida dan air yang menggantikan kehilangan air ketika bernafas (Guyton and Hall 1997; Clarenburgh 2001; Bachorik et al. 2001). Oksidasi lemak dapat menghasilkan cukup energi untuk mempertahankan suhu tubuh, untuk sintesis aktif asam amino dan protein, selain untuk aktivitas lain yang membutuhkan energi, seperti transport membran. Selain itu, degradasi trigliserida menjadi glukosa darah, setelah fosforilasi enzimatik menjadi gliserol fosfat dan oksidasinya menjadi dihidroksi aseton fosfat (Clarenburgh 2001). Pada hewan normal, biosintesis dan oksidasi trigliserida terjadi bersamaan dalam keadaan imbang sehingga jumlah lemak dalam tubuh relatif konstan selama jangka waktu panjang, walaupun mungkin terjadi sedikit perubahan dalam jangka waktu pendek, bersamaan dengan waktu berfluktuasinya kalori yang terpakai. Kecepatan biosintesis trigliserida diubah secara drastis oleh aktivitas beberapa hormon. Insulin contohnya, melangsungkan perubahan karbohidrat menjadi trigilserida. Trigliserida juga dapat digunakan sebagai cadangan makanan pada hewan yang tinggal di daerah bersuhu rendah saat hibernasi (Clarenburgh 2001). Hampir seluruh lemak dari diet, dengan pengecualian asam lemak rantai pendek, diabsorbsi dari usus ke dalam limfe. Selama pencernaan sebagian besar trigliserida dipecah menjadi monogliserida dan asam lemak. Kemudian sewaktu melalui sel epitel usus, keduanya disintesis kembali menjadi molekul trigliserida 15 baru yang berkumpul dan masuk ke dalam limfe dalam bentuk droplet kecil yang tersebar yang disebut kilomikron (Guyton and Hall 1997). II.2.4 SGPT (Serum Glutamat Piruvat Transminase) dan SGOT (Serum Glutamat Oksaloasetat Transminase) Aspartate aminotransferase (AST atau SGOT) dan alanine aminotransferase (ALT atau SGPT) adalah enzim-enzim hati yang paling sensitif dan digunakan secara luas mendeteksi kerusakan hati. AST (SGOT) normalnya ditemukan dalam suatu keanekaragaman dari jaringan termasuk hati, jantung, otot, ginjal, dan otak. SGOT dilepaskan kedalam serum ketika satu saja dari jaringan-jaringan ini rusak. ALT (SGPT) normalnya ditemukan sebagian besar di hati. SGPT dilepas ke dalam aliran darah sebagai akibat dari kerusakan hati. Oleh karenanya SGPT digunakan sebagai suatu indikator yang cukup spesifik dari keadaan (status) hati (Guyton dan Hall 1997). SGPT dan SGOT merupakan dua enzim transminase yang dihasilkan terutama oleh sel-sel hati. Bila sel-sel hati rusak, biasanya kadar kedua enzim meningkat. Batasan normal SGOT adalah 5 sampai 40 unit per liter serum (bagian cair dari darah). Sedangkan batasan normal SGPT adalah 7 sampai 56 unit per liter serum. Enzim SGPT berperan dalam deaminasi asam amino, pengeluaran gugus amino dari asam amino (Guyton dan Hall 1997; Hayes 2007). SGPT akan memindahkan gugus amino pada alanin ke gugus keton dari α-ketoglutarat membentuk glutamat dan piruvat. Selanjutnya piruvat akan diubah menjadi laktat. Reaksi tersebut dikatalisasi oleh enzim laktat dehidrogenase (LDH) yang membutuhkan NADH dalam reaksi yang dikatalisasinya. SGOT juga berperan dalam deaminasi asam amino, SGOT mengkatalisasi pemindahan gugus amino pada aspartat ke gugus keton dari α-ketoglutarat membentuk glutamat dan oksaloasetat dan selanjutnya oksaloasetat diubah menjadi malat. Reaksi tersebut dikatalisasi oleh enzim malat dehidrogenase (MDH) yang membutuhkan NADH dalam reaksi ini (Poedjiadi 1994). Secara normal organ mengalami regenerasi sel, termasuk hati. Pada keadaan ini sel yang telah rusak digantikan oleh sel yang baru, jadi pada keadaan normal, keberadaan SGPT dalam darah itu normal, hal tersebut terjadi karena regenerasi sel hati yang secara normal terjadi. 16 GPT α-ketoglutarat + alanin piruvat + NADH + H + piruvat + L-glutamat LDH L-laktat + NAD+ GOT α-ketoglutarat + aspartat oksaloasetat + NADH + H+ L-glutamat + oksaloasetat MDH L-malat + NAD+ Gambar 2. Peran GPT dan GOT dalam Deaminasi Protein Sumber: Poedjiadi (1994) Adanya kerusakan sel-sel parenkim hati atau permeabilitas membran akan mengakibatkan enzim GOT dan GPT, arginase, laktat dehidrogenase, dan γglutamil transminase bebas keluar sel, sehingga enzim masuk ke pembuluh darah melebihi keadaan normal dan kadarnya dalam darah meningkat (Girindra 1986). Namun demikian, indikator yang lebih baik untuk mendeteksi kerusakan jaringan hati adalah SGPT dan SGOT, karena kedua enzim tresebut akan meningkat terlebih dahulu dan peningkatannya lebih drastis dibanding enzim-enzim lainnya (Amin 1995; Callbreath 1992). Oleh karena itu melalui hasil tes laboratorium, keduanya dianggap memberi gambaran adanya gangguan pada hati (Girindra 1986). Oleh karena itu menurut pemaparan di atas faktor yang erat kaitannya dengan perubahan kadar SGPT dan SGOT yaitu laju metabolisme protein, dan laju regenerasi sel, yang mungkin diantaranya dapat dipengaruhi oleh tingkat aktivitas fisik (Girindra 1986, Suarsana et al. 2006). II.2.5 Ureum Ureum merupakan hasil akhir dari metabolisme protein dalam tubuh. Senyawa-senyawa ini harus dikeluarkan dari dalam tubuh secara terus-menerus untuk memastikan terus berlangsungnya metabolisme protein dalam sel (Price 2005). Ureum dihidrolisis di dalam air dengan bantuan urease sehingga dihasilkan amonia dan CO2 (Guyton and Hall 1997). Kadar ureum dalam darah bergantung pada katabolisme (pemecahan) protein dalam hati yang disekresikan ke dalam 17 ginjal dan diekskresikan melalui urin. Ketika air direabsorbsi dari tubulus, konsentrasi ureum dalam tubulus akan meningkat sehingga muncul gradien konsentrasi yang menyebabkan reabsorbsi urea. Ureum tidak bisa memasuki tubulus sebanyak air, sehingga ureum direabsorbsi secara pasif dari tubulus. Ureum yang masih tertinggal akan masuk ke dalam urin untuk akhirnya diekskresikan (Raphael 1987). Ureum dengan kadar tinggi dalam tubuh akan bersifat toksik karena sifatnya yang mendenaturasikan protein (Doxey 1983). Ginjal adalah organ ekskresi utama dalam tubuh yang terletak pada dinding posterior abdomen di luar rongga peritonium. Ginjal memiliki tiga bagian utama yaitu, korteks (bagian luar), medulla, dan pelvis renalis (Guyton 1995). Menurut Price 2005, ginjal merupakan organ penyaring plasma dan unsur-unsur plasma darah, secara selektif ginjal menyerap kembali air dan unsur-unsur berguna dari filtrat kemudian mengekskresi kelebihan dan produk buangan plasma. Menurut Raphael 1987, pembentukan urin dimulai dengan proses filtrasi glomerulus plasma. Aliran plasma ginjal kira-kira 660 ml/menit yang setara dengan sekitar 25% curah jantung. Seperlima dari plasma dialirkan melalui glomerulus ke kapsula Bowman yang dikenal sebagai laju filtrasi glomerulus. Sel-sel darah dan molekul-molekul protein yang besar atau bermuatan negatif secara efektif tertahan oleh seleksi glomerulus, sedangkan molekul berukuran kecil atau bermuatan positif langsung tersaring. Saat filtrat mengalir melalui tubulus ada beberapa zat yang diambil atau ditambahkan ke dalam filtrat sehingga hanya sekitar 1,5 L/hari yang diekskresikan sebagai urin. Ginjal memiliki fungsi yang multipel antara lain sebagai pengatur keseimbangan air dan elektrolit, pengatur konsentrasi osmolitas cairan tubuh, pangatur keseimbangan asam basa, ekskresi produk sisa metabolik dan bahan kimia asing, dan sekresi hormon (Ganong 2003). Guyton 1995 menyebutkan bahwa efek dari gagal ginjal akut atau kronis secara umum dapat berupa edema umum, asidosis, tingginya konsentrasi nitrogen non-protein terutama urea, dan tingginya konsentrasi produk retensi urin lainnya, termasuk kreatinin, asam urat, fenol, basa guanidine, sulfat, fosfat dan kalium. Maka dari itu sangat penting unutuk melakukan pemeriksaan terhadap fungsi normal ginjal. Beberapa indikator 18 pemeriksaan laboratorium ginjal antara lain pemeriksaan kadar kreatinin dan ureum dalam serum darah (Raphael 1987). Ureum selain direabsorbsi secara pasif dari tubulus ternyata juga diabsorbsi ke medulla ginjal dan berperan terhadap 40% osmolaritas interstisium medulla ginjal saat ginjal membentuk urin pekat secara maksimal (Guyton 1995). Mekanisme reabsorbsi ureum ke medulla ginjal, yaitu air mengalir ke cabang asenden ansa Henle dan masuk ke tubulus distal dan tubulus koligentes kortikalis hanya sedikit ureum yang direabsorbsi karena segmen ini impermiabel terhadap ureum. Dengan tingginya konsentrasi ADH, air direabsorbsi secara cepat dari tubulus koligentes kortikalis dan konsentrasi ureum juga meningkat dengan cepat. Selanjutnya, cairan tubulus mengalir ke bagian medulla duktus koligentes sehingga konsentrasi ureum semakin tinggi dan berdifusi ke interstitium ginjal dan pada akhirnya konsentrasi ureum dalam urin tetap tinggi meskipun sebagian telah direabsorbsi. Hal ini meyebabkan kadar ureum normal sangat tinggi dalam urin sedangkan dalam darah kebalikannya (Price 2005). Ureum merupakan produk ekskresi primer dari katabolisme protein yang dibentuk di hati dengan bahan dari amonia dan CO2 melalui proses biokimia yang dikenal dengan siklus Ornithin (Raphael 1987). Gangguan ginjal kronik akan menyebabkan penurunan laju filtrasi glomerulus (fungsi penyaringan ginjal) sehingga kemampuan ginjal menyaring ureum maupun kreatinin juga menurun, akibatnya zat-zat tersebut meningakt jumlahnya dalam darah (Doxey 1983). II.2.6 Kreatinin Kreatinin adalah produk endogenous akhir dari metabolisme kreatin fosfat yang terjadi di dalam otot dan dilepaskan dari otot dengan kecepatan yang hampir konstan serta diekskresikan dalam urin dengan kecepatan yang sama (Guyton and Hall 1997). Ekskresi kreatinin pada setiap individu terkait erat dengan ukuran jaringan otot. Zat ini dijumpai dalam jumlah yang besar di otot dan hadir di darah dan urin dalam jumlah yang sangat kecil dalam kondisi normal. Melalui reaksi dehidrasi dalam otot kreatin akan diubah menjadi kreatinin yang mudah diperfusi ke seluruh cairan tubuh dan diekskresikan melalui urin (Raphael 1987). Kreatinin merupakan sisa metabolisme fosfat otot, 19 keberadaannya dalam tubuh dengan jumlah yang tinggi ataupun rendah dapat memberi dampak buruk bagi tubuh. Peningkatan kadar kreatinin dapat mengakibatkan gagal glomerulonefritis, ginjal dehidrasi, akut dan penurunan kronis, aliran nekrosis darah ke tubular akut, ginjal (syok berkepanjangan, gagal jantung kongestif), leukemia. Kreatinin dalam jumlah rendah dapat mengakibatkan distrofi otot dan myasthenia gravis. (Riswanto 2010). Sisa metabolisme harus diekskresikan melalui ginjal, oleh karena itu jika terjadi peningkatan atau penurunan kadar kreatinin dalam tubuh maka interpretasi klinik akan cenderung pada gangguan fungsi ginjal. Kreatinin diekskresi dalam urin melalui proses filtrasi dalam glomerulus tetapi tidak direabsorbsi di tubulus bahkan sejumlah kecil disekresi oleh tubulus terutama bila kadar kreatinin dalam serum tinggi (Todd and Sanford 2008). Kreatinin dengan bebas melintasi membran glomerulus dan hanya sebagian kecil disekresi ke dalam tubulus nefron. Kreatinin merupakan indeks GFR yang lebih cermat dibandingkan ureum karena kecepatan produksinya sedkit sekali mengalami perubahan daalm massa otot. Oleh karena itu, pada kondisi normal kreatinin dijumpai dalam urin dengan konsentrasi sedikit. Konsentrasi dan ekskresi total harian kreatinin tetap konstan meskipun ada perubahan pola makanan (Frandson 1992). Selain faktor diet, faktor katabolik, jenis kelamin dan aktivitas juga diketahui tidak berpengaruh signifikan terhadap jumlah kreatinin dalam plasma. Akan tetapi kadang dijumpai bahwa kadar kreatinin dalam plasma hewan yang masih muda lebih tinggi jumlahnya daripada hewan dewasa (Doxey 1983). Peningkatan kadar kreatinin dalam darah dapat dipengaruhi berbagai hal. Salah satu diantaranya yaitu gangguan fungsi ginjal sehingga fungsi nefron menurun dan ekskresi kreatinin juga menurun dan pada akhirnya kadar kreatinin dalam plasma akan meningkat (Frandson 1992). II.3 Fisiologi Adaptasi II.3.1 Suhu dan Kelembaban Suhu merupakan suatu keadaan yang menunjukkan kondisi panas atau dingin suatu benda ataupun makhluk hidup. Semakin tinggi panas benda tersebut 20 semakin tinggi suhu benda tersebut. Suhu tubuh makhluk hidup merupakan suhu dalam atau suhu inti di bagian dalam makhluk hidup tersebut. Suhu tubuh normal Macaca fascicularis berada pada kisaran 37ºC sampai dengan 40ºC (Chantalakhana and Skunmun 2002). Suhu tubuh merupakan suhu yang berada di bagian dalam tubuh, atau disebut juga suhu inti. Kondisi suhu tubuh relatif stabil, kecuali jika terjadi gangguan seperti demam. Suhu tubuh bukan suhu permukaan yang mengacu pada suhu kulit atau jaringan di bawah kulit, karena suhu permukaan ini mudah mengalami kenaikan dan penurunan sesuai dengan suhu lingkungan. Namun, kulit merupakan system pengatur radiator panas yang efektif dan aliran darah ke kulit permukaan mekanisme penyebaran panas yang paling efektif dari inti tubuh ke kulit. Tetapi, tidak ada tingkat suhu tubuh yang dapat dianggap normal karena pengukuran pada banyak orang menunjukkan suatu rentang suhu normal. Suhu tubuh dapat bervariasi tergantung kerja fisik dan kondisi lingkungan yang ekstrim (Guyton and Hall 2008). Kelembaban adalah kandungan partikel air di udara. Besaran yang sering dipakai untuk menyatakan kelembaban udara adalah kelembaban nisbi yang diukur dengan higrometer. Kelembaban nisbi adalah perbandingan massa uap air terhadap massa udara kering yang dinyatakan dalam persen. Kelembaban nisbi dapat berubah sesuai tempat dan waktu. Saat siang hari kelembaban nisbi berangsur-angsur turun kemudian meningkat pada sore hingga menjelang pagi hari. Kelembaban berkaitan dengan suhu, semakin rendah suhu umumnya meningkatkan nilai kelembaban. Kelembaban dapat mempengaruhi kecepatan hilangnya panas dari tubuh hewan melalui kulit dan saluran pernafasan (Chantalakhana and Skunmun 2002). Hewan yang diperlakukan pada suhu tinggi dalam waktu yang cukup lama dapat mengalami perubahan pada ketebalan lemak tubuh dan rontoknya bulu (Suprayogi et al. 2006). Suhu dan kelembaban udara yang tinggi menimbulkan perubahan fisiologis dan biokimiawi pada makhluk hidup. Perubahan fisiologis dan biokimiawi ini mengakibatkan proses homeostasis tubuh agar kondisi menjadi normal kembali. Apabila proses homeostasis tidak mampu mengembalikan kondisi normal tubuh maka akan dapat 21 mengubah tingkah laku, metabolisme, aliran darah, respirasi, nafsu makan dan sistem fisiologis lainnya pada makhluk hidup (Suprayogi et al. 2009). II.3.2 Termoregulasi dan Adaptasi Tubuh Proses fisiologis yang dilakukan tubuh untuk menjaga keseimbangan suhu internal tubuh pada kondisi normal disebut termoregulasi. Termoregulasi pada manusia diatur pada hipotalamus anterior. Pengaruh suhu terhadap hewan digolongkan menjadi poikiloterm dan homoioterm. Hewan homoioterm memiliki suhu tubuh lebih stabil, karena adanya reseptor dalam otak yang dapat mengatur suhu tubuh (Swenson 1997). Hewan berdarah panas (homoioterm) merupakan hewan yang dapat menjaga suhu tubuhnya pada suhu yang konstan yang umumnya lebih tinggi dibandingkan suhu lingkungan. Contoh hewan berdarah panas adalah bangsa burung dan mamalia (termasuk Macaca fascicularis). Hewan berdarah dingin adalah hewan yang suhu tubuhnya kurang lebih sama dengan suhu lingkungan (Guyton and Hall 1993). Zona nyaman adalah kondisi nyaman seekor hewan dalam kondisi fisiologis sehingga hewan dapat menjalankan aktivitas hidupnya secara normal (White 2009). Kondisi fisiologis dipengaruhi oleh lingkungan (suhu dan kelembaban lingkungan) dan perilaku hewan tersebut. Keberadaan zona nyaman atau kondisi fisiologis dapat mempengaruhi tingkat metabolik dan produksi hewan. Mekanisme kehilangan panas melalui kulit terjadi melalui konveksi, konduksi, radiasi dan evaporasi. Jika suhu kulit lebih tinggi daripada suhu lingkungan, maka tubuh kehilangan panas melalui mekanisme konveksi, konduksi, radiasi dan evaporasi. Namun, jika suhu lingkungan lebih tinggi daripada suhu kulit, maka tubuh mendapatkan panas melalui makanan dan fermentasi rumen atau sekum yang diatur oleh hormon (tiroksin, hormon pertumbuhan dan glukokortikod) dan aktivitas tubuh (Yousef 1984; Suprayogi et al. 2006). II.3.3 Stres Stres merupakan gejala yang tidak baik berdasarkan keadaan klinis dan fisiologis. Respon tubuh terhadap stres terjadi karena aktivasi sistem saraf dan hormon tertentu. Salah satu penyebab stres adalah suhu lingkungan. Saat stres, 22 akan terjadi stimulasi terhadap hipotalamus yang kemudian akan menskresikan corticotrophin releasing hormone (CRH) yang memberikan sinyal kepada kelenjar hipofisis anterior yang menyebabkan pelepasan sejumlah besar adrenocorticotropin hormone (ACTH) dan kemudian meneruskan stimulasi pada kelenjar adrenal terutama korteks adrenal pada fase fasciculata untuk memproduksi glukokortikoid yang mempresentasikan kortisol untuk disekresi lebih banyak. Efek fisiologis glukokortikoid terhadap metabolisme adalah stimulasi glukoneogenesis oleh hati, mobilisasi asam amino dari jaringan ekstrahepatik sehingga lebih banyak asam amino yang tersedia dalam plasma untuk masuk ke dalam proses glukoneogenesis dalam hati, pengurangan penggunaan glukosa oleh sel dan menekan transpor glukosa ke dalam sel, dan mobilisasi asam lemak dari jaringan adiposa (Guyton and Hall 1993). Hal ini dilakukan oleh tubuh untuk memperoleh tambahan energi. Kondisi stres juga dapat mempengaruhi perilaku, penurunan kecernaan pakan, peningkatan konsumsi air yang pada akhirnya mengakibatkan penurunan bobot badan (Guyton and Hall 2008).