( FLUID THERAPY ) Oleh
advertisement

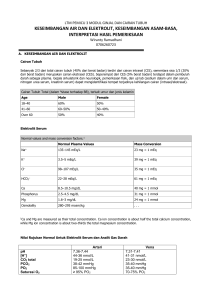
BAB V TERAPI CAIRAN ( FLUID THERAPY ) Oleh : Setyo Budhi Fluid therapy atau terapi cairan meliputi perhitungan tekanan osmotik,elektrolit,asam- bass, dan keseimbangan air. Perhitungan perhitungan ini sering dilakukan secara simultan dengan penggunaan kombinasi berbagai larutan elektrolit dan sering dibarengi dengan larutan nutrien untuk mencegah kerusakan jaringan tubuh hewan. Fluid therapy didasarkan pada pemikiran rasional mengenai perhitungan asambasa dan elektrolit untuk dikembalikan ke nilai normal dari kondisi yang tidak normal. Kesulitan utama pada terapi cairan adalah dalam pemilihan cairan yang tepat dan memberikannya dalam dosis yang tepat . Pada hewan yang sakit ringan penggunaan cairan yang konservatif hasilnya cukup balk, tetapi kelebihan jumlah elektrolit harus dihindari karena lebih banyak merugikan daripada menguntungkan. Pada perubahan elektrolit yang parah,keseimbangan pH dan cairan, data hasil pemeriksaan laboratorium sangat membantu untuk menentukan larutan elektrolit dan dosis yang tepat. pH tubuh dikontrol oleh sejumlah sistem buffer,respirasi dan ginjal. Sistem buffer bereaksi pada perubahan pH secara keseluruhan,sistem respirasi juga bereaksi dalam beberapa menit .tetapi biasanya tidak mampu melakukan koreksi penuh terhadap abnormalitas pH. Ginjal memerlukan beberapa jam untuk bereaksi, tetapi ginjal melakukan yang bertanggung jawab pada penyesuaian akhir pH ke nilai normal. Semua sistem ini berinteraksi, oleh karena itu harus dianggap satu kesatuan, terutama sistem buffer dan respirasi. Sistem sodium bikarbonat-karbondioksida adalah yang paling utama pada plasma. Jumlah karbondioksida terlarut dalam plasma membantu mengontrol kecepatan respirasi dan sebaliknya respirasi mengontrol karbondioksida. Peningkatan CO2 plasma merangsang respirasi lebih cepat dan meningkatkan eliminasi CO2, akibatnya mengurangi jumlah CO2 yang ada di dalam plasma. PH 7,4 terjadi apabila ratio Nabikarbonat terhadap CO2 adalah 20:1. Jika asam atau basa ditambahkan pada plasma mengakibatkan pergeseran pH dan respirasi mengontrol pH dengan mengatur jumlah CO 2 yang dieliminasi sampai pada batas-batas tertentu, terutama mengusahakannya sampai ratio 20:1 dengan Na-bikarbonat. Ratio ini terjadi walaupun jumlah absolut NaCO3 dan CO2mungkin tidak normal. Ratio lebih penting daripada jumlah absolut dalam regulasi pH. Universitas Gadjah Mada 1 Gambar di awah mengilustrasikan efek pemberian asam ke dalam plasma dan interaksinya dengan sistem buffer CO2-bikarbonat Induksi asidosis metabolik memiliki efek sebagai berikut: 1. Asam secara kimia berinteraksi dengan NaHCO3 unutk membentuk CO2 dan garam sodium dari asam itu. 2. Peningkatan CO2 akibat asam ini akan merangsang respirasi yang akan mengurangi CO2 plasma untuk mengembalikan ratio HCO : H2CO3 (atau pCO2) 20:1. 3. Sistem buffer dan respirasi tidak mengembalikan pH secara sempurna ke normal, tapi akan berada dalam batas-batas yang dapat diterima tubuh. Hanya butuh kurang lebih satu jam untuk menetralisir sejumlah asam,tetapi dibutuhkan beberapa jam atau beberapa hari untuk mengembalikan seutuhnya sistem buffer bikarbonat, tergantung parah tidaknya perubahan. Pada scat NaHCO3 dikembalikan ke dalam plasma,respirasi melambat dan CO2 plasma meningkat, dalam beberapa jam atau hari jumlah CO2 dan bikarbonat kembali normal. Universitas Gadjah Mada 2 Gambar 18.1.: Memperlihatkan asam akan berkurang dari bikarbonat(24-3,5). Kompensinya dengan mengurangi H2CO2(1,2-1). Perbandingan H2CO3 dan HCO3 cukup mendekati. tetapi tidak mendekati normal. Asidosis dan alkalosis Dari hasil konvensi, dua tipe abnormalitas pH adalah asidosis metabolik dan asidosis respiratorik, alkalosis metabolik dan alkalosis respiratorik. Tanda klinis dapat digunakan untuk membedakan kondisi ini dan diperkuat dengan data-data laboratorium. Asidosis dicirikan dengan meningkatnya respirasi( polipnea ) dan depresi mental. Tingkat depresi bisa beragam dari ringan sampai koma. PH asam cenderung meningkatkan ionosasi kalsium pada dinding sel dan bercampur dengan jalur sodium dan potasium lewat dinding sel. Secara umum hal ini menekan aktifitas sistem syaraf seperti jaringan yang lain juga. Asidosis respiratorik biasanya bisa dibedakan dari asidosis metabolik dengan adanya beberapa kondisi patologik pada paru-paru. Contoh pneumonia dengan akumulasi cairan,fibrosis, atau kelainan lain yang bisa mengganggu pembuangan CO2. Lesi otak pada pusat pernafasan bisa memperlambat respirasi sehingga mengakibatkan retensi CO2 dan menyebabkan asidosis. Asidosis metabolik umumnya terjadi pada shock,diabetes,penyakit-penyakit ginjal,diare dan penurunan kondisi yang diakibatkan nafsu makan yang menurun. Alkalosis mengakibatkan pengurangan atau penurunan respirasi,gemetar,otot kejang. Efek ini terjadi karena alkalosis menurunkan ionisasi kalsium pada dinding sel yang memungkinkan jalur transportasi potasium dan sodium yang akan mengakibatkan aktifitas sistem syaraf. Pengukuran laboratorium pH, pCO2 dan kadar bikarbonat sangat membantu dalam menentukan diferensial diagnosa dari beberapa tipe alkalosis dan asidosis. Analisa ini sangat penting untuk menentukan perlakuan terhadap abnormalitas pH. Universitas Gadjah Mada 3 Gambar 18.2 menunjukan perubahan umum yang terjadi pada rasio bikarbonat-CO2 selama terjadinya asidosis dan alkalosis. Alkalosis respiratorik. Seperti tampak pada gambar,penurunan level CO2 disebabkan pengeluaran yang berlebihan melalui paru-paru. Ginjal mengkompensasi dengan mengeluarkan lebih banyak sodium bikarbonat dan membuat rasio bikarbonat-CO2 mendekati normal. Kontrol ginjal terhadap bikarbonat secara perlahan-lahan dan mungkin tidak cukup cepat untuk mengatasi penurunan pCO2 Alkalosis respiratorik kemungkinan terjadi ketika pusat syaraf pengendali nafas cukup peka terhadap rangsangan tersebut. Pernafasan yang terlalu cepat mengakibatkan penurunan level CO2 dalam plasma. Akibat alkalosis ditandai terjadinya konvulsi dan koma. Bentuk ringan alkalosis respiratorik sering kali terjadi gejala syaraf, temperatur meningkat, pada anjing yang aktif dengan kecepatan respirasi di atas normal. Pada anjing-anjing pemburu setelah mengalami latihan keras,kadangkala mengalami konvulsi. Hal ini mungkin disebabkan oleh hypocalsemia, defek jantung, anemia dan alkalosis respiratorik. Perubahan kadar CO2 mungkin terjadi jika anjing melawan pada saat pengambilan sampel darah. Kadangkadang penurunan tekanan darah 10 mmHg atau lebih dapat terjadi akibat perlawanan dan pengeluaran CO2. Bentuk latrogenik alkalosis dapat terjadi ketika digunakan anestesi gas karena menekan pernafasan atau pada pernafasan buatan. Jika respirasi terlalu cepat,sebagian besar CO2 dikeluarkan dari tubuh dan akan menyebabkan alkalosis. Pada hewan yang teranestesi, gejala kejang biasanya ditutupi oleh pengaruh anestesi. Alkalosis respiratorik jarang terdiagnosa atau ditangani. Garnbar Perbandingan dari bikarbonat dan CO2 memperlihatkan beberapa tipe alkalosis dan asidosis. Universitas Gadjah Mada 4 Alkalosis metabolik. Perubahan plasma bikarbonat dan CO2 yang terjadi dalam alkalosis metabolik pada anjing adalah hilangnya chlorida tanpa berhubungan dengan hilangnya sodium. Ketika clorida turun,akan digantikan oleh bikarbonat,hal ini meningkatkan bikarbonat, pCO2 dan pH. Anjing mengkompensasi menahan CO2, tetapi hal ini selalu tidak mencukupi. Perbedaan dari berbagai parameter dapat dilihat dengan jelas pada tabel, yang diperoleh dari percobaan defisiensi yang terjadi pada seekor anjing. Tekanan CO2 bikarbonat dan pH akan meningkat pada saat volume respirasi per menit dan clorida menurun. Penurunan ion H+ dan pCO2 menurunkan kecepatan respirasi dan volume per menit. Pernafasan secara perlahan-lahan menyebabkan tertahannya pCO2, tetapi tidak cukup untuk mengkompensasi secara sempurna terhadap penahanan bikarbonat,sehingga pH menurun. Hilangnya clorida terjadi akibat muntah, karena getah lambung banyak mengandung banyak clorida dan sedikit sodium. Hilangnya cairan ini menghilangkan plasma clorida dan menyebabkan alkalosis metabolik. Hilangnya chlorida terjadi pada muntah yang bersamaan dengan gastroenteritis,namun demikian jika diare juga terjadi,kehilangan sodium juga akan terjadi dan menurunkan derajat alkalosis. Diare berat dengan muntah sedang dapat menyebabkan asidosis karena hilangnya sodium yang relatif banyak. Penyumbatan pylorus dan bersamaan dengan muntah berat selalu menyebabkan hilangnya clorida sangat hebat dan mengakibatkan alkalosis. Diuretika seperti furosemid dengan dosis 20-30 mg/kgBB dapat menyebabkan kehabisan chlorida dan terjadinya alkalosis pada anjing,terutama ketika bersamaan dengan penyebab hilangnya chiorida yang lain. Perlu diperhatikan penggunaan diuretika dalam waktu lama dapat menimbulkan kerusakan karena kongesti hepar. Hilangnya volume plasma merupakan faktor penting penyebab alkalosis metabolik. Tubuh berusaha untuk mengembalikan volume plasma yang hilang dengan menahan bikarbonat. Pengamatan pada anjing yang mengalami metabolik alkalosis menunjukkan bahwa pemberian infus yang mengandung plasma protein akan menaikan protein plasma, menyebabkan penambahan ekresi sodium bikarbonat dan menurunkan derajat metabolik alkalosis. Defisiensi potasium telah diketahui sebagai faktor penyebab terjadinya alkalosis metabolik,hal ini mungkin benar pada tikus dan manusia. Penelitian pada anjing menunjukkan bahwa kehabisan potasium benar-benar menyebabkan asidosis . Universitas Gadjah Mada 5 Asidosis respiratorik. Asidosis respiratorik terjadi bila ada gangguan transportasi karbondioksida melintasi paru-paru,meningkatnya tekanan CO2(pCO2) plasma dan akibat pH asam. Edema respirasi terjadi pada chronic heart failure( gagal jantung kronis ) dan akumulasi cairan pada kasus pneumonia akan menghalangi transfer CO2. Edeme respiratori mungkin terjadi karena ypovolemik shock,reaksi alergi,anaphilactic shock dan iritasi toksik. Abnormalitas paru-paru kadang sulit terdeteksi dan dibutuhkan pemeriksaan laboratorium untuk membuat diagnosa. pH plasma pada lambung asam akan kurang dari 7,35. pCO2 akan lebih dari 45mEq/L dan bikarbonat lebih dari 25 mEq/L(Tabel 18.2). Pada kenyataanya suatu kejadian asidosis menimbulkan pCO2 dan nilai bikarbonat plasma yang berbeda antara respirasi dan metabolik asidosis. Nilai keduanya tinggi pada asidosis respiratorik dan rendah pada asidosis metabolik. Tabel 18.1. Efek pengurangan clorida pada anjing. pCO2 mmHg Bikarbonat mEq/L pH Volume per menit L/min Clorida mEq Kontrol 37 23,9 7,44 2,89 115 Pengurangan Clorida 47 38,3 7,53 2,30 85 Terapi untuk penyembuhan penyakit paru-paru, pertama kadang-kadang diberikan sodium bikarbonat untuk mengurangi asidosis,tetapi ini bisa berbahaya karena ketika NaHCO3 bergabung dengan asam terbentuk CO2 dan ini harus dikeluarkan lewat paru-paru. Asidosis metabolik. Asidosis metabolik ada beberapa tingkatan yang berhubungan dengan beberapa penyakit. Dapat dikatakan bahwa beberapa penyakit selalu menyebabkan asidosis ringan. Asidosis mungkin agak berat pada shock ,diabetes mellitus, penyakit ginjal atau diare. Terapi dari asidosis seringkali berhasil balk sebab dapat memperbaiki kondisi hewan sehingga gejala klinis penyakit kadang dapat tertutupi walaupun penyebab primer masih ada. Asidosis metabolik terjadi kalau kuantitas asam berlebihan masuk dalam darah akan menetralkan sodium bikarbonat(Tabel 18.1 dan 18.2). Reduksi bikarbonat dalam Universitas Gadjah Mada 6 plasma yang diikuti penurunan pCO2 adalah karakteristik. Tekanan CO2 yang menurun akan meningkatkan H+ yang berhubungan dengan kondisi asidosis. Pusat respirasi sensitif terhadap H+ dan menyebabkan ekskalasi dari CO2. lnjeksi intra vena dengan cepat untuk beberapa obat bisa menyebabkan asidosis metabolik. Sebagai contoh adalah pemberian tetrasiklin intra vena menyebabkan asidosis yang beratnya tergantung dosis. Kontrol pH seluler. Kira-kira 80% injeksi asam pada hewan akan masuk ke dalam intraseluler. Ekperimen memperlihatkan ketika sejumlah asam diinjeksikan untuk menetralkan seluruh sodium bikarbonat dalam ruang intraseluler. Level sodium bikarbonat turun pada seekor anjing setelah diinjeksi 25%-50% asam. Banyak penyebaran asam dalam sel untuk menetralisir kondisi tersebut.Beberapa asam berubah dalam sel menjadi kemikalia non asam,seperti asam piruvat yang dapat merubah glukosa dan jugs asamasam lain penyangga protein atau penyangga intraseluler lain. Total kuantitas buffer asam intraseluler sulit diukur dan jumlah yang dinetralisir tidak diketahui sebelum pengukuran pH total. Faktor lain adalah metabclisine yang terus menerus menghasilkan asam. Keduanya harus benarbenar dipertimbangkan dalam program penanganan. Tiga faktor yang harus benar-benar dipertimbangkan dalam menangani asidosis metabolik adalah (1). seberapa besar kondisi asam dalam ruang ektraseluler (2). kondisi asam di dalam ruang intraseluler. (3). dan periode pembentukan asam sampai dengan akan dilakukannya penanganan. Pendekatan klinik selalu memperhitungkan banyaknya kekurangan ektraseluler sistem buffer bikarbonat-karbondioksida. Sesudah kekurangan ektraseluler ditentukan, beberapa faktor diperhitungkan untuk menambah bikarbonat pada asam intraseluler yang dapat dipakai untuk perhitungan dosis bikarbonat yang diinginkan. Sel darah merah mempunyai kapasitas buffer paling besar dibanding plasma. Jumlah total bikarbonat dalam darah lebih dibutuhkan untuk perhitungan terapi memperbaiki keasaman darah, dibanding dan nilai substansi bikarbonat plasma. Faktor 1 dan 2 digunakan untuk memperbaiki buffer optimal dari keseluruhan plasma darah,harga ini diperoleh dari kelelebihan atau kekurangan asam baik dalam intrasel maupun ektrasel. Universitas Gadjah Mada 7 Perhitungan kekurangan pada kasus klinis sebagai berikut : a. Normal bikarbonat - abnormal bikarbonat x 1,2 = ambang bawah darah. b. 24-14x1,2 = 12 mEq/L ambang bawah darah. c. Berat badan (kg) x 0,2 = volume ruang ektraseluler mEq. d. Berat badan x 0,2 x dasar bawah/L = ambang bawah ruang ektra sel mEq. e. Berat badan x (0,3-0,6) x ambang bawah/L = total bikarbonat mEq untuk terapi. a. Rumus (a) dan (b) mengubah defisit bikarbonat ke netral. Rumus (c) menghitung volume ruang ektraseluler. Rumus (d) menghitung kekurangan volume pada ruang ektraseluler. Rumus di atas tidak berlaku untuk keasaman yang tinggi dan variatif atau produksi asam dalam proses terapi. Perkiraan jumlah bikarbonat dapat diperoleh dari faktor yang lebih besar Mari 0,2, sebagian pare ahli menyarankan 0,3-0,6 untuk terapi bikarbonat. Penggunaan faktor 0,3-0,6 berdasarkan pada pengalaman penanganan yang aman. Paling tidak perlu 12 jam untuk asam di intrasel berdifusi dari sel ke ruang ekstrasel pada pemberian sodium bikarbonat. Jika digunakan dosis yang lebih tinggi(0,6) akan membahayakan, karena akan menimbulkan alkalasis saat pemberian bikarbonat secara cepat. Prosedur yang bisa dilakukan adalah dengan dosis 0,3-0,4. Larutan tersebut harus diberikan secara perlahan-lahan secara intra vena dan secara cepat dengan intraperitoneal atau subcutan. Kurang lebih 12 jam kemudian dapat dilihat pengaruhnya secara laboratorik dan berapa bikarbonat yang dibutuhkan. Pada dosis rendah, kelebihan bikarbonat dieliminasi lewat ginjal dan kontrol pH juga dapat dilakukan.. Hubungan antara garam elektrolit dan pH. Elektrolit seperti sodium dan clorida sangat berpengaruh pada pH saat terbentuk garam seperti sodium laktat dan amonium clorida. Perbandingan konsentrasi Na dan CI darah kurang lebih 1,4 : 1,penambahan Na dan CI akan mengubah keadaan pH.Pemberian dalam jumlah besar sodium laktat menyebabkan alkalosis dengan tanda meningkatnya jumlah sodium yang berhubungan dengan CI darah. Ion laktat berubah menjadi CO2di hepar dalam jumlah besar dan dapat meracuni paru-paru. Ion Na berubah menjadi sodium bikarbonat di dalam ginjal, dan menimbulkan peningkatan sodium bikarbonat plasma yang menyebabkan pergeseran pH ke arah alkalosis. Universitas Gadjah Mada 8 Perubahan tersebut berjalan bertahap,sehingga pemberian garam Na dan CI untuk kontrol pH akan aman jika dilakukan pelan-pelan. Hal ini juga harus memperhatikan keadaan hepar ,sistem respirasi dan fungsi ginjal karena berhubungan dengan perubahan kimia. Penggunaan sodium laktat untuk terapi cukup aman dan efektif karena obat ini menyebabkan perubahan pH perlahan-lahan dan lebih aman dibanding sodium bikarbonat. Penggunaan terapi asidosis metabolik dengan sodium bikarbonat dapat dilakukan dengan mempertimbangan kebutuhan sodium laktat pada fungsi hepar. Kebalikanya, efek yang sama dapat terjadi saat garam clorida seperti amonium clorida diberikan. Amoniak diubah menjadi urea oieh hati dan dieliminasi melalui ginjal. Ion clorida mengalami peningkatan dan digantikan bikarbonat. Hasilnya pH menjadi rendah dengan pengaruh keasaman yang digunakan untuk mengobati alkalosis. Baik hilangnya sodium maupun clorida sebagai akibat dari penyakit yang disebabkan perubahan pH yang berlawanan pada pengaruh kedua ion tersebut. Kejadian muntah yang hebat menyebabakan hilangnya clorida yang berlebihan tanpa diikuti hilangnya sodium. Ion clorida dipindahkan dalam plasma oleh ion bikarbonat menyebabkan terjadinya alkalosis. Beberapa bukti menunjukan bahwa tubuh menahan bikarbonat untuk menjaga plasma dan cairan ekstraseluler saat terjadi penurunan clorida. Diuretika seperti furosemid menyebabkan clorida plasma kosong dan menyebabkan penumpukan bikarbonat sehingga terjadi alkalosis. Alkalosis yang disebabkan karena hilangnya clorida sebaiknya diobati dengan pemberian amonium clorida atau bentuk lain dari clorida yang dapat dometabolisme secara pelan-pelan yang menyebabkan meningkatnya retensi clorida di dalam plasma. Penyakit yang menyebabkan hilangnya sodium berlebihan seperti diare,shock, penyakit ginjal mengakibatkan asidosis. Kondisi ini dapat diobati dengan pemberian sodium laktat atau sodium bikarbonat. Kebanyakan pengobatan dengan menggunakan sodium bikarbonat lebih disukai karena defisiensi sidium bikarbonat dapat diukur dan efektifitas terapinya adapat diperkirakan. Pada penggunaan sodium laktat,terkadang tidak dapat diyakini mengenai berapa banyak sodium yang akan diubah dalam bentuk sodium bikarbonat. Perubahan sodium laktat menjadi bikarbonat memerlukan hepar,ginjal dan sistem respirasi yang tidak berfungsi dengan semestinya pada suatu kondisi penyakit tertentu. Metode Pemeriksaan pH. Pemilihan metode untuk perhitungan pH pada umumnya tergantung peralatan laboratorium yang tersedia. Jika pH ,p CO2 dan bikarbonat plasma diketahui,pemilihan cairan yang diberikan dapat dibuat dengan alasan yang akurat. Bila tidak satupun Universitas Gadjah Mada 9 diketahui, penentuan keadaan asidosis atau alkalosis berdasarkan estimasi klinis,sehingga pemberian cairan harus lebih berhati-hati agar tidak menyebabkan overdosis. Terdapat empat metode umum untuk mengevaluasi keseimbngan asambasa pada hewan (1) evaluasi klinis (2) penentuan pH (3) determinasi bikarbonat (4) determinasi karbondioksida. Evaluasi Klinis Evaluasi klinis dari hewan sebaiknya dilakukan dalam setiap kasus, kadangkala hal ini merupakan metode tunggal dari evaluasi keseimbnagan asambasa. Penentuan secara laboratorium mungkin tidak bisa diperoleh, atau mungkin pengobatan lebih dahulu dilakukan sampai waktu penentuan secara laboratorium dapat dilaksanakan. Terdapat beberapa bahaya dalam pengobatan hewan yang disebabkan gangguan asam-basa tanpa pemeriksaan laboratorium. Sulit dikatakan dari evaluasi klinis jumlah sodium bikarbonat atau amonium clorida yang diperlukan untuk pengobatan. Bila pengobatan berlebihan terjadi,pH akan berubah berlawanan arah,dan berbahaya bagi hewan tersebut. Untuk mengatasi masalah yang mungkin akan terjadi,dosis rendah sebaiknya digunakan dengan pemberian subkutan, intraperoneal atau intravena dengan perlahan-lahan. Pada asidosis metabolik,penggunaan sodium bikarbonat akan mengakibatkan sedikit perubahan drastis pada pH dan resikonya kecil. Pengobatan alkalosis dan asidosis berhubungan dengan ginjal atau kerusakan alat pernafasan Ginjal dan pernafasan penting untuk kontrol pH dan apabila dosis berlebihan diberikan pada keruskan ginjal maupun alat respirasi, akan menimbulkan pengaruh jelek yang cukup serius. Penambahan berikut ini menunjukan perubahan yang lazim pada pH yang dijumpai pada beberapa tipe penyakit. Tabel 18.2 adalah data beberapa penyakit dengan perubahan pH dan terapi yang bermanfaat. Gastroenteritis. Diare yang ada hubunganya dengan gastroenteritis mengakibatkan naiknya kadar air yang hilang( 16% sampai 17% ) dari berat badan,kehilangan sodium ( 8% sampai 22% ) dan kehilangan potasium dengan asidosis metabolik dari yang ringan sampai yang cukup berat. Muntah yang disebabkan oleh gastroenteritis menyebabkan hilangnya clorida yang kurang lebih sama dengan hilangnya sodium yang mengakibatakn metabolik asidosis. Apabila diare dan muntah terjadi pada hewan yang sama, keduanya cenderung menutupi satu sama lain sehingga dapat merubah Universitas Gadjah Mada 10 alkalosis menjadi asidosis. Biasanya kejadian yang berat dari keduanya akan menyebabkan alkalosis atau asidosis. Sodium bikarbonat dalam dosis rendah(1mEq/kgBB) dapat diberikan secara subkutan,intraperitoneal atau intravena yang diberikan perlahan-lahan. Penggunaan saline fisiologi( Sodium clorid 0,9% ) atau cairan Ringer's(tabel 18-6) dapat diberikan karena perbandingan antara sodium dan clorida adalah 1:1 di dalam saline, dan 1,4:1 dalam plasma. Saline fisiologi dalam Ringer's merupakan larutan yang bersifat asam yang relatif aman dan cukup mengandung senyawa clorida dan sodium yag mampu mengkompensasi kehilangan clorida yang disebabkan oleh muntah. Muntah yang berhubungan dengan obstruksi pyloric menyebabkan perubahan yang besar terhadap pH yang menyebabkan metabolit alkalosis, hal ini sangat berbeda dengan muntah yang berhubungan dengan gastritis. Obstruksi mencegah regurgitasi sodium ke dalam lambung dan menyebakan hilangnya sodium. Turunnya kadar CI dalam darah yang akan digantikan oleh bicarbonat mengakibatkan metabolik alkalosis. Obstruksi pyloric secara ekperimen menyebabkan kematian dari anjing dalam waktu 4-10 hari. Keadaan ini juga terjadi pada hewan yang diberi amonoium clorida dalam dosis besar dan biasanya dapat bertahan selama satu minggu atau lebih. Shock. Shock, baik yang disebabkan oleh hypovolemik,endotoksin atau infeksi bakteri yang berat, biasanya menyebabkan asidosis ringan sampai berat. Shock pada anjing dan manusia biasnya berhubungan dengan asidosis berat. Ekperimen menunjukan darah dalam cairan ACD( sodium citrat, citric acid, cairan dextrose anticoagulan ) diberikan pada anjing yang mengalami shock berat. Jika pH dari ACD 7,8 diberikan ke anjing yang mengalami shock, akan membuat anjing tetap bertahan. Metabolik acidosis yang berhubungan dengan shock bisa diobati dengan larutan alkalin ,terutama sodium bikarbonat. Dalam sebuah percobaan, 1-2 mEq/kg sodium bikarbonat yang diberikan perlahan dapat membantu hewan bertahan hidup. Jika digunakan transfusi darah, dosis minimal sodium bikarbonat dapat diberikan untuk pengobatan metabolik asidosis dari shock. Gangguan ginjal. Metabolik asidosis biasanya terjadi pada gangguan ginjal. Penyebab utamanya adalah hilangnya sodium dan gagalnya eliminasi produksi asam dari metabolisme urine. Penurunan pH yang terjadi pada ginjal tidak selalu terjadi pada saat asidosis. Universitas Gadjah Mada 11 Terkadang muntah yang berat pada gangguan ginjal mengurangi asidosis dan menyebabkan alkalosis, sehingga pengobatan dengan menggunakan sodium bikarbonat, tingkat muntah harus dicatat dan dosis dapat dikurangi ketika muntah terus terjadi. Penggunaan peritoneal lavage akan Iebih aman dan merupakan metode yang Iebih akuat untuk mengoreksi pH. Cairan yang digunakan untuk peritoneal lavage jangan mengandung sodium bikarbonat(Tabel 18.6), cairan lavage mengoreksi pH dengan menyeimbangkan rasio antara sodium dengan chlorida. Gangguan respirarasi. Pneumonia, gangguan jantung dan berbagai kondisi yang berhubungan dengan obstruksi dari pertukaran udara dan paru-paru biasanya menahan keluarnya CO2 dan menyebabkan terjadinya asidosis respiratorik. Bikarbonat jangan digunakan untuk menangani masalah tersebut karena bikarbonat dan asam akan membentuk CO2 lebih banyak, hal ini akan menyebabkan asidosis yang lebih parch. Pengurangan metabolisme tubuh akan menjaga hewan menjadi tenang dan suasana yang hangat juga akan membantu. Pengobatan asidosis dan alkalosis harus berdasarkan pemeriksaan klinis, dan harus diberikan dengan dosis perlahan sehingga ginjal dan saluran respirasi dapat mencegah terjadinya penyimpangan pH. Dosis rendah dapat diberikan setiap 12 jam. Tabel 18.3 dapat membantu perkiraan dosis bikarbonat. Universitas Gadjah Mada 12 Penggunaan pHmeter untuk koreksi pH. Nilai normal pH pada anjing kira-kira 7,4 tapi kisaran nilai antara 7,35 — 7,45 masih termasuk normal.Nilai dibawah 7.35 sudah termasuk asidosis dan lebih tinggi dari 7,45 disebut alkalosis. Nilai pH buffer standar akan dapat ditentukan apakah hewan mengalalami asidosis atau alkalosis. Sebagai contoh,jika seekor hewan mengalami reduksi dalam nilai sodium bikarbonat dalam darah,hewan akan berkompensasi dengan mengeluarkan CO2 dan mereduksi CO2 dalam darah, yang akan menyebabkan perubahan pH darah ke asam. Mekanisme kompensasi jumlah kebutuhan bikarbonat untuk pengobatan asidosis dapat ditentukan. pH meter dipasang dengan alat lain yang disebut Titrimeter atau mesin gas darah. Kombinasi keterangan dari 2 alat tersebut akan cukup untuk menentukan apakah terjadi alkalosis atau asidosis dan untuk membuat suatu perkiraan jumlah dan tipe elektrolit yang dibutuhkan dalam mengkoreksi pH. Tabel 18-3. Penilaian defisit bikarbonat pada pasien dengan asidosis metabolik. Tanda-tanda Penilaian defisit Kebutuhan bikarbonat Bikarbonat untuk mengurangi Ringan mEq/L 5 defisit ( mEq/kg ) 3 Sedang 10 6 Berat 15 9 1 mEq = 84 mg sodium bikarbonat atau 1 gr NaHCO3 = kira-kira 12 mEq (Finco,D.R. General Quidelino for Fluid Therapy. J. Anim. Hosp. Assoc., 8 — 166, 1972) Bikarbonat ketetapan Titrimeter. Jumlah bikarbonat dalam darah dapat diperkirakan dengan alat yang relatif murah yang disebut Titrimeter. Hal ini dilakukan dengan mengukur bikarbonat plasma dengan titrasi plasma, sehingga akan diketahui jumlah asam. Alat ini terdiri dari 50 mL serum yang dimasukan ke dalam cylinder kecil, ditambahkan indikator asam dan standard asam sampai indikator berubah warna. Nilai dibaca dari lempeng sehingga diperoleh nilai bikarbonat dalam miliequivalen/liter. Dengan keterangan ini akan lebih mudah menghitung dosis bikarbonat yang pasti dan diperoleh koreksi pH lebih balk, kemudian dapat dilakukan observasi klinik. Kekurangan HCO3 yang diperoleh dari nilai pengurangan dalam kotak klinik dari nilai normal yaitu 24 mEq/L. Nilai ini dikalikan 1,2 dari nilai dasar. Defisit dasar dapat digunakan dalam satu formula sebelum dibahas Universitas Gadjah Mada 13 menjadi dosis bikarbonat total yang dibutuhkan untuk mengobati anjing. Di bawah ini contoh bagaimana hal ini dapat dikerjakan Anjing mempunyai berat badan 14 kg, mempunyai nilai bikarbonat dalam darah sebanyak 15 mEq/L diukur dengan Titrimeter. Kekurangan bikarbonat adalah 9(24-15-9) dan defisist dasar adaalah 10,8(1,2x9 = 10,8 0. Jadi jumlah bikarbonat yang dibutuhkan akan diperoleh dari : a. Berat badan/kg x faktor x defisist base = total bikarbonat/mEq untuk terapi. b. 14 x 0,3 x 10,8 = 45,4 mEq NaHCO3 Dosis 45,4 mEq seharusnya diberikan secara intraperitoneal, subkutan, atau intrvena secara perlahan-lahan selama 12-24 jam sebelum pengobatan, bikarbonat yang lain bisa diukur dan anjing bisa diobati sesuai dengan kebutuhan. Penentuan karbondioksida-mesin gas. Mesin gas adalah alat yang baik dan berharga dalam koreksi pH dan diagnosa terjadinya abnormalitas asam-basa. Peranan mesin ini besar, namun harganya mahal. Mesin ini utnuk mengukur pH dan tekanan karbondioksida yang terurai dalam plasma(pCO2). Mesin ni tidak untuk mengukur kandungan bikarbonat dalam plasma. Tekanan bikarbonat pada anjing normal bervariasi yaitu mulai darai 35-45 mmHg, angka yang tinggi atau rendah menggambarkan kondisi abnormal pada anjing. Nilai bikarbonat lebih berharga dalam menghitung dosis bikarbonat yang dibutuhkan daripada nilai pCO2. Bikarbonat plasma dapat dihitung dengan menggunakan rumus Handerson-Hasselbach, dengan mrenggunakan nilai pCO2 dan pH. Nilai pCO2 adalah tekanan CO2 dalam plasma, yang harus diubah menjadi miliequivalen yang menyatakan isi atau jumlah H2CO3 (CO2terurai) dalam plasma. Jumlah H2CO3 yang terurai adalah suatu tekanan yang tetap, karena itu untuk mengubahnya menjadi mEq/L hanya dengan mengalikan pCO2 dengan 0,03. Untuk menghitung pH dan bikarbonat dapat mengikuti rumus : a. pCO2 x 0,03 = H2CO3 dalam mEq. b. pH = 6.1 + log HCO3 (bikarbonat) H2CO3 (CO2) c. Bikarbonat = antilog (pH -6,1 + log (02) d.Bikarbonat = antilog (pH -6,1 + log (0,03) (pCO2) e. CO2= antilog (6,1 + log HCO3 —pH) Universitas Gadjah Mada 14 Rumus (a) adalah perubahan tekanan CO2 menjadi banyaknyan H2CO3 rumus dalam milliequivallent,yang harus digunakan dalam semua rumus,kecuali (d).Rumus (b) untuk menghitung pH bila HCO3 dan H2CO3 diketahui.Rumus (c) untuk menghitung bikarbonat bila pH dan pCO2 diketahui.Rumus (d) adalah gabungan (a) dan (c).Rumus (e) untuk menghitung H2CO3 (CO2) bila HCO3 dan pH diketahui.Dengan kalkulator yang murah,dengan dasar setelah bikarbonat ditentukan,dari 24 dikurangi angka ini dan mengalikan dengan 1,2 untuk mendapat kekurangannya.lni digunakan untuk menghitung dosis bikarbonat. Ketetapan rumus Henderson — Hasselbach. Nilai tetap 6,1 dalam rumus Henderson-Hasselbalch adalah pK atau pemisahan tetap sistem Buffer CO2-bikarbonat. Percobaan pada anjing menunjukkan bahwa kenaikan pK sebanding dengan kenaikan pH.Pada percobaan ini melibatkan 48 anjing dengan pH arteri antara 6,77 dan 7,76,angka pK antara 5,86 dan 6,273. Perbedaan ini menunjukkan bahwa perhitungan dengan menggunakan rumus Henderson- Hasselbaich akan meningkatkan kesalahan pH lebih dari dari 7,4. Penggunaan Nomogram untuk menghitung dosis bikarbonat. Semua perhitungan basa digambarkan oleh nomogram untuk penggunaan yang lebih mudah. Gambar 18.3. Nomogram Russel untuk menghitung whole body base defisit dari pH arterial plasma dan pCO2 Universitas Gadjah Mada 15 Nomogram Russel (gambar 18.3) didasarkan pada percobaan yang dilakukan pada anjing-anjing, dilakukan penghubungan nilai pCO2 dan pH dengan sebuah garis lurus. Kelebihan basa (+) atau (-) /kg dari berat badan dibaca dimana garis menyilang dengan garis yang ada ditengah. Contohnya, berat anjing 10 kg memiliki pCO 2 50, dan pH 7, kelebihan basa akan menjadi -8 ( minus menandakan pengurangan )/kg dara berat badan. Berat anjing 10 kg,sehingga kekurangan basa total 80 mEq. Sodium bikarbonat diberikan perlaahan-lahan akan mengorteksi kekurangan basa ini. Hasilnya akan dicatat dan nomogram Russel membaca langsung akan kekurangan basa ( karbonat tidak berkurang/kg BB ). Dasar nomogram ini terdiri dari pH dan pCO2 yang berasal dari darah arteria. Bila menggunakan darah vena tidak akan memperlihatkan perbedaan yang nyata dengan menggunakan nomogram ini secara klinis. Untuk lebih teiiti,konsentrasi 0,4/kg substrat di dapat dari kekurangan basa ketika menggunakan darah vena daripada darah arteria. Pada nomogram yang lain, pada Siggard-Anderson terjadi pengurangan basa pada 0,5 mEq/L dari plasma atau darah. Efek penghitungan pada nomogram ini berdasarkan variasi Hb dengan kekurangan basa. Penambahan Hb sebanyak 5 mg mengubah kekurangan basa menjadi kurang lebih 0,5 mEq/L dari plasma. Pembacaan nomogram Siggard-Anderson terlihat pada gambar 18-4, penghubungan pCO2, pH, CO2 dan bikarbonat oleh garis lurus dan kekurangan basa/kelebihannya terbaca bila garis lurus bersilang dengan nilai Hb yang tepat. Sebagai contoh, seekor anjing dengan berat badan 10 kg dengan pH 7,pH,CO 2 50 dan Hb 15 gm, garis lurus pCO2 50 dah pH 7. Garis Hb 12 gm bersilangan dengan garis lurus,kemudian kekurangan basa dapat terbaca. Kekurangan basa adalah -20. Tampilan ini digunakan dalam formasi yang sebelumnya mengacu pada Berat badan 10 kekurangan basa 20 Faktor = Total kekurangan basa tubuh. 0,4 80 mEq Faktor 0,4 digunakan dengan 12 gm Hb oleh nomogram Russel dan Siggaard Anderson menunjukan peniiaian yang lebih sama jika menggunakan faktor lain, antara 0,3 atau 0,5 akan terjadi sedikit perubahan nilai. Universitas Gadjah Mada 16 Modifikasi Hankins dari Nomogram Siggaard- Anderson. Nomogram pada gambar 18-4 adalah modifikasi dari nomogram SiggaardAnderson yang menjumlahkan 1,2 dan 3 gm garis Hb. Darah mempunyai daya buffer yang besar dibandingkan plasma dan cairan ektraselluler lain,terutama sel-sel darah merah. Gambar 18,4 Haskins modifikasi Siggaard-Anderson nomogram untuk menghitung defisit dari dua parameter ( pH, pCO2, HCO3, CO2) Jika nomogram Siggaard-Anderson digunakan untuk mengkalkulasi kekurangan basa/kelebihan basa dalam seluruh ruang ektraseluler, berapa kesalahan dapat menyebabkan sel darah merah mengikat darah vaskuler. Jika seluruh cairan ektraseluler (darah dan intestinal) akan tercampur,kemudian Hb per 100 ml ditambahkan air. Nilai Hb 15,10 dan 5 gm/100m1, setelah ditambahkan air dan cairan intestinal akan menjadi 3,2 atau 1mg/100m1. Penggunaan modifikasi Hankins memudahkan pembacaan nilai kekurangan/kelebihan basa dimana bersilangan dengan garis Hb 3,2 atau 1 gm diganti dengan garis 15,10 atau 5 gm. Pemakaian Nomogram Siggaard-Anderson untuk diferensial diagnosa ketidak seimbangan asam-basa. Data-data berisi nomogram (gambar 18-4) untuk mendekteksi adanya ketidak seimbangan asam-basa dari resporasi ataupun metabolik. lni diketahui dengan melihat pH,pCO2 (komponen respirasi) dan sifat asam basanya (komponen metabolik) Tabel 18-4 memperlihatkan kisaran nilai(rata-rata) parameter asam-basa pada anjing. Jika pH di bawah 7,35, hewan mengalami asidosis atau bila di atas 7,45 hewan mengalami alkalosis. Untuk memperkirakan adanya ketidakseimbanan asam-basa dalam respirasi ataupun metabolisme, yaitu dengan melihat nilai pCO2 dan nilai asam-basanya. Nilai pCO2diketahui dengan mengukur komponen CO2dan efektifitas sistem respirasi dalam Universitas Gadjah Mada 17 mengontrol pH. Jika nilai tersebut kurang dari 33 mmHg, hewan dalam keadaan alkalosis respirasi dan bila di atas 40 mmHg dalam keadaan asidosis respirasi. Nlai asam-basa mengindikasikan komponen metabolisme dari sisitem buffer bikarbonat. Bikarbonat mengontrol tingkat metabolisme hewan dan fungsi ginjal. Jika nilainya di bawah 22, hewan mengalami metabolik asisdosis, dan jika di atas 25 hewan mengalami metabolik alkalosis. Kebanyakan gangguan asam-basa tidak murni respirasi atau metabolik. Diferensial diagnosa gangguan-gangguan respirasi tersebut mempunyai deviasi jauh dari normal. Komponen respirasi(pCO2) atau metabolik(asam/basa) mempunyai deviasi jauh dari normal pada kasus-kasus primer,dimana komponen-komponen lainnya bersifat sekunder. Hal ini terjadi karena hewan yang mengalami gangguan alkalosis respirasi dengan level pCO2 yang rendah, usaha unutk kompensasi nilai pCO2dengan mengurangi level plasma bikarbonat, yang akan terlihat sebagai metabolisme asidosis. Tabel 18,4 Nilai asam-basa pada anjing Rata-rata pH 7,4 p CO2 37 H2 CO3 1,2 Bikarbonat 24 Kisaran 7,35 — 7,45 33 — 40 1,05 — 1,35 22 — 25 Tabel 18.5 Hipotesis nilai asam-basa Pasien pH pCO2 Asam/Basa Anjing A 7,25 65 0 Anjing B 7,18 65 -5 Anjing C 7,49 50 +13 Anjing D 7,52 27 0 Pada hewan yang sama, respiratorik alkalosis primer dan metabolik asidosis mungkin sebagai penyebab mekanisme kompensasi ini. lni akan dapat diketahui bahwa alkalosis primer karena nilai pCO2 jauh dari nilai karbonat normal. Tabel 18,5 memperlihatkan berbagai pH, pCO2 dan nilai asam/basa untuk beberapa hipotesis gangguan asam-basa, yang mungkin menggambarkan beberapa kemungkinan. Universitas Gadjah Mada 18 Anjing A (Tabel 18,5). Hewan ini mempunyai pH 7,25 dimana dia dalam keadaan asidosis. Nilai pCO2 65,terletak di normal, sebab itu mempunyai asidosis respirasi, Nilai asam/basanya, mengindikasikan tidak ada perubahan yang mendasar, maka ini bukan merupakan komponen metabolik. Diagnosa kaus ini kemungkinan adalah respirasi asidosis primer. Anjing B (Tabel 18,5). Hewan ini dengan pH 7,18 dalam keadaan asidosis. Kemudian p CO2 dengan nilao 65 mengindikasikan respirasi asidosis. Dalam kasus ini kebasaan menurun hingga 5, mengindilkasokan metabolik asidosis. Respirasi asidosisnya bersifat primer karena 65 sangat jauh adari nilai normal. Hewan ini dalam keadaan respirasi asidosis primer dengan metabolik sekundfer. Anjing C (Tabel 18,5). pH 7,49 mnegindikasikan alkalosis ringan. pCO2 50 adalah abnormal mengindikaisikan asidosis respirasi. Sifat asam/basa dengan nilai +13 mengindikasikan alkalosis metabolik dan akumulasi plasma bikarbonat yang berlebihan. Komponen metabolik atau akumulasi bikarbonat adalah jauh lebih besar daraipada pCO2 atau komponen respirasi, karena irtu hewan tersebut dalam keadaan alkalosis primer. Perlu diingat bahwa pada kebanyakan kasus tubuh akan mencoba untuk berkompensasi pada scat permulaan gangguan pH dengan melalui sistem respirasi. Dalam kasus ini respirasi melambat menyebabkan terjadinya akumulasi CO2 sebagai kompensasi sekunder. Pada anjing B, kedua komponen tersebut bergerak secara langsung dengan pH, keasaman/kebasaan -5 menyebabkan respirasi asidosis. Ketika respirasi dan komponen metabolik bergerak secara langsung, tidak berkompensasi seperti metabolik asidosis pada asidosis respirasi. Anjing D (Tabel 18,5). Pad a hewan ini pH 7,52 mengindikasikan Alkalosis. pCO2 27 mengindikasikan alkalosis resparasi dan sifat asam/basa mengindikasikan tidak ikut mengkontribusi komponen metabolik. Diagnosa alaklosis respirasi, mungkin menyebabkan frekwensi respirasi meningkat, yang mungkin terjadi selama pernafasan buatan. Biasanya sifat asam/basa ini akan berdampak negatip pada alkalosis, bila kompensasi terjadi secara parsial. Pada kejadian ini,bikarbonat akan diekresikan oleh ginjal. Ginjal yang bekerja sangat lambat, kemungkinan tidak punya waktu untuk mengkompensasi hilangnya CO2. Hipotesis kasus menggambarkan informasi yang mungkin diperoleh dari nomogram. Nilai-nilai tersebut dapat untuk terapi langsung sebab-sebab primer. Sebagai contoh,pada anjing B dengan respirasi dan metabolik asidosis,respirasi asidosis akan merupakan sebab primer,perlu dilakukan pemeriksaan paru-paru dan sistem respirasi untuk mendeteksi sebab-sebab penyakit. Universitas Gadjah Mada 19 Pengaturan darah dan volume ruang ektraseluler. Gambar 18,5 menyebutkan beberapa faktor penting dalam mengatur darah dan volume ruang ektraseluler. Ruang ektraseluler terdiri atas darah dan ruang interstisiil. Pada anjing normal 8% darai berat badan adalah volume darah, volume plasma 5% dan 15% volume ruang interstisiil. Pengaturan volume darah. Seperti pada pengaturan pH, volume darah sebagaian besar diatur oleh ginjal. Kontrol ginjal pada volume darah adalah lambat dan membutuhkan beberapa harai untuk mencapai maksimal. Ketika volume darah berkurang terjadi penurunan tekanan darah dan output ginjal. Penurunan tekanan darah pada ginjal menyebabkan terjadinya penurunan output urine dan hilangnya air. Terjadi retensi cairan sebagai akibat fungsi ginjal dalam meningkatkan volume darah. Baroreseptor yang terletak di arteri dan vena besar pada jantung juga mengatur volume darah lebih cepat daripada ginjal. Ketika tekanan darah menurun , reseptor tersebut menyebabkan beberapa efek yang tersebut pada tabel 18,5. Reseptor tersebut mampu menyimpan volume darah, kecuali pada penyakit parah, dalam waktu 1 atau 2 jam. Baroreseptor menginisiasi kejadian-kejadian tersebut di bawah ini 1. Melalui sistem nervus simpatikus, kontraksi lien dan peningkatan volume sel darah merah sampai dengan lebih 100% pada anjing. 2. Baroreseptor merangsang hepar untuk melepaskan plasma protein cadangan dan meningkatkan tekanan osmotik plasma. 3. Melalui nervus sympatikus, darah mengalir ke ginjal menurun, dengan penurunan dalam output urinasi dan hilangnya air. 4. Kebalikannya,pada hipothalamus, sekresi aldosteron meningkat yang menyebabkan retensi sodium oleh ginjal. 5. Konstriksi pembuluh darah mengurangi volume total darah pembuluh darah sehingga meningkatkan tekakan darah. 6. Regulasi atau pengaturan volume darah dan volume cairan lainnya diatur oleh mekanisme fisiologi yang bereaksi pada ruang vaskuler darah. Adalah Universitas Gadjah Mada 20 sangat penting bahwa program shock therapy yang lengkap termasuk koreksi dari abnormalitas dalam volume darah. Mungkin saja sama pentingnya dengan koreksi pada abnormalitas ruang interstisiil/seluler. Pengukuran volume darah. Untuk menilai dengan benar, jumlah darah atau plasma memerlukan koreksi abnormalitas, volume darah adalah penting untuk mengetahui volume darah. Ada beberapa cara untuk mengukur volume darah yaitu (1). Menggunakan PCV (2). Menggunakan Evans Blue(T18824) (3) Menggunakan bromsulphalein,rose bengal atau pearna lain. PCV. Pengukuran volume darah memakai PCV mudah dilaksanakan meskipun metode ini mungkin tingkat akurasinya yang paling rendah. Asumsi yang dibust bahwa volume sel darah merah adalah normal dan hanya volume plasma yang turun. Jika ini adalah benar, nilai hematokrit atau PCV akan menunjukan hemokonsentrasi ketika ada penurunan volume plasma. Jelasnya perubahan sel darah merah seperti pada anemia, akan menyebabkan error pada sistem tersebut. PCV di atas normal mengindikasikan adanya penurunan volume plasma. Perkiraan kasar dari sejumlah plasma yang seharusnya diberikan dalam suatu transfusi dapat dihitung dengan formula sebagai berikut : a) 1,2 x BB(kg) x ( PCV- normal PCV) = jumlah plasma untuk di transfusikan. b) 1,2 x 20 x (45 — 35) = 240 ml plasma. Formula (a) adalah formula umum untuk menghitung volume transfusi plasma dari PCV. Formula (b) mengindikasikan bahwa anjing dengan berat 20 kg, dengan PCV sekitar 45 akan membutuhkan 240 ml plasma. Hal tersebut didasarkan atas perkiraan bahwa setiap point peningkatan PCV di atas normal mengindikasikan hemokonsentrasi, terdapat 1,2 ml penurunan volume plasma tiap kg BB. a. Volume plasma = densitas optikal standar x standar pengenceran densitas optikal plasma b. 627,3 ml plasma = 0,345 x 500 0,275 c. Volume darah = 100 x volume plasma 100 - PCV Universitas Gadjah Mada 21 d. 965 ml volume darah = 100 x 627,3 100 - 35 e. Volume darah = 100 x volume plasma 100 - ( faktor koreksi ) (PCV ) f. 897,4 ml volume darah = 100 x 27,3 100 - ( 0,86) (35 ) Volume caircn ektraseluler. Sodium sejauh ini merupakan elektrolit yang terpenting dalam volume cairan ektraseluler yang utama. Mekanisme asam-basa ginjal akan menyeimbangkan jumlah anion dengan kation, sehingga ion-ion clorida atau bikarbonat akan seimbang dengan sodium. Sodium dikontrol ginjal dan hormon aldosteron. Perkiraan 95% tekanan cairan ektraseluler tergantung pada sodium dan anion-anion lainnya. Meskipun kalsium dan potasium mempuinyai efek relatif kecil pada tekanan osmotik cairan ektraseluler, mereka punya efek terhadap hepar,sistem syaraf dan jaringan lain. Mereka mungkin termasuk dalam cairan rehidrasi ektraseluler. Cairan seperti laktat ringer merupakan penyeimbang yang bagus unrtuk elektrolit ektraseluler. Perbandingan sodium dan clorida adalah 1,4 1 ditambah kalsium dan potasium secukupnya. Tabel 18,6 menggambarkan seleksi cairan elektroloit dalam beberapa tipe dehidrasi. Rehidrasi intraseluler. Elektrolit utama pada sel adalah potasium. Elektrolit ini dikeluarkan dalam suasana asam/asidosis dan pada tingkat tertenti dehidrasi. Merupakan mekanisme aman untuk menghindari tekanan osmotik yang berlebihan di dalam sel. Waktu potasium meninggalkan sel pada keadaan fungsi ginjal normal, akan dikeluarka dari tubuh saat cairan rehidrasi intraseluler potasiumnya dalam jumlah ekstra. Hal ini terjadi pada hewan muda sperti anak anjing. Untuk mendapatkan tingkat efek rehidrasi intraseluler, jumlah potasium cairan harus di atas 5 mEq/L. Ini digunakan untuk rehidrasi ektrseluler dan jumlah yang lebih bisa digunakan untuk rehidrasi intraseluler. Larutan Darrow yang terdaftar dalam tabel 18,6 merupakan cairan rehidrasi intraseluler. Universitas Gadjah Mada 22 Tabel 18,6. Komposisi bermacam-macam larutan elektrolit. Larutan mEq/L Penggunaan Na K Ca Mg ICI Laktat Plasma anjing 143 4,4 5,3 1,9 106 0 Asaline 0,9% 154 154 17 5 3 lnosol G 63 4 Ringers 147 4 Laktat Ringer 130 Asam untuk kejadian alkalosis 28 yang menyebabkan 151 muntah Asam. sda 158 Asam. Sda 109 Untuk diare asidosis K tinggi untuk rehidrasi intraseluler Darrow 121 35 103 K tinggi untuk rehidrasi intraseluler Cairan dialisis 140 0 4 1,5 102 Dialisis peritoneal pada Penyakit Universitas Gadjah Mada 23 PUSTAKA ACUAN Coles E.H, 1986. Veterinary Clinical Pathology 4Ed .W.B. Sounders Company. pp.203-216. Day Thomas K,2003. Shock : Pathophysiology,Diagnosis and Treatment. Pp. 1-16. Pettifer G, 2003. Fluid , Electrolytes, and Acid-Base Therapy. Pp. 17-41. Sattler F.P.; Knowles R.P.; Whittick W.E, 1997. Veterinay Critical Care. Lea and Febiger. Pp.415-434. Tilley L.P.,D.V.M.; Smith F.W.K. Jr.,D.V.M.,1977. The 5 Minute Veterinary Consult, Canine and Feline. Lea and Febiger. Pp. 150-151. William V. L.; Jones E.W., 1984. Veterinary Anesthesia 2Ed Lea and Febiger. Pp101-130 Universitas Gadjah Mada 24