PENGARUH KOLKISIN TERHADAP KERAGAAN
advertisement

PENGARUH KOLKISIN TERHADAP KERAGAAN FENOTIPE
DAN JUMLAH KROMOSOM JAHE EMPRIT
(Zingiber officinale Rosc.) ASAL IN VITRO
Oleh :
Suci Rahayuningsih
A34401046
PROGRAM STUDI
PEMULIAAN TANAMAN DAN TEKNOLOGI BENIH
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
2006
PENGARUH KOLKISIN TERHADAP KERAGAAN FENOTIPE
DAN JUMLAH KROMOSOM JAHE EMPRIT
(Zingiber officinale Rosc.) ASAL IN VITRO
Skripsi sebagai salah satu syarat
untuk memperoleh gelar Sarjana Pertanian
pada Fakultas Pertanian Institut Pertanian Bogor
Oleh
Suci Rahayuningsih
A34401046
PROGRAM STUDI
PEMULIAAN TANAMAN DAN TEKNOLOGI BENIH
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
2006
RINGKASAN
Suci Rahayuningsih. Pengaruh Kolkisin terhadap Keragaan Fenotipe dan
Jumlah Kromosom Jahe Emprit (Zingiber officinale Rosc.) Asal In Vitro
(Dibimbing oleh DINY DINARTI dan YUDIWANTI W.E.K).
Penelitian ini bertujuan untuk mempelajari pengaruh konsentrasi kolkisin
terhadap keragaan fenotipe dan jumlah kromosom jahe emprit asal in vitro.
Percobaan ini dilaksanakan dari bulan Desember 2004 sampai September 2005.
bertempat di Laboratorium Kultur Jaringan, Departemen Budidaya Pertanian, IPB
dan rumah plastik Laboratorium Ilmu dan Teknologi Benih, Leuwikopo,
Darmaga. Pengamatan stomata dilaksanakan di Laboratorium Ekofisiologi dan
analisis kandungan klorofil di Laboratorium Pusat Studi Pemuliaan Tanaman
(Research Group on Crop Improvement), Departemen Budidaya Pertanian IPB.
Analisis kromosom dilakukan di Herbarium Bogoriense bagian Anatomi dan
Sitologi, LIPI Bogor.
Penelitian dilaksanakan menggunakan faktor tunggal, yaitu konsentrasi
kolkisin. Rancangan yang digunakan dalam penelitian adalah rancangan acak
lengkap. Konsentrasi kolkisin yang digunakan adalah tanpa kolkisin sebagai
kontrol, dengan kolkisin 0.25% dan 0.50%. Setiap perlakuan diulang tiga kali
sehingga terdapat sembilan satuan percobaan dan setiap satu satuan percobaan
terdiri atas lima tanaman. Setiap perlakuan masing-masing ditanam pada polybag
secara terpisah
Hasil penelitian menunjukkan bahwa pemberian kolkisin terhadap jahe
emprit asal in vitro secara umum tidak berpengaruh terhadap keragaan fenotipe
dan hanya berpengaruh terhadap jumlah kromosom.
Penggandaan jumlah kromosom tanaman jahe pada perlakuan kolkisin
dengan konsentrasi 0.25% memiliki kisaran jumlah kromosom 2n = 36 - 48,
konsentrasi kolkisin 0.50% memiliki kisaran jumlah kromosom 2n = 43 - 84
sedangkan tanaman jahe tanpa kolkisin memiliki kisaran jumlah kromosom 2n =
22 - 27.
LEMBAR PENGESAHAN
Judul : PENGARUH KOLKISIN TERHADAP KERAGAAN FENOTIPE
DAN JUMLAH KROMOSOM JAHE EMPRIT (Zingiber officinale
Rosc.) ASAL IN VITRO
Nama : Suci Rahayuningsih
NRP : A34401046
Menyetujui,
Dosen Pembimbing
Pembimbing I
Pembimbing II
Ir Diny Dinarti, MSi
Dr Ir Yudiwanti Wahyu E.K., MS
NIP. 131 999 963
NIP. 131 803 645
Mengetahui,
Dekan Fakultas Pertanian
Prof Dr Ir Supiandi Sabiham, M. Agr
NIP. 130 422 698
Tanggal Lulus :
RIWAYAT HIDUP
Penulis dilahirkan di Kuningan, Propinsi Jawa Barat pada tanggal 16
Agustus 1982. Penulis merupakan anak keempat dari empat bersaudara dari
Bapak Ahmad dan Ibu Acih Supiacih.
Tahun 1995 penulis lulus dari MI Taufiqurrahman II Beji, Depok,
kemudian pada tahun 1998 penulis menyelesaikan studi di SLTP PGRI 3 Jakarta.
Penulis lulus dari SMUN 49 Jakarta pada tahun 2001.
Tahun 2001 penulis diterima sebagai mahasiswa Program Studi Pemuliaan
Tanaman dan Teknologi Benih, Departemen Budidaya Pertanian, Fakultas
Pertanian, Institut Pertanian Bogor melalui jalur Ujian Masuk Perguruan Tinggi
Negeri.
Selama studi di IPB, Penulis juga aktif pada berbagai organisasi
mahasiswa diantaranya HIMAGRON dan Forum Komunikasi Rohis Jurusan
Fakultas Pertanian.
KATA PENGANTAR
Alhamdulillah, segala puji bagi Alloh SWT atas segala rahmat dan
hidayahNya yang telah memberi penulis petunjuk, kekuatan dan kesabaran
sehingga penulisan skripsi ini dapat diselesaikan dengan baik.
Penelitian pengaruh kolkisin terhadap keragaan fenotipe dan jumlah
kromosom merupakan salah satu syarat untuk mendapatkan gelar Sarjana
Pertanian di Institut Pertanian Bogor.
Penulis menyampaikan terimakasih kepada :
1. Bapak dan mamah tercinta atas dorongan, semangat dan do’a yang selalu
menyertai setiap langkah dan aktivitas penulis.
2. Ir Diny Dinarti, MSi dan Dr Ir Yudiwanti Wahyu E.K., MS selaku dosen
pembimbing skripsi yang telah memberikan semangat dan pengarahan selama
kegiatan penelitian dan penyusunan skripsi ini..
3. Desta wirnas SP, MSi selaku dosen pembimbing akademik dan dosen penguji
yang telah memberikan motivasi dan arahan kepada penulis.
4. Prof Dr Ir Supiandi Sabiham, M. Agr selaku Dekan Fakultas Pertanian, Institut
Pertanian Bogor
5. Seluruh staf Laboratorim Ekofisiologi, terutama Pak Joko, yang telah
memberikan saran-saran dan bantuan dalam penelitian ini.
6. Seluruh staf Laboratorium Ilmu dan Teknologi Benih atas bantuan yang telah
diberikan kepada penulis.
7. Seluruh staf Laboratorium Pusat Studi Pemuliaan Tanaman, terutama Mas
Bambang, atas bantuan dan bimbingan kepada penulis.
8. Kakak-kakakku ; Yayat, Euis, Imam, bang Alik, Lia dan keponakankeponakanku yang lucu dan nakal : Azzam, Dede Kaila dan Dede Sena
terimakasih telah mendengar keluh kesah, memberi semangat dan kasih sayang
kepada penulis.
9. Teman-teman seperjuangan : Tias, Chotim, Indah, Salha, Dewi, Wawan,
Nandang, Usman, Pipit, Venti, Roji dan semua teman-teman PMT’38 atas
kebersamaan dan bantuan selama penelitian ini.
10.Anak-anak kost ”Wisma Maya” ; Ambar, Tina, Neng Sri, Mirna, Mba Umi,
Cacan, Ade Isti, Mba Uci, Wida dan Diah yang telah menjadi ’keluarga’
penulis selama di Bogor.
11. Anak-anak kost ”Ukhuwah”; Mba Rury, Mba Esti, Mba Ema dan Kasih atas
kebersamaannya.
12. Teman-teman FKRJ-A, BNC (A’Kamal, A’Iwang, Teh Lina, Teh Fa, Mute,
Tito, Mas Edwin, Mirwan, Aci, Hajar, Apip dan Mba Lia) dan semua temanteman yang tidak mungkin disebutkan satu persatu.
Akhirnya, semoga skripsi ini dapat bermanfaat bagi masyarakat pada
umumnya dan civitas akademik pada khususnya. Semoga Alloh SWT senantiasa
memberikan limpahan rahmat dan hidayahNya pada kita semua. Amin
Bogor, Januari 2006
Penulis
DAFTAR ISI
Halaman
PENDAHULUAN.......................................................................................
1
Latar Belakang ...............................................................................
1
Tujuan.............................................................................................
2
Hipotesis.........................................................................................
2
TINJAUAN PUSTAKA ............................................................................
3
Botani dan Ekologi Jahe .................................................................
3
Karakter Tanaman..........................................................................
5
Keragaman Jumlah Kromosom......................................................
6
Mutagen..........................................................................................
7
BAHAN DAN METODE...........................................................................
10
Waktu dan Tempat .........................................................................
10
Bahan dan Alat...............................................................................
10
Metode ............................................................................................
10
Pelaksanaan percobaan...................................................................
11
Pengamatan....................................................................................
12
HASIL DAN PEMBAHASAN................................................................. .
15
Pengaruh Kolkisin terhadap Keragaan Fenotipe………………... .
17
Pengaruh Kolkisin terhadap Jumlah Kromosom Jahe Emprit…...
23
KESIMPULAN DAN SARAN..................................................................
25
Kesimpulan………………………………………………………
25
Saran…………………………………………………………….. .
25
DAFTAR PUSTAKA.................................................................................
26
LAMPIRAN ................................................................................................
28
DAFTAR TABEL
Nomor
Halaman
Teks
1. Hasil Uji-t Pengaruh Kolkisin terhadap Keragaan Fenotipe Jahe Emprit... 16
2. Nilai Rata -rata dan Ragam Peubah Pengaruh Kolkisin terhadap
Keragaan Fenotipe Jahe Emprit................................................................... 17
Lampiran
1. Uji Kenormalan Nilai- F Pengaruh Kolkisin terhadap Keragaan Fenotipe
dan Jumlah Kromosom Jahe Emprit ……………………………………… 28
DAFTAR GAMBAR
Nomor
Halaman
Teks
1. Rumus Bangun Kolkisin Murni…………………………………………
8
2. Cara Pengukuran Panjang dan Lebar Stomata serta Lebar Sel Penjaga…
13
3. Daun Jahe Emprit yang Terkena Serangan Patogen Pyliosticta, sp……..
15
4. Keragaan Fenotipe Jahe Emprit …………………………………………
18
5. Bentuk Daun Jahe Emprit pada Berbagai Perlakuan…………………….
19
6. Bentuk Stomata Jahe Emprit pada Berbagai Perlakuan…………………
21
7. Keragaan Fenotipe Jahe Emprit setelah Panen………………………….
22
8. Keragaan Rimpang Jahe Emprit setelah Panen…………………………
22
9. Kromosom Jahe Emprit pada Beberapa Perlakuan………………………
24
PENDAHULUAN
Latar Belakang
Pengembangan tanaman obat di Indonesia sampai saat ini masih memiliki
peluang dan prospek yang sangat baik. Banyak kalangan mulai melirik untuk
mengembangkan tanaman obat, baik untuk kebutuhan sendiri maupun untuk
bisnis. Apalagi sejak masyarakat mulai sadar tentang manfaat tanaman obat untuk
menjaga dan memelihara kesehatan dengan makin menjamurnya industri-industri
obat tradisional di dalam maupun luar negeri. Hal ini juga ditunjang dengan
meningkatnya pandangan tentang segi positif mengkonsumsi bahan-bahan alam
(natural) dibandingkan bahan kimia atau sintesis. Berdasarkan latar belakang
tersebut maka beberapa pendapat mengatakan bahwa tanaman obat Indonesia
patut dan layak dikembangkan.
Pemakaian tanaman obat dalam dekade terakhir ini cenderung meningkat
sejalan dengan berkembangnya industri jamu atau obat tradisional, farmasi,
kosmetik, makanan dan minuman. Tanaman obat yang dipergunakan biasanya
dalam bentuk simplisia (bahan yang telah dikeringkan dan belum mengalami
pengolahan apapun). Simplisia tersebut berasal dari akar, daun, bunga, biji, buah,
terna, dan kulit batang (Syukur dan Hernani, 2002).
Jahe (Zingiber officinale Rosc.) merupakan salah satu tanaman obat yang
sangat penting dalam perekonomian masyarakat Indones ia. Selain areal yang
makin meluas, penggunaan jahe pun mengalami peningkatan. Saat ini penggunaan
jahe untuk kebutuhan sehari-hari dapat mencapai 90% dari total volume jahe yang
di ekspor. Jahe paling banyak digunakan sebagai bahan rempah-rempah dan
bumbu masak. Meluasnya penggunaan jahe tersebut menyebabkan ada
peningkatan serapan pasar dan volume perdagangan (Syukur, 2002).
Semakin pesatnya perkembangan sektor perindustrian, termasuk industri
yang menggunakan bahan baku jahe, mengharuskan bidang budidaya untuk
mendukung pengadaan bahan-bahan bermutu tinggi dan berkelanjutan yang
dibutuhkan ikut berkembang. Menurut Hasanah et al. (1992), kualitas dari bahan
tanaman yang digunakan merupakan faktor penting yang akan menentukan
apakah pertanaman yang dihasilkan akan baik atau tidak.
2
Berdasarkan ukuran, bentuk dan warna rimpangnya ada 3 jenis jahe yang
terkenal yaitu 1) Jahe putih atau kuning sering disebut juga jahe badak atau jahe
gajah; rimpangnya lebih besar dan ruas rimpangnya lebih menggembung dari
jenis lainnya, 2) Jahe putih kecil atau emprit, dan 3) Jahe merah; rimpangnya
berwarna merah dan lebih kecil dari jahe emprit (Januwati, 1997).
Jahe emprit mempunyai keunggulan antara lain aromanya yang kurang tajam
dibanding jahe merah dan mempunyai kandungan minyak atsiri yang lebih besar
dibanding jahe gajah sehingga jahe emprit banyak digunakan pada industri jamu.
Pada umumnya jahe diperbanyak secara vegetatif dengan potongan atau setek
rimpang. Rimpang yang digunakan untuk benih adalah bahan yang sudah terpilih
sejak di pertanaman, baik kultivar atau varietas memiliki keunggulan dan kondisi
lingkungan tempat tumbuhnya cukup baik.
Pada bunga jahe kepala putik berada diatas kepala sari yang menyebabkan
peluang terjadinya penyerbukan sendiri sangat kecil sedangkan peluang untuk
penyerbukan silang sangat besar namun tanaman jahe sangat jarang membentuk
bunga (Ajijah et al., 1997) sehingga diperlukan suatu upaya yang dapat
menghasilkan keragaman genetik pada jahe.
Salah satu upaya yang dapat dilakukan meningkatkan keragaman pada jahe
adalah mutasi. Mutasi adalah perubahan dalam struktur gen baik yang terjadi
secara spontan maupun secara buatan dengan menggunakan agensia fisik atau
kimia (Nasir, 2001) sedangkan senyawa kimia yang dapat digunakan untuk
menginduksi mutasi adalah kolkisin. Menurut Poespodarsono (1988), perlakuan
kolkisin termasuk perlakuan mutasi karena merubah kromosom yang berakibat
berubahnya sifat tanaman.
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mempelajari pengaruh konsentrasi
kolkisin terhadap keragaan fenotipe dan jumlah kromosom jahe emprit asal in
vitro.
Hipotesis
1. Pemberian kolkisin berpengaruh terhadap keragaan fenotipe jahe emprit.
2. Pemberian kolkisin berpengaruh terhadap jumlah kromosom jahe emprit.
TINJAUAN PUSTAKA
Botani dan Ekologi Jahe
Jahe adalah tanaman herba tahunan yang termasuk kelas tanaman berkeping
satu (Monocotyledon). Kata Zingiberaceae berpangkal dari bahasa sansekerta
“Zingiber” diterjemahkan secara bebas kedalam bahasa Indonesia artinya
“berbentuk seperti ta nduk” (Rismunandar, 1988).
Klasifikasi tanaman jahe secara lengkap adalah sebagai berikut :
Divisi
: Spermatophyta
Subdivisi
: Angiospermae
Kelas
: Monocotyledoneae
Ordo
: Zingiberales
Famili
: Zingiberacea
Genus
: Zingiber
Spesies
: Zingiber officinale
Tanaman jahe terdiri atas struktur rimpang, batang, daun, bunga dan buah.
Tanaman jahe memiliki daun yang terdiri dari upih dan helaian. Upih daun
melekat membungkus batang. Helaian daun tersusun berseling (folia disticha).
Setiap buku terdapat dua daun.
Batang jahe merupakan batang semu (pseudostems) berbentuk bulat (teres),
tegak, tidak bercabang, tersusun dari lembaran-lembaran pelepah daun, tinggi
mencapai 1 meter (30 - 100 cm). Batang berwarna hijau pucat, seringkali
berwarna kemerahan pada bagian pangkal. Setiap batang umumnya terdiri dari 8 12 helai daun (Jansen, 1981; Purseglove et al., 1981 dalam Ajijah et al., 1997)
Akar jahe berbentuk bulat, ramping, berserat berwarna putih sampai coklat
terang. Akar keluar dari garis lingkaran sisik rimpang. Pada jahe merah, akar
keluar hampir disekeliling sisik, nampak lebih kokoh, berserat, besar, panjang dan
kuat mencengkeram tanah, berbeda dengan akar pada jahe putih besar dan putih
kecil (Ajijah et al., 1997).
Bunga jahe majemuk, tersusun berupa mayang, panjang mayang 4 - 7 cm,
lebar 1.5 - 2 cm, bunga berbentuk tabung, setiap bunga dilindungi oleh daun
pelindung. Buah berbentuk bulat panjang seperti kapsul dengan tiga ruang biji,
4
masing-masing memiliki tujuh bakal biji. Biji jahe kecil, warna hitam selaput
rimpang bercabang tidak teratur umumnya kearah vertikal, kulit berbentuk sisik
tersusun melingkar dan berbuku-buku, warna kuning coklat sampai merah
tergantung jenisnya, daging berwarna kuning cerah, berserat, aromatik,
mengandung banyak metabolit sekunder, merupakan perubahan bentuk dari
batang yang terdapat didalam tanah. Rimpang jahe mempunyai bau yang spesifik,
berkisar antara bau yang tajam, pahit, langu sampai aromatis (Syukur dan
Hernani, 2002).
Berdasarkan ukuran, bentuk dan warna rimpangnya ada tiga jenis jahe yang
dikenal, yaitu jahe putih/kuning besar (disebut juga jahe badak atau jahe gajah),
jahe putih kecil atau emprit, dan jahe merah (Syukur dan Hernani, 2002). Jahe
badak/jahe gajah mempunyai rimpang lebih besar dan gemuk, ruas rimpangnya
lebih menggembung dari kedua varietas lainnya. Jahe putih /kuning kecil atau
disebut juga jahe sunti atau jahe emprit mempunyai ruas kecil, agak rata sampai
agak menggembung. Jahe ini selalu dipanen setelah berumur tua. Kandungan
minyak atsirinya lebih besar daripada jahe gajah, sehingga rasanya lebih pedas,
disamping seratnya tinggi. Sedangkan jahe merah selalu dipanen setelah tua dan
mempunyai kandungan minyak atsiri paling tinggi berkisar 2.58 - 3.90%, jahe ini
sering dibudidayakan dengan tujuan produksi minyak jahe, Jahe putih kecil
mempunyai kandungan minyak atsiri 1.5 - 3.5% atas dasar berat kering. Jahe ini
banyak digunakan dalam industri jamu, baik dalam bentuk jamu segar maupun
yang kering dan Jahe gajah mempunyai kandungan minyak atsiri 0.18 - 1.66%
atas dasar berat kering, jahe ini banyak digunakan untuk sayur, masakan,
minuman, permen dan rempah-rempah (Januwati, 1997).
Menurut Syukur (2002), jahe putih kecil atau lebih dikenal dengan jahe
emprit (Z. officinale var. rubrum) memiliki rimpang dengan bobot berkisar 0.5 0.7 kg per rumpun. Struktur rimpang jahe emprit kecil-kecil dan berlapis. Daging
rimpang berwarna putih kekuningan. Tinggi rimpangnya dapat mencapai 11 cm
dengan panjang antara 6 - 30 cm, dan diameter antara 3.27 - 4.05 cm. Akar ya ng
keluar dari rimpangnya berbentuk bulat. Panjang dapat mencapai 26 cm dan
diameternya berkisar antara 3.91 - 5.90 cm. Akar yang dikumpulkan dari satu
rumpun dapat mencapai 70 g lebih banyak dari akar jahe besar.
5
Menurut Mazza dan Oomah (2000) senyawa kimia yang terdapat pada jahe
antara lain gingerol, shogaol, diarylheptonoid dan terpenoid. Menurut Syukur dan
Hernani (2002) senyawa yang menyebabkan rasa pedas pada jahe adalah gingerol,
zingeron dan shogaol.
Dilihat dari lokasi penyebarannya, tanaman jahe tidak memerlukan lokasi
yang spesifik. Menurut Rismunandar (1988) tanaman jahe dapat tumbuh dan
berkembang dengan baik di daerah-daerah yang berlainan keadaan agro-iklimnya.
Sedangkan menurut Syukur dan Hernani (2002) tanaman jahe terutama
dibudidayakan di daerah tropika dengan ketinggian tempat antara 0 - 1700 m dpl,
dan yang terbanyak berada pada ketinggian menengah yaitu antara 350 - 600 m
dpl.
Di Indonesia, pertanaman jahe yang baik umumnya berada pada daerah yang
memiliki curah hujan antara 2500 - 4000 mm dalam setahun. Secara umum, lokasi
yang baik untuk pertanaman jahe terletak pada daerah-daerah yang memiliki
curah hujan hampir sepanjang tahun sehingga waktu tanam dapat dilakukan
sepanjang tahun.
Iklim yang ideal yang dikehendaki tanaman jahe adalah iklim panas sampai
sedang. Pada pertumbuhan vegetatif tanaman jahe memerlukan sinar matahari
yang sangat banyak sehingga akan membentuk rumpun dan rimpang yang banyak
serta
berukuran
besar.
Dalam
kondisi
ternaungi,
tanaman
jahe
akan
memperlihatkan pertumbuhan daun yang besar-besar dan memiliki rimpang yang
kecil-kecil.
Tanah yang banyak mengandung humus, subur dan gembur dengan drainase
yang baik merupakan lahan yang disukai jahe. Tanaman ini ditanam di berbagai
tipe tanah, tetapi akan lebih baik pada jenis latosol dan andosol.
Karakter Tanaman
Karakter tanaman dikendalikan oleh gen dalam sel tanaman itu sendiri.
Karakter tanaman yang tampak secara visual disebut dengan fenotipe. Fenotipe
merupakan pengaruh interaksi antara faktor genetik dan lingkungan. Oleh karena
itu setiap upaya untuk memperbaiki penampilan fenotipe tanaman haruslah
6
dimulai dari perbaikan susunan genetik (genotipe) dan memanipulasi lingkungan
yang sesuai dengan persyaratan tumbuh tanaman tersebut (Nasir, 2001).
Menurut Poespodarsono (1988), fenotipe tanaman dapat dikategorikan atas
dua bentuk karakter yaitu karakter kualitatif dan karakter kuantitatif. Karakter
kualitatif biasanya dapat diamati dan dibedakan dengan jelas secara visual, karena
umumnya bersifat diskret. Biasanya karakter ini dikendalikan oleh satu atau
beberapa gen. Bila karakter ini dikendalikan oleh satu gen , maka disebut dengan
karakter monogenik, dan beberapa gen disebut dengan oligenik. Sifat kualitatif
adalah sifat secara kualitatif berbeda sehingga mudah dikelompokkan dan
biasanya dinyatakan dalam kategori. Sifat ini yang menjadi obyek penelitian
Mendel sehingga tercipta hukum Mendel.
Hasil pengamatan sel epidermis jahe yang dilakukan Rugayah (1994)
menunjukkan bahwa bentuk sel epidermis jahe bervariasi yaitu persegi empat atau
persegi enam dengan ukuran 10 - 50 x 7.50 - 18.75 ìm pada jahe putih dan 7.5 35 x 10 - 18.75 ìm pada jahe merah. Bentuk stomata tergolong dalam tipe
tetrasitik dengan ukuran 22.5 - 25 x 8.75 - 12.5 ìm pada jahe putih dan 18.75 22.5 x 10 - 12.5 ìm pada jahe merah (Ajijah et al., 1997).
Karakter kuantitatif umumnya dibedakan oleh banyak gen dan merupakan
hasil akhir dari suatu proses pertumbuhan dan perkembangan yang berkaitan
langsung dengan karakter fisiologi dan morfologis. Diantara kedua ka rakter ini,
karakter morfologis lebih mudah diamati, misalnya produksi tanaman sering
dijadikan obyek pemuliaan tanaman.
Keragaman Jumlah Kromosom
Perubahan jumlah kromosom merupakan salah satu sumber keragaman
genetik. Perubahan jumlah ini terjadi dengan penambahan atau pengurangan
kromosom-kromosom utuh atau satu set kromosom lengkap (genom).
Euploidi
Istilah ini menunjukkan keragaman dalam satu set kromosom lengkap
(genom). Kebanyakan eukariot memiliki jumlah kromosom diploid, yaitu = 2n =
2x, tetapi diantara tanaman pangan, hortikultura dan tanaman hias terdapat yang
7
tetraploid (2n = 4x) dan hexaploid (2n = 6x) yang estetik dan berguna bagi
manusia.
Monoploid
Satu set kromosom (genom), yaitu hanya ada satu homolog untuk setiap
kromosom dalam suatu individu. Haploid adalah istilah yang lebih umum
digunakan daripada monoploid, haploid menunjukkan jumlah kromosom gamet
dari diploid.
Menurut Ajijah et al., (1997), tanaman jahe mempunyai jumlah kromosom
2n = 2x =22 (diploid). Penulis lain melaporkan 2n = 22+2f. Sementara Rugayah
(1994) melaporkan bahwa hasil pengamatan awal terhadap jumlah kromosom jahe
putih dan jahe merah menunjukkkan kisaran jumlah yang sama yaitu 2n = 22-24.
Suatu organisme yang memiliki lebih dari dua set kromosom atau genom
dalam se l-sel somatiknya biasa disebut poliploid (Crowder, 1997; Poespodarsono,
1988). Banyak tanaman budidaya yang termasuk poliploid alami, antara lain
kacang tanah, tomat, ubi jalar, kapas, tembakau, tebu, nenas, kopi, dan
sebagainya. Berdasarkan kepentingan pemuliaan keadaan ini perlu dipelajari
dalam usaha untuk meningkatkan sifat tanaman yang diharapkan. Sejak
ditemukan kolkisin yang dapat menggandakan kromosom pada tahun 1937, maka
banyak
pemulia
tertarik
untuk
mendapatkan
tetraploid
secara
buatan
(Poespoda rsono, 1988).
Mutagen
Salah satu cara untuk meningkatkan keragaman genetik maupun untuk
mendapatkan ketahanan dapat dilakukan melalui mutasi. Mutasi adalah perubahan
dalam struktur gen baik yang terjadi secara spontan maupun secara buatan dengan
menggunakan agensia fisik atau kimia. Program mutasi dilaksanakan apabila
sumber gen untuk sifat ketahanan tidak terdapat pada plasma nutfah yang dimiliki
(Nasir, 2001).
Mutagen kimia terdiri dari agen alkilasi yang merupakan bahan kimia yang
sangat kuat dan banyak digunakan dalam pemuliaan mutasi dan bahan kimia
lainnya, mencakup analog basa Nitzchia, peroksida dan alkaloid tertentu yang
memiliki sifat-sifat mutagenik.
8
Salah satu alkaloid yang sering digunakan antara lain kolkisin. Menurut
Eigsti dan Dustin (1995) kolkisin merupakan suatu senyawa yang dapat diekstrak
dari umbi dan biji tanaman krokus (C. autumnale ) yang termasuk anggota famili
Liliaceae. Kolkisin murni mempunyai rumus kimia C22H25O6 N.
Gambar 1. Rumus Bangun Kolkisin Murni
Penggunaan kolkisin pada titik tumbuh dari tanaman akan mencegah
pembentukkan serabut-serabut gelendong dan pemisahan kromosom pada anafase
dari mitosis menyebabkan penggandaan kromosom tanpa pembentukkan dinding
sel, perlakuan ini dapat menyebabkan peningkatan jumlah kromosom sebelum
terjadi penggandaan (Crowder, 1997). Menurut Nasir (2001), penggandaan
kromosom dapat terjadi secara spontan atau buatan. Penggandaan buatan terjadi
bila pada pembelahan sel kromosom juga mengganda, tetapi nukleusnya gagal
mengganda sehingga me mbentuk inti dengan jumlah kromosom ganda. Bila
penggandaan kromosom terjadi segera setelah pembuahan maka individu yang
dihasilkan akan menjadi poliploid sempurna, sedangkan penggandaan pada tahap
perkembangan lanjut hanya membentuk sektor poliploid saja. Bila penggandaan
terjadi setelah meiosis, maka pengurangan gamet akan terbentuk dan bila dibuahi
dengan gamet normal maka akan terbentuk poliploidi tidak berimbang.
Metode yang paling penting dan berguna yaitu menggandakan jumlah
kromosom dengan perlakuan kolkisin yang dipekatkan dalam pasta lanolin atau
dalam larutan pada bahan vegetatif pasta kolkisin dioleskan pada titik tumbuh
bibit, atau bibit dapat dimasukkan kedalam larutan kolkisin dengan jalan
membalikkan tanaman muda atau merendamnya kedalam la rutan selama periode
9
waktu tertentu (Crowder, 1997). Menurut Eigsti dan Dustin (1957) lamanya
kontak antar sel tanaman dengan larutan kolkisin ini berkisar 24 - 96 jam.
Menurut Poespodarsono (1988), kepekaan terhadap perlakuan kolkisin amat
berbeda di antara spesies tanaman. Oleh karena itu baik konsentrasi maupun
waktu perlakuan akan berbeda pula, bahkan untuk bagian tanaman yang berbeda
akan lain pula dosis dan waktunya. Untuk biji yang cepat berkecambah, biji
direndam dalam larutan selama 1-5 hari sebelu m tanam. Untuk kecambah dicelup
kedalam larutan kolkisin selama 3-4 jam, sedangkan untuk tunas larutan dioleskan
atau diteteskan.
Tiap spesies mempunyai tanggapan yang berbeda terhadap konsentrasi
kolkisin yang diperlukan untuk mengubah posisi kromosom. Biasanya 0.5 - 1.0%
pasta atau larutan kolkisin dapat menimbulkan poliploidi. Kolkisin
ternyata
mengganggu pembentukkan serabut gelendong dan sitokenesis berikutnya,
sehingga membentuk sel dengan jumlah kromosom yang meningkat. Perlakuan
kolkisin biasanya mengakibatkan perbedaan tingkat ploidi dalam jaringan batang,
karena itu perlu membuat pemeriksaan sitologis dari mixoploid untuk
mengidentifikasi tetraploid (Crowder, 1997).
Penggunaan kolkisin hanya untuk tujuan yang mempunyai arti penting,
karena harganya cukup mahal. Disamping untuk tujuan pemuliaan biasanya
digunakan pula pada penelitian-penelitian. Perlakuan kolkisin termasuk perlakuan
mutasi karena merubah kromosom yang berakibat berubahnya sifat tanaman
(Poespodarsono, 1988).
BAHAN DAN METODE
Tempat dan Waktu
Penelitian ini dilakukan di Laboratorium Kultur Jaringan, Departemen
Agronomi dan Hortikultura, IPB dan rumah plastik Laboratorium Ilmu dan
Teknologi
Benih,
Leuwikopo,
Darmaga.
Laboratorium
Ekofisiologi,
Laboratorium Pusat Studi Pemuliaan Tanaman dan Teknologi Benih (Research
Group on Crop Improvement), Departemen Agronomi dan Hortikultura IPB dan
Herbarium Bogoriense bagian Anatomi Dan Sitologi, LIPI Bogor. Penelitian
dilakukan dari bulan Desember 2004 sampai September 2005.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah tanaman jahe emprit hasil
perbanyakan in vitro, media MS, arang sekam, pupuk N, P, dan K, Dithane,
Agrimicyn, kolkisin dan pupuk kandang.
Alat yang digunakan terdiri dari gelas plastik, polybag, Hand sprayer dan
alat-alat penunjang penelitian lain.
Media tanam yang digunakan terdiri dari dua media. Media aklimatisasi
menggunakan arang sekam dan cocopit dengan perbandingan 1:1. Sedangkan
media lapangan menggunakan tanah, arang sekam dan pupuk kandang yang telah
disterilisasi dengan perbandingan 1:1:1.
Metode Penelitian
Penelitian dilaksanakan menggunakan faktor tunggal, yaitu konsentrasi
kolkisin. Rancangan yang digunakan dalam penelitian adalah rancangan acak
lengkap dengan tiga perlakuan yaitu tanpa kolkisin sebagai kontrol, dengan
kolkisin 0.25% dan 0.50%. Setiap perlakuan tiga ulangan sehingga terdapat
sembilan satuan percobaan dan setiap satuan percobaan terdiri atas lima tanaman.
Menurut Mattjik dan Sumertajaya (2000) model rancangan yang digunakan
adalah :
Yij = µ + α i + åij
Dengan i = 1, 2,…,t dan j = 1, 2,…,r
11
Keterangan lambang :
Yij
: Pengamatan pada konsentrasi ke-i dan ulangan ke-j
µ
: Rataan umum
αi
: Pengaruh konsentrasi ke -i
åij
: Pengaruh acak pada konsentrasi ke-i ulangan ke-j
Uji statistik yang digunakan adalah uji-t dengan menggunakan fasilitas
MINITAB.
Pelaksanaan
Pembuatan Larutan Kolkisin
Sebelum dibuat larutan perlakuan (0.25 % dan 0.50 %) terlebih dahulu
membuat larutan stok dengan konsentrasi 1 % (1 g kolkisin dalam 100 ml air
destilata steril). Pembuatan larutan perlakuan menggunakan teknik pengenceran.
Pembuatan larutan 0.25 % dilakukan dengan memipet larutan stok kolkisin
sebanyak 20ml dan ditambahkan air destilata sebanyak 60ml. Larutan 0.50 %
dibuat denga n menambahkan 40 ml larutan stok kedalam 40 ml air destilata steril.
Perlakuan kontrol (kolkisin 0 %) adalah air destilata steril 80 ml. larutan dibagi
dua dimasukkan kedalam botol sehingga masing-masing berisi 40 ml.
Pembuatan larutan kolkisin dilakukan di ruang asam. Pada waktu membuat
larutan kolkisin digunakan alat pengaman yaitu sarung tangan karet dan masker
khusus.
Perendaman Planlet Jahe Emprit Dengan Kolkisin
Planlet jahe emprit asal in vitro direndam dengan agrimycin dan dithane
selama 10 menit kemudian dibilas dengan aquades lalu direndam dalam larutan
kolkisin selama 48 jam sedangkan untuk perlakuan kolkisin 0% direndam dalam
air destilata selama 48 jam.
Penanaman
Media aklimatisasi (arang sekam steril) disiapkan dalam gelas plastik. Pla nlet
yang sudah direndam kolkisin ditanam pada media tersebut. Aklimatisasi
dilakukan selama 1 bulan.
12
Tanaman jahe yang berumur 1 bulan dipindahkan ke dalam media yang berisi
tanah, arang sekam dan pupuk kandang dengan perbandingan 1:1:1 yang telah
disterilisasi dan diberi pupuk NPK dalam polibag dan ditanam selama 5 bulan.
Pengamatan
Pengamatan dilakukan pada semua tanaman dengan dua tahap pengamatan,
yaitu pengamatan ketika di media aklimatisasi dan di lapangan. Variabel-variabel
yang diamati ketika tanaman di media aklimatisasi adalah :
1. Jumlah daun
2. Tinggi tanaman.
3. Jumlah anakan.
Variabel yang diamati pada tanaman jahe di lapangan sampai panen adalah :
1. Tinggi tanaman diukur dari pangkal batang sampai daun yang paling tinggi.
2. Jumlah daun
3. Diameter batang diukur pada ruas batang yang terbesar dengan menggunakan
jangka sorong.
4. Jumlah anakan
5. Bobot rimpang setelah dipanen
6. Bobot brangkasan setelah dipanen
7. Kandungan klorofil.
8. Kerapatan stomata, lebar stomata, panjang stomata dan lebar sel penjaga
9. Jumlah Kromosom
Penetapan kadar klorofil dilakukan dengan mengambil daun ke -3 atau ke-4
tanaman jahe, kemudian daun segar tersebut ditimbang sebanyak 50 mg lalu
digerus didalam mortar. Gerusan daun tersebut ditambahkan 2 ml aseton 80 %
lalu disentrifuge. Ekstraksi diulangi sampai warnanya tidak berubah kemudian
ditera
sampai
10
ml.
Contoh
tersebut
dibaca
absorbannya
dengan
spektrofotometer (SHIMADZU : UV – 1201) pada panjang gelombang 663 dan
645 nm. Kadar klorofil dalam mg klorofil/g daun segar ditetapkan dengan
persamaan berikut :
Klorofil-a (mg/g) :
{(12,7 x A663) - (2,69 x A645)}
xfp
Bobot Contoh
13
Klorofil-b (mg/g) :
{(12,7 x A663) - (2,69 x A645)}
xfp
Bobot Contoh
Klorofil Total : Klorofil-a + Klorofil-b
fp : Faktor Pengenceran = 10 ml x
1
1000 ml
Pengamatan kerapatan dan ukuran stomata dilakukan dengan mencetak
epidermis daun dengan kuteks. Daun yang dipilih adalah daun ke-3 sampai daun
ke-5 dan kuteks dioleskan pada permukaan bawah daun. Kuteks yang telah kering
dipindahkan ke gelas obyek kemudian ditutup dengan gelas penutup dan
direkatkan dengan kuteks. Kerapatan stomata diamati dibawah mikroskop dengan
perbesaran 40X dan dihitung jumlah stomata per bidang pandang. Pengamatan
lebar somata, panjang stomata dan lebar sel penjaga dilakukan secara digitasi
denga n menggunakan software TPS dig . Gambar 2 menunjukkan cara
penghitungan ukuran stomata.
Lebar stomata
Panjang stomata
Lebar sel penjaga
Gambar 2. Cara Pengukuran Panjang dan Lebar Stomata serta Lebar Sel Penjaga
Penghitungan jumlah kromosom dilakukan dengan menggunakan metode
Darnaedi (1991). Bahan yang diambil adalah ujung akar. Pengambilan bahan ini
dilakukan pada pagi hari pada pukul 09.00-10.00.
Ujung akar dipotong 0.5 - 1 cm, kemudian dibilas dalam air untuk
menghilangkan kotorannya. Potongan ujung akar tersebut dimasukkan ke dalam
botol yang berisi 8 hidroksikuinolin 0.002 M (0.3 g/l akuades) selama 3 - 5 jam.
14
Potongan ujung akar dimasukkan ke dalam air bersih lalu dibuang tudung
akarnya. Selanjutnya akar tersebut dimasukkan ke dalam asam asetat 45% selama
10 menit, kemudian dimasukkan ke dalam larutan yang terdiri atas campuran 1
NHCl : asam asetat 45% (b/v) = 3:1. Selanjutnya akar tersebut direbus ke dalam
air pada suhu 800 C selama 3 - 5 menit, setelah itu diangkat dan dimasukkan ke
dalam pewarna orsein 2% lalu dipindahkan ke gelas preparat dan ditutup dengan
gelas penutup. Selanjutnya akar dipukul-pukul perlahan dengan pangkal pensil
berkaret, kemudian gelas penutup ditekan halus dan pinggirnya dilekatkan dengan
kuteks tak berwarna. Kromosom diamati di bawah mikroskop.
Foto preparat kromosom diolah dengan menggunakan program komputer
Adobe Photoshop. Penggunaan progam komputer tersebut untuk memperbesar
dan memperjelas foto kemudian hasilnya dicetak lalu dihitung jumlah
kromosomnya.
HASIL DAN PEMBAHASAN
Kondisi Umum
Pertumbuhan tanaman jahe pada saat aklimatisasi sangat baik, presentase
pertumbuhan bibit tanama n jahe mencapai 100 %, namun pada saat 2 MST
tanaman jahe yang ditanam pada saat aklimatisasi terkena serangan penyakit
bercak daun yang disebabkan oleh patogen Pyliosticta sp. dengan gejalanya antara
lain muncul bercak pada daun kemudian daun menguning dan akhirnya
mengering (Gambar 3).
Gambar 3. Daun Jahe Emprit yang Terkena Serangan Patogen Pyliosticta sp
Menurut Ernawati et al. (1993) persentase keberhasilan aklimatisasi
bervariasi di antara asal tanaman yang berbeda. Kematian bibit terutama terjadi
pada saat aklimatisasi karena belum adaptif terhadap kondisi yang tidak aseptik,
suhu maupun cahaya yang berbeda dari kondisi in vitro sebelumnya. Persentase
planlet hasil percobaan yang berhasil dipindahkan ke lapangan umumnya rendah.
Rendahnya keberhasilan ini karena terlambatnya waktu mengeluarkan planlet dari
botol sehingga akarnya melingkar-lingkar dan kemungkinan besar akar ini akan
rusak ketika dikeluarkan dari botol.
Tingkat kematian tertinggi mencapai 50 % saat bibit jahe dipindahkan ke
lapangan. Hal ini disebabkan karena kondisi suhu di rumah plastik yang cukup
tinggi berkisar 340 C sehingga tanaman mengalami stress karena kekurangan air.
Selain itu, kematian bibit jahe tersebut disebabkan karena penyakit bercak daun
yang menyerang tanaman jahe dari awal tanam sampai panen.
Secara umum pemberian kolkisin tidak berbeda nyata untuk semua
peubah-peubah fenotipe. Pemberian kolkisin
berpengaruh terhadap jumlah
16
kromosom dimana perlakuan 0.25 % dan 0.50 % mengalami penggandaan jumlah
kromosom.
Tabel 1. Hasil Uji-t Pengaruh Kolkisin terhadap Keragaan Fenotipe Jahe Emprit
Peubah
Lebar Stomata
Panjang Stomata
Lebar Sel Penjaga
Klorofil a
Klorofil b
Klorofil Total
Bobot Rimpang
Bobot Akar
Bobot Brangkasan
Tinggi Tanaman
Jumlah Daun
Jumlah Anakan
Diameter Batang
Uraian
K0 vs K1
K0 vs K2
K1 vs K2
K0 vs K1
K0 vs K2
K1 vs K2
K0 vs K1
K0 vs K2
K1 vs K2
K0 vs K1
K0 vs K2
K1 vs K2
K0 vs K1
K0 vs K2
K1 vs K2
K0 vs K1
K0 vs K2
K1 vs K2
K0 vs K1
K0 vs K2
K1 vs K2
K0 vs K1
K0 vs K2
K1 vs K2
K0 vs K1
K0 vs K2
K1 vs K2
K0 vs K1
K0 vs K2
K1 vs K2
K0 vs K1
K0 vs K2
K1 vs K2
K0 vs K1
K0 vs K2
K1 vs K2
K0 vs K1
K0 vs K2
K1 vs K2
t
0.79
0.47
-0.68
-0.09
-1.11
-1.40
1.08
0.28
-0.74
-1.61
-0.89
0.51
-1.55
-0.69
0.66
-1.60
-0.83
0.55
0.49
0.09
-0.36
0.80
0.17
-0.62
1.09
1.15
0.22
0.07
0.22
0.29
0.53
1.04
0.39
1.13
0.19
-0.73
0.44
0.27
-0.21
P
0.573
0.722
0.509
0.944
0.466
0.189
0.392
0.796
0.482
0.168
0.426
0.624
0.183
0.531
0.525
0.171
0.453
0.596
0.712
0.934
0.73
0.571
0.876
0.55
0.472
0.456
0.832
0.957
0.864
0.777
0.607
0.356
0.702
0.295
0.859
0.487
0.735
0.832
0.836
17
Pengaruh Kolkisin terhadap Keragaan Fenotipe Jahe Emprit
Pemberian kolkisin secara umum tidak berpengaruh nyata terhadap
peubah-peubah yang digunakan untuk mengamati keragaan fenotipe seperti :
tinggi tanaman, jumlah daun, jumlah anakan, diameter batang, ukuran stomata,
bobot panen dan kandungan klorofil.
Tabel 2. Nilai Rata-rata dan Ragam Peubah Pengaruh Kolkisin terhadap Keragaan
Fenotipe Jahe Emprit
Konsentrasi Kolkisin (%)
Peubah
0
0.25
0.5
50.7 ± 15.1
49.9 ± 11.1
48.2 ± 10.7
136.5 ± 12.0
126.4 ± 50.3
117.2 ± 36.8
Jumlah Anakan (tunas)
16.0 ± 1.4
13.8 ± 5.1
15.6 ± 4.2
Diameter Batang (mm)
6.5 ± 0.7
6.3 ± 0.7
6.3 ± 0.7
Bobot Rimpang (gram)
61.61 ± 17.52
54.61 ± 22.02
59.99 ± 28.87
Bobot Akar (gram)
43.85 ± 15.89
34.38 ± 11.25
40.93 ± 28.99
Bobot Brangkasan (gram)
76.79 ± 28.93
53.77 ± 14.97
51.84 ± 16.16
14 ± 0
13 ± 2
14 ± 2
Lebar Stomata (mm)
0.0050 ± 0.0360
0.0029 ± 0.0029
0.0038 ± 0.0020
Panjang Stomata (mm)
0.0360 ± 0.0064
0.0365 ± 0.0087
0.0417 ± 0.0053
Lebar Sel Penjaga (mm)
0.0185 ± 0.0280
0.0157 ± 0.0048
0.0177 ± 0.0047
Klorofil a
0.5692 ± 0.0733
0.7095 ± 0.2096
0.6550 ± 0.1827
Klorofil b
0.2421 ± 0.0284
0.2937 ± 0.0802
0.2670 ± 0.0678
Klorofil Total
0.8113 ± 0.1017
1.0032 ± 0.2891
0.9219 ± 0.2505
Tinggi Tanaman (cm)
Jumlah Daun (helai)
Kerapatan Stomata
(per bidang pandang)
Tinggi Tanaman
Berdasarkan data Tabel 2, tanaman jahe dengan perlakuan kolkisin 0.25 %
dan 0.50 % lebih rendah dibandingkan tanaman dengan perlakuan kolkisin
kolkisin 0 %. Tanaman yang tidak diberi kolkisin memiliki nilai rata-rata dan
ragam yang lebih tinggi yaitu 50.7 cm dan ragam 15.1 lebih tinggi dibandingkan
tanaman yang diberi kolkisin.
18
Gambar 4. Keragaan Fenotipe Jahe Emprit (K0 : kolkisin 0 %, K1 : kolkisin
0.25 % dan K2 : kolkisin 0.50 %)
Menurut penelitian Ramachandran dan Nair (1992), tanaman jahe
tetraploid mempunyai daun lebih rindang, rapat dan berwarna lebih hijau
dibandingkan tanaman diploid. Sedangkan berdasarkan penelitian ini, keragaan
tanaman jahe terlihat pada Gambar 4.
Ketidakstabilan ukuran tinggi tanaman disebabkan karena adanya upaya
untuk mencegah penyakit bercak daun dengan memotong daun yang terkena
penyakit tersebut.
Jumlah Anakan
Hasil penelitian Dwiningsih (2004) menunjukkan pemberian kolkisin pada
tunas jahe emprit dalam kultur in vitro dapat menyebabkan jumlah tunas lebih
rendah dibandingkan perlakuan tanpa kolkisin.
Berdasarkan penelitian ini, tanaman tanpa perlakuan kolkisin memiliki
jumlah anakan yang lebih banyak dibandingkan tanaman dengan pemberian
kolkisin 0.50 % dan kolkisin 0.25 %. Sedangkan tanaman dengan perlakuan
kolkisin 0.50 % memiliki jumlah anakan yang lebih banyak dibandingkan dengan
kolkisin 0.25 %. Hal ini dapat dilihat pada Tabel 2, rata-rata jumlah anakan pada
tanaman tanpa kolkisin 16 tunas, sedangka n nilai keragaman tertinggi terdapat
pada tanaman dengan pemberian kolkisin 0.25% sebesar 5.1 meskipun secara
statistik tidak berbeda nyata.
Faktor penggunaan bibit jahe dan cara perbanyakan berpengaruh terhadap
peningkatan jumlah anakan yang dihasilkan. Menurut Rahardjo (1997)
penggunaan bibit tunas dapat meningkatkan jumlah anakan dan kadar karbohidrat
rimpang, tetapi tidak berpengaruh terhadap peningkatan tinggi tanaman, bobot
segar rimpang dan nisbah bobot kering rimpang/brangkasan.
19
Jumlah Daun
Pada peubah jumlah daun, tanaman jahe tanpa perlakuan kolkisin memiliki
jumlah daun yang paling banyak dibandingkan perlakuan lain. Berdasarkan Tabel
2, Tanaman tanpa kolkisin memiliki rata -rata jumlah daun 136.5 lebih banyak
dibandingkan tanaman jahe pada perlakuan lain. Sedangkan tanaman jahe dengan
perlakuan 0.25 % memiliki jumlah daun yang lebih banyak dibandingkan tanaman
pada perlakuan lain.
Berdasarkan Gambar 5, pada salah satu tanaman contoh, pemberian
kolkisin dengan konsentrasi 0.25 % mengakibatkan tanaman memiliki daun yang
lebih lebar dan panjang tetapi lebih jarang dibandingkan dengan perlakuan yang
lain. Tanaman dengan perlakuan kolkisin 0.50 % memiliki daun yang lebar,
panjang dan lebih rapat dibandingkan tanaman dengan perlakuan kolkisin 0.25 %
sedangkan tanaman dengan perlakuan tanpa kolkisin memiliki daun yang paling
kecil tetapi lebih rapat dibandingkan dengan perlakuan lainnya.
Gambar 5. Bentuk Daun Jahe Emprit pada Berbagai Perlakuan (K0 : kolkisin 0 %,
K1 : kolkisin0.25 % dan K2 : kolkisin 0.50 %)
Menurut Rahayu (1999) daun tanaman kacang tanah dengan kolkisin
secara umum lebih lebar daripada tanaman tanpa kolkisin walaupun secara
statistik tidak berbeda nyata. Sesuai dengan ukuran daun yang menjadi lebih
pendek dan lebih lebar, bentuk helai daun tanaman dengan kolkisin menjadi lebih
bulat (bulat telur terbalik / obovate hingga lanset terbalik / oblanceolet)
dibandingkan dengan tanaman tanpa kolkisin yang bentuk daunnya berbentuk
lonjong / elliptik.
20
Diameter Batang
Batang merupakan bagian tubuh tumbuhan yang amat penting, tumbuhan
berkeping dua (Dicotyledoneae) pada umumnya
mempunyai batang yang
dibagian bawahnya lebih besar dan ke ujung semakin mengecil. Jadi batangnya
dapat dipandang sebagai suatu kerucut atau limas yang ama t memanjang yang
dapat
mempunyai
percabangan
atau
tidak.
Tumbuhan
biji
tunggal
(Monocotyledoneae) sebaliknya mempunyai batang yang dari pangkal sampai ke
ujung dikatakan tidak ada perbedaan besarnya. (Tjitrosoepomo, 2001).
Berdasarkan Tabel 2, pemberian kolkisin secara statistik tidak berpengaruh
nyata, namun tanaman tanpa pemberian kolkisin memiliki rata -rata diameter
batang lebih besar dibandingkan tanaman dengan kolkisin tetapi keragaman pada
setiap perlakuan tidak berbeda. Menurut Arisumi (1973) tanaman tetraploid
mempunyai batang, bunga dan daun yang lebih besar dan tebal dibandingkan
tanaman diploid.
Ukuran Stomata
Stomata pada permukaan daun tanaman mengatur pertukaran gas antara
atmosfer dengan tanaman sehingga berpengaruh terhadap fotosintesis dan
transpirasi. Kadang stomata hanya terdapat di permukaan bawah daun, tapi sering
ditemui di kedua permukaan meskipun lebih banyak terdapat di bagian permukaan
bawah daun (Salisbury dan Ross, 1995). Oleh karena itu pada penelitian ini
bagian yang diamati adalah bagian bawah.
Hasil penelitian Rahayu (1999) ukuran stomata dan sel penjaga tanaman
dengan kolkisin menjadi lebih lebar dibanding tanaman tanpa kolkisin.
Berdasarkan Tabel 2, tanaman tanpa pemberian kolkisin memiliki lebar stomata
dan lebar sel penja ga lebih besar dibandingkan tanaman dengan pemberian
kolkisin. Pemberian kolkisin 0.50 % memiliki panjang stomata lebih besar
dibandingkan tanaman pada perlakuan lain meskipun secara statistik tidak berbeda
nyata.
Perlakuan kolkisin dengan konsentrasi yang lebih tinggi lebih banyak
jumlah stomatanya dibandingkan tanaman dengan konsentrasi kolkisin yang lebih
rendah dan tanaman tanpa kolkisin. Berdasarkan penelitian Arisumi (1973),
21
tanaman Impatiens tetraploid mempunyai stomata dan polen yang lebih besar
dibandingkan tanaman diploid. Menurut Lu dan Bridgen (1997), tanaman
Alstroemaria diploid mempunyai 39 stomata per mm 2 dan yang tetraploid
mempunyai kerapatan stomata lebih rendah, yaitu 22 stomata per mm2. Sel
penjaga stomata tanaman tetraploid lebih besar daripada yang diploid.
Rendahnya jumlah stomata pada penelitian ini, diduga dikarenakan
pengaruh suhu yang tinggi pada rumah plastik. Hasil penelitian Woodword (1987)
menunjukkan bahwa kerapatan stomata sangat bergantung pada konsentrasi CO 2,
yaitu bila CO2 tinggi, jumlah stomata persatuan luas lebih sedikit. Stomata
tumbuhan pada umumnya membuka saat matahari terbit dan menutup pada saat
hari gelap sehingga memungkinkan masuknya CO2 yang diperlukan untuk
fotosintesis pada siang hari. Sebagian besar tumbuhan, konsentrasi CO2 yang
rendah di daun juga membuat stomata membuka. Jika udara bebas CO2 yang
dihembuskan melalui daun sekalipun pada malam hari, maka stomata yang
terbuka sedikit akan membuka lebih lebar. Sebaliknya, konsentrasi CO 2 yang
tinggi di daun menyebabkan stomata menutup sebagian dan ini terjadi saat terang
maupun gelap. Bila stomata tertutup sama sekali (keadaan yang tak lazim terjadi)
udara luar yang bebas CO2 tidak berpengaruh lagi. Selain itu, suhu tinggi (30
sampai 35 0C) biasanya menyebabka n stomata menutup.
A
B
C
Gambar 6. Bentuk Stomata Tanaman Jahe Emprit pada perlakuan A.Tanpa
kolkisin B.0.25% dan C.0.50%
22
Bobot Rimpang, Akar dan Brangkasan Jahe Emprit
Menurut Ramachandran dan Nair (1992) tanaman jahe tetraploid memiliki
rimpang yang lebih rapat, internodenya lebih panjang dan kurang bercabang
dibandingkan tanaman diploid.
Berdasarkan Tabel 2, tanaman tanpa kolkisin memiliki bobot rimpang,
akar dan brangkasan yang paling besar dibandingkan tanaman dengan perlakuan
kolkisin walaupun secara statistik tidak berbeda nyata. Diduga faktor naungan di
lapangan berpengaruh terhadap pembentukkan rimpang. Goldy dan Lyrene (1984)
berpendapat bahwa rumah kaca yang digunakan untuk menanam tanaman
autopoliplodi dapat menurunkan vigor dan memperlambat pertumbuhan.
Bentuk rimpang, akar dan brangkasan setelah panen ditunjukkan pada
gambar 7 dan Gambar 8 menunjukkan rimpang jahe setelah panen.
Gambar 7. Keragaan Fenotipe Jahe Emprit Setelah Panen (K0 : kolkisin
0 %, K1 : kolkisin 0.25 % dan K2 : kolkisin 0.50 %)
Gambar 8. Rimpang Jahe Emprit Setelah Panen (K0 : kolkisin 0 %,
K1 : kolkisin 0.25 % dan K2 : kolkisin 0.50 %)
23
Kandungan Klorofil Jahe Emprit
Klorofil a dan b merupakan sebagian besar pigmen yang berada didalam
lamela kloroplas, selain juga karotenoid (Gardner, Pearce, dan Mitchell dalam
Rahayu, 1991).
Berdasarkan Tabel 2, Tanaman dengan perlakuan kolkisin 0.25 %
memiliki kandungan klorofil a dan b lebih besar dibandingkan dengan tanaman
pada perlakuan lain. Pengamatan secara visual juga mendukung hal tersebut, yaitu
tanaman jahe yang diberi kolkisin 0.25 % lebih hijau dibandingkan dengan yang
lainnya. Hal ini disebabkan karena kloroplas muda aktif membelah yang sehingga
terpengaruh oleh perlakuan kolkisin (Salisbury dan Ross, 1995).
Pengaruh Kolkisin terhadap Jumlah Kromosom Jahe Emprit
Penggunaan kolkisin pada titik tumbuh dari tanaman akan mencegah
pembentukkan serabut-serabut gelendong dan pemisahan kromosom pada anafase
dari mitosis menyebabkan penggandaan kromosom tanpa pembentukkan dinding
sel. Perlakuan ini dapat menyebabkan peningkatan jumlah kromosom sebelum
terjadi penggandaan kromosom dapat terlihat jelas selama tahap-tahap tertentu
dari pembelahan inti. Biasanya kromosom digambarkan pada tahap metafase
(Crowder, 1997).
Menurut Eigsti dan Dustin (1955) sel tanaman cenderung lebih tahan
terhadap konsentrasi kolkisin yang lebih tinggi. Kolkisin dapat berdifusi cepat
melalui jaringan tanaman dan dapat diedarkan melalui sistem pembuluh.
Konsentrasi yang aktif kontak dengan sel dalam waktu yang lama. Diduga
toksisitasnya rendah dan penyimpanan dalam sel yang lama dapat menyebabkan
penggandaan jumlah kromosom.
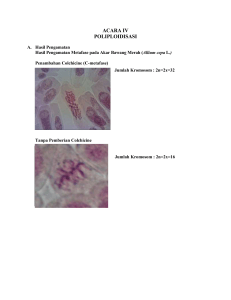
Sel akar diploid tanaman jahe mempunyai 22 kromosom, dan pada meiosis
terlihat 11 bivalent pada metafase I. Sel akar tanaman tetraploid mempunyai 44
kromosom dan pada saat meiosis bentuk kromosom bervariasi (Ramachandran
dan Nair, 1992) Berdasarkan penelitian ini, pemberian kolkisin pada tanaman jahe
berpengaruh terhadap jumlah kromosom. Tanaman jahe kontrol (K0) memiliki
kisaran jumlah kromosom 2n = 22 - 27, sedangkan tanaman yang diberi kolkisin
0.25 % mengalami penggandaan kromosom dengan kisaran 2n = 36 – 48 dan
24
tanaman
yang diberi perlakuan kolkisin
0.50 % memiliki kisaran jumlah
kromosom 2n = 43 – 84 (Gambar 9).
Menurut Sutjajo et al. (1993) hasil analisis sitologi terhadap jumlah
kromosom sel ujung akar dari keturunan ke dua varietas semangka yang diberi
perlakuan kolkisin menunjukkan bahwa jumlah set kromosom (ploidi) dari
tanaman tersebut mengalami perubahan (mutasi) dengan frekuensi total antara 0
% sampai 25 % bergantung tingkat konsentrasi kolkisin yang digunakan.
A
B
C
Gambar 9. Kromosom jahe emprit pada beberapa perlakuan A.Tanpa kolkisin
B. Kolkisin 0.25% dan C. Kolkisin 0.50%
Menurut Poespodarsono (1988) dengan bertambahnya jumlah kromosom
dapat mengakibatkan meningkatnya ukuran sel dan produksi. Namun ternyata
dapat terjadi sebaliknya karena menurunnya fertilitas.
KESIMPULAN DAN SARAN
Kesimpulan
Pemberian kolkisin terhadap jahe emprit asal in vitro secara umum tidak
berpengaruh terhadap keragaan fenotipe dan hanya berpengaruh terhadap jumlah
kromosom.
Penggandaan jumlah kromosom tanaman jahe pada perlakuan kolkisin
dengan konsentrasi 0.25% memiliki kisaran jumlah kromosom 2n = 36 - 48,
konsentrasi kolkisin 0.50% memiliki kisaran jumlah kromosom 2n = 43 - 84
sedangkan tanaman jahe tanpa kolkisin memiliki kisaran jumlah kromosom 2n =
22 - 27.
Saran
Perlu dilakukan penelitian lebih lanjut terhadap kandungan minyak atsiri
jahe emprit dan penanaman sebaiknya tidak di rumah plastik tetapi di lapangan.
DAFTAR PUSTAKA
Ajijah, N., B. Martono, N. Bermawie dan E.A. Haddad. 1997. Botani dan
Karakteristik. Monograf No.3 Jahe. Balitro. Bogor.
Arisumi, T. 1973. Morphology and breeding behavior of colchicines induced
polyploidy Impatiens spp. L. Amer. Soc. Hort. Sci. 98 (6) : 599-601.
Biro Pusat Statistik. 2003. Statistik Indonesia 2002. Jakarta.
Crowder, L.V. 1997. Genetika Tumbuhan (Diterjemahkan oleh Lilik Kusdiarti).
Cet-5. Gadjah Mada University Press. Yogyakarta. 499 hal.
Dwiningsih, W. 2004. Pengaruh Lama Perendaman dan Konsentrasi Kolkisin
terhadap Pertumbuhan Tunas Jahe Emprit. Skripsi. Departemen Budidaya
Pertanian. Institut Pertanian Bogor. Bogor. 32 hal.
Eigsti, O.J. and P. Dustin. 1995. Colchicine in Agriculture, Medicine, Biology,
and Chemistry. The Iowa State College Press. Ames, Iowa. 470p.
Goldy, R.G., and P.M. Lyrene. 1984. In vitro colchicines treatment of 4x
blueberries, Vaccinium sp. J. Amer. Soc. Hort. Sci. 109 (93) : 336-338.
Hasanah, M., I. Mariska., dan D. Sitepu. 1992. Persyaratan Bahan Tanaman
Bermutu Tanaman Obat. Prosiding Forum Komunikasi Ilmiah Hasil
Penelitia n Plasma Nutfah dan Budidaya Tanaman Obat. Balitro. Bogor.
Hobir dan I. Mariska. 1997. Perbenihan tanaman rempah dan obat. Prosiding
Forum Konsultasi Ilmiah. Balitro. Bogor.
Januwati, M dan Rosita S.M.D. 1997. Perbanyakan benih. Balitro. Bogor.
Monograf No.3:40-50.
Kikuzaki, H. 2000. Ginger for drug and spice purposes. p.77-83. In:G. Mazza and
B.D. Oomah (Eds.). Herbs, Botanicals and Teas. Technomic Publishing Co,
Inc. Lancaster-Basel.
Lu, C. and M.P. Bridgen. 1997. Chromosome doubling and fertility study of
Alstroemeria Aurea x A. Caryophyllaea. Euphytica 94 : 75-81.
Mattjik, A.A. dan M. Sumertajaya. 2000. Perancangan Percobaan dengan
Aplikasi SAS dan Minitab. IPB Press. Bogor. 326 hal.
Nasir, M. 2001. Pengantar Pemuliaan Tanaman. Direktorat Jenderal Pendid ikan
Tinggi. Depdiknas. Jakarta. 325 hal.
Poespodarsono, S. 1988. Dasar-dasar Ilmu Pemuliaan Tanaman. PAU - LSI. IPB.
Bogor. 169 hal.
27
Rahardjo, M., Hobir dan R. Fathan. 1997. Pertumbuhan Bibit Jahe Asal Kultur
Jaringan dengan Pemberian Pupuk Kandang. Prosiding Forum Konsultasi
Ilmiah Perbenihan Tanaman Rempah dan Obat. Balai Penelitian Tanaman
Rempah dan Obat. Bogor. hal 159.
Rahayu, A.A. 1999. Pengaruh Pemberian Kolkhisin terhadap Sitologi, Morfologi,
dan Anatomi Hibrid Kacang Tanah Hasil Persilangan antara Arachis
hypogaea Var. Gajah dengan Arachis cardenasii. Skripsi. Jurusan Budi
Daya Pertanian. IPB. Bogor. 32 hal.
Ramachandran, K., dan P.N. Nair. 1992. Induced tetraploid of ginger (Zingiber
officinale Rosc. ). Journal of Spices & Aromatic Crops 1:39-42.
Rismunandar. 1988. Rempah-rempah Komoditi Ekspor Indonesia. Cet ke-1.
Sinar Baru. Bandung. 119 hal.
Rosistiana, O., A. Abdullah, Taryono dan E.A. Haddad. 1991. Jenis-jenis tanaman
jahe. Edisi khusus Penelitian Tanaman Rempah dan Obat VII (1) : 7-10.
Salisbury, F.B dan C.W. Ross. 1995. Fisiologi Tumbuhan Jilid 1 (Diterjemahkan
oleh D.R. Lukman dan Sumaryono). Institut Teknologi Bandung. Bandung.
241 hal.
Salisbury, F.B dan C.W. Ross. 1995. Fisiologi Tumbuhan Jilid 2 (Diterjemahkan
oleh D.R. Lukman dan Sumaryono). Institut Teknologi Bandung. Bandung.
173 hal.
Sutjahjo, S. H., A. Makmur, N. Tripudayani dan U. Hafid. 1993. Induksi
tetraploid pada tanaman semangka (Citrullus lanatus (Thunb.) Manaf.)
dengan colchicine. Bul. Agr. Vol XXI No. I. hal 55-60.
Syahid, S.F. dan Hobir. 1996. Pertumbuhan dan Produksi Rimpang Jahe Asal
Kultur Jaringan. J. LITTRI.II(2).
Syukur, C. 2002. Agar Jahe Berproduksi Tinggi. Cet ke-2. Penebar Swadaya.
Jakarta. 64 hal.
Syukur, C. dan Hernani.2002. Budidaya
Penebar Swadaya. Jakarta. 136 hal.
Tanaman Obat Komersial. Cet ke-2.
Tjitrosoepomo, G. 2001. Morfologi Tumbuhan. Cet ke-13. Gadjah Mada
University Press. Yogyakarta. 266 hal.
Marha Tilaar Innovation Center. 2002. Aplikasi Budidaya Secara Organik
Tanaman Obat Rimpang. Cet- 1. Penebar Swadaya. 96 hal.
Warintek. 2004. Teknologi Tepat Guna. http : /www. Iptek.
Id/ind/Warintek/Budidaya_Pertanian_idx_php. Hp? (13 May 2004).
net.
28
Lampiran 1. Uji Kenormalan Nilai- F Pengaruh Kolkisin terhadap Keragaan
Fenotipe dan Jumlah Kromosom Jahe Emprit
Peubah
Lebar stomata
Panjang Stomata
Lebar Sel Penjaga
Klorofil a
Klorofil b
Klorofil Total
Bobot Rimpang
Bobot Akar
Bobot Brangkasan
Tinggi Tanaman
Jumlah Daun
Jumlah Anakan
Diameter Batang
Uraian
K0 vs K1
K0 vs K2
K1 vs K2
K0 vs K1
K0 vs K2
K1 vs K2
K0 vs K1
K0 vs K2
K1 vs K2
K0 vs K1
K0 vs K2
K1 vs K2
K0 vs K1
Uji statistik
1.544
3.215
0.000
0.551
1.484
2.692
0.349
0.360
1.032
0.122
0.161
1.316
0.125
P
0.498
0.925
0.996
0.958
0.580
0.354
0.858
0.839
0.950
0.529
0.583
0.841
0.535
F
Ragam Homogen
Ragam Homogen
Ragam Homogen
Ragam Homogen
Ragam Homogen
Ragam Homogen
Ragam Homogen
Ragam Homogen
Ragam Homogen
Ragam Homogen
Ragam Homogen
Ragam Homogen
Ragam Homogen
K0 vs K2
0.175
0.606
Ragam Homogen
K1 vs K2
K0 vs K1
1.396
0.124
0.792
0.532
Ragam Homogen
Ragam Homogen
K0 vs K2
0.165
0.589
Ragam Homogen
K1 vs K2
K0 vs K1
1.332
0.633
0.831
0.898
Ragam Homogen
Ragam Homogen
K0 vs K2
0.368
0.847
Ragam Homogen
K1 vs K2
K0 vs K1
0.582
1.997
0.477
0.391
Ragam Homogen
Ragam Homogen
K0 vs K2
0.300
0.775
Ragam Homogen
K1 vs K2
K0 vs K1
0.150
3.738
0.023
0.178
Ragam Heterogen
Ragam Homogen
K0 vs K2
3.206
0.296
Ragam Homogen
K1 vs K2
K0 vs K1
0.858
1.869
0.788
0.417
Ragam Homogen
Ragam Homogen
K0 vs K2
1.982
0.464
Ragam Homogen
K1 vs K2
K0 vs K1
1.060
0.057
0.973
0.366
Ragam Homogen
Ragam Homogen
K0 vs K2
0.107
0.480
Ragam Homogen
K1 vs K2
K0 vs K1
1.871
0.078
0.570
0.425
Ragam Homogen
Ragam Homogen
K0 vs K2
0.116
0.498
Ragam Homogen
K1 vs K2
K0 vs K1
1.485
0.985
0.742
0.700
Ragam Homogen
Ragam Homogen
K0 vs K2
K1 vs K2
1.004
1.020
0.746
0.939
Ragam Homogen
Ragam Homogen