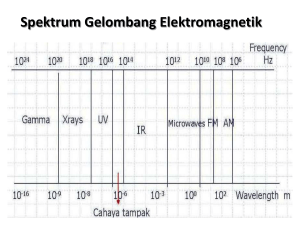
Faktor yang mempengaruhi energi ionisasi
advertisement

SIFAT PERIODIK UNSUR Afinitas Elektron Tulisan ini menjelaskan apa yang dimaksud dengan afinitas elektron, dan mengamati faktorfaktor yang mempengaruhi besarnya afinitas elektron. Anda dianggap telah memahami tentang orbital atom sederhana, dan dapat menuliskan struktur elektronik untuk atom-atom sederhana. Afinitas elektron pertama Energi ionisasi selalu ditekankan pada pembentukan ion positif. Afinitas elektron ditekankan pada ion negatif, dan keduanya banyak dipakai untuk unsur-unsur pada golongan 6 dan 7 pada tabel periodik. Mendefinisikan afinitas elektron pertama Afinitas elektron pertama adalah energi yang dilepaskan ketika 1 mol atom gas mendapatkan satu elektron untuk membentuk 1 mol ion gas 1-. Lebih mudah dipahami dalam bentuk simbol. Pada penggambaran di atas, afinitas elektron pertama diartikan sebagai energi yang dilepaskan (per mol X) pada saat perubahan ini terjadi. Afinitas elektron pertama memiliki harga negatif. Sebagai contoh, afinitas elektron pertama klor adalah -349 kJ mol-1. Berdasarkan perjanjian, tanda negatif menunjukkan pelepasan energi. Afinitas elektron pertama dari unsur-unsur golongan 7 F Cl Br I -328 kJ mol-1 -349 kJ mol-1 -324 kJ mol-1 -295 kJ mol-1 Apakah ada polanya? Ya − jika anda bergerak dari atas ke bawah dalam satu golongan, afinitas elektron pertama makin berkurang (artinya energi yang dilepaskan makin berkurang ketika ion negatif terbentuk). Fluor tidak mengikuti aturan itu, dan akan dijelaskan secara terpisah. Afinitas elektron dihitung dari tarikan antara elektron yang datang dengan inti − tarikan yang lebih kuat, energi yang dilepaskan makin besar. Faktor yang mempengaruhi tarikan ini sama dengan faktor yang berpengaruh pada energi ionisasi − muatan inti, jarak dan penyaringan (screening). Bertambahnya muatan inti dari atas ke bawah dalam satu golongan terkurangi oleh tambahan penyaringan elektron. Masing-masing elektron terluar mengalami tarikan 7+ dari pusat atom, untuk semua atom golongan 7. Sebagai contoh, atom fluor memiliki struktur elektron 1s22s22px22py22pz1. Terdapat 9 proton dalam inti. Elektron yang datang masuk ke tingkat-2, dan mengalami penyaringan dari inti oleh 2 elektron 1s2 electrons. Oleh karena itu tarikan bersih dari inti adalah 7+ (9 proton dikurangi 2 oleh penyaringan elektron). Berbeda dengan klor yang memiliki struktur elektron 1s22s22p63s23px23py23pz1. Klor memiliki 17 proton pada inti. Tetapi sekali lagi elektron yang masuk merasakan tarikan bersih dari inti 7+ (17 proton dikurangi 10 oleh penyaringan elektron pada tingkat pertama dan kedua). Faktor yang menentuka n adalah bertambahnya jarak antara elektron yang datang dengan inti dari atas ke bawah dalam satu golongan. Makin besar jarak, tarikan berkurang dan energi yang dilepaskan sebagai afinitas elektron juga berkurang. Mengapa fluor tidak mengikuti kecenderungan yang ada? Elektron yang datang, pada fluor akan lebih dekat dengan inti dibandingkan unsur lain, sehingga anda akan mendapatkan nilai afinitas elektron yang tinggi. Namun demikian, karena fluor merupakan atom kecil, anda memasukkan elektron baru pada tempat yang sudah penuh sesak oleh elektron dan ada banyak tolakan. Tolakan ini mengurangi tarikan yang dirasakan elektron yang datang dan mengurangi afinitas elektron. Perubahan yang sama dari kecenderungan yang diharapkan terjadi antara oksigen dan sulfur pada golongan 6. Afinitas elektron pertama oksigen (-142 kJ mol-1) lebih kecil dari sulfur (-200 kJ mol-1) untuk alasan yang sama bahwa fluor lebih kecil dari klor. Membandingkan afinitas elektron golongan 6 dan 7 Seperti yang anda perhatikan, afinitas elektron pertama oksigen (-142 kJ mol-1) lebih rendah dari fluor (-328 kJ mol-1). Sama dengan sulfur (-200 kJ mol-1) yang lebih rendah dari klor (-349 kJ mol-1). Mengapa? Sederhana saja, unsur golongan 6 memiliki 1 proton pada inti yang lebih sedikit daripada tetangganya, golongan 7. Banyaknya penyaringan pada keduanya sama. Itu artinya bahwa tarikan bersih dari inti pada golongan 6 lebih sedikit daripada golongan 7, sehingga afinitas elektron lebih rendah. Afinitas elektron pertama dan reaktivitas Reaktivitas unsur golongan 7 turun dari atas ke bawah dalam satu golongan − fluor merupakan unsur yang paling reaktif dan iod paling tak reaktif. Seringkali pada reaksinya unsur-unsur ini membentuk ion negatif. Pada GCSE kadang-kadang ditunjukkan penurunan reaktivitas karena tarikan terhadap elektron yang datang berkurang kekuatannya dari atas ke bawah dalam satu golongan, sehingga pembentukan ion negatif kurang disukai. Penjelasan itu masih dapat diterima kecuali untuk fluor! Reaksi keseluruhan terdiri dari banyak tahapan yang berbeda yang semuanya melibatkan perubahan energi, dan untuk menjelaskan kecenderungan yang ada tidak cukup hanya dengan mengamati salah satu tahap saja. Fluor lebih reaktif daripada klor (walaupun afinitas elektronnya lebih rendah) karena energi yang dilepaskan pada salah satu langkah reaksinya mengurangi energi yang dilepaskan sebagai afinitas elektron. Afinitas elektron kedua Anda hanya akan ditunjukkan pada unsur golongan 6, oksigen dan sulfur yang keduanya membentuk ion 2-. Mendefinisikan afinitas elektron kedua Afinitas elektron kedua adalah energi yang diperlukan untuk menambah satu elektron pada masing-masing ion dari 1 mol ion gas 1- untuk menghasilkan 1 mol ion gas 2-. Lebih mudah dipahami dalam bentuk simbol. Pada penggambaran di atas, afinitas elektron kedua diartikan sebagai energi yang dibutuhkan untuk membawa perubahan per mol X-. Mengapa untuk melakukannya diperlukan energi? Anda mendorong elektron ke dalam ion negatif. Hal ini tidak terjadi dengan serta-merta! EA ke-1 = -142 kJ mol-1 EA ke-2 = +844 kJ mol-1 Tanda positif menunjukkan bahwa anda memerlukan energi untuk terjadinya perubahan ini. Afinitas elektron kedua oksigen tinggi, karena elektron dipaksa masuk ke dalam ion yang kecil, elektronnya sangat rapat. Energi Ionisasi Tulisan ini menjelaskan apa yang dimaksud dengan energi ionisasi pertama, dan kemudian mengamati kecenderungannya pada tabel periodik – dalam satu periode dan golongan. Anda dianggap telah memahami tentang orbital atom sederhana, dan dapat menuliskan struktur elektron untuk atom yang sederhana. Mendefinisikan energi ionisasi pertama Definisi Energi ionisasi pertama merupakan energi yang diperlukan untuk melepaskan elektron terluar (paling mudah lepas) dari satu mol atom dalam wujud gas untuk menghasilkan satu mol ion gas dengan muatan 1+. Hal ini lebih mudah dipahami dalam bentuk simbol. Pada penggambaran di atas, energi ionisasi pertama diartikan sebagai energi yang dibutuhkan untuk menghasilkan perubahan per mol X. Yang perlu diperhatikan pada persamaan di atas Simbol wujud zat – (g) – penting. Pada saat anda membahas energi ionisasi, unsurnya harus dalam wujud gas. Energi ionisasi dinyatakan dalam kJ mol-1 (kilojoules per mole). Nilainya bervariasi dari 381 (yang sangat rendah) hingga 2370 (yang sangat tinggi). Semua unsur memiliki energi ionisasi pertama – bahkan atom yang tidak membentuk ion positif pada tabung reaksi. Helium (E.I pertama = 2370 kJ mol-1) secara normal tidak membentuk ion positif karena besarnya energi yang diperlukan untuk melepaskan satu elektron. Pola energi ionisasi pertama pada tabel periodik 20 unsur pertama Energi ionisasi pertama menunjukkanperiodicity. Itu artinya bahwa energi ionisasi bervarisi dalam suatu pengulangan jika anda bergerak sepanjang tabel periodik. Sebagai contoh, lihatlah pola dari Li ke Ne, dan kemudian bandingkan dengan pola yang sama dari Na ke Ar. Variasi pada energi ionisasi pertama ini dapat dijelaskan melalui struktur dari atom yang terlibat. Faktor yang mempengaruhi energi ionisasi Energi ionisasi merupakan ukuran energi yang diperlukan untuk menarik elektron tertentu dari tarikan inti. Energi ionisasi yang tinggi menunjukkan tarikan antara elektron dan inti yang kuat. Besarnya tarikan dipengaruhi oleh: Muatan inti Makin banyak proton dalam inti, makin positif muatan inti, dan makin kuat tarikannya terhadap elektron. Jarak elektron dari inti Jarak dapat mengurangi tarikan inti dengan cepat. Elektron yang dekat dengan inti akan ditarik lebih kuat daripada yang lebih jauh. Jumlah elektron yang berada diantara elektron terluar dan inti Perhatikan atom natrium, dengan struktur elektron 2, 8, 1 (tak ada alasan mengapa anda tak dapat menggunakan notasi ini jika ini sangat membantu!) ika elektron terluar mengarah ke inti, tidak akan terlihat oleh inti dengan jelas. Antara elektron terluar dan inti ada dua lapis elektron pada tingkat pertama dan kedua. Pengaruh 11 proton pada inti natrium berkurang oleh adanya 10 elektron yang lebih dalam. Oleh karena itu elektron terluar hanya merasakan tarikan bersih kira-kira 1+ dari pusat. Pengurangan tarikan inti terhadap elektron yang lebih dalam disebut dengan penyaringan (screening) atau perlindunga (shielding). Apakah elektron berdiri sendiri dalam suatu orbital atau berpasangan dengan elektron lain Dua elektron pada orbital yang sama mengalami sedikit tolakan satu sama lain. Hal ini mengurangi tarikan inti, sehingga el ektron yang berpasangan dapat dilepaskan dengan lebih mudah dari yang anda perkirakan. Menjelaskan pola pada sebagian unsur-unsur pertama Hidrogen memiliki struktur elektron 1s1. Merupakan atom yang sangat kecil, dan elektron tunggalnya dekat dengan inti sehingga dapat tertarik dengan kuat. Tidak ada elektron yang menyaring tarikan dari inti sehingga energi ionisasinya tinggi (1310 kJ mol-1). Helium memiliki struktur 1s2. Elektron dilepaskan dari orbital yang sama seperti pada contoh hidrogen. Elektronnya dekat dengan inti dan tidak tersaring. Energi ionisasinya (2370 kJ mol-1) lebih besar dari hidrogen, karena elektronnya ditarik oleh dua proton pada inti, bukan satu seperti pada hidrogen. Litium memiliki struktur 1s22s1. Elektron terluarnya berada pada tingkat energi kedua, lebih jauh dari inti. Anda mungkin berpendapat akan lebih dekat dengan adanya tambahan proton pada inti, tetapi elektron tidak mengalami tarikan yang penuh dari inti – tersaring oleh elektron 1s2. Anda dapat membayangkan elektron seperti merasakan tarikan bersih +1 dari pusat (3 proton dikurangi oleh dua elektron 1s2 electrons). Jika anda membandingkan litium dengan hidrogen (bukan dengan helium), elektron hidrogen juga mengalami tarikan 1+ dari inti, tetapi pada litium jaraknya lebih jauh. Energi ionisasi pertama litium turun menjadi 519 kJ mol-1 sedangkan hidrogen 1310 kJ mol-1. Pola pada periode 2 dan 3 Membahas 17 atom pada saat bersamaan akan memakan waktu. Kita dapat melakukannya dengan lebih terarah dengan menjelaskan kecenderungan utama pada dua periode ini, dan kemudian menjelaskan pengecualian yang ada. Secara umum pola pada kedua periode sama – perbedaannya energi ionisasi periode ketiga lebih rendah daripada periode kedua. Menjelaskan kecenderungan umum pada periode 2 dan 3 Kecenderungan yang umum adalah energi ionisasi meningkat dalam satu periode dari kiri ke kanan. Pada semua unsur periode 2, elektron terluar berada pada orbital tingkat 2 – 2s atau 2p. Semuanya memiliki jarak yang sama dari inti, dan tersaring oleh elektron 1s2. Perbedaan pentingnya adalah terjadi kenaikan jumlah proton pada inti dari litium sampai neon. Hal itu menyebabkan makin kuatnya tarikan inti terhadap elektron sehingga menaikkan energi ionisasi. Pada kenyataannya kenaikan muatan inti menyebabkan elektron terluar lebih dekat ke inti. Kenaikan energi ionisasi itu berada dalam satu periode. Pada periode 3, kecenderungannya sama. Semua elektron yang dilepaskan berada pada tingkat ketiga dan tersaring oleh elektron 1s22s22p6. Semuanya memiliki lingkungan yang sama, tetapi muatan intinya makin meningkat. Mengapa terjadi penurunan antara golongan 2 dan 3 (Be-B dan Mg-Al)? Penjelasannya didasarkan pada struktur boron dan aluminium. Elektron terluar kedua atom ini lebih mudah dilepaskan dibandingkan dengan kecenderungan umum pada atom-atom periode 2 dan 3 lainnya. 1s22s2 1s22s22px1 Be B E. I. pertama = 900 kJ mol-1 E. I. pertama = 799 kJ mol-1 Anda mungkin mengharapkan energi ionisasi boron lebih besar dari berilium karena adanya tambahan proton. Pada kenyataannya elektron terluar boron berada pada orbital 2p bukan pada 2s. Orbital 2p memiliki energi yang sedikit lebih tinggi daripada orbital 2s, dan elektronnya, ratarata, berada lebih jauh dari inti. Hal ini memberikan dua pengaruh. Bertambahnya jarak menghasilkan berkurangnya tarikan inti sehingga mengurangi energi ionisasi Orbital 2p tidak hanya disaring oleh elektron 1s2 tetapi, sedikit, juga oleh elektron 2s2. Hal itu juga mengurangi tarikan dari inti sehingga energi ionisasinya lebih rendah. Penjelasan terhadap turunnya energi ionisasi antara magnesium dan aluminium sama, hanya saja terjadi pada tingkat ke-3 bukan tingkat ke-2. Mg Al 1s22s22p63s2 1s22s22p63s23px1 E. I. pertama = 736 kJ mol-1 E. I. pertama = 577 kJ mol-1 Elektron 3p pada aluminium sedikit lebih jauh dari inti dibandingkan 3s, dan sebagian tersaring oleh elektron 3s2 sebagai elektron yang lebih dalam. Kedua faktor ini mengurangi pengaruh bertambahnya proton. Mengapa terjadi penurunan diantara golongan 5 dan 6 (N-O dan P-S)? Sekali lagi, anda mungkin mengharapkan energi ionisasi unsur golongan 6 akan lebih tinggi daripada golongan 5 karena adanya tambahan proton. Apa yang terjadi? N O 1s22s22px12py12pz1 1s22s22px22py12pz1 E. I. pertama = 1400 kJ mol-1 E. I. Pertama = 1310 kJ mol-1 Penyaringannya sama (oleh 1s2 dan, sedikit, oleh elektron 2s2), dan elektron dilepaskan dari orbital yang sama. Perbedaannya adalah pada oksigen elektron dilepaskan dari salah satu pasangan 2px2. Adanya tolakan antara dua elektron pada orbital yang sama menyebabkan elektron tersebut lebih mudah dilepaskan dibandingkan yang lain. Penurunan energi ionisasi pada sulfur dijelaskan dengan cara yang sama. Kecenderungan turunnya energi ionisasi dalam satu golongan Jika anda bergerak ke bawah dalam satu golongan pada tabel period ik, energi ionisasi secara umum akan menurun. Anda telah melihat bukti untuk hal ini bahwa energi ionisasi pada periode 3 lebih rendah dari periode 2. Sebagai contoh pada golongan 1: Mengapa energi ionisasi natrium lebih rendah dari litium? Pada atom natrium terdapat 11 proton, tetapi pada atom litium hanya 3. Jadi muatan inti natrium lebih besar. Anda mungkin memperkirakan energi ionisasi natrium lebih besar, tetapi kenaikan muatan inti tidak dapat mengimbangi jarak elektron dari inti yang makin jauh dan lebih tersaring. Li Na 1s22s1 1s22s22p63s1 E. I. pertama = 519 kJ mol-1 E. I. pertama = 494 kJ mol-1 Elektron terluar litium berada pada tingkat kedua, dan hanya memiliki elektron 1s2 yang menyaringnya. Elektron 2s1 mengalami tarikan dari 3 proton dan disaring oleh 2 elektron – tarikan bersih dari pusat adalah +1. Elektron terluar natrium berada pada tingkat 3, dan terhalangi dari 11 proton pada inti oleh 10 elektron yang berada lebih dalam. Elektron 3s1 juga mengalami tarikan bersih 1+ dari pusat atom. Faktor yang tersisa hanyalah jarak tambahan antara elektron terluar dan inti pada natrium. Sehingga energi ionisasi natrium lebih rendah. Penjelasan yang sama berlaku jika anda bergerak ke bawah pada unsur lain pada golongan tersebut, atau, pada golongan yang lain. Kecenderungan energi ionisasi pada golongan transisi Selain seng pada bagian akhir, energi ionisasi semua unsur relatif sama. Semua unsur memiliki struktur elektron [Ar]3dn4s2 (or 4s1 pada kromium dan tembaga). Elektron yang terlepas selalu dari orbital 4s. Jika anda bergerak dari kiri ke kanan, dari satu atom ke atom lainnya dalam deretan golongan transisi, jumlah proton pada inti meningkat, elektron pada 3d juga bertambah. Elektron 3d mengalami beberapa pengaruh penyaringan, proton tambahan dan elektron 3d tambahan dapat menambah atau mengurangi pengaruh tarikan dari pusat atom yang diamati. Kenaikan pada seng mudah untuk dijelaskan. Cu Zn [Ar]3d104s1 [Ar]3d104s2 E. I. pertama = 745 kJ mol-1 E. I. pertama = 908 kJ mol-1 Pada contoh di atas, elektron yang dilepaskan berasal dari orbital yang sama, dengan penyaringan yang sama, tetapi seng memiliki satu tambahan proton pada inti sehingga daya tariknya lebih besar. Pada seng terdapat tolakan antar pasangan elektron orbital 4s, tetapi pada kasus ini tolakannya tidak cukup untuk mengimbangi pengaruh bertambahnya proton. Energi ionisasi dan reaktivitas Pada energi ionisasi yang lebih rendah, perubahan ini lebih mudah terjadi: Anda dapat menjelaskan kenaikan reaktivitas logam golongan 1(Li, Na, K, Rb, Cs) dari atas ke bawah dalam satu golongan karena turunnya energi ionisasi. Bereaksi dengan apapun, logamlogam tersebut akan membentuk ion positif, dengan energi ionisasi yang lebih rendah, ion lebih mudah terbentuk. Bahaya dari pendekatan ini adalah pembentukan ion positif terjadi hanya satu tahap dalam beberapa langkah proses. Sebagai contoh, anda tidak mungkin memulai dengan atom gas; tidak juga mengakhirinya dengan gas ion positif – anda akan mengakhiri dengan ion dalam padatan atau larutan. Perubahan energi pada proses ini juga bervariasi dari satu unsur ke unsur lainnya. Secara ideal anda perlu mempertimbangkan semua hal dan tidak hanya mengambil sebagian saja. Namun demikian, energi ionisasi unsur merupakan faktor utama yang berperan dalam energi aktivasi suatu reaksi. Ingat bahwa energi aktivasi merupakan energi minimum yang diperlukan sebelum reaksi berlangsung. Dengan energi aktivasi yang lebih rendah, reaksi akan lebih cepat – tanpa mengabaikan seluruh energi yang berubah pada reaksi tersebut. Penurunan energi ionisasi dari atas ke bawah dalam satu golongan akan menyebabkan energi aktivasi lebih rendah dan reaksi menjadi lebih cepat. Elektronegatifitas Apakah elektronegatifitas itu? Definisi Elektronegatifitas adalah suatu ukuran kecenderungan atom untuk menarik pasangan elektron ikatan. Skala pauling merupakan skala yang paling umum digunakan. Fluor (unsur yang paling elektronegatif) diberikan skala Pauling dengan harga 4.0, dan harganya menurun sampai cesium dan fransium yang setidaknya hanya memiliki elektronegatifitas pada skala 0.7. Apa yang terjadi jika dua atom yang memiliki elektronegatifitas setara saling berikatan? Meninjau ikatan antara dua atom, A dan B. Tiap atom dapat membentuk ikatan satu sama lain seperti yang ditunjukkan berikut – tetapi ikatan ini tidak relevan dengan alasannya. Jika atom-atom memiliki elektronegatifitas yang setara, keduanya memiliki kecenderungan yang sama untuk menarik pasangan elektron ikatan, dan karena itu akan ditemukan setengah rata-rata antara kedua atom. Untuk memperoleh jenis ikatan seperti ini, A dan B harus selalu merupakan atom yang sama. Kamu akan menemukan ikatan seperti ini, sebagai contoh, pada molekul H2 atau Cl2 . Ikatan seperti ini dapat dikatakan sebagai ikatan kovalen "murni" – dimana elektron dibagikan secara rata antara dua atom. Apa yang terjadi jika B sedikit lebih elektronegatif dibandingkan dengan A? B akan lebih menarik pasangan elektron daripada yang dilakukan oleh A. Hal ini berarti bahwa ujung ikatan B lebih memberikan kerapatan elektron dibandingkan dengan A dan karena itu menjadikannya sedikit negatif. Pada waktu yang bersamaan, ujung A (lebih pendek elektron) menjadi sedikit positif. Pada diagram, " " (dibaca "delta") berarti "sedikit" – dimana + berarti "sedikit positif". . Pendefinisian ikatan polar Berikut ini digambarkan ikatan polar. Ikatan polar merupakan ikatan kovalen yang mana terdapat pemisahan muatan antara ujung yang satu dengan ujung yang lain – dengan kata lain salah satu ujung sedikit positif dan ujung yang lainnya sedikit negatif. Contohnya termasuk kebanyakan ikatan kovalen. Ikatan hidrogen-klor pada HCl atau ikatan hidrogen-oksigen pada air adalah ikatan yang khas. Apa yang terjadi jika B lebih elektronegatif dibandingkan dengan A? Pada kasus ini, pasangan elektron digeser ke sebelah kanan sampai ujung ikatan B. Praktis, A kehilangan kontrol atas elektron, dan B mengontrol sepenuhnya kedua atom. Terjadilah pembentukan ion. “Spektrum― ikatan Implikasi dari semua ini adalah tidak adanya batasan yang jelas antara ikatan kovalen dan ikatan ionik. Pada ikatan kovalen murni, elektron diikat pada setengah rata-rata diantara kedua atom. Pada ikatan polar, elektron sedikit bergeser ke salah satu ujung ikatan. Seberapa jauh pergeseran terjadi sebelum ikatan dinyatakan sebagai ikatan ionik? Tidak ada jawaban yang nyata dengan pertanyaan tersebut. Biasanya kamu berfikir natrium klorida sebagai padatan ionik yang khas, akan tetapi disini natrium tidak sepenuhnya kehilangan kontrol elektronnya. Karena sifat natrium klorida, bagaimanapun, kita cenderung menghitungnya dengan ionik murni. Litium iodida, di lain pihak, akan digambarkan sebagai "ionik dengan beberapa karakter kovalen". Pada kasus ini, pasangan elektron tidak bergerak masuk secara keseluruhan ke ujung ikatan iodium. Litium iodida, sebagai contoh, larut dalam pelarut organik seperti etanol – secara normalnya tidak satupun sesuatu yang bersifat ionik akan seperti ini. Ringkasan Tidak adanya perbedaan elektronegatifitas antara dua atom berperan penting pada ikatan kovalen non-polar murni. Perbedaan elektronegatifitas yang kecil berperan penting pada ikatan kovalen polar. Perbedaan elektronegatifitas yang besar berperan penting pada ikatan ionik Ikatan polar dan molekul polar Pada molekul yang sederhana seperti HCl, jika ikatan yang terjadi adalah polar, maka secara keseluruhan molekul juga barsifat polar. Bagaimana dengan molekul yang lebih rumit? Pada CCl4, tiap ikatan adalah polar. Molekul secara keseluruhan, bagaimanapun, tidak polar – dalam arti bahwa molekul tersebut tidak memiliki ujung (atau sisi) yang sedikit negatif dan salah satu yang lain sedikit positif. Secara keseluruhan molekul bersifat negatif, tetapi tidak terdapat pembagian muatan dari bagian atas ke bawah, atau dari kanan ke kiri. Sebaliknya, CHCl3 adalah polar. Hidrogen pada bagian atas molekul kurang elektronegatif dibandingkan karbon dan karena itu hidrogen sedikit positif. Hal ini berarti bahwa sekarang molekul sedikit positif “pada bagian atas†dan sedikit negatif “pada bagian bawahâ€, dan secara keseluruhan molekul bersifat polar. Molekul polar akan “berat sebelah― Pola susunan elektronegatifitas pada Tabel Periodik Unsur yang paling elektronegatif adalah fluor. Jika kamu mengingat fakta tersebut, semuanya menjadi mudah, karena elektronegatifitas selalu naik kearah fluor pada tabel periodik. Kecenderungan elektronegatifitas sepanjang perioda Jika kamu membentangkan suatu perioda maka elektronegatifitas akan meningkat. Grafik menunjukkan harga elektronegatifitas dari natrium sampai klor – kamu dapat mengabaikan argon. Argon tidak memiliki elektronegatifitas, karena argon tidak membentuk ikatan. Kecenderungan harga elektronegatifitas seiring dengan menurunnya posisi unsur pada sebuah golongan Seiring dengan turunnya posisi dalam sebuah grup, elektronegatifitas menurun. (jika elektronegatifitas meningkat ke arah fluor, elektronegatifitas harus menurun seiring dengan turunnya posisi). Grafik menunjukkan pola susunan elektronegatifitas pada golongan 1 dan 7. Penjelasan pola susunan elektronegatifitas Daya tarik yang dirasakan oleh pasangan elektron ikatan untuk inti yang khusus tergantung pada Jumlah proton pada inti; Jarak dari inti; Banyaknya rintangan oleh olektron yang lebih dalam Mengapa elektronegatifitas meningkat sepanjang perioda? Dengan menganggap natrium pada permulaan perioda 3 dan klor pada bagian akhirnya (mengabaikan gas mulia, argon). Pikirkan jika natrium klorida berikatan secara kovalen. Natrium dan klor memiliki elektron ikatan pada tingkat-3. Pasangan elektron dirintangi dari kedua inti oleh elektron-elektron 1s, 2s dan 2p, tetapi inti klor memiliki 6 proton lebih. Hal ini tidak mengherankan pasangan elektron digeser sejauh mungkin ke arah klor yang membentuk ion. Elektronegatifitas meningkat sepanjang perioda karena jumlah muatan pada inti juga meningkat. Hal itu menarik pasangan elektron ikatan dengan lebih kuat. Mengapa elektronegatifitas menurun sejalan dengan menurunnya pososi unsur pada sebuah golongan? Pikirkanlah mengenai hidrogen fluorida dan hidrogen klorida Pasangan ikatan terlindungi dari inti fluor hanya oleh elektron 1s2. Pada kasus klor pasangan ikatan terlindungi oleh semua elektron 1s22s22p6 . Pada tiap kasus terdapat tarikan dari pusat fluor atau +7 klor. Akan tetapi fluor memiliki pasangan ikatan pada tingkat-2 dibandingkan tingkat-3 seperti pada klor. Jika lebih dekat ke inti, dayatarik semakin besar. Seiring dengan menurunnya posisi pada suatu golongan, elektronegatifitas menurun karena pasangan elektron ikatan menjauh dari jangkauan dayatarik inti. Kemampuan polarisasi ion positif Apakah yang kami maksud “kemampuan polarisasi (polarising ability)―? Dalam diskusi sejauh ini, kita berfikiran ion dibangun dari perubahan bentuk dari ikatan kovalen. Kamu juga akan berfikir seperti itu pada hal yang lain. Padatan adalah kovalen. Malahan dibayangkan bahwa Alumunium klorida adalah ionik. Karena alumunium klorida mengandung ion Al3+ dan Cl-. Ion alumunium berukuran sangat kecil dan dibungkus oleh tiga muatan positif – karena itu “densitas muatan― sangat tinggi. Dengan mempertimbangkan efek pada setiap elektron terdekat. Pada kasus alumunium klorida, pasangan elektron digeser ke arah alumunium sedemikian rupa sehingga ikatan menjadi kovalen. Faktor-faktor yang mempengaruhi kemampuan polarisasi Ion positif dapat memiliki pengaruh untuk mempolarisasi (distorsi – perubahan bentuk – secara elektrik) ion negatif terdekat. Kemampuan polarisasi tergantung pada densitas muatan pada ion positif. Kemampuan polarisasi meningkat sejalan dengan ion positif yang mengecil dan jumlah muatan yang membesar. Selama ion negatif membesar, ion negatif tersebut menjadi lebih mudah untuk dipolarisasi. Sebagai contoh, pada ion iodida, I-, elektron terluar terletak pada tingkat-5 – relatif renggang dari inti. Ion positif akan lebih efektif dalam menarik pasangan elektron dari ion iodida dibandingkan dengan ion yang sama, katakanlah, ion fluorida yang mana lebih dekat ke inti. Alumunium iodida adalah kovalen karena pasangan elektron lebih mudah untuk dipaksa pergi dari ion iodida. Dilain pihak, alumunium fluorida adalah ionik karena ion alumunium tidak bisa mempolarisasi ion fluorida yang berukuran kecil dengan cukup untuk membentuk ikatan kovalen Jari-jari Atom Mengukur jari-jari atom Tidak seperti halnya bola, sebuah atom tidak memiliki jari-jari yang tetap. Jari-jari atom hanya bisa didapat dengan mengukur setengah dari jarak antara dua buah atom yang berapitan. Seperti halnya gambar diatas, pada atom yang sama kita bisa mendapatkan jari-jari yang berbeda tergantung dari atom yang berapitan dengannya. Gambar pada bagian kiri menunjukkan atom yang berikatan. Kedua atom ini saling menarik satu sama lain sehingga jari-jarinya lebih pendek dibandingkan jika mereka hanya bersentuhan. Hal ini kita dapatkan pada atom-atom logam di mana mereka membentuk struktur logam atau atomatomnya secara kovalen berikatan satu sama lain. Tipe dari jari-jari atom seperti ini disebut jarijari (radius) logam atau jari-jari kovalen, tergantung dari ikatannya. Gambar pada bagian kanan menunjukkan keadaan di mana kedua atom hanya bersentuhan. Daya tarik antar keduanya sangat sedikit. Tipe dari jari-jari atom seperti ini dinamakan jari-jari (radius) van der Waals di mana terjadi daya tarik yang lemah di antara kedua atom tersebut. Kecenderungan jari-jari atom pada tabel periodik Pola kecenderungan jari-jari atom tergantung dari jenis jari-jari atom mana yang ingin kita ukur – tapi pada prinsipnya pola seluruhnya sama. Diagram-diagram di bawah ini menunjukkan jari-jari logam untuk elemen-elemen logam, jarijari kovalen untuk elemen-elemen yang membentuk ikatan kovalen dan jari-jari van der Waals untuk elemen-elemen yang tidak membentuk ikatan (misalnya unsur gas mulia). Kecenderungan jari-jari atom pada periode 2 dan 3 Kecenderungan jari-jari atom pada suatu golongan Kita dapat segera memperkirakan bahwa jari-jari atom pada golongan yang sama akan semakin besar jika letak atom itu pada tabel periodik semakin di bawah. Alasannya cukup kuat – karena kulit elektron semakin bertambah. Kecenderungan jari-jari atom menyusur satu periode Kita perlu mengabaikan jari-jari gas mulia pada setiap periode. Karena neon dan argon tidak membentuk ikatan, kita hanya dapat mengukur jari-jari van der Waals – di mana ikatannya sangatlah lemah. Seluruh atom-atom lainnya jari-jari atom diukur berdasarkan jarak yang lebih kecil dikarenakan oleh kuatnya ikatan yang terbentuk. Kita tidak dapat membandingkan “suatu sifat yang sama” jika kita mengikutsertakan gas mulia. Kecuali gas mulia, atom akan semakin kecil menyusur satu periode Dari litium ke flor, elektron seluruhnya berada pada level dua, yang dihalangi oleh elektron pada 1s2. Peningkatan jumlah proton pada nukleus seiring dengan menyusurnya periode akan menarik elektron-elektron lebih kuat. Kecenderungan pada energi ionisasi yang naik turun tidak kita temui pada radius atom. Pada periode dari Natrium ke Klor, kita juga akan menemukan kecenderungan yang sama. Besar atom dikontrol oleh elektron-elektron pada tingkat ke 3 yang tertarik semakin dekat ke nukleus seiring dengan meningkatnya jumlah proton. Kecenderugan pada elemen-elemen transisi Walaupun pada awal dari elemen-elemen transisi, jari-jari atom sedikit mengecil, besar jari-jari atom hampir seluruhnya sama. Dalam hal ini, besar dari jari-jari atom ditentukan oleh elektron-elektron 4s. Penarikan karena naiknya jumlah proton pada nukleus berkurang karena adanya penghalang tambahan yaitu bertambahnya elektron-elektron pada orbital 3d. Memang hal ini agak sedikit membingungkan. Kita telah mempelajari bahwa orbital-orbital 4s memiliki tingkat energi lebih tinggi daripada 3d – di mana kebalikannya elektron akan menempati 4s sebelum 3d. Artinya, elektron-elektron 4s dapat kita simpulkan berada pada luar atom dan menentukan besarnya atom. Hal ini juga berarti orbital 3d berada lebih dekat dengan nukleus daripada 4s dan berperan sebagai penghalang. Radius Ion Ion-ion tidak memiliki besar yang sama dengan atom asalnya. Bandingkan besarnya ion natrium dan klor dengan atom natrium dan klor. Ion Positif Ion positif lebih kecil dibandingkan dengan atom asalnya. Konfigurasi elektron natrium adalah 2,8,1 ; sementara Na+ adalah 2,8. Kita kehilangan salah satu kulit elektron dan 10 elektron yang tersisa ditarik oleh 11 proton pada nukleus. Ion Negatif Ion negatif lebih besar dibandingkan dengan atom asalnya. Konfigurasi elektron klor adalah 2,8,7 ; sementara Cl- adalah 2,8,8. Walaupun elektron-elektron masih berada pada tingkat 3, penolakan tambahan terjadi karena bertambahnya elektron yang menyebabkan atom semakin membesar. Ion klor hanya memiliki 17 proton, tetapi mereka sekarang memiliki 18 elektron.