Spektrum Gelombang Elektromagnetik
advertisement
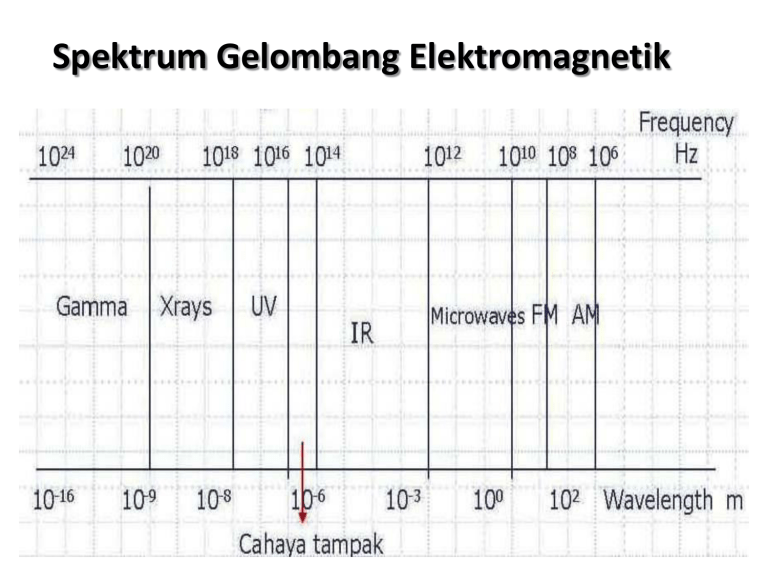
Spektrum Gelombang Elektromagnetik Hubungan spektrum dengan elektron • Berkaitan dengan energi energi cahaya. energi gerak elektron dan Keadaan elektron : Saat arus dilewatkan melalui gas pada tekanan rendah, EP atom-atom gas meningkat. Keadaan dasar (ground state) : posisi terendah suatu atom Keadaan tereksitasi (excited state) : posisi atom saat mempunyai EP lebih tinggi dari keadaan pada tingkat energi dasar. Lampu Neon • Saat atom tereksitasi kembali ke keadaan dasar memancarkan energi dalam bentuk radiasi EM Cahaya putih Tersusun atas bermacam spektrum warna Jika dilewatkan prisma, akan terdispersi menjadi spektrum warna penyusunnya. Spektrum garis emisi Ketika arus listrik dialirkan ke dalam tabung vakum yang mengandung gas Hidrogen pada tekanan rendah teramati emisi sinar kemerahan Spektrum Hidrogen Hγ 6565A Hδ 4863A 3971A 4103A 4342A • Spektrum hidrogen sangat menarik karena terdiri dari sederetan garis-garis yang diberi nama : Hα : garis merah Hβ : garis hijau Hγ : garis biru Hδ : garis ungu Hβ Hα n2 2 2 n 2 b Deret Balmer Johann Jakob Balmer (1885) : panjang gelombang dari garis-garis spektral yang waktu itu hanya menemukan 4 garis spektra yang mengikuti aturan sederhana : b = 3645,6 A = 3645,6 x 10-10 m n : bilangan bulat mulai dari 3, 4, 5 dan 6 2 n b 2 2 n 2 Garis spektrum atom Hidrogen • Rumus umum : 1 1 R 2 2 n n 1 n’ = 1 untuk deret Lyman (Ultra Violet) n’ = 2 untuk deret Balmer (Cahaya tampak) n’ = 3 untuk deret Paschen (Infra merah) Catatan : Nilai n = n’ + 1 (bilangan bulat) Model atom Bohr (1913) • Niels Bohr (1885-1962) ilmuan Denmark yang bekerja dengan Rutherford. • Usulannya : Secara elektrostatika, elektron harus bergerak mengelilingi inti agar tidak tertarik ke inti. Berdasarkan fisika klasik benda yang bergerak memutar akan melepaskan energi sehingga lama-lama energinya akan habis/kolaps. Jadi elektron harus mempunyai cukup energi untuk berada dalam gerak konstan mengelilingi inti. Gerakan elektron terhadap inti atom dianalogikan seperti gerakan planet mengelilingi matahari. Gagasan Bohr dalam menggabungkan teori klasik dan kuantum Hanya ada seperangkat orbit tertentu yang diizinkan bagi satu elektron dalam atom hidrogen Elektron hanya dapat berpindah dari satu lintasan stasioner ke yang lainnya dengan melibatkan sejumlah energi menurut Planck Lintasan stasioner yang diizinkan mencerminkan sifatsifat elektron yang mempunyai besaran yang khas. Momentum sudut harus merupakan kelipatan bulat dari h/2 atau menjadi nh/2. Besarnya energi yang diperlukan atau dipancarkan sebesar : h (tetapan Planck )= 6,6.10-34 J.detik hc E hf f (frekuensi foton )= Hz c (cepat rambat cahaya )= 3.108 m/detik λ (panjang gelombang foton )= m EU hf El 14 Model atom hidrogen • Lintasan yang diizinkan untuk elektron dinomori n = 1, n = 2, n = 3, dst. dinamakan bilangan kuantum, sedangkan huruf K, L, M, N dinamakan lintasan • Jari-jari orbit diungkapkan dengan 12, 22, 32, 42, …n2. Untuk orbit tertentu dengan jari-jari minimum a0 = 0,53 Å • Jika elektron tertarik ke inti dan dimiliki oleh orbit n, energi dipancarkan dan energi elektron menjadi lebih rendah. M L K + E3 E2 E1 n3 n2 n1 E1 < E2 < E3 Jari-jari lintasan stasioner -e F k ( Ze)(e) r2 Ze 2 mv 2 k 2 rn rn + Ze r rn kZe 2 mv 2 Katakanlah : v nh / 2 mrn kZe 2 4 2 mrn2 n2 h2 n2 rn r1 2 2 2 2 n h 4 mkZe Z Untuk orbit kecil n 1 dan untuk hidrogen Z 1 h2 r1 4 2 mke2 0, 53x1010 m (jari-jari Bohr) Energi total elektron dalam tiap lintasan adalah sebagai berikut : 13,6 En eV 2 n Energi elektron pada lintasan : n = 1 E= -13,60 eV n = 2 E= - 3,40 eV n = 3 E= - 1,51 eV n = 4 E= - 0,85 eV n = 5 E= - 0,54 eV n = 6 E= - 0,38 eV n = 7 E= - 0,28 eV n = ~ E= - 0 eV B E n 2 , B : konstanta numerik dengan nilai 2,179 x 10 -18 J n 17 Kesuksesan teori Bohr Mampu menerangkan spektrum dari atom yang mempunyai satu elektron pada kulit terluar. Kelemahan teori Bohr Tidak dapat menerangkan spektrum dari atom yang memiliki elektron lebih dari 1 di kulit terluarnya. Tidak dapat menerangkan terjadinya garis spektra tambahan ketika atom hidrogen diletakkan pada medan listrik atau medan magnet. Tidak mampu menghitung besarnya panjang gelombang spektra tambahan tersebut bahkan tidak mampu meramalkan sama sekali keberadaan garis itu.











