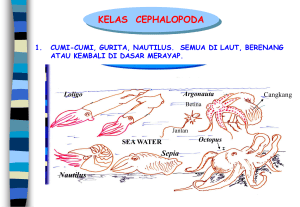
GAMBARAN HISTOPATOLOGI INSANG, OTOT DAN USUS
advertisement

GAMBARAN HISTOPATOLOGI INSANG, OTOT DAN USUS PADA IKAN LELE (Clarias spp.) ASAL DARI DAERAH BOGOR Oleh : DEBBY FADHILAH PAZRA B04104042 FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR 2008 1 ABSTRAK DEBBY FADHILAH PAZRA. Gambaran Histopatologi Organ Insang, Otot dan Usus pada Ikan Lele (Clarias sp.) Asal dari Daerah Bogor. Di bawah bimbingan : Bambang Pontjo Priosoeryanto dan Risa Tiuria Beberapa tahun terakhir produksi budidaya ikan mengalami penurunan, penyebabnya adalah timbulnya wabah penyakit pada ikan, sedangkan permintaan dan kebutuhan terhadap ikan terus meningkat. Peningkatan permintaan tersebut merupakan konsekuensi dari pertambahan jumlah penduduk dan perubahan pola konsumen yaitu peningkatan jumlah konsumsi ikan untuk memenuhi kebutuhan protein hewani. Penelitian ini bertujuan untuk mengetahui gambaran histopatologi secara deskriptif dari ikan lele (Clarias spp.) pada organ usus, insang dan otot yang sampelnya diambil di daerah Bogor. Penelitian ini menggunakan 17 ekor ikan lele yang dinekropsi. Organ yang diambil adalah insang, otot dan usus, kemudian dibuat preparat histopatologi dan dilakukan pengamatan dengan melihat perubahan histopatologi pada organ tersebut. Hasil penelitian menunjukkan bahwa perubahan histopatologi yang ditemukan pada organ insang yaitu hiperplasia lamela sekunder pada 17 sampel, kongesti 16 sampel, edema 13 sampel, proliferasi sel goblet 10 sampel, deskuamasi epitel insang 8 sampel, kerusakan tulang rawan 8 sampel, hemoragi 6 sampel dan kista dari metaserkaria trematoda digenea 5 sampel. Perubahan histopatologi pada organ usus adalah proliferasi sel goblet dan kongesti pada 10 sampel, deskuamasi sel epitel usus 8 sampel, infeksi parasit 5 sampel dan hemoragi 3 sampel. Perubahan histopatologi pada organ otot yaitu degenerasi otot sampai nekrosa 13 sampel, edema dan deskuamasi epitel 8 sampel serta infeksi oleh parasit 4 sampel. Kesimpulan dari penelitian ini yaitu perubahan histopatologi paling banyak ditemui pada insang adalah hiperplasia lamela sekunder, pada usus proliferasi sel goblet dan kongesti, sedangkan pada otot adalah degenerasi otot. Perlunya penelitian lanjutan dengan melakukan perlakuan khusus agar penyebab dari perubahan histopatologi akibat dari suatu penyakit atau infeksi dapat diketahui dengan pasti. Kata kunci : ikan lele, organ insang, organ usus, organ otot 2 ABSTRACT DEBBY FADHILAH PAZRA, Histopathological Lesions of Gill, Intestine, and Muscle of Catfish (Clarias spp.) from Bogor. Advisor: Bambang Pontjo Priosoeryanto dan Risa Tiuria Fish production, especially from aquaculture product in the last several years have been decreased. One of the causes is the incidence of fish disease epidemic, meanwhile the demand of fish is increasing significantly. The increasing of the fish demand is a consequence from the increasing of human population and consumer behaviour change due to the need of animal protein consumption. This purpose of the present research is to elaborate the histopathological lesions in the intestine, gill and muscle of catfish (Clarias spp.) from Bogor. A total of 17 heads catfish were used in this study. Gill, muscle and intestine organs were collected upon necropsy and were then processed for histopathological technique. The slides were observed using a light microscopy. Result of the present research indicated that the main lesions in the gill is secondary lamella hyperplasia which found in 17 samples, congestion 16 samples, oedema 13 samples, goblet cell proliferation 10 samples, epithelial desquamation 8 samples, cartilago damage 8 samples, haemorrahage 6 samples and metacercariae encysted infection 5 samples. Histopathological lesions in intestines were goblet cell proliferation and congestion which detected in 10 fishes samples, epithelial desquamation 8 samples, parasite 5 samples and haemorrahage 3 samples. Histopathological lesions in muscle were muscle degeneration 13 samples, oedema and epithelial desquamation 8 samples and parasite infection 4 samples. Conclusion from research is the most histopathological lesions in gill were secondary lamella hyperplasia which found in 17 samples. The most histopathological lesions in intestines were goblet cell proliferation and congestion which detected in 10 fishes samples, while in the muscle was degeneration which found in 13 samples. Future researches needed by doing special treatment in order to knows the cause of histopatologi’s change that is effected infection or disease which is certainly known. Numbers and location of research require to be multiplied in order to got the data which is more amount and representative area Bogor. Key words : catfish, gill organs , intestine organs, muscle organs 3 GAMBARAN HISTOPATOLOGI INSANG, OTOT DAN USUS PADA IKAN LELE (Clarias spp.) ASAL DARI DAERAH BOGOR Oleh : DEBBY FADHILAH PAZRA B04104042 Skripsi Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada Fakultas Kedokteran Hewan FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR 2008 4 Judul Skripsi : Gambaran Histopatologi Insang, Otot dan Usus pada Ikan Lele (Clarias spp.) Asal dari Daerah Bogor Nama : Debby Fadhilah Pazra NRP : B04104042 Menyetujui Dosen Pembimbing : drh. Bambang Pontjo Priosoeryanto, MS, Ph.D Pembimbing I drh. Risa Tiuria, MS, Ph.D Pembimbing II Mengetahui Dr. Nastiti Kusumorini Wakil Dekan 5 RIWAYAT HIDUP Penulis dilahirkan di Sawahlunto, Sumatra Barat pada tanggal 2 Februari 1986 sebagai putri pertama dari lima bersaudara pasangan Ali Mukhni Oyon, SH dan Rumjasmi. Pada tahun 1992 penulis memasuki bangku sekolah dasar negeri 27 Sijunjung lulus pada tahun 1998 dan melanjutkan ke SLTP negeri 2 Sijunjung. Pada tahun 2001 dilanjutkan ke SMA negeri 1 Sawahlunto Sijunjung dan lulus pada tahun 2004. Pada tahun 2004 penulis diterima sebagai mahasiswa Kedokteran Hewan Institut Pertanian Bogor, melalui jalur Undangan Seleksi Masuk IPB (USMI). Selama menjadi mahasiswa Kedokteran Hewan Institut Pertanian Bogor penulis aktif di beberapa organisasi diantaranya IMAKAHI (infokom dan bendahara), himpro satwa liar, himpro HKSA (hewan kesayangan dan satwa aquatik) dan himpro ornitologi. 6 KATA PENGANTAR Puji dan syukur kepada Allah SWT karena dengan Rahmat dan InayahNya penulisan skripsi yang berjudul Gambaran Histopatologi Organ Insang, Otot dan Usus pada Ikan Lele (Clarias spp.) Asal dari Daerah Bogor ini dapat terselesaikan. Penulis menyampaikan ucapan terima kasih dan penghargaan kepada drh.Bambang Pontjo Priosoeryanto, MS, Ph.D dan drh. Risa Tiuria, MS, Ph. D selaku pembimbing yang telah banyak memberikan masukan dan bimbingan kepada penulis. Serta drh. R. Roso Soejoedono. MPH.DEA selaku pembimbing akademik. Penulis juga menyampaikan ucapan terima kasih kepada Laboratorium Patologi FKH-IPB dan Labratorium Helmintologi FKH-IPB beserta staf yang telah banyak memberikan bantuan serta fasilitas laboratorium. Terima kasih juga kepada teman-teman satu penelitian yang telah banyak membantu penulis selama penelitian. Rasa cinta kasih serta ucapan terima kasih yang tak terhingga kepada kedua orang tua, Ayahanda dan Ibunda, adik-adik tersayang. Terimakasih atas bantuan, dorongan semangat dan doanya yang dicurahkan selama ini. Terima kasih juga kepada semua pihak yang telah membantu penulis sampai akirnya bisa menyelesaikan skripsi ini. Akhir kata penulis berharap semoga tulisan ini bermanfaat bagi semuanya terutama bagi yang membutuhkan. Bogor, Agustus 2008 Debby Fadhilah Pazra 7 DAFTAR ISI Halaman KATA PENGANTAR ..................................................................................... i DAFTAR GAMBAR ....................................................................................... v DAFTAR LAMPIRAN .................................................................................... vi BAB I PENDAHULUAN ................................................................................ 1 1.1 Latar Belakang ............................................................................. 1 1.2 Tujuan Penelitian ......................................................................... 2 1.3 Manfaat Penelitian ....................................................................... 2 BAB II TINJAUAN PUSTAKA...................................................................... 3 2.1 Biologi Ikan Lele ......................................................................... 3 2.1.1 Taksonomi ikan lele .......................................................... 3 2.1.2 Morfologi .......................................................................... 3 2.1.3 Habitat ............................................................................... 4 2.1.4 Makanan ............................................................................ 4 2.1.5 Tingkah laku ..................................................................... 5 2.2 Anatomi dan Fisiologi Ikan Lele.................................................. 5 2.2.1 Sistem Respirasi (Insang).................................................. 5 2.2.2 Sistem Pencernaan ............................................................ 6 2.2.3 Sistem Integumen .............................................................. 7 2.2.4 Sistem Muskuloskeletal (Otot).......................................... 8 2.3 Faktor-faktor yang Mempengaruhi Munculnya Penyakit pada Ikan Lele ............................................................... 8 2.3.1 Suhu .................................................................................. 8 2.3.2 Cahaya ............................................................................... 9 2.3.3 Stres ................................................................................... 9 2.3.4 Kelebihan Populasi (overcrowded) atau Multi kultur ....................................................................... 10 2.3.5 Sistem Imun Ikan Lele yang Rendah ................................ 10 2.4 Penyakit-Penyakit Infeksius pada Ikan Lele ................................ 10 2.4.1 Parasit ................................................................................ 10 8 2.5 Penyakit-Penyakit Non-Infeksius pada Ikan Lele ........................ 14 2.5.1 Defisiensi Vitamin ............................................................ 14 2.5.2 Expose Bahan Toksik........................................................ 15 2.6 Beberapa Perubahan Histopatologi .............................................. 16 2.6.1 Inflamasi............................................................................ 16 2.6.2 Edema................................................................................ 17 2.6.3 Hemoragi dan Kongesti .................................................... 18 2.6.4 Degenerasi Otot dan Nekrosa............................................ 19 2.6.5 Proliferasi Sel Goblet ........................................................ 20 2.6.6 Hiperplasia Lamela Sekunder ........................................... 20 BAB III METODE PENELITIAN .................................................................. 22 3.1 Waktu dan Tempat Penelitian ...................................................... 22 3.2 Bahan dan Alat ............................................................................. 22 3.3 Metode Penelitian ........................................................................ 22 BAB 1V HASIL DAN PEMBAHASAN......................................................... 23 4.1 Insang ........................................................................................... 23 4.1.1 Hiperplasia Lamela Sekunder ........................................... 23 4.1.2 Edema dan Deskuamasi Epitel .......................................... 26 4.1.3 Kongesti dan Hemoragi..................................................... 28 4.1.4 Parasit ............................................................................... 30 4.1.5 Proliferasi Sel Goblet ........................................................ 32 4.1.6 Kerusakan Tulang Rawan (kartilago) Insang.................... 33 4.2 Usus .............................................................................................. 34 4.2.1 Proliferasi Sel Goblet ........................................................ 35 4.2.2 Kongesti dan Hemoragi..................................................... 38 4.2.3 Deskuamasi Epitel............................................................. 39 4.2.4 Parasit ................................................................................ 40 4.3 Otot................................................................................................ 41 4.3.1 Degenerasi Otot Sampai Nekrosa ..................................... 42 4.3.2 Edema................................................................................ 44 4.3.3 Deskuamasi Epitel Integumen .......................................... 44 4.3.4 Parasit ................................................................................ 45 9 BAB V KESIMPULAN DAN SARAN........................................................... 47 5.1 Kesimpulan ................................................................................ 47 5.2 Saran............................................................................................. 47 DAFTAR PUSTAKA ...................................................................................... 48 10 DAFTAR GAMBAR No. Halaman 1. Gambar Ikan lele (Clarias spp.) ................................................................. 3 2. Gambar histogram frekuensi lesio histopatologi organ insang ikan lele (Clarias spp.) ............................................................................................. 23 3. Gambaran HP organ insang yang mengalami hiperplasia lamela sekunder ..................................................................................................... 25 4. Gambaran HP organ insang yang mengalami edema dan deskuamasi epitel ........................................................................................................... 27 5. Gambaran HP organ insang yang mengalami kongesti dan hemoragi ...... 29 6. Gambaran HP kista dari metaserkaria trematoda digenea terdapat di dalam filamen kartilago insang .............................................................. 31 7. Gambar HP proliferasi sel goblet pada insang. .......................................... 33 8. Gambaran HP kerusakan tulang rawan insang........................................... 34 9. Gambar histogram Frekuensi lesion histopatologi organ usus ikan Lele (Clarias spp.) ..................................................................................................... 35 10. Gambaran HP proliferasi sel goblet pada usus........................................... 37 11. Gambaran HP kongesti, hemoragi dan deskuamasi epitel pada usus ........ 38 12. Gambaran HP perasit menginfeksi epitel usus........................................... 40 13. Gambaran HP histogram frekuensi lesio histopatologi organ otot ikan Lele (Clarias spp.) ...................................................................................................... 41 14. Gambaran HP degenerasi hialin, edema dan nekrosa pada otot ................ 43 15. Gambaran HP deskuamasi epitel pada integument .................................... 45 16. Gambaran HP infeksi parasit di permukaan integumen dan otot ............... 46 11 DAFTAR LAMPIRAN No Halaman 1. Pembuatan Sediaan Histopatologi ............................................................. 51 2. Pewarnaan Hematoksilin Eosin (HE) ........................................................ 52 12 BAB I PENDAHULUAN 1.1 Latar Belakang Ikan lele merupakan salah satu komoditi unggulan budidaya yang dikembangkan saat ini. Ikan lele disamping sebagai salah satu sumber protein hewani bagi masyarakat, juga merupakan komoditas yang dapat menunjang ekonomi rumah tangga. Ikan lele mempunyai tingkat serapan pasar yang cukup baik, selain pasar dalam negeri juga terdapat peluang untuk pasar ekspor. Beberapa tahun terakhir produksi budidaya ikan khususnya ikan lele mengalami penurunan penyebabnya adalah timbulnya wabah penyakit pada ikan, sedangkan permintaan dan kebutuhan terhadap ikan terus meningkat. Peningkatan permintaan terhadap ikan merupakan konsekuensi dari pertambahan jumlah penduduk dan perubahan pola konsumen yaitu peningkatan jumlah konsumsi ikan untuk memenuhi kebutuhan protein hewani. Ikan juga menjadi alternatif pilihan karena masyarakat menganggap bahwa ikan lebih aman dan sehat dikonsumsi bagi tubuh dan dapat meningkatkan kecerdasan. Permintaan kebutuhan protein hewani asal ikan khususnya ikan lele yang terus meningkat mendorong petani ikan untuk meningkatkan industri atau budidaya ikan kearah intensifikasi. Budidaya sistem intensif sering mengakibatkan ikan stres, dalam kondisi ini pertumbuhan dan penularan agen penyakit terjadi secara cepat yang berakibat timbulnya wabah penyakit baik akibat virus, bakteri, parasit maupun jamur yang bisa menimbulkan kematian. Menurut Dana (1990), terjadinya kematian ikan budidaya dan stok alami yang dikaitkan dengan penyakit sering dilaporkan. Indonesia sedikitnya telah tercatat tiga kali wabah yang mengakibatkan kerugian besar disebabkan penyakit yaitu parasit protozoa maupun bakteri. Ikan lele merupakan ikan yang hidup diperairan berlumpur, air yang tergenang bahkan ikan lele tahan hidup pada perairan yang tercemar bahan-bahan organik, karena faktor tersebut ikan lele dengan mudah dapat terserang penyakit infeksius maupun penyakit non infeksius. Menurut Irianto (2005), ikan konsumsi bisa terserang penyakit infeksius dan non infeksius. Salah satu penyakit infeksius 13 yaitu parasit. Ikan bisa terserang penyakit jika pemeliharaan dan pembudidayaannya tidak baik. Serangan parasit pada ikan menimbulkan dampak negatif yang cukup tinggi. Apabila ditemukan parasit dalam jumlah sedikit sebetulnya masih dianggap wajar dan tidak mengganggu proses akuakultur, tetapi apabila jumlah parasit yang menyerang ikan sangat banyak akan mengganggu pertumbuhan dan produktifitas ikan bahkan mengakibatkan kematian. Pada ikanikan yang hidup bebas di alam, akibat yang ditimbulkan oleh parasit umumnya bersifat laten atau kronis. Ikan yang terinfeksi parasit biasanya dengan mudah diikuti infeksi sekunder oleh bakteri, fungi atau virus. Nabib dan Pasaribu (1989) menambahkan, penyakit non infeksius disebabkan oleh bermacam faktor diantaranya rendahnya kandungan oksigen terlarut, tingginya kandungan amoniak, nitrit ataupun racun-racun lain yang merupakan hasil ciptaan dan aktifitas manusia yang masuk ke dalam perairan. Histopatologi merupakan penelusuran penyakit secara mikroskopik dimana dalam pengamatan histopatologi informasi yang diperoleh dalam bentuk gambaran perubahan organ/jaringan. Informasi yang diperoleh juga dapat digunakan sebagai data untuk mengetahui ada atau tidak infeksi penyakit serta untuk meramalkan proses kejadian penyakit dan tingkat epidemik suatu penyakit. Infeksi suatu penyakit baik yang infeksius maupun yang non-infeksius dapat didiagnosa dengan beberapa cara, diantaranya dengan diagnosa secara histopatologi yang bertujuan untuk mendapatkan berbagai informasi tentang penyakit. Penelitian ini akan membahas tentang gambaran perubahan histopatologi apa saja yang terlihat pada organ usus, insang dan otot ikan lele. 1.2 Tujuan Penelitian Penelitian ini bertujuan untuk mengetahui gambaran histopatologi secara deskriptif dari ikan lele (Clarias spp.) pada organ usus, insang dan otot. 1.3 Manfaat Penelitian Melalui penelitian ini diharapkan dapat mengetahui ada atau tidak infeksi penyakit pada ikan lele (Clarias spp.) berdasarkan perubahan histopatologi. 14 BAB II TINJAUAN PUSTAKA 2.1 Biologi Ikan Lele 2.1.1 Taksonomi ikan lele Menurut Suyanto (1999), taksonomi ikan lele (Clarias spp.) adalah sebagai berikut: filum Chordata, sub filum Vetebrata, kelas Pisces, sub kelas Teleostei, ordo Osteriophysi, sub ordo Siluroidae, famili Clariidae, genus Clarias dan spesies Clarias spp.. 2.1.2 Morfologi Bentuk umum ikan lele adalah bulat memanjang dengan kepala pipih. Mulut terminal dilengkapi dengan empat pasang sungut disekelilingnya. Tubuh tidak bersisik, berkulit licin bewarna gelap atau coklat dengan bagian ventral lebih terang. Sepanjang dorsal dan anal dilengkapi sirip lunak, sirip punggung hampir mencapai atau bersambung dengan sirip ekor dan tidak bersirip lunak (Gambar 1) (Saanin 1984). Gambar 1. Ikan lele (Clarias spp.) Ikan lele mempunyai ciri khusus yaitu di bagian sirip dada terdapat patil pendek, tumpul dan tidak beracun. Tubuhnya tidak bersisik dan warnanya akan berubah menjadi pucat bila terkena sinar matahari, jika ikan lele mengalami tekanan dan stres tubuhnya akan diwarnai noda hitam dan putih (Suyanto 1986). Mempunyai sungut mandibula dan maksilar yang lebih panjang dan tegar, sifatnya tenang, lebih jinak dan kepala sampai punggung bewarna coklat kehitaman serta 15 cangkang tengkorak sampai leher terdapat bercak putih kusam. Alat pernafasan tambahan pada ikan lele bukan labirin seperti yang dipunyai ikan gurami, sepat dan tambakan melainkan hanya berupa lipatan kulit tipis yang menyerupai spons (arboresent) yang terdapat dalam rongga di atas insang serta melekat padanya (Soetomo 1987). Kriteria ikan lele yang baik adalah tubuh tidak cacat, bentuk tubuh lurus, berlendir bening, tidak ada benjolan ataupun luka, sungut sempurna dan warna cerah (Anonim 1992). 2.1.3 Habitat Habitat alami ikan lele adalah dasar perairan agak berlumpur, air tergenang, ada pelindung dan perairan relatif dangkal. Habitat dapat disesuaikan dengan persyaratan yang dituntut untuk hidup dan berkembang tumbuh sesuai dengan tingkat stadiumnya. Tempat berlindung ikan lele dapat berupa pelindung seperti tanaman air, pralon dan bambu. Kedalaman air di kolam induk antara 60125 cm dan di kolam benih antara 15-40 cm. Lele akan hidup lebih baik di air yang tergenang dengan kedalaman tertentu yaitu kedalaman tertinggi 125 cm (Anonim 1992). Ikan lele mempunyai organ insang tambahan (arborescent) yang memungkinkan ikan ini mengambil oksigen pernafasannya dari udara di luar air, karena itu ikan lele tahan hidup di perairan yang airnya mengandung sedikit oksigen. Ikan lele ini relatif tahan terhadap pencemaran bahan-bahan organik, oleh karena itu ikan lele tahan hidup dengan baik di daratan rendah sampai daerah perbukitan yang tidak terlalu tinggi. Apabila suhu tempat hidupnya terlalu dingin, misal kurang dari 200 C pertumbuhannya akan terhambat (Suyanto 1986). 2.1.4 Makanan Ikan lele termasuk dalam golongan pemakan segalanya (omnivora), tetapi cenderung pemakan daging (karnivora). Selain bersifat karnivorus, ikan lele juga makan sisa-sisa benda yang membusuk dan kotoran manusia, sedangkan tumbuhtumbuhan kurang disukai. Ikan lele juga dapat menyesuaikan diri untuk memakan pakan buatan (Anonim 1992). Makanan alami ikan lele yaitu binatang-binatang 16 renik, seperti kutu-kutu air (Daphnia, Cladosera, Copepoda), cacing-cacing, larva (jentik-jentik serangga), siput-siput kecil dan sebagainya (Suyanto 1986). Ikan lele secara alami makan di dasar perairan, tetapi dapat dilatih dan sifat ini membuka peluang bagi penggunaan pakan buatan dalam usaha budidaya baik pakan permukaan maupun tengah dan dasar (Anonim 1992). 2.1.5 Tingkah laku Ikan lele adalah ikan yang hidup di air tawar dan bersifat nokturnal, artinya ia aktif pada malam hari atau lebih menyukai tempat yang gelap. Siang hari yang cerah, ikan lele lebih suka berdiam di dalam lubang-lubang atau tempat yang tenang dan aliran air yang tidak terlalu deras. Ikan lele membuat sarang di dalam lubang-lubang di tepi sungai, tepi-tepi rawa atau pematang sawah dan kolam yang teduh dan terang. Berhubung sifat-sifat dan tingkah lakunya itu, memancing ikan lele pada malam hari lebih berhasil dari pada siang hari, karena ikan lele aktif mencari makan pada malam hari atau sesudah matahari terbenam (Suyanto 1986). Secara alami lele bersifat nokturnal, tetapi dalam usaha budidaya akan beradaptasi (diurnal). Secara periodik lele akan muncul ke permukaan untuk mengambil oksigen bebas. Lele mampu bergerak di darat dengan menggunakan sirip dada. Padat penebaran yang relatif tinggi dan keadaan lapar dapat memacu sifat kanibalisme (Anonim 1992). 2.2 Anatomi dan Fisiologi Ikan Lele 2.2.1 Sistem Respirasi (Insang) Ikan dilengkapi dengan insang sebagai alat respirasi pengganti paru-paru pada hewan darat. Insang sangat berperan dalam menyelenggarakan homeostasis lingkungan bagi ikan. Lapis epitelnya tipis untuk memudahkan pertukaran gas, namun hal ini pun menjadikan insang sangat rawan terhadap infeksi dari hamahama penyakit. Selain fungsinya dalam pertukaran gas, insangpun berfungsi sebagai pengatur pertukaran garam dan air, pengeluaran limbah-limbah yang mengandung nitrogen. Kerusakan struktur yang ringan sekalipun dapat sangat 17 mengganggu pengaturan osmose dan kesulitan pernafasan (Nabib dan Pasaribu 1989). Insang terdiri dari dua rangkaian yang tersusun atas empat lengkungan tulang rawan dan tulang keras (holobrankhia) yang menyusun sisi faring. Masingmasing holobrankhia yang menonjol dari pangkal posterior lengkung insang. Hemibrankhia terdiri dari dua baris filamen tipis panjang yang disebut lamela primer. Lamela primer permukaannya mengalami perluasan oleh adanya lamela sekunder yang merupakan lipatan semilunar yang menutupi permukaan dorsal dan ventral. Insang juga dilengkapi dengan lapisan sel-sel penghasil mukus dan sel-sel yang mengekresi ammonia dan kelebihan garam. Pada bagian tepi tengah anterior dilengkapi stuktur (gill rakers) yang berperan menyaring pertikel-pertikel pakan (Roberts 2001). Insang dilengkapi dengan sejumlah glandula yang dikenal sebagai glandula brankhial, yaitu sel-sel epitel insang yang mengalami spesialisasi. Glandula tersebut adalah glandula mukosa dan glandula asidofilik (sel-sel khlorida). Glandula mukosa berupa sejumlah sel-sel tunggal berbentuk buah pear atau oval dan menghasilkan mukus dan terdapat baik pada lengkung insang, filamen insang maupun lamela sekunder. Mukus merupakan glikoprotein yang bersifat basa atau netral dengan fungsi: a.) perlindungan atau proteksi, b.) menurunkan terjadinya friksi atau gesekan, c.) antipatogen, d.) membantu pertukaran ion, dan e.) membantu pertukaran gas dan air (Irianto 2005). 2.2.2 Sistem Pencernaan Meskipun panjang usus ikan bisa berbeda-beda sesuai dengan makanannya, tetapi kebanyakan usus ikan merupakan suatu tabung sederhana yang tidak dapat bertambah diameternya untuk membentuk suatu kolon dibagian belakangnya. Usus bisa lurus, melengkung atau bergulung-gulung sesuai dengan bentuk dari rongga perut ikan. Usus mempunyai suatu epitel silindris sederhana yang berlendir menutupi suatu sub-mukosa yang mengandung sel eosinofilik yang dibatasi oleh suatu muskularis mukosa yang rapat dan lapisan fibroelastik. Rektum pada ikan berdinding lebih tebal dari pada usus dan sangat berlendir serta dapat sangat berkembang (Nabib dan Pasaribu 1989). 18 Struktur histologi dinding dari intestin secara umum hampir sama dengan vetebrata tingkat tinggi dimana terdiri dari empat lapisan yaitu : mukosa, submukosa, muskularis dan serosa. Lapisan mukosa terdiri dari epitel mukosa, lamina basalis, lamina propria dan muskularis mukosa. Pada lapisan submukosa terdiri dari stratum kompaktum dan stratum granulosum. Pada lapisan muskularis terdiri dari lapisan otot sirkuler dan lapisan otot longitudinal, sedangkan pada lapisan serosa terdiri dari subserosa tella dan subserosa membran (Takashima dan Hibiya 1995). 2.2.3 Sistem Integumen Kulit merupakan penghalang fisik terhadap perubahan lingkungan serta serangan patogen dari luar tubuh. Lapisan kulit terdiri atas kutikula, epidermis, membran basalis, dermis dan hipodermis. Ikan tidak memiliki lapisan keratin pada epidermisnya, tetapi dilapisi oleh kutikula yang memiliki mukus, mukopolisakarida, immunoglobulin spesifik, lisozim dan sejumlah asam lemak bebas. Sel lain yang ada pada lapisan epidermis yaitu sel-sel goblet yang berperan dalam sekresi mukus. Mukus memiliki kemampuan protektif bagi hewan karena : a.) mukus melapisi permukaan tubuh sehingga mempermudah gerakan saat berenang, b.) membentuk lapisan pelindung dari infeksi agensia patogenik dan mengandung senyawa anti mikroba, c.) melindungi permukaan tubuh dari abrasi dan d.) berperan dalam proses osmoregulator (Irianto 2005). Sisik dan kulit merupakan bagian dari sistim pelindungan fisik tubuh ikan. Pada umumnya kerusakan sisik dan kulit dapat terjadi akibat penanganan (handling stress), kelebihan populasi, dan infeksi parasit. Kelebihan populasi (overcrowded) atau multikultur dapat menyebabkan trauma akibat berkelahi disertai lepasnya sisik dan kerusakan kulit. Infestasi parasit dapat pula menyebabkan gangguan berupa kerusakan insang, kulit, sirip serta kehilangan sisik. Kerusakan pada sisik dan kulit akan mempermudah patogen menginvasi inang. Banyak kasus menunjukkan bahwa kematian ikan sebenarnya akibat dari infeksi sekunder oleh bakteri sebagai kelanjutan infestasi parasit yang berat dan berakibat pada kerusakan pelindung fisik tubuh seperti mukus, kulit dan sisik 19 tetapi tidak semua ikan memiliki sisik misalnya pada ikan lele (Clarias spp.) (Irianto 2005). 2.2.4 Sistem Muskuloskeletal (Otot) Hasil pemeriksaan histopatologi dan biokhemis dari otot ikan ternyata terdapat sejumlah tipe serabut otot yang pada banyak spesies ikan tersusun dalam banyak kelompok-kelompok yang terpisah. Umumnya ada 2 kelompok yaitu, kelompok muskularis lateralis superfisialis terdiri atas yang disebut otot merah dan kelompok muskularis lateralis profundus yang terdiri atas serabut-serabut putih. Serabut-serabut merah ini adalah serabut aerobik dan berdaya kontraksi lamban dan banyak pembuluh darah, serupa dengan serabut-serabut merah pada otot mamalia, sedangkan serabut-serabut putih adalah anaerob berdaya kontraksi cepat dan mudah menderita kerusakan. Diantara lapisan otot-otot merah dan putih terdapat serabut merah muda yang fungsinya berada diantara serabut-serabut merah dan putih (Nabib dan Pasaribu 1989). 2.3 Faktor-faktor yang Mempengaruhi Munculnya Penyakit pada Ikan Lele 2.3.1 Suhu Ikan merupakan hewan ektotermik yang berarti tidak menghasilkan panas tubuh, sehingga suhu tubuhnya tergantung atau menyesuaikan pada suhu lingkungan sekelilingnya (Hoole et al. 2001). Ikan memiliki derajat toleransi terhadap suhu dengan kisaran tertentu yang sangat berperan bagi pertumbuhan, inkubasi telur, konversi pakan dan resistensi terhadap penyakit. Ikan akan mengalami stes manakala terpapar pada suhu di luar kisaran yang dapat ditoleransi (Irianto 2005). Suhu tinggi tidak selalu berakibat mematikan tetapi dapat menyebabkan gangguan status kesehatan untuk jangka panjang, misalnya stres yang ditandai dengan tubuh lemah, kurus, dan tingkah laku abnormal. Pada suhu rendah, akibat yang ditimbulkan antara lain ikan menjadi rentan terhadap infeksi fungi dan bakteri pathogen akibat melemahnya sitem imun. Pada dasarnya suhu rendah memungkinkan air mengandung oksigen lebih tinggi, tetapi suhu rendah 20 menyebabkan stres pernafasan dan denyut jantung sehingga dapat berlanjut dengan pingsannya ikan-ikan akibat kekurangan oksigen (Irianto 2005). 2.3.2 Cahaya Pada sistem budidaya intensif, intensitas cahaya, lama penyinaran, area berkanopi dan penyerapan cahaya lebih mudah dikontrol. Parameter-parameter ini akan berperan dalam laju pertumbuhan dan maturisasi ikan. Pada system intensif berair dangkal, sinar ultraviolet cahaya matahari yang berlebihan dapat menyebabkan gangguan “sunburn” pada bagian dorsal ikan (Irianto 2005). Penetrasi cahaya dapat terhalang oleh turbiditas air yang disebabkan melimpahnya populasi fitoplankton (alga bloom) dan partikel-partikel padatan terlarut. Apabila penetrasi cahaya tidak dapat mencapai dasar kolam atau tambak, akan menghambat tumbuhnya algae berfilamen dan tumbuhan air pengganggu pada dasar kolam. Sampai batas tertentu melimpahnya fitoplankton tertentu sangat menguntungkan karena kebutuhan pakan alami tercukupi (Boyd 1991). 2.3.3 Stres Stres yaitu suatu keadaan saat suatu hewan tidak mampu mengatur kondisi fisiologis normal karena berbagai faktor merugikan yang mempengaruhi kondisi kesehatannya. Sehingga stres didefinisikan sebagai pengaruh segala bentuk perubahan atau tantangan lingkungan yang mendorong homeostatik atau prosesproses penyeimbang lainnya melebihi batas kemampuan normal segala tingkatan organisasi biologis (Irianto 2005). Stres berpengaruh terhadap sistem pertahanan tubuh inang definitif yaitu mukus. Segala bentuk stres akan menyebabkan perubahan kimiawi dalam mukus yang dapat menyebabkan penurunan efektivitasnya sebagai pelindung kimiawi inang terhadap patogen dan parasit. Stres akan mengganggu keseimbangan elektrolit tubuh (Na, K, Cl) sehingga menyebabkan penyerapan air yang berlebihan atau dapat pula berupa kehilangan air (dehidrasi). Kondisi stres menyebabkan tuntutan kerja mukus dalam mengatur osmoregulasi yang efektif menjadi sangat penting (Irianto 2005). 21 2.3.4 Kelebihan Populasi (overcrowded) atau Multikultur Penyakit infeksi menjadi ancaman utama keberhasilan akuakultur. Pemeliharaan ikan dalam jumlah besar dan padat pada area yang terbatas, menyebabkan kondisi lingkungan tersebut sangat mendukung berkembang dan penyebarnya penyakit infeksi. Kondisi dengan padat tebaran tinggi akan menyebabkan ikan mudah stres sehingga menyebabkan ikan menjadi mudah terserang penyakit, selain itu kualitas air, volume air dan alirannya berpengaruh terhadap berkembangnya suatu penyakit. Populasi yang tinggi akan mempermudah penularan karena meningkatnya kemungkinan kontak antara ikan yang sakit dengan ikan yang sehat (Irianto 2005). 2.3.5 Sistem Imun Ikan Lele yang Rendah Beragam faktor yang mempengaruhi masing-masing individu dalam menanggapi suatu patogen potensial. Patogen harus dapat menembus sistem imun ikan untuk dapat menimbulkan penyakit. Daya tahan alami (imun) memungkinkan suatu hewan menjadi terbebas dari serangan patogen karena tidak adanya jaringan spesifik atau reseptor seluler bagi kolonisasi patogen atau tidak mampu mendukung syarat-syarat optimum baik dari sisi kecukupan nutrien maupun lingkungan bagi pertumbuhan pathogen. Masing-masing individu hewan memiliki daya tahan individu yang ditentukan antara lain oleh umur, jenis kelamin, status nutrien dan stres. Saat ikan pada kondisi lemah (sistem imun rendah) dan pada kondisi lingkungan yang kurang menguntungkan maka ikan akan rentan terserang patogen (Irianto 2005). 2.4 Penyakit-Penyakit Infeksius pada Ikan Lele 2.4.1 Parasit Supriyadi et al. (1986) menyatakan bahwa kematian benih ikan lele sekitar 80-100 % disebabkan oleh parasit-parasit dari golongan ciliata seperti Ichthiophthirius multifiliis, Trichodina spp. dan Epistylis spp. ; cacing monogenea seperti Gyrodactylus spp. dan Dactylogyrus spp. ; serta parasit yang tergolong berbahaya dari golongan Myxosporea yaitu Henneguya spp.. Berdasarkan data yang ada pada Dinas Perikanan Propinsi Jawa Barat, bahwa parasit yang umum 22 menyerang ikan lele antara lain Ichthiophthirius multifiliis dan Argulus sp. Hasil penelitian yang dilakukan di Balai Budidaya Air Tawar Sukabumi diperoleh jenisjenis parasit yang ditemukan menginfeksi benih ikan lele dumbo yaitu Trichodina spp.,Trichodinella spp., Ichthiophthirius multifiliis, Gyrodactylus spp., Cryptobia spp.. Sedangkan menurut Hariyadi (2006), parasit yang menyerang ikan lele yaitu Vorticella, Cryptobia sp., Trichodina, Ichthyophthirius multifiliis, Myxosporidea, Gyrodactylus, Dactylogyrus, Branchionus, Metaserkaria dari trematoda digenea dan Lytocestus parvulus. 1. Protoza Epistylis spp. Menurut Kabata (1985), Epistylis spp. digolongkan dalam filum Ciliophora, sub kelas Peritricha, ordo Peritrichida, sub ordo Sessilina, famili Epistylidae, genus Epistylis, spesies Epistylis spp.. Menurut Flynn (1973), tubuh berbentuk seperti kerucut dn mempunyai cilia di daerah ujung adoral. Organisme muda berenang bebas mempunyai cilia tambahan yang melingkar disekitar ujung posterior tubuh. Kabata (1985) menambahkan, Epistylis spp. mempunyai makronukleus lonjong seperti sosis, ciri perbedaan yang paling penting adalah tangkai yang tidak kontraktil. Selnya sendiri cukup baik untuk berkontraksi dan menarik kembali periostoma ke dalam sel. Secara individual Epistylis spp. hidup di dekat luka atau kerusakan lainnya di daerah kulit. Beberapa genus ini bersifat parasit obligat dan hampir tidak spesifik terhadap ikan sebagai induk semang definitif. Asia Tenggara yang kehidupan akuakultur air tawar kaya akan unsur organik mendukung dan mungkin dapat diharapkan adanya kondisi seperti itu untuk kehidupan protozoa. Gejala klinis yang tampak pada ikan yang terserang Epistylis spp. yaitu ikan menjadi lemah, menyebabkan terjadinya iritasi kulit, menekan sel epitel yang diserangnya mengakibatkan kelainan bentuk dan gangguan fungsi dari epitel. Kumpulan koloni pada kulit dapat menginfeksi alat pernafasan, pada beberapa ikan yang umumnya kulit berfungsi sebagai alat untuk bernafas. Koloni besar dari Epistylis spp. pada opercula dapat menggangu gerakan normal dan menginfeksi alat 23 pernafasan, pertumbuhan terhambat serta berat badan ikan menurun (Kabata 1985). Eimeria Menurut Woo (2006), Emeria digolongkan dalam filum Apicomplexa, kelas Sporozoasida, Subkelas Coccidiasina, Ordo Eucoccidiorida, Subordo Eimeriorina, famili Eimeriidae dan genus eimeria. Eimeria spp. merupakan coccidia yang menginfeksi beragam jenis ikan air tawar dan air laut serta menyebabkan penyakit coccidiosis. Emeria tidak hanya menginfeksi sel-sel epitel tetapi juga organ dalam termasuk gonad. Emeria subepitelia merupakan spesies emeria yang menginfeksi ikan-ikan cyprinid menyebabkan area bintik-bintik putih agak menonjol pada bagian saluran pencernaan anterior dan tengah. E. carpelli menginfeksi ikan cyprinid menyebabkan borok, hemoragi pada saluran pencernaan. Adapun E. sardinae menginfeksi ikan-ikan air laut menyebabkan reaksi granulomatous pada hati dan testis (Irianto 2005). Infeksi pada usus sering bersifat asimtomatis tetapi dapat menyebabkan nekrosa pada epitel usus dan enteritis. Inflamasi pada usus disebabkan oleh pembentukan ookista. Parasit ektraintestin dapat juga menyebabkan lesion dengan kerusakan sel target yang khas dan diikuti dengan inflamasi. Selain itu, infeksi juga terjadi pada organ reproduksi, hati, limpa dan gelembung renang (Noga 2000). 2. Trematoda Digenea Anatomi Trematoda Digenea Digenea menyebabkan infeksi asimtomatik pada ikan yang hidup liar/bebas. Ada 1700 spesies digenea dewasa menginfeksi ikan. Metaserkaria lebih sering terdapat pada ikan dewasa (Noga 2000). Bentuk tubuh pipih dorsoventral, tidak bersegmen, biasanya berbentuk oval atau seperti wajik kadang-kadang juga berbentuk oval secara melintang (leher lebih dominan). Trematoa digenea umumnya mempunyai dua alat penghisap (sucker), satu penghisap oral yang terletak di dekat anterior dan satu penghisap ventral yang letaknya bervariasi (Kabata 1985). 24 Siklus Hidup Menurut Noga (2000), siklus hidup dari trematoda digenea yaitu digenea dewasa menghasilkan telur yang keluar dari usus inang definitif (ikan, beruang atau mamalia), telur menetas menjadi mirasidium yang menginfeksi moluska (siput atau keong) sebagai inang antara. Serkaria berkembang dikeluarkan oleh moluska dan mengalami penetrasi pada ikan. Setelah menempati jaringan target, serkaria berubah menjadi metaserkaria dimana biasanya membentuk kista di jaringan. Ikan yang juga sebagai inang antara mengandung kista dari metaserkaria trematoda digenea dimakan oleh inang definitif kemudian metaserkaria berubah menjadi dewasa. Irianto (2005) menambahkan, trematoda digenea memiliki siklus hidup yang komplek dengan melibatkan sejumlah inang definitif. Ikan dapat berperan sebagai inang sementara dan inang definitif tergantung spesies trematoda digenea. Trematoda dapat berupa parasit ekternal atau internal pada berbagai macam organ. Patogenesis Kebanyakan digenea dewasa berada di dalam gastrointestinal, tetapi jarang menginfeksi gelembung renang, ovary, peritoneum, vesica urinaria atau sistem sirkulasi (Noga 2000). Kerusakan inang biasanya terjadi selama serkaria migrasi yang menyebabkan hemoragi, nekrosis dan inflamasi di tempat migrasi dari serkaria, jika terjadi infeksi bersifat akut sangat fatal khususnya pada ikan kecil. Serkaria berpindah atau migrasi dari jaringan inang definitif dapat mengganggu fungsi organ. Metaserkaria dapat ditemukan di beberapa jaringan, tergantung pada spesies digenea yang menginfeksi. Metaserkaria dapat merusak nilai estetika dan menurunnya laju pertumbuhan pada ikan. Lesion terlihat bewarna putih atau kuning karena warna dari cacing, selain itu juga bewarna hitam karena hiperpigmentasi reaksi dari inang definitif (Noga 2000). Metaserkaria trematoda digenea dapat berbahaya bagi ikan yaitu Diplostomum yang metaserkarianya menginfeksi lensa mata ikan salmon dan ikan lainnya, menyebabkan kebutaan dan selanjutnya dapat menghambat kemampuan mencari makan. Metaserkaria dari famili heterophyidae menyebabkan kerusakan hebat pada insang, penurunan kemampuan respirasi dan mortalitas yang tinggi 25 pada ikan subtropis dan tropis selain itu juga menyebabkan morbiditas serius di Florida dan Israel (Noga 2000). Menurut Olson dan Pierce (1997), kista dari metaserkaria dapat menimbulkan respon pada inang definitif berupa proliferasi kartilago dari perikondrium dan respon fibroblastik pada jaringan insang, selain itu juga mengakibatkan hiperplasia epitel insang dan fusi (penyatuan) lamela insang sehingga terjadi kerusakan dan berkurangnya permukaan respirasi insang serta berkurangnya efisiensi difusi gas. Beberapa trematoda digenea yaitu dari kelompok heterophyds (Heterophyes, Haplorchis, Metagonimus) dan opisthorchids (Chlonorchis, Opisthorchis) dapat menginfeksi manusia karena cacing ini bersifat zoonosis. Manusia dapat terinfeksi dengan cara memakan daging ikan yang mengandung kista dari metaserkaria trematoda digenea yang tidak dimasak dengan baik atau sempurna dan tidak diasinkan (Noga 2000). Menurut Woo (2006), kasus pada manusia pernah dilaporkan di negara Israel dan Jepang menyebabkan laryngitis akut pada manusia. 2.5 Penyakit-Penyakit Non-Infeksius pada Ikan Lele 2.5.1 Defisiensi Vitamin Vitamin E (tokopherol) Fungsi vitamin E dalam jaringan seperti halnya dalam diet menjadi komponen komplek dalam mekanisme protektif melawan efek toksik radikal bebas. Tokopherol sebagai antioksidan dipengaruhi oleh sumbangan proton dari radikal bebas, diubah menjadi stabil sehingga menjadi senyawa yang tidak berbahaya. Tokopherol berperan di dalam jaringan untuk regenerasi dengan mekanisme yang melibatkan selenium. Diet ikan yang mengandung lipid oksidasi mengakibatkan jumlah tokopherol regenerasi tidak dapat mengimbangi tekopherol oksidasi dengan demikian akan mempercepat penipisan membran dan level tokopherol seluler, ini menunjukkan tanda defisiensi. Gejala klinik defisiensi vitamin E berhubungan dengan distropi otot, steatitis, patologi otot jantung serta anemia. Anemia berhubungan dengan membran eritrosit yang rapuh dimana dapat digunakan untuk menentukan status tokopherol pada ikan (Roberts 2001). 26 Perubahan patologi akibat dari defisiensi vitamin E yaitu terjadinya perubahan temperatur akibat respon patologi yang hebat, degenerasi hyalin pada otot, infiltrasi lemak subepikardial dan proliferasi fibroblas. Pemberian tekopherol dapat mencegah kondisi ini, tentu saja level tokopherol dalam jaringan ketika diberikan makanan suplemen 5-10 kali di atas syarat diet minimum (Roberts 2001). 2.5.2 Expose Bahan Toksik Bermacam polutan dan logam berat menyebabkan perubahan morfologi insang pada ikan. Secara umum reaksi jaringan terhadap expose bahan toksik lingkungan menyerupai respon inflamasi (peradangan). Expose ikan terhadap logam berat, deterjen, nitropenol memperlihatkan pemisahan diantara sel epitel dan dasar sel pilar sistem, dimana dapat terjadi koleps integriti struktur lamela sekunder. Contohnya respon dari expose zinc pada ikan trout pelangi dan stickleback terlihat adanya “swelling”(membengkak) pada lamela sekunder dan pelepasan epitel lamela dari sel pilar sistem dan kerusakan sel epitel. Pada kasus berat ruang interlamelar dimana air secara normal disalurkan, dapat menjadi komplit menyebabkan hiperplasia sel epitel di filamen primer dan produksi mukus berlebihan (Leatherland 1998). Menurut Hoole et al. (2001), perubahanperubahan yang akut pada jaringan insang akibat dari terpapar bahan-bahan toksik berupa fusi (peleburan) lamela dan piknosis sel-sel. Kasus-kasus kronis akan terjadi nekrosis, deskuamasi sel epitel, edema, dan ditandai dengan infiltrasi selsel granuler eosinofilik dan jenis leukosit yang lain. Kondisi-kondisi ini mengurangi efisiensi difusi gas dan fungsi insang yang lain dan dapat berakibat fatal. Keracunan Pestisida Pestisida menimbulkan efek secara general yaitu penurunan tingkat kelahiran/produksi atau menghambat pertumbuhan ikan. Kadang-kadang terjadi overdosis atau melalui kontaminasi dapat menyebabkan kematian. Biasanya menimbulkan nekrosis akut dengan nekrosis pada hati dan ginjal. Kelangsungan hidup ikan dipertahankan dengan penggantian jaringan fibrosis pada area nekrosis dan general rekover. Pada insang menyebabkan edema dikuti dengan deskuamasi 27 epitel lamela sekunder dan nekrosa sel epitel mengakibatkan gangguan respirasi dan osmoregulasi serta mengakibatkan kematian (Roberts 2001). Ammonia Ammonia lebih toksik dari nitrogen, dapat bersifat akut bagi ikan dan dapat mengakibatkan kematian. Ammonia di dalam air ada dua bentuk yaitu ion ammonia (NH4+) dan ammonia bebas (NH3). Ammonia bebas (NH3) lebih toksik dari pada ion ammonia. Ammonia akan meningkat pada kondisi temperatur dan pH air meningkat. Ammonia lebih toksik jika rendahnya level oksigen yang terlarut (DO). Jika air mengandung biomass yang signifikan seperti macrophytes dan algae pada saat terjadi fotosintesis dan respirasi (malam) akan mengakibatkan kenaikan atau penurunan level (DO) dan kenaikan atau penurunan level CO2 hal ini dapat mempengaruhi pH (Hoole et al. 2001) Toksisitas dari ammonia dipengaruhi oleh beberapa faktor diantaranya : spesies ikan, level ekposur dari ammonia bebas (NH3), periode ekposur dan beberapa efek aklimasi. Ikan yang terpapar toksik menyebabkan perubahan kimia darah diantaranya : peningkatan pH, gangguan osmolegulator dan kesulitan bernafas. Gangguan osmolegulator, peningkatan permeabilitas, dimana ikan harus mengimbanginya dengan peningkatan ekresi urin. Fakta menyatakan bahwa ammonia dapat merusak epitel insang, edema, deskuamasi epitel insang dan nekrosis. Level ammonia yang tinggi menyebabkan kematian yang akut pada ikan. Ini karena kerusakan epitel dan usus, menyebabkan hemoragi, mempengaruhi CNS dan tingkahlaku yang abnormal. Ekposur kronis level subletal dapat menyebabkan penurunan berat badan dan peningkatan kerentanan infeksi (Hoole et al. 2001). 2.6 Beberapa Perubahan Histopatologi 2.6.1 Inflamasi Menurut Guyton and hall (1996), inflmasi (peradangan) ditandai dengan : (1) vasodilatasi pembuluh darah lokal yang mengakibatkan terjadinya aliran darah setempat yang berlebihan, (2) kenaikan permeabilitas kapiler disertai dengan kebocoran banyak sekali ke ruang interstisial, (3) seringkali pembekuan cairan dalam ruang interstisial yang disebabkan oleh fibrinogen dan protein lainnya yang 28 bocor dari kapiler dalam jumlah berlebihan, (4) migrasi sejumlah besar granulosit dan monosit ke dalam jaringan dan (5) pembengkakan sel jaringan, sedangkan menurut Roberts (2001), inflamasi merupakan suatu respon pertahanan jaringan yang rusak dan terjadi pada semua vetebrata. Respon inflamasi pada hewan tingkat tinggi ditandai dengan color, rubor, tumor, dolore dan function laeso (panas, merah, bengkak, sakit dan kehilangan fungsi). Inflamasi dapat mengakibatkan pembatasan area yang terluka dari jaringan yang tidak mengalami inflamasi. Ruang jaringan dan cairan limfatik dalam daerah yang meradang dihalangi oleh bekuan fibrinogen, sehingga sedikit saja cair yang melintasi ruang. Proses pembatasan akan menunda penyebaran bakteri atau produk toksik (Guyton and Hall 1996). Menurut Spector (1993), inflamasi dapat akut yaitu umurnya pendek atau kronis yaitu berkepanjangan, tergantung kepada derajat luka jaringan. Underwood (1992) menambahkan bahwa inflamasi akut merupakan reaksi awal dari kerusakan jaringan, terjadinya dilatasi dan peningkatan permeabilitas pembuluh darah, cairan dan sel keluar dari pembuluh darah serta adanya netrofil di jaringan yang meradang. Pada inflamasi kronis ditandai dengan : (1) adanya limposit, sel plasma dan makrofag predominan, (2) merupakan lanjutan dari inflamasi akut, (3) inflamasi granulomatos adalah bentuk spesifik dari inflamasi kronis dan kadangkadang diikuti reaksi sekunder oleh amyloidosis. 2.6.2 Edema Edema merupakan suatu kondisi dimana meningkatnya jumlah cairan dalam kopartemen jaringan interseluler. Edema terjadi pada jaringan ikat longgar (sub kutis) dan rongga-rongga badan (rongga perut dan di dalam paru-paru) (Underwood 1992). Menurut Guyton and Hall (1996), penyebab dari edema adalah meningkatnya tekanan hidrostatik intra vaskula menimbulkan perembesan cairan plasma darah keluar dan masuk ke dalam ruang interstisium. Kondisi peningkatan tekanan hidrostatik sering ditemukan pada pembendungan pada vena (kongesti) dan edema merupakan resiko paska kongesti. Underwood (1992) menambahkan bahwa edema dapat diklasifikasikan dalam empat kategori patogenetik yaitu (1) 29 inflamasi yang berkaitan dengan peningkatan permeabilitas vaskuler, (2) peningkatan tekanan intravena, (3) obtruksi saluran limfatik, (4) hipoalbumin yang berkaitan dengan penurunan tekanan onkotik plasma. 2.6.3 Hemoragi dan Kongesti Hemoragi (pendarahan) adalah kondisi yang ditandai dengan keluarnya darah dari dalam vaskula akibat dari kerusakan dinding vaskula. Kebocoran dinding ada dua macam melalui kerobekan (per reksis) dan melalui perenggangan jarak antara sel-sel endotel dinding vaskula (per diapedisis). Hemoragi per diapedisis umumnya terjadi pada pembuluh kapiler. Hemoragi per reksis dapat terjadi pada vaskuler apa saja, bahkan dapat terjadi bila dinding jantung robek atau bocor (Smith dan Jones, 1961). Hemoragi kecil dimana berbentuk titik darah tidak lebih besar dari ujung peniti disebut ptechiae (tunggal, petechia). Hemoragi dengan spot yang agak besar di permukaan tubuh atau di jaringan disebut ekimosis (tunggal, ekimosis). Ektrafasasi merupakan hemoragi dalam jaringan yang sudah sangat menyebar (Smith dan Jones 1961) . Hemoragi dapat disebabkan oleh : (1) trauma yaitu kerusakan dalam bentuk fisik yang merusak sistem vaskula jaringan di daerah benturan/ kontak, (2) infeksi agen infeksius terutama mengakibatkan septisemia, (3) bahan toksik yang merusak endotel kapiler, (4) faktor lain yang menyebabkan dinding vaskula lemah sehingga pembuluh darah rentan untuk bocor. Kongesti adalah berlimpahnya darah di dalam pembuluh darah di regio tertentu. Kongesti disebut juga hiperemi, jika dilihat secara mikroskopik kapilerkepiler dalam jaringan yang hiperemi terlihat melebar dan penuh berisi darah.Pada dasarnya kongesti dapat terjadi dengan dua mekanisme yaitu : (1) Kenaikan jumlah darah yang mengalir ke jaringan atau organ disebut dengan kongesti aktif dan (2) penurunan jumlah darah yang mengalir ke jaringan atau organ disebut dengan kongesti pasif (Price dan Wilson 2006). 30 2.6.4 Degenerasi Otot dan Nekrosa Degenerasi Hialin merupakan perubahan yang mengikuti cloudy swelling dan disebut juga nekrosis koagulasi. Nukleus kromatin berkondensasi dan menyebabkan lurik pada serabut otot menghilang. Serabut memperlihatkan suatu penampilan homogen dan efektif terhadap pewarnaan eosin. Serabut-serabut otot terhialinasi menjadi lebih rapuh dibandingkan serabut-serabut yang tetap utuh. Degenerasi hialin yang hanya terjadi pada sebagian dari serabut otot menyebabkan nukleus dekat dengan batas bagian terhialinasi dan bagian yang tetap utuh sering kali mengalami hiperplasia. Beberapa serabut otot yang telihat normal di dekat serabut-serabut yang terpengaruh hialinasi sering memperlihatkan pemisahan longitudinal yang frekuen (Takashima dan Hibiya 1995). Degenerasi granuler merupakan perubahan paling berat yang muncul pada serabut otot dan dikenal sebagai nekrosis pencairan, yaitu degenerasi granuler yang mempengaruhi seluruh serabut atau hanya suatu bagian saja. Sarkoplasma menjadi granuler memperlihatkan suatu massa eosinofilik yang tidak beraturan di dalam sarkolema, adakalanya tetap jelas terlihat pada bagian serabut otot yang tidak terpengaruh. Kejadian umum terlihat pada serabut otot yang rusak, yaitu adanya infiltrasi fagosit. Serabut dengan fagosit yang memenuhi bagian-bagian terdegenerasi dikenal sebagai kantong-kantong berbentuk pipa (Tubular Bag). Serabut-serabut otot berdekatan dengan serabut yang terpengaruh oleh degenerasi ini juga memperlihatkan pemisahan longitudinal, hipertropi dan hiperplasia nukleus, tetapi tingkatnya lebih besar dibandingkan dengan degenerasi hialin pada serabut otot (Takashima dan Hibiya 1995). Nekrosa merupakan jenis kematian sel ireversibel yang terjadi ketika terdapat cidera berat atau lama hingga suatu saat sel tidak dapat beradaptasi atau memperbaiki dirinya sendiri. Umunya perubahan-perubahan lisis yang terjadi dalam jaringan nekrotik dapat melibatkan sitoplasma sel, perubahan-perubahan paling jelas bermanifestasi pada inti. Inti sel yang nekrosis akan menyusut, memiliki batas yang tidak teratur dan bewarna gelap. Proses ini dinamakan piknosis. Kemungkinan lain inti dapat hancur dan membentuk fragmen-fragmen materi kromatin yang tersebar di dalam sel, proses ini disebut sebagai karioreksis. Pada beberapa keadaan init sel tidak dapat diwarnai lagi dan benar-benar hilang, 31 proses ini disebut sebagai kariolisis. Pengaruh nekrosis mengakibatkan hilangnya fungsi pada daerah yang nekrosa. Pada beberapa keadaan daerah nekrotik dapat menjadi fokus infeksi yang merupakan medium pembiakan yang sangat baik bagi pertumbuhan organisme tertentu yang kemudian dapat menyebar ke tempat lain di dalam tubuh, bahkan tanpa infeksipun adanya jaringan nekrosa di dalam tubuh dapat memicu perubahan sistemik tertentu misalnya peningkatan jumlah leukosit di dalam sirkulasi. Jaringan yang mengalami nekrosis dapat menginduksi respon peradangan dari jaringan yang berdekatan. Jaringan yang nekrosa akan hancur dan hilang memberi jalan bagi proses perbaikan yang mengganti daerah nekrotik dengan sel-sel yang beregenerasi, pada beberapa keadaan dengan terbentuknya jaringan parut (Price dan Wilson 2006). 2.6.5 Proliferasi Sel Goblet Sel goblet terdapat diantara sel absorbtif vili usus halus yang mengandung asam glikoprotein berfungsi untuk melicinkan dinding usus (Janquiera et al. 1997) dan berfungsi sebagai media pertahanan yang penting terhadap infeksi cacing (Tiuria et al. 2000), sedangkan pada insang terdapat pada epitel lamela primer bagian aferen dan eferen tepi lamela primer (Takashima dan Hibiya 1995) serta berfungsi sebagai pelindung atau proteksi, menurunkan terjadinya friksi dan gesekan, antipatogen, membantu pertukaran ion dan membantu pertukaran gas dan air (Irianto 2005). Proliferasi merupakan suatu keadaan dimana terjadi peningkatan atau kenaikan jumlah sel yang nyata dalam jaringan (Price dan Wilson 2006). Menurut Tiuria et al. (2000), proliferasi dan hiperplasia sel goblet terjadi pada permukaan mukosa usus. Sel ini berasal dari sel bakal (stem sel ) yang terdapat pada dasar kripta, berdiferensiasi dan bermigrasi dari dasar kripta ke bagian atas vili yaitu lamina propria selanjutnya disalurkan ke dalam lumen. 2.6.5 Hiperplasia Lamela Sekunder Hiperplasia lamela adalah respon dalam jangka panjang dari sel malpighian. Sel terutama didapat dari lamela primer, mereka berpindah ke distal dalam langkah awal menghasilkan akumulasi sel pada tepi lamela sekunder yang 32 biasanya disebut “clubbing” pada lamela. Seluruh jarak antar lamela dipenuhi oleh sel-sel baru dan sering ditunjukkan dengan metaplasia mukoid mengakibatkan area respirasi menjadi berkurang (Roberts 2001). Hiperplasia lamela biasanya berkaitan dengan peningkatan jumlah dan migrasi sel malpighian di lamela primer. Insang rusak oleh efek pH air yang rendah berkaitan dengan hujan asam dan peningkatan absorbsi (penyerapan) aluminium tanah. Hiperplasia lamela sekunder juga berkaitan dengan edema pada lamela dan hipertropi sel epitel. Terjadi perubahan bentuk sel pilar, tetapi faktor utama yaitu peningkatan jumlah sel kloride yang meluas sampai ke permukaan lamela sekunder sehingga terjadi penebalan pada lamela sekunder (Roberts 2001). 33 BAB III METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian Penelitian dilaksanakan di Laboratorium Patologi Departemen Klinik, Reproduksi dan Patologi serta Labratorium Helmintologi Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner FKH-IPB dimulai dari bulan Juli - Agustus 2007. 3.2 Bahan dan Alat Bahan dan alat yang digunakan dalam penelitian ini adalah : (1) organ insang, otot dan usus ikan lele yang telah difiksasi dalam BNF (Buffer Netral Formalin) 10%, (2) pewarnaan Haematoksilin-Eosin, (3) xylol dan minyak emersi, (4) objek gelas dan cover gelas, (5) mikroskop, (6) kamera untuk dokumentasi, (7) akuarium. 3.3 Metode Penelitian Sampel ikan lele diambil di pasar Laladon sebanyak 17 ekor kemudian diaklimatisasi di dalam akuarium selama satu hari supaya ikan lele bisa beradaptasi dengan lingkungannya yang baru. Ikan dimatikan dengan cara memukul bagian frontal dari kepala kemudian dinekropsi. Usus, otot dan insang yang diambil diawetkan dalam BNF 10%. Tahap berikutnya pembuatan preparat histopatologi dilakukan beberapa tahap (lampiran 1), setelah pembuatan preparat histopatologi dilakukan pewarnaan dengan Haematoksilin-Eosin (lampiran 2) dan dilakukan pengamatan pada organ insang, otot, usus menggunakan mikroskop cahaya dengan pembesaran 10x sampai 100x serta pengambilan foto histopatologi untuk dokumentasi. 34 BAB IV HASIL DAN PEMBAHASAN 1. Insang Berdasarkan pengamatan, perubahan histopatologi yang ditemukan pada organ insang yaitu hiperplasia lamela sekunder yang merupakan perubahan histopatologi paling banyak ditemukan yaitu pada 17 sampel dari 17 sampel ikan yang diambil, berikutnya diikuti oleh kongesti 16 sampel, edema 13 sampel, proliferasi sel goblet 10 sampel, deskuamasi epitel insang 8 sampel, kerusakan tulang rawan 8 sampel, hemoragi 6 sampel dan yang paling sedikit kista dari metaserkaria trematoda digenea 5 sampel (Gambar 2). Hiperplasia lamela sekunder Hemoragi 18 16 100% 94,12% Kongesti 14 76,47% 12 58,82% Jumlah 10 (Ekor) 8 6 47,06% 35,29% Deskuamasi epitel 47,06% Proliferasi sel goblet 29,41% 4 Edema 2 0 Kista dari metaserkaria trematoda digenea Perubahan Histopatologi 1 1 8 1 1 5 8 Kerusakan tulang rawan Gambar 2. Frekuensi lesio histopatologi organ insang ikan lele (Clarias spp.) Hiperplasia Lamela Sekunder Hiperplasia lamela sekunder merupakan perubahan histopatologi yang paling banyak ditemukan pada insang. Semua sampel ikan yang diambil mengalami hiperplasia lamela sekunder dan diikuti juga dengan inflamasi pada insang. Hiperplasia lamela sekunder terjadi mulai dari ringan sampai berat. Hiperplasia lamela sekunder yang berat terjadi jika hampir seluruh lamela sekunder insang mengalami penebalan, sedangkan hiperplasia lamela sekunder 35 ringan terjadi hanya sebahagian kecil dari lamela sekunder insang yang mengalami penebalan. Hiperplasia lamela sekunder disebabkan karena habitat ikan lele yang hidup di perairan berlumpur, rawa, telaga, sawah yang tergenang air dimana kualitas airnya buruk. Menurut Camargo dan Martinez (2007), kontaminasi air oleh aktifitas manusia seperti pertanian dan industri yang mengandung beranekaragam polutan organik dan inorganik diantaranya minyak, logam berat, pestisida dan pupuk menyebabkan perubahan kualitas air dan ganguan kesehatan pada ikan. Perubahan histopatologi insang ikan yang terpapar polutan berupa hiperplasia sel epitel dan terangkatnya epitel lamela insang. Pada kasus berat mengakibatkan fusi pada beberapa lamela sekunder, hipertropi sel epitel dan bentuk lamela insang menjadi tidak beraturan (Gambar 3). Faktor lain yang dapat menyebabkan hiperplasia lamela sekunder yaitu ammonia dalam bentuk NH3 yang berasal dari ekresi metabolisme pakan yang bersifat toksik bagi ikan serta bisa diikuti infeksi sekunder oleh bakteri. Kista dari metaserkaria trematoda digenea juga dapat menyebabkan hiperplasia lamela sekunder. Hal ini dapat dilihat dari 5 sampel ditemukan kista dari metaserkaria trematoda digenea yang terdapat di dalam filamen kartilago insang. Menurut Woo (2006), kista dari metaserkaria trematoda digenea menginduksi hiperplasia epitel insang dan penebalan filamen insang. Menurut Roberts (2001), hiperplasia lamela biasanya berkaitan dengan peningkatan jumlah dan migrasi sel malpighian di lamela primer. Hiperplasia lamela sekunder juga berkaitan dengan edema pada lamela dan hipertropi sel epitel serta terjadi perubahan bentuk sel pilar, tetapi faktor utama yaitu peningkatan jumlah sel kloride yang meluas sampai ke permukaan lamela sekunder sehingga terjadi penebalan pada lamela sekunder. Akibat dari penebalan lamela sekunder area respirasi menjadi berkurang, selain itu juga terjadi gangguan pertukaran ion di epitel dan terganggunya fungsi normal sel kloride. 36 Gambar 3. Hiperplasia lamela sekunder pada insang (panah biru). Pewarnaan HE, gambar atas 1 bar = 100 μm dan gambar bawah 1 bar = 60 μm 37 Edema dan Deskuamasi Epitel Insang Berdasarkan pengamatan, perubahan histopatologi pada organ insang didapatkan 13 sampel ikan lele terjadi edema pada lamela insang dari 17 sampel ikan lele yang diambil. Edema yang terjadi pada insang mulai dari yang ringan sampai yang berat. Enam sampel mengalami edema berat sisanya mengalami edema ringan sampai sedang, sedangkan deskuamasi epitel pada lamela primer dan sekunder ditemukan pada 8 sampel ikan lele dari 17 sampel yang diambil. Deskuamasi yang terjadi mulai dari ringan sampai berat. Edema dan deskuamasi yang berat terjadi jika hampir seluruh lamela sekunder insang mengalami edema dan deskuamasi, sedangkan edema dan deskuamasi ringan terjadi hanya sebahagian kecil lamela sekunder insang yang mengalami edema dan deskuamasi. Edema pada insang disebabkan karena bahan-bahan kimia seperti peptisida dan logam berat, ini berhubungan juga dengan habitat ikan lele yang hidup di air kotor yang kualitasnya buruk, selain itu juga disebabkan oleh eksresi ammonia dari metabolisme pakan dalam bentuk NH3 yang berlebihan dapat mengakibatkan terjadinya peningkatan permeabilitas vaskuler dan bersifat toksik bagi ikan. Menurut Roberts (2001), edema pada lamela diakibatkan karena terpaparnya polusi bahan-bahan kimia diantaranya logam (metal), peptisida, formalin atau hidrogen peroksida dengan dosis yang terlalu tinggi, selain itu juga bisa disebabkan oleh aflatoxikosis nutrisi akut yang dapat menyebabkan edema hebat pada lamela. Kelanjutan dari edema yaitu terlepasnya (deskuamasi) epitel respirasi pada lamela primer dan sekunder dengan nekrosa sel epitel lamela yang hebat, sering bersifat letal akibat kesulitan bernafas dan osmoregulasi. Menurut Underwood (1992), edema juga bisa disebabkan karena inflamasi akut dimana dapat mengakibatkan terjadinya peningkatan permeabilitas vaskuler dalam kaitan dengan separasi (pemisahan) sel endotel di bawah pengaruh bahan kimia. Cairan dengan kandungan protein tinggi keluar dari permeabilitas vena masuk ke jaringan mengalami radang. Terjadinya deskuamasi epitel pada lamela primer dan sekunder merupakan suatu indikasi adanya respon pertahanan insang terhadap infeksi bahan asing seperti bahan-bahan kimia dan ammonia. Gambaran histopatologi memperlihatkan insang yang mengalami edema ditandai dengan merenggangnya epitel lamela sekunder karena berisi cairan edema (Gambar 4). 38 Gambar 4. Edema (panah hitam) dan deskuamasi epitel lamela insang (panah biru). Pewarnaan HE, gambar atas 1 bar = 100 μm dan gambar bawah 1 bar = 40 μm 39 Kongesti dan Hemoragi Kongesti menempati urutan kedua paling banyak dari perubahan histopatologi yang terjadi pada insang yaitu 16 sampel, sedangkan hemoragi lebih sedikit yaitu 6 sampel. Kongesti dan hemoragi yang terjadi pada insang mulai dari yang ringan sampai dengan yang berat. Insang yang mengalami kongesti berat 4 sampel, sedangkan yang mengalami hemoragi yang berat 2 sampel sisanya mengalami kongesti dan hemoragi yang ringan sampai sedang. Kongesti dan hemoragi berat terjadi jika hampir seluruh bagian insang mengalami kongesti dan hemoragi, sedangkan kongesti dan hemoragi ringan terjadi jika sebahagian kecil insang yang mengalami kongesti dan hemoragi. Kongesti dan hemoragi yang terjadi pada insang bisa disebabkan karena migrasi dari serkaria yang merupakan tahap perkembangan dari trematoda digenea. Serkaria yang migrasi akan penetrasi ke epitel insang sehingga terjadi kerusakan pada insang dan diikuti dengan terjadinya hemoragi. Menurut Noga (2000), serkaria yang migrasi dapat menyebabkan hemoragi, nekrosa dan inflamasi di tempat migrasi dari serkaria tersebut. Menurut Camargo dan Martinez (2007), kwalitas air yang buruk akibat dari aktifitas manusia seperti pertanian, industri yang mengandung beranekaragam polutan organik dan inorganik dapat menyebabkan kongesti pada insang. Kasus yang berat menyebabkan lesio pada insang dimana lamela mengalami aneurism (pembengkakan pembuluh darah) dan hemoragi dengan ruptur pada epitel lamela insang. Faktor lain yang dapat menyebabkan terjadinya kongesti pada insang yaitu trauma fisik akibat dari perlakuan pada saat ikan lele dimatikan sebelum di nekropsi. Ikan dimatikan dengan cara memukul pada bagian frontal kepala sehingga menyebabkan terjadinya kongesti pada insang. Kongesti pada insang secara histopatologi ditandai dengan banyaknya eritrosit yang berada di pembuluh darah, sedangkan hemoragi ditandai dengan eritrosit sudah keluar dari pembuluh darah dan berada di jaringan insang (Gambar 5). 40 Gambar 5. Kongesti (panah hitam) dan hemoragi (panah biru). Pewarnaan HE, gambar atas 1 bar = 60 μm dan gambar bawah 1 bar = 40μm 41 Parasit Berdasarkan pengamatan, didapatkan kista dari metaserkaria trematoda digenea di dalam filamen kartilago insang sebanyak 5 sampel dari 17 sampel ikan yang diambil. Infeksi dari metaserkaria trematoda digenea yang membentuk kista mulai dari ringan sampai berat. Satu sampel mengalami infeksi berat, sedangkan empat sampel mengalami infeksi ringan sampai sedang. Infeksi yang berat terjadi jika kista dari metaserkaria trematoda digenea banyak ditemukan di dalam filamen kartilago insang, sedangkan infeksi yang ringan terjadi jika kista dari metaserkaria trematoda digenea sedikit ditemukan di dalam filamen kartilago insang. Menurut Woo (2001), kista dari metaserkaria trematoda digenea terdapat di dalam filamen kartilago insang diselimuti oleh kapsul sel kartilagenous akibat dari penetrasi (penembusan) serkaria pada filamen insang dan kista di jaringan konektif yang berdekatan dengan lapisan kartilago. Kista dari metaserkaria trematoda digenea dapat menginduksi poliferasi kondroblas dari perikondrium dan metaserkaria membentuk kapsul (hari ke-7 post-infeksi) terdapat di dalam perpanjangan filamen kartilago insang. Infeksi dari metaserkaria trematoda digenea yang membentuk kista juga menginduksi hiperplasia epitel, penebalan filamen insang, memendek ketika terjadi infeksi berat dan kadang-kadang terjadi hemoragi. Proliferasi kartilago insang menyebabkan filamen insang membesar dari diameter normal dan terjadi fusi (peleburan) filamen serta rusaknya morfologi insang normal (Gambar 6). Infeksi yang berat pada insang mengakibatkan penurunan efisiensi respirasi. 42 Gambar 6. Kista dari metaserkaria trematoda digenea di dalam filamen kartilago insang (panah biru). Pewarnaan HE, gambar atas 1 bar = 100 μm dan gambar bawah 1 bar = 60 μm 43 Proliferasi Sel Goblet Berdasarkan pengamatan, didapatkan 10 sampel dari 17 sampel ikan lele yang diambil mengalami proliferasi sel goblet. Proliferasi sel goblet terjadi mulai dari rendah sampai tinggi. Tiga sampel mengalami proliferasi sel goblet yang tinggi dan sisanya rendah sampai sedang. Proliferasi sel goblet tinggi terjadi jika jumlah sel goblet insang meningkat secara signifikan, sedangkan proliferasi sel goblet rendah terjadi jika jumlah sel goblet yang meningkat hanya sedikit dan tidak begitu signifikan. Proliferasi sel goblet pada insang yang ditandai dengan meningkatnya jumlah sel goblet insang (Gambar 7) disebabkan karena respon terhadap adanya kista dari metaserkaria trematoda digenea. Ini terlihat pada insang ditemukan kista dari metaserkaria trematoda digenea di dalam filmen kartilago insang, selain itu juga proliferasi sel goblet bisa disebabkan karena terpapar bahan kimia organik (pestisida dan deterjen) serta ammonia. Menurut Hoole et al. (2001), jumlah selsel mukus juga meningkat akibat respon atas infeksi atau peradangan parasit dan kualitas air yang buruk. Sel-sel mukus membebaskan material mukusnya ke permukaan epitel untuk melindungi jaringan insang. Irianto (2005) menambahkan, sel goblet merupakan sejumlah sel-sel tunggal berbentuk buah pear atau oval dan menghasilkan mukus dan terdapat pada lengkung insang, filamen insang maupun lamela sekunder. Mukus merupakan glikoprotein yang bersifat basa atau netral dengan fungsi pelindungan atau proteksi serta anti patogen. Proliferasi sel goblet yang terjadi pada insang merupakan mekanisme pertahanan dari selaput lendir insang pada ikan yang terinfeksi akibat respon dari adanya parasit dan bahan asing seperti bahan-bahan kimia organik. Menurut Tiuria et al. (2000), mukus yang dihasilkan oleh sel goblet bersifat protektif bagi inang dengan cara mempengaruhi pengeluaran atau penjeratan cacing dan bahan asing serta menghalangi kontak langsung dengan mukosa insang. Mukus juga memiliki kemampuan menghambat kolonisasi mikroorganisme pada insang. Mukus mengandung imunoglobulin (IgM) yang dapat menghancurkan patogen yang menginvasi. Hal ini menandakan bahwa tubuh ikan berusaha mengeluarkan apapun bentuk dari suatu antigen atau bahan asing dari dalam tubuh sehingga bisa terbebas dari bahan asing tersebut. 44 Gambar 7. Proliferasi sel goblet pada insang (panah biru). Pewarnaan HE, 1 bar = 40 μm Kerusakan Tulang Rawan (Kartilago) Insang Hasil pengamatan histopatologi yang didapat yaitu 8 sampel mengalami kerusakan tulang rawan pada insang dari 17 sampel ikan lele yang diambil. Lima diantaranya terdapat kista dari metaserkaria trematoda digenea di dalam filamen kartilago insang. Kerusakan tulang rawan insang bisa disebabkan karena infeksi dari metaserkaria trematoda digenea yang membentuk kista di dalam filamen kartilago insang. Kista dari metaserkaria trematoda digenea yang terdapat di dalam filamen kartilago insang diselimuti oleh kapsul sel kartilagenous. Menurut Olson dan Pierce (1997), kista dari metaserkaria trematoda digenea menstimuli terjadinya proliferasi kartilago dari perikondrium sehingga filamen kartilago insang membesar dari diameter normal dan dapat merusak morfologi normal dari insang serta diikuti dengan fusi pada filamen insang (Gambar 8). Infeksi yang berat pada ikan menyebabkan berkurangnya permukaan respirasi pada insang. 45 Gambar 8. Kerusakan tulang rawan insang (panah biru). Pewarnaan HE, gambar atas 1 bar = 100 μm dan gambar bawah 1 bar = 60 μm 2. Usus Berdasarkan pengamatan, perubahan histopatologi yang ditemui pada organ usus adalah proliferasi sel goblet dan kongesti pada 10 sampel, berikutnya 46 diikuti oleh deskuamasi sel epitel usus 8 sampel, infeksi parasit 5 sampel dan yang paling sedikit yaitu hemoragi 3 sampel (Gambar 9). 10 8 J umlah (Ekor) 58,82% 58,82% 47,06% 6 4 Kongesti Hemoragi 29,41% 17,65% 2 0 Perubahan Histopatologi 3 1 5 8 Deskuamasi epitel Proliferasi sel goblet Parasit Gambar 9. Frekuensi lesion histopatologi organ usus ikan Lele (Clarias spp.) Proliferasi Sel Goblet Proliferasi sel goblet merupakan perubahan histopatologi yang paling banyak di temukan di organ usus ikan lele bersama dengan kongesti yaitu sebanyak 10 sampel dari 17 sampel ikan lele yang diambil. Proliferasi sel goblet pada usus mulai dari rendah sampai dengan tinggi. Proliferasi sel goblet yang tinggi yaitu 4 sampel, sisanya mulai dari rendah sampai sedang. Proliferasi sel goblet tinggi terjadi jika jumlah sel goblet usus meningkat secara signifikan, sedangkan proliferasi sel goblet ringan terjadi jika jumlah sel goblet yang meningkat hanya sedikit dan tidak begitu signifikan. 47 Tabel 1. Jumlah Sel Goblet pada Usus Ikan Lele (Clarias spp.) Sampel (lele) Jumlah sel goblet 1 70 2 132 3 131 4 101 5 97 6 108 7 136 8 92 9 80 10 147 11 158 12 104 13 82 14 197 15 60 16 83 17 109 Pada tabel 1 dapat dilihat bahwa 5 lele dengan jumlah sel gobletnya lebih banyak dari yang lain, ini menunjukkan bahwa kelima lele mengalami proliferasi sel goblet yang tinggi pada usus. Proliferasi sel goblet pada usus yang ditandai dengan meningkatnya jumlah sel goblet usus (Gambar 10) bisa disebabkan karena infeksi cacing trematoda digenea. Kebanyakan cacing trematoda digenea dewasa berada di dalam usus inang definitif (ikan, beruang dan mamalia) untuk menghasilkan telur. Cacing trematoda digenea menstimulasi respon pertahanan selaput lendir usus ikan terinfeksi yang dibuktikan dengan terjadinya proliferasi sel goblet. Menurut Tiuria et al. (2000), mukus yang dihasilkan sel goblet bersifat protektif dan anti patogen bagi inang dengan cara mempengaruhi pengeluaran atau penjeratan cacing, menghalangi kontak langsung dengan mukosa sehingga mencegah establishment bagi cacing. Mukus juga memiliki kemampuan 48 menghambat kolonisasi mikroorganisme pada mukosa usus. Mukus mengandung imunoglobulin (IgM) yang dapat menghancurkan patogen yang menginvasi. Ini merupakan mekanisme pertahanan usus untuk mengeluaran suatu antigen atau bahan asing dari dalam tubuh sehingga bisa terbebas dari bahan asing tersebut. Gambar 10. Proliferasi sel goblet pada usus (panah biru). Pewarnaan HE, gambar atas 1 bar = 100 μm dan gambar bawah 1 bar = 40 μm 49 Gambar 11. Kongesti (panah biru), hemoragi (panah hitam) pada usus gambar atas dan deskuamasi epitel usus (panah biru) gambar bawah. Pewarnaan HE, 1 bar = 40 μm Kongesti dan Hemoragi Kongesti merupakan perubahan histopatologi yang paling banyak ditemui pada organ usus bersama dengan proliferasi sel goblet yaitu 10 sampel, sedangkan 50 hemoragi paling sedikit ditemui yaitu pada 3 sampel. Kongesti yang terjadi mulai dari yang ringan sampai sedang, sedangkan hemoragi terjadi mulai dari yang ringan sampai berat. Satu sampel mengalami hemoragi yang berat dan yang lainnya mengalami hemoragi ringan sampai sedang. Kongesti dan hemoragi berat terjadi jika hampir seluruh bagian usus mengalami kongesti dan hemoragi, sedangkan kongesti dan hemoragi ringan terjadi jika sebahagian kecil usus yang mengalami kongesti dan hemoragi. Hemoragi yang terjadi pada usus bisa disebabkan oleh masuknya bahan atau benda asing bersama makanan yang dapat menyebabkan lesio di usus dan terjadinya hemoragi. Menurut Irianto (2005), Eimeria yang menginfeksi ikan juga bisa menyebabkan borok, hemoragi pada saluran pencernaan. Infeksi berat yang ditandai dengan banyaknya cacing dewasa dari trematoda digenea di dalam usus dapat menyebabkan terjadinya kongesti akibat dari tertekannya pembuluh darah di usus oleh cacing dewasa trematoda digenea. Kongesti pada usus secara histopatologi ditandai dengan banyaknya eritrosit yang berada di pembuluh darah, sedangkan hemoragi ditandai dengan eritrosit sudah keluar dari pembuluh darah dan berada di jaringan usus (Gambar 11). Deskuamasi Epitel Usus Hasil pengamatan histopatologi yang didapat yaitu 8 sampel terjadi deskuamasi epitel usus. Deskuamasi epitel yang terjadi mulai dari yang ringan sampai sedang. Deskuamasi epitel sedang jika deskuamasi yang terjadi pada usus lebih banyak dibandingkan deskuamasi ringan tetapi tidak sebanyak deskuamasi yang berat, sedangkan deskuamasi epitel ringan terjadi jika hanya disebahagian kecil usus yang mengalami deskuamasi epitel. Deskuamasi epitel usus disebabkan karena infeksi dari parasit. Beberapa parasit mengambil makanan dari induk semangnya dengan cara menempel di vili usus sehingga menyebabkan kerusakan vili usus. Salah satunya yaitu cacing trematoda digenea, cacing ini mempunyai batil hisap yang berfungsi untuk menempel di vili usus yang dapat merusak epitel usus sehingga terjadi deskuamasi. Deskuamasi epitel merupakan suatu indikasi adanya respon pertahanan usus terhadap infeksi parasit (Gambar 11). 51 Gambar 12. Perasit pada epitel usus (panah merah) dan infiltrasi sel-sel radang (panah biru). Pewarnaan HE, gambar atas 1 bar = 100 μm dan gambar bawah 1 bar = 40 μm Parasit Hasil pengamatan histopatologi yang dilakukan pada organ usus didapat infeksi dari parasit sejenis protozoa pada 5 sampel. Tingkat infeksinya mulai dari 52 ringan sampai berat. Satu sampel mengalami infeksi berat sisanya ringan sampai sedang. Parasit menginfeksi epitel usus membentuk sarang-sarang bergranul merah. Gambaran histopatologi memperlihatkan bahwa disekitar sarang-sarang parasit ditemukan infiltrasi sel-sel radang yang merupakan respon pertahanan tubuh terhadap infeksi parasit (Gambar 12). Parasit ini belum teridentifikasi dengan pasti, kemungkinan oocysta yang bersporulasi dari Eimeria yang menyebabkan coccidiosis pada ikan. Menurut Philbey dan Ingram (1991), coccidia di usus berada di mukosa lamina epitelia dan lamina propria. Biasanya disekitar sarang dari coccidia diinfiltrasi oleh sel-sel radang pada bagian lamina propria. Menurut Woo (2006), Eimeria ditemukan di usus ikan umumnya menginfeksi epitel usus. Oocysta dari ikan yang terinfeksi coccidia akan bersporulasi ketika hidup di tubuh ikan, infeksi yang berat menyebabkan letargi dan penurunan berat badan ikan. 3. Otot Berdasarkan pengamatan yang dilakukan, perubahan histopatologi yang ditemui pada organ otot adalah degenerasi otot sampai nekrosa 13 sampel diikuti edema dan deskuamasi epitel 8 sampel serta infeksi oleh parasit 4 sampel (Gambar 13). J umlah (Ekor) 14 12 10 8 6 4 2 0 Degenerasi otot 76,47% 47,06% 47,06% Deskuamasi epitel 23,53% Edema Parasit Perubahan Histopatologi 4 1 8 Gambar 13. Frekuensi lesio histopatologi organ otot ikan Lele (Clarias spp.) 53 Degenerasi Otot Sampai Nekrosa Degenerasi otot sampai nekrosa merupakan perubahan histopatologi yang paling banyak di temukan di organ otot ikan lele yaitu 13 sampel. Degenerasi otot yang terjadi berupa degenerasi hialin, selain itu juga ditemukan nekrosa pada otot. Degenerasi otot disebabkan karena faktor defisiensi nutrisi terutama defisiensi vitamin E. Menurut Roberts (2001), perubahan patologi akibat dari defisiensi vitamin E yaitu terjadinya perubahan temperatur akibat respon patologi yang hebat, degenerasi hialin pada otot, infiltrasi lemak subepikardial dan proliferasi fibroblas. Menurut Takashima dan Hibiya (1995), degenerasi hialin merupakan perubahan yang mengikuti cloudy swelling dan disebut juga nekrosis koagulasi. Nukleus kromatin berkondensasi dan menyebabkan lurik pada serabut otot menghilang. Serabut memperlihatkan suatu penampilan yang homogen dan efektif terhadap pewarnaan eosin (Gambar 14). Serabut-serabut yang terhialinasi menjadi lebih rapuh dibandingkan serabut-serabut yang tetap utuh, jika degenerasi hialin yang hanya terjadi pada sebagian dari serabut otot menyebabkan nukleus dekat dengan batas bagian yang terhialinasi dan bagian yang tetap utuh sering kali mengalami hiperplasia. Beberapa serabut otot yang telihat normal di dekat serabut-serabut yang terpengaruh hialinasi sering memperlihatkan pemisahan longitudinal yang frekuen. Perubahan-perubahan lisis terjadi dalam jaringan yang nekrotik dapat melibatkan sitoplasma sel (Gambar 14), tetapi perubahan paling jelas terlihat pada inti. Pengaruh nekrosis mengakibatkan hilangnya fungsi pada daerah yang nekrosa. Pada beberapa keadaan daerah nekrotik dapat menjadi fokus infeksi yang merupakan medium pembiakan yang sangat baik bagi pertumbuhan organisme tertentu yang kemudian dapat menyebar ke tempat lain di dalam tubuh, bahkan tanpa infeksipun adanya jaringan nekrosa di dalam tubuh dapat memicu perubahan sistemik tertentu misalnya peningkatan jumlah leukosit di dalam sirkulasi. Jaringan yang mengalami nekrosis dapat menginduksi respon peradangan dari jaringan yang berdekatan. Jaringan yang nekrosa akan hancur dan hilang memberi jalan bagi proses perbaikan yang mengganti daerah nekrotik 54 dengan sel-sel yang beregenerasi, pada beberapa keadaan dengan terbentuknya jaringan parut (Price dan Wilson 2006). Gambar 14. Degenerasi hialin (panah hitam) gambar atas, edema (panah biru) dan nekrosa pada otot (panah hijau) gambar bawah. Pewarnaan HE, gambar atas 1 bar = 100 μm dan gambar bawah 1 bar = 40μm 55 Edema Hasil pengamatan histopatologi yang didapat yaitu 8 sampel terjadi edema pada organ otot. Menurut Guyton dan Hall (1996), edema pada otot disebabkan karena depresi sistem metabolik, inflamasi dan tidak adanya nutrisi untuk sel, contohnya jika aliran darah ke jaringan menurun sehingga pengiriman oksigen dan nutrien berkurang mengakibatkan pompa ion membran sel menjadi tertekan maka ion natrium yang biasanya masuk ke dalam sel tidak dapat lagi dipompa keluar sel. Gambaran histopatologi memperlihatkan bahwa otot yang mengalami edema terlihat serabut-serabut otot menjadi merenggang dan diisi oleh cairan edema (Gambar 14). Menurut Gavin dan Zachary (2007), edema juga dapat terjadi pada jaringan yang mengalami peradangan atau stimuli imunologi. Peradangan atau stimuli imunologi menginduksi terjadinya vasodilatasi dan peningkatan permeabilitas mikrovaskuler. Peningkatan permeabilitas diinduksi oleh mediator diantaranya histamin, bradikinin, leukotrienes dan substan P, dimana mediator ini dapat menyebabkan sel endotel kontraksi dan celah interendotel melebar sehingga cairan dengan kandungan protein tinggi keluar dari celah interendotel masuk ke jaringan yang mengalami peradangan. Price dan Wilson (2006) menambahkan, peningkatan tekanan hidrostatik cenderung memaksa cairan masuk ke dalam ruang interstisial tubuh sehingga dengan alasan ini kongesti dan edema cenderung terjadi secara bersamaan. Faktor lain yang dapat mengakibatkan terjadinya edema adalah penurunan tekanan osmotik intravaskuler. Keseimbangan cairan bergantung pada sifat-sifat osmotik protein serum, jika terjadi penurunan konsentrasi protein dapat mengakibatkan edema. Edema dapat menyebabkan pembengkakan pada jaringan yang mengalami peradangan karena terjadi akumulasi dari cairan. Deskuamasi Epitel Integumen Perubahan histopatologi yang ditemukan di bagian integumen (kulit) yaitu deskuamasi epitel pada 8 sampel. Deskuamasi epitel pada integumen disebabkan karena trauma fisik maupun akibat infeksi parasit yang mengakibatkan kerusakan epitel sehingga terjadi perlepasan epitel (deskuamasi) dan nekrosa sel epitel (Gambar 15). Ini dibuktikan pada saat sebelum nekropsi pada bagian kulit terjadi 56 perlukaan. Kerusakan epitel kulit dapat diikuti dengan infeksi sekunder oleh bakteri. Menurut Irianto (2005), kulit merupakan penghalang fisik terhadap lingkungan serta patogen dari luar tubuh, jika terjadi kerusakan pada kulit patogen akan dengan mudah masuk dan menginfeksi ikan. Gambar 15. Deskuamasi epitel pada integumen (panah biru). Pewarnaan HE, 1 bar = 40 μm Parasit Hasil pengamatan histopatologi yang dilakukan pada organ otot didapat infeksi dari parasit sebanyak 4 sampel. Parasit ini sejenis protozoa yang menginfeksi diantara serabut otot dan di permukaan integumen (Gambar 16). Tingkat infeksinya masih tergolong ringan hanya di sebahagian kecil dari otot maupun integumen. Parasit ini belum teridentifikasi dengan pasti, kemungkinan Epistylis yang bersifat parasit obligat dan hampir tidak spesifik terhadap ikan sebagai induk semang definitif. Menurut Kabata (1985), secara individual mereka hidup di dekat luka atau kerusakan lainnya di daerah kulit. Epistylis menyebabkan iritasi kulit, menekan sel epitel yang diserangnya sehingga dapat terjadi kelainan bentuk dan gangguan fungsi dari epitel. 57 Gambar 16. Parasit di permukaan integumen (panah biru) gambar atas dan parasit di otot (panah biru) gambar bawah. Pewarnaan HE, 1 bar = 20 μm 58 BAB V KESIMPULAN DAN SARAN 5.1 Kesimpulan Perubahan histopatologi yang ditemukan pada organ insang ikan lele (Clarias spp.) adalah hiperplasia lamela sekunder, kongesti, edema, proliferasi sel goblet, deskuamasi epitel insang, kerusakan tulang rawan, hemoragi dan kista dari metaserkaria trematoda digenea. Perubahan histopatologi pada organ usus adalah proliferasi sel goblet, kongesti, deskuamasi epitel usus, infeksi parasit dan hemoragi, sedangkan perubahan histopatologi pada organ otot adalah degenerasi otot sampai nekrosa, edema, deskuamasi epitel integumen dan infeksi oleh parasit. 5.2 Saran Diperlukan perhatian terhadap kualitas air yang baik untuk habitat ikan lele (Clarias spp.) agar tidak tercemar oleh bahan-bahan kimia maupun logam berat. Diperlukan pemeriksaan air tempat habitat ikan lele untuk memastikan apakah air tempat habitat ikan lele tercemar bahan-bahan kimia dan logam berat. Perlunya penelitian lanjutan dengan melakukan perlakuan khusus agar penyebab dari perubahan histopatologi akibat dari suatu penyakit atau infeksi dapat diketahui dengan pasti. Jumlah dan lokasi penelitian perlu diperbanyak agar didapat data yang lebih banyak dan mewakili untuk daerah Bogor. Kista dari meteserkaria beberapa trematoda digenea merupakan zoonosis sehingga perlu memasak ikan lele dengan baik atau sempurna. 59 DAFTAR PUSTAKA Anonim. 1992. Pedoman Teknis Pembenihan Ikan Lele (Clarias batrachus). Badan Penelitian dan Pengembangan Pertanian. Pusat Penelitian dan Pengembangan Perikanan, Departemen Pertanian. Boyd, C E. 1991. Water Quality Management and Aeration in Shrimp Farming. Proyek Penelitian dan Pengembangan Perikanan, Pusat Penelitian dan Pengembangan Perikanan, Jakarta. Camargo, M M P dan Martinez C B R. 2007. Histopathology of Gill, Kidney and Liver of A Neotropical Fish Caged in An Urban Stream. Neotropical Ichthyology 5 (3) : 327-336. Dana, D dan Angka S L. 1990. Masalah Penyakit Parasit dan Bakteri pada Ikan Air Tawar Serta Cara Penanggulangannya. Prosiding Seminar Nasional II Penyakit Ikan dan Udang. Badan Penelitian dan Pengembangan Pertanian, Bogor. Flynn, R J. 1973. Parasit of Laboratory Animals. The Iowa State University Press/Ames, USA. Gavin, M D dan Zachary J F. 2007. Pathologic Basis Veterinary Disease. Mosby Elsevier, USA. Guyton, A C dan Hall J E. 1996. Fisiologi Kedokteran. Edisi IX. EGC, Philadelphia. Hariyadi, P. 2006. Inventarisasi Parasit Lele Dumbo Clarias sp di daerah Bogor [skripsi]. Bogor : Fakultas Perikanan dan Ilmu Kelautan, IPB. Hoole et al.. 2001. Disease of Carp and Other Cyprinid Fishes. Fishing New Books, Oxford. Irianto, A. 2005. Patologi Ikan Teleostei. Gajah Mada University Press, Yogyakarta. 243 hal. Janquiera, L C et al..1971. Basic Histology. Second Edition. Lange Medical Publication, California. 468 hal. Kabata, Z. 1985. Parasites and Disease of Fish Cultured in the Tropics. Taylor and Francis, London and Philadelphia. 318 hal. 60 Leatherland, J F. 1998. Fish Diseases and Disorders. Volume 2 : Non-Infectious Disorders. CABI Publishing, USA. 386 hal. Nabib, R dan Pasaribu F H. 1989. Patologi dan Penyakit Ikan. Bogor. Departemen Pendidikan dan Kebudayaan, Bogor. 158 hal. Noga, E J. 2000. Fish Disease Diagnosis and Treatment. Iowa State Press, USA. 366 hal. Olson, R E dan Pierce J R. 1997. A Trematoda Metacercaria Causing Gill Cartilage Proliferation in Steelhead Trout from Oregon. Journal of Wildlife 33 (4) : 886-890. Philbey, W dan Ingram A. 1991. Coccidiosis due to Goussia lomi (Protista: Apicomplexa) in Aquarium-reared Murray cod, Maccullochela peeli (Mitchell), (Percichthyide). Journal of Fish Disease 14 : 237-242. Price, S A dan Wilson L M. 2006. Patofisiologi. Edisi VI. Volume I. EGC, Philadelphia. Roberts, R J. 2001. Fish Pathology. Third Edition. W.B.Saunders, London, Edinburgh, Philadelphia, St Louis, Sydney, Toronto. 472 hal. Saanin, H. 1984. Taksonomi dan Kunci Identifiksi Ikan. Bina Cipta, Jakarta. Smith, H A dan Jones T C. 1961. Veterinary Pathology. Lea & Febiger, Philadelpia. Soetomo, M H A. 1987. Teknik Budidaya Ikan Lele Dumbo. Sinar Biru, Bandung. 109 hal. Spector, W G. 1993. Pengantar Patologi Umum. Edisi III. Gadjah Mada University Press, Yogyakarta. Supriyadi, H et al.. 1986. Parasit pada Ikan Lele di Jawa Barat (Clarias sp.). Buletin Penelitian Perikanan darat. Vol. 5., Bogor. Suyanto, S R. 1986. Budidaya Ikan Lele. Cetakan IV. Penebar Swadaya, Jakarta. Takashima, F dan Hibiya T. 1995. An Atlas of Fish Histology Normal and Pathological Features. Edisi II. Kodansha Ltd, Tokyo. 195 hal. Tiuria, R et al.. 2000. Pengaruh Infeksi Cacing Ascaridia Galli Terhadap Respon Sel Goblet dan Sel Mast pada Usus Halus Ayam Petelur. Majalah Parasitologi Indonesia 13. 61 Underwood, J C E. 1992. General and Systematic Pathology. Churchill Livingstone, New York. Woo, P T K. 2006. Fish Diseases and Disorders. Volume 1 : Protozoa and Metazoa Infections. Second Edition. CABI Publishing, USA. 62 Lampiran 1 Pembuatan Sediaan Histopatologi Sampling Organ ↓ Fiksasi ↓ Dehidrasi (proses penarikan air dari jaringan) alkohol 70%, 80%,90%,95%,95% alkohol absolut I, alkohol absolut II : masing-masimg 2 jam ↓ Clearing Silol, silol II masing-masing 2 jam ↓ Embedding (penanaman jaringan dalam paraffin) ↓ Sectioning (pemotongan) Menggunakan mikrotom setebal 5 μm ↓ Mounting (penempelan sediaan pada gelas objek) ↓ Staining (pewarnaan) 63 Lampiran 2 Pewarnaan Hematoksilin Eosin (HE) Xylol I : 2 menit ↓ Xylol II : 2 menit ↓ Alkohol absolute : 2 menit ↓ Alkohol 95% : 1 menit ↓ Alkohol 85% : 1 menit ↓ Cuci dengan air kran : 1 menit ↓ Mayer’s Haematoxylin : 8 menit ↓ Cuci dengan air kran : 30 detik ↓ Lithium carbonat : 15-30 detik ↓ Cuci dengan air kran : 2 menit ↓ Eosin : 2-3 menit ↓ Cuci dengan air kran : 30-60 menit ↓ Alkohol 95% : 10 celupan ↓ Alkohol absolute I : 10 celupan ↓ Alkohol absolute I : 2 menit ↓ Xylol I : 1 menit ↓ Xylol II : 2 menit ↓ Tutup dengan gelas penutup 64