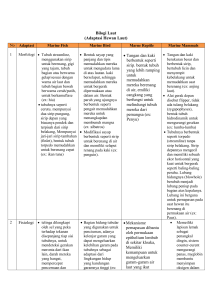
karakteristik fisika kimia perairan dan kaitannya dengan
advertisement

KARAKTERISTIK FISIKA KIMIA PERAIRAN DAN KAITANNYA DENGAN DISTRIBUSI SERTA KELIMPAHAN LARVA IKAN DI TELUK PALABUHAN RATU NURMILA ANWAR SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR BOGOR 2008 i PERNYATAANMENGENAI TESIS DAN SUMBER INFORMASI Dengan ini saya menyatakan bahwa tesis dengan judul: KARAKTERISTIK FISIKA KIMIA PERAIRAN DAN KAITANNYA DENGAN DISTRIBUSI SERTA KELIMPAHAN LARVA IKAN DI TELUK PALABUHAN RATU adalah karya saya sendiri di bawah komisi pembimbing, kecuali dengan jelas ditujukan rujukannya. Tesis ini belum pernah diajukan untuk memperoleh gelar pada program sejenis dari perguruan tinggi mana pun. Semua sumber data dan informasi yang digunakan telah dinyatakan dengan jelas dan dapat diperiksa kebenarannya. Bogor, September 2008 Nurmila Anwar NRP: C551060081 ii ABSTRACT NURMILA ANWAR. Characteristic of Chemical Physics of Territorial Water and Bearing with Distribution and also Abundance of Larva of Fish Bay of Palabuhan Ratu under Direction of DJISMAN MANURUNG and M. MUKHLIS KAMAL. Three cruises were conducted in the shallow embayment, and six cruises for distribution ini sentral Bay of Palabuhan Ratu, west Java to study abundance and caracterisation of chemical physics of territorial water bearing of the early stages of fish (fish larva) during six month the late summer reproductive season (west season and transition period). Result of subdividing character of chemical physics of territorial water from each station yield three group of habitat that is: estuary, transition and oseanic. High densities of recently post larvae and preflexion larvae were observed during November 2007- April 2008 in estuary. The dominant species for example from family: Congridae, Gobiidae, Elopidae, Mugilidae, Pomatomidae, Siganidae, Alepochepalidae, Chelodactylidae and Lutjanidae. Habitat of estuary found by species: Congridae, Siganus Spp., Liza Spp. later;then Elopsaurus, Mugil Sp, Gobidae, Xenodermicthys, Siganus spinus and Ostracion with overflows than 12-14 ind/m3 with entirety of mean per month more than 13 ind/m3. Stadia of Larva which is at most obtained by post of larva and juvenile. Species found in habitat of transition is equal to habitat of estuary is only differentiated by storey;level of density and what overflows. level of stadia even also still at gyration of prolarva and post of larva although there are some species of growth of stadianya have reached phase juvenile. composition of Species found in habitat of oseanic differ from habitat of estuary and transition because most species of exist in oseanic have the character of high stenohaline, some spesies found by a estuary species (eurihaline). For example Xenodermicthys, Siganus Spinus, Kuhlia marginata, Signoglassidae, Ambassis marianus; Nemadactylus macropterus, Leiognathus Sp, Siganus linneatus. In general the overall of station of oseanic more amount got by species of Apogonops anomalus, Pocicthidae, Kyphosus Sp, Bregmacerotidae, Aseraggodes Sp, and Urolophus sp. density and overflows in oseanic habitat much more a few compared to estuary and transition and than stadia most still yolk sac larvae and prolarva. In four of some cruises, larval size distribution moved progressively to larger larvae (By spasial); however, small-size, recently hatched larvae were low in the last cruise. The change in larval size coincided with intrusion of nutrient in the Bay as a result of current forcing and wave events. And by temporal the mean of a coastal station showed also presence of larval hake during month period and extremely high abundance of preflexion larvae in Februari, March and April 2008. The overall results from this study suggest that the Bay of Palabuhan Ratu is used by all fish spesies as a spawning and nursery area at the end of the west season season when environmental characteristics, such as food availability and nearshore retention are favourable for larval survival and for distribution in deep enveroment. Keyword: Larvae, Ichtyoplankton, Bay of Palabuhan Ratu, Distribution and abundance, Estuary, transition and oceanic habitat. iii RINGKASAN NURMILA ANWAR. Karakteristik Fisika Kimia Perairan dan Kaitannya dengan Distribusi serta Kelimpahan Larva Ikan di Teluk Palabuhan Ratu Dibimbing oleh: DJISMAN MANURUNG sebagai Ketua dan M. MUKHLIS KAMAL sebagai Anggota Komisi Pembimbing. `Pemahaman tentang biologi ikan sangatlah penting dimulai dengan pengetahuan yang baik tentang perkembangan awal daur hidup ikan, baik ekologi maupun kehidupannya. Pentingnya aspek ini karena mempunyai keterkaitan dengan fluktuasi ikan, bahkan kelangsungan hidup dari spesies itu sendiri. Seperti diketahui pada tahap awal daur hidup ikan mempunyai mortalitas yang tinggi karena kepekaan terhadap predator, ketersediaan makanan, dan juga perubahan lingkungan yang terjadi di alam (critical period). Kondisi perairan sangat menentukan kelimpahan dan penyebaran organisme di dalamnya, akan tetapi setiap organisme memiliki kebutuhan dan preferensi lingkungan yang berbeda untuk hidup yang terkait dengan karakteristik lingkungannya. Penelitian ini bertujuan mengetahui kaitan antara karakter habitat dengan distribusi larva yang didasarkan pada parameter fisika kimia perairan dan pola distribusi larva ikan secara spasial dan temporal di perairan Teluk Palabuhan Ratu. Dengan penelitian ini, akan diketahui sejauh mana kondisi ekologis larva ikan di Teluk Palabuhan Ratu. Pengumpulan data dilakukan dengan menyisir kolom perairan secara horizontal, pada 9 stasiun yang disebar berturut turut dari muara ke tengah teluk, menggunakan net larva 350-500 mikron. Parameter yang diukur untuk melihat keterkaitan fisika-kimia perairan dengan kelimpahan larva antara lain arus, gelombang, salinitas, pH, DO dan unsur nutrien penting yaitu: nitrat fosfat dan silika untuk melihat produktivitasnya. Data diolah dengan mengelompokkan stasiun yang sama tingkatan ciri fisik-kimianya melalui indeks similaritas. Didapatkan tiga kelompok habitat hasil pengelompokan stasiun yaitu habitat muara, transisi dan laut lepas. Hasil perolehan komposisi jenis, kelimpahan, kepadatan, dominansi dan stadia larva disubsitusikan kedalam masing masing kelompoknya untuk melihat distribusi spasial dan temporal masing-masing larva dihabitatnya. Habitat muara ditemukan spesies: Congridae, Siganus spp., Liza spp. kemudian Elopsaurus, Mugil sp, Gobidae Xenodermicthys, Siganus spinus dan Ostracion dengan kelimpahan 12-14 ind/m3 dengan keseluruhan rata-rata setiap bulannya lebih dari 13 ind/m3. Stadia larva yang paling banyak diperoleh adalah post larva dan juwana. Spesies yang ditemukan di habitat transisi sama dengan habitat muara hanya dibedakan oleh tingkat kepadatan dan kelimpahan. Tingkatan stadianya pun masih pada kisaran prolarva dan post larva walaupun terdapat beberapa spesies perkembangan stadianya telah mencapai fase juwana. Komposisi spesies yang ditemukan di habitat laut lepas berbeda dengan habitat muara dan transisi karena kebanyakan spesies yang ada di laut lepas bersifat stenohaline tinggi, beberapa diataranya ditemukan spesies muara (eurihaline). Antara lain Xenodermicthys, Siganus spinus, Kuhlia marginata, Signoglassidae, Ambassis marianus; Nemadactylus macropterus, Leiognathus sp, Siganus linneatus. Secara umum dikeseluruhan stasiun laut lepas lebih banyak didapatkan spesies Apogonops anomalus, Pocicthidae, Kyphosus sp, Bregmacerotidae, Aseraggodes sp, dan urolophus sp. Kepadatan dan kelimpahan di habitat laut lepas jauh lebih sedikit dibanding muara dan transisi dan stadia larvanyapun kebanyakan masih yolk sac larvae dan prolarva. iv Berdasarkan hasil analisis regresi antara kelimpahan dan faktor oseanografi untuk keseluruhan bulan pengamatan hampir seluruhnya menunjukkan angka signifikan atau memiliki keterkaitan. Demikian pula dengan hubungan kelimpahan dengan nutrien menunjukkan hubungan korelasi yang besar kecuali nitrat dibeberapa bulan pengamatan menunjukkan nilai korelasi yang kecil, atau cenderung berkorelasi negatif. Secara keseluruhan menunjukkan bahwa nutrien dan arus memegang peranan besar dalam transport dan distribusi larva secara spasial. Kata kunci: Larva, Ichtyoplankton, Teluk Palabuhan Ratu, Distribusi dan kelimpahan, habitat muara, habitat transisi dan habitat laut lepas. v © Hak Cipta milik Institut Pertanian Bogor, tahun 2008 Hak Cipta dilindungi Undang-undang Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; pengutipan tersebut tidak merugikan kepentingan yang wajar IPB. Dilarang mengumumkan dan memperbanyak sebagian atau seluruhnya dalam bentuk apapun, baik cetak, fotokopi, microfilm dan sebagainya tanpa izin tertulis dari Institut Pertanian Bogor, vi KARAKTERISTIK FISIKA KIMIA PERAIRAN DAN KAITANNYA DENGAN DISTRIBUSI SERTA KELIMPAHAN LARVA IKAN DI TELUK PALABUHAN RATU NURMILA ANWAR TESIS Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Ilmu Kelautan SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR BOGOR 2008 vii Penguji Luar Komisi pada Ujian Tesis: Dr. Ir. Ridwan Affandi, DEA. viii Judul Tesis : Karakteristik Fisika Kimia Perairan dan Kaitannya dengan Distribusi serta Kelimpahan Larva Ikan di Teluk Palabuhan Ratu Nama : Nurmila Anwar NRP : C551060081 Disetujui Komisi Pembimbing Dr. Ir. Djisman Manurung,M.Sc. Ketua Dr.Ir. M.Mukhlis Kamal, M.Sc Anggota Diketahui Ketua Program Studi Ilmu Kelautan Dekan Sekolah Pascasarjana Dr. Ir. Djisman Manurung,M.Sc. Prof.Dr. Ir. Khairil A. Notodiputro, M.S. Tanggal Ujian : 1 September 2008 Tanggal Lulus : ix Dan Dia-lah, Allah yang menundukkan lautan (untukmu), agar kamu dapat memakan daripadanya daging yang segar (ikan), dan kamu mengeluarkan dari lautan itu perhiasan yang kamu pakai; dan kamu melihat bahtera berlayar padanya, dan supaya kamu mencari (keuntungan) dari karunia-Nya, dan supaya kamu bersyukur. (Q.S. An Nahl : 14) Karya ilmiah ini kupersembahkan untuk orang tua, adik-adik, keluarga dan teman-teman tercinta. Kuhaturkan terimakasih dan penghormatan yang sedalam-dalamnya kepada orang tuaku: Abi H. Anwar Laku dan Ummi Hj. Rukmah, S.Ag. terkasih, atas do’a restu dan dorongan moril dalam setiap kegiatan Ananda, semoga Allah SWT. meridhoi. Adik-adikku tersayang: Yusri Anwar, Yusran Anwar dan M. Risky Arba Al Hikmah (Al hajj) Anwar. Kalian adalah motivatorku. x PRAKATA Alhamdulillahirabbil Alamin, Tiada kata yang paling tulus dipersembahkan kepada Allah SWT. atas rahmat dan hidayah serta kasih sayang-Nya sehingga tesis dengan judul Karakteristik Fisika Kimia Perairan dan Kaitannya dengan Distribusi serta Kelimpahan Larva Ikan di Teluk Palabuhan Ratu, dapat diselesaikan sesuai rencana. Salam serta shalawat senantiasa dituturkan untuk Baginda Rasullullah S.A.W, pembawa rahmat bagi semua makhluk. Tesis ini berisikan tentang hubungan antara parameter fisik kimia perairan dengan kelimpahan larva ikan di Teluk Palabuhan Ratu. Hasil dari penelitian ini nantinya akan menjadi masukan bagi pemerintah daerah sebagai alternatif pengelolaan perikanan pantai bagi masyarakat pesisir Teluk Palabuhan Ratu. Kendala dan permasalahan tidak luput dari kegiatan ini mulai dari awal hingga akhir pelaksanaannya, sehingga dirasa tidak mungkin dapat terselesaikan tanpa bantuan, dukungan, dorongan dan kerjasama dari semua pihak yang telah membantu hingga usainya segala kegiatan. Terima kasih dan penghargaan besar penulis ucapkan kepada: 1. Dosen pembimbing: Bapak Dr. Ir. Djisman Manurung, M.Sc. dan Bapak Dr. Ir. M.Mukhlis Kamal, M.Sc disela kesibukannya bersedia meluangkan waktu dalam membimbing penulisan tesis ini. 2. Dr. Ir. Ridwan Affandi, DEA. Sebagai penguji luar komisi dalam ujian akhir atas saran perbaikannya. 3. Program Mitra Bahari-Coral reef Management Program II (PMB-COREMAP II) Tahun 2008 dan Yayasan Danamandiri (DAMANDIRI) tahap I atas beasiswa bantuan penulisan tesis Tahun 2008. 4. Serta tidak lupa juga pada rekan-rekan P.S. IKL 2006-2007 atas masukan dan dukungannya, sehingga memudahkan penulisan tesis ini. Akhir kata, semoga tesis ini dapat berguna dalam rangka pengelolaan sumberdaya perikanan, khususnya daerah pantai. Bogor, September 2008 xi RIWAYAT HIDUP Penulis dilahirkan di Mandalle (Pangkep) Sulawesi Selatan pada tanggal 08 Mei 1982, dari Ayahanda H. Anwar Laku dan Ibunda Hj. St. Rukmah S.Ag. Penulis merupakan putri pertama dari empat bersaudara. Pada tahun 1994 penulis menyelesaikan pendidikan dasar di SD Negri 19 Tamarupa Kab. Pangkep dan melanjutkan pendidikan di SLTP Negri 2 Mandalle, selesai pada Tahun 1997. Pada tahun yang sama melanjutkan pendidikan ke jenjang SLTA di SMU Negri 1 Kabupaten Barru dan menyelesaikannya di SMU Negri 1 Segeri Kabupaten Pangkep pada tahun 2000. Pada tahun 2001 penulis melanjutkan pendidikan di program Manajemen Sumberdaya Perairan (MSP), Jurusan Perikanan, Fakultas Ilmu Kelautan dan Perikanan Universitas Hasanuddin Makassar dan selesai pada tahun 2006 dengan gelar Sarjana Perikanan. Selama di Universitas Hasanuddin, pernah aktif di berbagai organisasi kemahasiswaan, baik yang bersifat intern sebagai Anggota dalam lingkup Keluarga Mahasiswa Perikanan (KEMAPI) UNHAS di jurusan perikanan, maupun yang bersifak eksternal, diantara yang pernah aktif di ikuti adalah Anggota Forum kajian Pesisir (FKP) Perikanan, yang bergerak dibidang konservasi mangove dan pesisir (2003-2006); Anggota Forum Studi Ulil Albab (FSUA), yang bergerak di bidang pembinaan dakwah kampus UNHAS (2001-2006). Dibidang akademik penulis pernah tergabung di Korps Asisten Jurusan Perikanan sebagai asisten mata kuliah Limnologi (2002/2003), asisten mata kuliah Fisiologi Hewan Air (2005/2006), Asisten mata kuliah Biologi laut selama dua periode (2004/20052005/2006). Ditahun yang sama setelah menyelesaikan pendidikan Strata satu, penulis melanjutkan pendidikan Strata dua (S2) di Institut Pertanian Bogor dengan biaya Mandiri pada Program Studi Ilmu Kelautan (PS.IKL) minat Biologi laut dan selama di PS. IKL tergabung dalam anggota Wahana Interaksi Mahasiswa Pasca Sarjana IKL (WATERMAS IKL) 2006 hingga menyelesaikan studi. Nurmila Anwar xii DAFTAR ISI Halaman DAFTAR TABEL ............................................................................................. xii DAFTAR GAMBAR ......................................................................................... xiii DAFTAR LAMPIRAN ...................................................................................... xiv I. PENDAHULUAN 1.1. Latar Belakang ................................................................................... 1.2. Perumusan Masalah............................................................................ 1.3. Tujuan dan Manfaat............................................................................. 1.4. Hipotesis ............................................................................................. 1 2 4 4 II. TINJAUAN PUSTAKA 2.1. Kondidi Umum Teluk Palabuhan Ratu ................................................ 2.2. Biologi larva ikan ................................................................................. 2.3. Distribusi larva ikan ............................................................................. 2.4. Parameter Fisika ................................................................................. 2.4.1. Suhu perairan ............................................................................ 2.4.2 Salinitas ..................................................................................... 2.4.3 Arus ........................................................................................... 2.5. Parameter Kimia.................................................................................. 2.5.1 Derajat Keasaman (pH) ............................................................. 2.5.2 Oksigen Terlarut (DO) ............................................................... 2.5.3. Nitrat .......................................................................................... 2.5.4. Fosfat (PO4)............................................................................... 5 7 10 11 11 13 13 15 15 16 17 17 III. METODE PENELITIAN 3.1. Lokasi dan Waktu Penelitian ............................................................... 3.2. Penentuan stasiun penelitian .............................................................. 3.3. Bahan dan Alat .................................................................................... 3.4. Pengumpulan Data dan pengukuran parameter Fisika Kimia Perairan 3.5. Analisis Data ....................................................................................... 3.5.1. Struktur Komunitas Larva Ikan .................................................. 3.5.2. Pola Pemencaran/distribusi Populasi ...................................... 3.5.3. Kelimpahan Larva Ikan ............................................................. 3.5.4. Kepadatan Populasi .................................................................. 3.5.5. Pengelompokan Stasiun Penelitian Berdasarkan Indeks Similaritas Canberra .................................................................. 3.5.6. Keterkaitan antara Parameter Lingkungan dengan Kelimpahan Larva ikan ................................................. IV. HASIL DAN PEMBAHASAN 4.1. Kondisi Umum Teluk Palabuhan Ratu. ................................................ 4.1.1. Kondisi Oseanografi.................................................................. 4.1.1.1. Gelombang ................................................................... 4.1.1.2. Arus .............................................................................. 4.1.2. Parameter Fisika Kimia ............................................................ 4.1.2.1. Suhu Permukaan ......................................................... 19 19 20 20 21 21 22 23 23 24 24 25 25 25 26 26 26 xiii 4.1.2.2. Salinitas ....................................................................... 4.1.2.3. Oksigen terlarut ........................................................... 4.1.2.4. Tingkat Keasaman (pH) ............................................... 4.1.2.5. Tingkat Kekeruhan....................................................... 4.1.3. Variabilitas Nutrien antar Stasiun.............................................. 4.1.3.1. Nitrat ............................................................................ 4.1.3.2. Fosfat .......................................................................... 4.1.3.3. Silika............................................................................ 4.2. Pengelompokan habitat ....................................................................... 4.3. Struktur Komunitas larva Ikan.............................................................. 4.3.1. Komposisi Jenis larva Ikan ........................................................ 4.3.2. Kepadatan Individu dan Distribusi larva Ikan ........................... 4.4. Keanekaragaman dan Dominansi........................................................ 4.5. Keterkaitan Struktur komunitas dengan Karakteristik habitat .............. 4.5.1. Habitat Muara ............................................................................ 4.5.1.1. Komposisi Larva Ikan Habitat Muara............................ 4.5.1.2. Kelimpahan larva Ikan Muara....................................... 4.5.1.3. Stadia larva Ikan Muara................................................ 4.5.2. Habitat Transisi .......................................................................... 4.5.2.1. Komposisi Larva Ikan Habitat Transisi ......................... 4.5.2.2. Kelimpahan larva Ikan Transisi .................................... 4.5.2.3. Stadia larva Ikan Transisi ............................................. 4.5.3. Habitat Laut Lepas..................................................................... 4.5.3.1. Komposisi Larva Ikan Habitat Laut Lepas .................... 4.5.3.2. Kelimpahan larva Ikan Laut Lepas ............................... 4.5.3.3. Stadia larva Ikan Laut Lepas ........................................ 4.6. Struktur Komunitas dan Kepadatan Larva Ikan Temporal .................. 28 29 29 30 30 30 32 33 34 39 39 40 40 41 42 42 42 43 43 43 44 45 46 46 46 47 47 V. SIMPULAN DAN SARAN 5.1. Simpulan ............................................................................................. 49 5.2. Saran ................................................................................................... 49 DAFTAR PUSTAKA ....................................................................................... 50 LAMPIRAN ...................................................................................................... 55 DAFTAR TABEL xiv Halaman 1. Pengukuran parameter fisika kimia perairan .............................................. 22 2. Komunitas Ikan dan kepadatan individu selama bulan pengamatan di Teluk Palabuhan Ratu .................................................................................... 40 3. Data Hasil perhitungan indeks keanekaragaman dan dominansi larva ikan di Teluk Palabuhan Ratu setiap bulan pengamatan. .................. 41 4. Data hasil perhitungan kelimpahan larva ikan setiap bulan pengamatan (ind/m3). ........................................................................................ 42 5. Hasil regresi kelimpahan larva dengan nutrien perairan Teluk Palabuhan Ratu. ...................................................................................... 52 DAFTAR GAMBAR xv Halaman 1. Kerangka pemikiran ................................................................................... 3 2. Arah kecepatan arus dan pasang surut dalam periode 24 jam di Teluk Palabuhan Ratu ........................................................................... 7 3. Peta Teluk Palabuhan Ratu, Kabupaten Sukabumi, Jawa Barat ................ 20 4. Grafik fluktuasi suhu permukaan setiap bulan pengamatan ........................... 26 5. Grafik nilai rata-rata suhu setiap stasiun pada bulan pengamatan ............. 27 6. Grafik fluktuasi salinitas permukaan setiap bulan pengamatan .................. 28 7. Grafik konsentrasi nitrat perstasiun pengamatan ............................................. 31 8. Grafik rata-rata sebaran jumah nitrat setiap bulan pengamatan .................... 31 9. Grafik konsentrasi fosfat setiap stasiun pengamatan ....................................... 32 10. Grafik rata-rata sebaran jumah fosfat setiap bulan pengamatan .................. 33 11. Grafik konsentrasi silika perbulan pengamatan ................................................ 33 12. Grafik rata-rata sebaran jumlah silika (Si) setiap bulan pengamatan ........... 34 13 Dendrogram similaritas antar stasiun pada Bulan November, Desember dan Januari ......................................................................................... 36 14. Dendrogram similaritas antar stasiun pada Februari, Maret dan April .......... 37 15. Hubungan antara Kelimpahan dengan kecepatan arus perbulan pengamatan .......................................................................................... 51 DAFTAR LAMPIRAN xvi Halaman 1. Tabel data sampling parameter fisika kimia perairan Teluk Palabuhan Ratu 6 bulan pengamatan ..................................................... 60 2. Tabel komposisi dan frekuensi kehadiran larva ikan setiap stasiun pengambilan sampel di Teluk Palabuhan Ratu .............. 63 3. Tabel distribusi komposisi dan stadia larva berdasarkan kelompok habitat ......................................................................................... 64 4. Tabel hasil perhitungan pola pemencaran populasi Morisita (Iδ) ................. 68 5. Tabel koordinat dan kedalaman stasiun pengambilan sampel di Teluk Palabuhan Ratu ..................................................................................... 69 6. Hasil analisis klaster observasi parameter fisika-kimia .................................. 70 7. Gambar dan deskripsi morfologi larva/juwana ikan yang tertangkap di stasiun peneitian ................................................................................................ 73 8. Gambar Jaring larva untuk pengambilan sampel ............................................. 85 xvii KARAKTERISTIK FISIKA KIMIA PERAIRAN DAN KAITANNYA DENGAN DISTRIBUSI SERTA KELIMPAHAN LARVA IKAN DI TELUK PALABUHAN RATU NURMILA ANWAR SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR BOGOR 2008 0 I. PENDAHULUAN 1.1 Latar Belakang Jaminan stok berbagai komoditas perikanan umumnya tergantung pada keberadaan fase larva. Perikanan pantai tergantung pada keberadaan biota-biota muda yang hidup di areal pasang surut, tempat mereka berlindung dan memperoleh makanan diawal masa hidupnya. Pemahaman tentang biologi ikan sangatlah penting dimulai dengan pengetahuan yang baik tentang perkembangan awal daur hidup ikan, baik ekologi maupun kehidupannya. Pentingnya aspek ini karena mempunyai keterkaitan dengan fluktuasi ikan, bahkan kelangsungan hidup dari spesies itu sendiri. Seperti diketahui pada tahap awal daur hidup ikan mempunyai mortalitas yang tinggi karena kepekaan terhadap predator, ketersediaan makanan, dan juga perubahan lingkungan yang terjadi di alam (critical period). Dengan terganggunya tahap-tahap awal dari kehidupan ikan maka hal ini memberi dampak negatif bagi populasi ikan. Kondisi perairan sangat menentukan kelimpahan dan penyebaran organisme di dalamnya, akan tetapi setiap organisme memiliki kebutuhan dan preferensi lingkungan yang berbeda untuk hidup yang terkait dengan karakteristik lingkungannya. Nikolsky (1963) menyatakan bahwa setidaknya ada tiga alasan utama bagi ikan untuk memilih tempat hidup yaitu 1) yang sesuai dengan kondisi tubuhnya, 2) sumber makanan yang banyak, 3) cocok untuk perkembangbiakan dan pemijahan. Dalam rangka pengelolaan sumberdaya hayati perairan laut, pemahaman terhadap faktor-faktor fisik laut dan pengaruhnya terhadap perkembangan biota laut merupakan suatu kebutuhan yang mutlak. Faktor fisika-kimia laut, seperti cahaya, suhu, salinitas, arus dan pasang surut semenjak semula dipandang sebagai faktor abiotik pada ekosisitem laut yang memiliki banyak kegunaan dalam proses kelangsungan hidup ikan, seperti pertumbuhan dan distribusinya. Bertolak dari uraian di atas, dipandang perlu untuk menguraikan secara mendetail tentang keterkaitan pola distribusi dengan kelimpahan larva ikan berdasarkan parameter fisika kimia perairan. Mengingat Ichthyoplankton sebagai awal kehidupan ikan yang merupakan sumberdaya perikanan di suatu perairan. 1 Mengetahui distribusi Ichthyoplankton sangat penting, tidak hanya dalam pengertian proses ekologis, tetapi juga terhadap implikasi praktis penilaian kelimpahannya (Brodeur dan Rugen, 1994), diharapkan dengan pengetahuan tentang faktor-faktor fisik laut akan dapat memberikan arahan yang jelas tentang keberadaan ichthyoplankton di laut sehingga tidak dilakukan penangkapan tanpa memperhitungkan kelestariannya. Teluk Palabuhan Ratu dipilih sebagai lokasi penelitian karena teluk ini dianggap masih sangat potensial sebagai daerah pemijahan dan penangkapan ikan intensif, memiliki karakteristik perairan yang khas dengan berbagai macam sumberdaya ikan, sehingga diharapkan mampu memberikan interpretasi tentang keberadaan larva ikan. Disamping itu, studi mengenai distribusi dan kelimpahan larva di perairan ini masih belum banyak dilakukan. 1.2 Perumusan masalah Selama ini pemanfaatan sumberdaya ikan yang dilakukan oleh sebagian besar nelayan ditekankan pada kepentingan jangka pendek dengan besaran manfaat yang sedikit dibandingkan dengan jangka panjang. Umumnya nelayan bersaing untuk mendapatkan ikan lebih banyak sehingga mengancam kapasitas lingkungan sumberdaya. Keadaan di atas tidak hanya terjadi pada sumberdaya ikan yang telah dewasa tetapi juga terjadi pada sumber daya larva ikan, padahal telah diketahui bahwa fase ini merupakan fase awal dalam siklus biota untuk berkembang menjadi dewasa. Sehingga jika tidak dilakukan pengelolaan sejak awal akan mengancam kelestarian dan keberlangsungan hidup biota tersebut. Secara biologi fase larva akan banyak ditemui di daerah pesisir, selain karena adanya naluri dari induk ketika memijah, juga dipengaruhi oleh ketersediaan makanan dan ruang. Kedua faktor tersebut tidak berdiri sendiri, tetapi dipengaruhi oleh kondisi fisika kimia perairan seperti arus, suhu, pasang surut, salinitas, dan yang lainnya. Sehingga dengan demikian antara faktor fisika, kimia dan biologi larva akan terjadi interaksi yang saling terkait menjadi komponen ekologi di perairan pantai. Artinya jika salah satu di atara variabel lingkungan berubah maka secara berantai akan menyebabkan perubahan bagi variabel lingkungan lainnya (Gambar 1). Hal inilah yang ingin di kaji yaitu untuk melihat sejauh mana keterkaitan antara komponen-komponen itu dengan pola distribusi larva ikan. 2 RUANG PESISI ESTUARI LAUT LEPAS IKAN DEWASA SUMBER DAYA IKAN EKSPLOITASI PENGELOLAAN LARVA IKAN KETERSEDIAAN SD MAKANAN + KEBERLANGSUNGAN FISIKA KIMIA PERAIRAN Suhu, arus, salinitas, pasang surut, pH, DO, elemen nutrien (Nitrogen, Fosfat dan silika) POLA DISTRIBUSI LARVA IKAN BIOLOGI * komposisi dan kelimpahan * keragaman (Indeks Diversitas) * pola penyebaran (Indeks Morisita) * Kepadatan * Plankton = hubungan = ruang lingkup penelitian = pengaruh langsung * = komponen Gambar 1. Kerangka Pendekatan Masalah 3 1.3 Tujuan dan Manfaat Penelitian Penelitian ini bertujuan untuk: 1. Mengetahui keterkaitan antara karakter habitat dengan distribusi larva yang didasarkan pada parameter fisika kimia perairan di Teluk Palabuhan Ratu. 2. Mengetahui pola distribusi larva ikan secara spasial dan temporal di perairan Teluk Palabuhan Ratu. Manfaat penelitian ini diharapkan dapat memberi kontribusi dalam pemanfaatan dan pengelolaan sumberdaya larva ikan dan dengan ini akan diketahui sejauh mana kondisi ekologis larva ikan di Teluk Palabuhan Ratu. 1.4 Hipotesis 1. Perbedaan karakteristik habitat tidak mempengaruhi komunitas larva ikan dan distribusi stadia larva ikan di Teluk Palabuhan Ratu. 2. Perbedaan parameter fisika-kimia perairan tidak mempengaruhi pola distribusi dan komposisi jenis larva secara spasial-temporal. 4 II. TINJAUAN PUSTAKA 2.1 Kondisi Umum Teluk Palabuhan Ratu Perairan Teluk Palabuhan Ratu terletak pada posisi geografis 6o57’- 7o07’ LS dan 106o22’-106o23’ BT dengan panjang pantai lebih kurang 105 km. Perairan tersebut merupakan perairan pantai selatan Jawa Barat yang memilliki hubungan dengan Samudra Hindia. Sistem sungai yang bermuara di perairan teluk diketahui ada 7 buah yaitu 2 buah golongan besar: S. Cimandiri dan S. Cibareno dan 5 buah lainnya tergolong sungai kecil: S. Cimaja, CiPalabuhan, Cidadap, Cibutun dan Ciletuh (LON-LIPI 1975) Musim sangat berpengaruh terhadap kondisi hidrodinamika perairan teluk. Pada periode Musim Timur (Mei-Agustus) gelombang dan arus relatif lebih tenang dibandingkan pada periode musim barat (November-Februari), diantara Musim Timur dan Musim Barat terjadi periode peralihan (Wyrtki, 1961) yang disebut Musim Peralihan Timur (Maret-April) dan Musim peralihan Barat (September-Oktober) Kondisi Teluk Palabuhan Ratu banyak dipengaruhi oleh kondisi oseanografi Samudera Hindia seperti adanya pengaruh angin yang besar. Wyrtki (1961) mengemukakan bahwa keadaan angin di Palabuhan Ratu sesuai dengan sifat laut dan tercatat kecepatannya sebesar 1-7.5 cm/dtk pada Bulan September sampai Desember yang bergerak kearah barat. Selanjutnya dikatakan bahwa perairan Teluk Palabuhan Ratu mempunyai suhu permukaan laut pada musim barat berkisar 29-30oC dan pada musim timur 26-27oC Pariwono et al. (1988) mengemukaan bahwa pada Bulan September dan Oktober suhu permukaan laut relatif rendah, yaitu rata-rata 26.57oC sedangkan pada musim hujan suhu permukaan laut rata-rata naik menjadi 27.78oC padahal disaat itu laut kurang menerima pemanasan dari matahari, karena tertutup awan. Hal ini diduga sebagai pertanda bahwa proses upwelling terjadi pada Bulan Agustus September dan okteber di perairan Teluk Palabuhan Ratu. Dari hasil penelitian Purba (1995), diacu dalam PRTK & Dep ITK (2004) diketahui bahwa di lepas Pantai Palabuhan Ratu terjadi upwelling mulai Bulan Juli, terbukti dengan terlihatnya kelompok massa air yang lebih dingin di sekitar lepas pantai, diapit oleh massa air yang lebih hangat ke arah pantai dan ke arah laut lepas. Kelompok massa air dingin ini berasal dari proses upwelling oleh Ekman Pump yang dibangkitkan oleh angin Muson Tenggara. 5 Terdapat perbedaan suhu permukaan laut musim timur dan musim barat, baik di perairan lepas pantai selatan Jawa (S. Hindia) maupun di perairan Palabuhan Ratu. Levinton (1982) mendapatkan adanya perbedaan suhu permukaan laut di perairan lepas pantai selatan Jawa, yaitu 28oC (AgustusOktober) dan 29oC (Februari-April). Demikian pula hasil penelitian LON LIPI 1975 di perairan pantai selatan Jawa diketahui adanya perbedaan suhu pada musim kemarau (28oC) dan musim hujan (29-30) Hasil penelitian Pariwono et al. (1988) menunjang pernyataan di atas setelah melakukan pengukuran suhu di perairan Palabuhan Ratu pada bulan September-Oktober (akhir musim timur) dan bulan November-Desember (awal musim barat) masing-masing tercatat sebesar 26 dan 28 o C. Selanjutnya dikemukaan bahwa terdapat fenomena perbedaan suhu yang relaif lebih rendah pada musim timur dibandingkan dengan musim barat menunjukkan adanya proses upwelling di perairan yang bersangkutan. Penyebaran suhu vertikal di perairan Teluk Palabuhan Ratu pada kedalaman 25 meter antara 29.75-28.55 oC (rata-rata 28.43 oC). Perbedaan tersebut disebabkan terutama adanya pengaruh penyinaran matahari terhadap peningkatan suhu permukaan perairan teluk (Sanusi dan Atmodipoera, 1993) Salinitas di perairan Teluk Palabuhan Ratu dipengaruhi oleh keadaan musim dengan faktor utama adanya masukan massa air sungai yang bermuara. Transpor massa air sungai yang terutama pada musim barat mengakibatkan turunnya salinitas perairan pantai Teluk Palabuhan Ratu. Namun demikian di perairan teluk bagian tengah nilai perbedaan salinitas permukaan laut pada musim timur dan musim barat relatif kecil. Hasil pengukuran memperlihatkan nilai salinitas rerata pada periode Agustus Oktober dan Mei-Juli masing-masing sebesar 32.96‰ dan 32.33‰ (Pariwono et al., 1988) Massa air bersalinitas tinggi ini berasal dari Laut Flores yang memasuki Laut Jawa seiring dengan pergerakan arus permukaan pada Musim Timur ini yang menuju ke barat. Menurut Wyrtki (1961), bahwa pada Musim Timur ini di sekitar Laut Banda dan Selat Makasar bagian selatan terjadii upwelling, sehingga daerah sekitarnya menjadi subur. Kesuburan perairan tersebut terbawa arus hingga ke Laut Jawa sehingga mangakibatkan Laut Jawa selama dan sesudah Musim Timur ini menjadi subur dan akan tersedia makanan bagi ikan dan pijahannya. 6 Karakter pasut di perairan Teluk Palabuhan Ratu sama dengan karakter gelombang, merupakan perambatan dari pengaruh pasut yang terjadi di Samudera Indonesia. Pasut bersifat campuran dominasi semidiurnal yaitu tinggi pasang dan surut pertama tidak sama dengan tinggi pasang dan surut kedua, terjadi karena perairan teluk berhubungan langsung dengan perairan laut lepas Samudera Hindia (PRTK & Dep ITK 2004). Gambar 2 menunjukkan grafik komponen pasut dalam 24 jam di Teluk Palabuhan Ratu. Gambar 2. Arah Kecepatan Arus dan pasang Surut dalam periode 24 jam di Teluk Palabuhan Ratu (PRTK & Dep ITK 2004). 2.2 Biologi larva ikan Ichthyoplankton merupakan cabang ilmu yang membahas tentang larva ikan yang hidup planktonik, merupakan cabang Ichtyologi yang membahas tentang stadia larva yang sifatnya sangat ditentukan oleh lingkungannya terutama dalam pergerakan dan migrasinya. Awal daur hidup ikan, menurut Effendie (1978) dan Matarase et al. (1989), meliputi stadia telur dan perkembangannya, yaitu stadia larva dan juwana (ikan muda). Ikan-ikan pada stadia telur dan larva ikan dapat digolongkan sebagai plankton, yaitu sebagian 7 dari siklus hidupnya merupakan plankton sementara atau meroplankton (Odum, 1993). Menurut Mantiri (1995), ikan-ikan yang masih berada pada stadia telur dan larva digolongkan dan di istilahkan sebagai ichthyoplankton. Adapun setelah dewasa mereka menjalani kehidupan sebagai perenang-perenang yang aktif yang sudah masuk dalam kategori nekton. Ichthyoplankton menurut Mantiri (1995) adalah merupakan organisme ikan yang masih berada pada stadia telur dan larva, namun ada juga yang menggunakan istilah ini pada ikan yang sudah berada pada stadia juwana yang masih bersifat planktonis. Selanjutnya dikatakan bahwa istilah Ichthyoplankton belum terlalu dikenal dan digunakan. Tulisan-tulisan ilmiah yang sudah menggunakan istilah ini seperti: Able (1978), Brodeur et al. (1985), Boehlert et al. (1985), Beckley (1986), Ozawa (1986), Brodeur dan Rugen (1994), Mantiri (1993 dan 1995). Ichthyoplankton sebagai tahapan awal perkembangan, sejak dari stadia telur menuju larva dan juwana ikan. Russel (1976) mengemukakan bahwa larva ikan merupakan bentuk atau tingkatan ikan setelah telur menetas dan menggunakan istilah larva yang merujuk pada larva masih memiliki yolk sac atau kantung telur dan “postlarva” untuk ikan muda antara stadia larva dan juwana. Stadia ini kemudian berakhir setelah persediaan kuning telur yang ada telah habis diserap. Pada tahap ini tingkat mortalitas tinggi karena peka terhadap predator, ketersediaan makanan dan perubahan lingkungan seperti suhu, salinitas. Dengan demikian tahap ini adalah kondisi yang paling menentukan kelangsungan hidup satu spesies maupun populasi ikan tersebut. Menurut Effendie (1978), Perkembangan larva dalam garis besarnya di bagi menjadi dua tahap yaitu prolarva dan postlarva. Untuk membedakannya, prolarva masih mempunyai kantung kuning telur yang terletak di bagian depan bawah, tubuh masih transparan dengan beberapa butir pigmen yang belum diketahui fungsinya. Sirip dada dan ekor sudah ada tapi belum sempurna bentuknya dan kebanyakan prolarva yang baru keluar dari cangkang telur tidak mempunyai sirip perut yang nyata, hanya bentuk tonjolan. Mulut dan rahang belum berkembang dan ususnya masih merupakan tabung yang lurus. Sistem pernafasan dan peredaran darah belum sempurna dan memperoleh makanan hanya dari sisa kuning telur yang belum habis diserap. 8 Masa postlarva ikan mulai dari hilangnya kantung kuning telur sampai terbentuknya organ-organ baru atau selesainya taraf penyempurnaan organorgan yang telah ada sehingga pada akhir masa postlarva tersebut secara morfologis sudah mempunyai bentuk hampir sama dengan induknya. Sirip dorsal sudah mulai dapat dibedakan, demikian pula dengan sirip ekor sudah mulai ada bentuknya. Berenangnya sudah mulai aktif dan kadang-kadang memperlihatkan sifat bergerombol walaupun tidak selamanya demikian (Effendie, 1978). Pada perkembangan larva lebih lanjut dijelaskan bahwa sirip ekor berkembang diikuti oleh pemisahan sirip punggung dan sirip dubur. Vertebra dan osteogenesis mengeras dan dengan perubahan pigmentasi badan maka post larva mencapai tingkat juwana. Pada larva ikan yang baru menetas kuning telur terletak pada bagian anterior vertebral tubuh, bentuk menonjol dan sering kali menutupi hampir separuh panjang total tubuh. Mata belum berpigmen, mulut belum berfungsi dan anal belum terbuka. Selama perkembangan larva, mata menjadi berpigmen, mulut serta anus mulai terbuka. Posisi anus dapat digunakan sebagai karakter identifikasi. Selama perkembangan kuning telur dan kelenjar minyak digunakan secara bertahap. Ketika kuning telur habis, organorgan yang dibutuhkan untuk mencari dan mengunyah makanan sudah berfungsi. Pada masa ini larva mengalami masa krisis (Effendie, 1978). Apabila masa postlarva berakhir, ikan akan memasuki masa juwana. Untuk beberapa ikan dalam memasuki masa ini ada beberapa yang mengalami perubahan bentuk tubuh atau bermetamorphose. Hoar dan Randall (1987) mengatakan bahwa ikan dalam mengawali daur hidup akan melalui tiga tahap, yaitu telur, larva dan juwana. Diantaranya terdapat dua tahap transisi antara telur dan larva dan antara larva dan juwana, yaitu tahap yolk sac, dan tahap transformasi larva. Dalam tahap telur, dibagi kedalam tiga sub divisi yaitu awal, tengah, dan akhir. Pada tahap larva juga di bagi menjadi 3 sub divisi yaitu: preflexion, plexion dan postflexion larva. Pada ikan ada beberapa kelompok sifat taksonomik yang digunakan untuk mengenal larva, yaitu: 1. Berbagai struktur atau bentuk bagian tubuh, seperti mata, kepala, badan, lambung dan sirip (khususnya sirip dada) 2. Urutan munculnya sirip dan kedudukannya, fotofora dan unsur tulang. 3. Ukuran larva. 4. Pigmentasi (letak, jumlah dan bentuk melanophora) 9 5. Tanda-tanda yang sangat khas seperti lipatan sirip yang membengkak, sirip yang memanjang dan terubah, sungut pada dagu dan duri pada preoperculum (Russel, 1976). Karakter melanophora merupakan ciri diagnostik utama dalam mengidentifikasi spesies pada stadia postlarva. Kesamaan antar spesies dapat dilihat dari ada atau tidaknya melanophora atau posisi dimana melanophora berada. Lokasi melanophora biasa terletak di bagian eksternal dari dermis atau epidermis, bagian internal peritoneum, di atas atau di bawah kolom vertebra dan di daerah otocystic (Russel, 1976). 2.3 Distribusi larva ikan Ichthyoplankton memiliki pola distribusi vertikal berdasarkan migrasinya yang di bagi atas dua tipe. Migrasi tipe I dikenal sebagai pola distribusi yang lebih umum yaitu Ichthyoplankton naik ke permukaan pada malam hari. Migrasi tipe II merupakan pola distribusi yang tidak umum dan merupakan kebalikan dari migrasi tipe I yaitu Ichthyoplankton naik ke lapisan permukaan pada siang hari. Pada dasarnya pola distribusi ini sangat di pengaruhi oleh cahaya, namun predator dapat juga mengubah pola distribusi vertikal Ichthyoplankton (Brodeur dan Rugen, 1993). Contoh-contoh pola distribusi tipe I seperti yang dilaporkan Rogers (1940), dan Brodeur et al. (1993). Adapun tipe II dilaporkan oleh Boehlert et al. (1985). Demikian halnya ukuran tubuh, peningkatan kemampuan berenang dan kapasitas perkembangan larva dikatakan merupakan pengontrol posisi vertikal golongan ini (Fortier dan Leggett, 1983). Secara umum seperti yang dikemukakan beberapa ahli, distribusi ichthyoplankton di tentukan oleh faktorfaktor tingkah laku seperti pergerakan berdasarkan waktu dan cahaya (Mantiri, 1995); faktor-faktor fisik seperti sirkulasi air pasang surut (Laprise dan Dodson, 1989), suhu, salinitas dan turbiditas (Able, 1978); dan faktor ketersediaan makanan. 10 2.4 Parameter Fisika 2.4.1 Suhu perairan Suhu merupakan salah satu faktor yang penting dalam pengaturan seluruh proses kehidupan dan penyebaran organisme, dan proses metabolisme tejadi hanya dalam kisaran tertentu. Di laut suhu berpengaruh secara langsung pada laju proses fotosintesis dan proses fisiologi hewan (derajat metabolisme dan siklus reproduksi) yang selanjutnya berpengaruh terhadap cara makan dan pertumbuhannya. Perbedaan penerimaan radiasi matahari setiap wilayah menyebabkan perbedaan suhu, terkait dengan perbedaan letak geografis lintang. Selain panas matahari, faktor lain yang mempengaruhi suhu permukaan laut adalah arus permukaan, keadaan awan, upwelling, divergensi dan konvergensi terutama sekitar estuaria sepanjang garis pantai (Hela dan Laevastu, 1970). Selain oleh faktor di atas suhu permukaan laut juga dipengaruhi oleh kondisi meteorologi seperti penguapan, curah hujan, suhu udara, kelembaban udara dan kecepatan angin oleh karenanya suhu permukaan biasanya mengikuti pola musiman. Seperti contoh pada saat musim pancaroba, angin biasanya lemah dan permukaan laut akan tenang sehingga proses pemanasan dipermukaan terjadi sangat kuat. Akibatnya pada musim pancaroba suhu lapisan permukaan mencapai maksimum (Nontji, 2001). Perubahan suhu juga dapat menyebabkan terjadinya sirkulasi dan stratifikasi massa air dan hal itu dapat mempengaruhi distribusi. Ikan biasanya memilih suhu optimum untuk dapat hidup dengan baik. Aktivitas metabolisme dan penyebaran ikan banyak dipengaruhi oleh suhu perairan fluktuasi suhu dan perubahan geografis merupakan faktor penting yang menentukan konsentrasi dan pengelompokan ikan. Menurut Soegiarto dan Birowo (1975), suhu permukaan di perairan Indonesia berkisar antara 28-30oC dan di daerah upwelling suhunya dapat turun mencapai 25oC dan secara horizontal suhu permukaan laut di perairan Indonesia memiliki variasi tahunan yang rendah, namun variasi tersebut masih menunjukkan perubahan musiman. Perubahan ini dipengaruhi oleh posisi matahari dan pengaruh massa air di daerah lintang tinggi. Suhu permukaan laut dapat digunakan sebagai salah satu cara untuk menduga keberadaan organisme dalam suatu perairan, khususnya ikan. Hal ini karena sebagaian besar organisme bersifat poikiloterm. Tinggi rendahnya suhu 11 permukaan laut pada suatu perairan terutama dipengaruhi oleh radiasi matahari. Perubahan intensitas cahaya akan menyebabkan terjadinya perubahan suhu air laut baik secara horizontal, mingguan, bulanan, maupun tahunan. Suhu berpengaruh terhadap tingkah laku ikan, mempunyai kisaran tertentu untuk melakukan pemijahan bahkan dengan suatu siklus musiman yang tertentu pula (Gunarso, 1985). Lawalata (1977), diacu dalam Olii (2003). Menurut Sidjabat (1978), menyatakan bahwa suhu perairan merupakan suatu faktor lingkungan yang paling mudah dipelajari dari faktor-faktor lainnya, sebab suhu merupakan suatu petunjuk yang berguna dari perubahan kondisi lingkungan, suhu air laut, terutama lapisan permukaan, ditentukan oleh pemanasan matahari yang intensitasnya senantiasa berubah terhadap waktu, sehingga suhu air laut akan seiring dengan perubahan intensitas penyinaran matahari tersebut. Perubahan suhu ini dapat terjadi secara: (1) harian, (2) musiman, (3) tahunan, dan (4) jangka panjang. Selanjutnya Sidjabat (1978) mengatakan bahwa jika suatu perairan yang homogen dan tenang dipanasi oleh matahari, distribusi suhu secara vertikal akan menurun eksponensial ke bawah. Apalagi jika tidak ada gangguan pada perairan ini, keadaan perairan akan selalu stabil karena lapisan yang paling atas yang lebih panas akan lebih rendah densitasnya dari pada lapisan bawah. Ikan dapat mendeteksi perubahan suhu meskipun lebih kecil dari 0,1 oC. Setiap ikan mempunyai rentang karakteristik aklimatisasi (optimum) suhu dan mempunyai batas toleransi suhu yang dapat berubah secara musiman pada stok yang satu dengan yang lainnya dalam spesies yang sama. Sulliva (1954), diacu dalam Laevastu dan Hayes (1981) merangkum pengaruh suhu terhadap ikan antara lain: 1) sebagai modifier proses metabolik (misalnya mempengaruhi kebutuhan makanan dan laju up take dan pertumbuhan); 2) sebagai modifier dari aktivitas badan (misalnya laju renang); dan 3) sebagai stimulus saraf. Reaksi ikan terhadap anomali suhu adalah suatu masalah kompleks. Asumsi bahwa hampir semua reaksi spesies ikan terhadap anomali lingkungan muncul pada skala waktu sinoptik dan bulanan. Sedangkan jangka yang lebih panjang: musiman dan tahunan, reaksinya harus mencakup beberapa proses integrasi, seperti perubahan wilayah pencarian makan melalui migrasi dan pencarian atau beberapa pengaruh terhadap laju pertumbuhan, maturasi dan terhadap rekruitmen (Sulliva 1954, diacu dalam Laevastu dan Hayes 1981). 12 2.4.2 Salinitas Secara ideal, salinitas merupakan jumlah dari seluruh garam dalam gram pada setiap kilogram air laut. Secara praktis, adalah susah untuk mengukur salinitas di laut, oleh karena itu penentuan nilai salinitas dilakukan dengan meninjau komponen yang terpenting saja yaitu klorida (Cl). Kandungan klorida ditetapkan pada tahun 1902 sebagai jumlah dalam gram ion klorida pada satu kilogram air laut jika semua halogen digantikan oleh klorida. Laevastu dan Hayes (1981) menyatakan perubahan salinitas di laut terbuka relatif lebih kecil dibandingkan dengan perubahan salinitas di pantai yang memiliki masukan air tawar dari sungai terutama saat musim hujan. Salinitas berpengaruh pada osmoregulasi dari ikan serta berpengaruh besar terhadap kesuburan dan pertumbuhan telur. Beberapa spesies bisa hidup dengan toleransi salinitas yang besar (euryhaline) tetapi ada juga yang sempit (stenohaline). Disamping itu Hayes dan Laevastu (1982) menyatakan bahwa salinitas berpengaruh pada distribusi, orientasi migrasi, dan kesuksesan reprodukasi dari ikan. Hayes dan Laevastu (1982) menjelaskan bahwa salinitas mempengaruhi fisiologis kehidupan organisme dalam hubungannya dengan penyesuaian tekanan osmotik antara sitoplasma dan lingkungan. pengaruh ini berbeda pada setiap organisme baik itu fitoplankton, zooplankton, maupun ichthyoplankton. Pengaruh salinitas pada ikan dewasa sangat kecil karena salinitas di laut relatif stabil yaitu berkisar antara 30 - 36 o/oo, sedangkan larva ikan biasanya cepat menyusuaikan diri terhadap tekanan osmotik. Namun demikian cenderung memilih perairan dengan kadar salinitas yang sesuai dengan tekanan osmotik tubuhnya. Dan hal ini secara langsung akan sangat mempengaruhi distribusi larva ikan (Lignot et al., 2000). 2.4.3 Arus Arus berperan dalam transportasi ikan dan larva di laut. Adanya arus yang berlawanan akan menjadi perangkap bagi keberadaan makanan ikan di laut. Arus merupakan hal yang sangat penting kaitannya dengan iklim, arus juga membawa organisme plankton dalam jumlah yang besar dari tempat asalnya secara periodik (Davis, 1955). Pola aliran arus juga menentukan pola karakteristik penyebaran nutrien, transport sedimen, plankton, ekosistem laut dan geomorfologi pantai. Pada daerah teluk, pola aliran air lebih didominasi oleh pasang surut dan angin. 13 Di daerah teluk, jenis arus yang dibangkitkan oleh gaya pasang surut sangat dominan dibandingkan dengan arus yang dibangkitkan oleh gaya gesek angin dengan permukaan air. Dwiponggo (1972) mengemukakan bahwa jenis jenis ikan tertentu akan bergerak mengikuti arus pada waktu pasang naik kearah pantai. Laevastu dan Hayes (1981) mengungkapkan bahwa ikan-ikan besar menggunakan arus untuk mendeteksi medan geoelectrocity bagi perjalanan migrasi mereka. Ikan demersal juga melakukan hal yang sama yaitu antara arus pasut dan migrasinya. Arus juga berperan dalam distribusi pemindahan telur, larva dan ikan kecil selain itu arus merupakan faktor pembatas bagi beberapa spesies. Karakter arus bervariasi dari tahun ketahun dan berperan penting dalam migrasi musiman dan siklus hidup dari ikan pelagis dan semi pelagis. Sverdrup et al. (1972) membagi arus laut ke dalam tiga golongan besar, yaitu : 1). Arus yang disebabkan oleh perbedaan sebaran densitas di laut. Arus ini disebabkan oleh air yang berdensitas lebih berat akan mengalir ke tempat air yang berdensitas kecil atau lebih ringan. Arus jenis ini biasanya memindahkan sejumlah besar massa air ke tempat lain; 2). Arus yang ditimbulkan oleh angin yang berhembus di permukaan laut. Arus jenis ini biasanya membawa air kesatu jurusan dengan arah yang sama selama satu musim tertentu; 3). Arus yang disebabkan oleh air pasang. Arus jenis ini mengalirnya bolak-balik dari dan ke pantai, atau berputar. Gerakan massa air dalam sangat berbeda dengan massa air permukaan. Massa air dalam terisolasi dari angin, oleh karena itu gerakannya tidaklah bergantung pada angin. Tetapi gerakan massa air dalam sebenarnya terjadi karena perubahan gerakan air permukaan. Di daerah tertentu dan dalam keadaan tertentu pula, gerakan lateral air yang disebabkan oleh angin juga mengakibatkan air mengalami suatu sirkulasi vertikal atau gerakan ke atas atau upwelling (Nybakken, 1992). Arus sangat mempengaruhi penyebaran ikan Laevastu dan Hayes (1982) menyatakan, bahwa: 1) penyebaran ikan oleh arus mengalihkan telur dan anak anak ikan dari spawning ground (daerah pemijahan) ke nursery ground (daerah pembesaran) dan ke feeding ground (tempat mencari makan); 2) Migrasi ikan dewasa dapat disebabkan oleh arus, sebagai alat orientasi ikan dan sebagai pola rute alami; 3) Tingkah laku diurnal ikan dapat disebabkan oleh arus, khususnya arus pasang surut; 4) Arus dapat secara langsung mempengaruhi pengelompokan makanan atau faktor lain yang membatasinya (suhu); 5) Arus 14 juga mempengaruhi lingkungan alami ikan, dengan demikian secara tidak langsung mempengaruhi kelimpahan ikan tertentu dan sebagai pembatas distribusi geografisnya. Arus dapat mempengaruhi migrasi ikan oleh angkutan pasif juwana mulai dari daerah pembesaran sampai daerah pemijahan dan mungkin berperan sebagai suatu penjajakan migrasi arus balik dari ikan dewasa mulai dari daerah pembesaran sampai daerah pemijahan. Anomali arus permukaan dapat mempengaruhi distribusi larva, juwana dan juga migrasi pemijahan ikan dewasa. Selain itu, sebaran stok ikan utama biasanya mengikuti sistem arus tertentu. Arus arus yang besar di laut seluruhnya menyebabkan perubahan densitas massa air permukaan. Perubahan densitas air laut berhubungan dengan variasi suhu dan salinitas, yaitu kenaikan suhu menyebabkan penurunan densitas air laut yang diikuti dengan kenaikan salinitas. Di laut perubahan salinitas dan suhu biasanya terjadi bersama-sama dan keduanya sangat penting dalam mengendalikan densitas (Barnes dan Hughes, 1998). Menurut Hinckley et al. 1991, diacu dalam Olii (2003), arus selalu berhubungan dengan kedalaman. Perubahan arah arus yang kompleks susunannya terjadi sesuai dengan makin bertambahnya kedalaman perairan. Pada umumnya tenaga angin yang diberikan pada lapisan permukaan air dapat membangkitkan timbulnya arus permukaan yang mempunyai kecepatan sekitar 2% dari kecepatan angin itu sendiri. Kecepatan arus ini akan berkurang cepat sesuai dengan makin bertambahnya kedalaman perairan dan akhirnya angin menjadi tak berpengaruh sama sekali terhadap kecepatan arus (Hutabarat dan Evans, 1986). Selanjutnya mengemukakan bahwa pada kedalaman dibawah 100 meter kecepatan arus sangat lambat sehingga Ichthyoplankton di daerah ini kemungkinan tidak hanyut jauh dari wilayah dimana mereka dipijahkan, sedangkan pada kedalaman di atas 50 meter dari kolom air, arus semakin cepat sehingga Ichthyoplankton akan mudah terbawa oleh arus. 2.5. Parameter Kimia 2.5.1 Derajat Keasaman (pH) Air laut mempunyai kemampuan menyangga yang sangat besar untuk mencegah perubahan pH. Perubahan pH sedikit saja dari pH alami akan memberikan petunjuk terganggunya sistem penyangga. Hal ini dapat menimbulkan perubahan dan ketidakseimbangan kadar CO2 yang dapat membahayakan kehidupan biota laut. Derajat keasaman (pH) air laut permukaan 15 di Indonesia umumnya bervariasi dari lokasi ke lokasi antara 6.0 – 8.5. Perubahan pH dapat mempunyai akibat buruk terhadap kehidupan biota laut, baik secara langsung maupun tidak langsung (Romimuhtarto, 1991). Derajat keasaman merupakan salah satu parameter penentu produktivitas suatu perairan. Pada umumnya pH air laut tidak banyak bervariasi karena adanya sistem karbondioksida dalam laut, maka air laut mempunyai kapasitas penyangga (buffer) yang kuat (Nontji, 2001). 2.5.2 Oksigen Terlarut (DO) Kadar oksigen terlarut (dissolved oxygen, DO) dapat dijadikan ukuran untuk menentukan mutu air. Kehidupan di air dapat bertahan jika ada oksigen terlarut minimum sebanyak 5 mg oksigen setiap liter air (5 ppm). Selebihnya bergantung kepada ketahanan organisme, derajat aktivitasnya, kehadiran pencemar, suhu air dan sebagainya. Oksigen terlarut merupakan faktor pembatas bagi kehidupan organisme. Perubahan konsentrasi oksigen terlaurut dapat menimbulkan efek langsung yang berakibat pada kematian organisme perairan. Sedangkan pengaruh yang tidak langsung adalah meningkatkan toksisitas bahan pencemar yang pada akhirnya dapat membahayakan organisme itu sendiri. Hal ini disebabkan karena oksigen terlarut digunakan untuk proses metabolisme dalam tubuh dan berkembang biak (Romimuhtarto, 1991). Selanjutnya Goldman dan Horne (1983), menyatakan bahwa oksigen terlarut dalam ekosistem perairan sangat penting untuk mendukung eksistensi organisme dan proses-proses yang terjadi didalamnya. Hal ini terlihat dari peranan oksigen selain digunakan untuk aktifitas respirasi organisme air juga organisme dekomposer dalam proses dekomposisi bahan organik dalam perairan. Respirasi di perairan memerlukan oksigen dari dalam air dan menghilangkan limbah karbon dioksida. Insang adalah tempat pertukaran gas terjadi pada sebagian besar jenis ikan, meskipun ada juga beberapa jenis ikan yang bernafas melalui kulit. Biasanya laju konsumsi oksigen dapat digunakan untuk mengukur intensitas metabolismenya. Laju ini dipengaruhi oleh ukuran ikan dan karakteristik air seperti suhu dan kandungan CO2 (Reddy, 1993). Oksigen dapat merupakan faktor pembatas dalam penentuan kehadiran makhluk hidup di dalam air. Penentuan oksigen terlarut harus dilakukan berkali kali di berbagai lokasi dengan tingkat kedalaman yang berbeda pada waktu yang 16 tidak sama (Sastrawijaya, 2000). Oksigen terlarut merupakan parameter penting bagi sistem kimia air laut maupun proses biologi perairan laut. Hal ini karena oksigen diperlukan dalam proses mineralisasi/dekomposisi bakteri dalam menguraikan bahan organik. Penurunan oksigen terlarut juga akan mempengaruhi kehidupan organisme melalui proses respirasi, dan reaksi oksidasi reduksi terhadap senyawa-senyawa kimia dalam air laut. 2.5.3. Nitrat (NO3) Nitrogen merupakan salah satu unsur penting bagi pertumbuhan organisme dan proses pembentukan protoplasma, serta merupakan salah satu unsur utama pembentukan protein. Di perairan, nitrogen biasanya ditemukan dalam bentuk amonia, amonium, nitrit (NO2) dan nitrat (NO3) serta beberapa senyawa nitrogen organik lainnya (Wardoyo, 1987). Pada umumnya nitrogen diabsorbsi oleh fitoplankton dalam bentuk nitrat dan amonia (NH3-N). Fitoplankton lebih banyak menyerap amonia dibandingkan dengan nitrat karena lebih banyak dijumpai diperairan baik dalam kondisi aerobik maupun anaerobik (Welch, 1980). Senyawa-senyawa nitrogen ini sangat dipengaruhi oleh kandungan oksigen dalam air, pada saat kandungan oksigen rendah nitrogen berubah menjadi amoniak dan saat kandungan oksigen tinggi nitrogen berubah menjadi nitrat. Nitrat adalah bentuk nitrogen utama di perairan alami. Nitrat merupakan salah satu nutrient senyawa yang penting dalam sintesa protein hewan dan tumbuhan. Konsentrasi nitrat yang tinggi diperairan dapat menstimulasi pertumbuhan dan perkembangan organisme perairan apabila didukung oleh ketersediaan nutrient (Welch, 1980). 2.5.4. Fosfat (PO4) Selain nitrogen, fosfor merupakan nutrien penting bagi pertumbuhan fitoplankton. Parson et al., (1984) menyatakan bahwa fosfor diperairan berada dalam tiga bentuk utama yaitu fosfor anorganik terlarut, fosfor organik terlarut dan fosfor partikulat. Wetzel (1983) menyatakan bahwa orthofosfat merupakan bentuk senyawa dengan unsur dasar P yang efektif bagi pertumbuhan fitoplankton. Selanjutnya Grahame (1987) menambahkan bahwa fosfor terlarut terutama berfungsi sebagai ortofosfat anorganik (PO4-) atau yang secara sederhana disebut fosfat (PO4). Goldman dan Horne (1983) menyatakan bahwa fitoplankton hanya dapat menggunakan fosfor dalam bentuk fosfat untuk pertumbuhannya. 17 Pada perairan alami ikatan senyawa fosfat umumnya berada pada ikatan Fe dan Al, sedangkan pada perairan basa, fosfat berikatan dengan kation natrium dan pada perairan netral berikatan dengan kalsium (Prescott, 1973). Konsentrasi fosfat pada perairan tawar dan laut memiliki kisaran yang hampir sama yaitu 1 – 3 mg/l, sementara kisaran fosfat yang optimum bagi pertumbuhan fitoplankton adalah 0.09 – 1.80 ppm (Sunarto, 2001). Konsentrasi fosfat dalam perairan alami pada umumnya tidak melebihi 0,1 ppm. Kandungan fosfat yang melebihi kebutuhan normal akan meningkatkan kesuburan perairan dan merangsang pertumbuhan fitoplankton (Wardoyo, 1987). Kadar fosfat yang baik di perairan akan meningkatkan produktivitas perairan. Sebagai indikator produktivitas perairan, keberadaan fitoplankton atau zooplankton dapat diketahui melalui kandungan fosfat ideal yang terkandung di perairan karena akan menjadi makanan utama bagi larva ikan. 18 III. METODE PENELITIAN 2.1 Lokasi dan Waktu Penelitian Penelitian dilakukan di Teluk Palabuhan Ratu Kecamatan Palabuhan Ratu, Jawa Barat. Studi pendahuluan dilaksanakan pada Bulan September 2007 untuk survey dan penetapan stasiun penelitian. Pengambilan sampel dan pengukuran di lapangan dilaksanakan pada malam hari dimusim barat satu kali dalam setiap bulan mulai Bulan November 2007 hingga Bulan April 2008. = Stasiun pengamatan Sumber: Peta Dishidros AL. 2007 Gambar 3 Peta Lokasi Penelitian dan Posisi stasiun pengambilan sampel di Teluk Palabuhan Ratu. 3.2 Penentuan stasiun penelitian Perairan Teluk Palabuhan Ratu terletak pada posisi geografis 6o57’- 7o07’ LS dan 106o22’-106o23’ BT dengan panjang pantai lebih kurang 105 km (LONLIPI 1975) membentuk cekungan yang menyolok dibagian selatan Pulau Jawa. Berdasarkan perbedaan ciri fisik maka lokasi stasiun penelitian dibagi atas 9 mencakup muara dan laut lepas. 19 Secara spasial, stasiun terdistribusi menjadi dua bagian mulai dari mulut muara sungai Cimandiri hingga yang mengarah ke perairan terbuka di Teluk Palabuhan Ratu. Kelompok pertama mewakili muara sungai yang terdapat di Teluk Palabuhan ratu yakni stasiun 1, 8 dan 9. Kelompok kedua di daerah laut lepas yang terdiri dari stasiun 2 hingga 7, dimaksudkan untuk mengetahui batasan distribusi spesies larva ikan tertentu melalui komposisi dan jumlah yang tertangkap dimasing-masing kedalaman (Gambar 3; Lampiran 6). Kedalaman stasiun masing-masing adalah stasiun 2 adalah 25-30 meter, stasiun 3 dan 4 dengan kedalaman 80-100 meter; stasiun 5 kedalaman > 450 meter; stasiun 6 dan 7 kedalaman > 400 (Gambar 3; Lampiran 6) Perbedaan kedalaman yang sangat tajam disebabkan oleh Topografi dasar laut (bathymetri) Teluk Palabuhan Ratu yang curam dengan kadalaman antara 3 - 4 meter dibagian pantai (perairan pantai/muara) sampai > 200 meter di bagian tengah perairan teluk, yang merupakan lereng kontinen (Continental Shelf) (PRTK & Dep ITK 2004). 3.3 Bahan dan Alat Bahan yang digunakan dalam penelitian ini berupa bahan-bahan kimia untuk analisis kualitas air, buku identifikasi larva, alat tulis dan botol sampel. Sedangkan alat yang digunakan adalah perahu nelayan, Global Positioning System (GPS Tipe Map 198C) untuk menentukan posisi stasiun pengamatan, termometer (Hg Pembacaan skala) untuk pengukuran suhu, flow meter (For Plankto net Model OSK 16168) untuk mengukur kecepatan arus dan layangan arus untuk melihat arah arus, handrefraktometer untuk pengukuran salinitas, EhpH meter (Schott Instrumen Lab 850) untuk mengukur tingkat keasaman, saringan, timbangan elektrik (AND GR 200), mikrometer (Celiper ketelitian 0,05 mm), mikroskop binokuler (Olympus CH2O) perbesaran 4 kali, water sampler, net larva (mesh zise 350-500 µm, diameter 60 cm) dan hand counter untuk menghitung jumlah individu larva ikan. 3.4 Pengumpulan Data dan Pengukuran Parameter Fisika Kimia Perairan Pengumpulan data dilakukan dengan pengukuran langsung dengan menggunakan termometer, flow meter, layangan arus dan titrasi Winkler untuk pengukuran oksigen langsung di lokasi penelitian. Pengukuran TSS (Total Suspension Solid), salinitas, pH, nitrat, fosfat dan silika dilakukan di laboratorium 20 Produktivitas Lingkungan (Proling) Fakultas Perikanan dan Ilmu Teknologi Kelautan IPB. Larva (Ichthyoplankton) dikumpulkan menggunakan net larva dengan menyisir kolom perairan secara horizontal sejauh 70-100 meter selama 3-5 menit. Penyisiran pada tiap stasiun dilakukan dengan tiga kali ulangan, Sampel dikumpulkan dan diawetkan dalam formalin 4% untuk selanjutnya diukur panjang dan ditimbang beratnya. Pengukuran panjang dan berat larva ikan dilakukan di Laboratorium Unit Rehabilitasi Reproduksi (URR) Fakultas Kedokteran Hewan IPB, kemudian diidentifikasi dengan menggunakan Petunjuk Identifikasi FAO (Smith dan Richardson, 1977); buku identifikasi larva ikan (Leis dan Carson-Ewart, 2000; dan Niera, et al. 1998). Parameter fisika kimia perairan yang diukur selama penelitian tercantum pada Tabel 1. Tabel 1. Pengukuran Parameter Fisika Kimia Perairan No A 1. 2. 3. 4. B 1. 2. 3. C 1. 2. 3. Parameter Fisika Suhu Arus Kekeruhan Gelombang Kimia Salinitas Tingkat keasaman DO Nutrien Nitrat Fosfat Silika Satuan Alat/metode o C cm/detik NTU m Termometer Floating method/ estimasi Turbidimeter Estimasi ppt pH mg/l Handfraktometer pH meter Titrasi winkler mg/l mg/l mg/l spectrofotometer spectrofotometer spectrofotometer 3.5 Analisis Data 3.5.1 Struktur Komunitas Ikan Indeks keanekaragaman dan dominansi digunakan untuk mengetahui pengaruh kualitas lingkungan terhadap komunitas larva ikan. Pengaruh kualitas lingkungan terhadap kelimpahan ikan selalu berbeda-beda tergantung pada jenis ikan, karena tiap jenis ikan memiliki adaptasi dan toleransi yang berbeda terhadap habitatnya. Indeks tersebut digunakan untuk memperoleh informasi yang lebih rinci tentang komunitas ikan. Indeks keanekaragaman dikemukakan oleh Shannon-Wiener diacu dalam Bengen (2000), yang dirumuskan sebagai berikut: 21 s H ' = ∑ ( pi Log 2 Pi ) i =1 Dengan: H’ = Indeks keaneragaman Shannon-Wiener S = Jumlah jenis (spesies) ni = jumlah total individu jenis larva i N = jumlah seluruh individu dalam total n Pi=ni/N = sebagai proporsi jenis ke-i Kriteria yang digunakan untuk menginterpretasikan keanekaragaman Shannon-Wiener yaitu: H’ < 1, keanekaragaman rendah 1-3 keanekaragaman tergolong sedang 3 >, keanekaragaman tergolong tinggi. Indeks dominansi digunakan untuk memperoleh informasi mengenai jenis ikan yang mendominasi pada suatu komunitas pada tiap habitat indeks dominansi yang dikemukakan oleh Simpson yaitu (Ludwig dan Reynold, 1988): s C = ∑ pi 2 i =1 Dengan C = Indeks dominansi Simpson S = Jumlah jenis (spesies) ni = jumlah total individu jenis larva i N = jumlah seluruh individu dalam total n Pi=ni/N = sebagai proporsi jenis ke-i Kriteria yang digunakan untuk menginterpretasikandominansi spesies ikan yaitu: Mendekati 0 = indeks semakin rendah atau dominansi oleh satu spesies ikan. Mendekati 1 = indeks besar atau cenderung dominansi oleh beberapa spesies ikan. 3.5.2 Pola Pemencaran/distribusi Populasi Pola penyebaran larva ikan dalam penelitian ini ditentukan dengan menggunakan Indeks Morisita (Iδ). Indeks ini tidak dipengaruhi oleh luas stasiun pengambilan sampel dan sangat baik untuk membandingkan pola pemencaran populasi (Brower et al, 1990). Rumus yang dipergunakan adalah: 22 ∑X Iδ = n 2 i −N N ( N − 1) dengan: Iδ = indeks distribusi Morisita N = jumlah seluruh individu dalam total n n = jumlah seluruh stasiun pengambilan sampel ∑Xi2 = kuadrat jumlah larva jenis i per stasiun untuk total n stasiun Nilai indeks morisita yang diperoleh diinterpretasikan sebagai berikut: Iδ < 1, pemencaran individu cenderung acak Iδ = 1, pemencaran individu bersifat merata Iδ > 1, pemencaran individu cenderung berkelompok. Untuk menguji kebenaran nilai indeks di atas, digunakan suatu uji statistik, yaitu sebaran Chi-Kuadrat dengan persamaan: x2 = dengan : x2 n n∑ X 2 −N N = Chi-Kuadrat = Jumlah pengamatan ∑X2 = Jumlah kuadrat larva jenis I yang ditemukan pada tiap stasiun N = Jumlah seluruh Individu Nilai Chi-Kuadrat dari perhitungan di atas di bandingkan dengan niali Chi-Kuadrat tabel statistik dengan selang kepercayaan 95% (α = 0,05). Apabila nilai X2 hitung lebih kecil dibandingkan dengan nilai X2 tabel maka tidak berbeda nyata yang berarti pola sebaran jenisnya bersifat acak. 3.5.3 Kelimpahan Larva Ikan Kelimpahan larva ikan yang didefinisikan sebagai banyaknya larva ikan persatuan luas daerah pengambilan contoh dihitung dengan menggunakan N = n / Vtsr rumus: dengan: N n = Kelimpahan Larva ikan ( ind/m3) = Jumlah Larva ikan yang tercacah (ind) Vtsr = Volume air tersaring (Vtsr = l x t x v) l : Luas bukaan mulut saringan t : lama waktu penarikan saringan (menit) v : Kecepatan tarikan (m/menit). 23 3.5.4 Kepadatan Populasi Kepadatan populasi menunjukkan rataan individu suatu jenis larva ikan perstasiun dari seluruh contoh yang diamati, yaitu menggunakan rumus: D = ∑Xi / n Dengan: ∑Xi n = jumlah total individu jenis larva i = luas seluruh stasiun contoh (jumlah keseluruhan Vtsr). Kepadatan populasi (Ind/m3) yang didapatkan akan digunakan untuk menganalisis tingkat keanekaragaman, keseragaman, dan dominansi serta pola penyebaran spesies larva. 3.5.5 Pengelompokan Habitat berdasarkan Indeks Similaritas Canberra. Nilai indeks similaritas ini digunakan untuk membandingkan kesamaan antara stasiun pengamatan berdasarkan parameter fisika kimia perairan dan dan larva ikan yang diperoleh selama penelitian (Bengen 1999). C= 1 N ⎡ X1 j − X 2 j ⎤ ⎥ ⎢ ∑ i =1 ⎢ X 1 j + X 2 j ⎥ ⎦ ⎣ n dengan: Ic = Indeks Canberra X1j = Nilai Parameter ke j stasiun 1 X2j = Nilai Parameter ke j stasiun 2 n = Jumlah parameter yang dihitung N = Jumlah total stasiun pengambilan contoh Pada penelitian ini terdapat 6 parameter fisika kimia air laut yang diukur yaitu suhu, salinitas, oksigen terlarut, pH, nitrat dan fosphat. Hasil perhitungannya dibuat dalam bentuk matriks similaritas Canberra, dan dari matriks ini dapat dilihat persentase kemiripan antar stasiun penelitian berdasarkan parameter fisika kimia perairan. Matriks dan dendrogram dibuat dengan menggunakan bantuan softwere minitab 14. 3.5.6 Hubungan Kelimpahan Larva Ikan dengan Karakteristik Fisika Kimia Perairan Untuk melihat fluktuasi kehadiran larva ikan disajikan dalam bentuk grafik dan dianalisis secara deskriptif. Untuk melihat hubungannya digunakan analisis regresi. 24 IV. HASIL DAN PEMBAHASAN 4.1. Kondisi Umum Teluk Palabuhan Ratu 4.1.1. Kondisi Oseanografi 4.1.1.1. Gelombang Berdasarkan hasil pengukuran di lapangan (Lampiran 1) terlihat keadaan oseanografi Bulan November 2007 – April 2008. keadaan laut disemua stasiun penelitian tergolong sama yaitu sekitar 0.2 hingga 0.7 meter, kecuali di stasiun 6 dan 7 yang menunjukkan bahwa di stasiun tersebut gelombangnya selalu lebih tinggi dibanding stasiun lainnya, dan pengukuran gelombang tertinggi di dapatkan pada Bulan November yaitu masa peralihan menjelang musim barat yaitu sekitar 1.3 meter. Hasil pengamatan pada Bulan Desember– Februari untuk sekali trip dalam setiap bulannya, tertinggi didapatkan adalah 0.7 meter dengan rerata setiap bulannya berkisar antara 0.31–0.39 meter, sedangkan hasil pengamatan berdasarkan skala Beaufort dapat dinyatakan bahwa dengan tinggi gelombang maksimum antara 4-4.5 m diduga kecepatan angin yang terjadi di perairan Teluk Pelabuhan Ratu antara 30-39 km/jam dengan kondisi permukaan laut gelombang sedang dengan bentuk yang lebih panjang, banyak buih dan sedikit percikan (PRTK & Dep ITK 2004). Adanya perbedaan kisaran ketinggian gelombang dengan hasil-hasil penelitian dan pengamatan terdahulu disebabkan karena sampling larva dilakukan pada saat kondisi perairan sedang tenang, dalam rentang waktu musim barat dan musim peralihan, sehingga didapatkan hasil pengukuran dengan rata-rata tinggi yang relatif sama dan lebih rendah dibanding rata-rata hasil pengukuaran dimusim yang sama. Variasi tinggi gelombang antar stasiun tidak jauh berbeda setiap kali sampling karena pelaksanaannya dilakukan dalam waktu yang sama. Kisaran tinggi gelombang dengan keberadaan larva dalam kaitannya dengan kondisi oseanografi yang diperoleh sangat sesuai bagi larva untuk mengadakan distribusi secara vertikal kepermukaan. 25 4.1.1.2. Arus Kondisi arus di perairan Teluk Palabuhan Ratu lebih dipengaruhi oleh adanya fenomena pasang surut. Kisaran rata-rata kecepatan arus perstasiun selama pengamatan di Teluk Palabuhan Ratu adalah 3 – 15.6 cm/dtk ke arah barat dengan kecepatan arus yang semakin melambat seiring dengan berkurangnya kedalaman, yaitu pada stasiun 1, 8 dan 9 yang kisarannya antara 3 – 4.6 cm/dtk. Kecenderungan yang sama diperlihatkan dalam pengukuran Operasi Widya Bahari 1992, diacu dalam PRTK & Dep ITK (2004), bahwa kecepatan arus pada saat pasang berkisar antara 5-16 cm/dtk dengan arah menuju mulut teluk. Perubahan arah arus berdasarkan pengaruh pasang surut dapat dilihat pada Gambar 2. Kisaran rata-rata arus setiap bulan yaitu Bulan November rata-rata kecepatan arus untuk keseluruhan stasiun hanya 6,9 cm/dtk, pada bulan ini peralihan dari musim timur ke musim barat masih berlangsung dan kecepatan arus meningkat kembali pada Bulan Desember hingga Maret dan menunjukkan kecepatan arus yang hampir sama yaitu 1 – 1.05 cm/dtk, karena antara rentang bulan-bulan ini telah memasuki musim barat dan pada bulan April menurun kembali seiring masuknya musim peralihan yaitu 9.28 cm/dtk. 4.1.2. Parameter Fisika Kimia 4.1.2.1. Suhu Permukaan Fluktuasi suhu selama pengamatan di Teluk Palabuhan Ratu kisarannya antara antara 26 - 29 oC. dengan rata-rata setiap bulannya berada diatas 27.5 oC dan dibawah 28.5 oC. Grafik fluktusi suhu permukaan dapat terlihat pada Gambar 4. Gambar 4 Fluktuasi suhu permukaan setiap bulan pengamatan 26 Kisaran suhu yang saling berdekatan disebabkan karena pengukuran dilakukan hanya di lapisan permukaan. Data yang hampir sama didapatkan oleh PRTK & Dep ITK (2004) yaitu sebaran suhu permukaan di Teluk Palabuhan Ratu berkisar antara 27.55 - 27.97 oC dengan kedalaman pengukuran maksimum sebesar 18 m. Hasil penelitian Pariwono et al. (1988) mendapatkan hasil yang sama diakhir Musim Timur antara September-Oktober yaitu 26.0oC dan di awal Musim Barat antara November-Desember sekitar 28.0 oC. Selain itu adanya perbedaan suhu permukaan laut di perairan selatan Jawa antara periode Musim Timur (JuliSeptember) dan Musim Barat (Desember-Mei) juga dikemukakan oleh Wyrtki (1961), yaitu masing-masing sebesar 25.6 - 26.2oC dan 28oC. Namun demikian, menurut Effendie (2000) kisaran suhu yang didapatkan masih sesuai dengan kisaran pertumbuhan dan perkembangan fitoplankton dan zooplankton sebagai indikator makanan bagi larva ikan. 29.5 Grafik suhu rata rata setiap bulan Pengamatan suhu (oC) 29 28.5 28 27.5 27 26.5 26 25.5 25 24.5 Nov Des Jan Feb Bulan Mar max Apr min mean Gambar 5 Nilai rata-rata suhu setiap stasiun pada bulan pengamatan Pariwono et al. (1988) mengemukakan bahwa terdapatnya fenomena perbedaan suhu yang relatif rendah pada Musim Timur dan Musim Barat menunjukkan adanya proses upwelling di perairan Teluk Palabuhan Ratu. Menurut Reddy (1993). Batas arus (konvergensi dan divergensi) dan kondisi oseanografi dinamis yang lain (seperti eddies), berfungsi tidak hanya sebagai perbatasan distribusi lingkungan bagi ikan, tetapi juga menyebabkan pengumpulan ikan pada kondisi ini. 27 Pengumpulan ikan-ikan yang penting secara komersil biasanya berada pada tengah-tengah pusaran arus, memudahkan migrasi larva ikan ke permukaan (migrasi pasif) seiring dengan terangkatnya lapisan massa air yang hangat dari dasar kepermukaan bersama nutrien dasar. Akumulasi plankton, telur ikan juga berada di tengah-tengah pusaran antisiklon. Pengumpulan ini bisa berkaitan dengan pengumpulan ikan dewasa dalam pusaran arus (melalui rantai makanan) (Reddy, 1993). Selain Karena terbawa upwelling, larva juga akan berusaha untuk menghindar dari efek suhu rendah dengan menyesuaikan diri terhadap iklim dan menempati daerah-daerah pantai yang suhunya lebih tinggi sehingga larva akan bermigrasi secara aktif. Coombs et al. (1985) mengemukakan bahwa tahap yang paling ideal untuk larva ikan adalah di daerah permukaan yang suhunya lebih tinggi. 4.1.2.2. Salinitas Hasil pengukuran salinitas menunjukkan bahwa salinitas permukaan antar stasiun semakin menurun ke arah muara, stasiun 1 berada tepat dimulut muara memiliki nilai salinitas yang hampir sama setiap bulannya yaitu antara 5 – 7 o/oo. Pengukuran pada Bulan Desember 1993 menunjukkan bahwa salinitas perairan Teluk Palabuhan Ratu terpengaruh oleh masukkan massa air Sungai Cimandiri yang memilki salinitas 5 o/oo (Sanusi dan Atmodipoera, 1993). Gambar 6 Fluktuasi salinitas permukaan setiap bulan pengamatan Namun demikian di perairan bagian tengah teluk perbedaan nilai salinitas permukaan lautnya relatif kecil terlihat pada hasil pengukuran di enam stasiun (Stasiun 2 – 7) menunjukkan nilai salinitas yang relatif sama dan tidak fluktuatif 28 yaitu antara 33-35 o/oo, sedangkan stasiun 8 dan 9 masing masing memiliki nilai salinitas yang fluktuatif antara 20-31o/oo dan 25-29 o/oo kedua stasiun ini masih relatif dekat jaraknya dengan muara sehingga sangat fluktuatif perubahannya (Gambar 6 dan Lampiran 1). Salinitas di perairan Teluk Palabuhan Ratu dipengaruhi oleh keadaan musim dengan faktor utama adanya masukan massa air sungi yang bermuara (terdapat 7 buah sungai). Transport massa air sungai terutama pada Musim Barat mengakibatkan turunnya salinitas perairan pantai Teluk Palabuhan Ratu. Salinitas berpengaruh terhadap tingkah laku ikan ataupun distribusi ikan. Hasil pengukuran salinitas yang diperoleh di lapangan dengan keberadaan larva dimasing-masing stasiun menunjukkan kisaran yang sesuai bagi, terutama pada saat bermigrasi untuk mengadakan perlindungan dari arus atau gelombang yang kuat. Hal ini di perkuat dengan di temukannya beberapa spesies larva ikan yang bersal dari laut lepas di stasiun 1, 8 dan 9. 4.1.2.3. Oksigen Terlarut (DO) Pada umumnya konsentrasi oksigen yang terlarut di lapisan permukaan pada lokasi yang sama di Teluk Palabuhan Ratu berkisar antara 4.4 - 5.0 mg/l pada siang hari (PRTK & Dep ITK, 2004), sedangkan data oksigen terlarut yang didapatkan saat pengamatan pada lapisan permukaan di stasiun 1 adalah 2.4 8.9 mg/l, stasiun 2 antara 2.03 - 6.5 mg/l, stasiun 8 dan 9 masing-masing sebesar 2.03 - 6,09 dan 2.4 – 6.09 mg/l. Rendahnya nilai DO yang diperoleh dikarenakan sampling dilakukan pada malam hari dalam kondisi oseanografi yang relatif tenang sehingga difusi dengan atmosfir sangat sedikit terjadi dan keadaan tanpa fotosintesis sehingga tidak ada input DO dari tumbuhan air khususnya fitoplankton dan juga aktivitas respirasi organisme perairan yang cenderung hanya memanfaatkan oksigen dimalam hari. 4.1.2.4. Tingkat Keasaman (pH) Tingkat keasaman yang diperoleh selama pengamatan di Teluk Palabuhan Ratu menunjukkan nilai yang hampir sama pada keseluruhan stasiun yaitu sekitar 8.1 - 8.2 kecuali stasiun 1 hanya sekitar 7.6 - 7.9. Sebaran pH stasiun 2 - 9 relatif konstan, menurut Romimuhtarto dan Juwana (2001) hal ini berkaitan dengan kemampuan teluk menstabilkan perubahan pH. 29 4.1.2.5. Tingkat kekeruhan Kisaran nilai kekeruhan selama pengamatan di lokasi penelitian adalah 0.5−78 NTU, nilai kekeruhan yang terendah umumnya didapatkan dibagian tengah teluk dan semakin berkurang nilai NTU-nya seiring pertambahan kedalaman, sebaliknya semakin meningkat seiring berkurangnya kedalaman terutama 3 stasiun yang dekat dengan mulut muara Sungai Cimandiri yaitu stasiun 1, 8 dan 9 (stasiun muara). Untuk stasiun laut lepas (stasiun 2 - 7) yang berada dibagian selatan hingga bagian tengah muara nilai NTU relatif konstan dan sama rendahnya. Meningkatnya kekeruhan di stasiun muara disebabkan oleh padatan tersuspensi dalam perairan yang dapat berupa material anorganik dan organik. Material anorganik dapat berupa pasir halus dan mineral lumpur (PRTK & Dep ITK, 2004). Pada perairan pantai masukan partikel penyebab kekeruhan ini umumnya berasal dari aliran sungai (DAS), air limpasan dari darat (run off), dan dry deposisiton yang masuk ke muara Sungai Cimandiri. 4.1.3. Variabilitas Nutrien antar stasiun Berdasarkan hasil pengamatan kandungan nutrien yang didapatkan dalam penelitian (November 2007 – April 2008) rata-rata dari seluruh stasiun yang diamati sangat bervariasi. 4.1.3.1. Nitrat Secara spasial konsentrasi nitrat nampak tidak menunjukkan perbedaan setiap bulannya terutama di stasiun 3 (0.01-0.069 mg/l) dan stasiun 7 (0.0020.097 mg/l). Grafik menunjukkan bahwa kisaran konsentrasi antar stasiun sangat fluktuatif dan pola konsentrasi antar bulan yang hampir sama. Nilai terendah atau tidak dapat terdeteksi (TT) terjadi pada Bulan Januari (stasiun 3, 5 dan 6); Bulan Februari (stasiun 4) dan Maret (stasiun 6 dan 4). Konsentrasi nitrat tertinggi di dapatkan di stasiun 1, 2, 8 dan 9. Tingginya kandungan nitrat tersebut disebabkan karena letak stasiun yang lebih berdekatan dengan dermaga dan pemukiman di sebelah barat teluk dan masih menerima input dari sungai di sebelah selatan teluk sehingga penguraian dan nitrifikasi cenderung lebih tinggi dibanding stasiun lainnya. 30 Gambar 7 Grafik konsentrasi nitrat setiap stasiun pengamatan Secara teoritis tingginya konsentrasi nitrat tersebut dinilai normal karena kisaran nitrat umumnya akan semakin tinggi dengan wilayah yang dekat pantai, terlebih pada stasiun 1, 2, 8 dan 9 kedalaman perairan masih rendah. Hasil absorbance pada Bulan Januari dan April tidak dapat mendeteksi jumlah nitrat atau kandungan nitratnya terlalu sedikit untuk dideteksi melalui metode absorbance. 0.1 Sebaran Rata-rata Jumlah Nitrat Setiap Bulan Pengamatan Nitrat (mg/l) 0.08 0.06 0.04 0.02 0 -0.02 nov dec jan Bulan feb mar max apr min mean Gambar 8. Rata-rata Sebaran Jumah Nitrat Setiap Bulan Pengamatan Dalam grafik sebaran rata-rata jumlah konsentrasi nitrat pada Bulan November terlihat lebih tinggi, kemudian menurun secara gradual pada Bulan Desember dan Januari sebaliknya pada Bulan Februari dan Maret meningkat kembali secara gradual dan terakhir Bulan April sebaran rata-rata nitrat mengalami penurunan. Keadaan ini disebabkan oleh kondisi seasonal antar bulan yang berbeda. 31 Nitrat merupakan faktor pembatas bagi produktivitas di laut, sesuai dengan pernyataan Mackenthum (1969) bahwa bila kandungan nitrat lebih dari 0.1 mg/l masih dapat digunakan untuk pertumbuhan fitoplankton sedangkan kurang dari 0.1 mg/l merupakan faktor pembatas bagi perairan tersebut. 4.1.3.2. Fosfat Dari data pengamatan terlihat bahwa konsentrasi fosfat nampaknya lebih tinggi dibandingkan dengan konsentrasi senyawa nitrat dan hal ini diperkirakan terkait dengan inputan daratan. Konsentrasi fosfat nampak memiliki pola yang sama dengan senyawa nitrat, umumnya konsentrasi akan rendah di stasiunstasiun dengan kedalaman yang tinggi dengan variasi antara 0.0043 mg/l hingga kisaran dibawah 0.02 mg/l. konsentrasi fosfat dibawah nol atau tidak terdeteksi didapatkan pada Bulan April (stasiun 4). Gambar 9 Grafik konsentrasi fosfat setiap stasiun pengamatan Khusus peningkatan konsentrasi fosfat di stasiun yang dekat dengan pantai (stasiun 1, 2, 8 dan 9) diperkirakan akibat adanya proses resuspensi sedimen yang dapat melarutkan sebagain kandungan fosfat dalam partikel ke kolom air, dan dimungkinkan oleh input daratan yang cukup besar setelah terjadinya run off. 32 Phosphat (mg/l) 0.1 Sebaran Rata-rata Jumlah Phosphat Setiap Bulan Pengamatan 0.08 0.06 0.04 0.02 0 -0.02 nov dec jan Bulan feb mar max apr min mean Gambar 10 Rata-rata sebaran jumah fosfat setiap bulan pengamatan Tidak jauh berbeda dengan sebaran rata-rata nitrat, fosfat juga mengalami fluktuasi secara gradual dengan pola yang sama dengan nitrat. Terjadi fluktuasi fosfat setiap bulannya sangat tergantung dari kondisi seasonal yang berbeda pada setiap bulannya. 4.1.3.3. Silika Hasil pengamatan menunjukkan bahwa kandungan silika setiap bulan pengamatan pada stasiun 1 menunjukkan nilai yang fluktuatif, dan dari rata-rata didapatkan 2.63 mg/l jauh lebih tinggi dibanding 8 stasiun lainnya yang rata ratanya berkisar antara 0.20 – 1.24 mg/l. Gambar 11 Konsentrasi silika perbulan pengamatan Seperti halnya kelompok hara lain, silika juga menunjukkan peningkatan pada stasiun yang dekat dengan dasar atau yang berkedalaman rendah, Konsentrasi yang tinggi pada perairan Palabuhan Ratu terkait dengan input daratan, terutama di stasiun muara disebakan oleh adanya aktivitas mega proyek 33 pembangunan PLTU Cimandiri. Hal ini mengingat bahwa silika umumnya dapat berasal dari proses weathering dari daratan seperti erosi karena arus aliran sungai maupun akibat tiupan angin pada wilayah permukaan yang terbuka seperti terlihat pada berbagai wilayah sekitar Palabuhan Ratu yang berbukit dan terbuka yang sangat potensial menimbulkan proses-proses tersebut. 0.1 Sebaran Rata-rata Jumlah Silika Setiap Bulan Pengamatan Silika (mg/l) 0.08 0.06 0.04 0.02 0 -0.02 nov dec jan feb Bulan mar max apr min mean Gambar 12 Rata-rata sebaran jumlah silika (Si) setiap bulan pengamatan. Hasil pengukuran konsentrasi silika menunjukkan bahwa nutrien ini memiliki konsentrasi sangat tinggi dibanding nitrat dan fosfat. Karena terpengaruh oleh kondisi seasonal seperti musim hujan dan musim peralihan, silikat juga menunjukkan pola fluktuasi yang sama seperti fosfat dan nitrat yaitu Bulan November terlihat lebih tinggi, kemudian menurun secara gradual pada Bulan Desember dan Januari. Sebaliknya pada Bulan Februari dan Maret meningkat kembali secara gradual dan terakhir sebaran rata-rata mengalami penurunan pada Bulan April. 4.2. Pengelompokan Habitat Hasil pengelompokan stasiun dari keenam bulan pengamatan menunjukkan bahwa masing-masing stasiun tergabung kedalam tiga kelompok habitat yaitu habitat muara, habitat transisi dan habitat laut lepas. Pada Bulan November (Gambar 13a) kelompok pertama berasal dari stasiun 2,3,4,5,6 dan 7 (99.4%) kelompok kedua dari stasiun 8 dan 9 yang terikat dengan kelompok pertama (78.9% dan 76.4%) dan kelompok ketiga adalah stasiun 1, yang terikat dengan 2 kelompok sebelumnya (35.8%). Kesamaan tertinggi adalah antara stasiun 4 dan 7 yaitu 99.4% (Gambar 16 dan Lampiran 8) sedangkan kesamaan terkecil adalah stasiun 1 dan stasiun 2 (35.8%). 34 Bulan Desember dan Januari (Gambar 13a dan 13b) terdiri atas stasiun 2 hingga stasiun 7, dengan similaritas terdekat antar stasiun 4 dan 7 (99.2%) dan yang terjauh antara stasiun 2 dan 3 (97.30%). Kelompok kedua antara stasiun 8 dan 9 (80.2 dan 77.3%). Kelompok ketiga yaitu stasiun 1. secara keseluruhan memiliki tingkat similaritas yang paling jauh yaitu 40.8%, sedangkan yang paling dekat adalah antar stasiun 4 dan 7 sebesar 99.2% yang tergabung dalam kelompok pertama. Pada Bulan Januari similaritas terdekat didapatkan pada stasiun 2 hingga 9 sebagai kelompok pertama, masing-masing yang terdekat adalah stasiun 4 dengan 7 (99.2%); stasiun 4 dengan 6 (98.3%) yang terkait dengan stasiun sebelumnya, kemudian stasiun 4 dan 5 (98.1%); stasiun 3 dengan 4; 2 dengan 3; 2 dengan 8 dan 2 dengan 9 (97.9%, 97.3% 80.2%, 77.3%). Stasiun dengan similaritas terjauh 40.8% adalah stasiun 1 sedangkan stasiun 2 termasuk kedalam kelompok kedua (Gambar 13 Lampiran 7). (a) (b) 35 (c) Gambar 13 Dendrogram similaritas antar Stasiun pada Bulan: a) November; b) Desember dan c) Januari. Similaritas antar stasiun pada Bulan Februari (Gambar 14a) yaitu stasiun 2- 7, kelompok kedua stasiun 8 dan 9 dan kelompok ketiga adalah stasiun 1. Similaritas dari masing masing kelompok adalah: kelompok pertama dengan kisaran 97.38%-99.59%, kelompok kedua 64.1%-86.1% dan kelompok ketiga 47.9% (Gambar 13 Lampiran 7) Pada Bulan Maret dan April (Gambar 14b dan 14c) pengelompokan habitatnya sama yaitu berasal dari stasiun yang sama. kelompok pertama terdiri atas stasiun 4 dan 7 (99.8%); disusul stasiun 4 dan 5 (99.4%) dan Stasiun 4 dan 6 (99.1%). Kelompok kedua yaitu stasiun 2 dan 3 (98.9%); stasiun 2 dan 4 yang terikat dengan stasiun sebelumnya (97.9%); stasiun 2 dan 8 yang terikat dengan stasiun 2 dan 4 (91.9%) dan stasiun 2 dan 9 yang saling terikat dengan semua stasiun dalam kelompok kedua dan kelompok pertama (63.1%). Kelompok ketiga adalah stasiun 1 yang terikat dengan dua kelompok sebelumnya (39.4%). Kesamaan tertinggi pada Bulan Maret dan April adalah antara stasiun 2 dan 3 sebesar 99.8% dan terendah adalah stasiun 1 dan 9 sebesar 39.4%. hanya saja pada Bulan April tingkat similaritas terdekat terjadi antara stasiun 2 dan 3 (99.4%) disusul stasiun 4 dan 6 (99.3%); stasiun 4 dan 7 (99.1%) kemudian stasiun 4 dan 5 (98.7%); yang terakhir stasiun 2 dan 4 (97.7%). Stasiun 1 dan 2 memiliki similaritas paling kecil yaitu sebesar 32.7%. Similaritas terbesar antar stasiun pada bulan ini adalah antara stasiun 2 dan 3 sebesar 99.4%. (Gambar 13, Lampiran 7). 36 (a) (b) (c) Gambar 14 Dendrogram similaritas antar stasiun pada bulan: a) Februari; b). Maret dan c). April 37 Pada stasiun 1 kisaran persentase similaritasnya sangat jauh sehingga dianggap memiliki ciri habitat sendiri. Ciri habitat yang paling membedakan antara stasiun 1 dengan stasiun lainnya lebih kepada hampir semua parameter. Parameter yang paling berpengaruh terutama: salinitas yang rendah, kekeruhan yang tinggi dan kandungan nutrien yang melebihi stasiun yang lain. Keadaan ini disebabkan stasiun ini berada di depan mulut muara Sungai Cimandiri, sehingga stasiun 1 dikelompokkan atas habitat muara. Selain dipengaruhi oleh faktor oseanografi dan musim, perbedaan similaritas antar stasiun di habitat muara, disebabkan oleh adanya aktivitas pembangunan PLTU di dekat muara Sungai Cimandiri sehingga input partikel penyebab kekeruhan lebih cepat mengalir ke sungai jika terjadi hujan melalui aliran sungai dan run off. Habitat transisi dibedakan atas stasiun 8 dan 9. Parameter yang paling membedakannya dengan stasiun muara lebih karena kedua stasiun ini telah mendapat pengaruh dari laut air laut yang ada di kedua stasiun ini masih mendapat pengenceran dari limpasan sungai. Kedua stasiun ini merupakan stasiun yang memiliki perubahan yang sangat fluktuatif sehingga nilai parameternya berubah ubah sesuai dengan keadaan cuaca, keadaan ini menjadi salah satu sebab terbentuknya habitat transisi oleh hasil pengelompokan similaritas. Walaupun nilai similaritasnya cenderung mendekati stasiun laut lepas antara 70-80%, tetapi karakter signifikan yang paling dianggap membedakannya adalah kekeruhan dan salinitas serta kandungan nutrien dibeberapa periode bulan pengamatan. Habitat ketiga dibedakan atas habitat laut lepas,yang terdiri atas stasiun 2 - 7. Keadaan fisika kimia yang tidak fluktutif menyebabkan ke enam stasiun ini selalu mengelompok terutama karena kandungan parameter kimia dan nutrien yang ditemukan cenderung berada pada kisaran yang sama setiap bulannya, nilai parameter ini yang membuat similaritas hanya bertukar-tukar antar sesama stasiun di habitat laut lepas. Selain itu antara stasiun transisi dan laut lepas memiliki kedekatan di atas 50% karena dimungkinkan oleh tingginya turbulensi perairan karena semakin dekatnya musim barat pada bulan November dan masih adanya pengaruh musim barat pada bulan Maret dan April. Sedangkan stasiun 1 yang cenderung berdiri sendiri sebagai suatu habitat terpisah oleh similaritas yang sangat jauh disebabkan karena stasiun ini berada dimulut sungai dan karena tingginya intensitas hujan di daerah daratan yang terbawa aliran sungai menuju ke laut, 38 dan besarnya volume air sungai yang memasuki muara hampir tidak dapat tergeser oleh pasang surut di muara, sehingga stasiun 1 hanya sedikit sekali mendapat pengaruh dari laut. 4.3. Struktur Komunitas Larva Ikan 4.3.1. Komposisi Jenis Berdasarkan hasil penelitian yang telah dilakukan di Perairan Teluk Palabuhan Ratu pada 9 stasiun dengan pendekatan kualitatif ditemukan komunitas larva ikan sebanyak 31 spesies masing-masing 10 ordo dan 26 famili (Tabel 2 Lampiran 2). Tabel 2 Komunitas Ikan dan kepadatan individu selama bulan pengamatan di Teluk Palabuhan Ratu. No 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 Spesies Megalops cyprinoides Mugil sp. P. saltarix S. spinus Xenodermicthys N. macropterus Lutjanus spp. Ostracion spp. Microcanthus spp. Platycephalus sp. Kuhlia marginata S. cephalotes Cygnoglossus sp. Leiognathus spp. Terapon terapon A. marianus Aseraggodes spp. B. japonicus Kyphosus sp. S. canaliculatus Urolophus spp. Liza sp. Siganus javus S. linneatus Abudefduf sp. Apogon. sp. Pseudocaranx sp. Genus Megalops Mugil Pomatomus Siganus Xenodermicthys Nemadactylus Lutjanus Ostracion Microcanthus Platycephalus Kuhlia Siphamia Cynoglossus Leiognathus Terapon Ambassis Aseraggodes Bregmaceros Kyphosus Siganus Urolophus Liza Siganus ‐ Siganus Abudefduf Apogon Pseudocaranx Family Congridae Gobidae Elopidae Mugilidae pomatomidae Siganidae Alepochepalidae Cheilodactylidae Lutjanidae Ostraciidae Microcanthidae Platycephalidae Kuhlidae Acropomatidae Cynoglossidae Leiognathidae Terapontidae Ambassidae Soleidae Bregmacerotidae Serranidae Kyphosidae Siganidae Urolopidae Mugilidae Siganidae Phocichtydae Siganidae Pomacentridae Apogonidae Carangidae Ordo Anguilliformes Perciformes Elopiformers Mugiliformes Perciformes Perciformes Osmeriformes Perciformes Perciformes Tetraodontiformes Perciformes Scorpaniformes Perciformes Perciformes Pleuronectiformes Perciformes Perciformes Perciformes Pleuronectiformes Gadiformes Perciformes Perciformes Perciformes Myliobatiformes Mugiliformes Perciformes Perciformes Perciformes Perciformes Perciformes Perciformes Nama Indonesia Sidat Impun nener Belanak Baronang kakap Buntal Tokek Kerung Bête-bete Gamasi Sebelah Sunu Baronang Belanak Baronang Baronang Damsel Titang Kepadata n (ind/m3) 339 177 172 138 100 100 97 71 67 57 52 49 47 45 45 43 38 35 31 28 24 23 21 19 17 16 12 9 9 7 2 39 4.3.2. Kepadatan Individu dan Distribusi Larva Ikan Hasil perhitungan kepadatan induvidu dari komposisi jenis Family dan spesies yang ditemukan dalam penelitian ini yaitu Congridae (339 ind/m3); Gobiidae (177 ind/m3); Megalops cyprinoides (172 ind/m3); Mugil sp. (138 ind/m3); P. saltarix dan S. spinus (100 ind/m3); masing-masing lebih dari 100 ind/m3 dan merupakan spesies yang tertinggi kepadatannya. Kepadatan yang terendah didapatkan pada spesies Urolophus spp. (19 ind/m3); Liza sp.(17 ind/m3); Siganus javus (16 ind/m3); Pocicthydae (12 ind/m3); S. linneatus dan Abudefduf sp. (9 ind/m3); A. sp. (7 ind/m3) dan Pseudocaranx sp. (2 ind/m3). Hasil perhitungan kepadatan individu dapat dilihat dalam Tabel 2. 4.4. Keanekaragaman dan Dominansi Hasil analisis indeks keanekaragaman menunjukkan bahwa habitat muara memiliki keanekaragaman yang tergolong tinggi karena nilainya lebih besar dari tiga (>3) atau antara 3.5 hingga 4.0, kecuali pada Bulan November nilai keanekaragamannya masih tergolong sedang (=3). Sedangkan nilai Indeks dominansi pada habitat ini semuanya menunjukkan bahwa indeksnya besar atau cenderung di dominansi oleh satu spesies ikan, kecuali Bulan November perolehan spesies didominansi oleh beberapa spesies ikan. Stasiun laut lepas nilai keanekaragamannya bervariasi antara tinggi dan sedang, nilai keanekaragaman tertinggi yang didapatkan adalah adalah 3.4 hingga 3.3 atau lebih rendah dibanding nilai keanekaragaman tertinggi yang didapatkan pada stasiun muara. Sedangkan keanekaragaman sedang pada habitat laut lepas nilainya antara 1 hingga 3. Nilai indeks dominansi pada habitat laut lepas pada Bulan November, menunjukkan bahwa pada bulan ini perolehan spesies didominansi oleh beberapa jenis. Sedangakan pada bulan-bulan lainnya menunjukkan keadaan yang sama dengan habitat muara yaitu hanya didominansi oleh satu jenis saja. Perhitungan indeks keanekaragaman dan dominansi larva ikan dapat dilihat pada Tabel 3. 40 Tabel 3 Hasil perhitungan indeks keanekaragaman dan dominansi larva ikan di Teluk Palabuhan Ratu setiap bulan pengamatan. Keanekaragaman Muara Laut lepas Transisi Bulan st1 st2 st3 st4 st5 st6 st7 st8 st9 Nov Des Jan Feb Mar Apr 3.0 3.9 3.5 3.8 3.8 4.0 2.5 2.2 3.4 1.7 3.4 3.3 3.9 3.0 2.6 2.5 3.0 2.5 1 1.9 ‐ 1 ‐ ‐ ‐ 1 ‐ 1 ‐ ‐ ‐ 1.0 1.0 ‐ ‐ ‐ ‐ ‐ 2.5 ‐ ‐ 2.0 2.3 0.9 2.2 1.6 1.9 3.7 3.8 2.2 0.7 3.5 2. 9 0.12 0.07 0.05 0.07 0.04 0.04 Dominansi 2.1 ‐ 0.1 ‐ ‐ ‐ 0 0 ‐ ‐ ‐ ‐ Nov Des Jan Feb Mar Apr 1.02 0.07 0.10 0.07 0.09 0.07 1.86 0.15 0.05 0.29 0.05 0.06 ‐ ‐ ‐ ‐ ‐ ‐ ‐ ‐ ‐ 0.04 ‐ ‐ 0 0.16 0.50 0.21 0.32 0.18 0.02 0.08 0.22 0.68 0.08 0.17 Indeks keanekaragaman di habitat transisi memiliki nilai yang sangat variatif, ini terlihat dari kisaran nilai yang dimiliki indeks keanekaragamannya yaitu: yaitu tergolong tinggi nilainya antara 3.5 hingga 3.8 dan nilai indeks keanekaragaman sedangnya antara 1.6 hingga 2.9. Di habitat transisi, keanekaragaman yang tergolong rendah hanya didapatkan pada Bulan Januari dan Februari. Untuk Indeks dominansi keadaannya sama dengan habitat muara dan laut lepas perolehan spesies selalu didominansi oleh satu spesies saja. 4.5. Keterkaitan Struktur Komunitas dengan Karakteristik Habitat Pada bagian ini, pengelompokan habitat didasarkan atas keberadaan larva ikan masing-masing di stasiun yang telah dipisahkan similaritasnya (Gambar 16 dan 17 Lampiran 8) dan juga berdasarkan kepadatan antar stasiun (Gambar 14 dan 15). Secara umum sekitar 23 spesies tertangkap di daerah muara dan di stasiun yang dekat dengan pelabuhan (stasiun 1, 2, 3, 8 dan 9). Tujuh spesies selebihnya tertangkap di stasiun yang tersebar di tengah muara (stasiun 4, 5, 6 dan 7). 41 4.5.1. Habitat Muara 4.5.1.1. Komposisi Larva Ikan Habitat Muara Family dan spesies yang banyak tertangkap di habitat muara adalah Congridae, Siganus spp., Liza spp. kemudian Megalops cyprinoides, Mugil sp, Gobidae, Xenodermicthys, Siganus spinus dan Ostracion. Spesies ini lebih banyak didapatkan di stasiun muara, pada umumnya spesies ini sangat tergantung keberadaannya pada fluktuasi salinitas atau input terhadap sistem di daerah ini. Karakteristik lingkungan yang diduga berpengaruh terhadap populasi larva adalah fisik dan kimia air arus dan kandungan organik. Arus memberikan dampak langsung terhadap struktur sedimen, pasokan nutrien dan pasokan oksigen. 4.5.1.2. Kelimpahan Larva Muara Hasil perhitungan kelimpahan larva ikan selama pengamatan didapatkan tertinggi di habitat muara 12-14 ind/m3 dengan keseluruhan rata-rata setiap bulannya lebih dari 13 ind/m3. Hasil perhitungan kelimpahan larva ikan terlihat pada Tabel 4. Tabel 4 Data hasil perhitungan kelimpahan larva ikan setiap bulan pengamatan (ind/m3). Kelimpahan (ind/m3) Muara Bulan Nov Des Jan Feb Mar Apr Rata‐rata Laut lepas Transisi st1 st2 st3 st4 st5 st6 st7 st8 st9 13 14 12 12 14 14 5 2 4 3 4 4 6 3 3 2 3 2 1 1 0 1 3 1 0 1 1 1 0 0 0 1 1 0 0 0 1 0 1 2 1 0 4 16 2 3 3 2 12 28 3 3 99 7 3.17 1.17 0.5 0.3 0.83 5 25.3 13.17 3.667 Kelimpahan spesies yang lebih tinggi di stasiun muara dipengaruhi oleh faktor lingkungan antara lain faktor arus, salinitas dan nutrien. Stasiun ini memiliki karakteristik salinitas yang tidak stabil dan selalu fluktuatif, dan nutrien yang cukup melimpah. 42 4.5.1.3. Stadia Larva Ikan Muara Hasil pengelompokan ukuran dan stadia larva ikan menunjukkan bahwa di habitat muara pada semua bulan pengamatan didominasi oleh ukuran post larva terutama dari spesies Congridae, Gobidae, Megalops cyprinoides, Mugil Sp., Pomatomus saltarix, Siganus spinus, Xenodermicthys, Nemadactylus macropterus (Semua bulan); Kuhlia marginata dan Siphamia cephalothes (November); Terapon terapon, Serranidae (Januari – April), Liza sp (Desember, Januari dan Maret) dan Ambassis marianus (Desember) Sedangkan stadia juwana ditemukan Platycephalidae dan Leiognathus spp disemua bulan, Ostracion (November, Februari dan Maret), Siganus javus (Desember, Maret dan April). Stadia prolarva ditemukan Pocicthydae (November), Nemadactylus macropterus (Desember, Januari dan April), Cygnoglassidae (Desember, Februari-April), Siganus spinus dan Mugil sp. (Maret dan April). Dan satu-satunya spesies yang ditemukan dalam stadia yolk sac di habitat muara adalah Abudefduf sp. pada Bulan Februari (Lampiran 4). Secara keseluruhan stadia post larva dan juwana menempati proporsi terbesar untuk semua spesies di habitat muara secara spasial maupun temporal. 4.5.2. Habitat Transisi 4.5.2.1. Komposisi Larva Ikan Habitat Transisi Bagian Habitat transisi memiliki karakteristik lingkungan yang paling menyolok diantara 9 stasiun lainnya karena memiliki karakteristik lingkungan yang paling fluktuatif, bahkan kisaran fluktuatifnya selalu melebihi habitat muara. Secara umum spesies yang ditemukan pada habitat transisi sama dengan spesies yang terdapat di habitat muara. Namun demikian memiliki kelimpahan dan biomassa yang lebih rendah dari hasil sampling dibanding jumlah setiap spesies yang ditemukan di habitat muara. Spesies yang ditemukan antara lain Pomatomus saltarix; Congridae dan Mugil. Spesies kebanyakan berasal dari jenis yang bersifat eurihaline dan biomassa terbesar dimiliki oleh Congridae yang bersifat anadromous. Beberapa jenis larva ikan laut dan sejumlah telur ikan didapatkan di stasiun Ini larva tersebut antara lain dari famili Carangidae, Megalopidae dan Bregmacentrotidae. Selain karena faktor fisik lingkungan, larva ikan juga mengadakan migrasi untuk berbagai kebutuhan hidupnya, karena jika secara fisiologis tidak sesuai untuk bermigrasi, maka larva tidak akan mudah ditemukan pada kondisi salinitas 43 yang berbeda. Perubahan salinitas tersebut akan mempengaruhi pengaturan osmotik ikan dan menentukan daya apung dari telur-telur ikan pelagis. Menurut McMulen dan Middaugh (1985) menyatakan bahwa beberapa spesies ikan dapat hidup pada salinitas yang berbeda-beda, tetapi ada pula yang hanya dapat hidup pada salinitas tertentu. 4.5.2.2. Kelimpahan Larva Ikan Transisi Hasil perhitungan kelimpahan larva ikan selama pengamatan didapatkan kisaran tertinggi pada Bulan Desember dengan kisaran tertinggi sekitar 14 ind/m3 dan Bulan Maret pada kisaran tertinggi mencapai 99 ind/m3. Kelimpahan ratarata tertinggi setiap bulan di peroleh pada habitat transisi lebih dari 15 ind/m3 (Tabel 3). Perbedaan habitat juga akan mempengaruhi jumlah kelimpahan spesiesnya karena setiap spesies berbeda freferensinya terhadap kebutuhan lingkungan. Menurut Nagelkerken (1981) kedalaman bukan merupakan faktor pembatas bagi distribusi vertikal ikan, tetapi habitat yang sesuai memegang peranan yang penting bagi keberadaan suatu jenis. dikemukakan juga bahwa pada daerah yang terbuka atau yang terlindung mendapat masukan jenis dan jumlah larva ikan yang sama, tetapi karena adanya perbedaan tipe habitat maka pada akhirnya jenis larva yang dapat bertahan menjadi berbeda. 4.5.2.3. Stadia Larva Ikan Transisi Secara keseluruhan, habitat transisi memiliki stadia larva yang bergam dibadingkan kedua habitat lainnya. Stadia larva ikan yang didapatkan setiap stasiun dari spesies yang sama (Lampiran 4) Spesies dengan stadia juwana yang ditemukan di habitat transisi antara lain Kuhlia marginata dengan jumlah yang terbesar ditemukan pada Bulan November, dan beberapa ekor pada Bulan Maret dan April. Spesies yang ditemukan stadia prolarvanya dihabitat transisi antara lain dari famili Megalopidae pada Bulan November spesies ini didominasi oleh stadia post larva di habitat muara dengan kisaran panjang antara 20 – 28 mm, beratnya antara 0.17 g – 0.28 g. Gobidae, Megalops cyprinoides, Mugil Sp., Pomatomus saltarix, Siganus spinus dan Xenodermicthys stadia post larvanya hampir ditemukan di setiap bulan. Nemadactylus macropterus (November, Desember dan Maret), Serranidae dan Lutjanus (November), dan Siganus canaliculatus (November dan Desember); Terapon terapon, (November dan Maret), Liza sp (Desember) dan Ambassis marianus (Desember, Januari dan Maret) . 44 Larva Congridae lebih banyak ditemukan stadia prolarvanya pada Bulan Desember dan April dan beberapa ekor pada Bulan Februari dan Maret dengan kisaran panjang 11 mm – 31 mm atau berat sekitar 1.15 – 1.52 g. sekalipun stadia prolarva lebih banyak dijumpai pada Bulan April, awal pemijahan spesies ini telah berlangsung sejak awal musim barat, sehingga stadia prolarvanya masih ditemukan di habitat transisi yaitu stasiun yang berada di depan muara. Sudah umum diketahui bahwa jenis spesies ini beruaya dari hilir sungai menuju laut dalam untuk memijah, larva yang telah dipijahkan akan bermigrasi kembali ke hilir melalui sungai dan muara sungai merupakan tempat transport adaptasi yang paling baik untuk adaptasi fisiologis terutama terhadap perubahan salinitas, dari tinggi menuju salinitas rendah. Sehingga larva sidat akan lebih banyak dijumpai di daerah muara dan transisi. Menurut Grenberg dan Dahl (1998) Selain berkorelasi dengan mikrohabitatnya, juwana beberapa spesies ikan juga memiliki hubungan yang sangat kuat antara ukuran dan kedalaman. Juga diperkuat oleh pendapat Nagelkerken dan Velde (2002) bahwa Ukuran dan struktur populasi ikan di habitat yang dangkal menunjukkan besaran yang bersifat sementara dan banyak variasi ruang. Beberapa faktor akan mempengaruhinya setelah presettlement dan postsettlement. Masa presetlemen meliputi stadia larva dan tingkat masukan larva, sedangkan post setlemen mengikuti tingkat perekrutan, migrasi awal postsetlemen, persaingan intraspesifik, predasi dan kematian serta komplesitas habitat. Pada tahap postsetlemen, utilisasi habitat sering dihubungkan oleh waktu pencarian makanan, perlindungan dari pemangsaan ataupun untuk reproduksi. Variasi dan komposisi ukuran dari setiap spesies larva yang diperoleh sangat berbeda karena ini dimungkinkan oleh waktu terjadinya reproduksi dari setiap spesies ikan berbeda. Stadia larva yang ditemukan pada setiap stasiun setiap bulannya dapat dilihat dari ukuran dan perkembangan morfologisnya. Ukuran dan perkembangan morfologis dari setiap spesies juga berbeda untuk penentuan tingkatan stadia. (Lampiran 4). Secara analogi dapat dijelaskan berdasarkan contoh yang dipaparkan oleh Jungwirth, et al. (2000) yaitu tentang siklus hidup dari grayling (Thymallus thymallus L.) yang merupakan spesies dominan yang berasal dari zona braidle yang sangat jelas menunjukkan peranan penting secara longitudinal. Spesies ini memiliki jarak daerah pemijahan sekitar 5-15 km. Pada ikan dewasa, migrasi musim panas dan dingin dibedakan dengan adanya pergeseran habitat dan 45 juwana di bagian skala mikro- dan mesohabitat. Intinya, secara langsung di awal hidup setelah kemunculan larva dari substrat, setelah mengapung secara pasif, mereka akan berkumpul dalam microhabitat di daerah dangkalan sekitar 2 – 3 minggu kemudian juwana akan bermigrasi kehabitat yang lebih dalam mengikuti arus kemudian kembali ke awal habitatnya lagi. Dari segi karakteristik substrat, Teluk Palabuhan Ratu sifatnya pasir berlumpur yang didominasi oleh lumpur liat, karakteristik substrat dasar ini hampir sama di semua kedalaman (PRTK & Dep ITK 2004), sehingga pemijahan spesies ikan apapun ke daerah demersal tidak akan dibatasi oleh perbedaan karakteristik substrat secara mendasar. 4.5.3. Habitat Laut Lepas 4.5.3.1. Komposisi Larva Ikan Habitat Laut Lepas Di stasiun laut lepas yaitu spesies: Xenodermicthys, Siganus spinus, Kuhlia marginata, Signoglassidae, Ambassis marianus; Nemadactylus macropterus, Leiognathus sp, Siganus linneatus. Secara umum dikeseluruhan stasiun laut lepas lebih banyak didapatkan spesies Apogon sp., Pocicthidae, Kyphosus sp, Bregmacerotidae, Aseraggodes sp, dan urolophus sp. Selanjutnya spesies laut lepas yang bersifat stenohaline pada kisaran salinitas tinggi adalah Megalops cyprinoides, Pomatomus saltarix, Nemadactylus, Lutjanus, Microcanthus, Siphamia cephalotes, Bregmaceros dan Aserogedes sp, Abudefduf sp, Apogon sp., Kyposus, Bregmaceros japonicus, Urolophus sp. Xenodermicthys, Siganus spinus, Sphaeramia sp, Lutjanus, siganus javus, Pocicthidae. Spesies-spesies tersebut membutuhkan kestabilan salinitas untuk bertahan hidup, kaitannya dengan kemapuan osmoregulasinya. Adapun spesies muara yang ditemukan di stasiun laut lepas ini dikarenakan habitat pemijahannya memang di laut dalam dan beruaya ke sungai dengan bantuan arus juga dikarenakan kemampuannya sebagai spesies yang bersifat eurihaline sehingga jenis spesies ini juga banyak ditemukan di stasiun laut lepas. 4.5.3.2. Kelimpahan Larva Ikan Laut Lepas Kelimpahan terendah diperoleh pada habitat laut lepas. Rata-rata kelimpahan stiap bulannya hanya sekitar 2 ind/m3. Kelimpahan paling besar di habitat laut lepas didapatkan pada bagian stasiun yang masih dekat dengan daratan dan semakin kecil kelimpahannya seiring bertambahnya jarak stasiun dari darat. Karakteristik fisik permukaan pada stasiun ini hampir sama dengan 46 stasiun lainnya kecuali kandungan nutrien, terlepas dari itu, stasiun ini memiliki kedalaman yang sangat besar yaitu antara 100 hingga > 400 meter. Secara teoritis kedalaman dibawah 100 meter memiliki kecepatan arus yang sangat lambat sehingga ichthyoplankton di daerah ini kemungkinan tidak hanyut jauh dari wilayah mereka dipijahkan, sedangkan pada kedalaman di atas 50 meter dari kolom air, arus semakin cepat sehingga ichthyoplankton akan mudah terbawa oleh arus. (Hinckley et al. 1991, diacu dalam Olii, 2003). 4.5.3.3. Stadia Larva Ikan Laut Lepas Secara keseluruhan, stadia larva di laut lepas tidak terlalu bervariasi. Umumnya stadia didominasi oleh prolarva selain itu stadia yolk sac paling banyak ditemukan pada habitat ini. Stadia yolk sac yang jarang ditemukan di kedua habitat (muara dan transisi) adalah berasal dari spesies Urolophus sp. (Desember-Februari) dan Abudefduf sp. Pada Bulan Maret. Beberapa spesies yang ditemukan di habitat muara dan transisi masih ditemukan di habitat laut lepas dengan stadia postlarva ini dimungkinkan oleh beberapa stasiun dalam pengelompokannya masih dekat dengan daratan. Spesies yang umum ditemukan di muara dan transisi inilah yang memperkaya tingkatan stadia yang ditemukan di habitat laut lepas, karena spesies laut lepas yang bersifat stenohaline tinggi, yang ditemukan, umumnya masih berada dalam fase prolarva dan beberapa diantaranya masih stadia yolk sac (Lampiran 4). 4.6. Struktur Komunitas dan Kepadatan Larva Ikan Temporal Spesies yang banyak tertangkap pada Bulan November adalah Congridae, Siganus spp., Liza spp. dan Gobidae. Spesies ini lebih banyak didapatkan di stasiun muara, pada umumnya spesies ini sangat tergantung keberadaannya pada fluktuasi salinitas atau input terhadap sistem di daerah ini. Spesies yang paling banyak ditemukan pada Bulan Desember, Januari dan Februari di muara terdiri atas Megalops cyprinoides, Congridae dan Gobidae, Tingginya persentase kelimpahan yang didapatkan pada Bulan Desember, Januari dan Februari dibandingkan Bulan Maret dan April, di stasiun muara, disebabkan oleh faktor oseanografi yang terjadi saat itu seperti arus dan gelombang, keadaan ini menyebabkan larva ikan lebih banyak berlindung di teluk muara dibandingkan di laut lepas untuk menghindari arus dan gelombang atau bahkan terbawa arus menuju ke muara (Gambar 19. Lampiran 5 ). 47 Pada Bulan Maret dan April spesies yang paling banyak ditemukan adalah Mugil sp dan Congridae disusul oleh spesies Xenodermicthys pada Bulan April, Siganus spinus dan Ostracion. Karakteristik lingkungan yang diduga berpengaruh terhadap populasi larva adalah fisik dan kimia air arus dan kandungan organik. Arus memberikan dampak langsung terhadap struktur sedimen, pasokan nutrien dan pasokan oksigen. Berdasarkan pengamatan yang dilakukan pada Bulan November, Desember, dan Januari diperoleh hasil kepadatan larva ikan yang masih didominasi oleh Congridae (rata-rata 338 ind/m3), Gobidae (rata-rata 177 ind/m3) dan Megalops cyprinoides (rata-rata 171 ind/m3) dan disusul oleh Mugil (rata-rata 338 ind/m3) Kepadatan tertinggi untuk keempat spesies ini umumnya diperoleh pada Bulan November dan Desember, hanya ada beberapa spesies yang kepadatannya melebihi kepadatan spesies pada bulan tersebut yaitu spesies Xenodermicthys dan Microcanthus spp. Pada Bulan Januari jumlah kepadatan spesies spesies tersebut diatas umumnya mengalami penurunan jumlah kepadatan kecuali spesies Aseraggodes yang justru mengalami peningkatan kepadatan melebihi Bulan Desember. Hasil pengamatan pada Bulan Februari hingga April disemua kelompok habitat, menunjukkan bahwa kepadatan tertinggi spesies yang diperoleh, umumnya didapatkan pada Bulan Maret, hampir semua spesies ditemukan pada bulan ini keculai Abudefduf, Pseudocaranx, Apogon sp. dan Pocicthidae. Pada Bulan Februari spesies yang mengalami peningkatan kepadatan melebihi Bulan Desember dan Januari antara lain: Urolopidae, Bregmaceros, Apogon sp., Pocicthidae, Liza, Siganus linneatus, dan Tranchinothus, dari keseluruhan spesies yang mengalami peningkatan kepadatan, spesies Siganus spinus adalah spesies dengan kepadatan tertinggi melebihi Bulan Desember dan Januari Spesies yang mengalami peningkatan secara signifikan pada Bulan Maret adalah Kuhlia margianata (0.01759 ind/m3), peningkatan terlihat sangat besar dibanding pada bulan-bulan lainnya, diperkirakan bahwa spesies ini mulai memijah pada bulan Maret dan menuju ke daearah dangkalan karena terbawa arus dan gelombang. 48 V. SIMPULAN DAN SARAN 5.1. Kesimpulan Perbedaan karakter fisika kimia perairan di Teluk Palabuhan Ratu berkorelasi erat terhadap kelimpahan dan distribusinya dan dibagi atas tiga bagian yaitu: habitat muara, transisi dan laut lepas. Perbedaan karakter lingkungan antar habitat memberikan pengaruh terhadap komposisi larva yang tertangkap selama bulan pengamatan. Kelimpahan setiap spesies relatif lebih besar dan jumlahnya berfluktuasi setiap bulan. Pola distribusi larva ikan secara temporal untuk habitat muara, transisi dan laut lepas di perairan Teluk Palabuhan Ratu tidak menunjukkan perbedaan yang besar dalam perolehan jumlah spesies setiap bulannya, tetapi menunjukkan perbedaan jumlah dalam induvidu (dalam satu spesies) yang berfluktuasi secara temporal mengikuti musim. Secara spasial, larva ikan dominan lebih banyak ditemukan di daerah muara dan transisi. Pola distribusinya dapat terlihat melalui tingkatan stadia yang ditemukan mengikuti naluri pemijahan dan mencari makanan, terlihat dari kelimpahan yang lebih tinggi di daerah dekat daratan yang mempunyai zat hara yang relatif tinggi. 5.2. Saran Mengingat sampling pada penelitian ini terbatas pada daerah permukaan saja dan dilakukan secara horizontal, maka disarankan agar dilakukan sampling dikedalaman dengan metode penyisiran secara vertikal. 49 DAFTAR PUSTAKA Able, K.W. 1978. Ichthyoplankton of the St Lawrence Estuary: composition, distribution and abundance. Can. J. Fish. Aquat. Sci 35 : 1518 – 1531. Barnes, R.S.K. dan R.N. Hughes.1988. An Introduction to Marine Ecology. London: Blackwell Scientifik Publication. Beckley, L.E. 1986. The Ichthoplankton Assemblage of the Algae Bay Nearshore in Relation to Coastal zone Utilization by Juwana Fish. Journal of Zoology South African 21 : 244 – 252 Bengen, D.G. 2000. Teknik Pengambilan Contoh dan Analisa data Biofisik Sumberdaya Pesisir. Bogor: PKSPL. IPB. Bjorkman, K.M. dan D.M. Karl. 2003. Bioavailability of Disolved Organik Phosphorus in the Eutropic zone at Station ALOHA, Nort fasific Sub Tropical Gyre. Limnology and Oceanography 48 : 1049-1057. Boehlert, G.W., D.M. Gadomski, dan B.C. Mundy. 1985. Vertikal Distribution of Ichthyoplankton of the Oregon Coast in Spring and Summer Months. Fish Bull. 83 . 4 : 611-621 Brodeur, R.D., D.M. Gadomski, W.G. Pearcy, H.P. Batchelder, dan C.B. Miller. 1985. Abundance and Distribution of Ichthyoplankton in the Upwelling Zone off Oregon during Anomalous El Niño conditions. Est. Coast. Shelf Science 21:365-378. Brodeur, R. D. dan W.C. Rugen. 1994. Diel Vertical Distribution of Ichthyoplankton in the Northern Gulf of Alaska. Fish. Bull. 92:223−235. Brower, Z,E.,J. Zar dan C.Von Ende. 1990. General Ecology,Field and Laboratory Methods. Iowa: Brown Company Publisher. Davis, G,C. 1955. The Marine and Fres water Plankton. USA. Michigan State: University Press. Dovel, W.L. 1971. Fish Eggs and Larvae of the Upper Chesapeake Bay. Univ. Md. Nat. Resour. Dwiponggo, A. 1972. Perikanan dan Penelitian Pendahuluan Ketjepatan Pertumbuhan Lemuru (Sardinella longiceps) di Muntjak, Selat Bali. Djakarta: Lembaga penelitian Perikanan Laut. Efendie, I.M. 1978. Biologi Perikanan (Studi Natural History). Bogor: Fakultas Perikanan. IPB. Effendie, H. 2000. Telaahan Kualitas Air bagi Pengelolaan Sumberdaya dan Lingkungan Perairan. Bogor: MSP. FPIK. IPB. Fortier, L. dan W.C. Leggett. 1983. Vertikal Migrations and Transport of Larval Fish in a Partially Mixed Estuari. Can. J. Fish. Aquat. Sci. 40:1543-1555. 50 Goldman C.R. dan Horne A.J. 1983. Limnology. Tokyo: Mc Graw– Hill Book Company. Grahame J. 1987. Plankton and Fisheries. London: Edward Arnold. Grenberg. L.A. dan J. Dahl. 1998. Effect of Habitat Type on Growh and Diet of Brown Trout, Salmo trutta L., In Stream Enclosures. Fisheries Managemen and Ecology. 5: 331-348. Gunarso, W. 1985. Tingkah laku Ikan dalam Hubungannya dengan Alat, Metoda dan Teknik Penangkapan. Bogor: PSP. FPIK. IPB. Hayes, LM. dan Laevastu. 1982 . Fisheries Oceanography and Ecology. England: Fishing New Books Ltd. Hela, I. dan T. Laevastu. 1970. Fisheries Oceanography. New Ocean Enveromental Service. England: Fishing New Books Ltd. Hoar.W.S.,dan D.J. Randall. 1987. The Physiology of DevMegalopsing Fish Volume XI Part A. Vivipari and Posthatching Juwanas. San Dies. Toronto: Academis Press Inc. Hutabarat, S. dan S.M. Evans. 1986. Pengantar Oseanografi. Jakarta: Djambatan. Jungwirth. M., S. Muhar dan S. Schmutz (eds), 2000. Assessing the Ecological Integrity of Running Waters: fundamentals of fish ecological integrity and their relation to the extended serial discontinuity concept Hydrobiologia 422/423: 85–97. Kimmerer, J. H. Cowan, L. W. Miller, dan K. A. Rose. 2001. Analysis of an Estuarine Striped Bass population: effects of environmental conditions during early life history. Estuaries. 24:557–575. Laevastu, T. dan Hayes, M.L. 1981. Fisheries Oceanography and Ecology. New York: Fishering News Book Ltd. Laprise, R., dan J. J. Dodson. 1989. Ontogenetic Changes in the Longitudinal Distribution of Two Species of Larval fish in a Turbid well-mixed Estuary. J. Fish biol. 35: 39–47. Leis dan Carson-Ewart, 2000. Guide to identification to Order and Family and Main characters of larvae of commercially important fish in the South East Asia region. The larvae of Indo-Pacific coastal fishes: an identification guide to marine fish larvae. Samut Prakan, Thailand: The Regional Training Workshop on Larval Fish Identification and Fish Early Life History Science Seaf. Seafdec/Td. Levinton,J.S. 1982. Marine Ecology. New Jersey: Prentice Hall. Erg Lewoods Cliffs. 51 Lignot, J.H., S. Spanings-Pierrot dan G. Charmantier. 2000. Osmoregulatory Capacity as a Tool in Monitoring The Physiological Condition and The Effect of Stressin crustaceans. Aquaculture. 191: 209-245. LON-LIPI. 1975. Atlas Oseanografi Perairan Indonesia dan Sekitarnya. Jakarta: LON-LIPI. Ludwig, J.A. dan J.F. Reynold. 1988. Statistical Ecology a Primar on Methods and Computing. Singapore: John wiley and Sons. Mantiri, R.O.S.E. 1995. Ichthyoplanktonologi. Manado: Pasca Sarjana. Unsrat. Mackenthum,K.M. 1969. The Practice of Water pollution Biology. United States: United states departemen of inferior, federal Water Pollution control adimistration, Divition of Tecnical Support. Metarase, A.C., A.W. Kedall, Jr., dan D.M. Vinter. 1989. Laboaratory Guide to early life history stages of Northeas pacific Fishes. U.S: NOAA Technical Report NMFS 80. Dept commerce. Nagelkerken. 1981. Coral Reef Symposum. Distribution of the Grouper and Snappers of the Nederland Antilles. Nederland. Proc. 4th Int. 2; 479-484 Nagelkerken,I. dan Velde G.van der. 2002. Do Non-estuarine Mangroves Harbour Higher Densities of Juwana Fish than Adjacent Shallow-Water and Coral Reef Habitats in Curaçao (Netherlands Antilles)? Marine Ecology Progress Series . 245: 191–204. Niera, F.J., A.G. Miskiewicz dan T. Trnski, 1998. Guide to identification to Order and Family and Main Characters of Larvae of Commercially Important Fish in the South East Asia region. Samut Prakan, Thailand: The Regional Training Workshop on Larval Fish Identification and Fish Early Life History Science Seaf. Seafdec/Td. Nikolsky, G,V. 1963. The Ecology of Fishes. London: Academic Press. Nontji, A. 2001. Laut Nusantara. Jakarta: Djambatan. Nybakken, J.W. 1992. Biologi Laut. Suatu Pendekatan Ekologis. M Eidman, Koesobiono, D.G. Bengen dan M. Hutomo, Penterjemah; Jakarta: Gramedia Pustaka Utama. Terjemahan dari: Marine abiology. An Ecological Approach. Odum, E. P. 1993. Dasar- dasar ekologi. Yogyakarta: Gadjah Mada Univ Press. Olii. A.H., 2003. Kajian Faktor Fisik yang Mempengaruhi Distribusi Ichthyoplankton (awal Daur hidup ikan). Pengantar Falsafah Sains (pps702). Program pascasarjana/S3. IPB. Bogor: Institut Pertanian Bogor. Pariwono,J.I, M.Eidman, S.Rahardjo, M.Purba, T.Partono, R.Widodo, U. Djuariah dan J.H. Hutapea. 1988. Studi Up welling di Perairan Selatan Jawa. Bogor: Fakultas Perikanan IPB. 52 Parson, T.R., M. Takahashi, dan B. Hargrave. 1984. Biological Oseanographic Processes. Third Edition. Oxford: Pergamon Press. Pescod, M.B. 1973. Investigation of Rational Effluent and Stream Standard for Tropical Countries. Bangkok: AIT. Prescott GW. 1973. How to Know the Freshwater Algae. W. Lowa: Mc Brown Co. Publ. Pusat Riset Teknologi Kelautan, Badan Riset Kelautan dan Perikanan (PRTK) dan Departemen Ilmu dan Teknologi Kelautan, Institut Pertanian Bogor. 2004. Draft Final Report. Survei Hidrografi di Perairan Teluk Pelabuhan Ratu (Dalam rangka penyusunan studi kelayakan pemanfaatan air lautdalam untuk peningkatan sektor perikanan dan non-perikanan). Jakarta: Pusat Riset Teknologi Kelautan Badan Riset Kelautan dan Perikanan Departemen Kelautan dan Perikanan (PRTK-DKP). Reddy, M.P.M. 1993. Influence of the Various Oceanographic Parameters on the Abundance of Fish Catch; Apllication of Satellite Remote Sensing for Identifying and Forecasting Potential Fishing Zones in DevMegalopsing Countries, Proceeding of International workshop on, India, 7-11 Dec 1993. Rogers, H.M. 1940. Occurrence and Retention of Plankton within the Estuary. J. Fish.Res. Board.can. 5 : 164 - 171 Romimuhtarto, K. 1991. Kualitas Air dalam Budidaya Laut. Bandar lampung: Jakarta: Sea Farming Workshop Report. Romimuhtarto, K. dan S. Juwana. 2001. Biologi Laut Ilmu Pengetahuan Tentang Biota laut. Jakarta: Djambatan. Russel, F.S. 1976. The Eggs Planktonic Stage of British Marine Fishes. London: Avad Press. Sanusi, H.S. dan A.S. Atmodipoera, 1993. Karakteristik Kimia dan Kesuburan Teluk Palabuhan Ratu (Tahap I-musim Barat ). Bogor: Fakultas Perikanan IPB. Sastrawijaya, T. 2000. Pencemaran lingkungan. Jakarta: Rineka Cipta. Sidjabat, M.M. 1978. Pengantar Oseanografi. Bogor: Institut Pertania Bogor. Smith E.P dan S. Richardson . 1977. Standard Techniques For Pelagic Fish Egg and Larva Surveys Food and Agriculture Organization of the United Nations. Roma: FAO. Sugiarto, A dan Birowo. 1975. Atlas Oseanologi Perairan Indonesia dan Sekitarnya. Buku No.1 Jakarta: LON-LIPI. Sunarto. 2001. Pola Hubungan Intensitas Cahaya dan Nutrien dengan Produktivitas Primer Fitoplankton di Teluk Hurun Lampung. Tesis. Bogor: SPs IPB. 53 Sverdrup, H.V., M.W. Johson, dan R.H. Fleming. 1972. The Ocean. Their Physich, Chemistry and General Biology. Englewood Clifts: Prectice Hall Inc. Wardoyo,S.T. H. 1987. Kriteria Kualitas Air untuk Keperluan Pertanian dan Perikanan. Bogor: Pusdi PSL IPB. Welch EB. 1980. Ecological Effect of Waste Water. Cambridge: University Press. Wetzel, R. G. 1983. Limnology. (2nd Edition; Complete Revision). Philadelphia: Saunders College Publishing. Wrytki, K. 1961. Physical Oceanography of Southest Asian Waters. Naga Report, Vol 2. La Jolla: The University Of California. 54 Lampiran 1. Tabel Data Sampling Parameter Fisika Kimia perairan Teluk Palabuhan Ratu 6 bulan pengamatan Bulan November 2007 stasiun 1 2 3 4 5 6 7 8 9 suhu (oC) 26 28 29 28 28 28 28 27 28 arus (m/dtk) 0.04 0.11 0.04 0.09 0.01 0.15 0.13 0.04 0.03 T, glmbng (m) 0.3 0.45 0.3 0.3 1.3 1 0.3 0.6 0.6 kekeruhan (NTU) 78 1.4 1.3 1.1 0.7 1 1.2 12 30 DO (ppm) 8.9431 3.252 2.0325 3.252 5.2846 3.6585 3.6585 4.065 3.252 fosfat (mg/l) 0.0835 0.0785 0.0755 0.0885 0.0705 0.0655 0.0725 0.0785 0.0795 T, glmbng (m) 0 0 0 0 0 0 0 0 0 kekeruhan (NTU) 40 1.3 0.6 1 0.8 0.7 0.8 9 23 DO (ppm) 2.845 2.8455 2.439 2.439 2.439 2.845 2.439 3.252 3.252 fosfat (mg/l) 0.060 0.074 0.015 0.027 0.023 0.027 0.022 0.030 0.013 nitrat (mg/l) 0.049 0.022 0.015 0.006 0.004 0.005 0.002 0.004 -0.003 silika (mg/l) 2.94 1.57 1.67 0.84 0.69 0.27 0.65 0.5 0.91 pH 7.85 8.03 8.14 8.21 8.13 8.19 8.18 8.2 8.18 slnts (o/oo) 6 35 34 34 33 34 34 27 20 Kec tarik (m/mnt) 90 73.3 71.6 76.6 78.3 5 31.6 65 71.6 Bulan Desember 2007 stasiun 1 2 3 4 5 6 7 8 9 suhu (oC) 27 29 28 28 28.5 28 28 28 28 arus (m/dtk) 0.03 0.11 0.13 0.15 0.13 0.15 0.13 0.04 0.03 nitrat (mg/l) 0.025 0.074 0.01 0.002 0.003 0.009 0.026 0.005 0.005 silika (mg/l) 7.84 2.8 1.29 2.01 0.01 tt 6.13 3.83 3.68 pH 7.63 8.1 8.11 8.2 8.17 8.2 8.18 8.23 8.14 slnts (o/oo) 7 34 35 34 34 34 34 31 29 Kec tarik (m/mnt) 90 81.6 85 61.6 65 65 71.6 8.3 31.6 60 Lampiran 1 (lanjutan) Bulan Januari 2008 stasiun 1 2 3 4 5 6 7 8 9 suhu (oC) 26 26.5 29 29 28 28 28.5 28.5 27 arus (m/dtk) 0.02 0.11 0.15 0.13 0.13 0.13 0.15 0.05 0.04 T, glmbng (m) 0.2 0.3 0.25 0.5 0.7 0.6 0.6 0.2 0.2 kekeruhan (NTU) 60 1.1 0.8 0.6 0.6 0.5 0.6 13 28 DO (ppm) 6.0976 4.878 5.2846 6.5041 5.2846 6.5041 6.5041 6.0976 6.0976 T, glmbng (m) 0.4 0.4 0.3 0.3 0.3 0.4 0.4 0.3 0.3 kekeruhan (NTU) 55 1.3 0.9 0.6 0.5 0.6 0.7 8.2 30 DO (ppm) 3.6585 2.439 2.8455 2.439 3.252 2.439 2.0325 2.0325 3.252 fosfat (mg/l) nitrat (mg/l) silika (mg/l) 0.059 0.047 tt 0.04 1.57 0.56 0.0095 0.0165 0.0365 0.0145 0.0175 0.0415 0.0465 0.068 tt 0.003 tt 0.097 0.038 0.099 0.56 0.02 tt tt tt tt tt fosfat (mg/l) nitrat (mg/l) 0.052 0.028 tt 0.001 0.014 0.007 0.021 0.058 tt silika (mg/l) 4.92 1.73 1.52 0.88 0.65 0.65 0.76 0.65 0.99 pH 7.8 8.19 8.18 8.13 8.19 8.18 8.2 8.03 8.14 slnts (o/oo) 5 34 35 35 34 34 35 29 28 Kec tarik (m/mnt) 71.6 56.6 58.3 65 63.3 58.3 58.3 68.3 71.6 slnts (o/oo) 6 35 35 35 35 35 35 30 26 Kec tarik (m/mnt) 71.6 58.3 68.3 81.6 85 61.6 63.3 68.3 58.3 Bulan Februari 2008 stasiun 1 2 3 4 5 6 7 8 9 suhu (oC) 26 27 28.5 29 29 29 28.5 27 27 arus (m/dtk) 0.02 0.12 0.16 0.15 0.13 0.15 0.13 0.06 0.03 0.047 0.044 0.038 0.033 0.012 0.032 0.014 0.043 0.045 pH 7.91 8.1 8.11 8.21 8.17 8.2 8.18 8.17 8.12 61 Lampiran 1 (lanjutan) Bulan Maret 2008 stasiun 1 2 3 4 5 6 7 8 9 suhu (oC) 27 27.5 28 29 29 29 29 28 27 arus (m/dtk) 0.03 0.12 0.09 0.07 0.2 0.16 0.15 0.06 0.04 T, glmbng (m) 0.2 0.3 0.3 0.3 0.3 0.3 0.3 0.4 0.4 kekeruhan (NTU) 68 1.1 0.8 0.6 0.6 0.5 0.6 0.9 28 DO (ppm) 2.439 2.439 2.8455 2.439 2.8455 2.8455 2.439 2.8455 3.252 fosfat (mg/l) 0.0595 0.0405 0.0015 0.0635 0.0365 0.3315 0.0665 0.0745 0.0705 nitrat (mg/l) tt 0.045 0.064 tt 0.034 tt 0.083 0.024 0.087 silika (mg/l) 2.44 0.09 0.33 0.8 0.7 0.12 0.71 0.46 0.91 T, glmbng (m) 0.2 0.3 0.3 0.3 0.3 0.3 0.3 0.3 0.3 kekeruhan (NTU) 74 1.4 1.1 0.6 0.7 0.6 1.3 10 26 DO (ppm) 2.8455 2.8455 2.8455 2.439 2.439 2.439 2.439 2.439 2.439 fosfat (mg/l) 0.0345 0.0545 tt 0.0055 0.0085 0.0125 0.0025 0.0045 tt nitrat (mg/l) 0.015 0.063 0.069 0.001 0.04 0.009 0.085 0.031 0.098 silika (mg/l) 4.09 1.15 1.44 0.82 0.43 0.29 0.39 0.28 tt pH 7.81 8.1 8.11 8.25 8.18 8.16 8.18 8.19 8.15 slnts (o/oo) 5 34 34 35 35 35 35 28 25 Kec tarik (m/mnt) 71.6 76.6 78.3 5 61.6 63.3 68.3 58.3 5 slnts (o/oo) 7 34 34 35 35 35 35 31 29 Kec tarik (m/mnt) 90 68.3 71.6 10 68.3 5 38.3 61.6 58.3 Bulan April 2008 stasiun 1 2 3 4 5 6 7 8 9 suhu (oC) 26 27 27 29 28 29 29 28 26 arus (m/dtk) 0.05 0.11 0.04 0.09 0.16 0.2 0.13 0.03 0.04 pH 7.83 8.06 8.19 8.21 8.13 8.17 8.13 8.19 8.18 62 Lampiran 2. Tabel Komposisi dan Frekuensi Kehadiran Larva Ikan Setiap Stasiun Pengambilan Sampel di Teluk Palabuhan Ratu No Trip stasiun 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 Family/Spesies Megalops cyprinoides Pomatomus saltarix Congridae Gobiidae Xenodermicthys Nemadactylus macropterus siganus spinus Leiognathus sp. Siganus linneatus Kuhlia marginata Sphaeramia sp. NipHon sp.inosus Lutjanus Microcanthus ostraciidae/ ostracion Siphamia cephalotes Platycephalus sp mugil Signoglassidae siganus javus ambassis marianus Liza sp. Siganus linneatus Abudefduf sp sp. Pseudocaranx sp. Apogon sp. Pocicthidae Kyphosus sp. Bregmaceros japonicus 30 31 Aseraggodes sp. Urolopidae/Urolophus sp. Jumlah November 1 2 3 13 11 29 15 3 7 3 3 2 1 4 5 6 7 8 9 jml 1 2 3 9 9 3 11 10 8 4 2 1 2 3 1 29 18 49 30 11 17 13 7 2 8 3 4 8 3 7 6 7 12 6 0 3 0 0 1 0 1 3 2 2 11 4 19 11 6 2 4 2 5 4 8 3 4 5 5 4 5 Desember 2 3 1 2 4 1 3 2 2 2 5 3 2 2 7 3 1 1 1 2 1 2 1 99 28 32 1 1 1 2 2 4 2 0 1 21 71 6 7 3 3 8 1 2 2 2 1 1 1 2 1 1 2 9 jml 1 2 3 9 8 14 5 4 2 3 1 1 20 15 37 16 15 8 9 5 3 5 7 4 7 12 9 6 5 14 9 3 5 2 1 0 0 0 0 3 3 8 3 17 11 6 2 4 1 1 3 1 1 2 2 1 4 1 3 2 6 4 2 1 1 1 3 2 1 1 2 0 0 5 3 4 4 3 1 3 8 6 3 5 8 2 1 2 1 3 Januari 1 1 1 1 1 102 13 17 5 2 2 0 11 73 5 6 7 8 9 jml 6 2 1 7 14 7 30 11 11 5 6 4 1 0 2 1 2 5 6 3 4 8 0 0 3 1 0 0 0 0 0 1 2 3 2 1 1 2 1 2 5 2 4 5 2 3 1 1 3 1 1 2 1 1 1 1 1 1 2 1 1 2 4 1 74 19 2 1 11 1 1 5 2 1 0 1 3 1 9 16 63 Lampiran 2 (lanjutan) No Trip Februari Maret April stasiun 1 2 3 4 5 6 7 8 9 jml 1 2 3 4 5 6 7 8 9 jml 1 2 3 4 5 6 7 8 9 jml 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 Family/Spesies Megalops cyprinoides Pomatomus saltarix Congridae Gobiidae Xenodermicthys Nemadactylus macropterus siganus spinus Leiognathus sp. Siganus linneatus Kuhlia marginata Sphaeramia sp. NipHon sp.inosus Lutjanus Microcanthus ostraciidae/ ostracion Siphamia cephalotes Platycephalus sp mugil Signoglassidae Siganus javus ambassis marianus Liza sp. Siganus linneatus Abudefduf sp sp. Pseudocaranx sp. Apogon sp. Pocicthidae Kyphosus sp. Bregmaceros japonicus Aseraggodes sp. Urolopidae/Urolophus sp. 5 3 13 9 4 1 7 1 1 2 2 1 3 7 4 2 3 2 1 4 5 1 1 1 1 2 2 1 1 1 1 1 1 1 1 1 2 1 1 2 1 6 4 1 1 2 0 9 10 4 28 9 4 1 11 1 1 0 2 0 7 0 0 1 3 11 5 1 4 3 2 1 0 1 2 3 5 4 3 5 2 19 13 1 2 4 1 2 1 1 1 4 2 6 1 5 7 2 1 2 3 2 2 2 2 1 3 3 2 1 2 1 1 1 2 1 2 1 2 2 1 2 1 1 1 6 1 4 4 1 6 3 2 1 4 7 2 1 6 1 1 2 1 12 5 31 16 4 5 8 4 2 9 3 2 7 5 6 4 5 17 2 1 3 4 2 3 1 2 1 2 3 4 4 8 3 13 18 6 3 8 3 2 4 2 3 6 5 5 3 4 5 1 1 2 3 2 3 2 2 3 2 3 1 2 1 1 2 1 1 1 1 2 3 1 2 1 1 8 3 2 1 1 1 1 11 2 1 15 9 22 21 11 5 11 4 3 5 5 3 8 5 5 6 4 18 4 4 2 0 0 0 0 0 1 2 1 2 1 jml 100 58 197 103 56 41 58 25 12 27 22 14 39 30 33 26 28 80 26 9 20 10 5 5 1 4 7 13 16 18 11 Jumlah 71 11 8 2 2 0 7 15 11 85 21 15 1 0 0 1 12 42 105 23 7 1 0 0 0 8 33 1094 64 Lampiran 3 Tabel distribusi komposisi dan stadia larva berdasarkan kelompok habitat STADIA DAN HABITAT LARVA NOVEMBER TRANSISI MUARA No 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 Ket: Family/Spesies Congridae Gobiidae Megalops cyprinoides Mugil sp.. Pomatomus saltarix Siganus spinus Xenodermicthys Nemadactylus macropterus Lutjanus spp. Ostracion spp. Microcanthus spp. Platycephalus sp Kuhlia marginata Siphamia cephalotes Cygnoglassidae Leiognathus spp. Terapon terapon Ambassis marianus Aseraggodes spp. Bregmaceros japonicus Serranidae Kyphosus sp. Siganus canaliculatus Urolophus spp. Liza sp. Siganus javus Pocicthydae Siganus linneatus Abudefduf sp. Apogon sp. Pseudocaranx sp. YSL= yolk sac larvae PRL= prelarva PSL= postlarva JWN= Juwana YSL PRL PSL 4 25 15 13 JWN YSL PRL 3 3 11 3 3 7 5 PSL 20 8 8 9 6 2 8 4 2 2 5 LAUT LEPAS JWN YSL PRL 2 MUARA YSL PRL 4 6 PSL 2 YSL PRL PSL 8 10 5 9 6 11 3 4 3 1 2 3 JWN 4 2 3 2 2 PSL 2 5 1 4 4 5 4 3 1 1 1 2 1 1 2 2 1 PRL 3 2 3 YSL 5 1 4 2 LAUT LEPAS JWN 3 3 6 4 3 JWN 39 11 11 8 4 4 6 1 8 3 6 JWN 5 5 2 9 4 4 PSL DESEMBER TRANSISI 2 1 2 1 3 1 3 2 2 1 2 1 1 1 1 1 2 3 1 1 1 65 Lampiran 3 (Lanjutan) STADIA DAN HABITAT LARVA JANUARI TRANSISI MUARA No 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 Ket: Family/Spesies Congridae Gobiidae Megalops cyprinoides Mugil sp. Pomatomus saltarix Siganus spinus Xenodermicthys Nemadactylus macropterus Lutjanus spp. Ostracion spp. Microcanthus spp. Platycephalidae Kuhlia marginata Siphamia cephalotes Cygnoglassidae Leiognathus spp. Terapon terapon Ambassis marianus Aseraggodes spp. Bregmaceros japonicus Serranidae Kyphosus sp. Siganus canaliculatus Urolophus spp. Liza sp. Siganus javus Pocicthydae Siganus linneatus Abudefduf sp. Apogon sp. Pseudocaranx sp. YSL= yolk sac larvae PRL= prelarva PSL= postlarva JWN= Juwana YSL PRL 1 LAUT LEPAS JWN YSL PRL PSL JWN YSL PRL PSL JWN YSL PRL PSL JWN YSL PRL PSL JWN YSL PRL PSL 17 11 7 5 3 4 6 3 1 13 2 1 1 3 3 2 3 3 4 3 1 2 2 1 1 2 4 13 9 8 2 3 7 4 1 2 1 2 2 1 3 4 1 3 2 2 1 13 3 4 1 1 3 3 4 4 5 3 2 7 4 5 1 5 2 MUARA PSL 2 LAUT LEPAS FEBRUARI TRANSISI 2 1 2 1 2 5 2 1 1 1 1 1 2 JWN 1 66 Lampiran 3 (Lanjutan) STADIA DAN HABITAT LARVA MARET TRANSISI MUARA No 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 Ket: Family/Spesies Congridae Gobiidae Megalops cyprinoides Mugil sp.. Pomatomus saltarix Siganus spinus Xenodermicthys Nemadactylus macropterus Lutjanus spp. Ostracion spp. Microcanthus spp. Platycephalidae Kuhlia marginata Siphamia cephalotes Cygnoglassidae Leiognathus spp. Terapon terapon Ambassis marianus Aseraggodes spp. Bregmaceros japonicus Serranidae Kyphosus sp. Siganus canaliculatus Urolophus spp. Liza sp. Siganus javus Pocicthydae Siganus linneatus Abudefduf sp. Apogon sp. Pseudocaranx sp. YSL PRL PSL 2 17 13 5 3 5 4 1 2 3 1 2 1 JWN YSL PRL PSL 2 12 3 5 8 2 LAUT LEPAS JWN YSL PRL PSL JWN YSL PRL PSL 7 6 17 8 4 3 7 6 2 1 4 1 3 1 4 4 1 5 1 2 3 2 6 1 JWN 1 2 1 4 1 3 7 4 1 2 3 6 JWN YSL 1 3 2 1 3 2 1 2 1 3 1 2 2 3 2 2 2 2 1 4 1 2 1 JWN 2 2 3 3 1 PSL 4 3 3 1 PRL 2 5 2 4 4 1 1 1 PSL 5 2 3 3 1 PRL 6 2 1 1 YSL LAUT LEPAS 3 1 1 APRIL TRANSISI MUARA 1 1 1 1 1 2 1 3 1 2 2 1 YSL= yolk sac larvae PRL= prelarva PSL= postlarva JWN= Juwana 67 Lampiran 4. Tabel Hasil Perhitungan Pola Pemencaran Populasi Morisita (Iδ) Pemencaran Populasi berdasarkan Morisita (Iδ) No sp.esimen 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 Congridae Gobiidae Megalops cyprinoides Mugil sp.. Pomatomus saltarix Siganus spinus Xenodermicthys Nemadactylus macropterus Lutjanus spp. Ostracion spp. Microcanthus spp. Platycephalidae Kuhlia marginata Siphamia cephalotes Cygnoglassidae Leiognathus spp. Terapon terapon Ambassis marianus Aseraggodes spp. Bregmaceros japonicus Serranidae Kyphosus sp. Siganus canaliculatus Urolophus spp. Liza sp. Siganus javus Pocicthydae Siganus linneatus Abudefduf sp. Apogon sp. Pseudocaranx sp. Nov Dec Jan 0.3007 0.0905 0.0822 -0.0154 0.0098 -0.0119 -0.0186 0.0049 -0.0266 -0.0287 -0.0343 -0.0287 -0.0266 -0.0305 -0.0305 -0.0287 -0.0343 -0.0343 -0.035 -0.035 -0.0333 -0.035 -0.035 -0.0356 -0.0356 -0.0356 -0.0343 -0.0356 -0.0354 -0.0354 -0.0356 0.2043 0.0055 0.0313 -0.005 0 -0.026 0 -0.029 -0.031 -0.026 -0.014 -0.036 -0.036 -0.034 -0.026 -0.036 -0.031 -0.036 -0.04 -0.039 -0.037 -0.039 -0.039 -0.04 -0.039 -0.039 -0.04 -0.04 -0.04 -0.04 -0.04 0.387 -0.007 0.031 -0.035 -0.043 -0.049 -0.007 -0.055 -0.066 -0.049 -0.055 -0.06 -0.068 -0.063 -0.068 -0.06 -0.066 -0.063 -0.055 -0.066 -0.067 -0.067 -0.067 -0.066 -0.067 -0.068 -0.068 -0.068 -0.068 -0.068 -0.068 Bulan x n N x2 Σx2 November 254 9 2286 64516 580644 Desember 225 9 2025 50625 455625 Januari 134 9 1206 17956 161604 Februari 127 9 1134 15876 142884 Maret 177 9 1593 31329 281961 April 177 9 1593 31329 281961 Jumlah 1094 54 9837 Feb 0.3695 -0.0259 -0.0152 -0.0034 -0.0624 -0.0034 -0.0624 -0.0709 -0.0439 -0.0714 -0.0714 -0.0664 -0.0714 -0.0709 -0.0574 -0.0709 -0.0692 -0.0624 -0.0624 -0.0574 -0.0714 -0.0664 -0.0709 -0.0664 -0.0664 -0.0709 -0.0692 -0.0692 -0.0709 -0.0709 -0.0714 Mar Apr 0.2265 0.0228 -0.01 0.0324 -0.044 -0.033 -0.047 -0.044 -0.037 -0.041 -0.044 -0.044 -0.028 -0.047 -0.05 -0.047 -0.049 -0.049 -0.047 -0.049 -0.05 -0.05 -0.05 -0.047 -0.047 -0.051 -0.051 -0.05 -0.049 -0.05 -0.051 0.0887 0.0763 0.0139 0.0425 -0.028 -0.016 -0.016 -0.044 -0.033 -0.044 -0.044 -0.047 -0.044 -0.041 -0.047 -0.047 -0.044 -0.05 -0.05 -0.051 -0.049 -0.05 -0.049 -0.051 -0.051 -0.047 -0.051 -0.051 -0.051 -0.051 -0.051 Iδ 1894842 96756732 1,05751 1904679 Iδ = n∑xi2-N/N(N-1) adalah : 1 (bersifat acak) 102852666 Uji chi Kuadrat 10455,694 618,69442 dengan derajat bebas n-1 68 Lampiran 5. Tabel Koordinat dan kedalaman stasiun pengambilan sampel di Teluk Palabuhan Ratu Stasiun 1 2 3 4 5 6 7 8 9 posisi stasiun S ‐07' 01' 24.1" E 106' 56' 41.3" S ‐06' 99' 73.2" E 106' 49' 72.4" S ‐06' 98' 34.4" E 106' 46' 37.2" S ‐07' 00' 47.2" E 106' 42' 85.1" S ‐07' 03' 18.0" E 106' 41' 98.3" S ‐07' 03' 89.3" E 106' 46' 33.5" S ‐07' 07' 13.4" E 106' 46' 81.1" S ‐07' 03' 25.3" E 106' 52' 61.5" S ‐07' 02' 73.5" E 106' 53' 96.7" kedalaman (m) < 3 25‐30 80‐100 80‐100 > 450 > 400 > 400 40‐50 08‐10 69 Lampiran 6. Hasil Analisis Klaster Observasi Parameter fisika-kimia Cluster Analysis of Observations: Parameter fisika-kimia Bulan November Euclidean Distance, Single Linkage Amalgamation Steps Step 1 2 3 4 5 6 7 8 Number of clusters 8 7 6 5 4 3 2 1 Similarity level 99.4366 98.9999 98.4199 97.8112 97.5587 78.9326 76.4399 35.7711 Distance level 0.4630 0.8219 1.2984 1.7986 2.0061 17.3121 19.3604 52.7798 Clusters joined 4 7 4 6 2 4 2 3 2 5 2 8 2 9 1 2 New cluster 4 4 2 2 2 2 2 1 Number of obs. in new cluster 2 3 4 5 6 7 8 9 Final Partition Number of clusters: 1 Cluster1 Number of observations 9 Within cluster sum of squares 6160.18 Average distance from centroid 19.7508 Maximum distance from centroid 68.0026 Cluster Analysis of Observations: Parameter fisika-kimia Bulan Desember Euclidean Distance, Single Linkage Amalgamation Steps Step 1 2 3 4 5 6 7 8 Number of clusters 8 7 6 5 4 3 2 1 Similarity level 98.6610 97.3380 97.1701 96.5351 92.7492 82.7873 71.0134 42.3329 Distance level 0.6533 1.2988 1.3808 1.6906 3.5378 8.3984 14.1432 28.1370 Clusters joined 5 6 3 4 2 3 2 5 2 7 2 8 2 9 1 2 New cluster 5 3 2 2 2 2 2 1 Number of obs. in new cluster 2 2 3 5 6 7 8 9 Final Partition Number of clusters: 1 Cluster1 Number of observations 9 Within cluster sum of squares 2247.88 Average distance from centroid 12.1173 Maximum distance from centroid 39.3798 70 Cluster Analysis of Observations: Parameter fisika-kimia Bulan Januari Euclidean Distance, Single Linkage Amalgamation Steps Step 1 2 3 4 5 6 7 8 Number of clusters 8 7 6 5 4 3 2 1 Similarity level 99.2018 98.3069 98.1571 97.9398 97.3099 80.2888 77.3263 40.7877 Distance level 0.5319 1.1282 1.2280 1.3728 1.7925 13.1344 15.1085 39.4557 Clusters joined 4 7 4 6 4 5 3 4 2 3 2 8 2 9 1 2 New cluster 4 4 4 3 2 2 2 1 Number of obs. in new cluster 2 3 4 5 6 7 8 9 Final Partition Number of clusters: 1 Cluster1 Number of observations 9 Within cluster sum of squares 4094.86 Average distance from centroid 16.0594 Maximum distance from centroid 54.3934 Cluster Analysis of Observations: Parameter fisika-kimia Bulan Februari Euclidean Distance, Single Linkage Amalgamation Steps Step 1 2 3 4 5 6 7 8 Number of clusters 8 7 6 5 4 3 2 1 Similarity level 99.5933 98.9303 98.6663 98.4455 97.3815 86.1187 64.1682 47.9084 Distance level 0.2520 0.6627 0.8263 0.9631 1.6224 8.6004 22.2003 32.2744 Clusters joined 4 6 4 7 4 5 3 4 2 3 2 8 2 9 1 2 New cluster 4 4 4 3 2 2 2 1 Number of obs. in new cluster 2 3 4 5 6 7 8 9 Final Partition Number of clusters: 1 Cluster1 Number of observations 9 Within cluster sum of squares 3703.16 Average distance from centroid 15.6162 Maximum distance from centroid 50.5097 71 Cluster Analysis of Observations: Parameter fisika-kimia Bulan Maret Euclidean Distance, Single Linkage Amalgamation Steps Step 1 2 3 4 5 6 7 8 Number of clusters 8 7 6 5 4 3 2 1 Similarity level 99.7831 99.4411 99.1011 98.9840 97.9943 91.8785 63.0871 39.4627 Distance level 0.1603 0.4132 0.6646 0.7512 1.4829 6.0044 27.2906 44.7567 Clusters joined 4 7 4 5 4 6 2 3 2 4 2 8 2 9 1 2 New cluster 4 4 4 2 2 2 2 1 Number of obs. in new cluster 2 3 4 2 6 7 8 9 Final Partition Number of clusters: 1 Cluster1 Number of observations 9 Within cluster sum of squares 5071.42 Average distance from centroid 17.8044 Maximum distance from centroid 61.8862 Cluster Analysis of Observations: Parameter fisika-kimia Bulan April Euclidean Distance, Single Linkage Amalgamation Steps Step 1 2 3 4 5 6 7 8 Number of clusters 8 7 6 5 4 3 2 1 Similarity level 99.4272 99.3072 99.0913 98.7074 97.7352 88.2937 79.3524 32.7061 Distance level 0.4509 0.5453 0.7153 1.0174 1.7826 9.2141 16.2518 52.9674 Clusters joined 2 3 4 6 4 7 4 5 2 4 2 8 2 9 1 2 New cluster 2 4 4 4 2 2 2 1 Number of obs. in new cluster 2 2 3 4 6 7 8 9 Final Partition Number of clusters: 1 Cluster1 Number of observations 9 Within cluster sum of squares 5456.05 Average distance from centroid 17.5470 Maximum distance from centroid 65.6211 72 Lampiran 7 Gambar dan Deskripsi Morfologi Larva yang tertangkap di Stasiun peneitian Spesies Stadia Kepala badan badan sirip dorsal : Megalops cyprinoides : post larva Sirip anal sirip ekor Deskripsi : Badan pipih (depressed) dengan bagian depan semakin mengecil, di ujung truncate (kepala) menjadi gepeng (kompessed). Bagian tengan sepanjang badan kebelakang mengalami pelebaran hingga batas sirip perut di ujung badan (sirip prut terletak sekitar ¼ panjang tubuh dibagian belakang, sehingga bagian belakang tubuh lebih lebar di banding bagian tengah. Setelah sirip perut mengalami pengecilan hingga sirip ekor . Warna tubuh bening hamper transp.aran dengan miomer yang sangat jelas. Literature : Terdiri atas 72-82 myomeres, Leptosp..-like dengan sirip ekor tipe forked, kepala hampir berbentuk persegi tiga (triangular head), dengan tubuh yang pipih Stadia Flexion terjadi kurang lebih pada saat berukuran 0-15 mm standard length. Period pertumbuhan larval diiringi oleh badan yang menyusut dan menebal setelah bermetamorpHosis, dan kemudian tumbuh hingga beresumption menjadi Juwana. Jumlah dorsal dan anal biasanya lengkap sekitar 25 mm (setelah metamorpHosis). Ukuran maksimum setelah bermetamorpHosis sekitar 43 mm. Pigmentasi: pada bagian punggung, pada pertengahan sisi badan, dan di pangkal sirip dubur; dan pigmentasi pada gelembung renang di bagian dorsal setelah bermetamorpHosis. (Fahay, 1983. Guide to the early stages of marine fishes occurring in the Western North Atlantic Ocean, Cape Hatteras to the Southern Scotian Shelf.) Family Stadia post larva/ kepala badan badan : Pomatomus saltarix : Juwana badan+ btng ekor btng +sirip ekor sirip ekor 73 Deskripsi : Badan oval dengan bagian kepala dan ekor yang hampir simetris. Letak mulut terminal. Bagian tengah badan lebih tebal dan semakin berkurang ketebalannya menuju dibagian kepala dan ekor. warna tubuh bening dengan pigmentasi yang berwarna perak sepanjang linea lateralis hingga pangkal ekor, pigmentasi biru keperakan juga telah nampak di bagian dorsal dan ventral di sepanjang pangkal sirip punggung sirip perut dan sirip anal. Pada Stadia post larva pigmentasi nampak jelas dibagian perut dibawah sirip dada. Spesies : Congridae Stadia : post larva Deskripsi : Tubuh bulat memanjang lebarnya lebih dari 25 kali panjang tubuhnya, dengan sirip punggung dan sirip dubur sepanjang hampir seperdua bagian tubuh kebelakng hingga bersambung dengan sirip ekor. terdapat sirip dada yang kecil terletak tidak lebih dari 1/8 bagian tubuhnya dibagian ujung depan setelah kepala. Letak mulut terminal dengan ujung kepala agak meruncing dan bagian belakang tubuh hingga ujung sirip ekor berbentuk depressed. Pada Stadia ini sangat jelas terlihat bagian anatomi lambung dan ususnya dibagian perut karena warna tubuh masih sangat bening dan transp.aran. Literature : Terdiri atas 102-111myomeres, usus lurus dan panjang (sekitar 7075% TL), memendek saat metamorpHosis. Sirip dada dibagian akhir; tidak terdapat sirip anus. Ukuran maximum sebelum bermetamorpHosis mencapai 70 mm. rahang yang rendah terlihat menonjol pada saat dewasa dan pada saat larva yang bening. Tidak berpigmentasi kecuali dibagian mata, hingga Stadia bening tubuhnya selesai. (Fahay, 1983. Guide to the early stages of marine fishes occurring in the Western North Atlantic Ocean, Cape Hatteras to the Southern Scotian Shelf.) Kepala dorsal + sirip dada badan sirip ekor Ventral + sirip anal Spesies : Gobiidae Stadia : Prolarva Deskripsi : Tubuh bulat memanjang berbentuk terpedo, panjang tubuh hingga 67 kali tinggi badannya. Mulut terminal dengan mata yang menonjol dan agak melebar memenuhi hampir bagian sisi kepala yang agak bulat, sirip dada kecil terletak di ¼ bagian depan tubuhnya. Sirip ekor tipe lunate dengan posisi tegak/depressed. Warna tubuh bening pucat tanpa pigmentasi kecuali di bagian pangkal ekor. Tidak memiliki sirip punggung dan sirip perut berbentuk lingkaran terletak tepat di 1/2 tubuhnya di bagian ventral. 74 Spesies Stadia : Xenodermicthys : Postlarva Deskripsi : Tubuh bulat memanjang berbentuk cerutu dengan bagian depan kepala meruncing, letak mulut terminal. Sirip ekor truncate seluruh permukaan tubuh berwarna perak dengan bintik pigmentasi yang tersebar merata diseluruh bagian tubuh dan tampak lebih jelas di bagian dorsal memiliki sirip punggung hampir di bagian belakan dorsalnya, perut dan sirip anal, sirip dada terletak dibelakang tutup insang. Menurut Literature: Kepala Kecil (sekitar 20% standar length) besar hingga 40% standard length. PHotopHore bagian atas berbentuk cembung atau arcuate jika ada, tidak terdapat stalked tetapi dibatasi oleh sirip dada kurang dari 10. sirip anal dekat dengan anal masing msing 25 – 33 ; anus tertutup oleh sirip anal sirip punggung dan sirip anal 25 hingga 33 helai ; hanya 1 supramaxilla; pHotopHore berkembang dengan baik, rahang atas (jarang, hampir diserap pada bgian anterior) Spesies Stadia : Nemadactylus macropterus : Post larva Deskripsi : tubuh berbentuk oval yang agak simetris, bagian tengah tubuh tebal dan berkurang dibangian sirip dorsal dan ventral. Letak mulut terminal dengan mata yang masih melebar. Warna tubuh bening coklat keperakan. Warna perak lebih dominant terlihat dibagian perut. Sirip punggung terletak sebaris dari akhir bagian kepala sampai ke pangkal sirip ekor. dibagian ventral setelah sirip anal terdapat juga barisan sirip halus yang memanjang hingga pangkal sirip ekor. Garis lateralis dimulai dari bagian atas tutup ingsang menurun di tengah dan berakhir tepat ditengah pangkal sirip ekor ditandai dengan warna tubuh yang lebih gelap mengikutinya. Spesies Stadia Juwana/ kepala badan sirip dorsal : : ekor Siganus spinus post larva sirip ekor Deskripsi : Bentuk tubuh oval memanjang simetris dengan pigmen merata keseluruh tubuh, pola pigmen yang membedakan dengan Spesies ordo siganus lainnya telah nampak pigmen berwarna hitam. Warna pola pigmen berwarna hitam 75 dengan dasar otot berwarna putih pucat. Bagian pigmen yang terkumpul terdapat pada pangkal sirip dorsal dan ventral. Mulut terminal, Ekor emarginate terdapat sebaris sirip dorsal mulai dari akhir cagak hingga pangkal sirip ekor. sedangkan sirip ventral mulai dari anal hingga pangkal sirip ekor, pada Stadia post larva semua sirip masih berupa lembaran berselaput halus setelah masuk Stadia Juwana akan mengalami pengerasan dan tulang sirip akan kaku dan berduri tajam. Literature : Stadia Post larva bersifat pelagis berenang secara berkelompok biasanya berasal dari daerah terumbu, ukuran pase post larva sekitar 45 mm. Pada awalnya larva memanjang, tetapi lebih moderat sebelum berubah ke flexion. mempunyai 22-2.4 myomeres ( 6-10+ 12-18). kantung kuning telur kecil diserap pada saat berukuran sekitar 3 mm. tidak lama setelah menetas usus melebar ke pertengahan badan dan sering nampak. Suatu ga bledder sering tidak nampak yang terletak diatas usus pada saat memasuku Stadia preflexion larvae tetapi bergerak ke ventral setelah flexion. Kepala pada mulanya berukuran kecil dan bulat, mulut tumpul; pada Stadia flexion, kepala menjadi moderat dan membesar dan mulut memanjang terminal, tetapi setelah selesai menjadi lebih pendek. Selama Stadia flexion, tulang belakang yang kecil atau dorsal terbentuk di atas supraocula. Pigmen bervariasi menurut Stadia perkembangan, tetapi secara umum, larvae mempunyai pigmen di permukaan dorsal dari usus dan sepanjang linea yang hingga sirip perut ke ekor. Banyaknya Melanophores yang terbentuk akan berkurang seiring dengan perkembangannya menjadi flexion. Larva yang lebih besar mengembangkan pigmen di atas kepala bagian atas dan bawah, sepanjang caudal-fin mulai dari lateralis ke bagian ekor, di atas selaput sirip sp.inous hingga perut dan ventral. Sebelum tahap penyelesaian, pigmen badan lebih berkembang, dan Stadia pelagis paling akhir berwarna keperakan (Fahay, 1983. Guide to the early stages of marine fishes occurring in the Western North Atlantic Ocean, Cape Hatteras to the Southern Scotian Shelf). . Spesies Stadia kepala mata badan badan : Leiognathus sp. : Post larva ekor sirip ekor Deskripsi : Bentuk tubuh bulat pipih, panjang tubuh hampir sama dengan lebarnya, warna tubuh putih keperakan, letak mulut terminal, terdapat pigmen berupa bintik yang tersebar merata dipermukaan tubuh. Terdapat barisan pigmen yang terkumpul dan memanjang dibawah linea lateralis. Terdapat pigmen berwarna hitam dibagian tepi sirip bawah. Barisan sirip pendek yang halus terdapat sepanjang pertengahan dorsal setelah sirip punggung hingga pangkal sirip ekor, sedang dibagian ventral sirip berupa duri pendek juga terdapat setelah sirip anal dan 76 berakhir di pangkal sirip ekor. sirip ekor masih berupa lembaran dengan selaput halus, bentuk sirip ekor lunate. Literature: Morfologi badan sangat pipih , sekitar 1,8 hingga 1,9 kali standar length, bentuk ventral paling sedikit agak cembung seperti bentuk dorsal. Stadia Preflexion mempunyai karakteristik pigmen sirip perut sepanjang linealateralis dari ekor yang tegak lurus sepanjang Melanophores dengan satu sampai tiga Melanophores myomere. Menuju ke anal dan bersatu sehingga kedasar. Melanophores juga terdapat di atas finfold depan hingga anal pada usus dan gelembung renang, dan sering juga di atas linea lateralis. Kemudian, pigmen nampak di atas kepala bagian sudut rahang bawah, pectoralfin dasar, ruas-ruas tulang belakang ekor, bagian bawah caudal-fin, dan meluas di atas kepala, ekor dan batang ekor. pada morpHologi larvae 1, vertebra preopercular-angle yang panjang mempunyai Melanophores sepanjang poros nya. MorpHologi larva 2 dan 3 mempunyai pigmen internal di tengkuk dari preflexion sampai awal Stadia postflexion. (From: Leis and Carson-Ewart, 2000. The larvae of Indo-Pacific coastal fishes: An identification guide to marine fish larvae.) Spesies Stadia Sirip ekor ekor badan badan : Mugil sp.. : postlarva kepala Deskripsi: Tubuh memanjang agak tebal hampir berbentuk torpedo memipih, tingginya sekitar ¼ kali panjang tubuhnya, ekor bentuk lunate dengan filament sirip yang masih tipis dan lembut. Warna tubuh coklat dengan bagian bawah yang berwarna terang atau putih, pigmen berupa bintik hitam keperakan nampak tersusun secara zig-zag dari dorsal ke ventral mengikuti pola miomer pada ototnya dengan garis lateralis yang telah nampak di sepanjang badan mulai dari belakang sirip dada hingga kepangkal ekor yang ditandai dengan kumpulan pigmen yang mengikutinya. Pigmen coklat nampak terlihat jelas diatas cagak sedangkan piggmen hitam terkumpul dipangkal sirip ekor. Literatur: Morfologi badan memanjang. Mata bulat besar. Akan mengeras setelah berukuran 18 mm SL. Gap besar di antara anal dan sirip anal pada larva dan awal Juwana (post larva). Stadia Juwana 18 mm), tulang belakang kecil di atas sudut preopercular dan infraorbitals. Pigmentasi lebih banyak terjadi pada Stadia Juwana. Terutama pada bagian linea lateralis. Mugil Sp.: Larva dan Juwana lebih berpigmen. Kebanyakan karakteristik Melanophores ditemukan pada caudal peduncle. Melanophores terdistribusi di atas kepala, rongga abdominal, midline cabang samping, dasar sirip anal dan di belakang. Karakter diagnostic Mugil Sp.Karakter Meristric. Jumlah sinar sirip anal. Juwana di atas 18 mm terjadi dari daerah air tawar (Fahay, 1983. Guide to the early stages of marine fishes occurring in the Western North Atlantic Ocean, Cape Hatteras to the Southern Scotian Shelf.) 77 Spesies Stadia : : Sphaeramia sp. Postlarva Deskripsi: Pola tubuh berbentuk hampir seperti jajaran genjang dengan bagian tubuh belakang menuju keekor lebih memanjang (batang sirip ekor). Dibagian tubuh atas yang menyudut terdapat sebaris sirip dorsal yang tumbuh hingga batas lekukan batang sirip ekor. posisi mulut sub terminal dengan rahang bagian bawah lurus (tidak melengkung).Bagian cagak atas rata hingga hampir di puncak punggung. Bagian pangkal sirip ekor mengalami pelebaran seiring dengan arah tumbuh sirip ekor yang mengipas, sirip ekor terdiri dari lembaran halus yang bercabang atau berbentuk lunate. Pigmentasi lebis jelas nampak dipangkal semua sirip, kecuali pangkal sirip ekor yang tidak berpigmen. Pigmen coklat terdapat di operculum, mulai bagian atas operculum hingga ke batang ekor sampai ke pangkal ekor terdapat sebaris linea lateralis yang ditandai dengan beberapa bintik pigmen yang sebaris dengan garis lateral tersebut. Family Stadia : Serranidae : post larva Deskripsi : Tubuh oval lebih panjang (fusiform), panjang badan 2 ½ kali tinggi badan. mulut terminal dengan ekor yang berbentuk rounded. Sirip punggung memanjang sampai pangkal batang ekor. terdapat sirip dada dibelakang operculum yang masih transp.aran. warna tubuh bening kekuningan dengan sisik halus yang mulai tumbuh diseluruh tubuh. Sirip perut berada tepat di ½ bagian ventral. Barisan sirip anal terdapat setelah anal hingga sebelum batang ekor. Literatur : Memiliki pre operculum yang lembut, biasanya dengan lempeng sp.inna yang besar, opercle terdiri atas 3 lempeng, gigi berbentuk kerucut, tanda panah dan baris: garis lateral tidak memanjang kebelakang samapi sirip ekor, sirip punggung hanya satu dan di beberapa Spesies tidak terbagi. Spesies Stadia : Lutjanus sp. : Post larva Deskripsi : Tubuh lonjong memanjang (fusiform) bagian depan cagak meruncing dengan letak mulut yang terminal, bagian tengah tubuh bebal. Puncak dorsal terdapat satu tulang sirip punggung yang panjang diikuti oleh 2-3 tulang sirip yang pendek, kesemua tulang sirip dihubungkan oleh selaput tipis hingga kepangkal batang ekor. Sirip perut tepat berada lurus vertikal dengan sirip dorsal. Warna tubuh agak gelap dengan 4 barisan pigmen yang berpangkal dari ujung cagak dan nampak tereduksi bagian yang dekat dengan pangkal ekor. Literatur : Morfologi badan agak memanjang. Mulut kecil agak miring. Selama Stadia larva bersifat pelagic, tulang belakang di belakang dan sirip punggung 78 terdapat sepanjang dorsal. Diagnosa ventral dan hingga sebelum preopercular, posttemporal dan supracleithral. Tulang belakang preopercular lebih kecil dibanding ventral. Preopercular ventral yang keras terdapat diseluruh bagian. Pewarnaan lebih mudah dikenali. Melanophores terjadi di atas permukaan usus di bagian ventral, tepi ekor yang hinggai sirip perut. Lutijanus type1: Dua atau tiga Melanophores kecil di atas tepi ekor hingga sirip perut. Satu melanopHore besar di atas cleithrum. Pada Stadia postflexion. Melanophores terbentuk di atas kepala. Lutijanidae type1: Pewarnaan eksternal hampir tidak ada. Melanophores kecil terjadi di ujung mulut, cleithrum dan sisi ekor hingga sirip perut. Lutijanidae type2: Pewarnaan di kepala, cleithrum dan sisi ekor hingga sirip perut dan di dorsal. Melanophores di ekor terdapat secara simetris (Leis & Rennis (2000), Kojima & Mori (1988). Spesies Stadia Sirip ekor badan : Microcanthus sp. : Post larva badan kepala Deskripsi : Lebar badan dua kali panjang badan, ekor lunate dengan sirip yang masih tipis, pigmen badan berupa kumpulan yang tersebar dibagian tertentu sp.erti di garis lateral hingga pertengahan badan mengikuti pola myomernya, kemudian di sepanjang pangkal sirip punggung hingga ke sirip pangkal sirip ekor dan mengalami pelebaran hingga pertengahan badan. Bintik pigmen yang lebih tersebar juga terdapat di bagian belakang mata hingga pangkal kepala (cagak). Letak mulut terminal terdapat sirip dada, sirip perut dan sirip anal kecil yang halus bagian awal hingga akhir pangkal sirip terakumulasi pigmen. Literatur : Badan moderate (BD 25-36%) Kepala moderate hingga besar (HL 29-36%). Gigi kecil sepanjang kedua rahan pada saat Stadia flexion. Kecil hingga moderate anterion dan posterior di belakang tutup insang bawah (preopercular) pada Stadia Flexion bertambah jumlahnya tetapi tereduksi pada saat memasuli Stadia post flexion Duri permukaan Spesies Stadia : : badan sirip ekor Ostracion Post Larva Deskripsi : Tubuh Hampir berbentuk bola dengan permukaan kulit yang ditumbuhi duri kasar, sirip punggung terdapat hampir di akhir bagian punggung mendekati sirip ekor, sirip ekor berbentuk pointed yang terpisah dari sirip dorsal dan 79 anal, tepat dibawah batang ekor terdapat sirip anal. Mulut Terminal dengan mata yang lebar hamper tidak menonjol. Spesies Stadia kepala pigmen mata pigmen perut : Siphamia cephalotes : Post larva badan batang/sirip ekor Deskripsi : Tubuh agak panjang lebih dari dua kali tinggi badannya. Mulut terminal dengan garis linea tepat dibagian tengah badan mulai dari belakang operculum sampai pangkal batang ekor, linealateralis pada Stadia post larva dipertegas dengan kehadiran pigmen hingga setengah dari panjang standar tubuhnya, kumpulan pigmen juga tergapat dipangkal sirip punggung. Pigmen juga terdapat dipangkal sirip anal, sirip dada yang kecil tampak dibelakang operculum tetapi tidak terdapat sirip perut hanya ada sirip anal terletak di sepertiga bagian belakang tubuhnya sebelum pangkal batang ekor, sirip ekor berbentuk truncate keduan bagian sudut ekor lebih agak panjang dan meruncing seperti truncate. Spesies : Platycephalidae Stadia : Juwana Deskripsi : morfologi badan compres atau lebar badan lebih besar dibanding tingginya (gepeng), letak mulut dibagian bawah ujung depan badan karena sifatnya demersal, terdiri atas sirip punggung yang bersambung menjadi sirip ekor, sirip dada terdiri atas dua pasang lapisan, lapisan pertama terdiri atas sirip yang lebih keras dan kaku ; lapisan kedua terdiri atas sirip yang lemah yaitu terdiri atas selaput yang lebih lembut dibanding lapisan sirip pertama. Literatur : Stadia ini disebut Alevin prosesnya yaitu Pada Stadia yol sac larvae bermetamorpHosis langsung kedalam Stadia Juwana, sehingga disebut sebagai alevins. Stadia ini berukuran 47 mm panjang totalnya. Ekor tidak terbagi dua cabang tetapi berbentuk forked seperti fasa dewasa. Pigmen berwarna gelap berbentuk bintik masing-masing di sisi samping, di bagian atas yol sac. Vertebra belum mengalami pengerasan. Linea lateralis dapat terlihat.Adiposefin berkembang. Satu maxillary dan dua mandibular berkembang. Maxillary tidak sampai kebagian dasar pectoral pada Stadia ini. Stadia awal Juwana plat gigi belum berkembang (bagian gigi pada plat berbentuk lonjong sebagai gigi geraham yang terdapat pada ikan pada saat bermetamorpHosis) Satu maxillary sampai ujung pectoral. Panjang dari dua mandibular tidak sampai setengah bagian kepala . Adiposefin memiliki pigmen. (From M.J. Prince Jeyaseelan,1998. Manual of Fish Eggs and Larvae from Asian Mangrove Waters. Science and Technology, UNESCO Publishing.) Spesies : Bregmacerotidae Stadia : Post larva 80 Literatur : Morfologi badan pipih agak datar. usus dengan ketat bergulung. Kepala berubah dari bulat menjadi lurus. Mulut miring. Sekeliling mata agak datar. Sirip anal menjadi tebal dan panjang melewati anus. Sirip anal terbentuk dari anterior dan posterior dari depan kearah sirip yang akan memendek pada saat dewasa mengail. sirip dada berbentuk padlle dan terletak seperti pengayuh di atas linea lateralis yang bercabang samping. Pigmentasi pada larva Bregmacerotid berganti ganti mulai dari tanpa pigmen dari satu Stadia dari berbagai Spesies tergantung pada ketebalannya. Kebanyakan Spesies mempunyai pigmen di atas gelembung gasnya. Pigmen juga terdapat disudut rahang bagian bawah. Larva Bregmacerotid mempunyai banyak pewarnaan internal terutama pada diatas gelembung renang, ekor tersebar dan di peduncle kepala. Pigmen biasanya meningkatkan ketika larvae sedang tumbuh. post larva/ kepala badan badan ekor sirip ekor Spesies : Kyposus sp. Stadia : Post larva Morfologi : Tubuh memanjang agak pipih setengah mengular bagian kepala agak besar dengan batas kepala dengan badan sangat jelas karena dibelakang operculum tertekuk oleh lengkungan kepala. Mulut terminal dengan ekor truncate pigmen sangat jelas terlihat sepanjang linealateraris, bintik pigmen juga terlihat mengikuti pola myomer, terdapat sirip punggung yang memanjang sampai batang ekor. sirip anal terdapat dibagian belakang sebelum pangkal sirip ekor. Literatur : Badan memipih dan secara menyamping memampatkan. Kepala besar. mulut terminal agak besar miring. Sekeliling terlihat besar. Vertebra berukuran kecil di posterior dan ventral preopercular. Preopercular di depan tereduksi seiring pertumbuhan. Pewarnaan kepala badan ekor Spesies : Cynoglossis sp. Stadia : Prolarva Deskripsi : Badan agak panjang dengan bagian kepala lebih besar, dari depan badan lebih lebar dan semakin mengecil kebagian ekor. vertebra masih sangat namapak jelas , sirip belum nampak berkembang dengan sempurna, tetapi mulai terlihat pertumbuhan sirip sepanjang bagian dorsal dan di bagian bawah perut, sirip 81 ekor belum berkembang dengan sempurna masih berupa membrane tipis yang halus. Mata besar dengan mulut yang masih terbuka. Sangat jelas terlihat garis miomer halus mengikuti arah pertumbuhan tulang vertebra. Warna tubuh bening dan sangat pipih. Literatur : Morfologi larva Cynoglossid pada mulanya memanjang (cynoglossines) hingga halus ( sympHurines), pipih dan kedua sisinya simetris. menjadi sangat pipih dan lebih lebar setelah flexion notochordnya lengkap. Badan dan Kepala pada awalnya banyak lebih lebar disbanding ekor yang runcing. ekor secara berangsur-angsur menjadi lebih lebar, hanya sedikit yang tertinggal dibandingkan badannya. Ada 43-59 myomeres (7-10+ 36-50). Usus bergulung dan menebal ke dalam pengulangan tunggal, besar dan menonjol dengan jelas dari garis tepi badan sirip perut. Tingkat tonjolan keduanya bervariasi secara ontogenetic dan antar Spesies, tetapi usus yang menonjol dapat melakukan pelebaran. Pigmen penutup terdapat pada beberapa Spesies dalam ekstrimitas usus yang menonjol: Kombinasi panjang dari kedua proyeksi ini dapat melebihi 60% BL (Yevseyenko, 1991). Anus pada umumnya sedikit tertutup dan pada Stadia flexion dan postflexion larvae di sebelah kanan dan ventral hingga pangkal sirip anal. Usus (diukur mulai sirip anal ketika awal terbentuknya sirip anal) sampai 30-40% BL. Bagaimanapun, usus akan tertarik kembali tepi badan ketika berubah menjadi larva dan kemudian hanya mencapai 23-30% BL. Gelembung renang terdapat dibagian ventral dari usus terisi pada malam hari dan akan tereduksi selama metamorfosis. (Fahay, 1983. Guide to the early stages of marine fishes occurring in the Western North Atlantic Ocean, Cape Hatteras to the Southern Scotian Shelf). Mulut +kepala Spesies Stadia Ekor mata + kepala badan badan + btng ekor sirip ekor : Apogon sp. : Juwana badan badan badan post larva/ kepala Family : Phosichthydae Stadia : Post larva Deskripsi : Tubuh agak memanjang berbentuk torpedo, sirip yang lebih berkembang terdiri atas sirip perut berupa lembaran membrane filament halus berjumlah antara 7-9 lembaran, sirip punggung belum berkembang dengan sempurna di ujung belakang dorsal sebelum batang ekor. Sirip ekor berbentuk 82 truncate, sirip anal terlihat sejajar dengan sirip punggung dibagian ventral sebelum batang ekor. Myosepta dan myomer sangat jelas kelihatan, tubuh bening dengan garis linea yang nampak ditengah badan mulai daribelakang tutup ingsang sampai ujung batang ekor. mata masih besar dan k mulut sub terminal. Pigmentasi terbentuk dengan jelas disekitar kepala dan diatas mata. Sedangkan dibagian tubuh lain hanya nampak jelas dibagian pangkal sirip pada masing masing bagian. Spesies Stadia kepala ventral badan : Aseragoddes sp. : Prolarva vertebrae ekor+ sirip Deskripsi : Larva Spesies ini lebih mirip larva sinoglossis sp., yang membedakannya hanya lebar badan dari Spesies ini lebih besar dibanding sinoglossis, bentuk mulut dan posisi rahang berbeda dengan Sinoglossus sp.. Kepalanya juga lebih besar dan usus dibagian ventralnya sudah mulai nampak terbentuk, sirip halus yang sangat tipis sudah namapak terlihat mengelilingi bagian sisi ventral dan dorsal tubuhnya tanpa kecuali pada bagian kepala, dan hanya tersisa bagian depan sebelum mulut, sedangkan batas tumbuh sirip dibagian ventral sapai pada bagian perut bawah. Jika dilihat secara sepintas panjang tubuhnya hampir sama dengan lebar tubuhnya terutama disebabkan oleh terjadinya pelebaran pada bagian perut pada Stadia ini. Tubuh juga sangat pipih dan tipis. Literatur :Larval soleids mempunyai badan yang pipih, menyamping, terdapat suatu saluran usus. pada awalnya bagian sisinya simetris. Ada 33-47 myomeres (420 + 20-38). Preanal myomeres berkurang seiring dengan pertumbuhan karena anal berpindah ke depan. Usus berupa tabung yang tebal bergulung, dan tampak di bawah sirip perut, tidak terjumbai. Anal lebih sempit. pada preflexion larva biasanya lebih besar dari 50% BL, karena anus berpindah secara perlahan ke depan. Pada postflexion larva kurang dari 50% BL. Dari Stadia flexion usus akan melurus dan tereduksi kembali ke dalam rongga yang abdominal, pada saat anal tidak di posterior bagian usus. Gelembung renang pada beberapa Spesies terdapat dipertengahan hingga ke pertengahan ventral usus. kepala yang dimampatkan bersifat moderat dalamkeadaan variabel dan ukuran yang melebar. Tetapi menjadi dibulat dengan suatu profil di bagian belakang lebih cembung (kecuali selama perpindahan mata dibeberapa Spesies). Mulut pendek dan biasanya bulat. 83 Prolarva Spesies Stadia post larva/kepala ekor ekor : Urolophus sp. : Yolk sac larvae Telur Telur 1 badan yolk sac preplexion larva Telur 2 84 Lampiran 8. Gambar Jaring larva untuk pengambilan sampel. a b c d e Net Larva. a. Tali penarik, b. flow meter, c. Jaring larva 350 mikron, d. tabung larva, e. Pengoprasian. 85