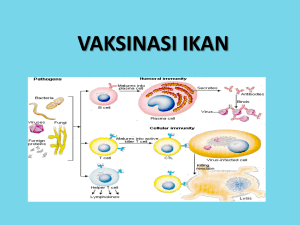
GAMBARAN DARAH IKAN MAS Cyprinus carpio SETELAH
advertisement

PENGUJIAN EFEKTIVITAS DOSIS VAKSIN DNA DAN KORELASINYA TERHADAP PARAMETER HEMATOLOGI SECARA KUANTITATIF NUR AKBAR MASWAN SKRIPSI PROGRAM STUDI TEKNOLOGI DAN MANAJEMEN AKUAKULTUR FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR 2009 PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI Dengan ini saya menyatakan bahwa skripsi yang berjudul : PENGUJIAN EFEKTIVITAS DOSIS VAKSIN DNA DAN KORELASINYA TERHADAP PARAMETER HEMATOLOGI SECARA KUANTITATIF adalah benar merupakan karya sendiri dan belum digunakan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini. Bogor, Agustus 2009 NUR AKBAR MASWAN C14104036 RINGKASAN NUR AKBAR MASWAN. Pengujian Efektivitas Dosis Vaksin DNA Dan Korelasinya Terhadap Parameter Hematologi Secara Kuantitatif. Dibimbing oleh SRI NURYATI dan AYI SANTIKA. Ikan mas adalah ikan konsumsi air tawar yang banyak digemari oleh masyarakat Indonesia, sedangkan ikan koi adalah jenis ikan hias yang memiliki nilai ekonomis penting yang dibudidayakan di Indonesia karena banyak menarik perhatian para peminat ikan hias. Namun sejak Maret 2002, pembudidaya ikan mas dan koi di Indonesia menghadapi wabah penyakit yang serius akibat koi herpesvirus (KHV) Upaya penanggulangan wabah KHV telah dilakukan salah satu cara efektif adalah membuat kekebalan spesifik pada ikan dengan pemberian vaksin. Hal ini karena vaksin dapat merangsang kekebalan spesifik dan kekebalan yang timbul relatif tinggi. Vaksin DNA menawarkan suatu metoda imunisasi yang menanggulangi beberapa kelemahan vaksin tradisional (vaksin hidup dan vaksin mati) seperti resiko infeksi dan biaya yang mahal. Penelitian ini bertujuan untuk menguji pengaruh dosis vaksin DNA 2.5, 7.5 dan 12.5 µg/100µl terhadap parameter gambaran darah ikan mas pada saat vaksinasi maupun ketika diuji tantang dengan virus KHV. Penelitian ini dilaksanakan pada bulan Januari hingga Maret 2009, bertempat di Laboratorium Kesehatan Ikan, Balai Besar Pengembangan Budidaya Air Tawar (BBPBAT) Sukabumi, Jawa Barat dan Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Ikan mas yang digunakan berasal dari Cianjur, prosedur penelitian ini dilakukan melalui beberapa tahap yaitu: 1) persiapan wadah dan ikan uji; 2) vaksinasi melalui penyuntikan vaksin DNA secara intramuskular dengan tiga tingkatan dosis yaitu 2.5 µg/100µl, 7.5 µg/100µl dan 12.5 µg/100µl; 3) uji tantang dilakukan pada hari ke-43 dengan menginjeksi virus aktif dosis pengenceran 10-3, sebanyak 0,1 ml melalui intramuskular (otot punggung) ke semua ikan uji. Paramater yang diamati adalah gambaran darah ikan meliputi jumlah eritrosit, kadar hemoglobin, hematokrit, leukosit total, hitung jenis (diferensial) leukosit, aktivitas fagositik dan identifikasi bakteri. Pengamatan dilakukan selama masa vaksinasi (hari ke-7 – 42) dan masa setelah uji tantang (hari ke-49 – 70). Hasil penelitian menunjukan bahwa vaksin DNA dengan dosis 2.5, 7.5 dan 12.5 µg/100µl selama masa vaksinasi memberikan pengaruh terhadap beberapa parameter gambaran darah ikan mas yaitu total leukosit, persentase limfosit dalam darah dan indeks fagositik. Sedangkan pada masa uji tantang dengan virus KHV pengenceran 10-3 parameter darah yang terlihat berpengaruh nyata adalah limfosit, monosit dan indeks fagositik. Pada akhir pengamatan, perlakuan C (dosis12.5 µg/100µl) menunjukan persentase limfosit tertinggi, total rataan eritrosit tertinggi dan persentase monosit yang lebih cepat turun dari kedua perlakuan dosis lainnya, sehingga dapat disimpulkan bahwa vaksin DNA dengan dosis 12.5 µg/100µl memberikan efektifitas (respon tanggap kebal) terbaik dibandingkan dengan kedua dosis yang lain. PENGUJIAN EFEKTIVITAS DOSIS VAKSIN DNA DAN KORELASINYA TERHADAP PARAMETER HEMATOLOGI SECARA KUANTITATIF NUR AKBAR MASWAN SKRIPSI Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan Pada Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor PROGRAM STUDI TEKNOLOGI DAN MANAJEMEN AKUAKULTUR FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR 2009 Judul : PENGUJIAN EFEKTIVITAS DOSIS VAKSIN DNA DAN KORELASINYA TERHADAP PARAMETER HEMATOLOGI SECARA KUANTITATIF Nama : Nur Akbar Maswan Nomor Pokok : C14104036 Menyetujui, Pembimbing I Pembimbing II Sri Nuryati, M.Si NIP :197106061995122001 Ayi Santika, M.Si NIP : 196903131998031003 Mengetahui, Dekan Fakultas Perikanan dan Ilmu Kelautan Prof. Dr. Ir. Indra Jaya, M.Sc. NIP. 196104101986011002 Tanggal Lulus : KATA PENGANTAR Alhamdulillaahirabbil’aalamin, puji syukur Penulis panjatkan kehadirat Allah Swt karena atas rahmat, hidayah dan karunia-Nya Skripsi yang berjudul “Pengujian Efektivitas Dosis Vaksin DNA Dan Korelasinya Terhadap Parameter Hematologi Secara Kuantitatif” ini dapat diselesaikan. Penulisan Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana pada Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Dalam kesempatan ini Penulis mengucapkan terima kasih yang setulustulusnya kepada : 1. Ibu Sri Nuryati, M.Si selaku Pembimbing I serta Bapak Ayi Santika, M.Si selaku pembimbing II yang telah banyak memberikan bimbingan dan masukan dalam menyelesaikan skripsi ini. 2. Ibu Dr. Dinar Tri Soelistyowati selaku Dosen Penguji Tamu yang telah memberikan banyak masukan dalam menyelesaikan skripsi ini. 3. Ayahanda Bakarrudin Maswan, Ibunda Nuri Soraya, kakakku Fitria Fithona, Farida Fatmah dan adikku Fathi Muhammad, atas kasih sayang, doa, dukungan semangat baik moril dan materi. 4. Pak Ranta, Kang udin, mba Ana, bu Ayu atas bantuan yang diberikan. 5. Iswi Hayati, Dwi, Riki, Mauluddin, Rahman Saleh, Dani, dan Yudha atas kebersamaan, kerjasama dan dukungannya. 6. Teman-teman BDP 41, kakak kelas BDP’40, BDP’39 dan BDP’38 adik kelas BDP 42 atas persahabatan dan bantuan yang diberikan. Akhir kata semoga skripsi ini bermanfaat khususnya bagi Penulis dan juga bagi semua pihak yang memerlukan informasi yang berhubungan dengan tulisan ini. Amin. Bogor, Agustus 2009 Nur Akbar Maswan DAFTAR RIWAYAT HIDUP Penulis dilahirkan di Jakarta, 14 Agustus 1986, adalah anak ketiga dari empat bersaudara dari ayah bernama Bakarrudin Maswan dan ibu Nuri Soraya. Pendidikan formal yang dilalui penulis yaitu SD Angkasa I Bogor, SLTPN 7 Bogor, SMUN 5 Bogor. Pada tahun 2004, Penulis mendapat kesempatan untuk melanjutkan pendidikan tinggi ke Intitut Pertanian Bogor di Fakultas Perikanan dan Ilmu Kelautan pada Program Studi Teknologi dan Manajemen Akuakultur melalui Jalur USMI (Undangan Seleksi Masuk IPB). Selama kuliah, Penulis pernah aktif dalam organisasi kemahasiswaan yaitu Himpunan Mahasiswa Akuakultur (HIMAKUA) sebagai staf Departemen Kewirausahawan (2005-2006). Selain itu, Penulis juga pernah menjadi Asisten Mata Kuliah Dasar-Dasar mikrobiologi (2008/2009), Penyakit dan Parasit Ikan (2008/2009). Dalam usaha menambah wawasan di bidang akuakultur, penulis melakukan Praktek Pembenihan ikan patin dan Pembesaran udang galah di Loka Riset Pemuliaan Teknologi dan Pengembangan Budidaya Air Tawar, SukamandiSubang, Jawa Barat pada bulan Juli - Agustus 2007. Tugas akhir di perguruan tinggi Penulis selesaikan dengan menulis Skripsi yang berjudul “Pengujian Efektivitas Dosis Vaksin DNA Dan Korelasinya Terhadap Parameter Hematologi Secara Kuantitatif”. DAFTAR ISI Halaman DAFTAR TABEL ...................................................................................... iii DAFTAR GAMBAR .................................................................................. iv DAFTAR LAMPIRAN .............................................................................. v I. PENDAHULUAN 1.1 Latar Belakang ................................................................................. 1 1.2 Tujuan .............................................................................................. 2 II. TINJAUAN PUSTAKA 2.1 Koi Herpesvirus (KHV) .................................................................... 2.2 Hematologi........................................................................................ 2.3 Sistem Pertahanan Ikan .................................................................... 2.4 Vaksin DNA ..................................................................................... 3 6 8 14 III. METODOLOGI 3.1 Waktu dan Tempat ........................................................................... 3.2 Alat dan Bahan ................................................................................. 3.3 Prosedur Penelitian ........................................................................... 3.3.1 Persiapan Wadah ..................................................................... 3.3.2 Persiapan Ikan Uji ................................................................... 3.3.3 Penyuntikan Vaksin DNA ......................................................... 3.3.4 Penyediaan Suspensi KHV........................................................ 3.3.5 Uji Tantang ............................................................................... 3.4 Metode Pengukuran Hematologi ....................................................... 3.4.1 Pengambilan Darah.................................................................. 3.4.2 Perhitungan Kadar Hemoglobin ............................................... 3.4.3 Perhitungan Kadar Hematokrit ................................................. 3.4.4 Penghitungan Total Eritrosit .................................................... 3.4.5 Penghitungan Total Leukosit ................................................... 3.4.6 Pembuatan Preparat Ulas Darah ............................................... 3.4.7 Indeks Fagositik....................................................................... 3.5 Analisa Data ..................................................................................... 18 18 18 18 18 19 19 19 19 19 20 20 20 21 21 22 22 IV. HASIL DAN PEMBAHASAN 4.1 Hasil ................................................................................................ 4.1.1 Total Leukosit .......................................................................... 4.1.2 Differensial Leukosit ................................................................ 4.1.3 Total Eritrosit............................................................................ 4.1.4 Kadar Hemoglobin .................................................................... 4.1.5 Kadar Hematokrit .................................................................... 4.1.6 Indeks Fagositik ........................................................................ 4.2 Pembahasan .................................................................................... 23 23 24 28 29 30 31 32 V. KESIMPULAN DAN SARAN 5.1 Kesimpulan ..................................................................................... 39 5.2 Saran ............................................................................................... 39 DAFTAR PUSTAKA ................................................................................. 40 LAMPIRAN ............................................................................................... 43 DAFTAR TABEL Halaman 1. Keuntungan dan Kekurangan Vaksin DNA ............................................... 15 2. Jumlah Rataan Leukosit Pada Setiap Perlakuan Selama Vaksinasi ............ 23 3. Jumlah Rataan Leukosit Pada Setiap Perlakuan Selama Uji Tantang ......... 23 4. Persentase Rataan Limfosit Pada Setiap Perlakuan Selama Vaksinasi ........ 25 5. Persentase Rataan Limfosit Pada Setiap Perlakuan Selama Uji Tantang .... 25 6. Persentase Rataan Monosit Pada Setiap Perlakuan Selama Vaksinasi ....... 26 7. Persentase Rataan Monosit Pada Setiap Perlakuan Selama Uji Tantang .... 26 8. Persentase Rataan Neutrofil Pada Setiap Perlakuan Selama Vaksinasi ....... 27 9. Persentase Rataan Neutrofil Pada Setiap Perlakuan Selama Uji Tantang ... 27 10. Jumlah Rataan Eritrosit Pada Setiap Perlakuan Selama Vaksinasi ........... 28 11. Jumlah Rataan Eritrosit Pada Setiap Perlakuan Selama Uji Tantang ........ 29 12. Nilai Rataan Hemoglobin Pada Setiap Perlakuan Selama Vaksinasi ........ 30 13. Nilai Rataan Hemoglobin Pada Setiap Perlakuan Selama Uji Tantang .... 30 14. Nilai Rataan Hematokrit Pada Setiap Perlakuan Selama Vaksinasi .......... 30 15. Nilai Rataan Hematokrit Pada Setiap Perlakuan Selama Uji Tantang ....... 31 16. Nilai Indeks Fagositik Pada Setiap Perlakuan Selama Vaksinasi............. 31 17. Nilai Indeks Fagositik Pada Setiap Perlakuan Selama Uji Tantang .......... 31 DAFTAR GAMBAR Halaman 1. Hubungan tingkat dosis dengan jumlah total leukosit ikan mas pada hari ke-21 dan 42..................................................................................................24 2. Hubungan tingkat dosis dengan persentase limfosit ikan mas pada hari ke-28 dan 63..................................................................................................25 3. Hubungan tingkat dosis dengan persentase rataan monosit ikan mas pada hari ke-63 ......................................................................................................26 4. Hubungan tingkat dosis dengan persentase rataan neutrofil ikan mas pada hari ke-14 dan 63 ...........................................................................................28 5. Hubungan tingkat dosis dengan jumlah rataan eritrosit ikan mas pada hari ke-63 .............................................................................................................29 6. Hubungan tingkat dosis dengan persentase rataan indeks fagositik ikan mas pada hari ke-28, 35, 42, 49 dan 63 ..........................................................32 7. Sel darah pada ikan mas : Eritrosit (E), Monosit (M), Neutrofil (N), Limfosit (L)...................................................................................................37 8. Proses fagositosis ...........................................................................................37 DAFTAR LAMPIRAN Halaman 1. Kadar Hemoglobin, Kadar Hematokrit, Total Eritrosit dan Total Leukosit 44 2. Differensial Leukosit ................................................................................. 46 3. Indeks Fagositik ........................................................................................ 47 4. Hasil Uji Identifikasi Bakteri..................................................................... 48 5. Suhu Selama Uji Tantang .......................................................................... 48 6. Analisis Sidik Ragam (ANOVA) .............................................................. 48 1 I. PENDAHULUAN 1.1 Latar belakang Ikan mas adalah ikan konsumsi air tawar yang banyak digemari oleh masyarakat Indonesia, sedangkan ikan koi adalah jenis ikan hias yang memiliki nilai ekonomis penting yang dibudidayakan di Indonesia karena banyak menarik perhatian para peminat ikan hias. Setiap tahun produksi budidaya ikan mas terus meningkat : 56,546 metrik ton (MT) (1998), 57,278 MT (1999), 75,322 MT (2000), 76,475 MT (2001) dan 83,885 MT (2002). 50% hasil produksi tersebut dikontribusi dari daerah Jawa Barat (Sunarto et al. 2005). Namun sejak Maret 2002, pembudidaya ikan mas dan koi di Indonesia menghadapi wabah penyakit yang serius akibat koi herpesvirus (KHV) (Sunarto et al. 2005). KHV bersifat sangat menular namun terbatas menyerang ikan mas dan koi (Cyprinus carpio), mengakibatkan mortalitas tinggi (80-95% populasi) (Sunarto et al. 2005). Kasus ini telah mengakibatkan kerugian besar bagi petani, penggemar serta pengusaha ikan mas dan koi. Kerugian yang tercatat di Indonesia, berdasarkan informasi yang dikumpulkan hingga bulan Desember 2003 kerugian akibat serangan KHV mencapai Rp 100 - 150 milyar (Sunarto et al. 2005). Patogenitas KHV sangat tinggi dan penyebarannya sangat cepat, sehingga dianggap sebagai salah satu penyakit yang paling serius dalam budidaya ikan air tawar. Upaya penanggulangan wabah KHV telah dilakukan dengan menggunakan bahan kimia atau obat-obatan, namun terbukti tidak efektif. Obat-obatan tersebut hanya membantu mengatasi infeksi sekunder oleh bakteri, fungi atau parasit. Ketidakefektifan pengobatan tersebut dikarenakan patogenitas KHV di dalam tubuh ikan berlangsung antar sel sehingga tidak perlu keluar sel dan masuk ke dalam sistem sirkulasi tubuh inang untuk penyebarannya. Oleh karena itu, diperlukan suatu alternatif lain yang dapat mengatasi masalah yang ditimbulkan oleh penyakit virus tersebut. Salah satu cara efektif adalah membuat kekebalan spesifik pada ikan dengan pemberian vaksin. Hal ini karena vaksin dapat merangsang kekebalan spesifik dan kekebalan yang timbul relatif tinggi. Beberapa tahun terakhir telah ditemukan vaksin jenis terbaru yaitu vaksin DNA. Vaksin ini mengandung satu atau lebih gen yang memberi kode sebagian sifat antigenik suatu virus core protein atau envelope protein. Ekspresi antigen yang terjadi di dalam sel inang yang telah divaksinasi merangsang pengaktivan sistem kekebalan tubuh inang (Lorenzen & Lapatra 2005). Vaksin DNA menawarkan suatu metoda imunisasi (pengebalan) yang menanggulangi beberapa kelemahan vaksin tradisional (vaksin hidup dan vaksin mati) seperti resiko infeksi dan biaya yang mahal (Zheng et al. 2006). DNA vaksin memiliki kelebihan dari pada vaksin konvensional, mencakup kemampuan untuk mempengaruhi suatu jangkauan jenis tanggapan kebal yang lebih luas (Naim 2004). Sel dan cairan darah (plasma darah) merupakan aspek diagnosa yang penting untuk dikaji, karena kedua aspek tersebut mempunyai peran fisiologis yang sangat penting serta mampu menggambarkan kondisi kesehatan ikan. Svobodova dan Vyukusova (1991) menjelaskan bahwa pemeriksaan darah dapat membantu untuk memantapkan tujuan diagnostik, beberapa diantara tujuan tersebut adalah untuk mengevaluasi kondisi ikan, menguji efek zat beracun pada ikan, untuk menguji pantas tidaknya makanan untuk ikan dan mengevaluasi efek tekanan situasi. Nabib dan Pasaribu (1989) menjelaskan pula bahwa, suatu pemeriksaan darah sangatlah perlu pada keadaan patologis dan kita bisa mendapatkan pelengkap diagnosa. Susunan darah ikan merupakan faktor diagnostik penting, sehingga perubahan gambaran darah banyak digunakan untuk menilai status kesehatan ikan (Amrullah 2004). Pada penelitian ini, parameter hematologi yang diamati meliputi jumlah eritrosit, kadar hemoglobin, hematokrit, leukosit total, hitung jenis (diferensial) leukosit dan aktivitas fagositik. 1.2 Tujuan Penelitian ini bertujuan untuk menguji pengaruh dan efektivitas dosis vaksin DNA 2.5, 7.5 dan 12.5 µg/100µl terhadap parameter gambaran darah ikan mas pada saat vaksinasi maupun ketika diuji tantang dengan virus KHV. 3 II. TINJAUAN PUSTAKA 2.1 Koi Herpesvirus (KHV) 2.1.1 Kronologis Kejadian Serangan KHV pada ikan mas dan koi telah tersebar ke berbagai belahan dunia sejak tahun 1998, meliputi beberapa negara seperti Amerika Serikat, Jerman, Italia, Belanda, Israel (Gilad et al. 2003); Jepang (Sano et al. 2005); dan sejak Maret 2002 tercatat menyerang berbagai kawasan di Indonesia (Sunarto et al. 2005). Di Indonesia, infeksi KHV berawal dari ikan koi yang didatangkan dari Cina pada bulan Desember 2001 dan Januari 2002 yang masuk ke Surabaya selanjutnya dibawa ke Blitar dan mulailah terjangkit wabah KHV yang mengakibatkan kematian massal (80-95%). Blitar merupakan pusat budidaya ikan koi di Indonesia. Koi yang terinfeksi KHV didistribusikan ke daerah sekitar pulau Jawa, seperti Jawa Tengah, Jawa Barat, dan Jakarta yang menjadi pasar utama. Di daerah Jawa Barat wabah KHV mulai merambah daerah Subang pada bulan April 2002 dan pada bulan Mei 2002 di waduk Cirata). Kemudian pada Februari 2003 wabah KHV mulai merambah ke daerah Lubuk Linggau, Sumatera Selatan. Ikan mas di Lubuk Linggau terinfeksi KHV akibat tertular ikan mas yang didatangkan dari waduk Cirata, Jawa Barat. Wabah menyebar ke daerah sekitar Sumatera Selatan yaitu Bengkulu dan Jambi (Sunarto et al. 2005). Dampak sosial-ekonomi yang diakibatkan oleh virus KHV tersebut pertama kali terjadi daerah Blitar. Asosiasi pembudidaya ikan koi di Blitar melaporkan bahwa pada 3 bulan pertama setelah terjadi wabah KHV (Juli 2002), sabanyak 5000 petani ikan mengalami kerugian ekonomi yang bila ditotal mencapai Rp 5 miliar. Sedangkan sampai bulan Desember 2003 kerugian akibat serangan KHV mencapai Rp 100 - 150 milyar. Kerugian yang disebabkan oleh infeksi virus ini sangat besar, sehingga untuk menanggulangi kerugian yang diderita, para petani terpaksa menjual ikannya dengan murah. KHV merupakan penyakit yang paling serius pada budidaya ikan air tawar karena patogenisitas KHV sangat tinggi dan penyebarannya yang cepat (Sunarto et al. 2005). 2.1.2 Karakteristik Koi Herpesvirus KHV merupakan penyakit viral pada ikan mas dan koi yang sangat menular dan mengakibatkan morbiditas dan mortalitas antara 80 – 100% dari populasi ikan, dengan masa inkubasi 1 – 14 hari. Individu yang bertahan hidup sekitar 20% pada saat terjadi wabah umumnya akan menjadi tahan (resisten) terhadap infeksi berikutnya. Namun ketahanan tersebut tidak menunjukan adanya transfer kepada keturunannya (Taukhid et al. 2004). Waltzek et al. (2005) menyatakan koi herpesvirus (KHV) merupakan salah satu virus DNA dari famili Herpesviridae, dikenal juga sebagai cyprinid herpesvirus-3 atau CyHV3. Penelitian yang dilakukan oleh Waltzek et al. (2005) menunjukkan bukti kuat bahwa KHV tergolong virus herpes. Berdasarkan pada morfologi dan genetikanya, KHV memiliki hubungan yang erat dengan kedua jenis virus herpes lainnya yaitu carp pox virus( cyprinid herpesvirus-1 atau Cyhv1) dan hematopoietic necrosis herpesvirus gold fish ( cyprinid herpesvirus-2 atau Cyhv-2). Virus herpes merupakan virus yang berukuran besar dibandingkan dengan virus lain. Secara morfologik, anggota virus herpes mempunyai arsitektur yang serupa. Morfologi, sturktur virus herpes dari bagian dalam ke bagian luar terdiri dari genom DNA untai ganda linier berbentuk toroid, kapsid, lapisan tegument dan selubung. Kapsid terdiri atas protein yang tersusun dalam simetri ikosahedral. Menurut Miwa et al. (2007) inti sel yang terinfeksi KHV mengandung banyak kapsid KHV dengan diameter 110 nm dan morfologi yang bervariasi. Tegumen yang terdapat diantara kapsid dan selubung merupakan massa fibrous dengan ketebalan bervariasi dan sering kali asimetrik (Daili dan Makes 2002). Selubung, jika dilihat dibawah mikroskop elektron tampak seperti susunan tiga lapis. Sebagian selubung berasal dari membran sel yang diinfeksinya. Karena dalam selubung terkadung unsur lipid, virus herpes menjadi sensitif terhadap pengaruh deterjen dan pelarut lipid lainnya. Selubung virion dewasa, memiliki kisaran diameter 170 - 200 nm (Miwa et al. 2007). Dari selubung keluar tonjolantonjolan yang disebut spike yang jumlahnya lebih banyak dibandingkan dengan virus berselubung lainnya. Tonjolan tersebut tersusun atas glikoprotein dengan 5 panjang tonjolan 8 nm. Jenis dan jumlah glikoprotein selubung virus herpes bervariasi (Daili dan Makes 2002). Kelompok Herpesvirus umumnya memiliki karakter yang unik, yaitu memiliki kemampuan untuk survive latent dalam sel inang untuk jangka waktu yang lama dan akan menjadi aktif kembali apabila ada pemicu seperti perubahan lingkungan atau stres yang terjadi pada inang (Taukhid et al. 2004). Sejumlah virus herpes tinggal tetap dalam bentuk laten seumur hidup induk semangnya (Malole 1988). Mekanisme penularan KHV umumnya terjadi melalui kontak antar ikan, cairan dari ikan yang terinfeksi, lewat air atau lumpur yang terkontaminasi, serta peralatan perikanan (Sunarto et al. 2005). Hal ini didukung pula oleh pendapat Perelberg et al. (2003) bahwa partikel virus KHV masih dapat bertahan di luar inang (dalam air) dan masih infektif sekurang-kurangnya selama 4 jam. Di sisi lain mekanisme infeksi KHV sangat dipengaruhi pula oleh faktor suhu lingkungan (Gilad et al. 2003). Dalam sistem budidaya virus ini dapat menginfeksi ikan pada suhu lingkungan yang sangat spesifik, yaitu pada suhu air 18-25oC (Ronen et al. 2003), 18-28 oC (Gilad et al. 2003). Kematian ikan terjadi sangat cepat antara 7 – 12 hari setelah infeksi, dengan tingkat kematian 80-95% dalam waktu satu minggu sejak gejala klinis pertama muncul (Gilad et al. 2003), atau bahkan 1-2 hari setelah muncul gejala klinis yang pertama (Hartman et al. 2004). Namun, kematian ikan akan menurun bahkan berhenti bila suhu berada diatas atau dibawah kisaran toleransi suhu tersebut (Gilad et al. 2003). Kisaran suhu optimal bagi kehidupan (replikasi) KHV yang diamati pada penelitian secara in vitro yaitu pada kisaran 15 – 25 oC dan tidak ada atau minimum replikasinya pada suhu 4, 10, 30, 37 o (Gilad et al. 2003). 2.1.3 Gejala Klinis Gejala klinis ikan mas yang terinfeksi KHV menunjukan kondisi ikan yang lemah, kehilangan keseimbangan dan kesulitan bernafas. Penampakan luar yang umum terjadi yaitu pengelupasan epitelium dengan produksi mukus berkurang dan kulit terasa kasar, pendarahan (hemoragi) pada operkulum, sirip ekor dan perut yang disertai kerusakan pada insang (Sunarto et al. 2005). Lebih lengkap Taukhid et al. (2004) menunjukan beberapa gejala-gejala yang timbul pada ikan mas dan koi yang terinfeksi koi herpes virus : 1) produksi lendir (mukus) berlebih sebagai respon fisiologis terhadap kehadiran patogen, selanjutnya produksi lendir menurun drastis sehingga tubuh ikan terasa kasat, 2) insang berwarna pucat dan terdapat bercak putih atau coklat (sebenarnya adalah kematian sel-sel insang atau nekrosa insang), selanjutnya menjadi rusak, geripis pada ujung tapis insang dan akhirnya membusuk. Secara mikroskopis terjadi adanya kerusakan jaringan yang serius serta kematian sel yang berat, 3) pendarahan (hemoragi) disekitar pangkal dan ujung sirip serta permukaan tubuh lainnya, 4) adanya kulit melepuh, 5) hati berwarna pucat selanjutnya menjadi rusak, 6) ginjal (anterior dan posterior) berwarna pucat. 2.2 Hematologi Darah ikan tersusun dari sel-sel yang tersuspensi dalam plasma dan diedarkan ke seluruh jaringan tubuh melalui sistem sirkulasi tertutup. Menurut Takashima dan Hibiya (1995), darah tersusun atas cairan darah (plasma darah) dan elemen-elemen seluler ( sel-sel darah). Plasma darah terdiri dari air, protein (yakni albumin, globulin dan faktor-faktor koagualasi), lipid dan ion, adapun sel darah terdiri dari sel darah merah (eritrosit) dan sel darah putih (leukosit). Sel darah merah (eritrosit) ikan mempunyai inti, umumnya berbentuk bulat dan oval tergantung pada jenis ikannya. Inti sel eritrosit terletak sentral dengan sitoplasma terlihat jernih kebiruan dengan pewarnaan giemsa (Chinabut et al. 1991). Jumlah eritrosit berbeda-beda pada berbagai spesies dan juga sangat dipengaruhi oleh suhu, namun umumnya berkisar antara 1 - 3 juta sel/mm3 (Takashima & Hibiya 1995). Penentuan kadar hematokrit dan hemoglobin dalam cairan darah berguna untuk melihat kesehatan ikan serta hubungan antara darah dan hormon pada ikan. Kadar hematokrit yaitu persentase volume sel darah merah pada ikan mas berkisar antara 28 – 40 % (Svobodova & Vyukusova 1991). Kadar hemoglobin adalah banyaknya hemoglobin (g) per 100cc volume darah. Hasil kadar hemoglobin yang diperoleh untuk ikan mas adalah 6 - 10 g% (gram/100cc darah) (Svobodova & Vyukusova 1991). 7 Sel darah putih (leukosit) ikan merupakan bagian dari sistem pertahanan tubuh yang bersifat non-spesifik. Leukosit ikan terdiri dari granulosit dan agranulosit. Lagler et al. (1977) mengungkapkan, bahwa agranulosit terdiri dari limfosit, monosit dan trombosit, sedangkan granulosit terdiri dari basofil, netrofil dan eosinofil. Moyle dan Cech (1988) menjelaskan bahwa jumlah sel darah putih lebih rendah dibandingkan dengan sel darah merah yaitu berkisar 20.000 sel/mm3 – 150.000 sel/mm3. Perubahan nilai leukosit total dan persentase jenis leukosit sering dijadikan petunjuk keadaan fisiologi ikan atau indikator keberadaan penyakit pada tubuh ikan. Limfosit adalah berupa sel darah kecil dengan nukleus yang besar (menempati bagian terbesar dari sel) tidak bergranula dan dikelilingi sejumlah kecil sitoplasma (Chinabut et al. 1991). Limfosit biasanya merupakan proporsi sel darah putih terbanyak (Takashima & Hibiya 1995). Jumlah limfosit pada ikan lebih besar dari pada mamalia dengan kepadatan 48.000 sel/mm3 (Nabib dan Pasaribu 1989). Menurut Svobodova dan Vyukusova (1991) kisaran limfosit adalah 76 – 97,5 % dari total leukosit. Limfosit merupakan sel-sel respon pertahanan tubuh terpenting, dan diklasifikasikan ke dalam 2 sub-kelas : sel B dan sel T. Sel B mempunyai kemampuan untuk bertransformasi menjadi sel plasma yaitu sel yang memproduksi antibodi. Sedangkan sel T sangat berperan dalam mengontrol respon imun (Takashima & Hibiya 1995). Monosit ikan berbentuk bulat oval, intinya terletak ditengah sel dengan sitoplasmanya tidak bergranula (Takashima & Hibiya 1995). Monosit dihasilkan dari jaringan haemapoietik dalam ginjal yang siap untuk melakukan fungsinya dalam jaringan, kisaran jumlah monosit sebesar 3 - 5 % dari jumlah leukosit (Svobodova & Vyukusova 1991). Monosit berkemampuan masuk ke jaringan dan berdiferensiasi menjadi sel makrofag. Peran monosit sangat penting, sebagai sel fagosit utama untuk menghancurkan berbagai patogen penyerang dan berperan pula sebagai antigen presenting cells (APC) yang fungsinya untuk menyajikan antigen kepada sel limfosit (Kresno 2001). Netrofil ikan berbentuk bulat dengan inti dapat memenuhi sebagian ruang sitoplasma (diamaeter 9-13 µm) dan terdapat granula dalam sitoplasmanya (Chinabut et al. 1991). Seperti halnya monosit, sel netrofil berperan pula dalam respon nonspesifik dengan melakukan fagositosis untuk menyingkirkan mikroorganisme penyerang (Kresno 2001). Jumlah netrofil berkisar antara 2 – 10 % dari total leukosit (Svobodova & Vyukusova 1991). Sel dan cairan darah (plasma darah) merupakan aspek diagnosa yang penting untuk dikaji, karena kedua aspek tersebut mempunyai peran fisiologis yang sangat penting serta mampu menggambarkan kondisi kesehatan ikan. Svobodova dan Vyukusova (1991) menjelaskan bahwa pemeriksaan darah dapat membantu untuk memantapkan tujuan diagnostik, beberapa diantara tujuan tersebut adalah untuk mengevaluasi kondisi ikan, menguji efek zat beracun pada ikan, untuk menguji pantas tidaknya makanan untuk ikan dan mengevaluasi efek tekanan situasi. Nabib dan Pasaribu (1989) menjelaskan pula bahwa, suatu pemeriksaan darah sangatlah perlu pada keadaan patologis dan kita bisa mendapatkan pelengkap diagnosa. Susunan darah ikan merupakan faktor diagnostik panting, sehingga perubahan gambaran darah banyak digunakan untuk menilai status kesehatan ikan (Amrullah 2004). Dalam penelitan hematologik ikan, parameter darah yang diukur meliputi jumlah eritrosit, kadar hemoglobin, hematokrit, leukosit total dan hitung jenis (diferensial) leukosit (Nabib & Pasaribu 1989; Svobodova & Vyukusova 1991). Rendahnya jumlah eritrosit menunjukan ikan mengalami infeksi (Nabib dan Pasaribu 1989). Perubahan nilai leukosit total dan hitungan jenis leukosit dapat dijadikan indikator adanya penyakit infeksi tertentu yang terjadi pada ikan (Moyle & Cech 1988). Lagler et al. (1977) mengatakan, bahwa kadar Hemoglobin (Hb) dalam darah ikan berkaitan dengan jumlah eritrosit. Hemoglobin mengangkut oksigen dalam ikatan dengan Fe (besi) dari darah. Kadar hematokrit yang abnormal dapat dijadikan petunjuk mengenai rendahnya kandungan protein pakan atau ikan mendapat infeksi (Blaxhall 1972 dalam Anderson 1990). 2.3 Sistem Pertahanan Ikan Ikan seperti hewan pada umumnya, memiliki mekanisme pertahanan diri terhadap patogen. Sistem pertahanan tersebut terdiri dari sistem pertahanan 9 konstitutif dan yang diinduksi (inducible). Sistem pertahanan konstitutif menjalankan perlindungan secara umum terhadap invasi flora normal, kolonisasi, dan penyakit infeksi yang disebabkan oleh patogen. Sistem pertahanan konstitutif dikenal pula sebagai sistem pertahanan innate (bawaan atau alami). Adapun sistem pertahanan yang diinduksi atau dapatan (acquaired), maka untuk berfungsi dengan baik harus diinduksi antara lain dengan pemaparan pada patogen atau produk-produk yang berasal dari patogen (misal: LPS, vaksin) (Irianto 2005). Ikan merupakan rantai penghubung antara invertebrata dan vertebrata tingkat tinggi. Meskipun sistem imun belum selengkap pada vertebrata tinggi tetapi jauh lebih berkembang dibandingkan sistem imun pada invertebrata (Irianto 2005). Ikan memiliki kemampuan respon imun humoral dan yang diperantai sel (cell mediated immune respon). Selain itu pada ikan sudah mulai terdapat respon imun spesifik terhadap antigen (immunoglobulin). Selain itu organ limfoid (organ yang merespon antigen) serta myeloid (organ penghasil darah) menjadi satu, yaitu pada ginjal untuk teleostei (Irianto 2005). Pada ikan teleostei ginjal merupakan organ limfoid penting. Secara umum ginjal ikan terdiri dari tiga bagian yaitu ginjal anterior, bagian tengah, dan posterior. Ginjal anterior merupakan situs yang memiliki kapasitas hematopoietik tertinggi tetapi memiliki fungsi renal yang terbatas. Pada ginjal ditemukan adanya limfosit mirip sel B dan sel T yang menunjukan peran jaringan limfoid ginjal dalam mekanisme pertahanan tubuh. Organ limfoid sekunder meliputi limpa dan jaringan limfoid yang berasosiasi dengan intestinum (gut-associated lymphoid tissue, GALT) (Irianto 2005). Pada ikan teleostei terdapat dua macam sistem imun yaitu sistem imun bawaan atau alamiah (innate) yang bersifat spesifik dan sistem imun dapatan (adaptive) yang bersifat spesifik. Kedua macam sistem imun tersebut mirip dengan sistem imun mamalia, meskipun akibat perkembangan evolusinya menyebabkan ikan memiliki aspek imunitas yang spesifik. Perbedaan terbesar diantara mamalia dan teleostei, yaitu pada teleostei tidak ada nodus limfatikus serta ontogeni leukosit dan sistem imunnya sangat terpengaruh suhu karena sifat ikan yang poikilotermal (Irianto 2005). Sistem imun non spesifik ikan, meliputi penghalang fisik (mukus, kulit, sisik dan insang), pertahanan humoral dan sel-sel fagositik. Penghalang fisik ikan teleostei meliputi kulit (sisik) dan mukus (lendir). Mukus memiliki kemampuan menghambat kolonisasi mikroorganisme pada kulit, insang dan mukosa. Mukus ikan mengandung immunoglobulin alami, bukan sebagai respon dari pemaparan terhadap antigen. Immunoglobulin (antibodi) tersebut dapat menghancurkan patogen yang menginfeksi (Irianto 2005). Sedangkan sisik atau kulit merupakan pelindung fisik yang melindungi ikan dari kemungkinan luka dan berperan dalam mengendalikan osmoralitas tubuh. Kerusakan sisik atau kulit akan mempermudah patogen menginfeksi inang (Irianto 2005). Sistem imun non spesifik didukung oleh dua komponen utama yaitu respon selular dan respon humoral (Irianto 2005). Respon selular imun non spesifik meliputi beberapa tipe mekanisme : inflamasi, fagositosis, fagositosis sebagai penyaji antigen (antigen presenting cells) dan non spesific citotoxic cells. Inflamasi merupakan upaya proteksi reaksi restoratif dari tubuh sejak ikan berusaha menjaga kondisi kestabilan sistem dari pengaruh lingkungan yang kurang baik (Tizard 1988). Inflamasi ditandai dengan rasa sakit, pembengkakan, kulit memerah atau peradangan, suhu tubuh naik atau kehilangan fungsi-fungsi fisiologis. Hal tersebut merupakan respon protektif awal tubuh dalam upaya menghalangi patogen dan menghancurkannya (Irianto 2005). Fagositosis merupakan pertahanan pertama dari respon selular yang dilakukan oleh monosit (makrofag) dan granulosit (netrofil). Proses fagositosis meliputi tahap kemotaksis, tahap pelekatan, tahap penelanan dan tahap pencernaan. Tahap kemotaksis yaitu pergerakan sel fagosit yang terarah dibawah pengaruh rangsangan kimiawi eksternal (pelbagai produk patogen yang menginfeksi ataupun sel yang rusak akibat infeksi patogen) (Tizard 1988). Setelah sel fagosit bertemu dengan suatu partikel yang akan ditelannya, partikel tersebut diikat kuat-kuat, proses ini disebut perlekatan. Sekali terpasang kuat pada membrane sel fagosit, partikel yang melekat tampak merangsang membran sel lokal dan aktivitas mikrotubul, yang sebaliknya menyebabkan sitoplasma mengalir diatas dan sekitar partikel dan menelannya, proses ini disebut penelanan. Sebuah partikel yang terkurung dalam sitoplasma sel fagosit 11 menempatkan dirinya dalam ruang yang disebut fagosom. Penghancuran partikel terjadi bila enzim hidrolitik yang biasanya tersimpan di dalam lisosom, dikosongkan ke dalam fagosom. Hal ini terjadi sebagai akibat granula bermigrasi melalui sitoplasma dan bersatu dengan fagosom membentuk fagolisosom. Enzim lisosom dapat mencernakan beberapa dinding sel bakteri, sedangkan enzim proteolotik, mieloperoksidase, ribonuklease dan fosfolipase bersifat letal bagi sebagian mikroorganisme (Tizard 1988). Proses fagositosis oleh sel-sel fagosit (makrofag) berperan pula dalam mekanisme penyajian antigen (antigen presenting cells) untuk menstimulasi respon sel limfosit. Partikel yang difagosit diproses dan dipresentasikan sebagai peptide antigen yang berasosiasi dengan molekul MHC kelas II pada permukaan sel fagosit (Gillund et al. 2008). T cell receptor ( TCR) mampu mengenali peptide antigen yang dipresentesikan oleh MHC kelas I dan MHC kelas II, yang masingmasing merangsang CD 8+ T sel ( cytotoxic T sel, CTL) dan CD4+T sel (helper-T sel) (Gillund et al. 2008). Mekanisme lain dari pertahanan seluler adalah non spesific cytotoxic cells (NCCs), pada mamalia dikenal sebagai sel natural killer (NK). Sel NK merupakan subpopulasi sel limfosit yang dapat membunuh sel sasaran secara spontan tanpa pengaktifan terlebih dahulu dan tanpa bergantung pada produk-produk MHC (Kresno 2001). Sel NK memegang peranan penting dalam pertahanan alamiah terhadap pertumbuhan sel kanker dan berbagai penyakit infeksi, khususnya infeksi virus tanpa pengaktifan sebelumnya (Kresno 2001). Respon humoral imun nonspesifik meliputi beberapa tipe mekanisme dalam perlawanan terhadap invasi patogen. Diantara tipe mekanisme tersebut, komplemen dan interferon sangat berperan dalam respon pertahanan terhadap infeksi virus (Affandi dan Tang 2002). Komplemen adalah suatu komplek enzimenzim yang terdiri atas sebelas unsur protein yang terpisah, yang terdapat dalam serum dan diduga dibentuk oleh makrofag-makrofag. Komplemen memiliki potensi aktivitas antimikroba melalui siat-sifat penghancurannya (Nabib dan Pasaribu 1989). Sedangkan interferon adalah suatu polipeptida yang diproduksi selama infeksi virus dan aktivitas antivirusnya bersifat spesifik (Affandi dan Tang 2002). Cara kerja interferon adalah dengan memasuki sel yang dapat diinfeksi virus dan mencegah replikasi dari asam nukleus. Pada ikan pembentukan interferon ini dipengaruhi oleh suhu (Affandi dan Tang 2002). Sistem imun spesifik (adaptive immunity) merupakan mekanisme interaksi antara sel limfosit dan fagosit. Respon spesifik ini diawali dengan aktifitas sel-sel fagosit atau antigen presenting cells (APC) yang memproses dan mempresentasikan potongan-potongan antigen pada sel-sel imun spesifik (Kresno 2001). Sel limfosit merupakan inti dalam respon imun spesifik karena sel-sel ini merupakan sel yang mengenal berbagai antigen, baik antigen yang terdapat intraselular maupun ekstraselular (dalam cairan tubuh ataupun dalam darah) (Kresno 2001). Antigen merupakan subtansi spesifik yang dapat merangsang suatu reaksireaksi kekebalan yang spesifik. Umumnya subtansi antigen tersebut berupa molekul besar seperti protein dan polisakarida (Nabib dan Pasaribu 1989). Pengolahan antigen merupakan proses yang penting untuk merangsang limfosit selanjutnya, karena reseptor pada sel limfosit akan mengenali antigen berdasarkan susunan asam amino dalam rantai peptide (bukan proteinnya) peptide antigen hasil pengolahan akan dipresentasikan bersama-sama dengan molekul protein MHC (major histicompatibility complex) tertentu membentuk struktur yang unik pada permukaan sel makrofag atau APC dan dapat dikenali oleh reseptor sel T (TcR). Pengenalan struktur ini oleh sel limfosit T, mengakibatkan sel-sel imun berproliferasi dan berdiferensiasi, menjadi sel yang memiliki kompetensi imunologik dan mampu bereaksi dengan antigen tersebut (Kresno 2001). Berdasarkan bentuk responnya, sistem imun spesifik pada dasarnya terdiri dari respon imun selular yang merupakan fungsi dari sel T dan respons humoral yang merupakan fungsi dari sel limfosit B (Kresno 2001). Respon imun selular ini sangat diperlukan untuk melawan organisme intraselular. Sel teinfeksi dapat dibunuh melalui sistem efektor ekstraseluler, misalnya oleh sel T sitotoksik, atau sel terinfeksi diaktivasi agar mampu membunuh organisme yang menginfeksinya. Sub populasi sel T yang disebut sel T-helper (Th) akan mengenali mikroorgnisme bersangkutan melalui MHC kelas II. Sinyal ini menginduksi limfosit untuk memproduksi berbagai jenis limfokin, termasuk diantaranya adalah interferon yang dapat membantu makrofag menghancurkan mikroorganisme 13 tersebut. Sedangkan sub populasi sel T yang lain disebut T-cytotoxic (Tc) berperan dalam menghancurkan mikroorganisme intraselular yang disajikan melalui MHC kelas I secara langsung (cell to cell contact). Selain itu juga menghasilkan gamma-interferon yang mencegah penyebaran mikroorganisme ke sel-sel lain (Kresno 2001). Respon imun humoral dilaksanakan oleh sel B dan produknya yaitu antibodi, dan berfungsi dalam pertahanan terhadap mikroba ekstraseluler. Respon ini diawali dengan diferensiasi limfosit B menjadi satu populasi sel plasma yang memproduksi dan melepaskan antibodi spesifik ke dalam darah. Antibodi memiliki kemampuan berikatan khusus dengan antigen serta mempercepat penghancurannya (Tizard 1988). Antibodi ini berikatan dengan antigen membentuk kompleks antigen-antibodi yang dapat mengaktivasi komplemen dan mengakibatkan hancurnya antigen tesebut (Kresno 2001). Supaya limfosit B berdiferensiasi dan membentuk antibodi diperlukan bantuan limfosit Th atas sinyal yang diberikan oleh makrofag. Makrofag sebagai APC (antigen presenting cells) akan menelan antigen yang berbentuk partikel maupun yang larut, kemudian memprosesnya dengan degradasi, denaturasi atau modifikasi dan selanjutnya menyajikan fragmen-fragmen antigen tersebut pada permukaan sel bersama-sama dengan MHC kelas II kepada sel T (Kresno 2001). Pada respon imun juga berlaku respon primer yang membentuk klon sel memori. Klon limfosit memori ini dapat mengenali antigen bersangkutan, dan mampu menghasilkan respon imun yang lebih cepat dan lebih intensif pada kejadian infeksi oleh patogen yang sama di kemudian hari (Kresno 2001). Menurut Tizard (1988) sel ini hidup berbulan-bulan atau tahunan setelah pertama kali bersentuhan dengan antigen, akibatnya bila dosis antigen kedua diberikan kepada hewan, akan bertemu dan merangsang lebih banyak lagi sel peka-antigen dari pada dosis yang pertama, karena itu respon imun spesifik sekunder secara kuantitatif lebih besar dari pada respon imun spesifik primer. Menurut Kresno (2001) pengelompokan respon imun ke dalam dua kelompok yaitu respon imun nonspesifik dan respon imun spesifik terlalu disederhanakan karena telah dibuktikan bahwa kedua jenis respon tersebut saling meningkatkan efektivitas dan bahwa respon imun yang terjadi sebenarnya merupakan interaksi antara satu komponen dengan komponen yang lain yang terdapat di dalam sistem imun. Diantara aktivitas terpadu antara kedua sistem yang paling penting adalah : 1) respon imun bawaan (innate) terhadap mikroba merangsang dan mempengaruhi sifat respon sistem imun didapat (acquired); 2) sistem imun didapat menggunakan berbagai mekanisme efektor sistem imun bawaan untuk menyingkirkan mikroba dan seringkali meningkatkan fungsi sistem imun bawaan. 2.4 Vaksin DNA Lebih dari 100 tahun berlalu, pengembangan dan penggunaan vaksin yang meluas untuk "memerangi" agen infeksius telah menjadi suatu kesuksesan dalam bidang kedokteran. Pengembangan vaksin diawali dengan kerja dari Edward Janner pada tahun 1796, seorang dokter Inggris yang melakukan eksperimen untuk menemukan suatu cara untuk memproteksi manusia dari serangan smallpox. Ia melakukan hal tersebut 80 tahun sebelum Robert Koch menyatakan postulatnya yang terkenal dengan nama Postulat Koch. Kemudian pada tahun 1880, Louis Pasteur telah menemukan bagaimana vaksinasi dapat bekerja. Ia yang telah menggunakan istilah vaccine untuk kultur atau biarkan dari mikroorganisme yang tidak virulen yang digunakan untuk inokulasi preventif (Naim 2004). Salah satu alasan untuk kesuksesan vaksinasi tersebut adalah bahwa vaksin dapat menginduksi antibodi yang merupakan agen prinsipal dari proteksi imun terhadap kebanyakan virus dan bakteri (Naim 2004). Semua vaksin yang ada saat ini, apakah dipreparasi dari sel mikroorganisme utuh yang dimatikan atau diinaktivasi, protein rekombinan, atau mikroorganisme hidup yang diatenuasi, akan menginduksi produksi antibodi. Dengan pengecualian vaksin yang dipreparasi dari organisme hidup yang diatenuasi, semua vaksin yang ada tidak menginduksi imunitas seluler. Lebih lanjut, kemungkinan dari penggunaan vaksin hidup yang diatenuasi terhadap virus yang sangat berbahaya telah meningkatkan perhatian terhadap prosedur produksinya dan risiko yang akan diterima bila vaksin hidup digunakan untuk imunisasi populasi yang besar (Naim 2004). Dengan alasan tersebut, suatu pendekatan yang relatif baru terhadap vaksinasi yang melibatkan injeksi suatu potongan DNA yang mengandung gen 15 untuk antigen mikroba tertentu masih terus diteliti dengan intensif. Suatu studi telah melaporkan bahwa induksi respon imunitas seluler terhadap suatu peptida dari parasit malaria Plasmodium falciparum pada manusia melalui vaksin DNA. Hal ini meningkatkan harapan untuk kemampuan aplikasi klinis dari metode imunisasi dengan DNA (Naim 2004). DNA vaksinasi merupakan suatu teknik untuk melindungi suatu organisma melawan terhadap penyakit dengan menyuntikkan konstruksi DNA untuk menghasilkan suatu tanggapan imunologi. vaksin DNA masih bersifat percobaan, dan telah diberlakukan bagi sejumlah model penyakit disebabkan kuman virus, yang seperti parasit dan hasil bakteri. DNA vaksin memiliki kelebihan dari pada vaksin konvensional, mencakup kemampuan untuk mempengaruhi suatu jangkauan jenis tanggapan kebal yang lebih luas (Naim 2004). Tabel 1. Keuntungan dan kekurangan vaksin DNA (Lorenzen & LaPatra 2005) Keuntungan Tingkat keamanan yang cukup tinggi. vaksin tidak memiliki resiko infeksi penyakit Dapat digabungkan dengan adjuvant untuk meningkatkan kemampuan vaksin. Mengaktivkan respon imun baik bersifat humoral maupun selular Kemungkinan dapat dilakukan penggabungan beberapa jenis vaksin (multivalent) Tetap menghasilkan efek yang baik ketika diberikan saat stadia awal organisme Proteksi timbul tidak lama setelah vaksinasi dan juga tahan lama Murah dan cepat dalam memperoleh vaksin dari patogen varian baru Biaya produksi relatif rendah dan mudah Kekurangan Masih diperlukan suatu strategi baru untuk vaksinasi secara massal Tidak effisien terhadap semua patogen Ketidakjelasan berkenaan dengan perbedaan antara vaksinasi DNA dengan modifikasi genetik organisme (Genetically Modified Organism /GMO’s), akibatnya antipati sebagian masyarakat umum terhadap produk GMO’s, besar kemungkinan mempengaruhi penerimaan konsumen terhadap vaksin DNA Disamping memiliki kelebihan Vaksin DNA juga memiliki kekurangan, yang diakibatkan masih terbatasnya informasi berkenaan dengan perbedaan antara vaksinasi DNA dengan modifikasi genetik organisme (Genetically Modified Organism /GMO’s), akibatnya antipati sebagian masyarakat umum terhadap produk GMO’s, besar kemungkinan mempengaruhi penerimaan konsumen terhadap vaksin DNA (Lorenzen & LaPatra 2005). Dalam suatu vaksin DNA, gen untuk antigen dari mikroba tertentu diklon ke dalam suatu plasmid bakteri yang direkayasa untuk meningkatkan ekspresi gen yang diinsersikan di dalam sel-sel hewan. Setelah diinjeksikan ke dalam suatu hewan, plasmid akan memasuki sel hewan tersebut, tempat ia menetap dalam nukleus sebagai suatu episom, ia tidak berintegrasi ke dalam DNA sel (kromosom). Dengan menggunakan mesin metabolik sel hewan tersebut, DNA plasmid dalam episom secara langsung mensintesis antigen yang dikodenya (Naim 2004). Kemudian kode genetik virus yang telah disintesis tersebut diekspresikan oleh sel yang mengandung kode gen virus tersebut, seperti pada gen glikoprotein rabdhovirus yang dijadikan sebagai informasi genetik pada suatu konstruksi vaksin DNA, setelah dimasukkan ke sel hewan dan disintesis oleh mesin metabolik sel hewan tersebut kemudian glikoprotein virus tersebut akan diekspresikan pada lapisan dalam dan permukaan sel hewan tersebut dimana keadaan ini sama dengan keadaan ketika sel terserang virus yang sebenarnya (Lorenzen & Lapatra 2005). Dengan alasan-alasan tersebut, vaksin DNA memiliki potensial untuk menginduksi imunitas seluler yang potensial dan mungkin bersifat long-term. Ada suatu keterbatasan yang masih bersifat teoritis dari metode ini, yaitu bahwa sel T sitotoksik yang diinduksi oleh vaksin mungkin akan membunuh semua sel yang memproduksi antigen yang diimunisasi. Sebagaimana yang mungkin diharapkan pada tahap perkembangannya, ada perhatian yang diberikan terhadap keamanan vaksin DNA bagi manusia. Ada beberapa kekhawatiran yang mengemuka, antara lain bahwa kemungkinan DNA dalam vektor plasmid akan berintegrasi ke dalam genom inangnya, kemungkinan akan menginduksi tumor, atau menginduksi terbentuknya antibodi terhadap DNA (Naim 2004). Penelitian mengenai vaksin DNA untuk ikan tergolong baru dan beberapa studi telah dilakukan terhadap infectious hematopoietic necrosis virus ( IHNV) (LaPatra et al. 2001) dan limphocystis disease virus ( LCDV) (Zheng et al. 2006). 17 Anderson melaporkan aplikasi pertama teknologi vaksin DNA dilakukan untuk merangsang respon imun ikan rainbow trout muda menggunakan plasmid yang berisi gen glycoprotein (G) dari IHNV (Zheng et al. 2006). Studi lebih lanjut telah menunjukkan bahwa vaksin DNA ecara perendaman maupun disuntik, pada ikan rainbow trout ukuran 2 – 160 gram (Corbeil et al. 1999). Pada penelitian distribusi dan eskpresi vaksin DNA melawan LCDV yang dilakukan pada ikan Japanese flounder (Paralichthys olivaceus) menunjukan hasil bahwa vaksin DNA yang diberikan secara intramuskular terdistribusi dan diekspresikan pada beberapa jaringan (usus, insang, ginjal anterior, limpa, hati dan gonad, tujuh hari setelah vaksinasi) serta berbeda persistensinya pada masingmasing jaringan. Hal ini menunjukan bahwa pemberian vaksin DNA pada Japanese flounder telah berhasil menyediakan antigen dan memproduksi respon kekebalan tubuh ikan (Zheng et al. 2006). III. METODOLOGI 3.1 Waktu dan Tempat Penelitian ini dilaksanakan pada bulan Februari hingga Maret 2009, bertempat di laboratorium Kesehatan Ikan, Balai Besar Pengembangan Budidaya Air Tawar (BBPBAT) Sukabumi, Jawa Barat dan Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. 3.2 Alat dan Bahan Alat yang digunakan adalah akuarium (40x40x60)cm, alat suntik (syringe), gelas objek, gelas penutup, eppendorf, hemometer, pipet sahli, tabung hematokrit sentrifuse, penggaris, haemacytometer tipe Neubauer, mikroskop, kertas tisu. Bahan yang digunakan adalah ikan mas strain wildan yang berasal dari daerah Cianjur, minyak cengkeh, darah ikan, antikoagulan (Na-sitrat 3,8%), larutan HCl 0.1 N, akuades, crytoseal, larutan Hayem’s, larutan Turk’s, bakteri Staphylococcus aureus, PBS, larutan methanol, pewarna Giemsa. 3.3 Prosedur Penelitian 3.3.1 Persiapan Wadah Wadah yang digunakan adalah akuarium (40x40x60) cm. Akuarium yang digunakan terlebuh dahulu dibersihkan kemudian dikeringkan. Setelah itu disemprot klorin dan dibiarkan kering udara. Akuarium diisi air setinggi 30 cm dan diberi aerasi. 3.3.2 Persiapan Ikan Uji Ikan uji yang digunakan adalah ikan mas strain wildan dari daerah Cianjur. Selama beberapa hari ikan diadaptasikan terlebih dahulu sebelum perlakuan. Jumlah ikan yang digunakan sebanyak 60 ekor per perlakuan. Kemudian jumlah ikan dibagi 2 (masing-masing 30 ekor) pada pengamatan status kelangsungan hidup ikan dan haematologi. Selama masa adaptasi maupun perlakuan ikan diberi pakan berupa pelet sebanyak 2 kali sehari yaitu pagi dan sore. 19 3.3.3 Penyuntikan Vaksin DNA Penyuntikan dilakukan secara intramuskular, dengan tiga tingkatan dosis yaitu 2.5 µg/100µl, 7.5 µg/100µl dan 12.5 µg/100µl. Adapun kelompok perlakuannya yaitu : Perlakuan A : Ikan disuntik dengan vaksin DNA dosis 2,5 µg/100µl Perlakuan B : Ikan disuntik dengan vaksin DNA dosis 7,5 µg/100µl Perlakuan C : Ikan disuntik dengan vaksin DNA dosis 12,5 µg/100µl Kontrol (K) : Ikan kontrol positif Setelah vaksinasi, ikan dipelihara selama 42 hari (6 minggu). 3.3.4 Penyediaan suspensi KHV Sebanyak satu gram insang yang terinfeksi KHV digerus kemudian disuspensikan dengan 9 ml larutan PBS. Lalu disentrifus dengan kecepatan 5000 rpm selama 30 menit dengan suhu 5 oC. Supernatan yang dihasilkan diambil dan disaring dengan kertas milipore 0.45 µm sehingga didapat konsentrasi virus dengan konsentrasi 20%, kemudian dilakukan pengenceran sampai 10 -3. 3.3.5 Uji Tantang Ikan yang telah divaksin dan telah dipelihara selama 6 minggu (42 hari) kemudian diuji tantang untuk melihat respon kekebalannya. Uji tantang dilakukan dengan menginjeksi virus aktif dengan konsentrasi pengenceran 10-3, sebanyak 0,1 ml secara intramuskular ke semua ikan uji. 3.4 Metode Pengukuran Hematologi 3.4.1 Pengambilan Darah Pengambilan darah dilakukan setiap seminggu sekali selama pemeliharaan setelah vaksinasi dan uji tantang. Sebelum pengambilan darah, ikan terlebih dahulu dibius dengan minyak cengkeh dosis 0.04 ppt. Pada pengambilan darah, ikan diletakkan dengan kepala disebelah kiri, sebelumnya alat suntik sudah dibilas dengan Na-sitrat sedikit, kemudian darah diambil pada bagian vena caudalis yaitu pembuluh darah yang terletak tepat dibagian ventral tulang vertebrae (tulang punggung). Jarum ditusukan di antara anus dan sirip anal. Lalu jarum ditarik sedikit kemudian darah dihisap sampai batas yang diinginkan. Setelah itu alat suntik dicabut kemudian darah ditempatkan ke dalam eppendorf. 3.4.2 Perhitungan Kadar Hemoglobin Pengukuran kadar Hemoglobin (Hb) dilakukan dengan metode Sahli yang mengkonversi darah ke dalam bentuk asam hematin setelah darah ditambah dengan asam klorida. Pertama darah dihidap dengan pipet sahli sampai skala 20 mm3 atau pada skala 0.02 ml, kemudian darah dipindahkan ke dalam tabung Hbmeter yang telah diisi HCl 0.1 N sampai skala 10, aduk dan dibiarkan selama 3 – 5 menit. Setelah itu aquades ditambahkan sampai warna darah dan HCl tersebut seperti warna larutan standar yang ada dalam Hb meter tersebut. Skala dibaca dengan melihat permukaan cairan dan dicocokkan dengan skala tabung sahli yang dilihat pada skala jalur gr % (kuning) yang berarti banyaknya hemoglobin dalam gram per 100 ml darah. 3.4.3 Perhitungan Kadar Hematokrit (Chinabut et al. 1991) Darah dihisap dengan tabung mikrohematokrit sampai mencapai ¾ bagian tabung. Kemudian ujung tabung ditutup dengan crytoseal sedalam kira-kira 1 mm, sehingga terbentuk sumbat crytoseal. Lalu tabung mikrohematokrit disentrifus dengan kecepatan 5000 rpm selama 5 menit dengan posisi tabung yang bervolume sama berhadapan agar putaran sentrifuse seimbang. Nilai kadar hematokrit ditentukan dengan persentase panjang bagian darah yang mengendap (a) serta panjang total volume darah yang terdapat di dalam tabung (b) : (a/b) x 100%. Kadar hematokrit ini mencerminkan banyaknya sel darah (digambarkan dengan endapan/padatan) dalam cairan darah. 3.4.4 Penghitungan Total Eritrosit (Svobodova & Vyukusova 1991) Darah dihisap dengan pipet yang berisi bulir pengaduk warna merah sampai skala 0,5). Lalu tambahkan larutan Hayem’s (berfungsi untuk mematikan sel-sel darah putih) sampai skala 101, pengadukan darah di dalam pipet dilakukan dengan mengayunkan tangan yang memegang pipet seperti membentuk angka delapan selama 3 – 5 menit sehingga darah tercampur rata. Setelah itu tetesan pertama larutan darah dalam pipet dibuang, selanjutnya teteskan pada haemacytometer tipe Neubauer kemudian ditutup dengan gelas penutup. Jumlah sel darah merah dengan bantuan mikroskop dengan perbesaran 400 x. Jumlah 21 eritrosit total dihitung pada 5 kotak kecil haemacytometer dan jumlahnya di hitung dengan rumus (Nabib & Pasaribu 1989) : Jumlah eritrosit : (A/N) x (1/V) x Fp Keterangan : A = ∑ sel terhitung V = volume kotak haemacytometer N = ∑ kotak haemacytometer yang diamati Fp = Faktor pengenceran 3.4.5 Penghitungan Total Leukosit (Svobodova & Vyukusova 1991) Darah dihisap dengan pipet yang berisi bulir pengaduk warna putih sampai skala 0,5. Lalu tambahkan larutan Turk’s (berfungsi untuk mematikan sel-sel darah merah) sampai skala 11, pengadukan darah di dalam pipet dilakukan dengan mengayunkan tangan yang memegang pipet seperti membentuk angka delapan selama 3 – 5 menit sehingga darah tercampur rata. Setelah itu tetesan pertama larutan darah dalam pipet dibuang, selanjutnya teteskan pada haemacytometer tipe Neubauer kemudian ditutup dengan gelas penutup. Jumlah sel darah putih dengan bantuan mikroskop dengan perbesaran 400 x. Jumlah leukosit total dihitung sebanyak 5 kotak besar dan dan jumlahnya dihitung dengan rumus : Total Leukosit = jumlah sel terhitung x 50 sel/mm3 3.4.6 Pembuatan Preparat Ulas Darah (Svobodova & Vyukusova 1991) Sebelumnya gelas objek yang akan digunakan direndam dalam methanol untuk menghilangkan lemak yang menempel. Pembuatan preparat ulas darah dilakukan dengan menempatkan setetes darah pada gelas objek, gelas objek kedua diletakan dengan suduk 45o terhadap gelas objek pertama, kemudian digeser ke belakang sehingga menyentuh darah, kemudian gelas objek kedua digeser berlawanan arah sehingga membentuk lapisan tipis darah. Selanjutnya preparat dikering-udarakan kemudian difiksasi dengan metanol selama 5 menit. Kemudian preparat dibilas dengan akuades dan dikering udarakan kembali sebelum diwarnai dengan pewarna Giemsa selama 15 menit. Lalu preparat dicuci kembali dengan akuades untuk mengurangi kelebihan warna dan dikeringkan dengan tisu. Setelah itu diamati di bawah mikroskop. Persentase sel-sel leukosit dihitung dengan cara mengamati sebanyak 10 lapang pandang dan masing-masing jenis leukosit yang terhitung dikelompokan dan dipersentasi menurut jenisnya, satuannya adalah persen (%). 3.4.7 Indeks Fagositik Sebanyak 50 µl darah dimasukan ke dalam mikrotiter plate, ditambahkan 50 µl suspensi Staphylococcus aureus dalam PBS (108 sel/ml), dihomogenkan dan diinkubasi dalam suhu ruang selama 20 menit. Setelah itu sebanyak 5 µl dibuat sediaan ulas darah dan dikering-udarakan. Lalu difiksasi dengan metanol selama 5 menit dan dikeringkan. Kemudian direndam dalam pewarna Giemsa selama 15 menit. Lalu dicuci dengan air mengalir dan dikeringkan dengan tisu. Setelah itu diamati di bawah mikroskop dengan perbesaran 1000x. Jumlah sel yang menunjukan proses fagostosis dihitung dari 100 sel fagosit yang teramati. 3.5 Analisa Data Data yang telah diperoleh dianalisis menggunakan SPSS ver 15.0 untuk uji Analisis Ragam (ANOVA) dengan uji F pada selang kepercayaan 95%, untuk menentukan apakah perlakuan berpengaruh nyata terhadap gambaran darah ikan. Apabila berpengaruh nyata, untuk melihat perbedaan antar perlakuan akan diuji lanjut dengan uji lanjutan Duncan. Garis regresi dibuat hanya pada perlakuan yang berbeda nyata dan memiliki nilai korelasi yang tinggi (>0.3) untuk mengetahui hubungan antara dosis dengan parameter hematologi. 23 IV. HASIL DAN PEMBAHASAN 4.1 Hasil 4.1.1 Total Leukosit Jumlah total rata-rata leukosit dalam darah ikan mas yang dipelihara selama 70 hari berkisar antara 27.2±6.3-127±11.3 (x103 sel/mm3) (Tabel 2 dan 3). Nilai tertinggi dicapai pada perlakuan B (dosis 7,5 µg/100µl) yaitu 127±11.3 (x103 sel/mm3) pada hari ke-42 setelah ikan divaksinasi. Nilai terendah terdapat perlakuan A (dosis 2,5 µg/100µl) yaitu 27.2±6.3 (x103 sel/mm3), pada hari ke-49 (seminggu setelah uji tantang). Dari analisa statistik ragam (ANOVA) dan uji lanjutan Duncan pada selang kepercayaan 95% (p<0,05), diperoleh hasil bahwa pada masa vaksinasi perlakuan kontrol berbeda nyata dengan perlakuan B pada hari ke-21 dan 42, namun pada hari ke-28 perlakuan kontrol berbeda nyata dengan perlakuan A dan B (Tabel 2). Sedangkan setelah ikan diuji tantang (diinfeksi KHV) jumlah rataan leukosit masing-masing perlakuan tidak berbeda nyata (Tabel 3). Tabel 2. Jumlah Rataan Leukosit Pada Setiap Perlakuan (x 103 sel/mm3) Selama Vaksinasi Perlakuan Masa Vaksinasi (hari) 7 14 21 28 35 42 ab c ab 43.8±15 33.6±7.5 44.8±16.1 86±4.4 82.7±4.3 100±8.5 A 35.7±18.5 44±9.1 68.1±16.1b 73.7±18.3bc 82.3±3.9 127±11.3b B ab ab 58.9±2.9 42.5±7.8 54.1±9.2 52.9±31.6 90.1±36.5 101±49.7ab C a a 27.6±8.2 31.3±16.7 33.7±4.4 43.6±11.6 77.5±12.2 76±9.6a K Keterangan : Huruf superscrift yang berbeda pada kolom yang sama menunjukkan pengaruh berbeda nyata (p<0,05) Tabel 3. Jumlah Rataan Leukosit Pada Setiap Perlakuan (x 10 3 sel/mm3) Selama Uji Tantang Perlakuan A B C K Masa Uji Tantang (hari) 49 27.2±6.3 46.5±8.4 44.2±11.1 45.9±10.1 56 36.9±10.4 32.1±17.3 33±6.9 45±12.9 63 46.7±4.5 50.5±4.5 51.9±3.1 47.7±5.1 70 57.6±1.9 H+21 y = -927.33x 2 + 13761x + 74522 R2 = 0.9904 140000 Nilai (sel/mm3) H+42 120000 100000 80000 60000 40000 y = -522.14x 2 + 8416.2x + 31388 R2 = 0.9469 20000 0 0 2.5 5 7.5 10 12.5 15 Dosis Gambar 1. Hubungan tingkat dosis (X) dengan jumlah total rataan leukosit (Y) ikan mas pada hari ke-21 dan 42. Pada gambar 1 menunjukkan peningkatan jumlah total rata-rata leukosit dalam darah ikan mas yang diberi perlakuan vaksin dengan dosis 0, 2.5, 7.5, dan 12.5 µg/100µl pada hari ke-21 dan 42 masing-masing membentuk pola kuadratik. Nilai korelasi yang diperoleh pada hari ke-21 dan 42 masing-masing sebesar 0.97 dan 0.99 yang berarti hubungan tingkat dosis dengan jumlah total rataan leukosit sangat tinggi. Sedangkan nilai koefisien determinasi (R2) yang diperoleh pada pada hari ke-21 dan 42 masing-masing sebesar 0.9469 dan 0.9904. Nilai determinasi yang didapat menunjukkan variabel dosis dapat menerangkan variabilitas masing-masing sebesar 94.69% dan 99.04% dari variabel total leukosit. 4.1.2 Differensial Leukosit a. Persentase Limfosit Pengamatan terhadap persentase jumlah limfosit dalam darah ikan mas, menunjukan bahwa nilai tertinggi terdapat pada perlakuan B yaitu 95.3±2.5 % pada hari ke 42 setelah ikan divaksinasi (Tabel 4). Nilai terendah juga terdapat perlakuan B yaitu 75.3±9.3 %, pada hari ke-28 setelah ikan divaksinasi. Dari analisa statistik ragam (ANOVA) dan uji lanjutan Duncan pada selang kepercayaan 95% (p<0.05), diperoleh hasil bahwa pada masa vaksinasi perlakuan B pada hari ke-28 berbeda nyata dengan perlakuan C (dosis 12.5 µg/100µl) dan kontrol. Pada hari ke-63 terdapat perlakuan yang berbeda nyata antara perlakuan C dengan ketiga perlakuan yang lain. 25 Tabel 4. Persentase Rataan Limfosit Pada Setiap Perlakuan Selama Vaksinasi Perlakuan A B C K Masa Vaksinasi (hari) 7 86.7±2.1 90.7±4 91.3±1.5 90.3±1.2 14 89.7±0.6 91±3.5 92.7±2.5 87±1 21 90.3±1.5 90.7±0.6 89.7±2.1 94.3±3.1 28 85±3.5ab 75.3±9.3a 87.3±3.1b 91.3±1.5b 35 91.3±4 92±3.6 91.3±3.2 93±2.6 42 93.7±1.5 95.3±2.5 94±3.6 93.7±1.5 Tabel 5. Persentase Rataan Limfosit Pada Setiap Perlakuan Selama Uji Tantang Perlakuan Masa Uji Tantang (hari) 49 56 63 70 a 77.7±6.7 81±1.5 80±1 A 79.3±12 83.7±3.2 79.3±3.1a B 80.3±3.5 86±3.5 91.3±1.5b 82.3±2.1 C 79±2.6 84.3±3.1 76.3±1.5a K Keterangan : Huruf superscrift yang berbeda pada kolom yang sama menunjukkan pengaruh berbeda nyata (p<0,05) H+28 100 H+63 Rataan (%) 80 y = 0.3321x 2 - 4.5888x + 92.399 R2 = 0.9491 60 40 y = 0.1197x 2 - 0.4506x + 77.74 R2 = 0.9054 20 0 0 2.5 5 7.5 Dosis 10 12.5 15 Gambar 2. Hubungan tingkat dosis (X) dengan persentase rataan limfosit (Y) ikan mas pada hari ke-28 dan 63 Pada gambar 2 menunjukkan peningkatan persentase rataan limfosit dalam darah ikan mas yang diberi perlakuan vaksin dengan dosis 0, 2.5, 7.5, dan 12.5 µg/100µl pada hari ke-28 dan 63 masing-masing membentuk pola kuadratik. Nilai korelasi yang diperoleh pada hari ke-28 dan 63 masing-masing sebesar 0,97 dan 0.95 yang berarti hubungan tingkat dosis dengan persentase rataan limfosit keduanya tinggi. Nilai koefisien determinasi (R2) yang diperoleh pada pada hari ke-28 dan 63 masing-masing sebesar 0.9491 dan 0.9054. Nilai determinasi yang didapat menunjukkan variabel dosis dapat menerangkan variabilitas masingmasing sebesar 94.91% dan 90.54% dari variabel persentase limfosit. b. Persentase Monosit Pengamatan terhadap persentase rataan monosit dalam darah ikan mas, menunjukan bahwa nilai tertinggi terdapat pada perlakuan C yaitu 12.7±2 % pada hari ke-49 (seminggu setelah ikan diinfeksi KHV). Nilai terendah terdapat perlakuan B dan C yaitu 2±1 %, pada hari ke-42 setelah ikan divaksinasi. Dari analisa statistik ragam (ANOVA) dan uji lanjutan Duncan pada selang kepercayaan 95% (p<0,05) menunjukan pada masa vaksinasi tidak terdapat perbedaan yang nyata antar perlakuan, namun pada masa uji tantang pada hari ke63 perlakuan C berbeda nyata dengan (p<0,05) kedua perlakuan yang lain dan kontrol, yakni lebih rendah. Secara umum rataan persentase monosit masingmasing perlakuan cenderung meningkat seminggu setelah ikan disuntik KHV (uji tantang), hal ini menunjukan bahwa infeksi KHV meningkatkan jumlah monosit. Tabel 6. Persentase Rataan Monosit Pada Setiap Perlakuan Selama Vaksinasi Perlakuan 7 7.3±0.6 5.7±4 6±2.6 5.7±2.9 A B C K Masa Vaksinasi (hari) 14 21 28 35 7±1 6.7±3.2 4.3±3.5 3.7±2.5 6.7±3.8 6±1.7 9±4.4 4.3±1.5 5.3±2.3 6±1.7 6±5.2 5.7±3.1 6.3±2.5 3±1 4.7±0.6 5±1.7 42 2.7±1.2 2±1 2±1 2.7±1.2 Tabel 7. Persentase Rataan Monosit Pada Setiap Perlakuan Selama Uji Tantang Perlakuan Masa Uji Tantang (hari) Rataan (%) 49 56 63 70 b 11.7±7.2 10.5±3.6 11±3.6 A 12.3±10 6.3±3.2 12.3±1.5b B 12.7±2.5 8.3±2.1 4.3±0.6a 10.7±0.6 C 10±5.6 9±1.7 9.7±0.6b K Keterangan : Huruf superscrift yang berbeda pada kolom yang sama menunjukkan pengaruh berbeda nyata (p<0,05) 14 12 10 8 6 4 2 0 H+63 y = -0.1434x2 + 1.4157x + 9.2111 R2 = 0.965 0 2.5 5 7.5 Dosis 10 12.5 15 Gambar 3. Hubungan tingkat dosis (X) dengan persentase rataan monosit (Y) ikan mas pada hari ke-63 27 Pada gambar 3 menunjukkan peningkatan persentase rataan monosit dalam darah ikan mas yang diberi perlakuan vaksin dengan dosis 0, 2.5, 7.5, dan 12.5 µg/100µl pada hari ke 63 membentuk pola kuadratik. Nilai korelasi yang diperoleh sebesar 0.98 yang berarti hubungan tingkat dosis dengan persentase rataan monosit sangat tinggi. Nilai koefisien determinasi (R2) yang diperoleh sebesar 0.965. Nilai determinasi yang didapat menunjukkan variabel dosis dapat menerangkan variabilitas sebesar 96.5% dari variabel persentase monosit. c. Persentase Neutrofil Pengamatan terhadap persentase rata-rata neutrofil dalam darah ikan mas, menunjukan bahwa jumlah neutrofil berfluktuasi. Nilai tertinggi terdapat pada perlakuan B yaitu 15.7±5.7% pada hari ke-28. Nilai terendah terdapat perlakuan C dan K yaitu 2±1%, masing-masing pada hari ke-14 dan 35 setelah ikan divaksinasi. Dari analisa statistik ragam (ANOVA) dan uji lanjutan Duncan pada selang kepercayaan 95% (p<0.05), diperoleh hasil bahwa pada masa vaksinasi kontrol berbeda nyata dengan perlakuan A, B dan C pada hari ke-14. Pada hari ke28 perlakuan A dan B berbeda nyata dengan kontrol. Sedangkan pada hari ke-63 kontrol berbeda nyata dengan perlakuan B dan C. Tabel 8. Persentase Rataan Neutrofil Pada Setiap Perlakuan Selama Vaksinasi Perlakuan A B C K 7 6±4.5 3.7±1.5 2.7±0.6 4±1.7 14 3.3±1.5a 2.3±0.6a 2±1a 6.7±1.5b Masa Vaksinasi (hari) 21 28 3±2 10.7±1.5bc 3.3±2.1 15.7±5.7c 4.3±0.6 6.7±2.5ab 2.7±2.1 4±1.7a 35 5±2 3.7±2.3 3±2.6 2±1 42 3.7±0.6 2.7±1.5 4±2.3 3.7±0.6 Tabel 9. Persentase Rataan Neutrofil Pada Setiap Perlakuan Selama Uji Tantang Perlakuan Masa Uji Tantang (hari) 49 10.7±1.2 A 8.3±5.1 B 7±2.6 C 11±3.5 K Keterangan : Huruf superscrift yang berbeda berbeda nyata (p<0,05) 56 63 70 8.5±3.2 9±4.6ab 10±0 8.3±1.5a 5.7±1.5 4.3±1.2a 7±0 6.7±4.7 14±1.7b pada kolom yang sama menunjukkan pengaruh Rataan % 16 14 12 10 8 6 4 2 0 H+14 y = 0.0237x 2 - 0.9652x + 13.049 R2 = 0.8807 H+63 y = 0.0528x 2 - 0.9876x + 6.2513 R2 = 0.9213 0 2.5 5 7.5 10 12.5 15 Dosis Gambar 4. Hubungan tingkat dosis (X) dengan persentase rataan neutrofil (Y) ikan mas pada hari ke-14 dan 63 Pada gambar 4 menunjukkan peningkatan persentase rataan neutrofil dalam darah ikan mas yang diberi perlakuan vaksin dengan dosis 0, 2,5, 7,5, dan 12,5 µg/100µl pada hari ke-14 dan 63 membentuk pola kuadratik. Nilai korelasi yang diperoleh masing-masing sebesar 0.95 dan 0.93 yang berarti hubungan tingkat dosis dengan persentase rataan neutrofil tinggi. Nilai koefisien determinasi (R2) yang diperoleh masing-masing sebesar 0.9213 dan 0.8807. Nilai determinasi yang didapat menunjukkan variabel dosis dapat menerangkan variabilitas masingmasing sebesar 92.13% dan 88.07% dari variabel persentase neutrofil. 4.1.3 Total Eritrosit Pengamatan terhadap jumlah total rata-rata eritrosit dalam darah ikan mas pada perlakuan yang berbeda, menunjukan bahwa nilai tertinggi terdapat pada perlakuan C yaitu 16.8±1.6 x 105 sel/mm3 pada hari ke-70. Nilai terendah terdapat pada kontrol yaitu 710.000 sel/mm3, pada hari ke-63. Dari analisa statistik ragam (ANOVA) dan uji lanjutan Duncan pada selang kepercayaan 95% (p<0,05) diperoleh hasil pada hari ke-63 kontrol berbeda nyata (p<0,05) dengan pelakuan A, B dan C yakni jumlah eritrosit lebih rendah dari ketiga perlakuan. Tabel 10. Jumlah Rataan Eritrosit Pada Setiap Perlakuan (x 10 5 sel/mm3) Selama Vaksinasi Perlakuan A B C K 7 14.6±1.7 11.5±2.4 12.8±4.7 15.3±3.5 14 13.8±1.6 14.3±3.0 13.1±2.7 11.8±4.8 Masa Vaksinasi (hari) 21 28 13.1±3.9 15.0±2.7 11.7±3.0 11.7±1.2 14.2±1.2 11.25.4 15.8±0.5 13.6±2.5 35 15.3±2.4 12.3±2.2 15.1±5.5 14.1±3.1 42 13.9±1.4 13.4±4.0 13.4±5.5 12.77±0.7 29 Tabel 11. Jumlah Rataan Eritrosit Pada Setiap Perlakuan (x 10 5 sel/mm3) Selama Uji Tantang Perlakuan Masa Uji Tantang (hari) Nilai (sel/mm3) 49 56 13.5±4.1 14.5±4.5 A 12.9±3.2 13.5±3.2 B 14.6±2.5 15.3±6.6 C 10.5±0.4 14.1±1 K Keterangan : Huruf superscrift yang berbeda pada berbeda nyata (p<0,05) 1600000 1400000 1200000 1000000 800000 600000 400000 200000 0 63 70 bc 12.0±0.8 10.2±0.2b 13.5±2.4c 16.8±1.6 7.1±0.9a kolom yang sama menunjukkan pengaruh H+63 2 y = -1629.5x + 57682x + 833819 R2 = 0.5773 0 2.5 5 7.5 10 Dosis 12.5 15 Gambar 5. Hubungan tingkat dosis (X) dengan jumlah rataan eritrosit (Y) ikan mas pada hari ke-63 Pada gambar 5 menunjukkan peningkatan jumlah rataan eritrosit dalam darah ikan mas yang diberi perlakuan vaksin dengan dosis 0, 2.5, 7.5, dan 12.5 µg/100µl pada hari ke-63 membentuk pola kuadratik. Nilai korelasi yang diperoleh sebesar 0.78 yang berarti hubungan tingkat dosis dengan jumlah rataan eritrosit cukup tinggi. Nilai koefisien determinasi (R2) yang diperoleh sebesar 0.5773. Nilai determinasi yang didapat menunjukkan variabel dosis dapat menerangkan variabilitas sebesar 57.73% dari variabel total eritrosit. 4.1.4 Kadar Hemoglobin Pengamatan terhadap nilai hemoglobin dalam darah ikan mas pada perlakuan yang berbeda, menunjukan bahwa nilai tertinggi terdapat pada perlakuan A yaitu 11.7±0.6 g% pada hari ke-42 setelah ikan divaksinasi. Nilai terendah terdapat perlakuan C dan kontrol yaitu 7.1±3 g%, pada hari ke 28. Dari analisa statistik ragam (ANOVA) dan uji lanjutan Duncan pada selang kepercayaan 95% (p<0,05), diperoleh hasil bahwa pada masa vaksinasi yaitu pada hari ke-42 perlakuan kontrol berbeda nyata dengan pelakuan A dan B. Sedangkan pada masa uji tantang juga tidak terdapat perbedaan yang nyata antara kontrol dengan ketiga perlakuan dosis 2.5, 7.5 dan 12.5 µg/100µl. Nilai korelasi pada hari ke-42 kurang dari 0.3 hal ini menunjukan hubungan tingkat dosis dengan persentase rataan hemoglobin sangat rendah sehingga tidak dapat dibuat garis regresi Tabel 12. Nilai Rataan Hemoglobin Pada Setiap Perlakuan (g%) Selama Vaksinasi Perlakuan A B C K 7 10±1.4 9.9±0.8 7.5±1.6 8.9±1.4 14 9.3±1.6 8.9±0.6 9.9±1.5 8.9±1.2 Masa Vaksinasi (hari) 21 28 35 8.8±3.0 7.3±0.7 8±2 8.7±2.2 7.2±1.6 9±2.8 8.9±3.1 7.1±3 8.3±3.3 9.1±4.6 7.1±0.2 8.7±1.1 42 11.7±0.6b 11±0.9b 10.4±4.4ab 9.3±1.0a Tabel 13. Nilai Rataan Hemoglobin Pada Setiap Perlakuan (g%) Selama Uji Tantang Perlakuan Masa Uji Tantang (hari) 49 56 63 70 9.2±1.2 11.6±2.8 10.1±1.8 A 8.3±0.1 8.7±0.2 9.5±2.1 B 10.3±1.2 9.9±1.7 10.5±1.3 8.5±4 C 8.2±2 10.5±1 9.3±1.1 K Keterangan : Huruf superscrift yang berbeda pada kolom yang sama menunjukkan pengaruh berbeda nyata (p<0,05) 4.1.5 Kadar Hematokrit Pengamatan terhadap nilai hematokrit dalam darah ikan mas pada perlakuan yang berbeda, menunjukan nilai yang berfluktuasi. Nilai tertinggi terdapat pada perlakuan B yaitu 39.3±3.1% pada hari ke-7 setelah ikan divaksinasi. Nilai terrendah yaitu 21±6 % pada perlakuan B hari ke-63. Dari analisa statistik ragam (ANOVA) pada selang kepercayaan 95%, diperoleh hasil bahwa pada masa vaksinasi maupun masa uji tantang tidak terdapat perlakuan yang berbeda nyata. Tabel 14. Nilai Rataan Hematokrit Pada Setiap Perlakuan (%) Selama Vaksinasi Perlakuan A B C K 7 35.2±5.8 39.3±3.1 37.3±3.8 32±1 14 27±4.5 24.5±4.7 28.7±7.5 25.3±3.5 Masa Vaksinasi (hari) 21 28 21±8.7 27.2±3.3 23±7.4 27.2±3.3 31.7±3.1 21±12 30±4.6 24.3±2.1 35 28.5±4.8 23.8±8.8 24.5±10 21.7±6.5 42 30.3±5.5 26.5±6.3 25.3±11 24.33±9 31 Tabel 15. Nilai Rataan Hematokrit Pada Setiap Perlakuan (%) Selama Uji Tantang Perlakuan A B C K Masa Uji Tantang (hari) 49 29.7±5.0 27.7±2.9 30.7±5.1 23.7±9.3 56 26±2.7 27.3±4.5 30.7±2.1 28.5±4 63 26.3±5.5 21±6 30.3±7.5 23.3±2.9 70 30.2±7.5 4.1.6 Indeks Fagositik Pengamatan terhadap nilai indeks fagositik dalam darah ikan mas pada perlakuan yang berbeda, menunjukan nilai yang berfluktuasi. Nilai tertinggi terdapat pada perlakuan C yaitu 24±1% pada hari ke-49 (seminggu setelah uji tantang). Nilai terendah terdapat perlakuan kontrol yaitu 7±1%, pada hari ke-42. Dari analisa statistik ragam (ANOVA) dan uji lanjutan Duncan pada selang kepercayaan 95%, diperoleh hasil bahwa pada masa vaksinasi kontrol berbeda nyata dengan ketiga perlakuan yang lain pada hari ke-28, 35, 42 dan 49. Sedangkan pada masa uji tantang kontrol berbeda nyata dengan perlakuan A, B dan C pada hari ke-49, namun pada hari ke-63 perlakuan C berbeda nyata dengan perlakuan B, C dan kontrol. Tabel 16. Nilai Rataan Indeks Fagositik Pada Setiap Perlakuan (%) Selama Vaksinasi Perlakuan A B C K 21 7.7±1.5 8.7±0.6 10±2 7.3±1.2 Masa Vaksinasi (hari) 28 35 42 12.7±1.5c 11.7±2.1ab 9.3±1.5b 16.7±1.5b 13.3±3.1b 10.3±0.6b 13.7±1.5b 14±1b 11±1b a a 8.3±1.2 8±1 7±1a Tabel 17. Nilai Rataan Indeks Fagositik Pada Setiap Perlakuan (%) Selama Uji Tantang Perlakuan Masa Uji Tantang (hari) 49 56 63 70 23±1b 19±2 17±1b A 23.7±0.6b 20.3±1.5 18.3±1.5b B 24±1b 17±2.6 10±1a 12.7±1.5 C a b 20±1 19.3±2.1 17±2.6 K Keterangan : Huruf superscrift yang berbeda pada kolom yang sama menunjukkan pengaruh berbeda nyata (p<0,05) H+28 H+35 H+42 30 Rataan (%) y = -0.0455x2 + 0.8437x + 20.409 25 R2 = 0.8961 H+49 H+63 y = -0.0576x2 + 1.1559x + 8.3953 R2 = 0.9551 y = -0.1278x2 + 1.1131x + 16.31 R2 = 0.9307 20 15 10 5 y = -0.1355x2 + 2.1261x + 8.2864 R2 = 0.9996 0 0 2.5 5 y = -0.0328x2 + 0.6993x + 7.2747 R2 = 0.949 7.5 Dosis 10 12.5 15 Gambar 6. Hubungan tingkat dosis (X) dengan persentase rataan indeks fagositik (Y) ikan mas pada hari ke-28, 35, 42, 49 dan 63 Pada gambar 7 menunjukkan peningkatan persentase rataan indeks fagositik dalam darah ikan mas yang diberi perlakuan vaksin dengan dosis 0, 2,5, 7,5, dan 12,5 µg/100µl pada hari ke-28, 35, 42, 49 dan 63 membentuk pola kuadratik. Nilai korelasi yang diperoleh masing-masing sebesar 0.99, 0.97, 0.97, 0.94 dan 0.96 yang berarti hubungan tingkat dosis dengan persentase rataan indeks fagositik sangat tinggi. Nilai koefisien determinasi (R2) yang diperoleh masing-masing sebesar 0.9996, 0.9551, 0.949, 0.8961 dan 0.9307. Nilai determinasi yang didapat menunjukkan variabel dosis dapat menerangkan variabilitas sebesar 99.96%, 95.51%, 94.9%, 89.61% dan 93.07% dari variabel indeks fagositik. 4.2 Pembahasan Pengamatan gambaran darah ikan selama penelitian meliputi jumlah eritrosit, kadar hemoglobin, hematokrit, leukosit total dan hitung jenis (diferensial) leukosit dan indek fagositik. Pemberian vaksin DNA (vaksinasi) terhadap ikan mas memberikan pengaruh terhadap jumlah sel darah putih (leukosit) dalam darah ikan. Berdasarkan analisis statistik pada masa vaksinasi perlakuan kontrol berbeda nyata dengan perlakuan B pada hari ke-21 dan 42, namun pada hari ke-28 perlakuan kontrol berbeda nyata dengan perlakuan A dan B, yaitu total leukosit kontrol lebih rendah dari kedua perlakuan tersebut (Tabel 2). Sedangkan setelah 33 ikan diuji tantang (diinfeksi KHV) jumlah rataan leukosit masing-masing perlakuan tidak ada yang berbeda nyata (Tabel 3). Pada tabel 2 menunjukan jumlah total rata-rata leukosit pada ikan mas yang divaksinasi lebih besar dibanding dengan ikan kontrol dan semakin tinggi seiring dengan bertambahnya hari. Dapat dikatakan vaksinasi meningkatkan jumlah leukosit. Hal ini berkaitan dengan fungsi sel darah putih dalam tubuh yaitu sebagai alat pertahanan. Namun seminggu setelah uji tantang dengan KHV (hari ke-49), secara umum jumlah total rata-rata leukosit pada ikan mas menurun. Penurunan ini menandakan virus KHV yang diinfeksikan ke ikan mulai aktiv. Hal ini turut pula didukung, dari hasil pengukuran suhu harian diperoleh kisaran suhu harian 23,5-25oC (lampiran 5), kisaran tersebut berada pada kisaran optimum bagi kehidupan (replikasi) KHV yaitu 18-25oC (Ronen et al. 2003). Penurunan tersebut masih berada di kisaran normal total leukosit ikan mas yaitu 20.000-150.000 sel/mm3. Diduga penurunan terjadi karena kuatnya infeksi virus, leukosit yang ada pada pembuluh darah sangat berkurang, karena sebagian besar leukosit bergerak maju menuju jaringan-jaringan yang terinfeksi. Hal ini merupakan respon ikan dalam upaya mengenal dan mengingat kembali jenis virus yang masuk. Pengenalan terhadap virus yang menginfeksi merupakan implementasi respon imun spesifik pada ikan. Namun seiring dengan lamanya pemeliharaan, kembali terjadi peningkatan total sel darah putih dalam darah ikan. Peningkatan jumlah rataan sel darah putih pada penginfeksian virus mengindikasikan bahwa ikan memberi respon tanggap kebal terhadap adanya benda asing yang masuk ke dalam tubuh. Gambar 1 menunjukan garis trend hubungan tingkat dosis dengan jumlah total rataan leukosit pada hari ke-21 dan 42 berbentuk kuadratik dengan nilai koefisien determinasi (R2) masing-masing 0.9469 dan 0.9904 menunjukkan pengaruh dosis vaksin DNA yang diuji sangat besar terhadap perubahan total leukosit ikan mas yakni masing-masing sebesar 94.69% dan 99.04%. Diferensial leukosit meliputi limfosit, monosit dan neutrofil. Persentase rataan limfosit pada hari yang sama dari hari ke 7 – 21 dan hari ke 35 - 56 tidak berbeda nyata, sedangkan pada hari ke-28 perlakuan B berbeda nyata (p<0.05) dengan perlakuan C dan kontrol. Tiga minggu setelah uji tantang (hari ke-63) perlakuan C berbeda nyata (p<0.05) dengan ketiga perlakuan yang lain, dimana perlakuan C menunjukan nilai limfosit tertinggi. Gambar 2 menunjukan garis trend hubungan tingkat dosis dengan persentase limfosit pada hari ke-28 dan 63 berbentuk kuadratik dengan nilai koefisien determinasi (R2) ) masing-masing 0.9491 dan 0.9054 menunjukkan pengaruh dosis vaksin DNA yang diuji sangat besar terhadap persentase limfosit ikan mas yakni masing-masing sebesar 94.91% dan 90.54%. Seminggu setelah uji tantang (hari ke-49), terjadi penurunan persentase limfosit pada ikan yang divaksin maupun ikan kontrol (tidak divaksin), kemudian pada minggu ke-2 (hari ke-56) persentase limfosit kembali meningkat. Hal ini mengindikasikan bahwa ikan memberi respon tanggap kebal terhadap adanya benda asing yang masuk ke dalam tubuh. Diduga penurunan limfosit pada hari ke-49 menunjukan bahwa virulensi virus pengaruhnya lebih dominan dibanding sistem pertahanan ikan pada semua perlakuan, namun infeksi lebih kuat terjadi pada perlakuan A, B dan kontrol. Respon imunitas ikan pada perlakuan C terlihat lebih dominan pada minggu ke-2 dan 3 setelah infeksi virus, terlihat dari peningkatan limfosit yang lebih tinggi. Peningkatan persentase limfosit tersebut terkait dengan peran sel limfosit sebagai sel pertahanan tubuh. Pada dasarnya sel limfosit terdiri dari dua populasi : sel B dan sel T. Sel B mempunyai kemampuan untuk bertransformasi menjadi sel plasma yaitu sel yang memproduksi antibodi. Sedangkan sel T sangat berperan dalam kekebalan berperantara sel (sel T sitotoksik) dan mengontrol respon imun (sel T supresor) (Kresno 2001). Setelah terjadi pengikatan antigen dengan reseptor antigen sel limfosit, maka sel limfosit akan membelah dan berdiferensiasi menjadi sel efektor dan sel memori (Tizard 1988). Persentase rataan monosit (Tabel 6) pada berbagai perlakuan selama masa vaksinasi tidak menunjukan perbedaan yang nyata. Pada tabel 7 menunjukan bahwa seminggu pasca infeksi KHV persentase monosit semua perlakuan meningkat tajam. Hal ini menunjukan infeksi KHV meningkatkan jumlah monosit dalam darah ikan, hal ini terkait dengan peran monosit sebagai makrofag yaitu sel fagosit utama untuk menghancurkan partikel asing dan jaringan mati, serta 35 mengolah bahan asing demikian rupa sehingga bahan asing itu dapat membangkitkan tanggap kebal (Tizard 1988). Kemudian dua minggu pasca infeksi KHV, persentase monosit cenderung menurun. Diduga penurunan ini disebabkan infeksi KHV mulai merusak jaringanjaringan tubuh ikan sedemikian sehingga merangsang sel monosit keluar dari sirkulasi darah dengan menembus dinding pembuluh darah kemudian masuk ke jaringan yang terinfeksi dengan berdiferensiasi menjadi makrofag (Affandi dan Tang 2002), akibatnya jumlah monosit dalam pembuluh darah menurun. Pada minggu ketiga (hari ke-63) pasca infeksi perlakuan C (dosis 12.5 µg/100µl) berbeda nyata dengan ketiga perlakuan yang lain (perlakuan A, B dan kontrol) yaitu lebih rendah, dimana persentase rataan monosit pada perlakuan A, B dan kontrol kembali meningkat. Gambar 3 menunjukan garis trend hubungan tingkat dosis dengan persentase monosit pada hari ke-63 berbentuk kuadratik dengan nilai koefisien determinasi (R2) sebesar 0.965 menunjukkan pengaruh dosis vaksin DNA yang diuji sangat besar terhadap perubahan persentase monosit ikan mas yaitu sebesar 96.5%. Pada gambar tersebut menunjukan perlakuan C memiliki persentase yang lebih kecil dibandingkan dengan perlakuan A, B dan kontrol hal ini mengindikasikan pada perlakuan A, B dan kontrol infeksi KHV semakin mengganas, sehingga monosit masih diproduksi untuk melawan infeksi virus ataupun infeksi sekunder oleh bakteri, sedangkan pada perlakuan C infeksi KHV dapat ditekan, sehingga produksi monosit tidak diperlukan, atau juga dapat diduga bahwa sistem pertahanan tubuh ikan pada perlakuan C tetap bekerja dengan baik, dimana sebagian besar monosit masih melakukan migrasi dari pembuluh darah menuju ke sel-sel yang terinfeksi virus dan berdiferensiasi menjadi sel makrofag yang berperan dalam memfagosit dan menyajikan antigen kepada sel limfosit. Persentase neutrofil perlakuan B pada hari ke-28 berbeda nyata (p<0,05) dengan perlakuan C dan kontrol, tetapi tidak berbeda nyata dengan perlakuan A. Peningkatan jumlah netrofil pada perlakuan B bahkan melebihi kisaran normal persentase netrofil ikan mas yaitu 2 – 10%. Hal ini disebabkan oleh adanya infeksi bakteri yang terjadi pada minggu keempat setelah vaksinasi. Pada hari ke-63 (minggu ke-3 pasca infeksi KHV) perlakuan kontrol yang berbeda nyata (p<0,05) dengan perlakuan B dan C, tetapi tidak berbeda nyata dengan perlakuan A. Perlakuan kontrol dan A memiliki persentase neutrofil lebih tinggi dari kisaran normal. Hal ini diduga akibat infeksi KHV yang semakin virulen yang menyebabkan terjadinya penurunan kondisi tubuh sehingga terjadi infeksi sekunder oleh bakteri (Puspitaningtyas 2006). Hasil identifikasi bakteri (lampiran 4) yang diisolasi dari ginjal menunjukan bakteri yang menyerang adalah Aeromonas sp. identifikasi bakteri merujuk pada Cowan (1974). Takashima dan Hibiya (1995) mengatakan bahwa fungsi neutrofil adalah untuk menahan serangan atau infeksi bakteri. Menurunnya jumlah neutrofil dalam darah disebabkan neutrofil sudah melakukan aktivitas fagositik di dalam sel dan neutrofil berumur pendek (Tizard 1988). Gambar 4 menunjukan garis trend hubungan tingkat dosis dengan persentase neutrofil pada hari ke-14 dan 63 berbentuk kuadratik dengan nilai koefisien determinasi (R2) masing-masing sebesar 0.9213 dan 0.8807 menunjukkan pengaruh dosis vaksin DNA yang diuji cukup besar terhadap perubahan persentase neutrofil ikan mas, baik sebelum maupun sesudah uji tantang dengan virus KHV. Jumlah rataan sel darah merah (eritrosit) dalam darah ikan mas pada masing-masing perlakuan, menunjukan tidak berbeda nyata pada hari yang sama dari hari ke-7 sampai hari ke-56. Sedangkan pada hari ke-63 jumlah rataan eritrosit pada kontrol berbeda nyata (p<0,05) dengan pelakuan A, B dan C. Rendahnya jumlah rataan eritrosit pada kontrol (710.000 sel/mm3), mengindikasikan virulensi KHV semakin mengganas, diduga telah terjadi pendarahan (hemoragi) yang cukup parah disekitar pangkal dan ujung sirip serta permukaan tubuh lainnya. Selain itu ada kemungkinan organ penghasil darah (hemopoietik) ikan yaitu ginjal telah mengalami kerusakan. Gambar 5 menunjukan garis tren hubungan tingkat dosis dengan jumlah total rataan eritrosit pada hari ke-63 berbentuk kuadratik dengan nilai koefisien determinasi (R2) sebesar 0.5773 menunjukkan pengaruh dosis vaksin DNA yang diuji terhadap perubahan total eritrosit ikan mas hanya 57.73% sedangkan sisanya dipengaruhi oleh faktor lain. 37 E N L M Gambar 7. Sel Darah Pada Ikan Mas : Eritrosit (E), Monosit (M), Neutrofil (N), Limfosit (L). bar = 10 μm a b c Gambar 8. Proses fagositosis (F) pada : a = Monosit; b = Neutrofil; c = Limfosit, bar = 10 μm Kadar hemoglobin (Hb) pada masing-masing perlakuan menunjukan nilai yang fluktuatif, namun jumlahnya masih berada dalam kisaran kadar Hb normal ikan mas (6 - 10 g%). Pada tabel 13 menunjukan seminggu pasca infeksi virus. Kadar Hb pada masing-masing perlakuan cenderung menurun. Diduga hal ini disebabkan kadar oksigen dalam darah menurun. Ikan yang terserang KHV akan sulit mendapatkan oksigen karena produksi lendir di insang yang berlebih dan terjadi nekrosis pada insang. Nilai hematokrit dalam darah ikan mas pada perlakuan yang berbeda, menunjukan nilai yang berfluktuasi. Secara umum tidak terdapat perbedaan yang nyata pada masing-masing perlakuan di hari yang sama. Namun bila dilihat pada tabel 15, pasca infeksi KHV perlakuan C terlihat memberikan respon peningkatan hematokrit yang paling tinggi dibandingkan perlakuan yang lain. Hal ini menggambarkan bahwa sistem pertahanan pada ikan perlakuan C mampu merespon lebih baik terhadap infeksi KHV dibanding perlakuan yang lain. Nilai indeks fagosistik pada hari 28, 35, 42 dan 49 menunjukan terdapat perbedaan yang nyata (p<0,05) antara perlakuan kontrol dengan ketiga perlakuan yang lain. Nilai indeks fagositik perlakuan kontrol lebih rendah dibanding ketiga perlakuan yang lain. Dapat dikatakan nilai indek fagositik pada ikan yang divaksinasi lebih tinggi dibanding yang tidak divaksinasi. Selain itu, seminggu setelah ikan diinfeksi KHV, cenderung terjadi peningkatan nilai indeks fagositik. Hal ini menunjukan terjadi peningkatan kekebalan tubuh. Gambar 6 menunjukan garis trend hubungan tingkat dosis dengan indeks fagositik pada hari ke-28, 35, 42 dan 63 berbentuk kuadratik dengan nilai koefisien determinasi (R2) masing-masing sebesar 0.9996, 0.9551, 0.949, 0.8961 dan 0.9307 menunjukkan pengaruh dosis vaksin DNA yang diuji sangat besar terhadap perubahan nilai indeks fagositik ikan mas, baik sebelum maupun sesudah uji tantang dengan virus KHV. Pola peningkatan persentase indeks fagositik ini adalah fungsi dari peningkatan total leukosit maupun persentase jenis darah leukosit masing-masing pada limfosit, monosit dan neutrofil. Proses fagositosis (gambar 8) terhadap bakteri Staphylococcus aureus menunjukan terjadinya tahapan dari proses fagositosis. Pada proses tersebut meliputi tahap kemotaksis, tahap pelekatan, tahap penelanan dan tahap pencernaan (Tizard 1988). Nilai indeks fagositik yang tinggi pada perlakuan vaksinasi menggambarkan pula bahwa proses fagositosis yang terjadi dengan cepat berkontribusi dalam mekanisme penyajian antigen (antigen presenting cells) untuk merangsang respon sel limfosit (Santika 2007). Partikel antigen yang difagosit, diproses dan dipresentasikan sebagai peptide antigen yang berasosiasi dengan molekul MHC kelas II pada permukaan sel fagosit. Sub populasi sel T yang disebut sel T-helper (Th) akan mengenali mikroorganisme bersangkutan melalui MHC kelas II. Sinyal ini menginduksi sel limfosit untuk memproduksi berbagai jenis limfokin, termasuk diantaranya adalah interferon yang dapat membantu makrofag menghancurkan mikroorganisme tersebut. Disamping itu pengikatan MHC kelas II dengan sel Th akan memberi sinyal supaya sel limfosit B berproliferasi dan berdiferensiasi untuk membentuk antibodi (Kresno 2001). 39 V. KESIMPULAN DAN SARAN 5.1 Kesimpulan Penggunaan vaksin DNA dengan dosis 2.5, 7.5 dan 12.5 µg/100µl selama masa vaksinasi memberikan pengaruh terhadap beberapa parameter hematologi yaitu total leukosit, persentase limfosit dalam darah dan indeks fagositik. Sedangkan pada masa uji tantang dengan virus KHV pengenceran 10-3 parameter darah yang terlihat berpengaruh nyata adalah limfosit, monosit dan indeks fagositik. Pada akhir pengamatan, perlakuan C (dosis 12.5 µg/100µl) menunjukan persentase limfosit tertinggi, total rataan eritrosit tertinggi dan persentase monosit yang lebih cepat turun dari kedua perlakuan dosis lainnya, sehingga dapat disimpulkan bahwa vaksin DNA dengan dosis 12.5 µg/100µl memberikan efektifitas (respon tanggap kebal) terbaik dibandingkan dengan kedua dosis yang lain. 5.2 Saran Diperlukan suatu kajian mengenai penambahan dosis vaksin DNA untuk mengetahui dosis optimum vaksin, sehingga diperoleh respon kekebalan tubuh ikan lebih baik. DAFTAR PUSTAKA Affandi R dan Tang UM. 2002. Fisiologi Hewan Air. Unri Press. Pekanbaru. Amrullah. 2004. Penggunaan Imunostimulan Spirulina platensis Untuk Meningkatkan Ketahanan Tubuh Ikan Koi (Cyprinus carpio) Terhadap Virus Herpes [Tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor. Anderson DP. 1990. Immunological indicators: effects of environmental stress on immune protection and disease outbreaks. Di dalam: Adams, SM, editor. Biological Indicators of Stress in Fish. American Fisheries Symposium 8. hlm 38-35. Chinabut S, Limsuwan C, Katsuwan. 1991. Histology of Walking Catfish Clarius batracus. IDRC, Canada. 96ps. Corbeil S, Lapatra SE, Anderson ED, Jones J, Vincent B, Hsu YL, Kurath G, 1999. Evaluation of the protective immunogenicity of the N, P, M, NV and G proteins of infectious hematopoietic necrosis virus in rainbow trout Oncorhynchus mykiss using DNAvaccines. Dis. Aquat. Org. 22;39 (1), 29–36. Cowan ST . 1974. Manual For The Identification of Medical Bacteria. Second Edition. Cambrigde University Press Daili SF dan Makes WI. 2002. Infeksi Virus Herpes. Fakultas Kedoteran Universitas Indonesia. Kelompok Studi Herpes Virus. Jakarta Gilad O, Yun S, Adkison MA, Way K, Willits NH, Bercovier H, Eldar A and Hedrick RP. 2003. Molecular comparison of isolates of an emerging fish pathogen, koi herpesvirus and effect of water temperature on mortality of experimentally infected koi. Journal of General Virology 84: 2661-2668 Gillund F, Dalmo R, Tonheim TC, Seternes T and Mhyr AI. 2008. DNA vaccination in aquaculture, Expert judgments of impacts on environment and fish health. . Elsevier. Journal of Aquaculture 284 : 25-34 Hartman KH, Yanong RPE, Petty BD, Francis-Floyd R, Riggs AC. 2004. Koi Herpes Virus (KHV) Disease, Universitas of Florida, IFAS Exten. Fact Sheet VM-149. Hibiya T and Takashima F. 1995. An Atlas of Fish Histology Normal and Pathological Feature. Second Edition. Takashima F. Kodansha Ltd Tokyo. 195 hlm. 41 Irianto A. 2005. Patologi Ikan Teleostei. Gajah Mada Universitas Press, Yogyakarta. 256 hlm. Kresno SB. 2001. Imunologi Diagnosis dan Prosedur Laboratorium. Edisi ketiga. Fakultas Kedokteran Universitas Indonesia. Jakarta. Lagler KF, Bardach JE, Miller RR and Paxino DRM. 1963. Ichtyology. Jhon Willey and Sons inc. New York. 295 ps. LaPatra SE, Corbeil S, Jones GR, Shewmaker WD, Lorenzen N and Anderson ED. 2001. Protection of rainbow trout against infectious hematopoietic necrosis virus four days after specific or semi-specific DNA vaccination. Vaccine 19 : 4011–4019. Lorenzen N and LaPatra SE 2005. DNA Vaccines for Aquacultured Fish. Rev Sci Tech supl 24 : 201-213. Miwa S, Ito T and Sano M. 2007. Morphogenesis of koi herpesvirus observed by electron microscopy. Journal of Fish Diseases 30: 715–722. Moyle PB and Chech JJ. 1988. Fishes: An Introduction to Ichtyology. PrenticeHall Inc. A Division of Salmon and Schuster Englewood Cliffs, New Jersey. 597 ps. Malole MB. 1988. Virologi. Pusat Antar Universitas IPB. Nabib R dan Pasaribu FH. 1989. Patologi dan Penyakit Ikan. Pusat Antar Universitas Institut Pertanian Bogor . Naim R. 20 Juli 2004. Molecular Medicine: Vaksin DNA. Kompas: http://www2.kompas.com/kompas-cetak/0407/20/ilpeng/1153089.htm [14 April 2009] Perelberg A, Smirnov M, Hutoran M, Diamant A, Bejerano M and Kotler M. 2003. Epidemiological description of a new viral disease afflicting cultured Cyprinus carpio in Israel. The Israeli Journal of Aquaculture 55 : 5-12. Pokorova D, Vesely T, Piackova V, Reschova S and Hulova J. 2005. Current knowledge on koi herpesvirus (KHV): a review. Vet. Med. – Czech, 50 (4): 139–147. Purwanto A. 2006. Gambaran Darah Ikan Mas Cyporinus carpio Yang Terinfeksi Koi Herpes Virus. [skripsi]. Bogor: Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Puspitaningtyas D. 2006. Potensi Ekstrak Bawang Putih Allium sativum Untuk Menginaktivasi Koi Herpes Virus (KHV) pada Ikan Mas Cyprinus carpio. [skripsi]. Bogor: Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Ronen A, Pereberg A, Abramowitz J, Hutoran M, Tinman S, Bejerano L, Steinitz M and Kotler M. 2003. Efficient vaccine against the virus causing a lethal disease in culture Cyprinus carpio. Elsevier. Vaccine Journal 21 : 46774684. Sano M, Ito T, Kurita J, Miwa S and Iida T. 2005. Diagnosis of koi herpesvirus (KHV) disease in Japan. Bulletin of Fisheries Research Agency, Supl 2 : 59-64. Santika A. 2007. Efektivitas Suplementasi Kromium-Ragi (Cr3+) Untuk Meningkatkan Ketahanan Tubuh Ikan Mas Terhadap Virus Herpes Pada Suhu Rentan KHV. [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor. Sunarto A, Rukyani A and Itami T. 2005. Indonesian experience on the outbreak of koi herpes virus in koi and carp (Cyprinus carpio). Bulletin of Fisheris Research Agency, Tokohama, Japan. 86 : 15-21. Svobodova Z, Vyukusova B. 1991. Diagnostik, Prevention and Therapy of Fish Disease and Intoxication. Research Institute of fish Culture and Hydrobiology Vodnany Czechoslovakia. http//www.fao.org/fi/website/firetriveaction.do?dom=topic&fid=16064&la ng=en [22 April 2009] Taukhid, Sunarto A, Koesharyani I, Supriyadi H, Gaedenia L. 2004. Strategi pengendalian penyakit koi herpes virus (KHV) pada ikan mas dan koi. Makalah seminar pengendalian penyakit koi herpes virus (KHV) pada budidaya ikan air tawar. Bogor Tizard I. 1988. Pengantar Imunologi Veteriner. Ed ke-2. Partodirejo M, Hardjosworo S, penerjemah; Surabaya: Airlangga University Press. Terjemahan dari: An Introduction to Veterinary Immunology. Waltzek BT, Kelley GO, Stone DM, Way K, Hanson L, Fukuda H, Hirono I, Aoki T, Davidson AJ and Hedrick RP. 2005. Koi herpesvirus represent a third cyprinid herpesvirus (CyHV-3) in the family Herpesviridae. Journal of General Virology 86: 1689-1667 Zheng FR, Sun XQ, Liu HZ, Zhang JX. 2006. Study on the distribution and expression of a DNA vaccine against lymphocystis disease virus in japanese flounder (Paralichthys olivaceus). Aquaculture 26: 1128-1134. 43 Lampiran 1. Kadar Hemoglobin, Kadar Hematokrit, Total Eritrosit dan Total Leukosit sampel A1 A2 A3 B1 B2 B3 C1 C2 C3 K1 K2 K3 Hb (g%) 11,6 9 9,4 10 10,6 9 6 9,2 7,4 9 6,6 11 Ht 29 40,5 36 36 42 40 39 33 40 33 31 32 A1 A2 A3 B1 B2 B3 C1 C2 C3 K1 K2 K3 8 7.2 6.6 6 6.6 9 7.2 8.2 6 7 7.4 7 31 25 25.5 31 25 25.5 20 31 12 26 22 25 7 Total eritrosit 1370000 1660000 1360000 880000 1220000 1340000 1030000 990000 1830000 1150000 1610000 1830000 28 1240000 1490000 1780000 1220000 1250000 1030000 1020000 1070000 850000 1390000 1600000 1100000 Total leukosit 42150 29500 59600 14350 46200 46650 60950 60150 55450 24850 36900 21150 Hb (g%) 9 7,8 11 9,2 8,2 9,2 11 10,4 8,2 8,6 7,8 10,2 81000 87900 89100 74650 54950 91450 43550 55150 59950 55550 32300 43000 8 10 6 5.8 11 10.2 6 9 10 8.2 10 8 Sampling hari ke14 Total Ht eritrosit 23,5 1560000 23 1340000 31 1240000 22,5 1780000 20 1220000 29 1300000 33 1620000 33 1170000 20 1140000 25 1740000 22 900000 29 910000 35 33 1480000 29 1790000 23.5 1320000 14 1020000 31 1460000 26.5 1200000 21 980000 27 1650000 25.5 1900000 15 1550000 22 1630000 28 1050000 Total leukosit 42100 28050 30700 33700 47500 50900 47250 46650 33450 50550 22000 21350 Hb (g%) 12 6 8,4 8,5 11 6,7 8,3 7,4 11,2 9,4 8,4 9,6 Ht 27 11 25 31,5 18 19,5 29 31 35 31 25 34 86750 83200 78150 77800 83800 85250 75700 84450 110250 63450 84950 84050 11.2 12.4 11.4 11.4 10 11.6 10.4 10.6 10.2 9.8 10 8.2 34 33 24 33 26 20.5 22 34 20 30 29 14 21 Total eritrosit 1750000 1010000 1170000 1320000 1380000 830000 1460000 1510000 1290000 1630000 1530000 1580000 42 1240000 1520000 1420000 1800000 1150000 1060000 860000 1340000 1330000 1330000 1200000 1300000 Total leukosit 27350 47950 59100 74250 80100 49800 62550 44350 55500 35550 36850 28750 92300 109250 99800 125950 139300 116800 90950 77100 135250 70950 87050 69850 45 A1 A2 A3 B1 B2 B3 C1 C2 C3 K1 K2 K3 9.1 10.4 8 8.2 8.4 8.4 9 11 11 10 8.5 6 29 35 25 26 31 26 25 32 35 30 28 13 C1 C2 C3 4 10 11.6 35 34 21.5 49 910000 1720000 1420000 1280000 1620000 990000 1530000 1180000 1670000 1100000 1030000 1020000 70 1840000 1520000 1690000 26100 21550 33950 53500 48800 37100 52700 48300 31600 55050 47400 35100 55750 59700 57400 11.6 14.4 8.8 8.8 8.8 8.4 10.4 11.2 8 11 9.4 11.2 29 25 24 32 23 27 29 33 30 33 27 25.5 56 1160000 1970000 1210000 1150000 940000 1560000 1160000 2300000 1140000 1440000 1620000 1470000 27300 47950 35350 26600 18300 51500 35050 25250 38650 49800 30300 54800 8 11 11.2 11.2 10 7.2 9.4 10.2 12 10.8 11.4 13 20 29 30 21 27 15 26 26 39 20 25 25 63 1250000 1240000 1110000 1040000 1000000 1020000 1140000 1290000 1610000 660000 650000 820000 42250 46400 51350 46750 55500 49350 48350 53550 53750 43500 46200 53450 Lampiran 2. Differensial Leukosit a. Persentase Limfosit Perlakua n A Ulanga n 1 2 3 rata2 B 1 2 3 rata2 C 1 2 3 rata2 K 1 2 3 rata2 7 86 89 85 86.6 7 93 86 93 90.6 7 91 90 93 91.3 3 91 89 91 90.3 3 14 89 90 90 89.6 7 87 93 93 91 95 90 93 92.6 7 87 88 86 87 Masa Vaksinasi 21 28 35 90 87 89 92 81 96 89 87 89 90.3 91.3 85 3 3 91 78 91 90 83 89 91 65 96 90.6 75.3 92 7 3 89 90 95 88 88 89 92 84 90 89.6 87.3 91.3 7 3 3 97 91 91 95 90 96 91 93 92 94.3 91.3 93 3 3 42 94 95 92 93.6 7 98 93 95 95.3 3 95 97 90 94 95 94 92 93.6 7 Masa Uji Tantang 49 56 63 70 82 83 80 81 80 81 70 82 79 77.6 81 80 7 75 85 80 93 80 82 70 86 76 79.3 83.6 79.3 3 7 3 84 90 80 90 77 84 83 93 80 84 84 91 80.3 91.3 82.3 86 3 3 3 81 85 75 76 81 76 80 87 78 84.3 76.3 79 3 3 b. Persentase Monosit Perlakua n A Ulanga n 1 2 3 rata2 B 1 2 3 rata2 C 1 2 3 rata2 K rata2 7 4 9 9 7.33 3 5 10 2 5.66 7 5 9 4 6 1 2 3 4 9 4 5.66 7 Masa Vaksinasi 14 21 28 35 6 9 1 6 7 3 8 1 8 8 4 4 6.66 4.33 3.66 7 7 3 7 11 5 8 4 4 5 6 6 5 8 13 3 6.66 4.33 6 9 7 3 4 7 3 3 8 7 3 5 4 4 12 9 5.33 5.66 6 6 3 7 6 2 4 6 4 3 5 3 9 4 5 6 6.33 4.66 3 5 3 7 42 2 2 4 2.66 7 1 3 2 2 2 1 3 2 2 2 4 2.66 7 Masa Uji Tantang 49 56 63 70 8 12 12 7 14 14 20 7 7 11.6 10.5 11 7 11 5 12 3 10 11 23 4 14 12.3 6.33 12.3 3 3 3 10 6 11 5 13 9 11 4 15 10 10 4 12.6 8.33 4.33 10.6 7 3 3 7 4 10 10 15 7 9 11 10 10 9.66 10 9 7 47 c. Persentase Neutrofil Perlakua n A Ulanga n 1 2 3 rata2 B 6 1 2 3 2 4 5 3.66 7 4 1 3 2.66 7 5 2 5 rata2 C 1 2 3 rata2 K 7 10 2 6 1 2 3 rata2 4 14 5 3 2 3.33 3 2 3 2 2.33 3 1 2 3 2 7 8 5 6.66 7 Masa Vaksinasi 21 28 35 1 12 5 5 11 3 3 9 7 10.6 3 5 7 4 14 5 5 11 5 1 22 1 3.33 15.6 3.66 3 7 7 4 7 2 5 9 6 4 4 1 4.33 6.66 3 3 7 1 5 3 2 5 1 5 2 2 2.66 4 2 7 42 4 3 4 3.66 7 1 4 3 2.66 7 3 2 7 4 3 4 4 3.66 7 Masa Uji Tantang 49 56 63 10 5 8 12 6 5 10 11 14 10.6 8.5 9 7 14 10 8 4 10 7 7 10 10 8.33 8.3 10 3 33 6 4 5 10 7 3 5 6 5 5.66 4.3 7 7 33 15 5 15 9 12 15 9 3 12 6.66 11 14 7 Lampiran 3. Indeks Fagositik Perlakukan A B C K Ulangan 1 2 3 R 1 2 3 R 1 2 3 R 1 2 3 R Masa sebelum infeksi (hari) 21 28 35 42 9 11 10 8 8 14 14 9 6 13 11 11 7.67 12.67 11.67 9.33 9 18 14 10 8 17 16 10 9 15 10 11 8.67 16.67 13.33 10.33 10 14 15 10 8 12 14 11 12 15 13 12 10 13.67 14 11 8 9 8 7 6 7 7 6 8 9 9 8 7.33 8.33 8 7 Masa uji tantang (hari) 49 56 63 70 23 21 16 24 19 17 22 17 18 23 19 17 24 22 18 23 20 17 24 19 20 23.67 20.33 18.33 23 15 9 14 25 20 10 11 24 16 11 13 24 17 10 12.67 20 21 14 21 20 19 19 17 18 20 19.33 17 70 9 6 6 7 Lampiran 4. Hasil Uji Identifikasi Bakteri Uji identifikasi Pewarnaan Gram Uji O/F (Oksidatif/Fermentatif) Uji Katalase Uji Motilitas Uji Oksidase Uji Gelatin Bakteri Hasil Gram negatif Fermentatif + + + Aeromonas sp Lampiran 5. Suhu Selama Uji Tantang (oC) Minggu ke-1 Hari kePagi Sore 1 24 25 2 24 25 3 24 25 4 24 25 5 23.5 25 6 24 25 7 24 25 Minggu ke-2 Hari ke8 9 10 11 12 13 14 Pagi Sore 24 25 24 25 24 25 23.5 25 23.5 25 23.9 25 24 24.5 Minggu ke-3 Hari kePagi Sore 15 23.5 24.5 16 23.5 25 17 23.8 24.8 18 24 25 19 23.8 24.8 20 23.5 24.5 21 23.5 24.8 Lampiran 6. Analisis Sidik Ragam (ANOVA) a. Total Eritrosit ANOVA sdm1 Between Groups Within Groups Total sdm2 sdm3 sdm4 Sum of Squares 272691666666.667 861800000000.000 df 3 Mean Square 90897222222.222 8 107725000000.000 1134491666666.667 11 Between Groups 105133333333.333 3 Within Groups 846533333333.333 8 105816666666.667 Total 951666666666.667 11 Between Groups 262700000000.000 3 87566666666.667 Within Groups 516866666666.667 8 64608333333.333 Total 779566666666.667 11 Between Groups 470466666666.666 Within Groups 327200000000.000 8 Total 797666666666.667 11 173025000000.000 3 862266666666.667 8 107783333333.333 sdm5 Between Groups Within Groups F Sig. .844 .507 35044444444.444 3 156822222222.222 .331 .803 1.355 .324 3.834 .057 40900000000.000 57675000000.000 .535 .671 49 Total sdm6 sdm7 sdm8 sdm9 1035291666666.667 11 Between Groups 77225000000.000 3 25741666666.667 Within Groups 526066666666.667 8 65758333333.333 Total 603291666666.667 11 Between Groups 270425000000.000 3 90141666666.667 Within Groups 665466666666.667 8 83183333333.333 Total 935891666666.667 11 Between Groups 188466666666.667 3 Within Groups 1511400000000.000 Total 1699866666666.667 62822222222.222 .391 .763 1.084 .410 .333 .802 8 188925000000.000 11 Between Groups 676625000000.000 3 225541666666.667 12.319 .002 Within Groups 146466666666.667 8 Total 823091666666.667 11 18308333333.333 sdm9 Duncan N perlakuan 4 2 Subset for alpha = .05 1 3 2 710000.00 3 1 3 1 1020000.0 0 1200000.0 0 1200000.0 0 3 1346666.6 3 7 Sig. 1.000 .142 .221 Means for groups in homogeneous subsets are displayed. a Uses Harmonic Mean Sample Size = 3.000. 3 b. Total Leukosit ANOVA Sum of Squares 1594870833.333 df 3 Within Groups 1296128333.333 8 Total 2890999166.667 11 sdp1 Between Groups sdp2 Between Groups Within Groups Total sdp3 Between Groups Mean Square F Sig. 531623611.111 3.281 .080 162016041.667 360651666.667 3 120217222.222 1.007 .438 955143333.333 8 119392916.667 1315795000.000 11 1904854166.667 3 634951388.889 4.090 .049 Within Groups 1241888333.333 8 155236041.667 Total 3146742500.000 11 sdp4 Between Groups 3350457291.667 3 Within Groups 1118785000.000 8 Total 4469242291.667 11 sdp5 Between Groups Within Groups 1116819097.222 7.986 .009 139848125.000 245495000.000 3 81831666.667 1009665000.000 8 126208125.000 .648 .606 Total 1255160000.000 11 sdp6 Between Groups 3965870625.000 3 Within Groups 2431015000.000 8 Total 6396885625.000 11 sdp7 Between Groups Within Groups Total 762200625.000 3 671766666.667 8 1321956875.000 4.350 .043 303876875.000 254066875.000 3.026 .094 83970833.333 1433967291.667 11 sdp8 Between Groups 309083958.333 3 103027986.111 Within Groups 1245061666.667 8 155632708.333 Total 1554145625.000 11 sdp9 Between Groups 52788333.333 3 17596111.111 Within Groups 153591666.667 8 19198958.333 Total 206380000.000 11 sdp3 Duncan N perlakuan 4 Subset for alpha = .05 1 3 2 33716.67 1 1 3 44800.00 44800.00 3 3 54133.33 54133.33 2 3 68050.00 Sig. .090 .060 Means for groups in homogeneous subsets are displayed. a Uses Harmonic Mean Sample Size = 3.000. sdp4 Duncan N perlakuan 4 Subset for alpha = .05 1 3 3 3 3 2 1 Sig. 2 43616.67 52883.33 3 52883.33 73683.33 1 73683.33 3 86000.00 .365 .063 .238 Means for groups in homogeneous subsets are displayed. a Uses Harmonic Mean Sample Size = 3.000. sdp6 Duncan N perlakuan 4 1 3 2 Sig. Subset for alpha = .05 1 3 3 3 3 2 75950.00 100450.00 101100.00 1 100450.00 101100.00 127350.00 .129 .107 Means for groups in homogeneous subsets are displayed. a Uses Harmonic Mean Sample Size = 3.000. .662 .598 .917 .475 51 c. Kadar Hemoglobin ANOVA Hb1 Hb2 Hb3 Hb4 Hb5 Hb6 Sum of Squares 11.707 df 3 Mean Square 3.902 Within Groups 20.080 8 2.510 Total 31.787 11 Between Groups Between Groups 2.010 3 .670 Within Groups 13.227 8 1.653 Total 15.237 11 Between Groups .289 3 .096 Within Groups 36.280 8 4.535 Total 36.569 11 Between Groups .037 3 .012 Within Groups 8.560 8 1.070 Total 8.597 11 Between Groups 1.743 3 .581 Within Groups 34.773 8 4.347 Total 36.517 11 Between Groups Within Groups Total Hb7 Hb8 Hb9 8.827 3 2.942 4.373 8 .547 Between Groups 8.833 3 2.944 Within Groups 13.747 8 1.718 Total 22.580 11 Between Groups 13.587 3 4.529 Within Groups 23.280 8 2.910 Total 36.867 11 Between Groups 8.303 3 2.768 Within Groups 20.987 8 2.623 Total 29.290 11 Duncan N 3 2 1 Sig. .405 .753 .021 .995 .011 .998 .134 .937 5.382 .025 13.200 11 Hb6 perlakuan 4 F Sig. 1.555 .274 Subset for alpha = .05 1 3 2 9.3333 3 10.4000 3 3 1 10.4000 11.0000 11.6667 .115 .079 Means for groups in homogeneous subsets are displayed. a Uses Harmonic Mean Sample Size = 3.000. 1.714 .241 1.556 .274 1.055 .420 d. Kadar Hematokrit ANOVA Ht1 Between Groups Sum of Squares 88.729 df Mean Square F Sig. 3 29.576 2.031 .188 Within Groups 116.500 Total 205.229 11 Ht2 Between Groups 8 14.563 36.750 3 12.250 Within Groups 220.667 8 27.583 Total 257.417 11 Ht3 Between Groups .444 .728 244.250 3 81.417 2.022 .189 Within Groups 322.167 8 40.271 Total 566.417 11 Ht4 Between Groups 77.417 3 25.806 Within Groups 235.000 8 29.375 Total 312.417 11 Ht5 Between Groups 73.229 3 24.410 Within Groups 304.833 8 38.104 Total 378.062 11 Ht6 Between Groups 62.063 3 20.688 Within Groups 414.500 8 51.813 Total 476.563 11 Ht7 Between Groups 7.000 3 2.333 Within Groups 280.000 8 35.000 Total 287.000 11 Ht8 Between Groups Within Groups Total Ht9 Between Groups 35.229 3 11.743 94.833 8 11.854 .878 .492 .641 .610 .399 .757 .067 .976 .991 .445 130.063 11 86.250 3 28.750 Within Groups 292.667 8 36.583 Total 378.917 11 .786 .535 e. Limfosit ANOVA Sum of Squares df Mean Square 39.583 3 48.667 8 88.250 11 13.194 6.083 2.169 .170 51.583 3 17.194 3.497 .070 4.917 Total 39.333 8 90.917 11 Between Groups 39.583 3 13.194 Within Groups Total 32.667 8 4.083 Limfosit1 Between Groups Limfosit2 Within Groups Total Between Groups Within Groups Limfosit3 72.250 11 F Sig. 3.231 .082 53 Limfosit4 Limfosit5 Between Groups 416.250 3 138.750 Within Groups 220.000 8 27.500 Total 636.250 11 Between Groups Within Groups Total Between Groups Limfosit7 Within Groups Total Between Groups Within Groups Total Between Groups Within Groups Total Limfosit9 1.861 11.667 .160 .921 6.917 3 30.000 8 36.917 11 2.306 3.750 .615 .624 10.917 3 3.639 .070 .974 413.333 8 424.250 11 51.667 28.917 68.000 390.250 3 30.000 8 420.250 11 Duncan N Subset for alpha = .05 1 3 3 3 3 2 75.33 85.00 1 85.00 87.33 91.33 .054 .194 Means for groups in homogeneous subsets are displayed. a Uses Harmonic Mean Sample Size = 3.000. 3 4 Sig. Limfosit9 Duncan N Perlakuan 4 2 1 3 Subset for alpha = .05 1 3 2 76.33 3 3 79.33 80.00 3 1 91.33 .057 1.000 Means for groups in homogeneous subsets are displayed. a Uses Harmonic Mean Sample Size = 3.000. Sig. 3 8 9.639 8.500 1.134 .392 96.917 11 Between Groups Within Groups Total Limfosit4 Perlakuan 2 1 3 8 98.917 11 Limfosit6 Limfosit8 5.583 93.333 5.045 .030 130.083 34.689 .000 3.750 f. Monosit ANOVA Monosit1 Between Groups Sum of Squares 5.667 Within Groups 80.000 Total 85.667 11 Monosit2 Between Groups 4.667 3 1.556 8 6.750 Total 58.667 11 .230 .873 24.250 3 8.083 1.865 .214 Within Groups 34.667 8 4.333 Total 58.917 11 40.667 3 13.556 1.030 .430 Within Groups 105.333 8 13.167 Total 146.000 11 Monosit5 Between Groups 6.667 3 2.222 Within Groups 42.000 8 5.250 Total 48.667 11 Monosit6 Between Groups Within Groups Total 1.333 3 .444 9.333 8 1.167 57.583 3 19.194 Within Groups 445.333 8 55.667 Total 502.917 11 Monosit8 Between Groups 33.333 3 Within Groups 61.333 8 Total 94.667 11 Monosit9 Between Groups 110.667 3 32.000 8 Within Groups Total 142.667 11 Monosit9 Duncan N Subset for alpha = .05 1 2 3 .423 .742 .381 .770 10.667 11 Monosit7 Between Groups 2 Sig. F Sig. .189 .901 10.000 54.000 Monosit4 Between Groups 4 1 8 Within Groups Monosit3 Between Groups Perlakuan 3 df Mean Square 3 1.889 1 4.33 3 9.67 3 3 11.00 12.33 1.000 .156 Means for groups in homogeneous subsets are displayed. a Uses Harmonic Mean Sample Size = 3.000. .345 .794 11.111 1.449 .299 7.667 36.889 9.222 .006 4.000 55 g. Neutrofil ANOVA Neutrofil1 Neutrofil2 Neutrofil3 Between Groups Sum of Squares 17.583 Within Groups 47.333 Total 64.917 11 Between Groups 40.917 3 Within Groups 12.000 8 Total 52.917 11 Between Groups Within Groups Total Neutrofil4 Total Neutrofil8 4.667 3 1.556 26.000 8 3.250 .479 .706 77.417 7.038 .012 88.000 8 11.000 14.250 3 4.750 1.096 .405 Within Groups 34.667 8 4.333 Total 48.917 11 Between Groups 3.000 3 1.000 Within Groups 20.000 8 2.500 Total 23.000 11 Between Groups 35.000 3 11.667 Within Groups 114.667 8 14.333 Total 149.667 11 .400 .757 .814 .521 Between Groups 63.000 3 21.000 1.938 .202 Within Groups 86.667 8 10.833 149.667 11 Between Groups Total 95.583 3 57.333 8 152.917 11 Neutrofil2 Duncan N 4 Sig. 1.500 3 Within Groups Perlakuan 3 2 1 13.639 9.093 .006 320.250 11 Total Neutrofil9 5.917 232.250 Neutrofil5 Between Groups Neutrofil7 8 F Sig. .991 .445 30.667 11 Between Groups Within Groups Neutrofil6 df Mean Square 3 5.861 Subset for alpha = .05 1 2 1 3 3 2.00 2.33 3 3 3.33 6.67 .237 1.000 Means for groups in homogeneous subsets are displayed. a Uses Harmonic Mean Sample Size = 3.000. 31.861 4.446 .041 7.167 Neutrofil4 Duncan N Perlakuan 4 Subset for alpha = .05 1 2 3 3 3 1 3 4.00 6.67 3 2 1 6.67 10.67 10.67 3 15.67 Sig. .354 .178 Means for groups in homogeneous subsets are displayed. a Uses Harmonic Mean Sample Size = 3.000. .102 Neutrofil9 Duncan N Perlakuan 3 2 1 4 Subset for alpha = .05 1 2 3 3 3 3 1 6.33 8.33 9.00 9.00 14.00 Sig. .276 .051 Means for groups in homogeneous subsets are displayed. a Uses Harmonic Mean Sample Size = 3.000 h. Indeks Fagositik ANOVA IF3 Between Groups Within Groups Total IF4 Between Groups Within Groups Total IF5 Between Groups Within Groups Total IF6 Between Groups Within Groups Total IF7 Between Groups Within Groups Total IF8 Between Groups Within Groups Total Sum of Squares 12.917 16.000 Df 3 8 28.917 11 107.000 3 16.667 8 123.667 11 64.917 31.333 Mean Square 4.306 2.000 F Sig. 2.153 .172 35.667 17.120 .001 2.083 3 8 21.639 3.917 5.525 .024 96.250 11 27.583 3 9.194 7.881 .009 9.333 8 36.917 11 30.000 3 6.667 8 36.667 11 17.583 1.167 10.000 12.000 .002 .833 3 5.861 35.333 8 52.917 11 4.417 1.327 .332 57 IF9 Between Groups Within Groups 128.250 22.667 Total 3 8 42.750 15.088 .001 2.833 150.917 11 IF4 Duncan N Perlakuan 4.00 Subset for alpha = .05 1 3 1.00 2 8.3333 3 3 3.00 2.00 3 12.6667 13.6667 3 Sig. 1.000 .421 Means for groups in homogeneous subsets are displayed. a Uses Harmonic Mean Sample Size = 3.000. IF5 Duncan N Perlakuan 4.00 1.00 Subset for alpha = .05 1 2.00 3.00 Sig. 3 2 8.0000 3 11.6667 11.6667 .053 13.3333 14.0000 .203 3 3 1 Means for groups in homogeneous subsets are displayed. a Uses Harmonic Mean Sample Size = 3.000. IF6 Duncan N Perlakuan 4.00 1.00 Subset for alpha = .05 1 3 3 3 3 2.00 3.00 2 7.0000 1 9.3333 10.3333 11.0000 Sig. 1.000 .107 Means for groups in homogeneous subsets are displayed. a Uses Harmonic Mean Sample Size = 3.000. IF7 Duncan N Perlakuan 4.00 1.00 2.00 3.00 Subset for alpha = .05 1 3 3 3 3 2 20.0000 1 23.0000 23.6667 24.0000 1.000 .234 Means for groups in homogeneous subsets are displayed. a Uses Harmonic Mean Sample Size = 3.000. Sig. 1 16.6667 1.000 IF9 Duncan N Perlakuan 3.00 1.00 4.00 2.00 Sig. Subset for alpha = .05 1 3 2 10.0000 1 3 3 17.0000 17.0000 3 18.3333 1.000 .379 Means for groups in homogeneous subsets are displayed. a Uses Harmonic Mean Sample Size = 3.000.