BAB II TINJAUAN PUSTAKA 2.1 PENDAHULUAN Secara umum
advertisement

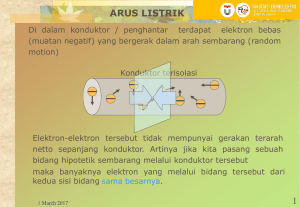
5 BAB II TINJAUAN PUSTAKA 2.1 PENDAHULUAN Secara umum, baterai logam udara mempunyai tiga komponen utama, pertama yaitu anoda yang berupa bahan logam. Kedua adalah elektrolit, dimana elektrolit yang paling umum adalah KOH. Sementara yang ketiga adalah katoda yang berupa karbon berpori (Vincenzo dkk, 2014) 2.2 BATERAI Baterai adalah perangkat yang mengubah energi kimia yang terkandung dalam bahan aktif menjadi energi listrik dengan cara reaksi reduksi-oksidasi secara elektrokimia (redoks). Dalam kasus sistem isi ulang, baterai diisi kembali oleh proses kebalikannya. Jenis reaksi melibatkan transfer elektron dari satu material ke yang lain melalui sebuah sirkuit listrik. Dalam reaksi redoks non elektrokimia, seperti berkarat atau terbakar, transfer elektron terjadi secara langsung dan hanya menghasilkan panas. Sebagai baterai elektrokimia mengubah energi kimia menjadi energi listrik, tidak seperti mesin pembakaran ataupun mesin panas yang mempunyai dalam batasan siklus Carnot yang ditentukan oleh hukum kedua termodinamika. Baterai mampu memiliki efisiensi konversi energi yang lebih tinggi. Sedangkan istilah baterai sering digunakan untuk unit elektrokimia dasar yang disebut sel. Sebuah baterai terdiri dari satu atau lebih sel-sel ini, dihubungkan secara seri atau parallel atau keduanya, tergantung pada tegangan output dan kapasitas yang diinginkan. Sel terdiri dari tiga komponen utama: http://digilib.mercubuana.ac.id/ 5 1. Anoda atau elektroda negatif yang memberikan elektron ke sirkuit eksternal dan teroksidasi selama reaksi elektrokimia. 2. Katoda atau elektroda positif yang menerima elektron dari sirkuit eksternal dan berkurang selama reaksi elektrokimia 3. Elektrolit merupakan ionik konduktor yang berfungsi sebagai media untuk transfer energi sebagai ion di dalam sel antara anoda dan katoda. Elektrolit biasanya berbentuk cair seperti air atau pelarut lainnya. seperti garam terlarut, asam, atau basa untuk meberikan konduktivitas ionik. Walaupun ada beberapa baterai yang menggunakan elektrolit padat. Kombinasi yang paling tepat dari material anoda dan katoda akan menghasilkan bobot paling ringan dan memberikan tegangan dan kapasitansi listrik yang tinggi. Kombinasi ini tidak selalu praktis, Didasarkan pada komponen dengan sel lainnya, polarisasi, kesulitan dalam reaktivitas penanganan, biaya pembuatan yang tinggi, dan kekurangan lainnya (Linden & Reddy,2011) Kinerja baterai melibatkan transfer elektron melalui suatu media yang bersifat konduktif dari elektroda negatif (anoda) ke elektroda positif (katoda) sehingga menghasilkan arus listrik dan beda potensial. Bahan dan luas permukaan elektroda mampu mempengaruhi jumlah beda potensial yang dihasilkan. Setiap bahan elektroda memiliki tingkat potensial elektroda yang berbeda-beda. Jika luas permukaan elektroda diperbesar maka akan semakin banyak elektron yang dapat dioksidasi dibandingkan dengan elektroda dengan luas permukaan yang kecil (Kartawidjaja dan Abdurrochman, 2008). Sebuah gambar sederhana dari proses elektroda ditunjukkan pada Gambar 2.1. dimulai dengan rangkaian terbuka, logam A dicelupkan dalam larutan,hingga sebagian logam berada didalam larutan . Elektron tetap pada elektroda sampai karakteristik kerapatan elektron dibangun. Untuk logam B, yang lebih mulia dari A proses yang berlangsung sama, tetapi jumlah kerapatan elektron yang dihasilkan lebih rendah. http://digilib.mercubuana.ac.id/ 6 Gambar 2.1 Skematik sistem sel baterai. (Sumber: pinkwart & tubke 2011) Jika dua elektroda yang terhubung dengan konduktor listrik, elektron mulai mengalir dari elektroda negatif dengan kerapatan elektron yang lebih tinggi ke elektroda positif. Sistem elektroda / elektrolit mencoba untuk menjaga kerapatan elektron agar tetap konstan. Sebagai konsekuensi tambahan elektroda negatif pada logam A membentuk ion A+ dalam larutan dan elektron e-, yang terletak di permukaan logam A (pinkwart dkk,2011). Reaksi pada anoda : A →A+ + e- Pada elektroda positif arus listrik yang dihasilkan meningkatkan kerapatan elektron . Sistem elektroda B / elektrolit mengkompensasi proses ini dengan mengkonsumsi elektron B + ions untuk pengendapan (pinkwart dkk,2011). Reaksi pada katoda : B++ e-→ B Keseluruhan reaksi : A(s) + B(s) A+ + B- + energi Secara umum, baterai dapat diklasifikasikan menjadi dua jenis yaitu baterai primer dan dan baterai sekunder. Baterai primer merupakan baterai yang pemakaian hanya satu kali saja, karena baterai jenis ini tidak dapat diisi daya kembali. Sementara baterai sekunder adalah baterai yang dapat dipergunakan beberapa kali, karena baterai jenis ini dapat diisi daya kembali jika daya dari baterai sudah menurun atau habis (Berndt dkk, 2003). http://digilib.mercubuana.ac.id/ 7 2.3 BATERAI PRIMER Baterai jenis ini adalah sulit dan tidak efektif dipergunakan kembali walaupun telah diisi daya kembali. Hal ini dikarenakan elektrolit yang digunakan terkandung pada suatu bahan penyerap ataupun matriks pemisah dan tidak menggunakan elektrolit cair. Sehingga pergerakan ion tidak akan bebas dan cenderung menjadi searah. Baterai jenis ini sering juga disebut sebagai baterai kering. Baterai primer mempunyai kelebihan diantaranya tidak mahal dan ringan sehingga sesuai dipaketkan dengan berbagai jenis peralatan elektronik bergerak seperti kamera digital, tablet, laptop, telepon selular, lampu penerangan meja dan banyak aplikasi lainnya. Kelebihan lain dari baterai primer adalah mempunyai waktu hayat yang panjang, energi densitas yang besar, sedikit perawatan dan mudah dipergunakan. Baterai primer dengan kapasitas energi yang besar biasanya dipergunakan untuk aplikasi militer, radar, dan UPS. Baterai primer sering dijumpai dalam bentuk sel tunggal seperti baterai silinder, baterai berbentuk kancing, ataupun dalam bentuk multisel yaitu baterai tunggal yang disusun dalam satu paket baterai. Baterai logam udara termasuk dalam baterai primer (Linden & Reddy, 2011). Macam – Macam Baterai Primer: 1. Baterai zinc-Carbon.The Leclanche' atau baterai karbon seng (dry cell) telah ada selama lebih dari 100 tahun dan telah menjadi yang paling banyak digunakan dari semua baterai sel kering karena biayanya yang rendah, kinerja yang relatif baik, dan ketersediaannya. Sel dan baterai dari berbagai ukuran dan karakteristik telah diproduksi untuk memenuhi persyaratan dari berbagai macam aplikasi. perbaikan yang signifikan dalam kapasitas dan umur simpan untuk system baterai ini dibuat pada periode antara tahun 1945 dan 1965 melalui penggunaan material baru (seperti beneficiated mangan dioksida dan seng klorida elektrolit) dan desain sel (seperti sel kertas berlapis). Biaya yang rendah pada baterai Leclanche' menjadi daya tarik utama, walaupun saat ini telah kehilangan pangsa pasar yang cukup besar, kecuali di negara-negara berkembang, karena baterai primer yang lebih baru dengan karakteristik kinerja yang unggul. 2. Zinc / Merkuri Oxide Battery.Baterai oksida seng / merkuri ini dikembangkan selama Perang Dunia II untuk aplikasi komunikasi militer karena masa pakai http://digilib.mercubuana.ac.id/ 8 yang baik dan kepadatan energi volumetrik yang tinggi. Pada periode pasca perang, desain baterai yagn digunakan berbentuk tombol kecil / kancing, datar, atau silinder yang dikonfigurasikan sebagai sumber listrik di jam tangan elektronik, kalkulator, alat bantu dengar, peralatan fotografi, dan aplikasi serupa yang membutuhkan masa pakai panjang dengan sumber daya yang rendah. Dalam dekade terakhir, penggunaan baterai oksida merkuri telah berakhir terutama karena masalah lingkungan yang terkait dengan merkuri dan dengan penggantian dengan sistem baterai lainnya, seperti baterai zinc / udara dan lithium, yang memiliki kinerja yang lebih unggul untuk banyak aplikasi. 3. Kadmium / Merkuri Oksida Baterai. Substitusi kadmium untuk anoda seng (sel oksida merkuri kadmium) menghasilkan tegangan yang lebih rendah tetapi sistem sangat stabil, dengan masa pakai hingga 10 tahun serta kinerja pada suhu tinggi dan rendah. Karena tegangan rendah, kapasitas watthour baterai ini adalah sekitar 60% dari kapasitas baterai seng / merkuri oksida. Sekali lagi, karena karakteristik berbahaya merkuri dan cadmium, penggunaan baterai ini dibatasi. 4. Zinc / Perak Oksida Baterai. Baterai seng / perak oksida memiliki desain yang serupa dengan baterai tombol seng / merkuri oksida , tetapi memiliki kepadatan energi yang lebih tinggi (berdasarkan berat) dan performa yang lebih baik pada suhu rendah. Karakteristik ini membuat sistem baterai ini cocok untuk digunakan dalam alat bantu dengar, aplikasi fotografi, dan jam tangan elektronik. Namun, karena biaya tinggi dan banyaknya pengembangan pada sistem baterai lainnya, penggunaan sistem baterai ini, sebagai baterai primer, telah terbatas terutama untuk aplikasi baterai. 5. Zinc / Air battery. Sistem baterai seng/udara terkenal karena kepadatan energi yang tinggi, tetapi hanya baterai berdaya rendah yang sebagian besar telah digunakan untuk sinyal dan aplikasi bantuan navigasi. Dengan perkembangan elektroda udara yang membaik, baterai ini sekarang digunakan secara luas dalam alat bantu dengar elektronik, dan aplikasi yang serupa. karena kepadatan energi yang tinggi, baterai seng / udara dan baterai logam / udara lainnya kini http://digilib.mercubuana.ac.id/ 9 sedang dikebangkan dengan serius untuk sejumlah aplikasi dari konsumen elektronik portabel dan akhirnya untuk perangkat yang lebih besar seperti kendaraan listrik, mungkin dalam cadangan atau konfigurasi isi ulang secara mekanis. 6. Baterai magnesium. Ketertarikan untuk komersialisasi baterai magnesium relative sedikit karena adanya generasi gas hydrogen selama proses discharge dan kemampuan penyimpanannya yang relative buruk. Sel kering magnesium telah suskses digunakan pada peralatan komunikasi militer. Mengambil keuntungan dari masa pakai yang lama pada kondisi undischarge, bahkan pada temperature yang tinggi. Magnesium masih digunakan sebagai material anoda untuk beberapa tipe batrai logam udara. 7. Baterai lithium. Perkembangan baterai litium relatif baru (sejak tahun 1970). Mereka memiliki keuntungan dari kepadatan energi tertinggi, serta operasi pada rentang suhu yang sangat luas dan masa pakai yang panjang, dan secara bertahap menggantikan sistem baterai konvensional. Namun, kecuali untuk kamera, jam tangan, cadangan memori, militer dan aplikasi niche lainnya, mereka belum mendapatkan pangsa pasar utama karena biaya yang tinggi dan kekhawatiran dengan keselamatan. Seperti dengan sistem seng, ada sejumlah baterai lithium yang masih dalam pengembangan, mulai kapasitas kurang dari 5 mAh sampai 10.000 Ah, menggunakan berbagai desain dan bahan kimia tetapi memiliki kesamaan penggunaan logam lithium sebagai anoda. 8. Baterai Elektrolit padat. Baterai elektrolit padat berbeda dari sistem baterai lain karena ketergantungannya pada konduktivitas ionik. Baterai yang menggunakan elektrolit padat mempunyai daya perangkat yang lemah (mikrowat), tetapi memiliki masa pakai yang sangat panjang dan kemampuan operasi pada rentang temperatur yang luas, terutama pada suhu tinggi. Baterai ini digunakan dalam peralatan elektronik medis, untuk sirkuit memori, dan untuk aplikasi lain yang membutuhkan masa pakai lama dan daya baterai yang rendah. Baterai solid-elektrolit pertama menggunakan anoda perak dan perak iodida untuk elektrolit, tapi lithium sekarang digunakan sebagai anoda untuk http://digilib.mercubuana.ac.id/ 10 sebagian besar baterai ini, karena menawarkan tegangan dan kepadatan energy yang lebih tinggi. Baterai karbon seng sampai saat ini menjadi baterai primer yang paling mudah untuk ditemui dan paling banyak digunakan karena harganya yang relatif murah. Banyaknya perangkat elektronik seperti senter, mainan anak-anak serta beberapa perangkat portable lainnya membuat penggunaan baterai karbon seng tidak dapat dipisahkan dalam kehidupan sehari – hari. Baterai karbon seng yang merupakan baterai primer dimana pada saat daya listrik yang dihasilkan sudah habis tidak dapat di isi ulang membuat baterai ini berakhir ditempat sampah setelah daya yang dihasilkan sudah habis yang justru menimbulkan masalah baru pada lingkungan. Secara umum baterai karbon seng menggunakan logam seng sebagai anoda, ammonium klorida, seng klorida ataupun campuran keduanya sebagai elektrolit dan mangan dioksida sebagai katoda. Dimana mangan dioksida dan elektrolit dilarutkan bersama sama dan ditambahkan karbon (acetylene black) untuk meningkatkan konduktivitas dan mempertahankan kelembabannya. Pada logam seng terjadi oksidasi dan pada mangan dioksida terjadi reduksi. Gambar 2.2 Skematik baterai karbon seng (Sumber: Schumm,2011) 2.4 BATERAI SEKUNDER Baterai ini dapat diisi daya kembali setelah daya dari baterai habis ataupun menurun kembali pada kapasitas awal dari baterai. Pergerakan ion dan elektron ketika diisi daya kembali adalah berwalanan dengan pergerakan ion dan elektron ketika dalam waktu penggunaan. Pergerakan ion dan elektron ketika penggunaan biasanya disebut http://digilib.mercubuana.ac.id/ 11 discas. Dengan demikian, baterai sekunder dapat berfungsi sebagai peralatan elektronik penyimpan energi. Aplikasi dari baterai sekunder ini secara garis besar dapat dibagi menjadi dua, yaitu: 1. Sebagai energi cadangan utama untuk peralatan elektronik, sistem otomotif, serta pesawat terbang. Sehingga ketika sistem energi utama tidak bekerja, maka baterai sekunder akan memainkan peranannya. Contohnya adalah pada mobil hibrid. Dimana sebelum digunakan, baterai sekunder akan diisi daya oleh sistem energi utama. 2. Sebagai energi utama untuk peralatan elektronik, seperti laptop, telepon selular sampai dayanya menurun. Biasanya dayanya cepat turun, namun dapat diisi daya kembali, sehingga dapat digunakan kembali. Hal ini menjadikan baterai sekunder memiliki kelebihan dibandingkan baterai primer. Baterai sekunder mempunyai ciri seperti densitas yang tinggi, laju discas yang cepat, mempunyai kurva discas yang flat dan kebanyakan kasus adalah mempunyai kinerja yang baik pada temperatur yang rendah. Secara umum, densitas energi dari baterai sekunder lebih rendah dari baterai primer (Linden & Reddy, 2011). Walaupun begitu, baterai logam udara ini ada peneliti yang mengklasifikasikan baterai logam udara sebagai baterai sekunder, karena beberapa baterai logam udara dapat diisi daya kembali (Vincenzo dkk, 2014) 2.5 BATERAI LOGAM UDARA Adanya keterbatasan densitas energi dari baterai lithium saat ini diakibatkan oleh terjadinya interkalasi kimia pada bahan elektroda baterai, yang menyebabkan baterai terlihat menjadi kurang praktikal untuk aplikasi kendaraan listrik. Keadaan ini menjadikan baterai logam udara menjadi menarik perhatian untuk diteliti lebih lanjut sebagai alternatif. Hal ini dikarenakan baterai logam udara secara ekstrim mempunyai densitas energi yang lebih tinggi berbanding baterai lainnya. Yang menjadi catatan dari ciri utama yang membedakan antara baterai logam udara dengan baterai konvensional lainnya adalah struktur selnya yang berbeda. Baterai logam udara mempunyai struktur yang terbuka dan baterai ini menggunakan gas oksigen dari udara untuk masuk ke dalam sistem baterai melalui katoda. http://digilib.mercubuana.ac.id/ 12 Sementara itu, struktur sel pada baterai konvensional adalah tertutup. Pengklasifikasian dari baterai logam udara ini biasanya didasarkan pada jenis-jenis logam yang digunakan sebagai anoda. Sementara itu mekanisme yang terjadi di dalam sistem baterai logam udara juga bervariasi, bergantung kepada jenis komponen dari sel baterai tersebut. Berdasarkan pedekatan sistem elektrolitnya, baterai logam udara dapat dikelompokan menjadi dua, yaitu elektrolit akues dan elektrolit dengan pelarut aprotik. Sistem sel yang berbasiskan elektrolit akues merupakan sistem yang tidak sensitif dengan kelembaban. Ini berbeda dengan sistem berbasiskan elektrolit dengan pelarut aprotik yang dapat terdegradasi oleh kelembaban (Jang dkk, 2011). Diantara baterai logam udara, bahan logam yang biasa dipergunakan sebagai anoda pada sistem akues diantaranya adalah logam Ca, Al, Fe, Cd dan Zn. Baterai aluminium udara mempunyai densitas energi yang lebih besar dibandingkan dengan baterai seng udara (Vincenzo dkk, 2014). Walaupun begitu, logam aluminium lebih mudah mengalami korosi berbanding logam seng di dalam larutan alkali. Sehingga diperlu dilakukan penelitian lebih lanjut untuk mengatasi permasalahan korosi pada logam aluminium yang terjadi di dalam sistem baterai logam udara (Gelman dkk 2014). 2.5.1 Komponen Baterai Logam Udara Secara umum, baterai logam udara mempunyai tiga komponen utama, pertama yaitu anoda yang berupa bahan logam. Kedua adalah elektrolit, dimana elektrolit yang paling umum adalah KOH. Sementara yang ketiga adalah katoda yang berupa karbon berpori (Vincenzo dkk, 2014), Walaupun begitu, pada beberapa jenis baterai logam udara ada yang menambahkan suatu komponen tambahan yaitu bahan pemisah di dalam sistem baterai logam udara tersebut (Jang dkk, 2011). A. Anoda Anoda merupakan salah satu komponen yang penting di dalam baterai logam udara. Baterai logam udara sebagaimana yang telah dijelaskan sebelumnya, pengklasifikasiannya didasarkan pada jenis logam yang digunakan (Jang dkk, 2011). Secara teoritis, nilai tegangan (voltage) yang dihasilkan oleh masing-masing jenis baterai logam udara ini akan berbeda mengikut jenis logam yang digunakan sebagai http://digilib.mercubuana.ac.id/ 13 anoda. Perbedaan ini di dasarkan kepada nilai energi potensial standar masing-masing logam. Tabel 2.2 berikut memperlihatkan densitas energi untuk beberapa jenis logam baterai udara (Vincenzo dkk, 2014). Tabel 2.1 Karakteristik baterai logam udara. Ekivalen Anoda Elektrokimia Logam (Ah/g) Energi Voltase Muatan spesifik Teori Teoritikal (V) Valensi (Logam) kWh/kg Voltase Operasi Praktikal (V) Li 3,86 3,4 1 13,0 2,4 Ca 1,34 3,4 2 4,6 2,0 Mg 2,20 3,1 2 6,8 1,2 - 1,4 Al 2,98 2,7 3 8,1 1,1 - 1,4 Zn 0,82 1,6 2 1,3 1,0 - 1,2 Fe 0,96 1,3 2 1,2 1,0 Logam alumunium bertindak sebagai anoda pada baterai ini, sehingga baterai ini dinamakan sebagai baterai alumunium udara. Logam aluminium pada sistem baterai ini akan mengalami reaksi pengoksidaan dengan menghasilkan ion Al3+ dan elektron. Ion Al3+ ini akan bermigrasi ke dalam elektrolit dengan tujuan untuk melengkapi reaksi elektrokimia yang berlangsung di dalam sistem baterai alumunium udara. Sementara itu, elektron akan bergerak menuju katoda melalui rangkaian sirkuit eksternal dan selanjutnya bereaksi dengan oksigen dari udara. Pergerakan elektron menuju katoda akan menghasilkan energi listrik. Reaksi keselurahan dari baterai alumunium udara ini adalah (Modesto dkk, 2007 dan Mohamad, 2008): Anoda: Al(s) + 3OH−(aq) → Al(OH)3(s) + 3e− Eo = -2,35 V Katoda: O2(g) + 2H2O(l) + 4e− → 4OH−(aq) Eo = +0,40 V Keseluruhan: 4Al(s) + 3O2(g) + 6H2O(l) → 4Al(OH)3(s) http://digilib.mercubuana.ac.id/ Eo = 2,75 V 14 B. Elektrolit Elektrolit merupakan komponen yang berfungsi sebagai jembatan garam dalam sistem sel galvanis atau baterai. Tujuan dari elektrolit ini adalah sebagai mediator untuk terjadinya perpindahan ion di dalam sistem baterai, sehingga reaksi elektrokimia dapat berlangsung. Jenis elektrolit yang digunakan akan mempengaruhi densitas energi, konduktivitas, waktu hayat, kapasitas energi. Dengan demikian, pemilihan elektrolit yang sesuai menjadi sangat penting (Joseph Wang, 2006). Elektrolit adalah zat yang jika dilarutkan dalam air menghasilkan larutan yang dapat menghantarkan arus listrik (Chang, 1998). Elektrolit yang digunakan dalam sel mempunyai persyaratan yaitu, mempunyai konduktivitas yang baik dan tidak bereaksi dengan komponen lain dalam baterai. Elektrolit merupakan bagian penting dalam sel elektrokimia baik dalam pengoperasiannya maupun dalam sistem kelengkapannya. Selain itu elektrolit harus dapat menghantarkan elektron dan menghasilkan elektron untuk menjalankan sel elektrokimia (Jouannea, 2002). Elektrolit terbagi menjadi dua yaitu elektrolit padat dan elektrolit cair. Elektrolit padat menunjukkan kestabilan pada suhu tinggi dan memiliki resistansi listrik yang baik. Namun elektrolit padat memiliki beberapa kelemahan diantaranya aliran arus rendah, kemampuannya menurun pada temperatur rendah dan sangat rentan terhadap hubungan singkat yang dapat menyebabkan hilangnya energi. Sedangkan elektrolit cair dapat menembus celah-celah atau pori-pori dari bahan elektroda, baik anoda maupun katoda. Karena elektrolit berupa larutan, maka elektrolit sangat mudah mencapai permukaan serbuk elektroda. Untuk penerapan elektrolit padat persyaratan yang harus dipenuhi adalah adanya pertemuan permukaan serbuk elektroda dengan elektrolit. Oleh karena itu komponen elektroda dibuat dengan komposisi yang mengandung bahan elektrolit atau garam lithium, sehingga reaksi redoks dapat berlangsung tepat di permukaan serbuk elektroda (Prihandoko, 2008). Di dalam sistem baterai aluminium udara, ada dua isu utama yang sangat menonjol dan dapat mempengaruhi performa dari baterai aluminium udara. Isu yang pertama adalah bahwa logam aluminium sangat mudah mengalami korosi pada kondisi potensial sirkuit terbuka (open-circuit potential) dan ketika mengalami discas yang disebabkan oleh reaksi yang terjadi diantara air dan anoda. Isu kedua adalah http://digilib.mercubuana.ac.id/ 15 terbentuknya lapisan hidroksida yang pasif pada permukaan aluminium, sehingga menghambat pelarutan logam aluminium dan menyebabkan berubahnya energi potensial dari logam aluminium (Egan dkk, 2013), disamping itu masalah lain yang timbul adalah dihasilkannya gas H2 yang dihasilkan melalui reaksi antara logam dengan elektrolit, sehingga akan membuat sistem dari baterai pecah (Vincenzo dkk, 2014). Secara garis umum, sistem elektrolit di dalam baterai logam udara ini terbagi dalam dua, yaitu, sistem akues dan non akues. Sistem akues merupakan sistem elektrolit yang berbasiskan kepada air sebagai pelarut dari elektrolit dalam baterai logam udara (Richard dkk, 2002), Sementara sistem non-akues menggunakan pelarut organik/aprotik ataupun cairan ionik sebagai elektrolit (Lorenzo dkk, 2014). Penggunaan cairan ionik ini didasarkan kepada sifat logam yang mudah teroksidasi oleh air ataupun larutan alkali (Gelman dkk, 2014). Namun, menurut laporan yang dinyatakan oleh Jang dkk pada tahun 2011, selain sistem akues dan non-akues, sistem elektrolit baterai logam udara dapat ditambah lagi sistem hibrid dan elektrolit padatan. Tujuan penggunaan dari sistem elektrolit hibrid dan elektrolit padatan adalah pada dasarnya adalah sama dengan sisten non-akues, yaitu mengurangi kontak langsung antara logam anoda baterai dengan air. Pada sistem hibrid, larutan elektrolit yang digunakan terdiri kombinasi dua jenis elektrolit, yaitu non-akues dan akues. Cairan ionik atau juga pelarut aprotik diletakkan di atas permukaan anoda. Ini dilakukan untuk mencegah terjadinya kontak langsung antara air dengan logam anoda. Sementara larutan elektrolit akues diletakkan pada posisi bersentuhan dengan katoda dan diantara cairan ionik dan larutan akues diletakan suatu matriks pembatas yang berupa membran semi permeabel ataupun keramik berpori. Pada sistem elektrolit secara umum, struktur sel baterai logam udara mirip dengan akues ataupun non akues, dimana elektrolitnya diganti dengan padatan. Biasanya merupakan keramik atau membran gelas yang terdop dengan suatu doping. Biasanya doping yang digunakan mengandung ion yang sejenis dengan jenis logam anoda yang digunakan. Bentuk struktur dari baterai logam udara dengan elektrolit padatan. Seperti yang dijelaskan sebelumnya, bahwa tantangan dalam pembangunan baterai logam udara adalah munculnya masalah korosi dari logam anoda, terbentuknya http://digilib.mercubuana.ac.id/ 16 lapisan oksida dari penghasilan gas H2. Ketiga masalah ini terkait penggunaan elektrolit berbasiskan kepada akues dan sifat alamiah dari kebanyakan logam yang bereaksi dengan air, asam ataupun alkali (Vincenzo dkk, 2014). Salah satu cara yang dikembangkan untuk mengatasi hal tersebut adalah dengan mengunakan membran polimer hidrogel (Marliyana dkk, 2015). Membran polimer hidrogel mempunyai kemampuan untuk mengikat air dengan cukup baik serta mempunyai permebialitas yang tinggi, sehingga proses migrasi ion tetap terjaga. Hal ini akan membuat konduktivitas dari baterai tetap tinggi. Ini menjadikan membran polimer hidrogel menjadi salah satu cara yang pontensial untuk menghambat proses pengkorosian pada permukaan anoda baterai logam udara (Othman dkk, 2001 dan Mohamad, 2008). C. Katoda Udara Katoda udara sangat penting untuk baterai aluminium-udara,katoda udara terdiri dari lapisan difusi gas,kolektor arus dan katalis reaksi reduksi oksigen oxygen reduction reaction catalysts (ORRC). Di antara mereka, ORRC adalah salah satu faktor yang paling penting yang menentukan ORR kinetika. Sejauh ini, berbagai variasi ORR termasuk logam mulia dan paduan mereka, bahan karbon, oksida logam transisi dan komposit anorganik-organik telah dikembangkan untuk baterai aluminium-air. Oksida mangan (MnOx) dianggap sebagai salah satu kandidat yang paling mungkin karena mereka biaya rendah serta jenis aktivitas katalitik yang tinggi. (Sun dkk, 2016) Arsitektur performa elektrokimia dari katoda pada baterai logam udara adalah mirip dengan sel bahan bakar, karena mekanisme reaksi yang terjadi pada sel bahan bakar mirip dengan mekanisme yang terjadi dengan baterai logam udara. Pada kasus sel bahan bakar hidrogen, proton H+ bergerak melalui elektrolit untuk bereaksi dengan ion oksida pada katalis untuk membentuk air (Jang dkk 2011). Sementara pada kasus baterai logam udara, ion logam dari anoda bergerak melalui elektrolit dan bereaksi dengan ion O22- atau O2- yang diperoleh dari reaksi reduksi O2 oleh katalis pada permukaan katoda udara untuk membentuk suatu endapan oksida dari ion logam anoda. O2 yang terlibat dalam sistem baterai logam udara berasal dari udara yang masuk melalui pori-pori karbon pada yang terdapat pada katoda (Yugang, 2013). Keberadaan endapan oksida logam dari ion logam anoda yang berlebihan akan membawa masalah baru kepada sistem baterai logam udara. Endapan oksida ini dapat http://digilib.mercubuana.ac.id/ 17 menutupi pori-pori dari karbon pada katoda, sehingga oksigen dari udara tidak dapat masuk kedalam sistem baterai logam udara. Kondisi ini akan menyebabkan turunnya densitas energi baterai logam udara, karena reaksi elektrokimia dalam sistem baterai terhambat. Ini menunjukkan bahwa mikrostruktur dari karbon akan memberikan efek pada performa dari baterai logam udara. Ukuran partikel karbon yang terlalu kecil kurang sesuai digunakan sebagai matriks pembuatan katoda udara. Hal ini karena, dengan ukuran partikel karbon yang kecil, maka ketika terjadi penyusunan partikelpartikel karbonya akan membentuk pori-pori yang lebih kecil dan rapat. Kondisi ini menyebabkan kemampuan oksigen untuk masuk ke dalam sistem baterai logam udara melalui katoda akan turun. Idealnya ukuran partikel karbon adalah sekitar 30 nm (Jang dkk, 2011). Sementara jika partikel karbon terlalu besar, memang akan membentuk pori-pori yang lebih besar, yang secara teoritis akan memudahkan masuknya oksigen kedalam sistem baterai logam udara. Namun pada aplikasinya, terutama untuk baterai logam udara dengan sistem akues, justru akan menyebabkan densitas energi baterai menurun. Fenomena ini terjadi karena, dengan semakin banyaknya oksigen yang masuk ke dalam sistem baterai logam udara, maka kecepatan reaksi elektrokimia yang terjadi juga semakin cepat, sehingga proses pembentukan endapan dan korosi pada permukan anoda akan berlangsung cepat (Zheng dkk, 2008). Katoda dalam sistem baterai logam udara termasuk baterai alumunium udara terdiri dari tiga komponen utama, yaitu karbon berpori, katalis serta polimer pengikat. 1) Karbon Aktif Karbon aktif atau sering disebut juga arang aktif, adalah arang yang dimurnikan yaitu konfigurasi atom karbonnya dibebaskan dari ikatan dengan unsur lain serta poriporinya dibersihkan dari unsur lain atau kotoran, sehingga permukaan karbon atau pusat aktif menjadi bersih dan lebih luas. Keluasan pusat aktif ini menentukan efektifitas kegunaannya sebagai adsorben (penyerap) cairan maupun gas. Sesuai kegunaannya sebagai adsorben, maka arang aktif didalam perdagangannya diklasifikasikan sebagai bahan kimia. Proses aktivasi merupakan suatu perlakuan terhadap arang yang bertujuan untuk memperbesar pori yaitu dengan cara memecahkan ikatan hidrokarbon atau mengoksidasi molekul-molekul permukaan sehingga arang mengalami perubahan http://digilib.mercubuana.ac.id/ 18 sifat, baik fisika maupun kimia, yaitu luas permukaannya bertambah besar dan berpengaruh terhadap daya adsorbsi. Pada umumnya karbon aktif dapat di aktivasi dengan dua cara, yaitu dengan cara aktivasi kimia dengan hidroksida logam alkali, garam-garam karbonat, klorida, sulfat, fosfat dari logam alkali tanah dan khususnya ZnCl2, CaCl2, asam-asam anorganik seperti H2SO4 dan H3PO4 dan aktifasi fisika yang merupakan proses pemutusan rantai karbon dari senyawa organik dengan bantuan panas pada suhu 800 °C hingga 900 °C (S.C. KIM, I.K. 1996). Proses aktivasi merupakan hal yang penting diperhatikan disamping bahan baku yang digunakan. Yang dimaksud dengan aktivasi adalah suatu perlakuan terhadap arang yang bertujuan untuk memperbesar pori yaitu dengan cara memecahkan ikatan hidrokarbon atau mengoksidasi molekul- molekul permukaan sehingga arang mengalami perubahan sifat, baik fisika maupun kimia, yaitu luas permukaannya bertambah besar dan berpengaruh terhadap daya adsorbsi (Ajayi dan Olawale, 2009). Berdasarkan pori-porinya, karbon aktif dapat dibedakan menjadi tiga jenis, yaitu (Sukir, 2008): 1. Makropori Merupakan bagian paling luar dari karbon aktif, dengan jari-jari lebih besar dari 50 nm dengan volume pori-pori 0,2-0,5 cm3/gram dan luas permukaan 0,2-2 m2/gram. Makropori dan mesopori memberikan kapasitas adsorbsi karbon aktif dan kegunaanya terbentuk selama aktivasi. 2. Mesopori Memiliki jari-jari 2-50 nm dengan volume pori-pori mencapai 0,02-0,01 cm3/gram dengan luas permukaan 1-100 m2/gram. Mesopori merupakan cabang setelah makropori dan berfungsi sebagai sarana transportasi. 3. Mikropori Merupakan pori-pori terkecil dengan jari-jari kurang dari 2 nm dengan volume pori 0,15-0,5 cm3/gram dan luas permukaan mencapai 100-1000 m2/gram. Keunggulan arang aktif adalah kapasitas dan daya serapnya yang besar, karena struktur pori dan keberadaan gugus fungsional kimiawi di permukaan arang aktif seperti C=O, C2-, dan C2H-. Kualitas arang aktif ditunjukkan dengan nilai daya serap Iod di mana berdasarkan ketetapan dari SNI 06-3730-1995 arang aktif dinilai http://digilib.mercubuana.ac.id/ 19 berkualitas bilamana nilai daya serap Iodnya mendekati 750 mg/g, Misalnya arang dari tempurung kelapa dan tongkol jagung sebelum diaktifasi daya serap iodinnya masing-masing adalah 276 dan 452 mg/g, namun setelah diaktivasi meningkat menjadi 672 dan 647 mg/g mendekati nilai persyaratan kualitas arang aktif (Harsanti dkk, 2010). 2) Katalis Komponen lain yang terdapat di dalam katoda baterai logam udara adalah katalis yang dicampur bersama dengan partikel karbon. Fungsi dari katalis ini adalah mereduksi gas O2 dari udara menjadi O22- atau O2- (Yugang, 2013). Beberapa jenis katalis yang digunakan diantaranya adalah Pt, La0.8Sr 0.2, MnO3, Fe2O3, NiO, Fe3O4, Co3O4, CuO dan CoFe2O4 dengan ukuran partikel 1-5 μm. Sementara itu katalis dengan ukuran nanostruktur yang telah dilaporkan oleh peneliti sebelum ini diantaranya adalah dari kelompok mangan oksida seperti α-MnO2, β-MnO2, λ-MnO2, Mn2O3 and Mn3O4. Reaksi katalitik yang terjadi pada oksigen adalah reaksi reduksi oksigen (oxygen reduction reaction, ORR) dan reaksi evolusi oksigen (oxygen evolution reaction,OER) (Jang dkk, 2011). Logam mulia seperti platinum telah menjadi katalis yang paling sering digunakan untuk elektroda udara tetapi biaya yang mahal dan kelangkaan membatasi pengaplikasian yang luas dalam teknologi energi bersih. Pencarian biaya yang rendah dalam penggunaan katalis dengan aktivitas katalitik yang cukup mendorong minat peneliti pada oksida logam transisi sebagai alternatif pengganti logam mulia. Di antara mereka, oksida mangan menunjukkan performa elektrokatalitik yang menjanjikan untuk OER dan ORR pada kondisi basa dan memiliki banyak keunggulan seperti kelimpahan dalam bijih alami,toksisitas rendah, biaya rendah dan ramah lingkungan. (Mainar dkk 2016). Saat ini diketahui perak menunjukkan aktivitas katalitik yang jauh lebih tinggi untuk ORR dalam larutan alkali dari pada oksida mangan. Katalis komposit AgMnOx secara ekstensif telah diselidiki dan menunjukkan aktivitas katalitik ORR yang sangat baik karena "efek sinergis". (Sun, dkk 2016) http://digilib.mercubuana.ac.id/ 20 3) Matriks Pengikat ( Binder ) Binder atau pengikat adalah materi atau substansi yang memegang atau menarik bahan lain bersama-sama untuk membentuk suatu kesatuan yang utuh secara mekanis dan kimia, dengan adhesi atau kohesi. Dalam arti yang lebih sempit, pengikat adalah zat cair atau adonan yang mengeras oleh proses kimia atau fisika. Contohnya termasuk lem, perekat dan penebalan. Peran utama pengikat adalah untuk mendukung daya kohesif dari ikatan partikel-partikel padat. Salah satu jenis pengikat yang dapat dipergunakan adalah Arabic gum. Arabic Gum / gum arab juga dikenal sebagai gum akasia, Chaar gund, char goond, atau meska, adalah karet alami yang terbuat dari getah mengeras dari berbagai jenis pohon akasia. Gum arab dapat diaplikasikan sebagai pengikat bahan pangan maupun bahan obat. Selain itu gum arab bersifat sebagai emulsifier sehingga bahan yang telah diproses dengan penambahan Arabic Gum akan mudah dilarutkan dalam air maupun minyak. (Arif Rahman & Anies Chamidah, 2013). Gum arab merupakan yang paling kuno dan paling terkenal dari semua jenis gum/karet. Istilah 'Arabic Gum' diciptakan oleh pedagang Eropa yang mengimpor gum ini dari Arab seperti Jeddah dan Alexandria. Di Mesir gum arab disebut sebagai 'Kami' dan diduga digunakan dari dinasti ketiga dan seterusnya (sekitar 2650 SM) untuk mengamankan perban di sekitar mumi. gum ini juga digunakan untuk memperbaiki pigmen ke dalam lukisan hieroglif. Menurut sebuah Peneliti Sudan, kata 'mana' (manna) disebutkan dalam Alquran (QS Al baqarah) sebagai makanan terbaik yang tersedia manusia, yang pada kenyataannya direferensikan langsung ke gum arab. Kata 'mana' tampaknya juga merujuk pada gum arab di Taurat di mana ia digambarkan sebagai makanan penting dan ditunjuk oleh Musa kepada Israel sebagai roti yang diberikan Tuhan. Ada sekitar dengan 900 spesies akasiayang mampu menghasilkan gum. Biasanya terletak di iklim tropis, dengan sekitar 130 dari mereka terletak khusus pada benua Afrika (Eqbal & Aminah, 2013) Gum arab yang terdiri dari polisakarida dan glikoprotein, diterapkan sebagai dual-fungsi pengikat. Pertama, kelompok hidroksil hepolysaccharide pada gum arab sangat penting dalam memastikan binding kuat. Kedua, sama halnya dengan fungsi serat dalam beton, rantai glikoprotein memberikan toleransi mekanik lanjut untuk ekspansi (Min Ling, 2015). http://digilib.mercubuana.ac.id/ 21 Gambar 2.3 Skematik gum arab mengikat partikel karbon Pada gambar diatas menjelaskan skematik dari gum arab untuk mengatasi volume yang bermasalah pada perubahan material baterai. gum arab baterai dengan fungsi ganda bisa menjaga kedua ikatan kimia yang kuat dan properti ulet untuk mentolerir ekspansi selama lithiation proses / delithiatio. (Min Ling, 2015). Gum Acacia (GA) adalah particular yang menarik karena aman digunakan, kelarutan tinggi dalam air dan ukuran molekul yang tinggi. Ini adalah bahan multifraction yang terdiri dari polisakarida bercabang (Gambar 2.4). Pada umumnya mengandung 42% galactosyl, 27% arabinosyl, 15% rhamnosyl, 14,5% glucuronosyl, dan 1,5% 4-O-methyl-glucuronosyl) dan protein-polisakarida yang kompleks sebagai komponen minor. GA terdiri dari tiga fraksi utama; (1) Yang utama adalah polisakarida bercabang (MW = 3 × 105) yang terdiri dari β(1→3) galaktosa backbone dengan cabang terkait dari arabinose dan rhamnose, yang berakhir pada asam glukuronat (ditemukan di alam sebagai magnesium, kalium, dan garam kalsium). (2) Sebuah fraksi yang lebih kecil ( 10 wt% dari total) adalah berat molekul tinggi ( 1 × 106 g/mol) arabinogalactan-protein kompleks (GAGP -Ga glikoprotein) di mana rantai arabinogalactan adalah kovalen terkait dengan rantai protein melalui serin dan kelompok hidroksiprolin. arabinogalactan mengandung 13% (dengan mol) asam glucoronic. (3) Fraksi terkecil ( 1% dari total) memiliki kandungan protein tertinggi (50 wt%) adalah glikoprotein yang berbeda dalam komposisi asam amino dari GAGP kompleks. Bahan ini diperoleh dari pohon Acacia yang tumbuh di daerah yang membentang dari Senegal ke Sudan di Afrika. Namun, komposisinya dapat bervariasi dengan sumbernya, usia pohon, lingkungan tanah dan kondisi iklim. Idris et al melaporkan GA terdiri dari 39-42% galaktosa, 24-27% arabinosa, 12-16% rhamnose, 15-16% asam glukuronat, 1,5-2,6% protein, 0,22-0,39% nitrogen, dan 12,5-16,0% kelembaban. (M. A. Abu-Dalo, 2012). http://digilib.mercubuana.ac.id/ 22 Gambar 2.4 Struktur monosakarida dan molekul GA (Sumber: Dalo,2012) Pada gambar diatas menunjukan Struktur monosakarida (A), Segmen gum arab molekul (B). Polisakarida backbone terdiri dari D-galactopyranose (GALP), dengan cabang-cabang terkait L-Arabofuranose (Araf), L-Rhamnopyranose (RHAP), dan Asam D-Glucuronic (GA). D. Matriks Pemisah Salah satu keuntungan menggunakan sistem akues pada baterai logam udara adalah densitas energi yang diperoleh adalah cukup tinggi. Ini karena proses migrasi ion logam dari anoda menuju katoda melalui media elektrolit akan berlangsung secara lebih baik (Jake dkk, 2012). Namun begitu, penggunaan sistem akues juga mempunyai kerugian seperti logam anoda yang terkorosi akibat reaksi antara elektrolit dengan permukaan anoda baterai logam udara, selain itu juga akan membentuk lapisan logam hidroksida. Hal ini menyebabkan proses migrasi ion logam menuju katoda akan terhambat dan ini menyebabkan densitas energi yang menurun dan masa hidup baterai menjadi singkat (Mohamad, 2008, Gelman dkk, 2014-2015, Vincenzo dkk, 2014). Salah satu cara mengatasi permasalahan tersebut diantaranya dengan meletakkan matriks pemisah. Tujuan dari matriks pemisah adalah untuk menghindari kontak langsung antara anoda dengan elektrolit. Syarat dasar dari matriks pemisah diantaranya adalah mempunyai kestabilan dengan larutan elektrolit, terutama alkali. Selain itu juga bersifat penghantar ion yang tinggi, mempunyai pori-pori yang sesuai dengan ion logam, bersifat inert terhadap reaksi pengoksidaan, stabil sewaktu proses discas dan cas berlangsung (Jang dkk, 2011). Selain itu, matriks pemisah juga haruslah mempunyai koefisien difusi yang rendah terhadap OH- dan spesis gas H2O, http://digilib.mercubuana.ac.id/ 23 O2, CO2, N2 serta gas lainnya yang mungkin eksis berada di udara, mempunyai kestabilan terhadap pelarut organik (Yugang, 2013) serta stabil secara mekanikal ketika proses asembli berjalan (Sheng, 2007). Bahan matriks pemisah yang biasa digunakan diantaranya adalah keramik, polimer, membran gelas, serta komposit polimer keramik. Penambahan matriks pemisah dapat menyebabkan terjadinya peningkatan resistansi dari baterai logam udara, sehingga biasanya ketebalan dari matrik pemisah juga harus cukup tipis (Jake dkk, 2012). Selain itu, bahan pemisah yang digunakan biasanya didoping atau disisipkan suatu garam atau oksida sesuai dengan jenis logam anodanya seperti Al2(WO4)3 yang digunakan oleh Mori pada tahun 2015. Tujuan penambahan doping ini adalah untuk meningkatkan konduktivitas ionik dari matriks separator. Salah satu jenis matriks membran gelas yang berpotensi digunakan sebagai matriks bahan pemisah adalah sol-gel (Jo dkk, 2012). E. Pemisah (Separator) Separator adalah suatu material berpori yang terletak di antara anoda dan katoda berfungsi untuk mencegah agar tidak terjadi hubungan singkat dan kontak antara katoda dan anoda. Separator dapat berupa elektrolit yang berbentuk gel, atau plastik film nano pori (microporous), atau material inert berpori yang diisi dengan elektrolit cair. Sifat listrik separator ini mampu dilewati oleh ion tetapi juga mampu memblokir elektron, jadi bersifat konduktif ionik sekaligus tidak konduktif elektron (Prihandoko dkk, 2011). Beberapa hal yang penting untuk memilih material agar dipilih sebagai separator antara lain material tersebut bersifat insulator, memiliki hambatan listrik yang kecil, kestabilan mekanik (tidak mudah rusak), tidak mudah terdegradasi dengan elektrolit serta memiliki ketebalan lapisan yang seragam atau sama di seluruh permukaan. Struktur pori dan penyerapan elektrolit berpengaruh terhadap konduktivitas ion. Separator dengan porositas yang tinggi dapat menyerap lebih banyak elektrolit liquid. Sehingga besarnya penyerapan elektrolit pembawa muatan ion sangat dibutuhkan (H. Li, 2011). Beberapa material yang dapat digunakan sebagai separator antara lain polyolefins (polyethylene dan polypropylen), PVdF (polyvinylidene fluodire), PTFE, PVC dan poly ethylene oxide (Manjunatha, 2011). http://digilib.mercubuana.ac.id/ 24 2.6 BATERAI ALUMINIUM UDARA Baterai aluminium udara merupakan baterai logam udara yang menggunakan aluminium sebagai anodanya. Seperti baterai logam udara lainnya, baterai aluminium mempunyai 3 komponen utama, yaitu katoda udara sebagai elektroda positif, elektrolit sebagai jembatan garam dan aluminium sebagai anoda. Baterai alumunium adalah suatu alat konversi energi elektrokimia yang mengubah reaksi kimia pada aluminium sebagai anoda dan udara sebagai katoda dan menghasilkan energi listrik dari aliran elektron anoda ke katoda. Baterai alumunium udara merupakan energi ramah lingkungan karena tidak menggunakan bahan bakar fosil dalam penghasilan energi listrik. Pengembangan teknologi baterai alumunium udara dengan menggunakan alumunium berongga diharapkan mampu memperbaiki kinerja dari baterai tersebut sehingga dapat digunakan secara optimal pada kehidupan sehari-hari. Elektroda aluminium berongga ini nantinya diproduksi dengan metode stir casting yang ditambahkan zat blowing agent. Dalam perkembangan teknologi baterai alumunium udara terdapat berbagai macam kendala dalam mengoptimalkan kinerja baterai terutama dalam meningkatkan kapasitas baterai dengan menyempurnakan desain dari baterai alumunium, penyempurnaan desain baterai Lithium ion dengan membuat elektroda lithium yang berongga sehingga dapat menurunkan resistansi ohmik. Diperoleh hasil resistansi minimum untuk setiap kombinasi elektrodaelektrolit jika persentase massa porositas berada pada nilai 0.18 hingga 0.2 (Suwandi, 2013). Alumunium dapat juga diaplikasikan dalam bentuk logam saat dipergunakan menjadi anoda baterai dan dapat menghasilkan reaksi kimia sebesar 2980 Ah kg-1. Konsep baterai tradisional yang umumnya tipe single-use (primary). Reaksi elektrokimia berasal dari reaksi redoks, reaksi redoks singkatan dari reaksi reduksi oksidasi, reaksi ini menjelaskan perubahan bilangan oksidasi dari sebuah reaksi kimia (elektrokimia), dalam reaksi redoks, elektron berpindah dari satu substansi ke substansi lainnya. Bahan dari baterai adalah elektroda, elektroda adalah bahan baku sebuah sel pada baterai yang menjadi sumber utama terjadinya energi listrik dikarenakan adanya potensial tegangan dari kedua bahan sehingga terjadi perpindahan elektron. http://digilib.mercubuana.ac.id/ 25 Elektroda harus terbuat dari bahan konduktor agar dapat dialiri listrik. Berbeda dengan arus listrik dalam sistem eksternal, transportasi muatan antara elektroda positif dan elektroda negatif dalam elektrolit dilakukan oleh ion. Umumnya arus dalam elektrolit terdiri dari perpindahan ion positif dan negatif. Elektroda adalah bahan baku sebuah sel pada baterai yang menjadi sumber utama terjadinya energi listrik dikarenakan adanya potensial tegangan dari kedua bahan sehingga terjadi perpindahan elektron. Elektroda harus terbuat dari bahan konduktor agar dapat dialiri listrik. Berbeda dengan arus listrik dalam sistem eksternal, transportasi muatan antara positif dan elektrode negatif dalam elektrolit dilakukan oleh ion. Umumnya arus dalam elektrolit terdiri dari perpindahan ion positif dan negatif. Di sel baterai alumunium udara terdapat dua jenis elektroda, yaitu: katoda dan anoda. Pada sebuah sel baterai alumunium udara terjadi reaksi elektrokimia, pada katoda terjadi reaksi 3O 2 + 6H2O + 12e- 12OH-. Katoda sel ini adalah udara, lebih spesifik oksigen (O2), udara diambil dari lingkungan diluar sistem, katoda udara adalah salah satu komponen yang sangat penting dalam reaksi elektrokimia baterai alumunium udara. Katoda udara memfasilitasi adanya reaksi reduksi oksigen pada elektroda. Gambar 2.5 Struktur elektroda udara di laminasi. (a) Komposisi air-katoda menunjukkan struktur fungsi masing-masing komponen . (b) Diagram tigas-fase untuk proses oksigen pengurangan elektrolit (Sumber: Linden & Reddy, 2011). Semakin banyak pori yang terdapat pada elektroda akan mempercepat reaksi elektrokima yang terjadi tetapi mengurangi hasil reaksi elektrokima pada sel baterai alumunium udara. Semakin rendah porositas akan memperbanyak reaksi elektrokimia yang terjadi dikarenakan jumlah aluminium sebagai sumber energi semakin banyak, tetapi mengurangi kecepatan reaksi. Jumlah persentase porositas yang terlalu rendah http://digilib.mercubuana.ac.id/ 26 akan mengurangi jumlah reaksi pula, hal ini dikarenakan bidang kontak reaksi pada sel ini akan semakin berkurang sehingga dapat mengurangi tegangan listrik sebagai hasil dari reaksi elektrokima pada sel baterai alumunium udara (Rio dkk, 2014). Pada baterai alumunium udara, anodanya adalah aluminium, anoda adalah elektroda negatif yang mengalami proses oksidasi pada saat discharging baterai. Reaksi yang terjadi adalah 4Al 4Al3+ + 12e-. Aluminium mengalami oksidasi atau melepaskan elektron sebanyak 12 atom dan ion Al3+. Tegangan listrik dari suatu sel elektrokimia adalah, beda potensial yang dimiliki oleh dua material yang dijadikan elektroda pada sebuah sel baterai, sehingga tiap baterai yang memiliki penyusun elektroda berbeda maka tegangan listrik yang dihasilkan akan berbeda, standar potensial dari setiap sel dapat dihitung dengan: Anoda + Katoda = Potensial sel standar. Pada baterai alumunium udara hitungan potensial sel standarnya adalah sebagai berikut: Reaksi oksidasi pada anoda: Al + 3OH- Al(OH)3 + 3e-; -2.31 V Reaksi reduksi pada katoda: O2 + 2H2O + 4e- 4OH-; +0,40 V Total reaksi: 4Al + 3O2 + 6H2O 4Al (OH)3; 2,71 V 2.7 TEORI DASAR LISTRIK 2.7.1 Arus Listrik Arus Listrik merupakan aliran elektron-elektron dari atom ke atom yang terjadi pada sebuah penghantar dengan kecepatan dalam waktu tertentu. Penyebab timbulnya arus listrik tersebut dikarenakan adanya beda potensial pada kedua ujung penghantar yang terjadi karena mendapatkan suatu tenaga untuk mendorong elektron-elektron tersebut berpindah-pindah tempat. Umumnya gerakan aliran elektron ini akan menuju tempat yang lebih lemah tekanannya. http://digilib.mercubuana.ac.id/ 27 Arus listrik tersebut juga haruslah dapat dialirkan atau diputuskan agar aliran listrik aman dengan kecepatan yang stabil. Kecepatan perpindahan arus listrik ini dapat disebut laju arus yang dapat ditulis dengan I dengan satuan ampere. Dan arus listrik tersebut terjadi jika muatan listrik tersebut mengalir setiap detik. Sehingga dapat kita tuliskan hubungan muatan listrik, arus listrik, dan waktu, dengan rumus : I = Q/t atau (2.1) Q=Ixt Keterangan : I = Kuat arus listrik (A) Q = Banyaknya muatan Listrik (Coulomb) t = waktu (s) Arus listrik yang mengalir tersebut dari sumber arus listrik tersebut dapat kita bedakan menjadi 2 macam yaitu : a. Arus bolak-balik (Alternating Current) Arus bolak-balik (AC) adalah arus yang mengalir dengan polaritas yang berubah dan dimana masing-masing terminal polaritasnya bergantian. Pada umumnya arus AC ini adalah arus yang digunakan dalam kehidupan seharihari seperti alat-alat elektronika yang dipakai didalam rumah kita. Arus listrik ini dihasilkan oleh pembangkit tenaga listrik yang bernama generator yang ada pada pembangkit listrik. b. Arus searah (Direct Current) Arus searah (DC) merupakan arus yang mengalir dengan arah yang tetap (konstan) dengan masing-masing terminal selalu tetap pada polaritasnya. Arus ini bisa terjadi karena berasal dari akumulator (Accu). Arus listrik searah ini dapat dihasilkan dengan cara merubah arus AC menjadi DC menggunakan power supply dengan dioda sebagai penyearah arus yang dapat menyearahkan arus bolak-balik menjadi arus searah. http://digilib.mercubuana.ac.id/ 28 2.7.2 Tegangan Listrik Sebuah benda bermuatan positif kalau benda tersebut kehilangan elektron dan bermuatan negatif kalau benda tersebut kelebihan elektron. Dalam keadaan berbeda muatan inilah munculnya tenaga potensial yang berada di antara benda – benda itu. Karena itu bila sepotong kawat penghantar dihubungkan diantara kedua benda yang berbeda muatan menyebabkan terjadinya perpindahan energi diantara benda – benda itu. Peralihan energi ini berlangsung terus selama ada beda tegangan. Terjadinya tegangan disebabkan adanya beda tiap muatan mempunyai tenaga potensial untuk menggerakkan suatu muatan lain dengan cara menarik atau menolak. Beda tegangan dapat dihasilkan dengan memberikan tekanan listrik dari suatu pembangkit listrik pada salah satu tempat penghantar. Satuan untuk mengukur tegangan listrik adalah volt. 2.7.3 Daya Listrik Daya Daya listrik adalah energi yang dibawa oleh elektron yang bergerak tiap satuan ewaktu. Karena ada arus yang mengalir dalam rangkaian maka akan ada konversi energi listrik menjadi energi bentuk lain. Contoh, arus mengalir melalui filamen merubah energi listrik menjadi terang dan energi panas. Daya listrik dapat didefenisikan sebagai ukuran (rate) pada saat energi listrik dikonversi dan merupakan kuantitas yang penting dalam rangkaian-rangkaian praktis. Daya merupakan ukuran disipasi energi dalam sebuah alat. Karena tegangan dan arus dapat berubah sesuai fungsi dari waktu, kita segera memperkirakan bahwa nilai sesaat dan nilai rata-rata dapat digunakan untuk menggambarkan disipasi.Watt (W) adalah ukuran dasar dari daya listrik. Secara matematis rumus daya listrik dapat ditulis sebagai berikut: P=VxI (2.2) Dimana : P = Daya/energi listrik (watt) V = Tegangan/beda potensial (Volt) I = Arus (Ampere) http://digilib.mercubuana.ac.id/