Panduan Praktikum Mikoriza
advertisement
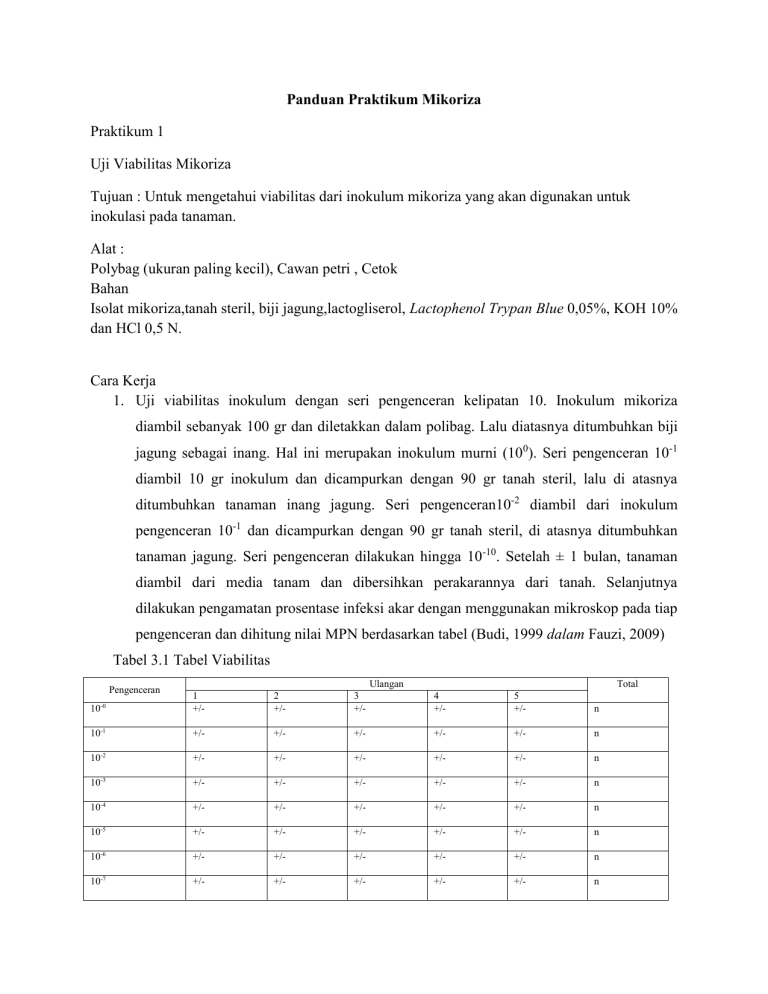
Panduan Praktikum Mikoriza Praktikum 1 Uji Viabilitas Mikoriza Tujuan : Untuk mengetahui viabilitas dari inokulum mikoriza yang akan digunakan untuk inokulasi pada tanaman. Alat : Polybag (ukuran paling kecil), Cawan petri , Cetok Bahan Isolat mikoriza,tanah steril, biji jagung,lactogliserol, Lactophenol Trypan Blue 0,05%, KOH 10% dan HCl 0,5 N. Cara Kerja 1. Uji viabilitas inokulum dengan seri pengenceran kelipatan 10. Inokulum mikoriza diambil sebanyak 100 gr dan diletakkan dalam polibag. Lalu diatasnya ditumbuhkan biji jagung sebagai inang. Hal ini merupakan inokulum murni (100). Seri pengenceran 10-1 diambil 10 gr inokulum dan dicampurkan dengan 90 gr tanah steril, lalu di atasnya ditumbuhkan tanaman inang jagung. Seri pengenceran10-2 diambil dari inokulum pengenceran 10-1 dan dicampurkan dengan 90 gr tanah steril, di atasnya ditumbuhkan tanaman jagung. Seri pengenceran dilakukan hingga 10-10. Setelah ± 1 bulan, tanaman diambil dari media tanam dan dibersihkan perakarannya dari tanah. Selanjutnya dilakukan pengamatan prosentase infeksi akar dengan menggunakan mikroskop pada tiap pengenceran dan dihitung nilai MPN berdasarkan tabel (Budi, 1999 dalam Fauzi, 2009) Tabel 3.1 Tabel Viabilitas Pengenceran Ulangan Total 10-0 1 +/- 2 +/- 3 +/- 4 +/- 5 +/- n 10-1 +/- +/- +/- +/- +/- n 10-2 +/- +/- +/- +/- +/- n 10-3 +/- +/- +/- +/- +/- n 10-4 +/- +/- +/- +/- +/- n 10-5 +/- +/- +/- +/- +/- n 10-6 +/- +/- +/- +/- +/- n 10-7 +/- +/- +/- +/- +/- n 10-8 +/- +/- +/- +/- +/- n 10-9 +/- +/- +/- +/- +/- n 10-10 +/- +/- +/- +/- +/- n Keterangan: + = terinfeksi mikoriza - = tidak terinfeksi mikoriza n = jumlah akar terinfeksi Tabel Nilai MPN (Budi, 1999 dalam Fauzi, 2009) 2. Pembuatan Akar Semi Permanen Untuk menghitung persen infeksi pada akar perlu dilakuakan pembuatan preparat akar semi permanen. Preparat akar semi permanen dapat dibuat dengan menggunakan metode Philip dan Haymen 1979 Akar dibersihkan kemudian dipotong – potong sepanjang ± 1,5 cm.kemudian akar dipanaskandalam KOH 10% pada suhu 900C selama ± 10 menit. Setelah mendidih akar ditiriskan dan dicuci dengan aquades. Akar kemudian dimasukkan lagi kedalan HCl 0,1 N kemudian ditiriskan dan dicuci kembali dengan aquades. Setelah itu akar diwarnai dengan cara dimasukkan dalam Lactophenol Trypan Blue 0,05% beberapa saat dan dimasukkan dalam laktogliserol. Praktikum 2 Eksplorasi dan Identifikasi Mikoriza Alat Saringan bertingkat, baskom, gelas beker, cawan petri, rotary shaker, dan mikroskop. Bahan Tanah taman, air, sukrosa Cara kerja 1. Eksplorasi Dan Ekstraksi Mikoriza dari Tanah Sekitar Kawasan ITS Eksplorasi Tanah yang sudah diambil dikering anginkan hingga tidak terlalu basah. Setelah itu sampel tanah dari masing-masing daerah ditimbang per 100 gram. Antara akar tanaman dan sampel tanah dipisahkan. Ekstraksi Sampel tanah yang sudah di eksplorasi dan di timbang per 100 gram di ambil untuk di ekstraksi. Tiap satu kali ekstraksi menggunakan 100 gram sampel tanah. Sampel tanah yang siap di ekstraksi dimasukkan ke dalam ember dan dicampur dengan air. Sampel tanah dan air di aduk secara merata. Atur posisi saringan dengan urutan saringan biasa dibagian paling atas, kemudia saringan 24 mesh diletakkan di bawahnya dan paling bawah adalah gelas beker untuk menampung airnya. Kemudian air sampel tanah yang tertampung di dalam gelas beker di campur dengan gula/sukrosa (densitas = ± 2,76 gr/ml). setelah itu di diamkan selama 2 menit. Air bagian atas disaring dengan saringan 325 mesh dengan cara diputar sehingga hanya air yang berada di bagian atas saja yang tersaring. Setelah itu ukur volume air yang tertampung di saringan dan letakkan dalam cawan petri. Encerkan hingga volumenya 25 ml. Kemudian dilakukan pengamatan jumlah spora pada tiap sampel per 25 ml. Simpan supernatant sampel dalam Erlenmeyer. 3. Identifikasi Supernatant hasil ekstraksi dituangkan dalam cawan petri kemudian diamati spora mikoriza dibawah mikroskop stereo dengan perbesaran 100x. kemudian hasil pengamatan di identifikasi jenis spora dengan menggunakan buku identifikasi spora mikoriza. Praktikum 3 Interaksi mikoriza dengan jamur pathogen Tujuan : untuk mengetahui pengaruh mikoriza dalam menghambat jamur pathogen pada tanaman. Bahan Isolat Mikoriza, Isolat Jamur pathogen (Fusarium oxysporum dan Rhizoctonia solani), tanah, pupuk, pasir, bibit tomat Alat Polybag, timbangan, oven Cara kerja 1. Persiapan Media Tanam Media tanam yang digunakan adalah campuran tanah, pasir dan pupuk kandang masingmasing 1:1:1. Media tanam kemudian di autoclave dengan suhu 1210C dan 1 atm dua kali dengan masing-masing waktu sterilisasi 1 jam. 2. Penyemaian Tomat Peralatan yang digunakan dalam penyemaian tanaman tomat adalah bak tanam, sekrup kecil. Media tanam yang sudah disterilkan di masukkan ke dalam 2 bak tanam. Masing – masing bak di isi dengan 5 kg tanah. Untuk tiap bak tanam di taburkan bibit tanaman tomat varietas fortuna sebanyak 15 biji. Tanaman tomat disemai hingga umur 3 minggu. Bibit siap dipindah jika sudah mempunyai helai daun 4-6 helai. 3.Persiapan Tanam dan Inokulasi Mikoriza Tanaman tomat yang sudah memiliki daun 4-6 helai dipindahkan ke dalam polybag yang sudah berisi media tanam sebanyak 3 kg. Masing-masing polybag berisi 1 tanaman tomat. Mikoriza di inokulasikan pada tanaman tomat dengan cara memberi mikoriza dalam lubang di bawah tanaman tomat dengan kedalaman 2-5 cm. Perlakuan yang diberikan adalah control, 20 gram mikoriza dan 40 gram mikoriza dengan pengulangan 3 kali. 4.Inokulasi Patogen Inokulasi jamur pathogen dilakukan dalam dua masa perlakuan, yaitu bersamaan dengan inokulasi mikoriza dan tiga minggu setelah inokulasi mikoriza. Suspensi jamur patogen dengan kerapatan 105/ml diambil 16 ml dan di inokulasikan bersamaan dengan mikoriza dengan cara menuangkan suspensi pada lubang yang sama dengan mikoriza kemudian diaduk agar bercampur dengan tanah. Untuk inokulsai jamur patogen 3 minggu setelah inokulasi mikoriza dilakukan dengan cara melubangi area sekitar tanaman kemudian dituangkan suspensi ke dalam lubang tersebut. Tanah yang sudah diberi suspensi jamur patogen diaduk dan ditutup kembali. 5. Parameter Pengamatan a. Tinggi Tanaman Pengamatan tinggi tanaman dilakukan tiap minggu selama enam minggu. Tinggi tanaman diukur dengan menggunakan benang dan penggaris dari batas terbawah pertumbuhan sampai batas teratas pertumbuhan yaitu daun terakhir yang tumbuh (Sitompul, 1995) b. Jumlah Helai Daun Perhitungan jumlah daun dilakukan pada daun yang sehat dan yang terkena penyakit (Hidayati, 2007). Perhitungan jumlah daun ini dilakukan seminggu sekali selama enam minggu. c. Berat Basah Untuk menentukan berat basah dari akar dan batang, tanaman akan dipanen setelah enam minggu. Akar dipisahkan dari batang. Akar kemudian di cuci dengan air keran dan di cuci kembali menggunakan aquades. Akar yang sudah di cuci kemudian diletakkan di antara kertas saring untuk menyerap sisa air cucian. Perlakuan yang sama juga dilakukan pada batang. Setelah itu akar dan batang ditimbang berat basah secara terpisah (Ozgonen and Erkilic, 2007). d. Berat Kering Untuk menentukan berat kering dari akar dan batang, tanaman akan dipanen setelah 6 minggu. Akar dipisahkan dari batang. Akar kemudian di cuci dengan air keran dan di cuci kembali menggunakan aquades. Akar yang sudah di cuci kemudian diletakkan di antara kertas saring untuk menyerap sisa air cucian. Perlakuan yang sama juga dilakukan pada batang. Setelah itu akar dan batang ditimbang berat kering setelah dikeringkan pada suhu 70o C selama dua hari (Ozgonen and Erkilic, 2007). e. Persen Infeksi Mikoriza Untuk menghitung persen infeksi akar perlu dibuat terlebih dahulu preparat akar semi permanen. Persen infeksi mikoriza di hitung dari jumlah akar yang terinfeksi dari 10 potongan akar yang diamati. Akar yang terinfeksi ditandai dengan adanya vesikel atau arbuskula dalam korteks akarnya. Persen infeksi mikoriza dihitung berdasarkan rumus Philip & Haymen (1978) (Hidayati, 2007). Keterangan, JAT : jumlah akar yang terinfeksi mikoriza JSP : jumlah total potongan akar f. Persen Infeksi Fusarium oxysporum Untuk mengetahui infeksi jamur patogen perlu dilakukan perhitungan persen infeksi dari jamur patogen perhitungan infeksi menggunakan rumus Philip& Hayment (1997) (Hidayati, 2007). Keterangan, JAT : jumlah akar yang terinfeksi jamur patogen JSP : jumlah total potongan akar g. Persen Tingkat Kejadian Penyakit (Deasaeas Incidence) Metode penentuan kejadian penyakit (DI) didasarkan pada perbandingan antara jumlah tanaman yang sakit atau jumlah bagian tanaman yang sakit dengan jumlah tanaman seluruhnya atau jumlah bagian tanaman seluruhnya, misalnya : daun, batang, cabang, atau buah yang memperlihatkan gejala (Purnomo, 2006). Pengukuran kejadian penyakit pada penelitian ini di lakukan berdasarkan tingkat serangan pada daun, dengan menggunakan rumus Keterangan : P : tingkat serangan pada daun a : jumlah daun tanaman yang mengalami kelayuan b : jumlah daun per tanaman (Hidayati, 2007)











