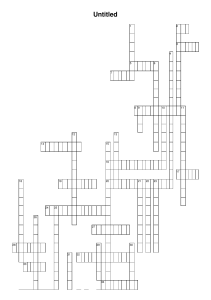
perubahan kadar hormon tiroksin (t4)
advertisement

PERUBAHAN KADAR HORMON TIROKSIN (T4) DAN GAMBARAN PROFIL PITA PROTEIN SERUM PADA HEWAN MODEL TIKUS AUTOIMMUNE THYROIDITIS (AITD) HASIL INJEKSI TIROGLOBULIN KAMBING (Capra hircus) THE SERUM PROTEIN PROFILES AND CHANGES IN THYROXINE (T4) HORMONE LEVELS OF ANIMAL MODELS AUTOIMMUNE THYROIDITIS Rattus norvegicus INJECTED WITH CAPRA THYROGLOBULIN (Capra hircus) Fitri Amalia Riska*, Agung Pramana Warih Marhendra dan Masdiana C. Padaga Program Studi Pendidikan Dokter Hewan, Program Kedokteran Hewan Universitas Brawijaya *[email protected] ABSTRAK Penyakit autoimun yang menyerang organ tiroid disebut dengan Autoimmune thyroiditis (AITD). Keberadaan hewan coba AITD yang disebut dengan experimental autoimmune thyroiditis (EAT) diperlukan untuk mempelajari lebih dalam mengenai patomekanisme terbentuknya penyakit ini. Penelitian ini bertujuan untuk mengetahui tingkat keparahan AITD berdasarkan perubahan kadar hormon tiroksin (T4) dan gambaran profil pita protein serum pada tikus sebelum dan setelah injeksi tiroglobulin kambing (cTG) dengan variasi dosis yang berbeda. EAT dibuat dengan cara injeksi cTG yang telah diemulsikan dengan CFA atau IFA (perbandingan 1:1) sebanyak 0,2 ml pada hari ke-0, 14 dan 28, injeksi dilakukan secara subcutan cervical. Hasil penelitian menunjukkan bahwa injeksi tiroglobulin kambing (cTG) akan mengakibatkan kerusakan pada tiroid sehingga mempengaruhi kadar hormon tiroksin (T4) dan gambaran profil pita protein serum pada tikus (Rattus norvegicus). Pengukuran kadar hormon tiroksin menggunakan ELISA menunjukkan perbedaan yang signifikan, semakin tinggi dosis injeksi semakin turun kadar hormonnya. Hasil analisa protein serum dengan menggunakan metode SDS-PAGE menunjukkan bahwa terdapat protein spesifik dengan berat molekul 40 kDa. Kata kunci : Autoimmune thyroiditis, experimental autoimmune thyroiditis, tiroglobulin kambing, hormon tiroksin (T4), pita protein serum. ABSTRACT Autoimmune disease that affecting the thyroid gland called autoimmune thyroiditis (AITD). The animal models of AITD called experimental autoimmune thyroiditis (EAT) was required to study the mechanism of this disease. This research aimed to study the changing of thyroxine (T4) hormone levels and serum protein profiles on rats (Rattus norvegicus) injected with capra thyroglobulin (cTG) with a variation doses. Capra thyroglobulin (cTG) for injection emulsified with CFA or IFA (1:1 ratio) in 0.2 ml and were injected by subcutan cervical method on day 0, 14 and 28. The result showed that the injection of cTG could damage the thyroid gland thus affected the T4 hormone level and serum protein profiles on rats. The measurement of thyroxine hormone levels using ELISA showed a significant decreasing of T4 levels from 1,772 ± 0,123 ng/dL (normal rat) to 1.472 ± 0.041 ng/dL and 1.238 ± 0.119 µg/µL respectively in rats injected with cTG dose of 100 µg/µL and cTG dose of 200 µg/µL. The higher dose of injection, the lower of T4 level. Analysis of serum proteins using SDS-PAGE showed that there was a specific protein with a molecular weight of 40 kDa in rat serum injected with cTG. Keywords: Autoimmune thyroiditis, experimental autoimmune thyroiditis, capra thyroglobulin, hormones thyroxine (T4), protein bands profile PENDAHULUAN Penyakit autoimun merupakan suatu penyakit akibat dari kegagalan fungsi sistem kekebalan tubuh yang menyebabkan tubuh menyerang jaringannya sendiri. Salah satu penyakit autoimun yang berbahaya adalah autoimmune thyroiditis (AITD) (Oto, 2011). Autoimmune thyroiditis (AITD) merupakan penyakit autoimun pada organ spesifik yaitu tiroid. Penyakit ini selain menyebabkan kerusakan pada kelenjar tiroid, juga menyebabkan hipertropi tiroid dan diikuti dengan stimulasi peningkatan metabolisme tiroid (Weetman, 2001). Bentuk dari AITD yang paling umum adalah berupa Hashimoto thyroiditis (hipotiroiditis) dan Grave’s disease (hipertiroiditis) (Nhanes, 2011). Penyakit AITD dapat menyerang manusia maupun hewan. Penyakit ini lebih banyak menyerang wanita daripada lakilaki pada rentan usia 30-50 tahun karena pada wanita terdapat hormon progesteron yang dapat meningkatkan inisiasi terhadap produksi sitokin proinflamasi (Nhanes, 2011). Kejadian AITD pada hewan sering terjadi pada anjing dan merupakan 80% kasus penyakit autoimun berupa hipotiroiditis yang mengakibatkan kerusakan pada kelenjar tiroid. Beberapa ras anjing yang sering terserang penyakit ini antara lain golden retriever, shetland sheepdog, american cocker spaniel, boxer, doberman pincher, collie, labrador retriever, akita, english setter, old english sheepdog dan german shepherd (Dodds, 2008). Pengembangan hewan model AITD yang disebut dengan experimental autoimmune thyroiditis (EAT) sudah banyak dilakukan untuk mengetahui patomekanisme yang lebih mendalam dari penyakit autoimun ini. Antigen utama yang dapat menginduksi EAT ada tiga macam yaitu tiroglobulin (TG), tiroxine peroxidase (TPO) dan thyroid stimulating hormone receptor (TSHR) (Weetman, 2004). Tiroglobulin lebih banyak dipilih sebagai inducer karena merupakan glikoprotein spesifik yang dapat menginduksi AITD secara signifikan dengan jumlah yang paling banyak ditemukan pada sel tiroid yaitu sekitar 75% (Ng et al., 2004). Tiroglobulin (TG) yang digunakan untuk membuat EAT selama ini berasal dari tiroglobulin tikus (murine thyroglobulin/mTG), babi (porcine thyroglobulin/pTG), sapi (bovine thyroglobulin/bTG) dan rodensia. Penggunaan tiroglobulin asal kambing (capra thyroglobulin/cTG) belum banyak dikenal dan digunakan, namun tiroglobulin asal kambing ini juga memiliki potensi yang sama untuk dapat menginduksi terjadinya AITD pada EAT karena pada dasarnya semua tiroglobulin memiliki kesamaan ditinjau dari keadaan fisik, biokimia dan kandungan molekul yang terdapat di dalamnya (Zhou dan Gill, 2005). Dewasa ini pengujian kadar hormon tiroksin (T4) banyak dilakukan untuk identifikasi kelenjar tiroid karena lebih sensitif dan dapat dijadikan sebagai indikator fungsi tiroid. Penurunan kadar hormon T4 menetapkan diagnosa dari hipotiroidisme, sebaliknya saat kadar hormon T4 meningkat, maka diagnosanya adalah hipertiroidisme (Anwar, 2005). Gambaran pita protein serum darah juga dapat dijadikan sebagai deteksi awal dalam melakukan diagnosa dan prognosa terhadap suatu penyakit (Zaias et al., 2009). Oleh karena itu, penelitian ini dilakukan untuk mempelajari efek injeksi tiroglobulin kambing (cTG) pada tikus (Rattus norvegicus) model AITD ditinjau dari perubahan kadar hormon tiroksin (T4) serta gambaran profil pita protein serumnya. Penelitian ini bertujuan untuk mengetahui perubahan kadar hormon tiroksin (T4) serta perbedaan gambaran profil pita protein serum pada tikus setelah dilakukan perlakuan injeksi tiroglobulin kambing. Melalui hewan model AITD (EAT) hasil induksi dari tiroglobulin kambing (Capra hircus) diharapkan patomekanisme AITD dapat diketahui secara mendalam sehingga dapat digunakan sebagai media untuk penelitian lebih lanjut guna menghasilkan prototype, metode pencegahan serta pengobatan yang tepat. association of official analytical chemist (AOAC) (2005). Tikus telah mendapatkan sertifikat laik etik dari Komisi Etik Penelitian Universitas Brawijaya No. 140KEP-UB. MATERI DAN METODE Alat dan bahan Peralatan yang digunakan dalam penelitian ini antara lain mortar, sentrifus (Hettich EBA III), timer, sonikator (Branson 200), vortex (GUO HUQ), vacumtainer, tabung eppendorf, mikropipet, yellow tube, blue tube, Rodent T4 ELISA Test Kit, microtiter plate reader, plate elektroforesis. Bahan yang digunakan antara lain organ tiroid kambing, larutan Phosphat Buffer Saline asida (PBS-asida), Complete Freud’s Adjuvant/CFA (Sigma F5881, USA), Incomplete Freud’s Adjuvant/IFA (Sigma F-5506, USA), larutan Phosphat Buffer Saline TweenPhenyl Methyl Sulfonyl Fluoride (PBSTPMSF), pasir kuarsa, etanol absolut, larutan Biuret 80%, ddH2O/aquades, T-Akrilamid, Upper Gel Buffer (UGB), Lower Gel Buffer (LGB), Amoniumpersulphate (APS), TEMED, Reducing Sample Buffer (RSB) dan running buffer TBE. Isolasi Tiroglobulin dari Tiroid Kambing (cTG) Tiroid kambing setelah diseparasi dari trakea ditimbang sebanyak 0.5 gram kemudian dicuci dengan PBS sebanyak 3 kali untuk dibersihkan dari darah yang masih tersisa. Kemudian organ digerus dengan mortar dingin. Ditambahkan pasir kuarsa serta larutan buffer ekstrak lima kali volume tiroid ke dalam mortal dan dihomogenasi. Setelah itu homogenat dituang ke dalam tabung eppendorf dan disentrifus pada kecepatan 10.000 rpm pada suhu 4oC selama 20 menit. Supernatan dipindahkan ke dalam tabung eppendorf baru. Ekstrak protein kasar (crude protein) yang didalamnya terdapat protein tiroglobulin selanjutnya diukur kadarnya menggunakan uji biuret dan diukur absorbansinya menggunakan spektofotometri pada panjang gelombang 540 nm (Amin dkk, 2009). Perlakuan Hewan Coba Tikus yang digunakan adalah tikus putih (Rattus norvegicus) betina strain Wistar yang diperoleh dari Unit Pengembangan Hewan Percobaan (UPHP) UGM Yogyakarta dengan umur 8-12 minggu dan berat badan antara 100-150 gr. Tikus diadaptasi selama tujuh hari dan diberi pakan berupa ransum basal yang komposisinya disusun berdasarkan standar Persiapan Hewan Coba Tikus Hewan coba dibagi menjadi tiga kelompok, yaitu (1) kelompok kontrol tanpa perlakuan, (2) kelompok AITD injeksi cTG dengan dosis 100µg/µl, (3) kelompok AITD injeksi CTg dengan dosis 200µg/µl. Masing-masing kelompok perlakuan terdiri dari enam ekor tikus sebagai ulangan. Perhitungan dan Preparasi cTG Kadar protein cTG kemudian diukur dengan menggunakan metode uji biuret kemudian diabsorbansi dengan spektofotometer (Yazid dan Nursanti, 2006). Data absorbansi kemudian dianalisis dengan kurva baku protein. Hasil analisis kurva baku protein menunjukkan kadar protein cTG sebanyak 570 µg/µl. Jumlah protein yang dibutuhkan dalam perlakuan adalah 100 µg/µl dan 200 µg/µl. Injeksi cTG pada Tikus Injeksi cTG dilakukan secara subcutan pada daerah cervicalis yang merupakan metode modifikasi dari metode yang telah dilakuakan oleh Song et al. (2011). Injeksi dilakukan sebanyak tiga kali, injeksi pertama sebanyak 0,2 ml pada hari ke-0 menggunakan adjuvant CFA dosis 100μg/ml untuk kelompok perlakuan I (P1) dan 200μg/ml untuk kelompok perlakuan II (P2) kemudian dilakukan booster pada hari ke-14 dan hari ke-28 yang keduanya menggunakan adjuvant IFA dengan dosis 100μg/ml untuk P1 dan 200μg/ml untuk P2 masing-masing sebanyak 0,2 ml. Koleksi Serum Darah Pengambilan darah dilakukan melalui vena cocygea yang sebelumnya dibilas terlebih dahulu dengan air hangat. Darah yang diperoleh kemudian dimasukkan pada tabung vacmutainer dan dimiringkan pada sudut 45° selama kurang lebih tiga jam. Setelah itu dilakukan sentrifugasi dengan kecepatan 3000 rpm selama 15 menit. Supernatan yang terbentuk dipisahkan dan dilakukan setrifugasi lagi selama 15 menit dengan kecepatan yang sama yaitu 3000 rpm. Setelah sentrifugasi kedua, supernatan (serum) dipisahkan dan dipindahkan ke tabung ependorf yang baru lalu disimpan di dalam freezer (Ganong, 2008). Pengambilan darah dilakukan setiap satu minggu sekali selama 6 minggu. Pengamatan Profil Pita Protein Serum Analisa profil pita protein serum dilakukan dengan menggunakan metode SDS-PAGE. Tiga tahapan utama dari metode SDS-PAGE ini adalah yang pertama preparasi sampel, pembuatan gel (stacking gel dan separating gel) dan running gel. Sampel serum sebanyak 15 µl ditambah dengan 15 µl RSB (reducing sample buffer) didenaturasi pada air suhu 100°C selama 5 menit. Sampel kemudian dimasukkan ke dalam sumuran masingmasing. Running dilakukan pada tegangan 200 volt selama 45 sampai 60 menit. Gel kemudian dipindahkan pada wadah kemudian dituangi pewarna (staining) selama 30 menit. Gel kemudian dicuci dengan larutan destaining selama 30 menit sebanyak dua kali. Gel didokumentasi menggunakan scanner. Pengukuran Kadar Hormon Tiroksin (T4) Menurut penelitian yang telah dilakukan oleh Mikami, et al. (2003), kadar hormon tiroksin (T4) dapat diukur dari serum dapat diukur menggunakan metode ELISA. Kadar hormon T4 dalam penelitian ini diukur dengan menggunakan Rodent T4 ELISA Test Kit dengan Log No. 030413. Tahapan pertama adalah memasukkan larutan standart sebanyak 50 µl ke dalam well serta serum yang telah diencerkan sebanyak 50µl ke dalam well yang berbeda. Lalu ditambahkan 100µl T4 HRPConjugate Reagent ke dalam masingmasing well. Kemudian diinkubasi pada suhu 37°C selama 60 menit. Selanjutnya dicuci dengan washing buffer. Lalu ditambahkan reagen TMB pada masingmasing well kemudian ditutup dengan alumunium foil dan diinkubasi pada suhu 37°C selama 20 menit. Selanjutnya ditambahkan stop solution (2N HCl) sebanyak 50µl pada masing-masing well. Untuk menganalisa hasil perlu dibuat kurva baku standar terlebih dulu kemudian dibaca dengan ELISA READER. Analisa Data Analisis data yang digunakan dalam penelitian ini adalah analisa secara kualitatif deskripstif untuk gambaran profil pita protein serta kuantitatif statistik untuk kadar hormon tiroksin (T4). Kadar hormon tiroksin (T4) dianalisis menggunakan SPSS 16,0 for Windows dengan analisis ragam (ANOVA) kemudian dilakukan uji lanjutan Tukey untuk perbedaan ketiga perlakuan dengan α=5%. HASIL DAN PEMBAHASAN Kadar Hormon Tiroksin (T4) Kadar hormon tiroksin (T4) dalam serum merupakan salah satu indikator untuk penyakit autoimmune thyroiditis (AITD). Hasil pengukuran kadar hormon T4 pada hewan model tikus menggunakan metode ELISA yang telah dianalisis secara statistik menunjukkan adanya perbedaan nyata pada masing-masing perlakuan (Tabel 1). Tabel 1. Rata-rata Kadar Hormon Tiroksin pada Tikus Kadar Hormon T4 Kelompok Perlakuan (Mean±SD) (ng/dL) kontrol 1,772c ± 0,123 Dosis cTG 100 µg/µl 1,472b ± 0,041 Dosis cTG 200 µg/µl 1,238a ± 0,119 Keterangan : Penurunan kadar hormon T4 terhadap kontrol (%) 0 16,9 53,4 Notasi yang berbeda menunjukkan adanya perbedaan nyata pada masing-masing perlakuan (p>0,05) Rata-rata kadar hormon tiroksin (T4) pada serum tikus perlakuan mengalami penurunan dibandingkan pada serum tikus kontrol (Tabel 5.1). Rata-rata kadar hormon tiroksin (T4) pada tikus kontrol tanpa injeksi adalah 1,772±0,123 ng/dL. Kadar hormon tiroksin (T4) menurun secara signifikan pada tikus perlakuan. Tikus perlakuan 1 kadar hormonnya turun menjadi 1,472±0,041 ng/dL sedangkan pada tikus perlakuan 2 mencapai 1,238±0,119 ng/dL. Kadar hormon tiroksin (T4) pada tikus perlakuan 1 dan 2 mengalami penurunan masing-masing berturut 16,9% dan 53,4% dibandingkan pada tikus kontrol. Berdasarkan hasil yang ada, penelitian ini menunjukkan bahwa injeksi tiroglobulin kambing (cTG) pada tikus (Rattus norvegicus) akan menyebabkan perbedaan kadar hormon tiroksin (T4) pada serum tikus kontrol dan tikus perlakuan. Variasi dosis cTG yang diberikan juga memberikan pengaruh terhadap kadar hormon tiroksin (T4) pada serum tikus perlakuan. Kadar hormon tiroksin (T4) pada serum tikus perlakuan 1 pada lebih banyak daripada kadar tiroksin (T4) tikus perlakuan 2. Kenaikan dan penurunan kadar hormon T4 dalam darah dapat mengindikasikan adanya penyakit autoimun pada kelenjar tiroid (Ferguson, 2007). Biosintesis hormon T4 terjadi di dalam kelenjar tiroid yang dikendalikan oleh mekanisme umpan balik dari hipotalamus dan hipofisa (Deruiter, 2002; Ganong, 2008). Kadar hormon T4 pada kelompok normal tanpa perlakuan berdasarkan penelitian adalah 1,772±0,123 ng/dL. Keadaan ini sama dengan yang dilaporkan oleh Piechotta et al. (2010) bahwa dalam kondisi normal, kadar hormon T4 dalam serum tikus berkisar antara 1,60-3,10 ng/dL. Pemberian cTG terhadap tikus berpengaruh secara nyata (p > 0,05) dalam menurunkan kadar hormon T4 pada serum tikus. Hal tersebut ditunjukkan dengan penurunan nilai rata-rata kadar hormon T4 pada kelompok pemberian cTG dosis 100 µg/µl dan 200 µg/µl dibandingkan dengan kelompok kontrol atau tanpa perlakuan. Penurunan kadar hormon T4 dalam serum pada hasil penelitian ini disebabkan oleh rusaknya kelenjar tiroid akibat adanya autoimunitas hasil injeksi crude protein tiroglobulin yang mengandung cTG. Tiroglobulin kambing yang telah diemulsikan dengan adjuvant tersebut akan dikenali sebagai antigen oleh MHC II dengan bantuan APC. Setelah terjadi pengenalan antigen oleh MHC II, sel TCD4+ (Th) akan diinisiasi untuk berpoliferasi menjadi sel T helper 1 (Th1) dan T helper 2 (Th2). Sel Th1 menginduksi makrofag untuk menghasilkan sitokin proinflamasi sedangkan Th2 akan menginisiasi sel B untuk menghasilkan antibodi. Antibodi yang dihasilkan oleh sel B akan berikatan dengan cTG dan tiroglobulin (TG) pada tiroid tikus. Pengenalan TG sebagai autoantigen merupakan suatu reaksi autoimun karena memiliki kesamaan dengan cTG seperti yang dinyatakan Zhou dan Gill (2005) bahwa tiroglobulin dari beberapa spesies memiliki kesamaan fisik, biokimia dan struktur molekul yang sama. Sel tiroid mengandung TG dalam jumlah besar, sehingga penyerangan antibodi terhadap TG yang dianggap sebagai autoantigen tadi akan menyebabkan kerusakan pada sel tiroid dan pelepasan hormon T4 ke dalam darah menjadi berkurang. Menurut Anwar (2005), produksi hormon tiroid diawali dengan perangkaian iodotirosil. Dua molekul diiodotirosin (DIT) membentuk T4 dan satu molekul DIT ditambah satu molekul monoiodotirosin (MIT) membentuk T3 yang kemudian pelepasannya dalam darah melibatkan peran tiroglobulin (TG). Keadaan autoimunitas tersebut sama dengan penelitian yang telah dilakukan oleh Chistiakov (2005), injeksi tiroglobulin pada hewan model tikus autoimmune thyroiditis akan menginisiasi pembentukan autoantibodi terhadap tiroglobulin dalam sel tiroid sehingga terjadi kerusakan pada tiroid. Ferguson (2007) menambahkan, sintesis dan sekresi hormon tiroid sangat bergantung pada kondisi kelenjar tiroid serta diatur oleh dua mekanisme utama yaitu mekanisme autoregulasi berdasarkan iodida yang tersedia serta mekanisme umpan balik oleh hipotalamus dan hipofisis anterior. Hal tersebut sejalan dengan pernyataan Deruiter (2002) bahwa penyebab utama disfungsi kelenjar tiroid adalah autoimmune thyroiditis yang dapat menghambat produksi hormon tiroid. Keadaan yang menunjukkan penurunan kadar hormon pada serum tikus tersebut mengarah pada penyakit autoimmune thyroiditis khususnya hipotiroidisme. Menurut Piechotta et al. (2010) penurunan kadar hormon T4, menunjukkan hipotiroidisme, sedangkan peningkatan jumlahnya dapat mengindikasikan penyakit hipertiroidisme. Pada kondisi hipotiroidisme tiroid tidak mampu menghasilkan hormon tiroid yang cukup untuk menjaga kestabilan kerja organ tubuh (Pace, 2004). Gambaran Profil Pita Protein Serum Protein hasil isolasi dari serum tikus autoimmune thyroiditis yang telah diinjeksi tiroglobulin kambing (cTG) dianalisa menggunakan metode SDS-PAGE. Hasil elektroforesis protein serum pada gel polyakrilamid akan menggambarkan pola pita protein serum dengan warna biru keunguan (Gambar 1). Gambar 1 . Hasil Profil Pita Protein Serum Tikus Perlakuan. (M=Marker; K=Kontrol; P=Perlakuan 1 dosis 100µg/µl; P2=Perlakuan 2 dosis 200µg/µl; 0,14,28,34=hari pengambilan serum). Pita protein pada serum hari ke-0 menunjukkan pola yang hampir sama baik pada serum tikus perlakuan 1 maupun tikus perlakuan 2 dan mulai menunjukkan perbedaan pada hari ke-14, 28 dan 34. Hari ke-0 merupakan hari pre-imun atau sebelum diberi perlakuan injeksi cTG, sedangkan hari ke-14, 28 dan 38 merupakan hari setelah dilakuan injeksi pertama, kedua dan ketiga secara berturutturut. Hasil band atau pita protein pada gambar memiliki tingkat ketebalan yang berbeda akibat dari perbedaan konsentrasi dari masing-masing protein yang terekspresi. Hewan model AITD yang diinjeksi tiroglobulin kambing (cTG) menghasilkan protein spesifik dengan berat molekul 40 kDa. Hal ini menunjukkan bahwa injeksi tiroglobulin kambing (cTG) pada tikus mempengaruhi ekspresi protein tertentu akibat adanya abnormalitas pada tubuh. Sesuai dengan pernyataan Zaias et al. (2009) bahwa perubahan ekspresi serta kadar protein yang terkandung dalam serum dapat dijadikan sebagai deteksi awal dalam melakukan diagnosa dan prognosa terhadap suatu penyakit. Menurut Tseng et al. (2004), protein dengan berat molekul 40 kDa merupakan protein haptoglobin (Hp). Tiroglobulin kambing (cTG) yang diinjeksikan pada tikus akan menyebabkan inflamasi sel tiroid yang berlanjut pada kerusakan sel tiroid. Kondisi inflamasi ini diinisiasi oleh sitokin pro-inflamasi seperti IL-1 dan IL-6 yang dihasilkan oleh makrofag. Keberadaan sitokin pro-inflamasi selain menginisiasi proses inflamasi juga akan menginduksi produksi protein penanda inflamasi seperti yang dinyatakan oleh Kaisho dan Alkira (2002), sitokin pro inflamasi seperti interleukin-6 (IL-6), interleukin-1 (IL-1) dan tumor necrosis factor (TNF) yang dikeluarkan oleh makrofag menginisiasi produksi protein penanda inflamasi. Munculnya ekspresi protein haptoglobin (Hp) dapat dijadikan sebagai indikasi adanya inflamasi atau tumor serta kerusakan jaringan, dalam hal ini jaringan tiroid. Pernyataan tersebut diperkuat oleh penelitian Mishra et al. (2010), fungsi utama haptoglobin (Hp) adalah untuk mengikat hemoglobin bebas yang dilepaskan eritrosit ke dalam sirkulasi darah akibat adanya kerusakan jaringan atau peradangan kemudian membentuk kompleks haptoglobin-hemoglobin (HpHb). Haptoglobin dapat digunakan sebagai landasan diagnosa maupun prognosa terhadap suatu penyakit (Sadrzadeh et al., 2004). Castro dan Gourley (2010) menambahkan, saat terjadi peradangan atau inflamasi pada jaringan tertentu, beberapa protein serum seperti CRP (115 KDa), haptoglobin (40 KDa) dan ferritin (330 KDa) akan diproduksi sebagai respon dari inflamasi tersebut. Keberadaan protein ini tidak hanya dapat dijadikan sebagai penanda inflamasi namun juga dapat mencerminkan adanya kelainan pada penyakit autoimun, infeksi, tumor serta penyakit lainnya Haptoglobin adalah bagian dari plasma N-glikoprotein. Keberadaan protein ini memiliki kepentingan klinis, peningkatan haptoglobin dapat dijadikan sebagai indikasi adanya kondisi patologis baik pada manusia maupun hewan (Ulutas et al., 2007). Haptoglobin (Hp) merupakan komponen dari imunitas bawaan, yang juga dapat mempengaruhi kekebalan tubuh serta terlibat dalam patogenesis tumor dan infeksi (Levy, et al., 2010). Kaisho dan Alkira (2002) menambahkan sintesis haptoglobin diinduksi oleh sitokin setelah aktivasi sel-sel imunitas bawaan oleh PAMPs (pathogen associated molecular patterns) seperti TLR4 (toll like receptor) activator. Berdasarkan hasil penelitian kedua parameter yang telah dipaparkan di atas dapat disimpulkan bahwa pemberian perlakuan injeksi cTG pada tikus (Rattus norvegicus) signifikan dalam menurunkan kadar hormon tiroksin (T4) dalam serum dan berbanding lurus dengan dosis yang diberikan serta menghasilkan suatu protein yaitu protein penanda inflamasi dengan berat molekul 40 kDa (protein haptoglobin). KESIMPULAN Injeksi tiroglobulin kambing (cTG) mempengaruhi kadar hormon tiroksin (T4) yang menyebabkan penurunan dari awalnya 1,772±0,123 ng/dL menjadi 1,472±0,041 ng/dL pada tikus perlakuan injeksi cTG dosis 100 µg/µl dan 1,238±0,119 ng/dL pada tikus perlakuan injeksi cTG dosis µg/µl serta mempengaruhi gambaran profil pita protein serum pada tikus yaitu menghasilkan protein spesifik dengan berat molekul 40 kDa. SARAN Perlu dilakukan purifikasi protein dengan berat molekul 40 kDa untuk memastikan bahwa protein tersebut merupakan protein haptoglobin serta diukur kadarnya. UCAPAN TERIMAKASIH Terimakasih kepada Direktorat Jendral Pendidikan Tinggi (DIKTI) yang telah mendanai penelitian ini sehingga penelitian ini dapat selesai sesuai dengan yang diharapkan. Terimakasih kepada Dr. Agung Pramana Warih Marhendra, MS, drh. Masdiana C. Padaga M.App.Sc, Ibu Dyah Kinasih Wuragil, S,Si., M.P., M.Sc, drh. Handayu Untari serta staf Laboratorium Biokimia dan Laboratorium Fisiologi Hewan Fakultas MIPA, Universitas Brawijaya atas dukungan,bantuan, dan kerjasama yang luar biasa untuk penyelesaian penelitian ini. DAFTAR REFERENSI Anwar, R. 2005. Fungsi Dan Kelainan Kelenjar Tiroid. Disampaikan pada pertemuan Fertilitas Endokrinologi Reproduksi bagian Obstetri dan Ginekologi RSHS/FKUP. Bandung. AOAC (Association of Official Analytical Chemist). 2005. Official Methods of Analysis. Washington DC. Castro, D. O. C. and M. D. M. Gourley. 2010. Diagnostic Testing and Interpretation of Tests for Autoimmunity. J Allergy Clin Immunol, 125(2 Suppl 2): S238– S247. Chistiakov, D.A. 2005. Immunogenetics of Hashimoto's thyroiditis. J. Autoimmune Diseases Vol.2 No.1 Ciftci G., G. F. Yarım, S. Cenesiz1 and A. Fındık. 2012. Age-Related Changes In Haptoglobin Phenotypes, Some Non-Enzymatic Antioxidants And Electrophoretic Profiles Of Serum Proteins In Rats. Turk J Biochem 37 (4) ; 457– 462. Deruiter, J. 2002. The Thyroid And Thyroid Hormones. Endocrine Pharmacotherapy Module., London. 1-16. Dodds, W. J. 2008. Thyroid Disease and Autoimmune Thyroiditis. Fall. SALUKI sightings. Ferguson D. C. 2007. Testing for hypothyroidism in dogs. Vet Clin North Am Small Anim Pract, 37:647-669 Gaffar, S. 2007. Buku Ajar Bioteknologi Molekul. Bandung: FMIPA Kimia Universitas Padjadjaran. Ganong W. F. 2008. Buku Ajar Fisiologi Kedokteran. Ed. 20. Andrianto P penerjemah. Jakarta: EGC. Terjemahan dari: Review of Medical Physiology hlm 486-507 Kaisho T. and S. Alkira. 2002. Toll-like receptors as adjuvant receptors. Biochem. Biophy. Acta; 1589: 113 Levy AP, R. Asleh, S. Blum, N.S. Levy and R. Miller-lotan. 2010. Haptoglobin: Basic and clinical aspects. Antioxidants & Redox signalling 12(2): 293-304 Mikami, E., T. Ohno, H. Matsumoto and S. Sekita. 2003. Detection of Thyroxine in Dietary Supplements Using an Enzime LinkedImmunosorbant Assay. J. of Health Sci. 49(6):547-550 Mishra, S.P., S.S. Siddiqi, A. Kashyap and Nkagrawal. 2010. Polymorphism Of Human Haptoglobin And Its Importance In Diabetic Nephropathy. J. of Nanomaterials and Bioss, 5(3): 599-603 Ng, H. P., J. P. Banga and A. W. Kung. 2004. Development of A Murine Model Of Autoimmune Thyroiditis Induced with Homologous Mouse Thyroid Peroxidase. Endocrinology vol.145, no.2, pp. 809–816. Nhanes. 2011. Autoimmune Thyroid Disorders.http://www.japi.org/thyr oid.special_jan_issue_2011/index. html. [21 Februari 2013] Oto, I. 2011. Gangguan Autoimun. http://medicastore.com/penyakit/3 320/ Gangguang_Autoimun.html. [21 Februari 2013] Pace, M. 2004. Autoimmune hypothyroidism: T cells caught in the act. Nature Medicine 10, 895 896 (2004) doi:10.1038/nm0904895 Piechotta M., M. Arndt and H. O. Hoppen. 2010. Autoantibodies against thyroid hormones and their influence on thyroxine determination with chemiluminescence immunoassay in dogs. J. Vet. Sci., 11(3):191196 Sadrzadeh S. M. H., J. Bozorgmehr. 2004. Haptoglobin Phenotypes In Health And Disorders. Amer J Clin Pathol 121:97–104. Song, XH, R. Z. Zan, C. H. Yu and F. Wang. 2010. Effects of Modified Haizao Yuhu Decoction in Experimental Autoimmune Thyroiditis Rats. Journal of Ethnopharmacology, vol.135:2, pp. 321-324. Tseng C. F., H. Y. Huang, Y. T. Yang and S. J. Mao. 2004. Purification Of Human Haptoglobin 1-1, 2-1, And 2-2 Using Monoclonal Antibody Affinity Chromatography. Prot Expres Purif 33:265–73. Ulutas B., T. Tan, P.A. Ulutaş, and G. Bayramli. 2007. Haptoglobin and serum amyloid A responses in cattle persistently infected with Bovine Viral Diarrhea Virus. Neonatol; 91(1):44–8. Weetman, A. P. 2001. Determinants of Autoimmune Thyroid Disease. Nature Immunology vol. 2, no.9, pp. 769–770. Weetman, A. P. 2004. Cellular Immune Responses in Autoimmune Thyroid Disease. Clinical Endocrinology, vol.61: no.4, pp. 405–413. Zaias J., M. Mineau., C. Cray., D. Yoon., and N. H. Altman. 2009. Reference Values for Serum Proteins of Common Laboratory Rodent Strains. Journal of the American Association for Laboratory Animal Science. Vol 48(4) : 387-390 Zhou, J. S. and H.S. Gill. 2005. Immunostimulatory Probiotic Lactobacillus rhamnosus HN001 and Bifidobacterium lactis HN019 Do Not Induce Pathological Inflammation in Mouse Model of Experimental Autoimmune Thyroiditis. International Journal of Food Microbiology, vol.103:1, pp. 97–104.