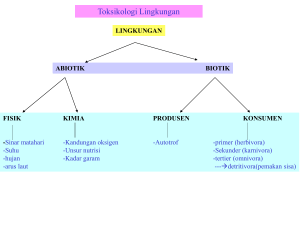
MAKALAH TOKSIKOLOGI VETERINER MEKANISME RACUN MASUK DALAM TUBUH “Disusun untuk memenuhi tugas mata kuliah Toksikologi Veteriner” Disusun oleh Nama : Yuda Afrinaldo NIM : 1802101010109 FAKULTAS KEDOKTERAN HEWAN UNIVERSITAS SYIAH KUALA BANDA ACEH 2021 i BAB I PENDAHULUAN 1.1 LatarBelakang Toksikologi adalah ilmu yang menetapkan batas aman dari bahan kimia (Casarett and Doulls, 1995). Selain itu toksikologi juga mempelajari jelas/kerusakan/ cedera pada organisme (hewan, tumbuhan, manusia) yang diakibatkan oleh suatu materi substansi/energi, mempelajari racun, tidak saja efeknya, tetapi juga mekanisme terjadinya efek tersebut pada organisme dan mempelajari kerja kimia yang merugikan terhadap organisme. Banyak sekali peran toksikologi dalam kehidupan sehari-hari tetapi bila dikaitkan dengan lingkungan dikenal istilah toksikologi lingkungan dan ekotoksikologi. Pengetahuan tentang mekanisme toksisitas suatu zat meningkatkan kemampuan untuk mencegah toksisitas dan merancang bahan kimia yang lebih diinginkan; ini merupakan dasar untuk terapi atas paparan berlebih, dan seringkali memungkinkan pemahaman lebih lanjut tentang proses biologis yang mendasar. Untuk tujuan Ensiklopedia ini, penekanan akan diberikan pada hewan untuk memprediksi toksisitas manusia. Area toksikologi yang berbeda termasuk toksikologi mekanistik, deskriptif, regulasi, forensik dan lingkungan (Klaassen, Amdur dan Doull 1991). Semua ini mendapat manfaat dari pemahaman mekanisme dasar toksisitas. 1.2 Rumusan Masalah 1. Bagaimana ? 2. Cara kerja racun di dalam tubuh? 1.3 Tujuan Penulisan 1 Tujuan penulisan ini mengetahui lebih lanjut tentang morfologi,fisiologi partus dan fisilogi laktasi kelelawar. Paparan Rute pemaparan dalam studi mekanistik biasanya sama dengan pemaparan pada manusia. Rute ini penting karena bisa ada efek yang terjadi secara lokal di lokasi paparan selain efek sistemik setelah bahan kimia diserap ke dalam darah dan didistribusikan ke seluruh tubuh. 2 Contoh efek lokal yang sederhana namun meyakinkan adalah iritasi dan akhirnya korosi pada kulit setelah aplikasi larutan asam atau alkali kuat yang dirancang untuk membersihkan permukaan keras. Demikian pula, iritasi dan kematian sel dapat terjadi pada sel yang melapisi hidung dan / atau paru-paru setelah terpapar uap atau gas iritan seperti oksida nitrogen atau ozon. (Keduanya adalah penyusun polusi udara, atau kabut asap). Setelah penyerapan bahan kimia ke dalam darah melalui kulit, paru-paru, atau saluran pencernaan, konsentrasi di setiap organ atau jaringan dikendalikan oleh banyak faktor yang menentukan farmakokinetik bahan kimia di dalam tubuh. Tubuh memiliki kemampuan untuk mengaktifkan serta mendetoksifikasi berbagai bahan kimia seperti yang disebutkan di bawah ini. Peran Farmakokinetik dalam Toksisitas Farmakokinetik menggambarkan hubungan waktu untuk penyerapan, distribusi, metabolisme kimia (perubahan biokimia dalam tubuh) dan eliminasi atau ekskresi dari tubuh. Sehubungan dengan mekanisme toksisitas, variabel farmakokinetik ini dapat menjadi sangat penting dan dalam beberapa kasus menentukan apakah toksisitas akan terjadi atau tidak. Misalnya, jika suatu bahan tidak terserap dalam jumlah yang cukup, toksisitas sistemik (di dalam tubuh) tidak akan terjadi. Sebaliknya, bahan kimia yang sangat reaktif yang didetoksifikasi dengan cepat (detik atau menit) oleh enzim pencernaan atau hati mungkin tidak memiliki waktu untuk menyebabkan toksisitas. Beberapa bahan dan campuran polisiklik halogenasi serta logam tertentu seperti timbal tidak akan menyebabkan toksisitas yang signifikan jika ekskresi cepat; tetapi akumulasi ke tingkat yang cukup tinggi menentukan toksisitasnya karena ekskresi tidak cepat (kadang-kadang diukur dalam beberapa tahun). Untungnya, sebagian besar bahan kimia tidak memiliki retensi yang lama di dalam tubuh. Akumulasi bahan yang tidak berbahaya tetap tidak akan menyebabkan toksisitas. Laju eliminasi dari tubuh dan detoksikasi sering disebut sebagai waktu paruh bahan kimia, yaitu waktu 50% bahan kimia dikeluarkan atau diubah menjadi bentuk tidak beracun. 3 Namun, jika bahan kimia terakumulasi dalam sel atau organ tertentu, itu mungkin menandakan alasan untuk memeriksa lebih lanjut potensi toksisitasnya di organ itu. Barubaru ini, model matematika telah dikembangkan untuk mengekstrapolasi variabel farmakokinetik dari hewan ke manusia. Model farmakokinetik ini sangat berguna dalam menghasilkan hipotesis dan menguji apakah hewan percobaan dapat menjadi representasi yang baik untuk manusia. Banyak bab dan teks telah ditulis tentang subjek ini (Gehring et al. 1976; Reitz et al. 1987; Nolan et al. 1995). Contoh sederhana dari model fisiologis digambarkan pada gambar 1. Gambar 1. Model farmakokinetik yang disederhanakan Tingkat dan Sistem yang Berbeda Dapat Terkena Dampak Buruk Toksisitas dapat dijelaskan pada tingkat biologis yang berbeda. Cedera dapat dievaluasi pada keseluruhan orang (atau hewan), sistem organ, sel atau molekulnya. Sistem organ meliputi sistem kekebalan tubuh, pernapasan, kardiovaskular, ginjal, endokrin, pencernaan, muskoloskeletal, darah, reproduksi, dan saraf pusat. Beberapa organ kunci termasuk hati, ginjal, paruparu, otak, kulit, mata, jantung, testis atau ovarium, dan organ utama lainnya. Pada tingkat seluler / biokimia, efek samping termasuk gangguan pada fungsi protein normal, fungsi reseptor endokrin, penghambatan energi metabolik, atau penghambatan atau induksi enzim xenobiotik (zat asing). Efek merugikan pada tingkat molekuler termasuk perubahan fungsi normal transkripsi DNA-RNA, pengikatan reseptor inti dan sitoplasma tertentu, dan gen atau produk 4 gen. Pada akhirnya, disfungsi dalam sistem organ utama kemungkinan besar disebabkan oleh perubahan molekuler pada sel target tertentu di dalam organ itu. Namun, tidak selalu mungkin untuk melacak mekanisme kembali ke asal molekuler penyebab, juga tidak perlu. Intervensi dan terapi dapat dirancang tanpa pemahaman yang lengkap tentang target molekuler. Namun, pengetahuan tentang mekanisme spesifik toksisitas meningkatkan nilai prediksi dan akurasi ekstrapolasi bahan kimia lain. Gambar 2 adalah representasi diagram dari berbagai tingkatan di mana gangguan proses fisiologis normal dapat dideteksi. Tanda panah menunjukkan bahwa konsekuensi terhadap individu dapat ditentukan dari atas ke bawah (paparan, farmakokinetika hingga toksisitas sistem / organ) atau dari bawah ke atas (perubahan molekuler, efek seluler / biokimia hingga toksisitas sistem / organ). Gambar 2. Perulangan mekanisme toksisitas Contoh Mekanisme Toksisitas Mekanisme toksisitas bisa langsung atau sangat kompleks. Seringkali, ada perbedaan antara jenis toksisitas, mekanisme toksisitas, dan tingkat efek, terkait dengan apakah efek samping disebabkan oleh dosis tunggal akut tinggi (seperti keracunan yang tidak disengaja), atau dosis rendah. paparan berulang (dari paparan pekerjaan atau lingkungan). Secara klasik, untuk tujuan pengujian, dosis tinggi tunggal akut diberikan dengan intubasi langsung ke dalam perut hewan pengerat atau paparan atmosfer gas atau uap selama dua hingga empat jam, mana yang paling menyerupai paparan manusia. Hewan diamati selama dua minggu setelah paparan dan kemudian organ eksternal dan internal utama diperiksa untuk mengetahui apakah ada cedera. 5 Pengujian dosis berulang berkisar dari bulan hingga tahun. Untuk spesies hewan pengerat, dua tahun dianggap sebagai studi kronis (seumur hidup) yang cukup untuk mengevaluasi toksisitas dan karsinogenisitas, sedangkan untuk primata non-manusia, dua tahun akan dianggap sebagai studi subkronis (kurang dari seumur hidup) untuk mengevaluasi toksisitas dosis berulang. Setelah pemaparan, pemeriksaan lengkap semua jaringan, organ, dan cairan dilakukan untuk menentukan efek samping. Mekanisme Toksisitas Akut Contoh berikut khusus untuk efek akut dosis tinggi yang dapat menyebabkan kematian atau ketidakmampuan yang parah. Namun, dalam beberapa kasus, intervensi akan menghasilkan efek sementara dan sepenuhnya dapat dibalik. Dosis atau tingkat keparahan paparan akan menentukan hasilnya. Asfiksia sederhana. Mekanisme toksisitas untuk gas lembam dan beberapa zat non reaktif lainnya adalah kekurangan oksigen (anoksia). Bahan kimia ini, yang menyebabkan kekurangan oksigen ke sistem saraf pusat (SSP), disebut asfiksia sederhana. Jika seseorang memasuki ruang tertutup yang mengandung nitrogen tanpa oksigen yang cukup, penipisan oksigen langsung terjadi di otak dan menyebabkan pingsan dan akhirnya kematian jika orang tersebut tidak segera dikeluarkan. Dalam kasus ekstrim (hampir nol oksigen) ketidaksadaran dapat terjadi dalam beberapa detik. Penyelamatan bergantung pada pemindahan yang cepat ke lingkungan beroksigen. Kelangsungan hidup dengan kerusakan otak yang tidak dapat diperbaiki 6 dapat terjadi dari penyelamatan yang tertunda, karena kematian neuron, yang tidak dapat beregenerasi. Asfiksia kimiawi. Karbon monoksida (CO) bersaing dengan oksigen untuk mengikat hemoglobin (dalam sel darah merah) dan oleh karena itu menghalangi jaringan oksigen untuk metabolisme energi; dapat mengakibatkan kematian sel. Intervensi termasuk penghilangan dari sumber CO dan pengobatan dengan oksigen. Penggunaan oksigen secara langsung didasarkan pada aksi toksik CO. Asfiksia kimiawi kuat lainnya adalah sianida. Ion sianida mengganggu metabolisme sel dan pemanfaatan oksigen untuk energi. Pengobatan dengan natrium nitrit menyebabkan perubahan hemoglobin dalam sel darah merah menjadi methaemoglobin. Methaemoglobin memiliki afinitas pengikatan yang lebih besar pada ion sianida daripada target seluler sianida. Akibatnya, methaemoglobin mengikat sianida dan menjauhkan sianida dari sel target. Ini menjadi dasar terapi antidotal. Depresan sistem saraf pusat (SSP). Toksisitas akut ditandai dengan sedasi atau ketidaksadaran untuk sejumlah bahan seperti pelarut yang tidak reaktif atau yang diubah menjadi zat antara reaktif. Dihipotesiskan bahwa sedasi / anestesi disebabkan oleh interaksi pelarut dengan membran sel di SSP, yang mengganggu kemampuannya untuk mengirimkan sinyal listrik dan kimia. Meskipun sedasi mungkin tampak sebagai bentuk toksisitas ringan dan merupakan dasar untuk pengembangan anestesi awal, "dosisnya masih membuat racun". Jika dosis yang cukup diberikan dengan menelan atau menghirup, hewan tersebut bisa mati karena henti napas. Jika kematian akibat anestesi tidak terjadi, jenis toksisitas ini biasanya mudah pulih saat subjek dikeluarkan dari lingkungan atau bahan kimia tersebut didistribusikan kembali atau dihilangkan dari tubuh. 7 Efek kulit. Efek merugikan pada kulit dapat berkisar dari iritasi hingga korosi, tergantung pada bahan yang ditemui. Asam kuat dan larutan alkali tidak cocok dengan jaringan hidup dan bersifat korosif, menyebabkan luka bakar kimiawi dan kemungkinan jaringan parut. Jaringan parut terjadi karena kematian dermal, sel kulit dalam yang bertanggung jawab untuk regenerasi. Konsentrasi yang lebih rendah dapat menyebabkan iritasi pada lapisan pertama kulit. Mekanisme toksik spesifik lain pada kulit adalah sensitisasi kimiawi. Sebagai contoh, sensitisasi terjadi ketika 2,4-dinitroklorobenzena berikatan dengan protein alami di kulit dan sistem kekebalan mengenali kompleks terikat protein yang diubah sebagai bahan asing. Dalam menanggapi bahan asing ini, sistem kekebalan mengaktifkan sel khusus untuk menghilangkan zat asing dengan melepaskan mediator (sitokin) yang menyebabkan ruam atau dermatitis (lihat “Imunotoksikologi”). Ini adalah reaksi yang sama dari sistem kekebalan ketika terjadi paparan racun ivy. Sensitisasi kekebalan sangat spesifik untuk bahan kimia tertentu dan membutuhkan setidaknya dua pemaparan sebelum timbul respons. Paparan pertama membuat peka (mengatur sel untuk mengenali bahan kimia), dan paparan berikutnya memicu respons sistem kekebalan. Penghapusan dari kontak dan terapi simtomatik dengan krim anti inflamasi yang mengandung steroid biasanya efektif dalam mengobati individu yang peka. Dalam kasus yang serius atau sulit disembuhkan, imunosupresan kerja sistemik seperti prednison digunakan dalam hubungannya dengan pengobatan topikal. Sensitisasi paru-paru. Respon sensitisasi imun ditimbulkan oleh toluene diisocyanate (TDI), tetapi sasarannya adalah paru-paru. Paparan TDI yang berlebihan pada individu yang 8 rentan menyebabkan edema paru (penumpukan cairan), penyempitan bronkial, dan gangguan pernapasan. Ini adalah kondisi yang serius dan memerlukan pemindahan individu dari potensi eksposur berikutnya. Pengobatan terutama bergejala. Sensitisasi kulit dan paru mengikuti respons dosis. Melebihi tingkat yang ditetapkan untuk pajanan pekerjaan dapat menyebabkan efek yang merugikan. Efek mata. Cedera pada mata berkisar dari kemerahan pada lapisan luar (kolam renang kemerahan) hingga pembentukan katarak pada kornea hingga kerusakan pada iris (bagian mata yang berwarna). Tes iritasi mata dilakukan jika diyakini tidak akan terjadi cedera serius. Banyak mekanisme yang menyebabkan korosi kulit juga dapat menyebabkan cedera pada mata. Bahan korosif pada kulit, seperti asam kuat (pH kurang dari 2) dan alkali (pH lebih besar dari 11,5), tidak diuji pada mata hewan karena sebagian besar akan menyebabkan korosi dan kebutaan karena mekanisme yang mirip dengan yang menyebabkan korosi kulit. . Selain itu, bahan aktif permukaan seperti deterjen dan surfaktan dapat menyebabkan cedera mata mulai dari iritasi hingga korosi. Sekelompok bahan yang membutuhkan kehati-hatian adalah surfaktan bermuatan positif (kationik), yang dapat menyebabkan luka bakar, kekeruhan permanen pada kornea dan vaskularisasi (pembentukan pembuluh darah). Bahan kimia lain, dinitrofenol, memiliki efek spesifik pembentukan katarak. Ini tampaknya terkait dengan konsentrasi bahan kimia ini di mata, yang merupakan contoh spesifisitas distribusi farmakokinetik. Meskipun daftar di atas masih jauh dari lengkap, ini dirancang untuk memberikan apresiasi kepada pembaca atas berbagai mekanisme toksisitas akut. Mekanisme Toksisitas Subkronis dan Kronis 9 Jika diberikan dalam dosis tinggi tunggal, beberapa bahan kimia tidak memiliki mekanisme toksisitas yang sama seperti bila diberikan berulang kali sebagai dosis yang lebih rendah tetapi tetap toksik. Ketika satu dosis tinggi diberikan, selalu ada kemungkinan melebihi kemampuan seseorang untuk mendetoksifikasi atau mengeluarkan bahan kimia, dan ini dapat menyebabkan respon toksik yang berbeda dibandingkan ketika dosis berulang yang lebih rendah diberikan. Alkohol adalah contoh yang bagus. Alkohol dosis tinggi menyebabkan efek sistem saraf pusat primer, sedangkan dosis berulang yang lebih rendah menyebabkan cedera hati. Penghambatan antikolinesterase. Sebagian besar pestisida organofosfat, misalnya, memiliki sedikit toksisitas mamalia sampai diaktivasi secara metabolik, terutama di hati. Mekanisme kerja utama organofosfat adalah penghambatan asetilkolinesterase (AChE) di otak dan sistem saraf tepi. AChE adalah enzim normal yang menghentikan stimulasi neurotransmitter asetilkolin. Penghambatan sedikit AChE dalam waktu lama tidak dikaitkan dengan efek samping. Pada tingkat keterpaparan yang tinggi, ketidakmampuan untuk menghentikan stimulasi saraf ini menyebabkan stimulasi berlebihan pada sistem saraf kolinergik. Stimulasi berlebihan kolinergik pada akhirnya menyebabkan sejumlah gejala, termasuk henti napas, diikuti oleh kematian jika tidak diobati. Pengobatan utama adalah pemberian atropin, yang menghalangi efek asetilkolin, dan pemberian pralidoksim klorida, yang mengaktifkan kembali AChE yang dihambat. Oleh karena itu, penyebab dan pengobatan toksisitas organofosfat ditangani dengan memahami dasar biokimia dari toksisitas. 10 Aktivasi metabolik. Banyak bahan kimia, termasuk karbon tetraklorida, kloroform, asetilaminofluoren, nitrosamin, dan paraquat secara metabolik diaktifkan menjadi radikal bebas atau zat antara reaktif lainnya yang menghambat dan mengganggu fungsi sel normal. Pada tingkat keterpaparan yang tinggi, hal ini menyebabkan kematian sel (lihat "Cedera seluler dan kematian seluler"). Sementara interaksi spesifik dan target seluler masih belum diketahui, sistem organ yang memiliki kemampuan untuk mengaktifkan bahan kimia ini, seperti hati, ginjal, dan paru-paru, semuanya merupakan target potensial untuk cedera. Secara khusus, sel-sel tertentu di dalam suatu organ memiliki kapasitas yang lebih besar atau lebih kecil untuk mengaktifkan atau mendetoksifikasi zat antara ini, dan kapasitas ini menentukan kerentanan intraseluler di dalam suatu organ. Metabolisme adalah salah satu alasan mengapa pemahaman tentang farmakokinetik, yang menjelaskan jenis transformasi ini dan distribusi serta eliminasi zat antara ini, penting dalam mengenali mekanisme kerja bahan kimia ini. Mekanisme kanker. Kanker adalah ragam penyakit, dan meskipun pemahaman tentang jenis kanker tertentu meningkat pesat karena banyaknya teknik biologi molekuler yang telah dikembangkan sejak 1980, masih banyak yang harus dipelajari. Namun, jelas bahwa perkembangan kanker adalah proses multi-tahap, dan gen kritis adalah kunci untuk berbagai jenis kanker. Perubahan dalam DNA (mutasi somatik) pada sejumlah gen kritis ini dapat menyebabkan peningkatan kerentanan atau lesi kanker (lihat "Toksikologi genetik"). Paparan bahan kimia alami (dalam makanan yang dimasak seperti daging sapi dan ikan) atau bahan kimia sintetis (seperti bensin, digunakan sebagai pewarna) atau agen fisik (sinar ultraviolet dari matahari, radon dari tanah, radiasi gamma dari prosedur medis atau aktivitas industri) semuanya kontributor mutasi gen somatik. Namun, ada zat alami dan sintetis (seperti anti-oksidan) dan proses perbaikan DNA yang melindungi dan memelihara homeostasis. Jelas bahwa genetika 11 merupakan faktor penting dalam kanker, karena sindrom penyakit genetik seperti xeroderma pigmentosum, di mana terdapat kekurangan perbaikan DNA normal, secara dramatis meningkatkan kerentanan terhadap kanker kulit akibat paparan sinar ultraviolet dari matahari. Mekanisme reproduksi. Mirip dengan kanker, banyak mekanisme reproduksi dan / atau perkembangan toksisitas yang diketahui, tetapi banyak yang harus dipelajari. Diketahui bahwa virus tertentu (seperti rubella), infeksi bakteri, dan obat-obatan (seperti thalidomide dan vitamin A) akan berdampak buruk pada perkembangan. Baru-baru ini, penelitian Khera (1991), ditinjau oleh Carney (1994), menunjukkan bukti yang baik bahwa efek perkembangan abnormal pada hewan uji dengan etilen glikol disebabkan oleh metabolit asam metabolik ibu. Ini terjadi ketika etilen glikol dimetabolisme menjadi metabolit asam termasuk asam glikolat dan oksalat. Efek selanjutnya pada plasenta dan janin tampaknya disebabkan oleh proses toksikasi metabolik ini. 12 BAB II PEMBAHASAN 1. Mekanisme Racun di dalam tubuh A. Mempangaruhi kerja enzym / hormon Enzym / hormon terdiri dari protein yang kompleks, dalam bekerjanya enzym / hormon memerlukan adanya co-faktor / aktivator berupa logam berat atau vitamin. Racun bersifat menonaktifkan aktivator. B. Masuk bereaksi kedalam sel, sehingga mempengaruhi / menghambat kerja sel. C. Masuk jaringan sehingga timbul kistamine atau serotonine, yang menimbulkan reaksi alergi an kadang terjadi reaksi oksidasi sehingga dapat terjadi senyawa baru yang lebih beracun. 13 BAB III PENUTUP 3.1 Kesimpulan Maksud artikel ini adalah untuk memberikan perspektif tentang beberapa mekanisme toksisitas yang diketahui dan kebutuhan untuk penelitian di masa mendatang. Penting untuk dipahami bahwa pengetahuan mekanistik tidak mutlak diperlukan untuk melindungi kesehatan manusia atau lingkungan. Pengetahuan ini akan meningkatkan kemampuan profesional untuk memprediksi dan mengelola toksisitas dengan lebih baik. Teknik aktual yang digunakan dalam menjelaskan mekanisme tertentu bergantung pada pengetahuan kolektif para ilmuwan dan pemikiran mereka yang membuat keputusan mengenai kesehatan manusia. 14 3.2 Saran DAFTAR PUSTAKA Chao, A., Ca’cdon, R. L. Colwell, R.L., Shen, T. J. (2005) A new statistical approach for assessing similiraty of species composition with incidence dan abundancedata. Ecological Letters 8 :148 -159 Djuri S. dan Madya W. (2009). Mengenal dunia kelelawar. Balai Diklat Kehutanan Bogor. Bogor. Feldhamer, G. A. Lee, C. D. Stephe H. V., Joseph F. M. (1999). Mammalogy : Adaptin, diversity, and ecology .Mc Graw Hill. New York. 15 Lane, D.J.W., T. Kingston, Lee B.P.Y-H. (2006). Dramatic decline in bat species richness in Singapore, with implication for Southeast Asia. Journal Biol Conserv. 131:584-593. Nowak, R. M. (1995). Bats of The World. The Johns Hopkins University Press. London. Prasetyo, P.N. Noerfahmy, dan Tata, H.L. (2011). Spesies-Spesies Kelelawar Khas Agroforest Sumatera. ICRAF. Sapika, N., Ransaleleh, T.A., Kiroh H.J., Nangoy M.J.(2020) Tingkah Laku Makan, Kawin, Menyusui Dan Menyusu Kelelawar Pemakan Buah (Pteropus Alecto) Di Penangkaran/ Ex-Situ. Zootec. 40 (2) : 410 – 417 Suyanto A, (2001). Kelelawar di Indonesia. Pusat Penelitian dan Pengembangan Biologi LIPI. Bogor. Syukri A. F., Arum S. dan Indra Y. (2018). Inventarisasi Spesies Kelelawar (Chiroptera) di Kawasan Karst Gua Putrikabupaten Ogan Komering Ulu Provinsi Su-matera Selatan. Jurnal Penelitian Sains. 20 (2) :68- 6 Wiyatna, M. F. (2003). Potensi Indonesia sebagai penghasil Guano Fosfat Kelelawar. IPB. 16