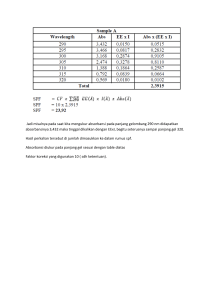
Pengantar Praktikum Tien Bagian Biokimia Fakultas Kedokteran Universitas Halu Oleo OUTLINE • • • • • • Uji Makromolekul: Karbohidrat, Lipid, Protein Membran Biologi Larutan Penyangga Spektrofotometer Enzim Bioinformatika Tes Karbohidrat • • • • • Tes Molisch Tes Seliwanoff Tes Benedict Tes Barfoed Tes Amilum dengan iodium Tes Molisch Tujuan: Mengidentifikasi adanya karbohidrat baik monosakarida, disakarida, dan polisakarida Prinsip: Adanya karbohidrat dideteksi melalui pembentukan senyawa furfural atau turunannya akibat reaksi dehidrasi oleh asam sulfat Hasil positif: terbentuk warna ungu pada sampel yang mengandung karbohidrat Tes Seliwanoff Tujuan: Mengidentifikasi adanya ketosa Prinsip: Pembentukan 4-hidroksil furfural Hasil positif: terbentuk warna merah pada sampel yang mengandung ketika Tes Benedict Tujuan: Mengidentifikasi adanya gula pereduksi Prinsip: Reaksi reduksi larutan tembaga alkalis oleh gula yang memiliki gugus aldehid atau keton Hasil positif: terbentuk endapan warna merah bata pada sampel yang mengandung ketika Tes Barfoed Tujuan:Membedakan monosakarida dan disakarida Prinsip: Reaksi reduksi oleh gugus aldehid atau keton pada suasana asam Hasil positif: terbentuk endapan warna merah bata pada sampel yang mengandung ketika Tes Amilum dengan iodium Tujuan: Mengidentifikasi adanya polisakarida seperti pati (amilum) Prinsip: Pembentukan kompleks iod amilum Hasil positif: terbentuk warna biru keunguan atau merah anggur pada sampel yang mengandung ketika Pati dapat bereaksi dengan iodin 9 Tes Lipid • Daya Larut Lemak • Ikatan Tidak Jenuh • Reaksi Liebermann-Buchard Terhadap Kolesterol Daya Larut Lemak Tujuan:Mengidentifikasi kelarutan lemak pada berbagai macam pelarut Prinsip: Like dissolve like Hasil positif: Lemak tidak larut pada air dan alkohol dingin Lemak larut pada alkohol panas dan eter Ikatan Tidak Jenuh Tujuan:Mengidentifikasi adanya asam lemak jenuh atau asam lemak tidak jenuh Prinsip:Terjadi reaksi adisi pada ikatan rangkap asam lemak tidak jenuh dan menghilangkan warna pereaksi KMnO4 Hasil positif: Warna KMnO4 hilang Reaksi Liebermann-Buchard Terhadap Kolesterol Tujuan: Mengidentifikasi adanya kolesterol Prinsip:Kolesterol dengan asam asetat anhidrida dan asam sulfat pekat membentuk senyawa yang berwarna biru hijau Hasil positif: Terbentuk senyawa berwarna biru hijau Tes Protein • Reaksi Biuret • Reaksi Ninhidrin • Uji Pengendapan ion logam dan senyawa organik Reaksi Biuret Tujuan:Mengidentifikasi adanya ikatan peptida Prinsip:Pembentukan senyawa kompleks berwarna ungu oleh reaksi ion tembaga dan ion logam pada suasana basa Hasil positif: warna berubah menjadi ungu Reaksi Ninhidrin Tujuan:Mengidentifikasi adanya gugus amina Prinsip:Asam amino bereaksi dengan ninhidrin membentuk aldehid yang lebih rendah dengan melepaskan NH3 dan CO2 Hasil positif: Terbentuk warna biru dan tercium bau amoniak Reaksi Ninhidrin O O OH RCHCOO + OH O O N NH 3+ O O anion berwarna ungu + RCHO+ CO2 + H2O + H+ Uji Pengendapan ion logam dan Pereaksi Alkaloid Tujuan: mengidentifikasi protein berdasarkan pengendapan dengan logam dan pereaksi alkaloid Prinsip: pembentukan garam proteinat yang tidak larut Hasil positif: terbentuk presipitat (endapan) Membran Biologi • Hemolisis sel darah merah • Pengaruh larutan hipertonik/hipotonik terhadap membran sel darah merah Red Blood Cells (erythrocytes) The figure is found at http://www.biosbcc.net/doohan/sample/htm/Blood%20cells.htm (March 2007) Penyusun Sel Darah Merah Fragilitas Osmotik • • • Disebut juga uji resistensi osmotik eritrosit Osmotik : gerakan molekul pelarut melewati membran semi permeabel ke larutan yang lebih pekat Tes untuk mengukur resistensi sel darah merah menahan terjadinya hemolisis (destruksi sel darah merah) ketika terpapar oleh perubahan salinitas lingkungan di sekitarnya What happens to red blood cells when placed in hypotonic, hypertonic, and isotonic solutions? • osmolarity (285 mosmol/l) • acanthocytes • hemolysis (blood, plasma) The figure is found at http://www.vet.purdue.edu/depts/bms/nour/bms520/content/blood/b9.htm (March 2007) Lingkungan Sel Darah Merah • Isotonis: larutan fisiologis NaCl 0,9% yang sama dengan cairan tubuh atau darah • Hipotonis: larutan fisiologis lebih kecil dari NaCl 0,9 % (0,8 %; 0,6 %; 0,3 %; 0,1 %) • Hipertonis: larutan fisiologis lebih besar dari NaCl 0,9 % ( 1 %; 2 %) Hemolisis Sel Darah Merah Tujuan: Memperlihatkan bahwa membran sel darah merah dapat mengalami lisis dalam pelarut organik Prinsip:Membran sel darah merah (SDM) antara lain mengandung lipid. Bila SDM dimasukkan kedalam larutan yang mengandung pelarut organic, maka lipid membrane akan larut, sehingga terjadi hemolisis Hasil NaCl 0,9% Alkohol Kloroform, eter, aseton, toluene Pengaruh Larutan Hipertonik/Hipotonik Terhadap Membran Sel Darah Merah Tujuan: Memperlihatkan pengaruh larutan hiper/ hipotonik terhadap membrane sel darah merah Prinsip:SDM akan mengkerut bila berada dalam larutan hipertonik terhadap tekanan osmotic plasma. Dalam larutan yang hipotonik, cairan dari luar sel masuk kedalam sel sehingga SDM akan membengkak, dan akhirnya terjadi hemolisis. Haemoglobin dalam SDM akan larut dalam larutan, sehingga member warna merah jernih pada larutan. Hasil positif: Terjadi hemolisis, krenasi, atau tidak berwarna pada konsentrasi NaCl tertentu Derajat Hemolisis • • • • 0 = tidak merah 1 = merah pudar 2 = merah 3 = merah terang Larutan Penyangga (Buffer) Tujuan :Menentukan pH buffer asetat berdasarkan rumus Henderson-Hasselbach dan menggunakan pH-meter Prinsip : Berdasarkan persamaan HendersonHasselbach menyatakan ketika [A-] sebanding dengan [HA], maka pH sebanding dengan pKa Larutan Penyangga (Buffer) Buffer : Larutan asam lemah / basa lemah dengan garam konjugasinya Penambahan sedikit asam, basa, atau pengenceran pada larutan penyangga hanya menimbulkan sedikit Sistem Kimia Buffer Henderson-Hasselbalch Equation Rearranged form of Ka equilibrium equation: [H ][ A ] Ka [HA] Take log of both sides: [H ][ A ] [ A ] log K a log log[H ] log [HA] [HA] rearrange: [A-]/[HA] pH 100:1 pKa + 2 10:1 pKa + 1 1:1 pKa 1:10 pKa - 1 1:100 pKa - 2 [ A ] log[H ] log K a log [HA] pH pKa [ A ] pH pK a log [HA] Sistem Buffer • Intracellular Buffers – Proteins – Haemoglobin – Phosphate • Extracellular Buffers – Proteins – Phosphate – Bicarbonate Spektrofotometer Tujuan: Mengetahui prinsip kerja spektrofotometer Spektrofotometer Instrumen yang digunakan untuk menentukan kadar suatu zat dalam sampel Hubungan antara konsentrasi dengan jumlah cahaya yang diserap dinyatakan dalam hukum Beer-Lambert : A=kxcxl SPECTROPHOTOMETER Electromagnetic spectrum • Visible light (400-700 nm) constitutes only a small portion of the spectrum that ranges from gamma rays (less than 1 pm long) to radio waves that are thousands of meters long SPECTROPHOTOMETER Percobaan Menggunakan Spektrofotometer 1. Menentukan panjang gelombang maksimum 2. Membuat kurva standar 3. Menentukan kadar sampel berdasarkan kurva standar 1. Menentukan panjang gelombang maksimum LARUTAN TABUNG B TABUNG U - 2 ml 5 ml 5 ml 5 ml 3 ml Larutan glukosa 1 mg/mL Larutan DNS Dipanaskan dalam air mendidih selama 5 menit Didinginkan dalam es batu Air suling Ukur absorbansi pada panjang gelombang 500-600 nm Hasil Percobaan Panjang gelombang (nm) Serapan (abs) Panjang gelombang (nm) 500 560 510 570 520 580 530 590 540 600 550 Serapan (abs) Kurva panjang gelombang maksimum 2. Membuat kurva standar LARUTAN TABUNG B TABUNG U Larutan glukosa 1 , 2, 4, 6, 8, 10 mg/mL - 2 ml 5 ml 5 ml 5 ml 3 ml Larutan DNS Dipanaskan dalam air mendidih selama 5 menit Didinginkan dalam es batu Air suling Ukur absorbansi pada panjang gelombang yang diperoleh pada percobaan 1 Hasil Percobaan Kadar glukosa (mg/ml) 1 2 4 6 8 10 Serapan (A) pada λmaks Kurva panjang gelombang maksimum Tentukan persamaan linier kurva standar; y = ax + b 3. Menentukan kadar sampel berdasarkan kurva standar LARUTAN TABUNG B TABUNG U - 2 ml 5 ml 5 ml 5 ml 3 ml Larutan G1, G2, G3 Larutan DNS Dipanaskan dalam air mendidih selama 5 menit Didinginkan dalam es batu Air suling Ukur absorbansi pada panjang gelombang yang diperoleh pada percobaan 1 Hasil Percobaan Larutan Serapan (Abs) Kadar (%) G1 G2 G3 Hitung kadar masing-masing larutan menggunakan persamaan linier kurva standar; y = ax + b Faktor-faktor yang mempengaruhi aktivitas enzim Tujuan : Memahami faktor yang mempengaruhi aktivitas enzim Faktor yang mempengaruhi aktivitas enzim : 1. Suhu 2. pH 3. Kadar enzim 4. Kadar substrat 5. Pengaruh ion logam Enzim Amilase Saliva Membuat liur 100X: 0,5 mL + 49,5 mL Suhu • Tujuan : Mengetahui bahwa aktivitas enzimatik dapat dipengaruhi oleh suhu • Prinsip : Pada suhu tertentu (suhu optimum) akan mencapai kecepatan reaksi yang tinggi untuk mengubah substrat menjadi produk. Prosedur LARUTAN Larutan pati 1% TABUNG B 1 ml TABUNG U 1 ml Keram pasangan tabung dari tiap suhu minimal selama 5 menit Liur (diencerkan 100x) - 200 µl Campurkan baik-baik, inkubasi lagi dari tiap suhu tepat 1 menit Larutan DNS (untuk suhu 60oC dan 100 oC penambahan dilakukan diluar penangas) Air suling Ukur absorbansi spektrofotometer 2 ml 2 ml 7 ml 7 ml pada panjang gelombang di percobaan Hasil Percobaan SUHU 0 oC 25 oC Suhu ruang (..oC) 37 oC 60 oC 100 oC Abs Blanko (B) Abs Uji (U) ∆Abs/MENIT (V) Kurva Suhu vs Absorbansi pH • Tujuan : Membuktikan bahwa keasaman (pH) dapat mempenguhi kecepatan reaksi enzimatik • Prinsip : Pada pH tertentu (pH optimum) akan mencapai kecepatan reaksi yang tinggi untuk mengubah substrat menjadi produk. Prosedur LARUTAN TABUNG B Larutan pati dgn berbagai pH (1, 3, 5, 7, 9, 11) Liur (diencerkan 100x) 1 ml TABUNG U 1 ml - 200 µl Campurkan baik-baik, inkubasi pada suhu 37oC tepat 1 menit Larutan DNS 2 ml 2 ml Air suling 7 ml 7 ml Ukur absorbansi spektrofotometer pada panjang gelombang di percobaan Hasil Percobaan pH 1 3 5 7 9 11 Abs Blanko (B) Abs Uji (U) ∆Abs/MENIT (V) Kurva pH vs Absorbansi Kadar Enzim • Tujuan : Membuktikan bahwa kadar enzim ikut mempengaruhi aktivitas enzim • Prinsip : Semakin tinggi kadar enzim maka kecepatan reaksi enzimatik akan semakin tinggi dan hal ini akan menghasilkan kurva yang linier Prosedur LARUTAN TABUNG B TABUNG U 1 ml Larutan pati dgn berbagai pH (1, 3, 1 ml 5, 7, 9, 11) Liur 100x, 200x, 300x, 400x dan 200 µl 500x Campurkan baik-baik, inkubasi pada suhu 37oC tepat 1 menit Larutan DNS 2 ml 2 ml Air suling 7 ml 7 ml Ukur absorbansi spektrofotometer pada panjang gelombang di percobaan Membuat larutan saliva dengan berbagai kadar • Liur 100x sebanyak 50 mL (pipet 0,5 mL liur + 49,5 mL aquadest) • Liur 200x sebanyak 1 mL (pipet 0,5 mL liur 100x + 0,5 mL aquadest) • Liur 300x sebanyak 3 mL (pipet 1 mL liur 100x + 2 mL aquadest) • Liur 400 x sebanyak 2 mL (pipet 0,5 mL liur 100x + 1,5 mL aquadest) • Liur 500x sebanyak 5 mL (pipet 1 mL liur 100x + 4 mL aquadest) Hasil Percobaan Kadar Enzim Abs Blanko (B) 100X 200X 300X 400X 500X Abs Uji (U) ∆Abs/MENIT (V) Kurva kadar enzim vs Absorbansi Kerja Beberapa Enzim 1. Enzim Urease 2. Enzim Schardinger dalam susu 3. Enzim peroksidase susu Enzim Urease Tujuan : Membuktikan bahwa kacang kedelai mengandung enzim urease Prinsip: Urease merubah uream menjadi CO2 dan NH3. Terbentuknya NH3 dapat dilihat dengan perubahan warna dari fenolftalein Enzim Schardinger dalam susu Tujuan: Membuktikan bahwa susu segar mengandung enzim Schardinger Prinsip: Penangkapan atom hidrogen dari aldehid dan sebagai H akseptor digunakan biru metil. Enzim schardinger mengkatalisis reaksi oksidasi formaldehid menjadi asam dalam suasana anaerob Hasil : Terjadi perubahan warna dari biru menjadi putih Enzim peroksidase susu Tujuan:Membuktikan bahwa susu segar mengandung enzim peroksidase Prinsip:Oksidasi benzidin yang menimbulkan warna biru