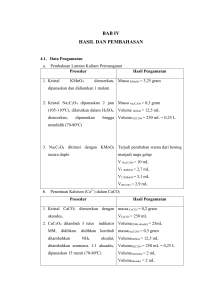
LAPORAN PRAKTIKUM KIMIA ANALITIK II “PERMANGANOMETRI” DISUSUN OLEH : NAMA : AHMAD ASRARUDDIN NIM :173145453042 KELAS : 17 B KELOMPOK : 1 (SATU) SEMESTER : 2 (DUA) PROGRAM STUDI DIII ANALISIS KESEHATAN STIKES MEGA REZKY MAKASSAR 2018 BAB I PENDAHULUAN A. Latar Belakang Permanganometri merupakan titrasi yang dilakukan berdasarkan reaksi oleh kalium permanganat (KMnO4). Reaksi ini difokuskan pada reaksi oksidasi dan reduksi yang terjadi antara KMnO4 dengan bahan baku tertentu. Titrasi dengan KMnO4 sudah dikenal lebih dari seratus tahun. Kebanyakan titrasi dilakukan dengan cara langsung atas alat yang dapat dioksidasi seperti Fe2+, asam atau garam oksalat yang dapat larut dan sebagainya, (Yasinta, 2014). Reaksi-reaksi kimia yang melibatkan oksidasi-reduksi dipergunakan secara luas dalam analisa titrimetrik. Ion-ion dari berbagai unsur dapat hadir dalam kondisi oksidasi yang berbeda-beda, menghasilkan kemungkinan terjadi banyak reaksi redoks. Banyak dari reaksi-reaksi ini memenuhi syarat untuk digunakan dalam analisa titrimetrik, dan penerapan-penerapannya cukup banyak, (Underwood, 2002 : 287). Berdasarkanuraian diatas, maka dilakukan percobaan ini untuk mengetahui standarisasi larutan KMnO4 dengan larutan baku asam oksalat dan untuk menetapkan kadar besi(II) dalam garam ferro. B. Rumusan Masalah 1. Bagaimana mengetahui standarisasi larutan KMnO4 dengan larutan baku asam oksalat. 2. Bagaimana menetapkan kadar besi(II) dalam garam ferro. C. Tujuan Percobaan 1. Untuk mengetahui standarisasi larutan KMnO4 dengan larutan baku asam oksalat. 2. Untuk menetapkan kadar besi (II) dalam garam ferro. BAB II TINJAUAN PUSTAKA Titrasi merupakan cara analis volumetrik yang digunakan dengan cara menambahkan reagen pada reagen yang lain yang mana volumenya diketahui. Penambahan dilakukan perlahan-lahan hingga titik akhir titrasi tercapai, dengan bantuan indikator. Volume yang digunakan untuk mencapai titik akhir dicatat. Jika salah salah satu larutan diketahui konsentrasinya, maka konsentrasi reagen lainnya dapat dihitung (Daintith, 1994). Pada reaksi redoks terdapat reduktor dan oksidator dimana reduktor adalah zat yang dalam reaksi mengalami oksidasi, zat yang mampu mereduksi zat lain dan zat yang dapat memberikan electron kepada zat lain sedangkan oksidator adalah zat yang dalam reaksi mengalami penurunan bilangan oksidasi, zat yang mampu mengoksidasi zat lain, zat yang menangkap elaktron dari zat lain (Keenan, 1986). Titrasi permanganometri adalah salah satu bagian dari titrasi redoks (reduksioksidasi). Rekasinya adalah merupakan serah terima elektron yaitu elektron diberikan oleh pereduksi (proses oksidasi) dan diterima oleh pengoksidasi (proses reduksi). Oksidasi adalah pelepasan elektron oleh suatu zat, sedangkan reduksi adalah pengambilan elektron oleh suatu zat. Reaksi oksidasi ditandai dengan bertambahnya bilangan oksidasi sedangkan reduksi sebaliknya. Kalium permanganat secara luas digunakan sebagai larutan standar oksidimetri dan ia dapat bertindak sebagai indikatornya sendiri (autoindikator). Perlu diketahui bahwa larutan Kalium permanganat sebelum digunakan dalam proses permanganometri harus distandarisasi terlebih dahulu, untuk menstandarisasi kalium permanganat dapat dapat dipergunakan zat reduktor seperti asam oksalat, natrium oksalat, kalium tetra oksalat, dan lain-lain. Asam Sulfat merupakan asam yang paling cocok digunakan sebagai pelarutnya karena jika digunakan asam klorida maka kemungkinan akan terjadi reaksi seperti di bawah ini: 2 MnO4- + 16 H+ + 10 Cl - ↔ 2Mn + 5Cl2 + 8 H2O dengan demikian, sebagian permanganatnya digunakan untuk pembentukan klorin. Reaksi ini terutama terjadi dengan garam-garam besi. Adanya mangan dioksida dapat mempercepat peruraian permanganat karena mangan dioksida tersebut memperbanyak pembentukan mangan dioksida sehingga peruraian bertambah cepat. Ion-ion mangan juga dapat beraksi dengan permanganate membentuk mangan dioksida menurut reaksi: 2MnO4- + 2H2O ↔ 4MnO2 + 3 O2 + 4OH. Dan sebagaimana dijelaskan diatas, reaksi ini dikatalisis oleh MnO2 padat. Kalium permanganat jika digunakan sebagai oksidator dalam larutan alkali kuat, maka ada 2 kemungkinan reaksi, yaitu pertama: reaksi yang berjalan relatif cepat: MnO4- + e- →MnO42- dan reaksi kedua yang berlangsung relatif lambat: MnO42-+ 2H2O + e-↔MnO2 + 4OH potensial standar reakasi yang pertama E0 = 0,56 volt, sedangkan pada reaksi kedua sebesar E0 = 0,60 volt. Dengan mengatur suasana sebaik-baiknya (misalnya menambah ion barium yang dapat membentuk endapan barium manganat) maka reaksi pertama dapat berjalan baik sekali, (Svehla, G., 1985) . KMnO4 merupakan zat pengoksida yang penting. Untuk analisis kimia biasanya digunakan pada larutan asam, dimana senyawa tersebut direduksi menjadi Mn2+(aq). Pada analisis besi dengan MnO4-, contoh disiapkan dengan cara yang sama untuk reaksi dan dititrasi dengan MnO4-(aq). Mn2+ mempunyai warna pink (merah muda) sangat pucat yang dapat dilihat dengan mata telanjang. MnO4- berwarna sangat cerah (ungu). Pada titik akhir titrasi larutan yang dititrasi mempunyai warna akhir pink (merah muda) pekat dengan hanya penambahan satu tetes lagi MnO4-. MnO4- kurang cocok untuk titrasi pada larutan alkali sebab hasil reduksi MnO2 yang tidak larut mengaburkan titik akhir titrasi (TAT). Titrasi lain yang menggunakan MnO 4- meliputi penentuan nitrit, H2O2 dan kalsium (setelah mengendap sebagai oksalat). Pada kimia organik MnO4- digunakan untuk mengoksidasi alkohol dan hidrokarbon tidak jenuh. Mangan dioksida, MnO2, digunakan pada sel kering, pada kaca dan lapisan keramik, dan sebagai katalis, (Petrucci, 1999). Penetapan besi dalam bijih besi merupakan salah satu penerapan yang penting dari titrasi permanganat. Bijih besi yang utama adalah oksida atau oksida terhidrasi: hemit (Fe2O3), mangnetit (Fe2O4), geotit, dan limotit (2 Fe2O3 3H2O). Asam terbaik untuk melarutkan bijih-bijih besi adalah asam klorida. Oksidasi terhidrasi mudah larut, sedangkan hematit dan magnetit melarutkan agak lambat. Sebelum titrasi dengan permanganat besi(III) harus direduksi menjadi besi(II). Reduksi ini dapat dilakukan dengan timah (II) klorida, (Underwood, 1998). BAB III METODOLOGI PERCOBAAN A. Waktu Penelitian Hari/Tanggal : Rabu/16 Mei 2018 Waktu : 15.00-17.00 WIB Tempat : Laboratorium Kimia Stikes Mega resky B. Alat dan Bahan 1. Alat a. Alat-alat gelas b. Batang pengaduk c. Botol semprot d. Hotplate e. Neraca analitik f. Sendok tanduk g. Statif dan klem h. Thermometer 2. Bahan a. Aquades b. Asam oksalat 0,033 N c. FeSO4 d. H2SO4 4 N e. Kertas label f. Kertas timbang g. KMnO4 0,1 N h. Tissue roll C. Prosedur kerja 1. Standarisasi larutan KMnO4 0,1 N dengan bahan baku asam oksalat a. Disiapkan larutan asam oksalat 0,1 N. b. Dibilas buret dengan KMnO4. c. Diisi buret dengan larutan KMnO4. d. Dipipet 25 mL larutan asam oksalat 0,01 N ke dalam erlenmeyer. e. Ditambahkan 10 mL H2SO4 4 N kemudian diencerkan sampai 100 mL dan diberi label C. f. Larutan dipanaskan sampai 70 ̊C. g. Dititrasi larutan C dengan larutan KMnO4 dalam keadaan panas hingga berubah dari tidak berwarna menjadi ungu. h. Dicatat volume KMnO4 yang digunakan. 2. Penetapan kadar besi (II) dalam garam ferro a. Ditimbang ± 500 mg besi (II) sulfat. b. Dilarutkan dengan aquades dalam erlenmeyer sampai 100 mL. c. Dipipet 25 mL larutan dan dimasukkan kedalam Erlenmeyer. d. Ditambahkan 12,5 mL H2SO4 4 N. e. Dititrasi dengan larutan KMnO4 0,1 N hingga terjadi perubahan warna dari kuning menjadi ungu. BAB IV HASIL DAN PEMBAHASAN A. Hasil Pengamatan 1. Table Hasil Pengamatan a. Standarisasi larutan KMnO4 0,1 N No. Berat H2C2O4.2H2O V KMnO4 Perubahan Warna 1 25 mL 27,5 mL Bening → ungu 2 25 mL 26 mL Bening → ungu b. Penetapan besi (II) dalam garam ferro No. Berat FeSO4 V KMnO4 Perubahan Warna 1 0,5 gram 5 mL Kuning → ungu 2 0,5 gram 5 mL Kuning → ungu 2. Reaksi a. Pembakuan KMnO4 Oks : C2O42- → 2CO2 + 2e- (x5) Red : MnO4- + 8H+ + 5e- → Mn2+ + 4H2O (x2) 5C2O42- → 10CO2 + 10e- 2MnO4- + 16H+ + 10e- → 2Mn2+ + 8H2O 5C2O42- + 2MnO4- + 16H+ → 10CO2 + 2Mn2+ + 8H2O Reaksi lengkapnya 2KMnO4 + 5H2C2O4 + 3H2SO4 → 2MnSO4 + K2SO4 + 10CO2 + 8 H2O b. Penetapan besi (II) dalam garam ferro Oks : C2O42- → 2CO2 + e- (x5) Red : MnO4- + 8H+ + 5e- → Mn2+ + 4H2O (x1) 5C2O42- → 10CO2 + 5e- MnO4- + 8H+ + 5e- → Mn2+ + 4H2O 5C2O42- + MnO4- + 8H+ → 10CO2 + Mn2+ + 4H2O Reaksi lengkapnya 10FeSO4 + 2KMnO4 +8H2SO4 → 5Fe(SO4)3 + 2MnSO4 + K2SO4 + 8H2O 3. Perhitungan a. Standarisasi larutan KMnO4 N KMnO4 = mgH2C2O4.2H2O FP x V KMnO4 x 63 = 630 mg 20 x 26,75 mL x 63 mg/mek = 630 mek 33.705 mL =0,01 mek/mL =0,01 N b. Penetapan NaCl dalam garam dapur % besi (II) = FP x V KMnO4 x N KMnO4 x 56 x 100% mg sampel = 2 x 5 mL x 0,02 mek/mL x 56 x 100% 500 mg = 2,24% B. Pembahasan Pada praktikum ini kami melakukan standarisasi larutan KMnO4 dengan larutan baku asam oksalat dan penetapan kadar besi (II) dalam garam ferro menggunakan titrasi permanganometri. Metode ini adalah titrasi yang didasarkan dari reaksi redoks. Dalam reaksi ini, ion MnO4- bertindak sebagai oksidator. Ion MnO4- akan berubah menjadi ion Mn2+ dalam suasana asam. Titrasi dilakukan hingga mencapai titik ekuivalen. Titik ekuivalen ditandai dengan berubahnya warna larutan menjadi ungu. Pada percobaan ini, KMnO4 yang digunakan dibuat sendiri oleh praktikan dengan melarutkan 6,32 gram KMnO4 dengan akuades hingga volumenya 1000 mL (diencerkan dalam labu ukur 1000 mL). Pada percobaan penetapan kenormalan KMnO4 digunakan asam oksalat 0,1 N sebagai larutan baku dan juga sebagai pereduksi dalam larutan. Pada penambahan asam sulfat 4 N berfungsi, untuk mengasamkan larutan, karena potensial elektroda KMnO4 sangat tergantung pada pH. Penambahan asam sulfat penting supaya reaksi berada dalam suasana asam sehingga MnO4- tereduksi menjadi Mn2+. Jika larutan dalam keadaan netral atau sedikit basa maka KMnO4 akan tereduksi menjadi MnO2 berupa endapan coklat yang akan mempersulit penentuan titik akhir titrasi. Setelah larutan menjadi homogen, maka dilakukan pemanasan. Pemanasan ini hingga mencapai 60°C-70°C, hal ini berfungsi agar KMnO4 dapat mengoksidasi H2C2O4 (asam oksalat) karena apabila suhu larutan dibawah 60°C70°C maka reaksi akan berjalan lambat dan akan mengubah MnO4- menjadi MnO2 yang berupa endapan cokelat sehingga titik akhir titrasi susah untuk dilihat. Sedangkan apabilasuhu larutan di atas 60°C-70°C maka akan merusak asam oksalat, dan terurai menjadi CO2 dan H2O sehingga hasil akhir akan lebih kecil. Setelah dipanaskan hingga suhunya mencapai 60°C-70°C kemudian dilakukan titrasi dengan KMnO4. Pada percobaan titrasi pertama, V KMnO4 27,5 mL didapat perubahan warna dari bening menjadi ungu dan pada percobaan titrasi kedua V KMnO4 26 mL didapat perubahan warna dari bening menjadi ungu. Perubahan warna ini merupakan titik akhir titrasi dari volume KMnO4 tersebut dan didapat konsentrasi dari KMnO4 yaitu 0,01 N. Penentuan kadar besi (II) dapat diketahui dengan cara permanganometri. Pada percobaan ini digunakan FeSO4 sebagai larutan cuplikan yang dilarutkan dalam aquades. Larutan kemudian ditambahkan asam sulfat supaya besi sulfat larut sempurna dan dapat bereaksi dengan baik. Selain untuk melarutkan besi sulfat, penambahan asam sulfat juga bertujuan untuk agar KMnO4 tereduksi menjadi Mn2+. Asam sulfat juga dimaksudkan untuk menghindari oksidasi Fe2+ menjadi Fe3+ karena Fe2+ kurang stabil diudara terbuka. Titik akhir titrasi petama ditandai dengan perubahan warna kuning menjadi ungu pada V KMnO4 5 mL dan titik akhir titrasi kedua ditandai dengan perubahan warna kuning menjadi ungu pada V KMnO4 5 mL. Dar hasil tersebut, didapatkan kadar melalui perhitungan yaitu 2,24 %. BAB V PENUTUP A. Kesimpulan Berdasarkan hasil pengamatan, dapat disimpulkan bahwa hasil standarisasi KMnO4 dengan larutan baku asam oksalat adalah 0,01 N, sedangkan hasil dari penetapan kadar besi (II) dalam larutan garam ferro adalah 2,24 %. B. Saran Disarankan agar menjaga ketertiban dalam proses praktikum serta menjaga kedisiplinan dalam proses praktikum demi kelancaran praktikum. DAFTAR PUSTAKA Keenan, W. Charles. 1986. Ilmu Kimia untuk Universitas. Erlangga. Jakarta. Petrucci, R.H. 1999. Kimia Dasar 3. Erlangga. Jakarta. Svehla, G. 1985. Analisis Anorganik Kualitatif Makro dan Semimikro Bagian I Edisi ke Lima. PT.Kalman Media Pusaka. Jakarta. Underwood. 2002. Analisis Kimia Kuantitatif edisi kelima. Erlangga. Jakarta. Yasinta. 2014. Jurnal Praktikum Kimia Analitik II Titrasi Permanganometri. Universitas Negeri Syarif Hidayatullah. Jakarta. .