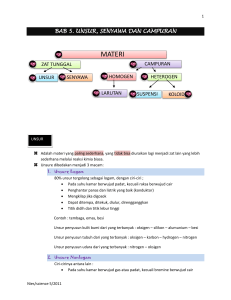
1. Sejumlah sampel zat mengandung 11,2 gram Fe dan 4,8 gram O (Ar Fe = 56 dan O = 16). Tentukan rumus empiris senyawa tersebut ? 2. Suatu senyawa hidrokarbon memiliki komposisi zat 80% unsur karbon dan 20% unsur hidrogen. Tentukan rumus empirisnya jika Ar C = 12 dan Ar H = 1. 3. Suatu senyawa mengandung 64,8 g natrium, 45,2 g belerang dan 90 g oksigen. Jika diketahui Ar N = 23, Ar S = 32, dan Ar O = 16. Maka tentukan rumus empiris senyawa tersebut ? 4. Suatu senyawa dengan rumus empiris CH (Ar C = 12 dan H = 1) mempunyai Mr = 26. Tentukan rumus molekul senyawa tersebut! 5. Suatu senyawa (Mr = 46 g/mol) mengandung massa senyawa (g) 52,14% C; 13,03% H; dan 34,75% O. Tentukan rumus molekul senyawa tersebut jika diketahui Ar H = 1, C = 12, dan O = 16. Latihan Soal Berilah nama senyawa – senyawa di bawah ini : a.P2O5 b.Ca(OH)2 c.Na3PO4 Tuliskan rumus kimia dari senyawa berikut ini : a.Belerang trioksida b.Aluminium bromida c.Kalium sulfat d.Aluminium sulfat e.Ammonium fosfat TATA NAMA SENYAWA KIMIA Senyawa Biner Senyawa Poliatomik Senyawa Asam Senyawa Basa Senyawa Biner Senyawa yg terbentuk dari 2 unsur ( logam + nonlogam atau nonlogam + nonlogam a.Penamaan senyawa biner : logam dan nonlogam Tuliskan nama unsur logam tanpa modifikasi, diikuti nama unsur nonlogam dan menambahkan akhiran “ida” Example : NaCl Li2O NaBr CsI BaCl2 : Natrium Klorida : Litium Oksida : Natrium Bromida : Cesium Iodida : Barium Klorida b. Penamaan senyawa biner : logam dan nonlogam dengan bilangan oksidasi lebih dari satu jenis Tuliskan nama unsur logam ( Indonesia )+ besarnya bilangan oksid asi ( menggunakan angka romawi ) diikuti nama unsur nonlogam dan menambahkan akhiran “ida” Tuliskan nama unsur logam diakhiri dengan huruf “o” jika biloks kecil dan huruf “i” jika biloks besar diikuti nama unsur nonlogam dan menambahkan akhiran “ida” c. Tata nama senyawa biner yang terbentuk dari Non-Logam dan Non-Logam Jumlah unsur pertama dituliskan lebih dahulu, diikuti dengan nama unsur NonLogam pertama. Kemudian, menuliskan jumlah unsur kedua, diikuti dengan nama unsur NonLogam kedua dengan diberi akhiran ida. Jumlah unsur akan dinyatakan dalam bahasa Yunani. Non-Logam A + Non-Logam B Ax By Catatan : 1 = Mono, untuk Non-Logam pertama tidak disebut Contoh : CO 2 Karbon dioksida N 2O3 Dinitrogen trioksida Senyawa Poliatomik Senyawa yg dibentuk dari ion – ion poliatomik. Pada ion poliatomik tergabung lebih dari 2 atom membentuk ikatan kovalen Senyawa Asam Senyawa gabungan H dengan atom – atom nonlogam lainnya. Cara penamaannya : Menggunakan awalan asam lalu diikuti dengan nama pasangannya dan di akhiri dengan kata “ida” Contoh : HF : Asam florida HCl : Asam klorida HBr : Asam bromida HI : Asam Iodida H2S : Asam sulfida Senyawa Basa Senyawa yg menghasilkan ion OH- ( hidroksida ) ketika dilarutkan dalam air Cara penamaannya : Menyebutkan nama unsur yg terikat dengan OH- dan diikuti dg kata hidroksida Example : KOH NaOH Mg(OH)2 : Kalium hidroksida : Natrium hidroksida : Magnesium hidroksida 1. 2. 3. 4. 5. 6. Wafiq Junio Arya Devy Fatimah Dhyajeng Fikri alfandani