Geseran kimia - kimia disekitar kita
advertisement
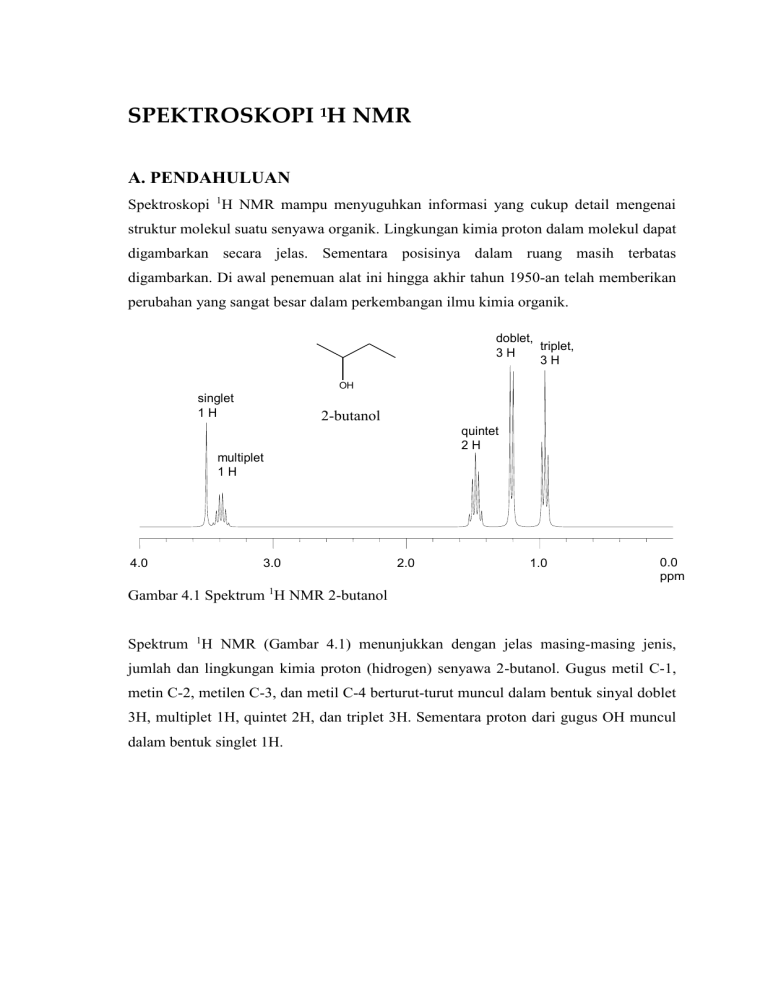
SPEKTROSKOPI 1H NMR A. PENDAHULUAN Spektroskopi 1H NMR mampu menyuguhkan informasi yang cukup detail mengenai struktur molekul suatu senyawa organik. Lingkungan kimia proton dalam molekul dapat digambarkan secara jelas. Sementara posisinya dalam ruang masih terbatas digambarkan. Di awal penemuan alat ini hingga akhir tahun 1950-an telah memberikan perubahan yang sangat besar dalam perkembangan ilmu kimia organik. doblet, triplet, 3H 3H OH singlet 1H 2-butanol quintet 2H multiplet 1H 4.0 3.0 2.0 1.0 0.0 ppm Gambar 4.1 Spektrum 1H NMR 2-butanol Spektrum 1H NMR (Gambar 4.1) menunjukkan dengan jelas masing-masing jenis, jumlah dan lingkungan kimia proton (hidrogen) senyawa 2-butanol. Gugus metil C-1, metin C-2, metilen C-3, dan metil C-4 berturut-turut muncul dalam bentuk sinyal doblet 3H, multiplet 1H, quintet 2H, dan triplet 3H. Sementara proton dari gugus OH muncul dalam bentuk singlet 1H. B. KONSEP DASAR RESONANSI MAGNET INTI Saat berputar pada sumbunya, inti atom memiliki sifat yang disebut spin inti. Inti atom yang memiliki bilangan massa ganjil dan nomer atom ganjil atau salah satunya, memiliki momen spin angular dan momen magnet tertentu. Banyaknya keadaan spin inti yang dimungkinkan, ditentukan dan dikuantitasi berdasarkan bilangan spin magnet inti (I). Keadaan spin yang dimungkin dari setiap inti dengan harga spin magnet inti (I) adalah 2I + 1. Untuk inti hidrogen yang memiliki harga I = ½ , akan memiliki 2 keadaan spin inti, yaitu - ½ dan + ½. Berikut ini harga bilangan quantum spin dari beberapa inti. Tabel 4.1. Harga Bilangan Quantum Spin dari Beberapa Inti HARGA BILANGAN QUANTUM SPIN DARI BEBERAPA INTI Unsur Bilangan Quantum Spin Inti Jumlah Keadaan Spin 1 1H 2 1H 12 6C 13 6C 14 7N 16 8O ½ 1 0 ½ 1 0 2 3 0 2 3 0 17 8O 5 19 9F 31 15P /2 ½ ½ 6 2 2 35 17Cl 3 /2 4 Keadaan spin inti memiliki tingkat energi yang berbeda dalam medan magnet, karena inti atom merupakan sebuah partikel bermuatan dan semua partikel yang bergerak akan menimbulkan medan magnet disekitarnya. Karenanya, inti atom memiliki momen magnet () akibat muatan dan spin intinya. Inti hidrogen memiliki spin - ½ (berlawanan arah) dan + ½ (searah jarum jam), serta momen magnet inti () dalam dua arah yang berlawanan. Fenomena resonansi magnet inti akan terjadi jika inti yang berada dalam lingkungan medan magnet, menyerap energi dan spin intinya mengalami perubahan orientasi sehubungan medan magnet tersebut. Besarnya energi yang diserap inti supaya proses resonansi terjadi, adalah sama dengan besarnya selisih energi antara dua keadaan spin inti, yaitu keadaan searah medan magnet (+½) dengan keadaan berlawanan arah medan magnet (-½). Besarnya selisih energi ini merupakan fungsi dari medan magnet luar (B0). Semakin besar medan magnet luar yang mempengaruhi inti semakin besar pula selisih energi keadaan dua spin inti. Selain dipengaruhi medan magnet luar, selisih energi keadaan dua spin inti juga dipengaruhi oleh apa yang disebut dengan rasio magnetogirik (). Setiap inti memiliki rasio momen magnet dengan momentum angular yang berbedabeda karena perbedaan massa dan muatan masing-masing inti. Ediserap = (Ekeadaan -½ - Ekeadaan +½) = h ∆E = f (B0) ∆E = f ( B0) = h Karena harga momentum angular inti sama dengan h/2, maka ∆E = (h/2) B0 = h = (/2) B0 Jika harga tetapan dari suatu proton dimasukkan dalam persamaan diatas, maka suatu proton yang tidak terlindungi (unshielding) akan menyerap frekuensi radiasi sebesar 42,6 MHz pada medan magnet 1 Tesla (10.000 Gauss) atau menyerap frekuensi radiasi 60,0 MHz pada medan magnet 1,41 Tesla (14.100 Gauss). Tabel berikut menunjukkan hubungan frekuensi radiasi yang diserap dengan kuat medan magnet dari beberapa inti untuk proses resonansi. Tabel 4.2. Frekuensi dan Kuat Medan Magnet Untuk Resonansi Setiap Inti Isotop 1 2 H H C 13 Kelimpahan dialam (%) Kuat medan, B0 (Tesla*) Frekuensi, (MHz) 1,00 1,41 2,35 4,70 7,05 1,00 1,00 1,41 2,35 4,70 7,05 1,00 1,00 42,6 60,0 100,0 200,0 300,0 6,5 10,7 15,1 25,0 50,0 75,0 40,0 17,2 99,98 0,0156 1,108 19 F 100,0 P 100,0 * 1 Tesla = 10.000 Gauss 31 Rasio Magnetogirik, (radian/Tesla) 267,53 41,1 67,28 251,7 108,3 Untuk sebuah proton, jika kuat medan magnet 1,41 T dan resonansi terjadi pada frekuensi 60 MHz, ∆E dari dua keadaan spin inti +½ dan -½ adalah 2.39 x 10-5 kJ/mol. Selisih energi ini sangat kecil sehingga distribusi spin inti pada keadaan +½ dan -½ hampir sama atau kelimpahan spin inti pada keadaan berenergi rendah sedikit lebih banyak dibandingkan pada keadaan berenergi tinggi. Distribusi spin inti pada dua keadaan ini dapat dihitung dengan persamaan distribusi Boltzman. N -1/2 = e- AE / k T = e- h v / k T N +1/2 h = 6,624 x 10 -34 J dt k = 1,380 x 10 -23 J/K molekul T = temperatur absolut (K) Misalkan pada temperatur 298 K (25 0C) dan frekuensi alat (instrumen) 60,0 MHz, harga N-½ / N +½ adalah 0,999991. Hal ini berarti kelimpahan inti pada keadaan +½ dan -½ perbandingannya adalah 1.000.000 : 1.000.009 atau dengan kata lain pada keadaan berenergi rendah terdapat kelebihan inti sebanyak 9 buah. Dengan cara perhitungan yang sama, dapat diketahui bahwa peningkatan frekuensi alat yang digunakan akan meningkatkan kelebihan spin inti pada keadaan berenergi rendah (+½). Dengan meningkatnya kelebihan inti pada keadaan +½ akan meningkatkan sensitivitas alat dan sinyal resonansi makin kuat karena jumlah spin inti yang mengalami transisi meningkat. Tabel 4.3. Variasi Kelebihan Inti 1H berenergi Rendah dengan Frekuensi Alat Frekuensi (MHz) 20 40 60 80 100 200 300 600 Kelebihan Inti 3 6 9 12 16 32 48 96 C. JUMLAH SINYAL PROTON Lingkungan kimia masing-masing proton berpengaruh terhadap berapa jumlah sinyal proton yang muncul pada spektrum 1H NMR. Proton yang berada dalam lingkungan kimia yang sama disebut disebut proton ekivalen secara kimia. Sebagai contoh, 1-bromo propana memiliki tiga macam proton yang ekivalen secara kimia. Tiga proton metil akan ekivalen karena rotasi ikatan C – C. Begitupula dua proton metilen pada C-2 dan dua proton metilen pada C-1. Karenanya, spektrum 1H NMR dari 1-bromopropana akan menghasilkan tiga sinyal proton yang masing-masing akan dihasilkan oleh proton metil dari C-3, proton metilen dari C-2, dan proton metilen dari C-1. 2-bromopropana memiliki dua set proton yang ekivalen sehingga akan menghasilkan dua sinyal proton pada spektrum 1H NMR. Dua gugus metil (C-1 dan C-3) akan menghasilkan satu sinyal proton karena adanya simetri dari C-2. Sinyal proton yang lagi satu adalah sinyal proton metin (C-2). Beberapa contoh senyawa lainnya terdapat pada Gambar berikut. a b CH3 CH2 a c CH2Br CH3 a a CH3 CH3 b CH a O CH3 Br 3 sinyal 2 sinyal 1 sinyal a b a a b b CH3 CH2 CH3 CH3 CH2 CH2 2 sinyal a a CH3 2 sinyal H b CH3 H H a CH3 b CH3 b a 2 sinyal H a CH3 H O CH2 b CH3 a H d CH3 H a H b H c 4 sinyal c NO 2 H a Ha H b Hb H a H H a Ha H a H H a H H a 1 sinyal c CH3 3 sinyal 2 sinyal a b a NO 2 NO 2 3 sinyal 1 sinyal a a Gambar 4.2. Hubungan Struktur Senyawa dengan Jumlah Sinyal Proton D. GESERAN KIMIA PROTON Geseran kimia berhubungan dengan frekuensi Larmor dari spin inti pada lingkungan kimianya. Frekuensi Larmor adalah frekuensi presesi dari inti dalam lingkungan medan magnet statis (tetap). Karena frekuensi Larmor berbanding lurus dengan kuat medan magnet, maka geseran kimia tidak memiliki nilai absolut. Selisih frekuensi (dalam satuan Hz) diukur dari resonansi senyawa standar TMS pada 1H dan 13 C NMR, dibagi dengan nilai absolute frekuensi Larmor standar (dalam satuan MHz). Oleh karena itu, geseran kimia dinyatakan dalam satuan bagian per juta (part per million = ppm), yaitu hasil Hz / MHz atau 1 / 106. Geseran kimia pada prinsipnya disebabkan elektron yang menyelimuti molekul sehingga timbul efek shielding terhadap spin inti. Lebih jelasnya, elektron menyebabkan efek shielding apabila arahnya berlawanan dengan arah medan magnet luar, yang selanjutnya menyebabkan frekuensi presesi dari spin inti berkurang Faktor-faktor yang Mempengaruhi Geseran Kimia Proton 1. Keelektronegatifan atom atau gugus tetangga Kerapatan awan elektron yang mengelilingi suatu proton akan berpengaruh terhadap seberapa mudah proton tersebut untuk beresonansi. Awan elektron yang tebal akan mengurangi efek medan magnet luar terhadap proton tersebut. Akibatnya, agar dapat beresonansi diperlukan medan magnet yang lebih kuat dibandingkan dengan proton yang kerapatan elektron lebih rendah. Proton yang kerapatan elektronnya lebih tinggi biasanya disebut proton terlindungi (shielding), sementara yang sebaliknya disebut proton tak terlindungi (deshielding). Sinyal proton terlindungi akan muncul pada geseran kimia yang lebih rendah dibandingkan sinyal roton tak terlindungi. Tinggi rendahnya kerapatan elektron disekitar proton sangat dipengaruhi oleh keelektronegatifan atom atau gugus tetangganya. Meningkatnya keelektronegatifan atom atau gugus tetangga akan mengurangi kerapatan elektron yang menyelimuti suatu proton sehingga akan muncul pada geseran kimia yang lebih besar. Hal sebaliknya akan terjadi jika kerapatan elektron atom atau gugus tetangga bertambah. Tabel berikut menunjukan hubungan keelektronegatifan atom atau gugus tetangga terhadap geseran kimia proton. Tabel 4.4. Hubungan Keelektronegatifan Atom Tetangga dengan Geseran Kimia No Senyawa Geseran Kimia ( ) Kelektronegatifan 1 CH3F 4.26 F : 3.98 2 CH3Cl 3.05 Cl : 3.16 3 CH3Br 2.68 Br : 2.96 4 CH3I 2.16 I : 2.66 5 CH2Cl2 5.30 6 CHCl3 7.27 7 CH3CCl3 2.70 8 (CH3)4C 0.86 C : 2.55 9 (CH3)4Si 0.00 * Si : 1.90 * TMS (tetrametilsilan) sebagai pembanding 2. Efek Hibridisasi Hibridisasi atom karbon dimana proton itu terikat juga berpengaruh terhadap geseran kimianya. Kerapatan elektron yang menyelimuti proton sp3 akan lebih teal (tinggi) dibandingkan dengan proton pada karbon sp2 dan sp. Karenanya, proton sp3 akan muncul pada geseran kimia yang lebih kecil (mengalami efek shielding), yaitu pada 0 - 2 ppm. Hal yang kontradiktif justru terlihat pada proton yang terikat pada karbon sp2 dengan karbon sp. Kerapatan elektron yang menyelimuti proton pada karbon sp lebih rendah dibandingkan proton pada karbon sp2, sehingga geseran kimia proton sp seharusnya lebih besar dibandingkan dengan proton sp2. Geseran kimia proton sp2 dan sp berturut-turut adalah 4,5 - 7 ppm dan 2 - 3 ppm. Hal ini terjadi karena adanya awan elektron tak simetris (efek anisotropi). Jenis proton yang terikat pada karbon sp3 mulai CH3, CH2, dan CH, juga memiliki tren geseran kimia kimia yang menarik. Perubahan dari CH3, CH2, CH akan dibarengi dengan berkurangnya kerapatan elektron yang menglilingi proton, sehingga geseran kimianya semakin besar. 3. Proton asam, proton ikatan hidrogen dan proton yang dapat ditukar Kerapatan elektron yang menyelimuti proton asam sangat rendah, sehingga untuk beresonansi memerlukan medan magnet yang sangat kecil. Geseran kimia proton asam berkisar pada 10 -12 ppm. Proton yang berada dalam bentuk ikatan hidrogen memiliki geseran kimia yang bervariasi dengan kisaran geseran kimia yang besar. Temperatur dan konsentrasi sangat berpengaruh terhadap keberadaan ikatan hidrogen. Ikatan hidrogen semakin lemah seiring dengan naiknya temperatur, sehingga kerapatan elektron yang menyelimuti proton semakin bertambah. Hal ini akan menyebabkan perubahan geseran kimia menjadi lebih kecil. Seperti efek temperatur, perubahan konsentrasi akan mempengaruhi eksistensi ikatan hidrogen. Semakin encer konsentrasi suatu larutan akan menyebabkan jarak antar molekul semakin jauh, sehingga peluang terbentuknya ikatan hidrogen semakin kecil. Semakin encer konsentrasi larutan akan menyebabkan penurunan geseran kimia proton. Geseran kimia proton dalam larutan pekat berkisar 4 - 5 ppm, sementara dalam larutan encer berkisar 0,5 - 1,0 ppm. Untuk proton yang dapat ditukar, geseran kimianya sangat bervariasi mengingat pertukaran dapat terjadi antar proton dalam molekul yang berbeda dan antar proton dengan pelarut. Bahkan pertukaran proton dengan pelarut dapat menghilangkan sinyal proton tersebut, karena pelarut yang lazim digunakan dalam pengukuran 1 H NMR adalah pelarut terdeuterosasi. Pada pelarut terdeuterosasi, semua proton disubstitusi dengan deuterium (2H) yang tidak terdeteksi dalam 1H NMR, sehingga diharapkan tidak menggangu sinyal proton dari sampel yang diukur. 4. Efek anisotropi Ada anomali geseran kimia proton yang terikat pada atom karbon dengan sistem tak jenuh (memiliki elektron ). Misalnya proton pada benzena. Dalam lingkungan medan magnet, elektron dari cincin aromatik akan terinduksi untuk berputar sekitar cincin. Perputaran elektron ini disebut putaran arus (ring current). Perputaran elektron ini akan menimbulkan medan magnet, yang nantinya berpengaruh terhadap ketebalan elektron yang mengelilingi proton benzena. Efek anisotropi ini akan menyebabkan efek deshielding (berkurangnya ketebalan elektron) disekitar proton benzena. Akibatnya, proton benzena menjadi lebih mudah beresonansi dibandingkan proton alkena. Hal yang sama juga terjadi pada proton dari aldehid. Adanya elektron pada gugus karbonil menimbulkan efek deshielding, sehingga proton aldehid beresonansi pada energi yang rendah. Sementara proton yang secara stereokimia berada diatas cincin benzena (aromatik) dan proton pada alkuna akan mengalami efek shieding. Perputaran elektron justru menambah ketebalan awan elektron yang mengelilinginya, sehingga memerlukan energi yang lebih tinggi untuk beresonansi. Efek anisotropi elengkapnya digambarkan pada Gambar berikut. Gambar 4.3. Efek anisotropi pada proton benzena dan alkena E. INTEGRASI PROTON Spektrometer NMR memiliki kemampuan secara elektronik untuk mengintegrasikan luas area dibawah puncak. Garis integral akan muncul pada spektrum dari setiap puncak yang tingginya sebanding dengan luas area puncak tersebut. Pada spektrometer NMR yang modern, garis itegral biasanya tidak dimunculkan, tetapi luas area dari setiap puncak akan ditampilkan dalam bentuk angka. Luas area dibawah puncak sebanding dengan jumlah hidrogen (proton) dari puncak tersebut. Luas area masing-masing puncak dalam satu spektrum dibandingkan satu sama lain sehingga diperoleh perbandingan angka bulat sederhana. Misalnya pada 1-bromo-2,2-dimetilpropana akan terdapat dua sinyal proton yang mewakili proton CH2, dan CH3 dengan perbandingan tinggi puncak integral 1,6 : 7,0 atau 1 : 4,4. Untuk memperoleh perbandingan bulat sederhana, dilakukan perkalian 2 sehingga diperoleh rasio 2 : 8,8. Jika dibulatkan akan menjadi 2 : 9 (kesalahan pengukuran integral sekitar 10 % karena eksperimen error). Gambar 4.4. Pengukuran rasio integral dari 1-bromo-2,2-dimetilpropana F. KOPLING SPIN-SPIN Kopling scalar atau tak langsung dari spin inti melalui ikatan kovalen akan menyebabkan terjadinya splitting (pembelahan) sinyal NMR menjadi multiplet pada spektroskopi NMR resolusi tinggi. Kopling dipol atau kopling secara langsung diantara spin inti melalui ruang hanya dapat teramati pada NMR padatan. Dalam larutan, kopling dipole akan hilang akibat adanya pergerakan molekul. Kopling konstan Kopling konstan adalah perbedaan frekuensi (J) dalam satuan Hz antara dua garis multiplet sederhana. Besarnya harga kopling konstan tidak tergantung pada kuat medan magnet. Besarnya harga kopling konstan menunjukkan seberapa kuat suatu inti dipengaruhi oleh spin inti tetangganya. Kopling konstan merupakan bukti adanya interaksi antar inti yang berdekatan. Pada spektroskopi NMR resolusi tinggi, kopling dapat terjadi melalui satu ikatan (kopling sederhana), dua ikatan (kopling geminal), tiga ikatan (kopling vicinal), empat dan lima ikatan (kopling jarak jauh). Kopling dapat terjadi antar inti 1H, 2D, 13C, 19F, dan 31P. Namun, kopling yang akan dibahas pada bab ini adalah kopling antar 1H dengan 1H, dan terbatas dalam bentuk kopling dua ikatan dan kopling tiga ikatan. J = 7,0 Hz J = 7,0 Hz J = 7,0 Hz 2.0 1.0 ppm Gambar 4.5. Ilustrasi tentang kopling konstan Perubahan harga kopling konstan biasanya menandakan (ciri) dari struktur molekul atau menandakan posisi stereokimia dari kedua inti. Cis-alkena dengan trans-alkena dapat dibedakan dengan memperhatikan harga kopling konstan proton vinilnya. Sudut dihedral () antara dua proton yang saling kopling akan menentukan besarnya harga kopling. Secara matematis, hubungan antar sudut dihedral () kedua proton dengan harga tetapan kopling digambarkan dalam bentuk kurva Karplus. Besarnya harga kopling juga dapat dihitung dengan persamaan Karplus yaitu : JHH = A + B cos + C cos 2 (dimana A=7, B= -1, C =5) H H Sudut dihedral () Gambar 4.6. Hubungan sudut dihedral proton () dengan harga kopling (J) Hubungan antara sudut dihedral proton () dengan harga kopling terlihat jelas pada senyawa turunan ter-butilsikloheksana. Gugus ter-butil merupakan gugus yang besar sehingga akan memilih konformasi equatorial untuk mengurangi energi tolakan dalam molekul. Dua proton bertetangga dengan sudut dihedral yang berbeda akan menghasilkan kopling konstan yang berbeda pula. a,a e,e HA HA (H3C)3C (H3C)3C HB HB J = 10 - 14 Hz J = 4 - 5 Hz a,e (H3C)3C HA HB J = 4 - 5 Hz Tabel 4.6. Jenis dan Harga Kopling Konstan (Hz) Yang Lazim dijumpai Beberapa Tetapan Kopling Tiga Ikatan (JXY) H–C–C–H 6 – 8 Hz C–C–C–H 5 Hz F–C–C–H 5 – 20 Hz 13 19 F – C – C – 19F P–C–C–H 31 P–O–C–H H–C=C–H cis 6 – 15 Hz trans 11 – 18 Hz cis 18 Hz trans 40 Hz cis 30 – 40 Hz trans -120 Hz H – C = C – 19F 19 F – C = C – 19F -3 – (-20) Hz 13 Hz 5 – 13 Hz 19 31 Tabel 4.7. Variasi Harga Kopling dengan Sudut Velensi dari Alkena Siklik (Hz) H H H H 0-2 2-4 H H H H H H 5-7 8 - 11 6 - 15 E. PEMECAHAN SPIN INTI Pemecahan spin inti terjadi karena dalam medan magnet, spin inti proton tetangga dapat mempengaruhi efek medan magnet yang diterima oleh suatu proton yang diamati. Spin inti proton tetangga ini dapat memperkuat dan memperlemah medan magnet luar yang dirasakan suatu proton, akibatnya proton tersebut selain akan mengalami efek shielding juga akan mengalami efek deshielding. Efek shielding akan terjadi bila spin inti proton tetangga posisinya berlawanan arah dengan arah medan magnet luar. Hal sebaliknya terjadi bila spin inti proton tetangga searah dengan arah medan magnet luar. Adanya gangguan ini akan dapat memberikan informasi tentang jumlah proton tetangga dari proton yang diamati. E.1 Pemecahan Spin Orde Satu (n+1) Proton yang mengikuti aturan pemecahan spin orde satu akan mempunyai sinyal proton dengan multiplisitas n+1, dimana n merupakan jumlah proton tetangga. Dalam hal ini, harga selisih frekuensi antara geseran kimia dua inti yang berinteraksi jauh lebih besar dari harga konstanta kopling (∆/J > 10). Sebagai contoh sinyal proton CH3 dan CH2 pada spektrum 1H NMR dari etil bromida. Sinyal proton CH3 muncul triplet (tiga puncak) akibat pemecahan proton tetangganya CH2 (memiliki 2 proton), begitu pula dengan proton CH2 yang muncul kuartet (empat puncak) akibat pemecahan proton CH3 (memiliki 3 proton). Sementara sesama proton CH2 dan CH3 tidak terjadi pemecahan karena identik secara kimia. CH3 – CH2 - Br CH3 CH2 3.0 4.0 5.0 2.0 1.0 0.0 Gambar 4.7. Spektrum 1H NMR etilbromida Secara umum pemecahan spin orde satu mengikuti aturan segitiga Pascal, baik dari segi multiplisitas (jumlah) maupun dari intensitas puncak. Sinyal proton doblet (dua puncak) memiliki intensitas puncak relatif 1 : 1, sinyal proton triplet (tiga puncak) memiliki intensitas relatif 1 : 2 : 1, dan begitu seterusnya seperti tertera pada tabel berikut. Tabel 4.8. Intensitas Relatif dan Pola Umum Pemecahan Spin Proton Jumlah Proton tetangga Sinyal proton 0 1 2 3 4 5 6 Singlet Doblet Triplet Kuartet Kuintet Sektet Septet Intensitas relatif 1 1 1 1 1 1 1 3 4 5 6 1 2 6 10 15 1 3 1 4 10 20 1 5 15 1 6 1 E.2 Pemecahan Multiplikatif Jika perbedaan geseran kimia dua inti yang berintaraksi kurang dari 10 kali harga konstanta kopling (J), maka spektrum dengan pemecahan multiplikatif (orde dua) yang terlihat. Seperti halnya pemecahan orde satu, setiap inti memecah spektrum inti tetangganya menjadi dua. Namun karena harga konstanta koplingnya berbeda-beda, peluang berhimpitnya puncak dalam satu sinyal inti menjadi lebih kecil, sehingga peluang menemukan sinyal inti yang mengikuti pola segitiga Pascal semakin kecil pula. Sebagai contoh adalah spektrum 1H NMR vinil etanoat berikut. Proton b dan c berbeda secara kimia maupun magnetik sehingga memiliki geseran kimia dan konstanta kopling yang berbeda. Antara proton b, c, dan d terjadi saling kopling sehingga tiap proton memiliki multiplisitas doblet-doblet. Hb C Hc Hd C CH3 2,15 ppm singlet a O C CH3 O Hd 7,28 ppm dd 7,0 dan 14 Hz Hc 4,88 ppm dd 1,5 dan 14 Hz Gambar 4.8. Spektrum 1H NMR viniletanoat Hb 4,05 ppm dd 1,5 dan 7,0 Hz F. Sistem Homotopik, Enansiotopik, dan Diastereotopik Proton Saat analisis spektrum NMR dimana terdapat dua proton terikat pada satu atom karbon (proton geminal) atau ada dua gugus metil terikat pada satu atom karbon (gugus metil geminal), seringkali muncul pertanyaan apakah kedua proton tersebut identik atau tidak identik. Untuk mengetahui jawabannya, perlu dilakukan analisa apakah proton atau gugus metil tersebut termasuk kategori homotopik, enansiotopik, atau diastereotopik proton/metil. H H Proton geminal H3C CH3 Gugus metil geminal Homotopik proton Homotopik proton selalu identik, tidak ada kopling sesamanya sehingga memberikan satu serapan pada NMR. Cara sederhana untuk mengetahui homotopik proton adalah dengan cara mengganti salah satu proton dengan gugus lain. Lakukan penggantian pada salah satu proton secara bergantian sehingga akan diperoleh dua molekul yang lain. Analisa hubungan kedua molekul yang dihasilkan, apakah identik atau bukan. Homotopik metil juga dapat diuji dengan cara yang sama. Enansiotopik proton Enansiotopik proton akan memberikan satu serapan NMR, tetapi akan berbeda jika ditempatkan dalam lingkungan kiral atau direaksikan dengan reagen kiral. Pengujian enansiotopik proton atau enansiotopik gugus metil juga dilakukan dengan cara yang sama pada pengujian homotopik proton. Diastereotopik proton Diastereotopik proton merupakan tidak identik proton, sehingga memberikan serapan yang berbeda pada NMR dan akan mengalami pembelahan (spliting) satu sama lain sebesar tetapan kopling konstan geminal. HA diganti HA X HB D H H D X X X X X Homotopik HA X HB diganti Identik (tidak kiral) HB D H H D Y X Y X Y Enansiotopik Enansiomer HA HB D H H D X Y* X Y* X Y* Diastereotopik (Y* = suatu pusat kiral) Diastereomer Gambar 4.9. Analisis homotopik, enansiotopik, dan diastereotopik proton G. Benzena Tersubstitusi Cincin fenil umum ditemukan pada senyawa organik, sehingga pengetahuan tentang serapan NMR dari senyawa-senyawa ini sangat penting. Selain adanya efek anisotropi yang mampu mempengaruhi geseran kimia proton pada cincin fenil, keberadaan substituen juga sangat berpengaruh. Substituen yang bersifat pendorong elektron seperti gugus metoksi dan amino, mampu menggeser geseran kimia proton kearah shielding, sebaliknya substituen yang bersifat penarik elektron akan memberikan efek deshielding. Pada tabel berikut digambarkan pengaruh substituen terhadap geseran kimia proton dari 1,4-disubstitusi benzena dengan dua subsituen yang sama. Karena keempat proton benzena secara kimia dan magnetik sama, tentu hanya satu sinyal proton aromatik yang muncul pada spektrum 1H NMR senyawa tersebut. Tabel 4.9 Pengaruh substituen terhadap geseran kimia proton benzena-1,4-disubstitusi Subsituen X (ppm) Karakter X 6,80 6,60 6,36 7,05 7,32 8,20 8,48 Pendorong elektron Pendorong elektron Pendorong elektron Pendorong elektron - OCH3 - OH - NH2 - CH3 -H - CO2H - NO2 X X Penarik elektron Penarik elektron Monosubstitusi benzena Pada monosubstitusi benzena, baik yang memilki substituen pendorong atau penarik elektron, kelima proton aromatik (2H orto, 2H meta, dan 1H para) akan muncul berupa singlet jika spektrum diukur pada 60 MHz. Hal ini sangat lazim meskipun proton orto, meta dan para tidak ekivalen secara kimia. Penyebab utamanya adalah ketidakmampuan alat untuk membedakan perbedaan geseran kimia proton tersebut yang cukup kecil. Akan tetapi bila spektrum diukur dengan alat 300 MHz atau lebih, ketiga jenis proton tersebut akan muncul terpisah, dan urutan posisinya dipengaruhi oleh karakter substituen apakah pendorong atau penarik elektron. Proton aromatik posisi orto akan muncul paling shielding bila substituen pada cincin aromatik bersifat sebagai pendorong elektron karena resonansi akan meningkatkan kerapatan elektron diposisi tersebut. Sebaliknya akan paling deshielding jika substituennya bersifat penarik elektron karena kerapatan elektron diposisi tersebut berkurang. Hal ini dapat dijelaskan dengan menggambarkan resonansi elektron antara substituen dengan cincin aromatik. CH 3 O + CH 3 + O _ : + : CH 3 : : :O CH 3 O _ : : : _ H H O : H _ : : : : _ : : O : : : H _ O : O + + + Gambar 4.10 Resonansi gugus pendorong elektron (atas) dan gugus penarik elektron (bawah) dengan cincin aromatik. Karena proton-proton aromatik pada monosubstitusi benzena berbeda secara kimia, tentu antara proton-proton tersebut akan terjadi kopling satu sama lain, dan secara umum akan mengikuti aturan pemecahan orde dua. Dua proton posisi orto terhadap substituen (H2 dan H6) akan muncul doblet doblet akibat kopling orto dengan H3 dan kopling meta dengan H4. Sementara dua proton posisi meta terhadap subtituen (H3 dan H5) akan muncul triplet akibat kopling orto dengan H2 atau H6 dan H4, begitupula satu proton posisi para terhadap substituen (H4) yang muncul triplet akibat kopling dengan (H3 dan H5). Para-disubstitusi benzena dan pola substitusi lainnya Pada cincin aromatik 1,4-disubstitusi dengan dua substituen yang sama, keempat proton aromatik akan muncul singlet karena keempatnya identik secara kimia dan magnetik. Sementara bila kedua substituen berbeda, akan muncul dua sinyal proton aromatik yang mewakili masing-masing dua proton (H2 dengan H6 dan H3 dengan H5) dengan multiplisitas doblet kopling orto. Untuk benzena dengan jumlah substituen yang lebih banyak, biasanya multiplisitas sinyal proton akan lebih rumit. Namun dengan pemahaman prinsip-prinsip simetri dan harga kopling (orto, meta dan para), hal tersebut akan menjadi lebih mudah. Apalagi kopling para biasanya tidak teramati sehingga harganya nol, sehingga cukup memperhitungkan kopling orto (J = 7-10 Hz) dan kopling meta (J = 2-3 Hz). A 1 Kedua substituen sama Multiplisitas proton singlet 4 H 2 6 3 5 4 A A 1 Kedua substituen berbeda Multiplisitas proton doblet 2H (J orto) untuk H2 dan H6 doblet 2H (J orto) untuk H3 dan H5 2 6 3 5 4 B A 1 6 C 2 3 5 4 B Ketiga substituen sama atau berbeda Multiplisitas proton doblet 1H (J meta) untuk H3 doblet doblet 1H (J orto dan J meta) untuk H5 doblet 1H (J orto) untuk H6 Gambar 4.11 Hubungan pola substitusi dengan multiplisitas proton aromatik. H. Pelarut Dalam 1H NMR Pelarut diperlukan dalam pengukuran sampel padatan dan cairan kental. Agar proton yang terdapat dalam pelarut tidak mengganggu sinyal proton sampel, maka proton yang ada dalam pelarut harus diganti dengan deuterium (2H atau D). Spin inti deuterium beresonansi pada frekuensi yang berbeda dengan proton, sehingga tidak muncul pada spektrum 1 H NMR. Akan tetapi, sedikit gangguan lain muncul seiring dengan penggunaan pelarut terdeuterisasi. Proton-proton dalam sampel yang bersifat asam, yaitu proton yang terikat pada atom hetero O, N, dan S dapat mengalami pertukaran dengan deuterium pelarut polar seperti D2O dan CD3OD, sehingga tidak muncul dalam spektrum. Masalah ini dapat diatasi dengan mengganti pelarut yang digunakan, bahkan dengan menggunakan dua pelarut ini secara terpisah akan mampu mengidentifikasi keberadaan gugus O–H, N–H, dan S–H dalam sampel. RXH + D2O RXD + DOH (dimana X = O, N, dan S) Tabel 4.10 Geseran kimia air terlarut dalam pelarut terdeuterasi Pelarut Kloroform-d (CDCl3) Benzena-d6 (C6D6) Aseton-d6 Metilenklorida-d2 (CH2Cl2) Dimetilformamida-d7 Piridin-d5 Toluena-d8 Metanol-d4 (CD3OD) Asetonitril-d3 Dimetilsulfoksida-d6 Air-d2 (D2O) (ppm) 1,50 0,40 2,75 1,55 3,00 5,00 0,1-0,2 4,90 2,10 3,35 4,75 (DOH) I. LATIHAN SOAL-SOAL 1. Berapakah jumlah sinyal proton pada senyawa-senyawa berikut : a. CH3CH2CH3 b. CH3CH2CH2CH3 c. CH 3 CH CH 2 CH 3 CH 3 d. CH 3 g. CH 3 CH CH CH 3 CH 3 C CH CH 3 e. CH3OCH2CH2CH3 f. CH 3 CH CH 3 O CH 3 h. CH2=CH2 i. CH 3 CH 3 j. CH 3 C C CH 2 CH 3 O C CH k. HO CH 3 C CH 2 CH 3 l. O OH m. n. CH 2Br o. H3C CH 3 H3C CH 2CH 3 2. Ada 3 isomer diklorosiklopropana (C3H4Cl2). Data spektrum 1H NMR senyawasenyawa tersebut menunjukkan bahwa senyawa A memiliki 1 sinyal proton, B memiliki 2 sinyal proton, dan C memiliki 3 sinyal proton. Tuliskanlah rumus struktur dari ketiga senyawa tersebut ! 3. Tuliskan urutan sinyal proton pada masing-masing senyawa berikut mulai yang paling deshielding hingga yang paling shielding ! a. 1-butanol b. dietil eter c. asam propanoat d. propana e. butanon f. metilbenzena g. nitrobenzena h. 2-klorobutana i. propanaldehid j. 2,4-dimetilbenzena 4. Suatu sinyal proton muncul pada 600 Hz kearah deshielding dari TMS pada spektrometer NMR dengan frekuensi operasi 300 MHz. a. Berapakah geseran kimia proton tersebut ? b. Berapakah geseran kimia proton tersebut pada instrumen dengan frekuensi operasi 100 MHz ? c. Berapa Hertz sinyal proton tersebut kearah deshielding dari TMS pada instrumen 100 MHz ? 5. Gambarkan spektrum 1H NMR dari senyawa-senyawa pada soal nomer 3 diatas. Lengkapi data spektrum dengan harga geseran kimia, multiplisitas, dan harga kopling, serta integrasi relatif masing-masing sinyal proton ! 6. Tentukanlah rumus struktur dari suatu senyawa keton memiliki rumus molekul C6H12O. Data spektrum 1H NMR menunjukkan ada 5 sinyal proton pada geseran kimia 0,9 (t, 3H); 1,3 (sext, 2H); 1,5 (quint, 2H); 2,1 (s, 3H); dan 2,4 (t, 2H). 7. Spektrum 1H NMR dua asam karboksilat dengan rumus molekul C3H5O2Cl. Tentukanlah struktur molekul kedua asam tersebut sesuai dengan data spektrum berikut! a b. 8. Tentukanlah struktur molekul senyawa berikut ! RM C9H12 9. Tentukanlah struktur molekul senyawa berikut ! RM C5H10O 10. Tentukanlah struktur molekul senyawa berikut ! RM C5H10O J. DAFTAR PUSTAKA Breitmaier, E., Structure Elucidaton by NMR in Organic Chemistry, A Practical Guide, translated by Julia Wade, John Wiley and Sons, Chichester, 1993 Pavia, D.L., Lampman, G.M., and Kriz, G.S., 1996, Introduction to Spectroscopy, A Guide for Students of Organic Chemistry, 2nd edition, Saunders College Publishing, USA, Silverstein RM, Bassler GC, Morrill TC, 1991, Spectrometric Identification of Organic Compounds, 5th ed., John Wiley & Sons, USA Cresswell, CJ., Runquist, OA., Campbell, MM., 1982, Analisis Spektrum Senyawa Organik, (diterjemahkan oleh Kosasih Padmawinata dan Iwang Sudiro), Penerbit ITB, Bandung Dudley W., and Fleming I., 1995, Spectroscopic Methods in Organic Chemistry, McGraw Hill Higher Education Bruice PY, 2005, Organic Chemistry, 4th ed, John Wiley & Sons, USA