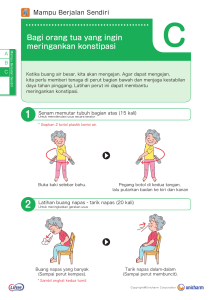
BAB II LANDASAN TEORI A. Penyakit Paru Obstruktif Kronik (PPOK
advertisement

BAB II LANDASAN TEORI A. Penyakit Paru Obstruktif Kronik (PPOK) Penyakit paru obstruktif kronik (PPOK) merupakan penyakit yang dapat dicegah dan diobati, ditandai hambatan aliran udara persisten, progresif, dan berhubungan dengan peningkatan respons inflamasi kronik saluran napas dan paru terhadap berbagai partikel atau gas beracun. Eksaserbasi dan komorbid berpengaruh terhadap keparahan penyakit 1,4 . Mayoritas kasus PPOK di negara berpendapatan tinggi dihubungkan dengan merokok, sedangkan kejadian PPOK di negara berpendapatanrendah dikaitkan dengan pajanan polusi udara 31. Merokok diperkirakan sekitar 80-90% menjadi faktor risiko utama PPOK di dunia. Perokok berkembang menjadi PPOK sekitar 15-20%, menunjukkan ada keterlibatan faktor risiko lain yaitu genetik, pajanan polutan berbahaya baik di dalam dan luar lingkungan, usia tua, dan beban sosial ekonomi rendah yang menjadi modifikasi faktor risiko individu menjadi PPOK 32 . Merokok adalah membakar tembakau yang kemudian diisap asapnya, baik menggunakan rokok maupun menggunakan pipa. Asap rokok mengandung lebih dari 4000 substansi yang teridentifikasi termasuk bahan yang secara farmakologik bersifat antigenik, sitotoksik, mutagenik, dan karsinogenik 32,33. 1. Patogenesis PPOK Patogenesis PPOK dikaitkan dengan proses perubahan yang kompleks pada struktur jaringan di saluran napas baik besar, kecil, parenkim, dan pembuluh darah paru. Pajanan asap rokok menyebabkan sejumlah mekanisme terlibat dalam patogenesis PPOK. Inflamasi diyakini berperan penting dalam patogenesis PPOK 1,4,20 . Hipotesa inflamasi berasal dari inhalasi asap rokok menyebabkan penarikkan sel imun ke dalam saluran napas dan paru. Produk yang diakibatkan oleh asap rokok dan sel imun menimbulkan respons imflamasi berkepanjangan yang berdampak pada kerusakan epitel saluran napas dan jaringan paru, menurunnya mekanisme pertahanan paru, serta menggangu meperbaikan jaringan paru 1,34,35. Mekanisme kedua ketidakseimbangan antaraoksidan dan antioksidan. Radikal bebas adalah oksidan yang tidak mempunyai elektron tidak berpasangan sehingga cendrung untuk menarik elektron lain.Sumber oksidan (ROSRNS) pada PPOK dapat berasal dari luar lingkungan seperti asap rokok dan polusi udara, sedangkansumber oksidan endogen berasal dari metabolisme aerob selular berupa respirasi mitokondria dan nicotinamine adenine dinucleotide phosphate (NADPH). Peningkatan beban ROS/RNS eksogen dan endogen yang tidak diimbangi dengan pertahanan antioksidan endogen menyebabkan terjadinya fenomena disebut stres oksidatif 20,34,35 . Stres oksidatif berperan mengatur beberapa proses penting antara lain meningkatkan respons inflamasi, menurunkan pertahanan antioksidan endogen, aktivasi protease dan inaktivasi antiprotease, serta proses apoptosis. Stres oksidatif juga menurunkan efek kortikosteroid akibat menurunnya kadar enzim HDAC. Proses tersebut dikaitkan dengan aktivasi jalur signal intraselular meliputi aktivasi faktor transkripsi utama NFκB 34-36. Mekanisme ketiga, suatu hipotesa menyatakan emfisema paru pada PPOK disebabkan oleh ketidakseimbangan antara protease dan antiprotease. Peningkatan aktivitas protease menyebabkan kerusakan matriks ekstraselular, tanpa matriks sel epitel dan kompartemen unit alveolar rusak berdampak pada terjadainya emfisema paru. Peningkatan aktivitas protease merupakan konsekuensi inflamasi abnormal dengan melepaskan pelepasan enzim proteolitik oleh sel inflamasi seperti makrofag dan netrofil, serta diperkuat oleh oleh faktor genetik defisiensi α1AT. Mekanisme apoptosis sel epitel dan endotel alveolar pada PPOK disebabkan oleh hambatan reseptor atau menurunnya ekspresi regulasi produksi genvascular endothelial growth factor (VEGF). Ketidakseimbangan apoptosisdan pertumbuhan sel epitel dan endotelalveolar berkontribusi pada kerusakan jaringan parenkim paru 34,35 . Mekanisme patobiologi pada PPOKdijelaskan pada Gambar 1 35. Gambar 1. Mekanisme patobiologi PPOK. Dikutip dari (35) a. Inflamasi Penyakit paru obstruktif kronik (PPOK) ditandai dengan respons inflamasi abnormal dengan melibatkan sejumlah sel imun dalam saluran napas besar, kecil, dan paru. Hipotesa inflamasi pada PPOK berasal dari pajanan asap rokok dan zat iritan lain menginduksi sel imun masuk kedalam saluran napas dan paru, dimana produk sel imun menyebabkan kerusakan jaringan dan mengganggu mekanisme perbaikan paru 34 . Inflamasi dan respons imun berperan pada perkembangan dan progresifitas PPOK. Inflamasi PPOK terjadi saat stabil dan eksaserbasi. Amplifying inflamasi kronik terjadi saat eksaserbasi akut PPOK. Ampliflying inflamasi pada eksaserbasi akut PPOK utamanya disebabkan oleh infeksi (bakteri dan virus) dan lingkungan. Ampliflying inflamasi pada eksaserbasi akut PPOK meningkatkan produksi berbagai mediator inflamasi 35 . Mekanisme pertahanan sistem respirasi terdiri dari alami dan didapat. Sistem imun alami dan didapat memiliki kemampuan yang berbeda namun fungsi sel dan molekul saling bekerjasama untuk melindungi struktur dan fungsi saluran napas dan parenkim paru 34,35. Mekanisme pertahanan sistem imun alami/bawaan/nonspesifik Mekanisme pertahanan alami sistem respirasi memberikan perlindungan utama terhadap pajanan gas atau partikel berbahaya atau mikroorganisme patogen. Sistem imun alami memberikan respons cepat, tidak spesifik, dan secara lambat dapat merangsang sistem imun didapat. Mekanisme pertahanan sistem imun alami respirasi terdiri dari pertahanan fisik, biokimia, dan selular 37. Pertahanan fisik sistem respirasi terdiri dari struktur penunjang, silia, lapisan sel didalam saluran napas dan alveoli paru. Pertahanan biokimia merupakan protein terlarut yang melindungi permukaan saluran napas dan paru. Sel epitel dan endotel diketahui dapat menghasilkan sejumlah sistem pembersihan pada saluran napas dan alveoli paru yaitu peptida antimikroba dan antiprotease. Peptida antimikroba meliputi defensin, lizosom, laktoferin, imunoglobulin, komplemen, dan surfaktan. Antiprotease meliputi alpha1antitripsin (a1AT), antimacroglobulin, secretory leukoproteinase inhibitor (SLI), dan tissue inhibitor of metalloproteinase (TIMP).Pertahanan selular sistem imun alami meliputi sel epitel, makrofag, netrofil, dan dendritic 37,38. Aktivasi respons sel imun alami terhadap iritasi seperti asap rokok atau partikel berbahaya belum jelas namun ‘hipotesis danger’ yang dikemukan olehMatzinger dapat diterima. Matzinger mengemukakan bahwa aktivasi responssel imun alami pada PPOK bukan hanya berasal dari pajanan asap rokok dan mikroorganisme namun juga berasal dari stres seluler atau akibat kerusakan sel dan jaringan paru 39. Sel imun alami dapat mengenali suatu molekul mikroba atau zat iritan yang disebut pathogen associated molecular patterns (PAMPs) oleh pattern recognition receptors (PRRs). Pattern recognition receptors (PRRs) terdiri dari toll-like receptor (TLR), nod-like receptor (NLR) sitosol, dan rig-i-like receptor (RLR). Pattern recognition receptors (PRRs) diekspresikan padasel epitel, makrofag alveolar, dan sel dendritik. Pattern recognition receptors (PRRs) juga dapat teraktivasi melalui molekul endogen spesifik umumnya berasal dari sel epitel yang rusak disebut damage-associated molecular patterns (DAMPs). Pengenalan PAMPs dan DAMPs oleh PRRs merupakan tahapan penting pada respons inflamasi 40,41. Sel epitel dan makrofag alveolar merupakan pertahanan utama pertama sel imun alami saluran napas dan paru 40,41. Aktivasi sel epitel dan makrofag alveolar oleh PAMPs dan DAMPs akan mengeluarkan sejumlah mediator inflamasi antara lain TNFα, IL1β, IL6, IL8, IFNɤ, TGFβ, GM-CSF, G-CSF, dan M-CSF, serta enzim protease (NE dan MMPs). Granulosit monosit colony stimulating factor (GM-CSF), G-CSF, dan M-CSF merupakan sitokin yang menstimulasi sel progenitor granulosit dan monosit dari sumsum tulang ke darah menjadi sel makrofag dan netrofil di dalam jaringan paru yang rusak. Sel inflamasi yang menumpuk di saluran napas dan paru akan memulai suatu kaskade inflamasi. Sel inflamasi menyebabkan hipersekresi mukus, fibrosis saluran napas kecil, dan kerusakan dinding alveoli paru. Respons inflamasi abnormal atau tidak terkontrol akan terus berlangsung meskipun telah berhenti merokok 34,35,42. Peran sel inflamasi pada PPOK dijelaskan pada Gambar 2 42. Gambar 2. Peran sel imun dalam patogenesis PPOK. Keterangan: TNF: tumor necrosis factor; IL: interleukin; CXCL: kemokin ligan; CCR: c-kemokin reseptor; TGF:tumor growth factor; FGF: fibroblast growth factor; IFN: interferon; EGF: epidermal growth factor. Dikutip dari (42) Sel epitel saluran napas Epitel saluran napas merupakan barier pertahanan struktur saluran napas dan paru terhadap stimulus lingkungan. Epitel saluran napas memiliki peranan yang multifungsi dan terdiri dari beberapa tipe sel yang berbeda antara lain sel epitel kolumner bersilia, goblet, klara, basal, dan endotel alveoli. Sel epitel mensekresi peptida antimikroba, antioksidan, dan antiprotease 38 . Respons sel epitel terhadap asap rokok menggambarkan usaha melindungi diri dan memperbaiki kerusakan saluran napas akibat asap rokok. Sel epitel saluran napas pasien PPOK berubah secara karakteristik akibat bahan rokok. Kerusakan epitel kolumner bersilia menyebabkan gangguan pergerakan silia, perubahan dan peningkatkan jumlah sel sel goblet, serta kelenjar mukosa. Perubahan tersebut mengakibatkan terjadinya hipersekresi mukus, memudahkan kolonisasi kuman, dan obstruksi saluran napas.Sel epitel juga secara aktif melepaskan berbagai mediator inflamasi antara lain kemokin, sitokin, dan faktor pertumbuhan 38,40,43. Aktivasi sel epitel mensekresi berbagai mediator inflamasi meliputi IL6, IL8, CXCL8, CXCL1, CXCL5, CXCL6 berikatan dengankemokin reseptor (CXCR)2 untuk menarik netrofil dan monosit masuk kedalam saluran napas dan parenkim paru. Sel epitel mensekresi CXCL9, CXCL10, dan CXCL11 berikatan dengan CXCR3 untuk menginduksi sekresi sel Th1 dan sel T sitotoksik (CTL). Sel epitel juga menghasilkan faktor pertumbuhan yaitu TGFβ dan FGF yang berperan sebagai stimulasi proliferasi fibroblast untuk menghasilkan fibrosis di saluran napas kecil. Peningkatan mediator proinflamasi mencetuskan respons inflamasi kronik dan remodelling dalam saluran napas kecil dan paru napas pada penderita PPOK dilihat Gambar 3 43. Gambar 3. Sel epitel saluran napas pada penderita PPOK. 42,43 . Peran sel epitel saluran Keterangan: TGFβ: transforming growth factor β; LTB4 : leukotrien B4; MMP: matrix metalloproteinase; PGE2 prostaglandine E2; CD8+: cell ofdiferrentiation8 Dikutip dari (43) Makrofag Makrofag alveolar merupakan fagosit mononuklear yang memberikan pertahanan selularpertama terhadap mikroorganisme atau partikel yang mencapai saluran napas bawah. Fungsi utama makrofag yaitu fagositosis namun juga dapat berperan sebagai antigen presenting cell (APC). Kemampuan makrofag berikatan dengan patogen diperantarai oleh reseptor pada permukaan makrofagsehingga dapat mengikat ligan spesifik seperti lipopolisakarida (LPS), polisakarida, dan toksin. Aktivasi makrofag mencetuskan berbagai pengeluaran mediator inflamasi seperti sitokin, kemokin, sehingga dapat menarik dan mempengaruhi sel imun seperti sel netrofil, limfosit T dan B, serta mengeluarkan metabolit aktif yang menyebabkan kerusakan jaringan paru 37,38. Makrofag alveolar berperan dalam patofisiologi pada PPOK. Peningkatan jumlah makrofag alveolar di dalam saluran napas berkorelasi signifikan dengan progresifitas hambatan aliran udara PPOK. Studi penelitian menunjukkan bahwa makrofag alveolar banyak ditemukan dalam paru perokok dibandingkan bukan perokok 42 . Pajanan asap rokok menginduksi makrofag alveolar untuk mensekresi sejumlah kemoaktraktan yang berperan dalam jalur orkestra inflamasi PPOK antara lain sekresi selektif kemoaktraktran monosit yaitu CXCL1 (dikenal growth related oncogen-α (GRO-α)) dan CCL2 (dikenal monocyte chemotactic peptide-1(MCP1)) bekerja melalui CCR2 untuk menarik monosit darah dan selanjutnya berdiferensiasi menjadi makrofag alveolar di parenkim paru. Makrofag juga mensekresi TNFα, leukotrien B4 (LTB4), CXCL8, dan CXCL1 bekerja melalui CXCR2 untuk menarik sel netrofil darah masuk ke dalam paru, dan menstimulasi IFNγ untuk melepaskan kemokin ligand CXCL9 (dikenal dengan monokine induce IFNγ (MIG)), CXCL10 (IFNγ induce protein (IP10), CXCL11 (I-TAC) sehingga Th1 dan sel T CTL teraktivasi masuk kedalam paru melalui CXCR-3 42,43. Makrofag alveolar juga dapat mensekresi beberapa enzim elastolitik antara lainMMP2, MMP9, MMP12, captesin K, L, S, dan netrofil elastase (berasal dari netrofil). Enzim elastolitik bersama dengan sel Tc1 dan Th1 berkontribusi pada terjadinya emfisema. Makrofag alveolar juga mensekresi TGFβ dan FGF untuk menghasilkan fibroblast sehingga saluran napas kecil fibrosis. Pembentukan ROS endogen yang dihasilkan dari metabolisme makrofag berkontribusi pada resistensi kortikosteroid. Penurunan aktivitas fagositosit makrofag alveolar meningkatkan kolonisasi bakteri 31,42,43 . Peran makrofag pada PPOK dijelaskan Gambar 4 31. Gambar 4. Peran utama makrofag pada PPOK. Keterangan: TGFβ: transforming growth factor β; CCR: chemokine recepor; CXCR: chemokine receptor; CXCL: chemokine; ROS: radical oxygen species; LTB4: leukotrien B4; MMP: matrix metalloproteinase; Th1: T-helper 1; Tc1: T citolitic. Dikutip dari (31) Netrofil Netrofil merupakan sel granulosit yang berasal dari sel induk sumsum tulang dan terdapat di sirkulasi/darah. Netrofil mengandung granul azurofilik primer dan sekunder. Granul azurofilik primer dan sekunder mengandung enzim antimikroba, protease, dan asam hidrolase. Netrofil berperan sebagai respons pertahanan pertama sistem imun alami terhadap infeksi dan inflamasi. Asap rokok menginduksi makrofag dan sel epitel untuk melepaskan faktor kemotaktik netrofil sehingga sel netrofil yang terdapat di darah migrasi ke dalam saluran napas yang mengalami kerusakan atau terinfeksi 37,38. Pajanan asap rokok menyebabkan infiltrasi sel netrofil meningkat dalam sputum dan BAL padapenderita PPOK. Faktor kemotaktik sel netrofil meliputi IL8 atau CXCL8, IL1β, CXCL1, LTB4, dan TNFα. Sel netrofil migrasi dari pembuluh darah paru ke rongga alveoli dengan melekat di dinding sel endotel alveoli. Perlekatan sel netrofil darah melibatkan molekul adhesi yaitu VCAM-1, ICAM-1 dan e-selectin pada sel endotel saluran napas penderita PPOK. Kelangsungan hidup sel netrofil dalam saluran napas dan paru mungkin diperkuat oleh sitokin GM-CSF dan G-CSF dari sumsum tulang yang dilepaskan oleh makrofag alveolar sehingga sel netrofil menetap lebih lama dalam saluran napas dan paru. Sel netrofil diperkirakan berperan penting dalam patogenesis bronkitis kronis dan emfisema paru pada PPOK 31,42,43 . Sel netrofil dapat mensekresi keluarga serin protease dan MMPs. Keluarga serin protease meliputi netrofil elastase (NE), cathepsinG (CatG), proteinase3 (Pr3) terdapat di dalam granul netrofil. Keluarga MMPs yang disekresi oleh sel netrofil terutama MMP 8 dan 9. Keluarga serin protease merupakan stimulan poten sekresi mukus, dan bersama dengan MMP8 dan MMP9 berkontribusi terhadap kerusakan dinding alveolar paru pada penderita PPOK 35,42,43 . Perekrutan dan peran sel netrofil pada patogenesis PPOK dijelaskan pada Gambar 5 43. Gambar 5. Peran netrofil pada PPOK. Keterangan: TGFβ: transforming growth factor β;CXCR: chemokine receptor; CXCL: chemokine; LTB4:leukotrien B4; MMP: matrix metalloproteinase. Dikutip dari (43) Mekanisme pertahanan sistem imun didapat/adaptif/spesifik Antigen yang berasal dari pajanan asap rokok, bakteri, virus, produk hasil pemecahan matriks ekstraseluler, dan kemungkinan autoantigen dari jaringan paru memicu respons sistem imun didapat pada penderita PPOK.Sistem imun didapat berperan memberikan reaksi lebih spesifik untuk mengenal pajanan sebelumnya dari benda asing yang masuk. Sistem imun adaptif juga meningkatkan mekanisme pertahanan paru. Peningkatan respons sistem imun adaptif terhadap kolonisasi dan infeksi dalam saluran napas bawah sering ditemukan pada PPOK derajat berat. Sel yang berperan dalam sistem imun adaptif pada PPOK yaitu sel limfosit TCD8+, CD4+ terutama subset Th1, Th17, dan limfosit B 39,40,41. Sel dendritik Sel dendritik merupakan antigen presenting cell (APC) poten yang terdapat di intrepitel dan subepitel saluran napas. Sel dendritik mempunyai peran penting dalam memperantarai respons imun alami dan didapat. Sel dendritik (SD) sebagai APC paling efektif dalam mengaktifkan sel T naif dan menentukan jenis respons sel limfosit T yang diarahkan oleh antigen. Sel dendritk (SD) berasal dari sel induk sumsum tulang atau dari prekusor monosit dalam darah 31,37,39 . KeberadaanPAMPs atau DAMPs pada permukaan epitel saluran napas menjadi sinyal utama untuk SD imatur (SDi) teraktivasi.Sel dendritik imatur yang teraktivasi oleh PAMPs/DAMPs migrasi dari epitel saluran napas ke kelenjar limfoid bronkus menjadi SD matur. Sel dendritik matur di limfoid mempresentasikan antigen dengan mengekspresikan MHC pada molekul ko-stimulator untuk limfosit T naif. Sel dendritik meningkat di dalam saluran napas dan dinding alveolar parupada perokok. Peran SD pada PPOK belum jelas namun SD diketahui berperan penting sebagai perantara pada respons imun alami dan didapat dalam patogenesis inflamasi PPOK 11,31,40. Kerusakan epitel saluran napas akibat pajanan zat iritan seperti asap rokok juga menginduksi makrofag untuk melepaskan berbagai mediator penarik SD imatur dalam darah meliputi makrofag inflammatory protein3a (MIP-3a) atau CCL20 melalui CCR6. Pelepasan CCL20 akan menarik SDi ke tempat akumulasi antigen atau kerusakan jaringan. Antigen yang ditangkap dan diproses oleh SD imatur lepas dari CCR6, migrasi menuju organ limfatikmelaluiCCR7. Sel dendritik imatur (SDi) menjadi matur setelah berada di organ limfoid sekunder akan mengekspresikan sejumlah molekul MHC pada kostimulator sel T seperti CD40, CD80 and CD86.Sel T berdiferensiasi dan berproliferasi menjadi sel CD4+ dan CD8+.Sel dendritik imatur juga mampu menghasilkan MMP12 yang berkontribusi terhadap patogenesis emfisema pada PPOK 11,44 . Hubungan antara pajanan asap rokok, inflamasi dan SD dalam patogenesis PPOK dijelaskan pada Gambar 6 44. Gambar 6. Hubungan antara pajanan asap rokok, inflamasi dan SD dalam patogenesis PPOK. Keterangan: DC: dendritik cell;pDC: plasmasitoid DC; mDC:mieloid DC; MIP-3a: makrofag inflammatory protein3a; Dikutip dari (44) Limfosit Sel limfosit merupakan sel yang berperan dalam sistem imun didapat atau spesifik. Limfosit Sel limfosit T berperan dalam imunitas selular sedangkan sel B imunitas humoral. Respons imun didapat dimulai ketika reseptor pada limfosit mengenali antigen. Sel B dan T yang matur dapat mengekspresikan reseptor (BCR dan TCR) pada permukaanya. Sel B menggunakan antibodi sebagai reseptor di permukaan membran untuk mengenali antigen 37. Sel T hanya mengenali antigen yang terikat molekul MHC yang dipresentasikan oleh SD.Sel dendritik matur migrasi kedalam kelenjar getah bening lokal dengan mengekspresikan MHC pada kostimulator CD80 dan CD86 untuk mempresentasikan antigen ke sel T. Sel T berproliferasi dan berdiferensiasi menjadi sel efektor limfosit T CD4+ dan CD8+. Keterlibatan sel T CD8+ dan CD4+ meningkat signifikan di dalam saluran napas besar, kecil, dan parenkim paru pada perokok penderita PPOK. Beberapa studi penelitian menunjukkan bahwa sel T CD8+ lebih berperan dibandingkan CD4+ pada perokok penderita PPOK. Peningkatan jumlah sel T CD8+ dikaitkan dengan kerusakan alveoli dan derajat obstruksi saluran napas 39,45. Sel T di dalam pembuluh darah tidak dapat masuk ke dalam parenkim paru namun sekali teraktivasi sel T dapat ditarik masuk ke paru melalui tissue-specific chemokine receptors. Sel epitel dan makrofag yang teraktivasi oleh asap rokok akan menstimulasi IFNγ melepaskan kemokin ligand CXCL9 (dikenal dengan monokine induce IFNγ (MIG), CXCL10 (dikenal dengan IFNγ induce protein (IP10), CXCL11 (I-TAC) untuk menarik sel efektor Th1 CD4+ dan sel T sitolitik CD8+ masuk ke dalam paru melalui CXCR3. Peningkatan sekresi IFNγ oleh Tc1 dan Th1 berikatan dengan CXCR3 dapat menyebabkan proses inflamasi menetap. Sel T CD8+ saat teraktivasi akan berdiferensiasi menjadi sel T sitotoksik (CTL/Tc) yang mampu membunuh sel terinfeksi dan dapat mensekresi protein seperti porfirin atau granzim A dan B mengakibatkan sel apoptosis. Sel T CD8+ mengenal antigen yang dipresentasikan oleh APC melalui MHC1 31,41,45. Sel T CD4+ berdiferensiasi menjadi beberapa sel efektor berdasarkan sitokin yang diproduksinya. Antigen ditangkap, diproses, dan dipresentasikan oleh SD melalui MHC2 menjadi T CD4+naif.Sel T CD4+naif yang teraktivasikan berproliferasi dan berdiferensiasi menjadi subset sel efektor diantaranya Th1,Th2, Th17, dan Treg. Sel efektor T CD4+berperan mengaktifkan fungsi makrofag dan limfosit B. Subset selefektor T CD4+ Th1 dan Th17 sering ditemukan pada penderita PPOK stabil. Sel Th1 memproduksiIFNγ yang berperan penting dalam meningkatkan fungsi fagositosis makrofag untuk membunuh patogen. Interferon gama (IFNγ) juga memstimulasi sel B untuk memproduksi IgG yang bekerja sebagai opsonin dalam fagositosis. Interferon gama(IFNγ) menstimulasi ekspresi MHC1 dan MHC2 dan ko-stimulator pada APC sehingga memperkuat respons sel T. Peran CD4+ pada penderita PPOK stadium lanjut belum jelas. Peningkatan jumlah sel T CD4+dan CD8+di dalam paru dikaitkan dengan beratnya derajat PPOK 31,41,45. Sel Th17 merupakan T CD4+ yang mempunyai peranan dalam repons inflamasi dan penyakit autoimun 41 . Interleukin 17 berperan dalam pengerahan, aktivasi, dan migrasi sel imun terutama sel netrofil pada saluran napas. Interleukin 17 diperkirakan berperan meningkatkan respons inflamasi terutama penyakit inflamasi kronik. Peran SelTh17 perokok dan penderita PPOK belum jelas namun Th17 dapat menginduksi kerusakan jaringan paru yang bersifat autoimun Gambar 7 42. 41,42 . Sel T CD4+ dan CD8+ pada patogenesis PPOK dijelaskan pada Gambar 7. Peran sel T CD8+ dan CD4+ pada PPOK. Keterangan: IFNγ: interferon gamma; CXCL:kemokin ligan;Th1: Thelper1;Tc1: T cell sitolitik. Dikutip dari (42) b. Ketidakseimbangan oksidan dan antioksidan Radikal bebas adalah oksidan yang tidak mempunyai elektron tidak berpasangan sehingga cendrung untuk menarik elektron lain. Sifat radikal bebas yang tidak berpasangan membuat radikal bebas menjadi sangat reaktif, sehingga menyebabkan terjadi reaksi rantai berantai yang dapat menimbulkan kerusakan sel, jaringan, dan menimbulkan proses penuaan. Radikal bebas di terbentuk dalam membran sel, mitokondria, retikulum endoplasma, dan sitosol melalui reaksi enzimatik yang berlangsung dalam proses metabolisme. Oksigen dalam rantai pernafasan berperan sebagai akseptor terakhir dari electron ROS melalui reduksi O2, dijelaskan pada Gambar 8 46. 36,46 . Sel menghasilkan Gambar 8. Proses produksi ROS. Keterangan : O2-: anion superoksida; H2O2: hidrogen peroksida; HOCl: Hypochlorous; HOBr: hypobromous acids; NO: nitrit Oksida. Dikutip dari (46) Sumber oksidan pada PPOK berasal dari luar/eksogen lingkungan seperti asap rokok dan dari dalam/endogen lingkungan berupa hasil metabolisme selular. Sumber oksidan luar lingkungan pada PPOK berasal dari pajanan gas dan partikel berbahaya terutama asap rokok 46 . Asap rokok adalah senyawa yang mengandung > 4700 komponen kimia dan oksidan dengan kadar tinggi (1014senyawa/puff) serta nitrit oksida 300 ppm/puff. Asap rokok terdiri dari fase gas dan padat/partikulat. Fase padat adalah senyawa yang tersaring dalam cambrigde filter, sedangkan fase gas yaitu senyawa yang melewati filter. Fase gas asap rokok mengandung sekitar 1015 radikal bebas. Radikal bebas dalam fase gas umumnya kurang stabil dan berumur pendek. Fase gas mengandung bahan karsinogenik sama dengan yang terkandung dalam asap rokok. Fase partikulat dari asap rokok terdiri dari tar dan nikotin. Fase tar mengandung sekitar 1017 radikal bebas. Radikal bebas yang dihasilkan oleh tar bersifat lebih stabil dan berumur panjang. Fase tar bersifat lipofilik sehingga lebih mudah berinteraksi dengan mitokondria dan menghasilkan ROS lebih banyak 34,46. Salah satu radikal bebas yang dihasilkan oleh tar yaitu radikal semiquinone dapat mereduksi O2 menjadi anion superoksida (O2.-). Anion superoksida (O2.-) membentuk radikal hidroxil (OH-) dari hydrogen peroksida (H2O2). Nikotin merupakan bahan kimia psikoaktif yang sangat adiktif atau lebih menyebabkan kecanduan dibandingkan ganja, kafein, etanol, kokain dan heroin 46. Sumber oksidan endogen pada PPOK berasal dari metabolisme selular merupakan hasil reaksi enzimatik dan nonenzimatik. Sumber pembentukan ROS/RNS selular berasal dari sistem respirasi mitokondria, NADPH oksidase, xanthine oxidase (XO), dan arachidonic acid (COX2). Sel epitel, endotel, dan sel inflamasi (makrofag dan netrofil) saat teraktivasi akan menghasilkan NADPH oksidase dan xantine oksidase untuk mereduksi molekul oksigen (O2) menjadi anion superoksida (O2-). Anion superoksida (O2-) berubah dengan cepat menjadi hidrogen peroksida (H2O2) melalui reaksi katalitik enzim super oxide dismutase (SOD). Hidrogen peroksida (H2O2) dirubah menjadi radikal hidroksil (OH.-) melalui katalitik nonenzimatik dengan ion besi (Fe2+) sebagai reaksi fenton. Radikal hidroksil (OH.-) merupakan produk turunan O2- yang paling reaktif dan berbahaya. Anion superoksida (O2-) juga dapat bereaksi dengan spesies molekul lain seperti nitrit oksida (NO) menghasilkan produk radikal bebas peroksinitrit (ONOO) 46,47 . Sumber stres oksidatif dapat dilihat pada Gambar 9 47. Gambar 9. Sumber stres oksidatif Keterangan: PMN:polimorfonuklear; Eos:eosinofil;NADPH oxidase: enzim nikotinamida adenin dinukleotida fosfat oxidase; AM:makrofag alveolar. Dikutip dari (47) Reactive oxygen species (ROS) yang dihasilkan dari asap rokok dan reaksi metabolisme endogen melalui sel inflamasi merupakan dapat meningkatkan beban oksidan di dalam paru. Paru mempunyai kemampuan untuk menetralisir kadar ROS yang berlebih melalui mekanisme pertahanan antioksidan selular meliputi superoksida dismutase (SOD), katalase (CAT), dan glutation peroksidase (GSH). Peningkatan kadar radikal bebas melebihi kemampuan pertahanan antioksidan selular di paru menyebabkan timbulnya keadaan stres oksidatif 47 . Stres oksidatif baik secara langsung maupun tidak langsung menyebabkan perubahan struktur dan fungsi saluran napas dan parenkim paru. Stres oksidatif secara langsung menyebabkan oksidasi deoxyribonucleat acid (DNA), lemak, dan protein membran sel saluran napas dan paru. Oksidasi DNA mengakibatkan kerusakan paru dan meningkatkan risiko kejadian kanker paru. Stres oksidatif tidak langsung menyebabkan respons inflamasi meningkat, aktivasi protease dan inaktivasi antiprotease, dan apoptosis sel. Proses ini diakibatkan oleh aktivasi faktor transkripsi sensitif redoks dan signal tranduksi meliputi NFκB, aktivator protein1 (AP1), mitogen-activated protein kinases (MAPK), dan phosphoinositide 3-kinases (PI3Ks) yang mengatur sejumlah transkripsi gen proinflamasi 48,49 . Mekanisme stres oksidatif menyebabkan perubahan struktur dan fungsi paru pada PPOK dijelaskan pada Gambar 10 48. Gambar 10. Mekanisme stres oksidatif menyebabkan perubahan struktur paru dan eksaserbasi pada PPOK. Dikutip dari (48) Peroksidasi Lemak Membran sel terdiri dari dua lapisan yaitu protein dan lemak yang kaya akan asam lemak tidak jenuh ganda/polyunsaturated fatty acid (PUFA). Reactive oxygen species (ROS) saat berikatan dengan lemak tak jenuh ganda penyusun fosfolipid membran selmudah membentuk hidroperoksida 48,49 . Target utama ROS adalah DNA, protein, asam lemak tak jenuh dan lipoprotein. Peroksidasi lemak menyebabkan struktur membran terganggu, perubahan integritas, fluiditas, permeabilitas dan gangguan fungsional, serta memodifikasi low density lipoprotein (LDL). Peroksidasi lemak terlibat dalam patogenesis kerusakan jaringan paru pada penderita PPOK. Produk hasil peroksidasi lemak berupa reaktif aldehid seperti malondialdehide (MDA), isoprostane (8-IP), acrolein, dan4-hydroxy-2-nonenal (4HNE). Produk reaktif aldehid secara in vivo relatif stabil sehingga dapat digunakan sebagai penanda sebagai penanda stres oksidatif di paru. Peningkatan kadar MDA, 4-HNE, dan 8-IP menyebabkan mutasi gen dan peningkatan risiko kanker paru. Peroksidasi lemak membran sel dijelaskan pada Gambar 11 49. Gambar 11. Mekanisme lipid peroksidasi membran sel oleh ROS. Dikutip dari (49) Aktivasi faktor transkripsi Reactive oxygen species (ROS) secara tidak langsung dapat mencetuskan dan meningkatkan respons inflamasi melalui jalur aktivasi faktor transkripsi sensitif redoks seperti NFκB dan AP1 34,48,49 . Aktivitas NFκB dapat dicetuskan baik melalui fosforilasi keluarga protein inhibitor κappa B (IκB) dengan atau tanpa stimulus keluarga protein kinase meliputi mitogen-activated protein kinases (MAPK) p38, c-jun-n-terminal kinase (JNK), extracellular signal regulated kinase (ERK), phosphoinositide 3-kinases (PI3Ks), dan protein kinase C (PKC). Nuclear factor kaffa β (NFκβ) merupakan faktor transkripsi keluarga Rel yang mengatur berbagai transkripsi gen dalam respons imun, reaksi inflamasi, proliferasi, apoptosis, dan onkogenesis. Nuclear factor kaffa β (NFκβ) didapatkan pada semua jenis sel yang terlibat dalam respons seluler terhadap stimulus, seperti stres oksidatif, sitokin, kemokin, radikal bebas, radiasi UV, dan oksidasi LDL. Nuclear factor kaffa β (NFκβ) terdiri dari lima anggota yang berasal dari keluarga Rel antara lain NFκβ1 (p50/p105), NFκβ2 (p52/p100), p65 (Rel A), Rel B, dan c Rel 8,49. Nuclear factor kaffa β (NFκβ) dalam keadaan tidak teraktivasi berikatan dengan protein keluarga inhibitor κappa β (Iκβ α, Iκβ β, dan Iκβ ε) di sitoplasma. Inhibitor κappa β (Iκβ) merupakan penghalang translokasi faktor transkripsi NFκβ kedalam inti sel. Sitokin dan stimulus ekstraselular meliputi sitokin (seperti TNFα, IL1β, dan IL6), radikal bebas, produk bakteri, virus, sinar ultraviolet (UV), dan agen kemoterapi menginduksi fosforilasi dan degradasi Iβ pada heterodimer subunit p50 dan p65 melalui katalisis suatu enzim Iβ kinase (IK). Fosforilasi dan degradasi Iβ menyebabkan NFκβ lepas dari Iβ selanjutnya translokasi kedalam inti sel dan berikatan dengan DNA membentuk kompleks ikatan DNA dan NFκB. Kompleks ikatan DNA dan NFκβ menginduksi sejumlah pengaturan ekspresi gen inflamasi seperti sitokin (TNFα, IL1β, IL6, IL8, IL12), kemokin (CXCL8, Gro α, β, dan γ, MIP1, MCP1), colony stimulating factors (G-CSF dan GM-CSF), molekul adhesi (ICAM1 dan VCAM1), dan faktor pertumbuhan (TGFβ dan FGF). Peningkatan aktivitas NFκβ pada PPOK berdampak pada peningkatan inflamasi, aktivasi protease, inaktivasi antiprotease, apoptosis, dan penurunan kemampuan antioksidan enzimatik selular 8,9. Mekanisme ROS dan berbagai stimulus dalam mengaktivasi faktor transkripsi dijelaskan pada Gambar 12 34. Gambar 12. Mekanisme ROS dan berbagai stimulus mengaktivasi NFκβ. Keterangan: Iβ: inhibitor kappaβ; p65 dan p50: subunit protein; p: phosforilasi; ub: ubiquitin; ERK: extracellular signal regulated kinase; JNK: c-Jun-N-terminal kinase; MAPKp38: subfamili mitogen-activated protein kinases; NFκβ: nuclear factor kappaβ Dikutip dari (34) Stres oksidatif tidak hanya menginduksi jalur signal sensitif redoks namun juga menyebabkan ketidakseimbangan asetilasi dan deasetilasi protein histon (remodelling kromatin). Kromatin tersusun dari kompleks ikatan protein histon dengan DNA membentuk suatu kromosom di dalam inti sel. Perubahan kimia menyebabkan protein histon mengalami berbagai modifikasi seperti asetilasi, metilasi, dan fosforilasi. Modifikasi posttranslasi protein histon mengakibatkan perubahan struktur kromatin dan berdampak pada transkripsi gen 9,49 . Asetilasi protein merupakan proses pengikatan gugus asetil pada rantai asam amino lisin. Proses asetilasi menurunkan kemampuan ikatan protein histon dengan DNA mengakibatkan perubahan struktur kromatin dalam inti sel. Perubahan struktur kromatin mempermudah faktor transkripsi NFκβ berikatan dengan DNA dan berdampak pada sejumlah transkripsi gen. Oksidan baik dari asap rokok dan metabolisme selular atau mediator inflamasi menginduksi molekul koaktivator faktor transkripsi NFκβ yaitu CREB (cAMP response element-binding protein)-binding protein (CBP)/p300 mengandung enzim asetiltransferase (HAT). Aktivasi molekul koaktivator CBP/p300 menyebabkan DNA unwinding (terurai DNA) dari ikatan protein histon dan berikatan dengan faktor transkripsi mengakibatkan transkripsi gen 8,9. Deasetilasi protein merupakan proses pemutusan gugus asetil dari rantai asam amino lisin. Proses deasetilasi bertujuan untuk menjaga struktur kromatin sehingga faktor transkripsi NFκβ tidak dapat berinteraksi dengan DNA dan tidak terjadi transkripsi gen. Proses deasetilasi protein dikatalisis oleh kelompok enzim histon deasetilasi (HDAC) 50,51 dan penderita PPOK sebagian besar mengalami resistensi glukokortikosteroid 51 . Perokok . Reactive oxygen species (ROS) melalui reaksi peroksinitrit dan karbosilasi menyebabkan kadar enzim HDAC kelas 2 menurun. Penurunan kadar enzim HDAC 2 mengakibatkan efikasi glukokortikosteroid menurun. glukokortikosteroid melalui reseptor glukokortikosteroid (RG) bertranslokasi dari sitoplasma kedalam inti sel dan dengan bantuan enzim HDAC kelas 2 mampu menekan kompleks promoting asetilasi protein sehingga regulasi transkripsi gen inflamasi dapat dihambat dan menstimulasi gen sensitif steroid 9,50,51 . Pengaruh asap rokok dan stres oksidatif terhadap asetilasi dan deasetilasi protein histon dalam mengatur ekspresi gen inflamasi dijelaskan pada Gambar 13 50. Gambar 13. Pengaruh stres oksidatif terhadap regulasi kromatin dan ekspresi gen proinflamasi. Dikutip dari (50) c. Ketidakseimbangan protease dan antiprotease Emfisema paru yaitu suatu kondisi paru yang ditandai dengan kerusakan dan dilatasi abnormal mulai dari saluran napas distal bronkiolus terminalis sampai dinding alveoli paru. Ketidakseimbangan proteinase-antiproteinase menyebabkan emfisema paru pada PPOK. Serat elastin merupakan salah satu komponen jaringan penyusun matriks ekstraselular parenkim paru yang menjadi target utama enzim protease. Kerusakan serat elastin akan menyebabkan elastisitas parenkim paru menurun 34,35,52 . Asap rokok menginduksi sel epitel untuk mengaktivasi sel makrofag dan netrofil masuk kedalam paru. Peningkatan aktivitas sel makrofag dan netrofil dapat menghasilkan beberapa enzim protease seperti netrofil elastase (NE), MMPs, cathepsin S, L, dan G, serta proteinase 3. Peningkatan aktivitas enzim protease dapat meningkatkan efek proteolitik dan menurunkan aktivitas antiprotease antara lain α1AT, TIMPs, SLPI, dan α-macroglobulin. Protease merupakan enzim proteolitik yang mampu memecah atau mendegradasi komponen jaringan ikat penyusun matriks ekstraselular parenkim paru sehingga mengakibatkan kerusakan dinding alveoli/emfisema paru 35. Oksidan turut berperan menurunkan kadar atau aktivtas enzim antiprotease mengakibatkan kerusakan dinding alveoli paru. Defisiensi α1AT diduga berasal dari oksidan yang dihasilkan oleh asap rokok. Suatu studi penelitian menunjukkan perokok mengalami defisiensi α1AT sekitar 40% 52,53 . Mekanisme ketidakseimbangan proteinase-antiproteinase dan emfisema paru dijelaskan pada Gambar 14 53. Gambar 14. Mekanisme asap rokok mencetuskan ketidakseimbangan proteinaseantiproteinase dan emfisem paru. Dikutip dari (53) d. Apoptosis Apoptosis adalah mekanisme kematian sel terprogram. Apoptosis secara fisiologis berperan menjaga homoestasis sel dan jaringan. Sel epitel alveolar dan endotel pembuluh darah paru secara rutin mengalami apoptosis dan proliferasi. Gangguan pengaturan apoptosis berdampak kelainan penyakit paru. Peningkatan apoptosis sel epitel dan endotel paru tanpa diimbangi dengan proliferasi sel mengakibatkan destruksi jaringan dan emfisema paru pada PPOK. Mekanisme peningkatan apoptosis sel epitel dan endotel paru sulit dijelaskan pada PPOK. Mekanisme peningkatan apoptosis kemungkinan disebabkan oleh hambatan reseptor atau menurunnya ekspresi regulasi produksi gen vascular endothelial growth factor (VEGF) 35,53,54 . Asap rokok atau pajanan lingkungan diketahui dapat menurunkan regulasi gen produksi dan reseptor VEGF, serta memendekkan usia VEGF-dependent pada sel epitel dan endotel alveoli paru. Vascular endothelial growth factor (VEGF) merupakan sitokin faktor pertumbuhan yang melindungi sel dan reseptor endotel paru. Kerusakan membran sel endotel oleh MMPs menyebabkan hilangnya signal kelangsungan hidup dan menginduksi terjadinya apoptosis sel epitel dan endotel alveolar. Peningkatan sel limfosit T CD8+ pada penderita PPOK melalui pelepasan enzim profirin dan grandzim juga menyebabkan apoptosis sel epitel alveoli dan berkembang menjadi emfisema paru35,53,54. Interaksi apoptosis dengan mekanisme patogenesis PPOK dijelaskan Gambar 15 54. Gambar 15. Interaksi antara apoptosis dan mekanisme patogenesis PPOK. Dikutip dari (54) 2. Interleukin (IL)-8 Interleukin (IL)-8, kemokin CXC adalah kemoaktraktan poten netrofil yang memiliki peranan penting dalam amplifikasi respons inflamasi pada PPOK eksaserbasi. Kadar IL-8 meningkat di sputum dan BAL pada PPOK terutama kondisi eksaserbasi 42,44 . Peningkatan kadar IL-8 dikaitkan dengan peningkatan jumlah netrofil di dalam sputum. Interleukin (IL)-8 disintesis oleh beberapa sel yaitu epitel, netrofil, makrofag sebagai respons terhadap stimulus (asap rokok, TNFα, lipopolisakarida, produk bakteri, dan virus) 15,44 . Sel netrofil juga dapat melepaskan IL-8 sehingga menarik netrofil lebih banyak yang berdampak pada peningkatan respons inflamasi. Aktivasi faktor transkripsi utama NFκB dapat meningkatkan pelepasan gen mediator inflamasiIL-8. Peningkatan kadar IL-8 dalam sputum dan plasma dikaitkan dengan perburukkan gejala klinis, peningkatan rawat inap rumah sakit, penurunan fungsi paru dan kualitas hidup, serta peningkatan mortalitas 16. 3. Matrix metalloproteinase (MMP)-9 Matrix metalloproteinases (MMPs) merupakan enzim proteolitik yang mampu mendegradasi komponen matriks ekstraselular baik proses fisiologi dan patofisiologi remodeling jaringan. Anggota keluarga MMP terbagi menjadi beberapa kelompok berdasarkan kemampuan degradasi matriks meliputi kolagenase (MMP1, 8, dan 13), gelatinase (MMP2 dan 9), stromelysin (MMP1, 3, dan 10), matrilysin (MMP7), dan makrofag metalloelastase (MMP12)55. Matrix metalloproteinase (MMP)-9 adalah enzim elastolitik utama yang memiliki kemampuan mendegradasi jaringan ikat elastin 42 . Makrofag alveolar merupakan sumber utama elastase MMP-9, dapat meningkat pada makrofag yang aktif 56 . Aktivitas elastase makrofag meningkat secara signifikan setelah pajanan asap rokok (diakibatkan oleh pajanan nikotin rokok) dan lingkungan berpolutan 57 . Kadar enzim elastase MMP-9 dalam sirkulasi dan bahkan pada septum interalveoler dapat berbulan-bulan, dan lebih lama dibanding sitokin inflamasi. Hasil penelitian lavase cairan bronkus kadar MMP-9 lebih tinggi ditemukan pada penderita emfisema dibanding tidak emfisema 58. 4. Patologi PPOK Mekanisme patogenesis PPOK yang kompleks menyebabkan perubahan patologi pada kompartemen paru yang berbeda meliputi saluran napas besar, kecil, parenkim paru, dan pembuluh darah paru.Perubahan patologi saluran napas dan parenkim paru pada pada penderita PPOK bervariasi 1,4,34. Perubahan patologi yang terjadi pada PPOK meliputi : 1. Saluran napas proksimal Bronkitis kronis adalah batuk kronik dan peningkatan produksi sputum setiap hari selama tiga bulan dalam satu tahun dan setidaknya dua tahun berturut-turut. Ciri khas bronkitis kronis yaitu hipersekresi mukus dan inflamasi kronik di dalam saluran napas besar.Struktur saluran napas besar dimulai dari ujung trakea (pinggir bawah kartilago krikoidea) sampai bronkiolus terminalis dengan diameter > 2 milimeter (mm) 59. Inflamasi kronik saluran napas menyebabkan perubahan morfologi dan selular. Perubahan morfologi terjadi mulai dari sel epitel, kelenjar submukosa, dan jaringan ikat tulang rawan bronkus. Perubahan morfologi tersebut meliputi metaplasia sel epitel, hiperplasia sel goblet,hipertropi kelenjar mukus submukosa, serta hipertropi otot polos dan jaringan ikat tulang rawan bronkus. Sel yang menginfiltrasi dinding saluran napas besar seperti sel makrofag, netrofil, dan limfosit T 5, 59,60. 2. Saluran napas perifer Studi penelitian menunjukkan penderita PPOK mengalami perubahan abnormal pada struktur saluran napas kecil. Perubahan saluran napas kecil pada perokok dan penderita PPOK terjadi di dalam bronkiolus respiratorius diameter < 2 mm. Perubahan patologi saluran napas kecil meliputi metaplasia sel epitel, hiperplasia sel goblet, fibrosis,dan remodelling. Perubahan salurannapas kecil dikaitkan dengan akumulasi sel inflamasi. Sel inflamasi yang terdapat di dalam epitel dan subepitel saluran napas kecil antara lain makrofag, netrofil, dan limfosit T CD8+>CD4+. Fibrosis peribronkial kemungkinan berkontribusi pada obstruksi saluran napas kecil yang ireversibel.Iritasi kronik menginduksi sel epitel saluran napas yang rusak untuk melepaskan faktor pertumbuhan seperti tumor growth factorβ (TGFβ) dan fibroblast growth factor (FGF) berperan dalam menstimulasi proliferasi fibroblast sehingga menyebabkan fibrosis pada saluran napas kecil 5,59,60. 3. Parenkim paru Patogenesis emfisema melibatkan destruksi alveolar. Emfisema paru yaitu suatu kondisi anatomi paru yang ditandai dengan pembesaran abnormal permanen mulai bronkiolus terminalis sampai kerusakan dinding alveolar paru tanpa adanya bukti fibrosis. Suatu data menunjukkan bahwa proses destruksi dikaitkan dengan peningkatan matriks kolagen, menunjukkan bahwa emfisema paru dapat terjadi fibrosis pada dinding alveolar 34 . Kontribusi emfisema paru pada penderita POK terhadap hambatan aliran udara ekspirasi penting namun morfologi dilatasi dan kerusakan menentukan perubahan fungsi paru 34,59,60. 4. Pembuluh darah arteri paru Perokok penderita PPOK derajat ringan dapat ditemukan disfungsi endotel dan penebalan tunika intima pembuluh darah paru. Perubahan morfologi otot polos pembuluh darah paru pada PPOK stadium lanjut berupa hipertropi dan hiperplasia sel endotel, serta serat elastin dan kolagen menumpuk dan menebal di dalam otot polos pembuluh darah paru. Perubahan tersebut menyebabkan lumen pembuluh darah paru tersumbat yang berdampak pada penyakit tromboemboli, hipertensi pulmonal dan gagal jantung kanan 1,5,60 . 5. Patofisiologi PPOK Perubahan patofisiologi PPOK karena perubahan patologis pada saluran napas proksimal, perifer, parenkim paru, dan pembuluh darah paru. Perubahan karakteristik PPOK berhubungan dengan perubahan abnormalitas fisiologis dan gejala yang khas. Inflamasi dan penyempitan saluran napas perifer menyebabkan penurunan VEP1.Emfisema paru yang diakibatkan oleh kerusakan parenkim pada PPOK berkontribusi terhadap hambatan aliran udara dan gangguan pertukaran gas 1,34. Perubahan fisiologis PPOK meliputi: 1. Hipersekresi mukus dan disfungsi silia Hipersekresi mukus mengakibatkan batuk kronik produktif yang merupakan gambaran klinis bronkitis kronik. Hipersekresi mukus pada PPOK terjadi karena peningkatan jumlah sel goblet dan pembesaran kelenjar sub mukosa sebagai respons inflamasi saluran napas kronik terhadap asap rokok dan zat berbahaya lainnya. Beberapa mediator dan protease yang berperan menstimulasi sekresi mukus antara lain proteinase (netrofil elastase dan MMP9) dan (EGFR) 1,34,60. 2. Hambatan aliran udara dan air trapping Hambatan aliran udara saat ekspirasi sebagian besar ireversibel merupakan tanda fisiologis utama PPOK. Hambatan aliran udara terutama pada salurannapas konduksi kecil dengan diameter < 2 mm akibat adanya airway remodeling yaitu fibrosis dan penyempitan. Perluasan inflamasi, fibrosis,dan eksudat di lumen saluran napas kecil berhubungan dengan penurunanVEP1, rasio VEP1/KVP, dan percepatan penurunan nilai VEP1 sebagai tandakhas pada PPOK 1,60 . Penderita PPOK mengalami penurunan nilai VEP1 sebesar 50-60 mL/tahun. Penurunan rasio VEP1/KVP berdasarkan spirometri dengan menilai cut off rasio VEP1/KVP postbronkodilator <70% 1,60. 3. Ketidakseimbangan asam-basa Penderita PPOK yang mengalami eksaserbasi menyebabkan gangguan pertukaran gas berdampak terjadinya hipoksemia dan hiperkapnia. Pertukaran gas antara oksigen (O2) dan karbondioksida (CO2) semakin bertambah berat dengan beratnya derajat progesifitas PPOK. Penurunan ventilasi menyebabkan sensitivitas kemoreseptorpusat menurun akibat retensi karbondioksida (CO2). Pemberian oksigen (O2) berlebih pada pasien PPOK terutama pada saat ekasarsebasi akan menurunkan sensitivitas pusat pernapasan 1. 4. Hipertensi pulmonal Hipertensi pulmonal, gagal jantung kanan, dan tromboemboli merupakan kejadian yang sering terjadi pada PPOK stadium lanjut. Hipertensi pulmonal disebabkan oleh vasokontriksi pembuluh darah kapiler paru yang diinduksi oleh keadaan hipoksia, dan akhirnya menyebabkan disfungsi endotel, remodelling pembuluh darah kapiler paru akibat hiperplasia dan hipertrofi sel otot polos, destruksi capillary bed pulmonal. Progresifitas hipertensi pulmonal menyebabkan hipertrofi, dilatasi, dan disfungsi ventrikel kanan yang bermanifestasi sebagai gagal jantung kanan kronik 1,5. 5. Eksaserbasi Eksaserbasi adalah perburukan gejala (batuk, sesak, perubahan dahak) dari kondisi biasa sehari-hari. Eksaserbasi pada PPOK sekitar 70% disebabkan oleh infeksi baik bakteri maupun virus selebihnya polutan lingkungan dan komorbid 1,4 . Eksaserbasi berhubungan dengan peningkatan respons inflamasi dan perburukan gejala. Kondisi eksaserbasi akut PPOK merupakan suatu kondisi penting karena memiliki efek negatif terhadap kualitas hidup penderita. Eksaserbasi akut PPOK memperberat derajat PPOK. Perbaikan gejala dan perbaikan fungsi paru akibat eksaserbasi membutuhkan waktu lebih lama. Eksaserbasi juga menyebabkan meningkatnya perawatan di rumah sakit (RS), meningkatnya beban sosio ekonomi, meningkatnya angka mortalitas, dan memperburuk prognosis 1,4,5. 6. Diagnosis PPOK Diagnosis klinis PPOK dipertimbangkan jika didapatkan sesak napas (bersifat progresif, persisten, dan memberat dengan beraktivitas), batuk kronik (dapat bersifat intermiten dan tidak produktif), produksi sputum kronik, riwayat paparan faktor risiko (asap rokok, asap pembakaran dan pemanasan, debu pekerjaan, dan kimia) dan riwayat keluarga dengan PPOK. Spirometri diperlukan pada pasien lebih dari 40 tahun dengan klinis tersebut dan ditegakkan diagnosis PPOK jika didapatkan VEP1/KVP paska uji bronkodilator < 0,7 yang menunjukkan keterbatasan aliran udara persisten 1,4. Pemeriksaan fisik penderita PPOK seringkali normal diluar serangan dan saat penyakit pada stadium dini. Kelainan pemeriksaan fisik tampak saat derajat berat. Tanda khas PPOK berupa pursed lipsbreathing, barrel chest, penggunaan otot bantu napas, hipertrofi otot bantu napas, pelebaran sela iga, peningkatan tekanan vena jugularis, dan edema tungkai. Ronki basah kasar dan mengi sering terdapat pada saat ekspirasi 1,4 . Penilaian derajat keparahan PPOK ditentukan berdasarkan gejala klinis, derajat obstruksi aliran udara, risiko eksaserbasi, dan faktor komorbiditas. Global Initiative of Chronic Obstructive Lung Diseases (GOLD) tahun 2016 merekomendasikan penggunaan dua kuisioner untuk menilai gejala klinis PPOK yaitu kuisioner Modified Medical Research Council (mMRC) dan COPD Assesment test (CAT) 1,4 . Kuesioner mMRC untuk menentukan derajat sesak napas PPOK dijelaskan oleh Tabel 11,4, 61. Tabel 1 kuesioner dari mMRC. TEBALKAN DALAM KOTAK YANG SESUAI DENGAN ANDA (SATU KOTAK SAJA) mMRC tingkat 0. Saya hanya mendapat sesak apabila latihan yang berat mMRC tingkat 1. Saya mendapat sesak apabila tergesa-gesa menaiki tangga atau berjalan menaiki bukit. mMRC tingkat 2. Saya berjalan lebih lambat daripada orang lain seusia saya karena rasa sesak, atau saya harus berhenti untuk bernapas ketika berjalan pada tingkat kecepatan saya sendiri mMRC tingkat 3. Saya berhenti bernapas setelah berjalan 100 meter atau setelah beberapa menit dengan tingkatannya mMRC tingkat 4. Saya terlalu mudah sesak untuk bepergian meninggalkan rumah atau saya merasakan sesak ketika memakai pakaian atau melepaskan pakaian Dikutip dari (1) 7. Skor COPD assessment test pada PPOK Skor COPD Assessment Test (CAT) merupakan kuesioner yang tervalidasi dan mudah diterapkan terdiri dari delapan item pernyataan untuk mengetahui status kesehatan pada PPOK 1. COPD Assessment Test bisa digunakan untuk semua pasien yang terdiagnosis PPOK pada semua derajat keparahan baik PPOK stabil maupun eksaserbasi. COPD assessment test (CAT) bukan merupakan alat diagnostik pengganti spirometri dan tidak menggantikan terapi PPOK, tetapi CAT dan spirometri merupakan komponen pengukuran untuk menilai klinis, membantu monitoring efek PPOK seperti program rehabilitasi atau perbaikan eksaserbasi sehingga terapi yang diberikan dapat optimal. Nilai skor CAT meningkat saat eksaserbasi akut dan menggambarkan beratnya eksaserbasi berkaitan dengan fungsi paru dan lama perawatan 1,62. Kuesioner CAT dijelaskan oleh Gambar 16 1,62. Gambar 16. Kuesioner CAT memiliki 8 item pertanyaan. Dikutip dari (62) Pemeriksaan spirometri merupakan baku emas penegakan diagnosis PPOK dan dapat digunakan untuk menentukan derajat berat obstruksi saluran napas. Standar emas diagnosis PPOK berdasarkan nilai VEP1 prediksi (VEP1/KVP) paska bronkodilator <70%. Nilai VEP1 menunjukkan kecepatan udara yang keluar dan digunakan untuk mengukur obstruksi aliran udara. Derajat obstruksi saluran napas dibagi menjadi ringan, sedang, berat, dan sangat berat, seperti pada Tabel 2 1. Tabel 2.Derajat obstruksi menurut hasil spirometri. Penderita FEV-1/FVC < 70% GOLD 1 Ringan GOLD 2 Sedang GOLD 3 Berat GOLD 4 Sangat berat 8. Derajat Eksaserbasi Prediksi FEV-1 ≥ 80% prediksi 50% ≤ FEV-1< 80% prediksi 30% ≤ FEV-1< 50% prediksi FEV-1< 30% prediksi Dikutip dari (1) Eksaserbasi rata-rata terjadi tiap tahun dan menjadi penting karena berhubungan dengan pemberian terapi. Derajat eksaserbasi akut tanpa gagal napas diklasifikasikan berdasarkan beberapa sistem penderajatan. Salah satu klasifikasi berdasar kriteria Winnipeg. Winnipeg membagi derajat eksaserbasi berdasar tiga gejala kardinal yaitu peningkatan jumlah dahak, perubahan warna (purulensi) dahak, dan penambahan sesak napas. Kriteria Winnipeg dapat dilihat pada Tabel 3 63. Tabel 3.Derajat eksaserbasi akut PPOK berdasar kriteria Winnipeg. Derajat eksaserbasi Gejala klinis Tipe 1 Tiga gejala meliputi peningkatan jumlah sputum, purulensi sputum, dan sesak napas bertambah Tipe 2 Dua dari tiga gejala Tipe 3 Satu dari tiga gejala ditambah paling tidak satu kriteria yaituinfeksi saluran napas, demam, mengi, batuk bertambah, atau peningkatan denyut jantung >20% dari nilai dasar. Dikutip dari (63) Global Initiative of Chronic Obstructive Lung Diseases tahun 2016 membagi PPOK menjadi grup A, B, C, dan D berdasarkan penilaian keempat faktor diatas. Penderita derajat A adalah penderita dengan risiko rendah dan sedikit gejala, ditandai derajat obstruksi saluran napas GOLD 1-2, risiko eksaserbasi ≤1x/ tahun atau tidak membutuhkan perawatan RS, dan nilai mMRC 0-1 atau CAT <10. Penderita derajat B adalah penderita risiko rendah dan gejala lebih, ditandai derajat obstruksi saluran napas GOLD 1-2, risiko eksaserbasi ≤1x/ tahun atau tidak mmbutuhkan perawatan RS, dan nilai mMRC ≥2 atau CAT ≥10. Penderita derajat C adalah penderita risiko tinggi dan sedikit gejala, ditandai derajat obstruksi saluran napas GOLD 3-4, risiko eksaserbasi ≥2x/ tahun atau ≥1x membutuhkan perawatan RS, dan nilai mMRC 0-1 atau CAT <10. Penderita derajat D adalah penderita risiko tinggi dan gejala lebih, ditandai derajat obstruksi saluran napas GOLD 3-4, risiko eksaserbasi ≥2x/ tahun atau ≥1x membutuhkan perawatan RS, dan nilai mMRC >2 atau CAT ≥10 1. Penilaian derajat berat penyakit PPOK menurut GOLD dapat dilihat pada Gambar 17 1. Gambar 17. Kategori penderita PPOK. Keterangan : kategori penderita dikelompokan menjadi empat golongan berdasarkan derajat hambatan saluran napas, gejala sesak napas dan risiko eksaserbasi dalam setahun. Dikutip dari (1) 9. Penatalaksanaan PPOK Tujuan penatalaksanaan PPOK antara lain mengurangi gejala, mencegah progresivitas penyakit, meningkatkan toleransi latihan, meningkatkan kualitas hidup penderita, mencegah dan menangani komplikasi, mencegah dan menangani eksaserbasi, serta menurunkan risiko kematian 1,4. Tatalaksana PPOK terdiri atas non-farmakologik dan farmakologik. Terapi nonfarmakologik antara lain berhenti merokok, rehabilitasi dengan fisioterapi dada serta latihan pernapasan untuk memperkuat otot napas dan membuang kelebihan karbondioksida yang terkumpul di alveoli paru. Terapi farmakologis diberikan saat penderita dalam kondisi stabil dan eksaserbasi. Pemilihan terapi PPOK saat stabil disesuaikan dengan derajat klasifikasi PPOK sesuai pedoman GOLD 2016 dijelaskan pada Tabel 4 1. Tabel 4.Terapi farmakologisPPOK saat stabil Pasien Rekomendasi pilihan Pilihan alternative Terapi lain SAMA bila perlu atau LAMA atau LABA Teophyline SABA bila perlu atau SAMA dan pertama A SABA B LAMA atau LABA LAMA dan LABA SABA dan atau SAMA Theophyline C ICS + LABA atau LAMA dan LABA SABA dan atau SAMA LAMA atau LAMA dan Theophyline PDE4-inh D ICS + LABA dan atau ICS + LAMA dan Carbosistein LAMA LABA atau ICS + SABA dan atau SAMA LABA dan PDE4-inh Theophyline atau LAMA dan LABA atau LAMA dan PDE4-inh Keterangan: SAMA: short acting muscarinic agent; SABA:short acting beta agonis; LAMA: long acting muscarinic agent; LABA: long acting beta agonis; PDE4-inh: phosphodiesterase inhibitor. Dikutip dari (1) Kriteria Rawat dan Pemulangan Pasien PPOK Eksaserbasi Akut Indikasi rawat inap pasien PPOK eksaserbasi akut adalah peningkatan gejala yang jelas seperti peningkatan sesak saat istirahat secara mendadak, riwayat PPOK berat, ditemukan tanda fisik baru seperti sianosis atau edema perifer, gagal respons pada terapi awal, adanya komorbid serius seperti gagal jantung atau aritmia, usia tua, eksaserbasi yang sering berulang dan fasilitas perawatan dirumah yang tidak memadai 1. Kriteria pasien pulang mampu menggunakan bronkodilator kerja panjang seperti β2 agonis dan atau antikolinergik dengan atau tanpa kortikosteroid inhalasi, membutuhkan bronkodilator jangka pendek tidak lebih dari tiap 4 jam, mampu bergerak sekitar ruangan, mampu makan dan tidur tidak terbangun karena sesak, pasien stabil secara klinis dalam 12-24 jam, analisis gas darah stabil dalam 12-24 jam dan pasien mampu menggunakan pengobatan di rumah, pemantauan dan rencana perawatan dirumah yang lengkap dan pasien keluarga serta dokter yakin bahwa perawatan pasien dirumah berhasil 1,4. 10. Penatalaksanaan PPOK Eksaserbasi Akut Terapi PPOK eksaserbasi meliputi pemberian bronkodilator kerja singkat, kortikosteroid, dan antibiotik. Pemberian inhalasi short acting β2 agonis (SABA) dengan atau tanpa short acting anticholinergik (SAMA) selalu menjadi pilihan dalam terapi PPOK eksaserbasi. Kortikosteroid sistemik pada PPOK eksaserbasi bertujuan untuk mempercepat penyembuhan, memperbaiki oksigenasi dan fungsi paru, mengurangi risiko eksaserbasi berulang serta kegagalan terapi. Pemberian antibiotik pada PPOK eksaserbasi masih menjadi kontroversi, karena eksaserbasi dapat disebabkan karena virus atau bakteri. Antibiotik diberikan pada PPOK eksaserbasi jika terdapat tanda infeksi bakteri dengan tiga tanda kardinal PPOK yaitu peningkatan sesak napas dan produksi dahak, serta perubahan warna dahak 1,4. 11. Terapi Antiinflamasi PPOK Inflamasi berperan penting dalam patofisiologi PPOK. Infeksi bakteri atau pajanan asap rokok menginduksi peningkatan sel imun dan mediator inflamasi di saluran napas dan paru. Peningkatan inflamasi paru terutama saat eksaserbasi menyebabkan spillover mediator inflamasi paru ke sirkulasi sehingga berdampak padapeningkatan inflamasi sistemik.Inflamasi kronik pada PPOKmenyebabkan resisten terhadap kortikosteroid. Penurunan sensitivitas ktortikosteroid diakibatkan oleh penurunan kadar atau aktivitas HDAC 30 . Pendekatan terapi antiinflamasi alternatif PPOK diperlukan untuk menurunkan inflamasi sehingga dapat memperlambat progresifitas penyakit, memperlambat penurunan fungsi paru, menurunkan risiko eksaserbasi, morbiditas kardiovaskular, dan risiko kanker paru, serta meningkatkan kualitas hidup penderita. Pendekatan terapi antiinflamasi alternative nonsteroid PPOK meliputi phosphodiesterase (PDE)-4inhibitor,anti TNFα, NFκB dan MAPK inhibitor, serta CXCR antagonis 64. Tumbuhan telah diketahui memiliki berbagai aktivitas biologi karena dapat menghasilkan ribuan senyawa aktif. Fitoaleksin merupakan salah satu senyawa bioaktif dengan berat molekul rendah yang dihasilkan oleh tumbuhan sebagai respons terhadap infeksi mikroorganisme atau pada keadaan stres akibat pajanan sinar ultraviolet. Beberapa studi telah mempelajari bahwa fitoaleksin bermanfaat bagi kesehatan manusia antara lain antiinflamasi, antioksidan, kardioprotektif, dan neuroprotektif. Kelompok fitoaleksin beragam antara lain trepenoid, kumarin, steroid, alkaloid, dan polifenol. Salah satu senyawa fitoaleksin polifenol yang dimanfaatkan sebagai suplemen adalah resveratrol 65,66. B. Resveratrol Resveratrol (RES, 3,4’,5-trihydroxystilbene) merupakan suatu fitoaleksin polifenol turunan stilbene yang dihasilkan oleh beberapa jenis tumbuhan sebagai mekanisme pertahanan terhadap bakteri atau jamur. Resveratrol ditemukan pada kulit buah anggur, akar kering polygonum cuspidatum atau knotweed jepang, dan red wine. Resveratrol juga ditemukan dalam kacang-kacangan dan buah beri 66 . Resveratrol telah menarik banyak perhatian ahli biologi dan kimia karena memiliki aktivitas biologi yang luas bagi kesehatan manusia. Resveratrol mimiliki aktivitas antioksidan, antinflamasi, antikanker, kardioprotektif, neuroprotektif, dan antipenuaan 65,66. Resveratrol dikelompokkan dalam senyawa stilbenoid (senyawa turunan stilbene terhidroksi) atau senyawa polifenol karena memiliki lebih dari dua gugus hidroksil dalam struktur kimianya (Veres, 2004). Struktur kimia senyawa polifenol tersusun dari satu atau lebih gugus hidroksil (OH) yang terikat langsung dengan cincin aromatik hidrokarbon. Senyawa polifenol mempunyai kemampuan sebagai antioksidan alami. Kemampuan senyawa polifenol sebagai antioksidan tergantung dari sifat gugus fenol dalam mereduksi status redoks dan mempunyai potensi untuk melengkapi kekurangan elektron dari struktur kimia yang dimiliki radikal bebas 65,67. 1. Sejarah Resveratrol Resveratrol (RES, 3,5,4’-trihydroxystilbene)pertama kali ditemukanpada tahun 1940 oleh Michio Takaoka dari akar keringtumbuhan hellebore white (veratrum grandiflorum O. loes). Nonomura dkk. pada tahun 1963 menemukan resveratrol dari akar tanaman kering polygonum cuspidum atau knotweed sebagai obat tradisional negara jepang dan cina. Polygonum cuspidum atau knotweed Jepang digunakan untuk mengobati berbagai penyakit seperti dermatitis supuratif, inflamasi, hiperlipidemia, dan athlete’s foot (tinea pedis) di negara jepang. Hasil produk polygonum cuspidum seperti teh itadori atau ko-jo-kon yang merupakan sumber resveratrol menjadi konsumsi utama minuman jepang sampai sekarang. Resveratrol pada tahun berikutnya telah banyak diteliti ditemukan lebih dari 70 jenis tumbuhan dan buah meliputi anggur, blueberi, mulberi, cranberi, rhubard, kacang, dan cacao 28,68 . Resveratrol menjadi terkenal saat ditemukan dalam red wine oleh Siemann dan Creasy pada tahun 1992 karena menjadi suatu fenomena yang disebut “french paradoks” di negara Perancis. Penelitian epidemiologi di negara Perancis menunjukkan konsumsi red wine jangka panjang dan tidak berlebih diperkirakan dapat menurunkan risiko penyakit jantung meskipun kebiasaanmakan penduduk negara Perancis diit tinggi lemak, kurang olahraga, dan perokok.Salah satu alasan resveratrol menarik perhatian oleh para peneliti membuktikan bahwa resveratrol memperpanjang umur manusia. Resveratrol yang terdapat di dalam red wine merupakan hasil fermentasi utama anggur. Konsumsi resveratrol saat ini semakin meningkat di Eropa karena efek pleiotrofik biologis yang bermanfaat bagi kesehatan manusia 28,68 . 2. Struktur Resveratrol Resveratrol merupakan senyawa polifenol stilbene yang memiliki struktur rantai karbon C6-C2-C6. Stilbene berasal dari etilen yang mempunyai dua buah cincin fenol. Cincin A umumnya mempunyai dua kelompok gugus hidroksil sedangkan cincin B mempunyai sebuah kelompok gugus hidroksil. Senyawa yang beragam dibentuk berdasarkan jumlah dan lokasi kelompok gugus hidroksil. Rumus molekul resveratrol yaitu C14H12O3. Sifat fisik-kimia resveratrol yaitu berbentuk bubuk padat, berwarna off white, berat molekul 228,25 dalton atom (DA), dan meleleh pada suhu 253-255˚c 28,69 . Struktur kimia resveratrol dapat dilihat pada Gambar 18 28. Gambar 18. Stuktur kimia resveratrol (RES, 3,5,4’-trihydroxystilbene). Keterangan: HO: Hidroksil Dikutip dari (28) Ikatan ganda pada struktur kimia resveratrol berperan dalam pembentukan isomer cis dan trans-resveratrol. Resveratrol (RES) terdiri dari dua bentuk struktur isomer kimia cis dan trans.Bentuk cis dan trans resveratrol juga dapat terikat dengan senyawa glukosa disebut dengan piceid (resveratrol-3-O-β-D-glucoside). Bentuk isomer cis dan trans-resveratrol merupakan bentuk alami dan mempunyai efek biologis yang sama namun bentuk isomer trans telah diteliti dan dikenal secara luas. Trans-resveratrol lebih dominan dan stabil dalam bentuk alami. Resveratrol yang relatif stabil dan tahan lama karena tahan terhadap pH tinggi dan sinar ultraviolet (UV).Cis-resveratrol sangat sensitif terhadap sinar namun dapat stabil dalam keadaan gelap pada suhu udara ambien.Cis-resveratrol hampir tidak dapat ditemukan dalam ekstrak anggur. Bentuk umum resveratrol yaitu trans-resveratrol atau trans-3,5,4’trihydroxystilbene 28,70. Bentuk resveratrol dijelaskan pada Gambar 19 70. Gambar 19. Bentuk resveratrol. Keterangan: HO: hidroksi; GluO: glycosides. Dikutip dari (70) 3. Farmakokinetik dan Farmakodinamik Resveratrol Interaksi antara obat dan sistem biologis terbagi dua yaitu farmakokinetik dan farmakodinamik. Farmakokinetik resveratrol meliputi absorbsi, metabolisme, distribusi, dan eliminasi. Bioavailabilitas resveratrol tergantung dari absorbsi, distribusi, metabolisme ikatan resveratrol dengan berbagai molekul, dan eksresi pada tiap individu 71,72. a. Absorbsi resveratrol Resveratrol oral diabsorbsi dengan baik sekitar 70-80%dan relatif cepat dalam saluran gastrointestinal. Resveratrolyang telah tercerna diabsobsisebagian besar secara difusi pasif oleh epitel usus halusdan transport aktif oleh ATP-dependent binding cassette (ABC) sehingga memudahkan translokasi bahan terlarut masuk kedalam sel. Resveratrol memiliki daya larut air rendah. Peningkatan kelarutan RES dalam air rendah diperlukan pelarut organik antara lain dilarutkan dalam wine atau bersamaan dengan makanan. Trans-resveratrol oral memiliki berat molekul kecil dan bersifat larut lemak sehingga absorbsi lebih baik ke dalam sel 71,72. b. Metabolisme resveratrol Resveratrol mengalami konjugasi glukoronida dan sulfat di hepar dan usus halussetelah diabsorbsi sehingga mencapai sirkulasi sekitar 30-60 menit. Proses konjugasi glukuronida dan sulfat dapat meningkatkan kelarutan resveratrol dalam air sehingga mudah diekresikan oleh ginjal melalui urin. Resveratrol dalam hati manusia diubah menjadi transresveratrol-3-O-4’-disulfat (S1), trans-resveratrol-4’-O-sulfat (S2), dan trans-resveratrol-3O-sulfat (S3) oleh enzim sulfatransferase (SULT). Resveratrol dalam usus halus ditemukan dalam bentuk trans-resveratrol-4’-O-glucuronide (G1) dan trans-resveratrol-3-O- glucuronide (G2). Perubahan bentuk metabolit resveratrol dalam usus karena mengalami glukoronidase oleh uridine 5’-diphospho-glucoronosyltransferases (UGTs).Kemampuan usus halus mengabsorbsi dan memetabolisme resveratrol tergantung fungsi hepar dan aktivitas metabolik mikroflora lokal usus pada manusia 72,73 . Jalur metabolisme resveratrol dalam hati oleh enzim SULT dapat dilihat pada Gambar 20 73. Gambar 20. Jalur metabolisme resveratrol dalam hati oleh enzim SULT. transresveratrol-3-O-4’-Odisulfate (S1), trans-resveratrol-4’-O-sulfate (S2), dan trans-resveratrol-3-O-sulfate (S3). Dikutip dari (73) c. Distribusi Suatu senyawa terapeutik bersifat efisien bila memiliki afinitas berikatan dengan protein pengangkut. Resveratrol memiliki sifat kelarutan air rendah oleh karena itu resveratrol harus berikatan dengan protein plasma untuk memastikan terdistribusi ke seluruh tubuh dan bioavailabilitas adekuat. Resveratrol dalam proses transportasi berikatan dengan protein serum seperti albumin, asam lemak, dan lipoprotein sehingga ikatan kompleks tersebut dapat memfasilitasi penyerapan obat ke seluruh organ tubuh. Studi penelitian in vitro menunjukkan trans-resveratrol lebih dari 90% mudah berikatan dengan plasma lipoprotein manusia 72,73. d. Eksresi Seluruh metabolit resveratrol dieksresikan melalui urin dan feses setelah 24 jam pada pemberian tunggal. Metabolit utama yang ditemukan dalam urin mencit yaitu monoglukuronida dan dihidro-resveratrol, sadangkan metabolit yang ditemukan dalam urin manusia berupa konjugasi glucuronida dan sulfat dari resveratrol dan dihydro-resveratrol. Total ekskresi konjugasi glucuronida dan sulfat dalam urine dan feses manusia sekitar 8098% setelah pemberian oral dan 59-91% setelah intravena (iv) 73. e. Bioavabilitas resveratrol Bioavailabilitas resveratrol tergantung dari efektivitas absorpsi usus halus dan ekskresi ginjal. Data farmakokinetik dari beberapa penelitian menunjukkan trans-resveratrol diabsorbsi, dimetabolisme, dan diekskresikan dengan cepat pada manusia dan hewan namun resveratrol memiliki bioavailabilitas rendah sehingga mengurangi manfaat biologis dan farmakologisdalam tubuh. Studi penelitian pada manusia menunjukkan pemberian resveratrol oral 25 mg/kgbb/hari diserap sekitar 75% dan dimetabolisme dengan cepat sekitar 30 menit dengan kadar puncak di dalam plasma sebesar 2μM 72,73 . Resveratrol dengan dosis besar dapat digunakan untuk memaksimalkan hasil resveratrol namun dosis besar juga dihubungkan dengan efek samping yang buruk. Salah satu pendekatan yang sederhana untuk meningkatkan bioavailabilitas resveratrol yaitu bersamaan dengan makanan. Piperin adalah polifenol yang ditemukan pada merica hitam, dilaporkan dapat meningkatkan kadar maksimal plasma (Cmax) dan under area curve (AUC) resveratrol dalam serum tikus secara bermakna. Johnson dkk. tahun 2008 menunjukkan pemberian piperin 10mg dengan resveratrol 100mg meningkatkan kadar resveratrol dalam plasma sekitar 100% dan menghambat salah satu metabolisme glukuronida resveratrol 72,73 . Sejumlah penelitian baru menunjukkan pemberian nanocapsul resveratrol memperbaiki stabilitas dan bioavailabilitas, serta meningkatkan pemberian intraselular 72-73. f. Toksisitas Beberapa studi penelitian telah mempublikasikan berbagai efek samping pemberian trans-resveratrol oral pada hewan dan manusia. Penelitian Juan et al. 2002 melakukan penelitian pemberian trans-resveratrol intravena 80 mg/kg/hari pada tikus selama 5 hari tidak menunjukkan efek samping. Penelitan tersebut dilanjutkan dengan pemberian transresveratrol oral 250 mg/kg/hari selama 5 hari namun juga tidak menunjukkan adanya efek samping pada tikus. Studi penelitian menunjukkan bahwa efek toksik akut pemberian transresveratrol terjadi pada dosis letal (DL50) yaitu dosis letal rata-rata lebih dari 3 g/hari. Kebanyakan efek samping yang terjadi pada dosis tinggi berupa penurunan fungsi ginjal 73. Pemberian trans-resveratrol jangka panjang pada tikus juga tidak menimbulkan efek samping. Penelitian Crowell dkk. tahun 2004 menunjukkan bahwa pemberian transresveratrol oral dengan dosis terbagi masing-masing 300, 1000, dan 3000 mg/kg/hari selama 28 hari pada tikus 73 . Efek samping terbanyak didapatkan pada dosis 3000 mg/kg/hari. Efek samping tersebut meliputi penurunan nafsu makan dan berat badan, serta peningkatan tanda klinis toksik berupa peningkatan enzim hati (ALT), plasma BUN dan kreatinin. Penurunan fungsi ginjal ditandai dengan perubahan patologi berat pada ginjal. Banyak peneliti menunjukkan pemberian trans-resveratrol oral dosis 300 sampai 1000 mg/hari tidak menimbulkan efek samping pada tikus. Produk suplemen diet trans-resveratrol rata-rata sekitar 50 sampai 500 mg. Penelitian klinis pada manusia menunjukkan bahwa pemberian trans-resveratrol 50-1000 mg/hari tidak menunjukkan efek samping. Food drug administration (FDA) merekomendasikan pemberian trans-resveratrol oral dosis 300 mg/hari telah memenuhi standar untuk tingkat keamanan suplemen 72,73. 4. Peran Resveratrol pada PPOK Peranan resveratrol pada PPOK dikaitkan dengan aktivitas antioksidan dan antiinflamasi 26,51 . Resveratrol sebagai antiinflamasi mempunyai sifat pleiotrofik yaitu mampu mentargetkan berbagai jalur signal selular. Resveratrol menurunkan respons inflamasi paru pada PPOK melalui hambatan beberapa jalur signal sensitif redoks intraselular seperti NFκβ, AP1, dan MAPK. Resveratrol selain menurunkan inflamasi juga dapat meningkatkan sensitivitas glukokortikoid. Peranan resveratrol terhadap sensitivitas glukokortikoid dikaitkan peningkatan aktivitas fungsi enzim HDAC. Resveratrol sebagai antioksidan dapat mengikat (scavenger) radikal bebas secara langsung, menghambat peroksidasi lemak dan meningkatkan fungsi antioksidan enzimatik selular seperti superoxide dismutase (SOD), MnSOD, glutation (GSH), dan katalase (CAT) melalui aktivasi sirtuin1 dan nuclear factor E2 related factor2 (Nrf2) 26. a. Resveratrol sebagai antiinflamasi Resveratrol diketahui memiliki peranan sebagai antiinflamasi. Efek antiinflamasi resveratrol dikaitkan dengan sejumlah hambatan jalur signal selular redoks faktor transkripsi dan kinaseseperti NFκβ, AP1, dan PKC. Resveratrol secara langsung menghambat faktor transkripsi utama NFκβ melalui hambatan pembentukan inhibitor κβ kinase (IκK). Hambatan enzimIκK dapat menekan fosforilasi dan degradasi protein Iκβ kinase sehingga mencegah translokasi heterodimer subunit p65 dan p50 NFκβ kedalam inti sel. Inhibitor κβ kinase (IκK) merupakan enzim inhibitor pendegradasi Iκβ sehingga jumlah Iκβ meningkat dan aktivitas NFκβ terhambat. Faktor transkripsi sekunder API, MAPKp38, dan PKC juga dapat dihambat oleh resveratrol. Hambatan aktivasi NFκβ menurunkan berbagai ekspresi gen inflamasi (seperti TNFα,IL1, IL6, IL8, dan GM-CSF), molekul adhesi, dan enzim protease seperti MMPs pada PPOK Hambatan NFκβ oleh resveratrol pada penderita PPOK terjadi di sel epitel saluran napas dan makrofag alveolar28,74. Hambatan NFκβ juga dapat meningkatkan efek antiinflamasi steroid. Efek resveratrol pada jalur NFκβ, dijelaskan pada Gambar 21 28. Gambar 21. Efek resveratrol padajalur NFκβ. Keterangan : NFκβ: nuklear kappaβ; Iκβ: Inhibitor kappaβ; P: fosforilasi. Dikutip dari (28) Holmes McNary dan Baldwin tahun 2000 menunjukkan resveratrol merupakan penghambat poten aktivasi NFκβ dan AP1 padasel monosit U937 dan sel epitel alveolar A549 manusia 75 . Pemberian resveratrol oral 30 mg menghambat TNF atau LPS yang diinduksi oleh aktivasi NF-κβ melalui hambatan aktivitas Iκβ. Resveratrol juga telah menunjukkan dapat menghambat TNFα memperantarai ekspresi MMP9 dengan menurunkan regulasi aktivitas NFκβ. Resveratrol juga menghambat IL1β dan pengeluaran IL8 dan GMCSF dari makrofag alveolar oleh asap rokok 28,76 . Culpitt dkk. tahun 2001 menunjukkan resveratrol dapat menghambat pelepasan IL8 pada pasien perokok dan penderita PPOK sekitar 88% dan 94% 28. Hambatan resveratrol terhadap GM-CSF akan menurunkan molekul adhesi yaitu ICAM-1 dan e-selectin sehingga perlekatan migrasi netrofil kedalam saluran napas oleh faktor kemotaktik TNFα, LTB4, IL1β, CXCL1, CXCL5, CXCL8 menurun. Resveratrol menghambat pelepasan GM-CSF sekitar 74% dan 79% pada perokok dan penderita PPOK. Mediator faktor kemotaktik ini berasal dari makrofag, sel epitel, sel T, dan netrofil. Hambatan netrofil yang teraktivasi akan mencegah pelepasan serin protease meliputi netrofil elastase (NE), cathepsin G, dan proteinase 3, serta MMP8, MMP9 sehingga tidak menyebabkan destruksi parenkim paru, hipersekresi mukus, dan aktivasi TGFβ. Penurunan jumlah netrofil karena resveratrol pada PPOK eksaserbasi akut akan menurunkan faktor kemotaktik netrofil seperti LTB4, CXCL8 28. b. Resveratrol memperbaiki sensitivitas steroid Glukokortikosteroid merupakan terapi utama penyakit inflamasi saluran napas. Penyakit inflamasi saluran napas respons terhadap glukokortikosteroid yaitu asma. Penderita asma yang merokok dan PPOK sebagian besar resisten terhadap steroid. Glukokortikosteroid adalah antiinflamasi yang bekerja dengan cara berikatan pada reseptor glukokortikosteroid dan melibatkan aktivitas enzim HDAC2 untuk menekan regulasi transkripsi gen proinflamasi. Kegagalan terapi antiinflamasi steroid disebabkan oleh menurunnya aktivitas enzim HDAC 30 . Reactive oxygen/nitrogen species (ROS/RNS) yang dihasilkan dari pajanan asap rokok dan metabolisme selular dapat menurunkan aktivitas fungsi enzim HDAC kelas 2 sehingga kompleks interaksi HDAC dengan RelA/p65 terganggu (rasio HAT terhadap HDAC meningkat), asetilasi RelA/p65 meningkat di dalam inti sel dan terjadi sejumlah transkripsi gen proinflamasi. Histon deasetilasi (HDAC) terdiri dari 4 kelas enzim meliputi 1, 2, 3, dan 4 9,21 . Stres oksidatif juga dapat menyebabkan aktivitas enzim HDAC kelas 3 (sirtuin 1/sir2) menurun. Suatu penelitian baru menunjukkan bahwa asap rokok mengganggu fungsi sirtuin1 pada makrofag alveolar pada manusia secara in vitro dan pada paru tikus secara in vivo. Penurunan kadar/aktivitas enzim HDAC kelas 2 dan sirtuin 1/sir2 menyebabkan efek faktor transkripsi NFκβ semakin kuat dan efek terapi antiinflamasi steroid menurun pada perokok dan penderita PPOK 9,21. Sirtuin, homolog sir yeast2 adalah gen yang berperan dalam antiaging pada jamur seperti jamur caenorhabditis elegans, and drosophila. Sirtuin terdiri dari 7 isoenzim. Sirtuin 1/sir2 merupakan gen penting pada manusia berperan untukmemperrtahankan terhadap kondisi stres selular, inflamasi, penuaan, dan metabolisme baik protein maupun lemak. Sirtuin 1 berperan sebagai antiinflamasi, antioksidan, dan antiaging pada PPOK. Resveratrol memperantai aktivitas sirtuin 1 dalam memperpanjang kelangsungan hidup sel dan memperbaiki fungsi mitokondria pada makhluk hidup. Suatu penelitian Sirtuin 1 termasuk kelompok HDAC kelas 3 dan membutuhkan nicotinamide adenine dinucleotide (NAD+) sebagai ko-subtrat dalam proses deasetilasi. Target molekular sirtuin1 seperti NFκβ subunit RelA/p65, p300, p53, peroxisome proliferator-activated response-coactivator-1α (PARP), dan forkhead transcription factorbox kelas O3 (FOXO3) 27,28,50 . Resveratrol secara langsung menginduksi sirtuin1 untuk berikatan dengan NFκβ subunit RelA/p65 sehingga tidak terjadi asetilasi RelA/p65 dan proses “silencing” transkripsi gen proinflamasi dapat dihambat, dijelaskan pada Gambar 22 50. Gambar 22. Efek stres oksidatif dan diit polifenol pada modifikasi struktur kromatin dan ekspresi gen proinflamasi. Keterangan : IκB : inhibitor kappa B; p65 dan p50 : subunit protein; CBP/p300 :cAMP binding protein; HAT : histon asetiltransferase; SIRT :silent information regulator; P: fosforilasi; Ac : asetilasi. Dikutip dari (50) c. Resveratrol sebagai antioksidan Resveratrol mempunyai aktivitas antioksidan karena mampu menetralisir radikal bebas dan meningkatkan antioksidan enzimatik selular. Zini dkk. tahun 1999 menunjukkan resveratrol berperan sebagai antioksidan alami melalui tiga mekanisme yang berbeda yaitu (a) mengikat (scavenger) radikal bebas, (b) mencegah peroksidasi lemak yang dihasilkan dari reaksi fenton, (c) menstimulasi biosintesis antioksidan endogen enzimatik melalui modulasi signal transduksi redoks antara lain nuclear erythroid-related factor (Nrf2) dan Forkhead transcription factor box kelas O 3 (FOXO3) 28 . Resveratrol sebagai antioksidan berperan mengikat (scavenger) radikal bebas dengan menyumbangkan elektronnya (atom hidrogen) ke molekul radikal bebas yang bersifat reaktif sehingga menjadi lebih stabil. Resveratrol baik secara in vivo dan in vitro dapat mengaktifkan dan meningkatkan beberapa antioksidan endogen enzimatik seperti MnSOD, CAT, glutation (GSH) reduktase, dan peroksidase 27,75 . Penelitian menurut Yen dkk dilanjutkan oleh Pandey dan Rizvi pada tahun 2010 menyatakan bahwa resveratrol mampu melindungi sel epitel saluran napas dari kerusakan oksidatif dengan menginduksi sintesis GSH melalui faktor transkripsi nuclear factor E2 related factor2 (Nrf2) 26. C. Kerangka Teori Penyakit paru obstruktif kronik (PPOK) eksaserbasi adalah kondisi akut yang ditandai dengan perburukan gejala respiratorik berupa sesak napas, batuk, dan produksi dahak diluar variasi normal sehingga membutuhkan pengobatan lebih intensif. Faktor penyebab PPOK eksaserbasi yaitu faktor internal dan eksternal. Faktor internal yaitu infeksi saluran napas dan eksternal yaitu pajanan polutan didalam rumah (keluarga perokok dan asap pembakaran kayu) dan pajanan polutan diluar rumah (asap transportasi dan tempat kerja). Faktor umur, status gizi, pekerjaan juga dapat menjadi perancu timbulnya eksaserbasi. Eksaserbasi berkontribusi terhadap keparahan penyakit oleh karena dapat meningkatkan respons inflamasi, stres oksidatif, dan kadar protease. Peningkatan (amplifikasi) respons inflamasi mengakibatkan pengerahan sel inflamasi (neutrofil, makrofag, eosinofil, limfosit) dalam jumlah besar masuk ke saluran napas dan paru. Peningkatan sel inflamasi menyebabkan faktor transkripsi NFκβ teraktivasi. Nuclear factor kaffa β (NFκβ) dalam keadaan tidak teraktivasi berikatan dengan protein keluarga inhibitor κappa β (Iκβ α, Iκβ β, dan Iκβ ε) di sitoplasma. Inhibitor κappa β (Iκβ) merupakan penghalang translokasi faktor transkripsi NFκβ kedalam inti sel. Fosforilasi dan degradasi Iβ oleh radikal bebas menyebabkan NFκβ lepas dari Iβ melalui enzim IK selanjutnya translokasi kedalam inti sel. Aktivitas NFκβ di dalam inti sel menghasilkan berbagai mediator inflamasi antara lain, sitokin (TNF-α, IL-8, IL-6,dan IL-1β), kemokin (chemokine ligand CXCL8), dan proteinase (netrofil elastase, dan MMP-9). Kondisi eksaserbasi juga dapat meningkatkan inflamasi sistemik yang disebabkan oleh spillover mediator inflamasi paru ke sirkulasi. Inflamasi kronik PPOK meningkatkan resistensi glukokortikosteroid. Sel inflamasi neutrofil dan makrofag merupakan sumber utama ROS/RNS endogen. Paru memiliki mekanisme pertahanan untuk mempertahankan kondisi homeostasis dengan menghasilkan antioksidan endogen. Kondisi eksaserbasi akan mengerahkan sel inflamasi kedalam saluran napas sehingga menghasilkan pelepasan ROS berlebih. Ketidakseimbangan antara oksidan dan antioksidan yang mengakibatkan timbulnya stres oksidatif. Stres oksidatif baik secara langsung maupun tidak langsung menyebabkan perubahan struktur dan fungsi saluran napas dan parenkim paru. Stres oksidatif secara langsung menyebabkan oksidasi DNA, lemak, dan protein membran sel saluran napas dan paru. Stres oksidatif tidak langsung mengaktivasi faktor transkripsi NFκβ yang berdampak pada regulasi sejumlah mediator inflamasi. Amplifikasi inflamasi, peningkatan stres oksidatif, dan peningkatan produksi dan aktivitas protease menyebabkan terjadinya perubahan struktur dan fungsi saluran napas yang bersifat kronik, progresif, dan ireversibel. Perubahan patofisiologis berupa hipersekresi mukus dan disfungsi silia, edema saluran napas, dan fibrosis saluran napas kecil, serta emfisema paru. Perburukan gejala klinis PPOK saat eksaserbasi dapat dinilai dengan kuesioner CAT. Kerangka teori secara ringkas dapat dilihat pada Gambar 24. PPOK Faktor internal : infeksi saluran napas Faktor eksternal : pajanan polutan lingkungan, lingkungan keluarga perokok Variabel perancu : umur, status gizi, pekerjaan PPOK eksarsebasi akut CAT Amplifikasi inflamasi ↑ aktivitas dan jumlah sel inflamasi (makrofag, neutrofil, monosit, limfosit, fibroblast) Struktur sel saluran napas (sel epitel, sel goblet) ↑ROS ↑Protease ↓antiprotease ↑Stres oksidatif Aktivasi faktor transkripsi (NFkβ) Oksidasi lipid Destruksi MES Emfisema MDA Release mediator inflamasi IL-8↑ IL-1β↑ IL-6↑ TNF-α↑ GMCSF ↑ TGF-β ↑ Neutrofil elastase MMP-9 ↑ ↑ Inflamasi saluran napas, hipersekresi mukus, edema saluran napas, fibrosis saluran napas kecil, dan emfisema paru Perburukan gejala klinis (CAT↑) Gambar 23.Kerangka Teori Patogenesis PPOK. D. Kerangka Konsep Penelitian Inflamasi memegang peranan penting dalam imunopatogenesis PPOK. Pada kondisi eksaserbasi respons inflamasi meningkat (amplifying) di saluran napas dan paru. Eksaserbasi dapat disebabkan oleh faktor internal yaitu infeksi saluran napas dan faktor ekternal antara lain pajanan polutan lingkungan luar dan lingkungan keluarga perokok. Faktor umur, status gizi, pekerjaan juga dapat menjadi perancu terjadinya eksaserbasi. Penderita PPOK eksaserbasi akut derajat berat dilaporkan lebih banyak mengalami malnutrisi. Penyebab malnutrisi PPOK antara lain diit rendah, inflamasi, dan hipoksia kronik 1. Amplifikasi inflamasi mengakibatkan pengerahan sel imun (neutrofil, makrofag, eosinofil, limfosit) masuk dalam saluran napas dan paru. Peningkatan sel imun menstimulasi aktivitas NFκß. Aktivasi NFκβ akan mengeluarkan berbagai mediator inflamasi yaitu IL-8 dan MMP-9. Peningkatan sel imun juga dapat mengaktivasi protease sehingga terjadi emfisema paru. Interleukin (IL)-8 memiliki peranan penting dalam amplifikasi respons inflamasi pada PPOK eksaserbasi. Kadar IL-8 meningkat di sputum dan plasma pada PPOK eksaserbasi. Peningkatan kadar IL-8 menyebabkan jumlah sel netrofil meningkat. Peningkatan jumlah sel netrofil akan menghasilkan enzim elastase 42 . Matrik metalloproteinase (MMP)-9 diketahui mempunyai peranan penting dalam mendegradasi jaringan elastin 18,42. Resveratrol merupakan senyawa polifenol stilbene yang memiliki aktivitas antiinflamasi. Resveratrol secara langsung menghambat faktor transkripsi utama NFκβ melalui hambatan pembentukan IκK. Hambatan aktivasi NFκβ menurunkan berbagai pengaturan ekspresi gen mediator inflamasi salah satunya IL-8 dan MMP-9 28,74 . Penurunan mediator inflamasi diharapkan dapat memperbaiki gejala klinis yang dinilai dengan skor CAT. Kerangka konsep secara ringkas dapat dilihat pada Gambar 25. PPOK Faktor internal : infeksi saluran napas Faktor eksternal : pajanan polutan lingkungan, lingkungan keluarga perokok Variabel perancu : umur, status gizi, pekerjaan PPOK eksarsebasi akut CAT Amplifikasi inflamasi ↓ Aktivasi faktor Resveratrol transkripsi (NF-kβ) (NFkβ) ↓Release mediator ↓Releaseinflamasi mediator inflamasi ↓interleukine ↓interleukine (IL)-8 (IL)-8 plasma, plasma, MMP-9 MMP-9 plasma plasma ↓ Inflamasi saluran napas, hipersekresi mukus, edema saluran napas, fibrosis saluran napas kecil, dan emfisema paru Perbaikan gejala klinis (CAT↓) Gambar 24. Kerangka konsep penelitian tentang pengaruh resveratrol terhadap kadar IL-8 plasma, MMP-9 plasma, dan skor CAT penderita PPOK eksaserbasi akut. Variabel penelitian: variabel terikat ,variabel bebas , Area penelitian:------- E. Hipotesis Penelitian 1. Ada pengaruh pemberian resveratrol terhadap penurunan kadar IL-8 plasma penderita PPOK eksaserbasi akut. 2. Ada pengaruh pemberian resveratrol terhadap penurunan kadar MMP-9 plasma penderita PPOK eksaserbasi akut. 3. Ada pengaruh pemberian resveratrol terhadap skor CAT penderita PPOK eksaserbasi akut.