pendahuluan - E-Journal Research Center for Biology-LIPI
advertisement

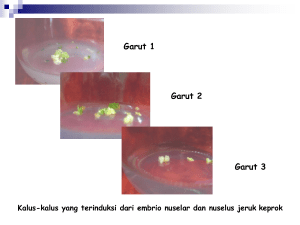
Berita Biologi 10(4) - April 2011 TINJAUAN ULANG (REVIEW) PARTENOKARPI: BUAH TANPABIJI - APA, MENGAPADAN BAGAIMANA [Parthenocarpy: Seedless Fruit - What, Why and How] LAgus Sukamto Bidang Botani, Pusat Penelitian Biologi-LIPI CibinongScienceCenter,JlnRayaJakarta-BogorKm46,Cibinong 16911 e-mail: [email protected] ABSTRACT Fruit growth and development occurred in plant for producing the offspring. Pollination and fertilization will form embryo and seed, which produce and supply plant growth regulators (PGR) for fruit growing. The role of seed can be exchanged with supply of POR exogenously and produce seedless fruit. Seedless fruit could be produced from triploid plant by crossing between tetraploid x diploid plants, in vitro culture of endosperm/irradiated pollen and genetic engineering or treated diploid plant by using PGR, pollen stress, chemical agent/ antibiotic and environment/ plant control. The benefit of triploid plant is quicker growth and produce of seedless fruits directly, whereas diploid plant could produce seedless fruits after fruit induction with special treatment. The other advantages of seedless fruit on certain plants are increased yield, fruit size/ weight, carotene and total sugar contents, decreased harvest period, yield fluctuation and blossom-end rot. Seedless fruit is preferential of consumer and give a higher price than the seeded fruit. Recently, seedless fruits of tomato, grape, citrus, cucumber and watermelon have been produced in commercial industries. Key words: Parthenocarpy, seedless fruit, plant growth regulator, crossing, endosperm culture, triploid plant, genetic engineering, radiation. ABSTRAK Buah-buah tanpa biji adalah buah-buah yang terjadi tanpa terbentuk biji, yang disukai konsumen dan harga jualnya menjadi lebih tinggi dibanding buah yang berbiji. Keuntungan lain dari buah tanpa biji pada tanaman tertentu yaitu meningkatkan hasil, ukuran/ berat buah, kandungan karoten dan gula, mempercepat pemanenan, mengurangi fluktuasi panen dan busuk ujung buah. Terjadinya buah dan biji pada tanaman untuk menghasilkan keturunan. Penyerbukan dan pembuahan akan membentuk embrio dan biji, yang akan memproduksi dan memasok zat pengatur tumbuh (ZPT) untuk pertumbuhan buah. Peranan embrio dan biji dapat digantikan dengan pemberian ZPT dari luar dan menyebabkan terbentuknya buah tanpa biji. Buah tanpa biji dapat diproduksi dari tanaman triploid dengan menyilangkan tanaman tetraploid dengan diploid, kultur endosperma secara in vitro/ radiasi benangsari, rekayasa genetika atau perlakuan tanaman diploid dengan ZPT, stress benangsari, zat kimia/ antibiotika dan pengaturan lingkungan/ tanaman. Metoda yang paling baik untuk memproduksi buah tanpa biji adalah dengan perlakuan kultur endosperma/ radiasi benangsari secara in vitro untuk menghasilkan tanaman triploid. Tanaman triploid menyebabkan pertumbuhan menjadi lebih cepat dan memproduksi buah-buah tanpa biji secara langsung. Kini, buah-buah tomat, anggur, jeruk, ketimun dan semangka tanpa biji telah diproduksi dalam skala besar secara komersial. Kata kunci: Buah tanpa biji, zat pengatur tumbuh, penyilangan, kultur endosperma, tanaman triploid, rekayasa genetika, radiasi PENDAHULUAN Istilah partenokarpi pertama kali diperkenalkan oleh Noll pada tahun 1902 untuk menunjukkan peristiwa pembentukan buah tanpa penyerbukan atau melalui rangsangan. Winkler 1908 mengatakan partenokarpi adalah pembentukan buah tanpa biji atau buah dengan biji yang hampa; dewasa ini umumnya partenokarpi diartikan sebagai peristiwa pembentukan buah tanpa pembuahan bakal buah (Tukey, 1954; Weaver, 1972).Partenokarpimerupakan suatu peristiwa mencengangkan dan aneh karena pembentukan buah tanpa melalui pembuahan sel telur, tanaman memerlukanbanyak energi untuk pembesaranbuahnya, tetapi tidak memperoleh keturunan dengan tidak terbentuknya biji. Partenokarpi banyak terjadi pada tanaman yang mempunyai sejumlah besar sel telur dalam buahnya, seperti buah pisang, nenas, tomat, melon dan ara (Leopold, 1964). Nitsch (1952) membagi dalam dua golongan berdasarkan penyebab terjadinya partenokarpi, yaitu partenokarpi karena pengaruh genetik dan lingkungan. Pengaruh genetik dapat terjadi secara alami, seperti pada jeruk, ketimun, kesemek, ara, pir, anggur, pisang (Avery etal., 1947). Pengaruh lingkungan secara alami 'Diterima: 02 Februari 2011 - Disetujui: 02 Maret 2011 549 Sukamto - Partenokarpi: Buah Tanpa Biji terutama karena cuaca, yaitu kabut yang hebat pada bulan Juni menyebabkan buah zaitun tidak berbiji, beku malam (frost) terjadi pada buah pir, suhu rendah pada musim gugur terjadi pada terong (Rotino et al., 1997), suhu rendah pada musim dingin bulan Desember pada buah tomat (Mohamed, 1998); juga karena penyerbukan oleh tepungsari asing atau serangga (Nitsch, 1952). Leopold (1964) menggolongkan tiga tipe terjadinya partenokarpi secara alami, yaitu perkembangan buah tanpa terjadinya penyerbukan, seperti pada tomat, lombok, waluh, ketimun, pisang, nenas, jeruk; perkembangan buah dirangsang oleh penyerbukan tetapi pertumbuhan selanjutnya tanpa terjadi pembuahan seperti pada anggrek, Poa sp.; gugurnya embrio sebelum buah mencapai kemasakan, seperti pada cherry, peach, anggur. PERANANZATPENGATURTUMBUH(ZPT) Zat Pengatur Tumbuh (ZPT) berperanan besar dalam pembentukan dan pertumbuhan buah. Substansi ini terjadi secara endogen dalam tubuh tanamannya sendiri. Golongan ZPT, seperti auksin antara lain berperan dalam merangsang pembelahan sel, peningkatan plastisitas dan elastisitas dinding sel, -mengatur pembungaan dan terjadinya buah; giberelin (GA) antara lain berperanan dalam merangsang pertumbuhan jaringan muda, pembungaan dan peningkatan pembelahan sel (Weaver, 1972). Banyak bukti yang menunjukkan adanya hubungan kandungan auksin dengan kegagalan pembentukan buah (Nitsch, 1950). Thimann (cit. Gustafson, 1939) mendapatkan adanya auksin dalam tepungsari. Bakal buah (ovarium) mengandung auksin yang aktif, walaupun dalam jumlah sangat sedikit yang dianggap sebagai batas ambang jumlah auksin (Tukey, 1954). Batas ambang jumlah auksin dalam putik akan diubah menjadi menjadi auksin yang aktif oleh beberapa substansi yang diduga terjadi karena kegiatan enzim yang berasal dari tabling sari dan dapat mengoksidasi indole-3-acetal dehyde menjadi indole-3-acetic acid (IAA) (Bower et al., 1978). Ada hubungan yang positif antara kandungan GA, dan GA3 endogen dengan terbentuknya buah-buah jambu biji partenokarpi (Nagar and Rao, 1981), akumulasi kandungan IAA dalam ovarium pada ketimun partenokarpi (Kim et al., 1992). 550 Pembuahan terjadi bila tepungsari menyerbuki putik, pertumbuhan buah diikuti dengan pembentukan biji dan embrio. Auksin diproduksi terutama dalam jaringan meristem, biji dan embrio, kemudian diedarkan ke seluruh bagian tanaman (Gustafson, 1939; Nitsch, 1952; Coombe, 1960). Konsentrasi auksin tertinggi terdapat dalam endosperm (Coombe, 1960). Auksin berpengaruh terhadap perkembangan dan pertumbuhan buah ditunjukkan bila pusat bakal buah termasuk sel telur (ovule) dihilangkan, maka tidak terbentuk buah, tetapi terbentuk buah bila rongga tersebut dibubuhi pasta lanolin yang mengandung auksin (Nitsch, 1952). Buah dapat mengalami keguguran, terbentuk buah yang kecil tanpa biji, bila pasokan ZPT tidak mencukupi, atau terbentuk buah yang tidak simetris karena pasokan ZPT tidak merata yang berkorelasi dengan pembentukan biji. Hal ini menunjukkan peranan tepungsari dapat digantikan dengan ZPT (Thimann cit. Gustafson, 1939; Soedharoedjian, 1962; Sukamto, 1979; Carmi et al., 2003). Percobaan pada tanaman tomat yang ditumbuhkan dalam rumah kaca pada musim dingin, dimana penyerbukan dan pembentukan buahnya sangat sedikit, ternyata dapat diatasi dengan perlakuan ZPT, selain meningkatkan pembentukan buah, buah yang terbentuk sebagian besar atau seluruhnya tidak berbiji (Meyer and Anderson, 1952). Terbentuknya buah tanpa biji pada tomat, menarik minat para peneliti untuk menggunakan ZPT pada tanaman buah lainnya. CARAMENDAPATKAN BUAH TANPABIJI Buah-buah tanpa biji dapat dihasilkan dari tanaman triploid melalui penyilangan tanaman tetraploid dengan diploid, kultur endosperma/ radiasi tepungsari secara in vitro dan rekayasa genetika (genetic engineering) atau dari tanaman diploid (normal) dengan perlakuan ZPT, stress tepungsari, zat kimia/ antibiotik dan lingkungan/ tanaman. Penyilangan Tanaman Tetraploid dengan Diploid Tanaman tetraploid (2n=4x) adalah tanaman yang mempunyai jumlah kromosom kelipatan empat dari kromosom dasarnya (4n), biasanya merupakan hasil dari perlakuan zat kimia colchicine atau oryzalin untuk menggandakan jumlah kromosomnya. Tanaman diploid Berita Biologi 10(4) - April 2011 (2n=2x) adalah tanaman normal yang biasanya jumlah kromosomnya kelipatan dua dari kromosom dasarnya (2n). Persilangan kedua tanaman tersebut akan menghasilkan tanaman triploid (2n=3x) yang jumlah kromosomnya kelipatan tiga dari kromosom dasarnya (3n). Tanaman triploid memberikan keuntungan, yaitu pertumbuhannya lebih cepat, buahnya lebih besar, tidak berbiji dan lebih produktif, seperti pada pepaya, pisang, apel, jeruk, anggur (De Zerpa, 1957; Soost and Cameron, 1980; Sanford, 1983; Oiyama and Kobayashi, 1990; Thomas and Chaturvedi, 2008) dan ketimun (Chen et al, 2003), juga untuk mendapatkan pembungaan awal, aroma yang baik dan mudah dikupas pada jeruk melalui fiisi protoplast (Guo et al, 2000; Wu et al, 2005). Kultur Endosperma/ Radiasi Tepungsari Secara in vitro • •:£%>.,•• Endosperma adalah jaringan triploid yang terdapat pada biji, hasil dari penyatuan dua inti polar garnet betina dengan satu inti garnet jantan. Kultur endosperma merupakan suatu teknik alternatif untuk menghasilkan tanaman triploid secara langsung, hanya melalui satu pentahapan (Sita, 1987) dibandingkan dengan cara penyilangan yang harus mendapatkan dahulu tanaman tetraploid melalui penggandaan kromosom dan menunggu tersedianya bunga betina dan jantan yang masak bersamaan. Keberhasilan kultur endosperma secara in vitro dipengaruhi oleh banyak faktor, yaitu: umur yang tepat (berapa hari setelah penyerbukan) menentukan keberhasilan, seperti 7-10 hari pada ketimun (Nakajima, 1962), 35-60 hari pada loquat (Chen et al, 1988), 56 hari pada walnut (Tulecke et al., 1988), 21 hari pada tomat (Kagan-Zur et al, 1990), 84-98 hari pada jeruk besar cv White Siamese dan jeruk manis cv Ridge Pineapple (Gmitter et al, 1990), 85-95 hari pada jeruk besar cv Tosa-Buntan (Yang et al, 2000), jeruk manis cv Hongjiang (Chen et al., 1990), 28 hari pada blackberry (Cantoni et al, 2009). Selain umur endosperma, keberhasilan kultur endosperma secara in vitro juga dipengaruhi oleh faktor penyertaan zigot embrio, formulasi media, pencoklatan dan umur kultur (Sukamto, 2010). Media kultur yang paling sering digunakan untuk kultur endosperma adalah Murashige and Skoog (1962) karena kandungan garam anorganik dan nitrogen yang lebih besar (Chen et al, 1988) dan zat pemadatnya adalah phytagel karena kemurnian dan kandungan substansi perangsangnya (Ladyman and Girard, 1991). Kultur endosperma umumnya memerlukan kombinasi auksin dengan sitokinin untuk pembentukan kalusnya, seperti 2,4dichlorophenoxy acetic acid (2,4-D) 9xlO'6M + 6benzylamino purine (BA) 22x10'6M, gibberellic acid (GA) 6-43x10'6M untuk pembentukan embrio dan planletnya pada Citrus grandis cv Bei-pei dan C. sinensis cv Chin-cheng (Wang and Chang, 1978), 2,4D 2xlO6M + BA 2xlO"6M, GA 0,3-14xl0-6M untuk pembentukan akar dan planletnya pada C. sinensis cv Hongjiang (Chen et al, 1990), 2,4-D 9x106M + BA 22x 10"*M + 6-furfurylamino purine (Kn) 23x 1 O^M dan BA 10"6M + Adenine 15xlO6M + GA6x10 6 M untuk pembentukan embrio, akar dan planletnya pada C. sinensis cv Ridge Pineapple (Gmitter et al, 1990), 2,4D 0,5 mg/1 + B A 1,5 mg/1 + IAA 0,5 mg/1, G A310 mg/1 + BA 2 mg/1 untuk pembentukan tunas dan 2,4-D 2x106 M + BA 2xlO-6M + IAA 1,5 mg/1 untuk pengakaran pada pir (Zhao, 1988), zeatin 3 mg/1+NAA 0,1 mg/1 dan ditransfer ke zeatin 3 mg/1 + 2,4-D 0,5 mg/1 pada Chinese gooseberry (Gui et al, 1988). Endosperma pepaya memerlukan 2,4-D 6 uM +NAA 2,5 uM + Kn 4 uM, 1,5 uM BA + 3 uM IAA untuk pembentukan tunas dan indole-3-butyric acid (IBA) 2 uM untuk perakaran (Sun et al, 2011), tetapi kultur endosperma kelapa tidak memerlukan auksin untuk pembentukan kalusnya dan 4-amino-3,5,6-trichloropicolinic acid (picloram) lebih baik dibanding 2,4-D dalam merangsang organogenesis (Sukamto, 1996). Peranan sitokinin diperlukan untuk pembentukan tunas pada endosperma, seperti BA 10" 5 M pada kelapa (Sukamto, 1996), thidiazuron (TDZ) 0,5 mg/1 pada Actinidia deliciosa cv Hayward (Goralski et al, 2005), BA 0,44 uM + GA3 2,89 uM padaLonicera caerulea var. emphyllocalyx (Miyashita et al, 2009). Perlakuan tepungsari tanaman kiwi dengan radiasi sinar gamma dosis 900 Gy dan ditumbuhkan secara in vitro dapat menghasilkan tanaman triploid langsung walaupun tergantung pada genotipe dan dosis radiasinya (Musial and Przywara, 1998). Perlakuan tepungsari jeruk lemon 'Meyer' dengan radiasi sinar gamma dosis 150-900 Gy dan diserbukkan pada putik tanaman jeruk mandarin menghasilkan 551 Sukamto - Partenokarpi: Buah Tanpa Biji tanaman diploid dan triploid (Froelicher et al, 2007). lakuan Rekayasa Genetika (Genetic Engineering) Pada prinsipnya rekayasa genetika tanaman memungkinkan pengubahan suatu sifat yang dituju menjadi jenis berbeda dan dalam jenis menjadi varietas yang dituju. Untuk mengubah buah partenokarpi, suatu gen chimera dikonstruksi, khususnya penggunaan gen DefH9-iaaM yang mengandung daerah pengkode gen iaaM dari Pseudomonas syringae pv. savastanoi di bawah kendali promotor spesifik plasenta dan ovule dari gen DefH9 dari Anthirrinum majus. Gen iaaM mengkode tryptophan monoxygenase yang memproduksi indolacetamide, kemudian secara kimiawi atau ensimatis diubah menjadi auksin indole-3-acetic acid. Penggunaan gen DefH9-iaaMtelah menghasilkan buah partenokarpi pada tembakau dan terung (Rotino et al, 1997; Acciarri et al, 2002), tomat (Ficcadenti et al, 1999). Tanaman tomat ditransformasi dengan suatu konstruksi chimera mengandung gen rolB berfusi pada ovary dan promotor spesifik buah muda TPRP-F1 menghasilkan buah-buah yang tanpa biji (Carmi et al, 2003). Gen kloropas chaperonin 21 (ch-Cpn21) adalah suatu gen yang ekspresinya berbeda dari anggur galur ' Thompson' yang berbij i dan tanpa bij i, merupakan 21kDa co-chaperonin polypeptide yang dibentuk oleh dua GroES yang berfusi berurutan dan diduga menyebabkan gugurnya bij i hingga menghasilkan buah anggur tanpa biji (Hanania etal, 2007). Tanaman anggur tanpa biji transgenik juga dapat diperoleh dari meristem pucuk 'Thompson seedless' dengan perantaraan transformasi Agrobacterium (Dutt et al., 2007). Rekayasa genetika selain menghasilkan buah-buah tanpa biji, juga meningkatkan produktifitas buah sekurang-kurangnya 30-35% (Acciarri et al, 2002). Perlakuan ZPT Tiap jenis tanamanmemerlukan ZPT danmetode penggunaan yang spesifik untuk menginduksi terbentuknya buah tanpa biji (Avery et al, 1947). Metode ZPT yang praktis digunakan umumnya dalam bentuk larutan dengan cara disemprotkan. Pengemposan tomat dengan P-NOA 250 mg/1000 ft3 menghasilkan 50-98% buah tanpa biji (Mitchell and Whitehead, 1942). Penyemprotan GA3+IAA 500 mg/1, 2,4-D 40 mg/1 atau IBA 500 mg/1 menghasilkan buah 552 tanpa biji 66,7%, 50% dan 24,6% berturut-turut, sedangkan kombinasi perlakuan kastrasi dan ZPT menghasilkan semua buahnya tanpa biji (Sukamto, 1979), lombok besar {Capsicum annum) dengan chlorflurenol 100-200 mg/1 (Bisaria and Prakash, 1978). Penyemprotan tanaman kiwi dengan N-(2-chloro-4pyridyl)-N'-phenylurea (CPPU) pada 3 hari sebelum pembungaan menghasilkan buah-buah tanpa biji yang kecil, tetapi pada saat pembungaan menghasilkan buah-buah yang besar dan berbij i (Iwahori et al, 1988). Penyemprotan CPPU 2 mg/1 sebanyak 3 kali pada 1 hari sebelum, 7 dan 14 hari setelah pembungaan atau 5 mg/ 1 sebanyak 2 kali pada 1 hari sebelum dan 7 hari setelah pembungaan atau 10 mg/1 sekali pada 1 hari sebelum pembungaan (Hitoshi et al., 2010), labu beligo (Lagenaria leucantha) dengan CPPU 10-100 mg/1 (Yu, 1999; Yu et al, 2001), semangka dengan CPPU pada ovari bunga yang membuka pada semangka menghasilkan buah tanpa biji dan meningkatkan hasil sedikitnya 50% dibanding tanaman triploid yang memerlukan penyerbukan dari tepungsari tanaman diploid. Penyemprotan 2,4-D secara langsung membasahi seluruh tanaman semangka tanpa dibatasi pada ovari bunga, menyebabkan biaya perlakuan berkurang, hanya hasilnya berkurang 10% (Maroto et al, 2005), loquat dengan GA3100 mg/1 (Mesejo et al, 2010). Perlakuan Tepungsari Penyerbukan bunga labu Cucurbita pepo dengan tepungsari yang telah lama dan mengalami pengeringan (stress) akan menghasilkan buah-buah yang tanpa biji (Gay et al, 1987). Penyerbukan yang terjadi dengan tepungsari yang daya kecambahnya rendah (< 10%) dapat menyebabkan buah pepino tidak berbiji (Ercan and Akilli, 1996). Perlakuan tepungsari dengan radiasi sinar gamma dosis 800-1000 Gy dan diserbukkan pada putik tanaman semangka cv. 'Fujihikari' menghasilkan buah tanpa biji, sedangkan dosis 400-1000 Gy pada semangka cv. 'Benikodama' menghasilkan buah tanpa biji yang lebih manis dibanding kontrol (Sugiyama and Morishita, 2000), dosis 600 and 800 Gy menghasilkan buah semangka tanpa biji karena tabung tepungsari yang normalnya menembus ke dalam sinergida dan sel sperma dikeluarkan, inti sel telur dan inti sperma melekat jadi Berila Biologi 10(4) - April 2011 satu dalam sel telur, globular embrio terbentuk tetapi embrio gagal berdiferensiasi dan mengalami degenerasi; perlakuan tepungsari semangka dengan sinar gamma dapat meningkatkan hasil, kandungan karotin, gula, berat buahnya dan ada kecenderungan kulit buahnya berkurang (Moussa and Salem, 2009). Perlakuan Zat Kimia/Antibiotik Penyemprotan zat kimia CuSO4.5H2O 25 mg/1 pada tanaman jeruk mandarin 'Clemenules' sebelum bunganya mekar dan jeruk 'Afourer' pada saat bunga mekar penuh meningkatkan terbentuknya buah-buah tanpa biji tanpa mengurangi hasil buahnya (Mesejo et al., 2006). Penyemprotan streptomycin 400 mg/1 pada perbungaan 6-8 hari sebelum bunga mekar, diikuti dengan penyemprotan GA3 30 mg/1 pada perbungaan 12 hari setelah mekar akan menghasilkan dompolan buah anggur 466 g dan 100% tanpa biji dengan berat rata-rata per buah 6,3 g (Pommer et al., 1996). Perlakuan Lingkungan/Tanaman Perlakuan suhu rendah 26°C pada malam hari dan intensitas cahaya yang tinggi pada siang hari dengan suhu 32°C akan menghasilkan buah-buah tanpa biji 53% pada tanaman tomat (Sato et al., 2001). Perlakuan tanaman dengan mengupas kulit selebar 1 cm sampai batas kayunya sekeliling batang menyebabkan hasil asimilasi/ ZPT giberelin tertahan di atas luka irisan hingga meningkatkan ukuran buah dan menghasilkan buahbuah tanpa bij i pada tanaman anggur (Weaver and Pool, 1965) dan loquat (Mesejo et al., 2010). PEMBAHASAN Persilasgan aatara tanaman tp.trjyi1nirl c\p.r\gar\ diploid merupakan suatu metoda sederhana yang dapat menghasilkan tanaman triploid, banyak dilakukan oleh industri benih. Petani tidak dapat memperbanyak benih dari tanaman triploid hingga selalu membeli benih dari industri benih. Metode persilangan menghadapi banyak kendala yaitu memerlukan waktu yang panjang, melalui pentahapan penggandaan kromosom untuk mendapatkan tanaman tetraploid, menunggu pembungaan tanaman diploid dan tetraploid untuk dapat disilangkan. Daya kecambah biji hasil persilangan yang rendah karena ada kegagalan endosperma berkembang yang berkorelasi dengan nisbah (ratio) jumlah kromosom embrio dengan endosperma yang tidak tepat 2 : 3 seperti pada biji yang normal, diikuti dengan keguguran embrio (Sita, 1987; Soost, 1987). Rekayasa genetika tanaman memerlukan teknik, peralatan dan bahan kimia yang canggih dan mahal. Buah tanaman hasil rekayasa genetika memerlukan waktu yang lama untuk pembuktian keamanan dikonsumsi dan masih dipersoalkan keberadaannya. Perlakuan ZPT, tepungsari, zat kimia/ antibiotik, lingkungan/ tanaman merupakan metode yang paling sederhana, tetapi memerlukan perlakuan beberapa kali dan menghasilkan buah-buah yang tidak semuanya tanpa biji (Mitchell and Whitehead, 1942; Sukamto, 1979; Hitoshi et al., 2010; Mesejo etal, 2010). Kultur endosperma/ radiasi tepungsari secara in vitro merupakan metode yang terbaik karena akan mendapatkan tanaman triploid dan akan menghasilkan buah-buah yang seluruh buahnya tanpa biji. Metode ini memerlukan pengambilan endosperma/tepungsari pada umur tertentu, penyertaan/ tidak zigot embrio, dosis radiasi yang tepat pada perlakuan tepungsari, formulasi media yang sesuai, jenis ZPT dan dosis yang tepat, menghindari pencoklatan (browning) dan umur kultur yang tidak terlalu lama (Sukamto, 2010). Di Indonesia, buah-buah yang berbiji banyak sangat potensial untuk dikembangkan sebagai buah tanpa biji, seperti srikaya, sirsak, jeruk, delima, rambutan, duku, manggis dan durian. Buah-buah tersebut bila tanpa biji akan lebih disukai konsumen dan meningkatkan harga jualnya, juga ada keuntungan tambahan pada tanaman tertentu yaitu meningkatkan prnrhiktivitas. likiiran. herat. kandungan karotin dan gula (Moussa and Salem, 2009), mempercepat pemanenan, mengurangi fluktuasi panen dan busuk ujung buah (blossom-end rot) (Heuvelink and Korner, 2001). Kultur endosperma adalah metode yang paling efektif dengan mengambil eksplan berupa endosperma dari buah-buah yang masih muda dengan mencoba berbagai umur eksplan, formulasi media, perlu penyertaan/tidak zigot embrio, pembatasan terjadinya pencoklatan dan penuaan kultur untuk mendapatkan respon pertumbuhan endosperma yang terbaik. 553 Sukamto - Partenokarpi: Buah Tanpa Biji DAFTARPUSTAKA Acciarri N, F Restaino, G Vitelli, D Perrone, M Zottini, T Pandolfini, A Spena and GL Rotino. 2002. Genetically modified parthenocarpic eggplants: improved fruit productivity under both greenhouse and open field cultivation. BMC Biotechnology 2, 4. http://www.biomedcentral.eom/1472-6750/2/4. Avery GSJr, EB Johson, RM Addoms and BF Thomson. 1947. Hormones and Horticulture. I s ' Edition. McGraw-Hill Book Company, Inc., New York and London. Bisaria AK and U Prakash. 1978. Growth, sex expression, pollen germination and yield in pepper as affected by chlorflurenol. Scientia Horticulturae 9(1), 15-20. Bower PJ, HM Brown and WK Purves. 1978. Cucumber seedling indoleacetaldehyde oxidase. Plant Physiology 61(1), 107-110. Cantoni L, G Berardi and P Rosati. 2009. Callus induction from endosperm culture of blackberrv.http:// w w w . a c t a h o r t . o r g / m e m b e r s / showpdt?booknranr=35220=abstract. Carmi N, Y Salts, B Dedicova, S Shabtai and R Barg. 2003. Induction of parthenocarpy in tomato via specific expression of the rolB gene in the ovary. Planta 217(5), 726-735. Chen Z, S Lin and Q Lin. 1988. The development of plantlets from the endosperm of loquat. In: Genetic Manipulation in Crops, 363-364. Proceedings of the International Symposium on Genetic Manipulation in Crops, Beijing. Chen RZ, G Li, LY Zhang and CY Kuo. 1990. Somatic embryogenesis of endosperm of sweet orange (Citrus sinensis cv. Hongjiang) in vitro culture. In: Proceedings International Citrus Symposium, 182-187. Guangzhao, China. Chen JF, XD Luo, JE Staub, MM Jahn and CT Qian. 2003. An allotriploid derived from a amphidiploids x diploid. Euphytica 131(2), 235-241. Coombe BC. 1960. Relationship of growth and development to changes in sugars, auxins, and gibberellins in fruit of seeded and seedless varieties of Vitis vinifera. Plant Physiology 35(2), 241-249. De Zarpa DM. 1957. Triploides de Carica papaya (Triploids of Carica papaya). Agronomia Tropical VII(2), 83— 86. Dutt M, ZT Li, SA Dhekney and DJ Gray. 2007. Transgenic plants from shoot apical meristems of Vitis vinifera L. "Thompson Seedless" via Agrobacterium - mediated transformation. Plant Cell Reports 26(12), 2101 — 2110. Ercan N and M Akilli. 1996. Reason for parthenocarpy and the effects of various hormone treatments on fruit set in pepino (Solarium muricatum Ait.). Scientia Horticulturae 66(3-4), 141-147. Ficcadenti N, S Sestili, T Pandolfini, C Cirillo and GL Rotino. 1999. Genetic engineering of parthenocarpic fruit development in tomato. Molecular Breeding 5(5), 463-470. Froelicher Y, JB Bassene, E Jedidi-Neji, D Dambier and R Morillon. 2007. Induced parthenogenesis in mandarin for haploid production: induction procedures and genetic analysis of plantlets. Plant Cell Reports 26(7), 937-944. Gay G, C Kerhoas and C Dumas. 1987. Quality of a stresssensitive Cucurbita pepo L. Pollen. Planta 171(1), 554 82-87. Gmitter FGJr, XB Ling and XX Deng. 1990. Induction of triploid Citrus plants from endosperm calli in vitro. Theorical Applied Genetics 80, 785-790. Goralski G, M Popielarska, H Slesak, D Siwinska and M Batycka. 2005. Organogenesis in endosperm of Actinidia deliciosa cv. Hayward cultured in vitro. Ada Biologica Cracoviensia Series Botanica 47(2), 121128. Gui Y, S Guo and T Xu. 1988. Differentiation of organs in endosperm culture of Chinese gooseberry. In: Genetic Manipulation in Crops, 364—366. Proceedings of the International Symposium on Genetic Manipulation in Crops. Beijing. Guo WW, XX Deng and HL Yi. 2000. Somatic hybrids between navel orange (Citrus sinensis) and grapefruit (C. paradise) for seedless triploid breeding. Euphytica 116(3), 281-285. Gustafson FG. 1939. The cause of natural parthenocarpy. American Journal of Botany 26, 135-138. Hanania U, M Velcheva, E Or, M Flaishman and N Sahar. 2007. Silencing of chaperonin 21 that was differentially expressed in inflorescence of seedless and seeded grapes, promoted seed abortion in tobacco and tomato fruits. Transgenic Research 16(4), 515525. Heuvelink E and O Korner. 2001. Parthenocarpic fruit growth reduces yield fluctuation and blossom-end rot in sweet pepper. Annals of Botany 88(1), 69-74. Hitoshi O, I Jun'ichi, K Satoru, H Naoki, M Hiroyuki, H Naomi and T Eikichi. 2010. Induction of fruit set and growth of parthenocarpic 'Hayward' kiwifruit with plant growth regulators, http://sciencelinks.ip/i-east/ article/200002/000020000299A09 22094.php. Iwahori S, S Tominaga and T Yamasak 1988. Stimulation of fruit growth of kiwifruit, Actinidia chinensis Planch. By N-(2-chloro-4-pyridyl)-N'-phenylura, a diphenylurea-derivative cytokinin. Scientia Horticulturae 35(1-2), 109-115. Kagan-Zur V, D Mills and Y Mizrahi. 1990. Callus formation from tomato endosperm. Ada Horticulturae 280, 139-142. Kim IS, H Okubo and K Fujieda. 1992. Endogenous levels of IAA in relation to parthenocarpy in cucumber (Cucumis sativus L.). Scientia Horticulturae 52(1• 2), 1-8. Ladyman JAR and B Girard. 1991. Non-hormonal factors that improve the multiplication and development of somatic embryos of cucumber (Cucumis sativus L.). Ada Horticulturae. 300, 233-236. Leopold AC. 1964. Plant Growth and Development. McGrawHill Book Company, New York. Maroto JV, A Miguel, S Lopez-Galarza, AS Bautista and B Pascual. 2005. Parthenocarpic fruit set in triploid watermelon induced by CPPU and 2,4-D applications. Plant Growth Regulation 45(3), 209-213. Mesejo C, A Martinez-Fuentes, C Reig, F Rivas and M Agusti. 2006. The inhibitory effect of CuSO4 on Citrus pollen germination and pollen tube growth and its application for the production of seedless fruit. Plant Science 170, 37-43. Mesejo C, C Reig, A Martinez-Fuentes and M Agusti. 2010. Parthenocarpic fruit production in loquat (Eriobotrya japonica Lindl.) by using gibberellic acid. Scientia Horticulturae 126(1), 37-41. Berita Biologi 10(4) - April 2011 Meyer BS and DB Anderson. 1952. Plant Physiology. 2"" Edition. Maruzen Company, Limited. Tokyo, Japan. Mitchell JW and MR Whitehead, 1942. Effects of vaporous naphthoxyacetic acid on development of tomato fruits, with special reference to their vitamin C content. Botanical Gazette 104(2), 362-365. Miyashita T, T Ohashi, F. Shibata, H Araki and Y Hoshino. 2009. Plant regeneration with maintenance of the endosperm ploidy level by endosperm culture in Lonicera caerulea var. emphyllocalyx. Plant Cell, Tissue and Organ Culture. 98(3), 291-301. Mohamed MF. 1998. Characteristics and inheritance of natural facultative-parthenocarpic fruit-set in 'Nadja' tomato under low temperature conditions. Euphytica 103(2), 211-217. Moussa HR and AAE Salem. 2009. Induction of parthenocarpy in watermelon (Citrullus lanatus) cultivars by gamma irradiation. Ada Agronomica Hungarica 57(2), 1588-2527. Murashige T and F Skoog. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiological Plantarum 15, 473-497. Musial K and L Przywara. 1998. Influence of irradiated pollen on embryo and endosperm development in kiwifruit. Annals of Botany 82 (6), 747-756. Nagar PK and TR Rao. 1981. Gibberellin-like substances in seedless guava (Psidium guajava L.) fruit. Journal of Horticultural Science 56(4), 339-343. Nakajima T. 1962. Physiological studies of seed development, especially embryonic growth and endosperm development. Bulletin University Osaka Prefecture Serie B. 13, 13-48. Nitscb JP. 1950. Growth and morphogenesis of the strawberry as related to auxin. American Journal of Botany 37, 211-215. Nitscb JP. 1952. Plant hormones in the development of fruits. The Quarterly Review in Biology 27, 48-51. Oiyama I and S Kobayasbi. 1990. Polyembryony in underdeveloped monoembryonic diploid seeds crossed with a Citrus tetraploid. HortScience 25(10), 12761277. Pommer CV, EJP Pires, MM Terra and IRS Passos. 1996. Streptomycin-induced seedlessness in the grape cultivar Rubi (Italia red). American Journal for Enology and Viticulture 47(3), 340-342. Rotino GL, E Perri, M Zottini, H Sommer and A Spena. •-«..••; 1997. Genetic engineering of parthenocarpic plants. Nature Biotechnology 15, 1398-1401. Sanford JC. 1983. Ploidy manipulations. In: J.N. Moore and J. Janick (Eds.). Methods in Fruit Breeding, 100-123. Purdue University Press. Indiana. Sato S, MM Peet and RG Gardner. 2001. Formation of parthenocarpic fruit, undeveloped flowers and aborted flowers in tomato under moderately elevated - •:* temperatures. Scientia Horticulturae 90, 243-254. Sita, GL. 1987. Triploids. In: Bonga, J.M. and D.J. Durzan (Eds.). Cell and Tissue Culture in Forestry Vol. 2, 269284. Martinus Nijhoff Publishers, Dordrecht, The Netherlands. Soedharoedjian. 1962. Beberapa tjatatan mengenai usahausaha memperoleh buah-buah parthenocarp buatan pada tanaman lombok {Capsicum annum L.) dan tomat (Solanum lycopersicum L.). In.: A Dilmy (Ed.). Laporan Konggres llmu Pengetahuan Nasional, 323342. Madjelis llmu Pengetahuan Indonesia, Departemen Urusan Research Nasional, Djakarta. Soost RK and JW Cameron. 1980. 'Oroblanco', a triploid pummelo-grapefruit hybrid. HortScience 15(5), 667669. Soost RK. 1987. Breeding C/frws-genetics and nucellar embryony. In: AJ Abbott and RK Atkin (Eds.). Improving Vegetatively Propagated Crops, 83-110. Academic Press, London. Sugiyama K and M Morishita. 2000. Production of seedless watermelon using soft-X-irradiated pollen. Scientia Horticulturae 84(3-4), 255-264. Sukamto A. 1979. Induksi buah partenocarp dengan perlakuan beberapa zat pengatur tumbuhan pada tanaman tomat (Lycopersicon esculentum Mill.). Tests. Fakultas Pertanian, Universitas Gadjah Mada, Yogyakarta. Sukamto LA. 1996. Endosperm Culture of Coconut. Disertasi. Program Studi University of Hawaii, USA. Sukamto LA. 2010. Kultur in vitro endosperma, protocol yang efisien untuk mendapatkan tanaman triploid secara langsung. Jurnal AgroBiogen 6(2), 107-112. Sun DQ, XH Lu, GL Liang, QG Guo and YW Mo. 2011. Production of triploid plants of papaya by endosperm culture. Plant Cell, Tissue and Organ Culture 104(1), 23-29. Thomas TD and R Chaturvedi. 2008. Endosperm culture: a novel method for triploid plant. Plant Cell, Tissue and Organ Culture 93(1), 1-14. Tukey HB 1954. Plant Regulators in Agriculture. John Wiley & Sons, Inc., New York. Tulecke W, GMc Granaham and H Ahmadi. 1988. Regeneration by somatic embryogenesis of triploid plants from endosperm of walnut, Juglans regia L. Cv. Manregian. Plant Cell Reports 7, 301-304. Weaver RJ and RM Pool. 1965. Relation of seededness and ringing to gibberellin-like activity in berries of Vitis vinifera. Plant Physiology 40(4), 770-776. Weaver RJ. 1972. Plant Growth Substances in Agriculture. WH Freeman and Company, San Francisco. Wu JH, AR Ferguson and PA Mooney. 2005. Allotetraploid hybrids produced by protoplast fusion for seedless triploid Citrus breeding. Euphytica 141(3), 229-235. Yang X, A Kitajima and K Hasegawa. 2000. Callus induction and embryoid regeneration from the endosperm culture of 'Tosa-Buntan' pummelo (Citrus grandis [L.]). Enviromental Control Biology 38(4), 241-246. Yu JQ. 1999. Parthenocarpy induced by N-(2-chloro-4pyridyl)-N'-phenylurea (CPPU) prevents flower abortion in Chinese white-flowered gourd (Lagenaria leucantha). Environmental and Experimental Botany 42(2), 121-128. Yu JQ, Y Li, YR Qian and ZJ Zhu. 2001. Cell division and cell enlargement in fruit of Lagenaria leucantha as influenced by pollination and plant growth substances. Plant Growth Regulation 33(2), 117-122. Zhao HX 1988. Induction of endosperm plantlets of 'Jinfeng* pear in vitro and their ploidy. In: Genetic Manipulation in Crops, 123-124. Proceedings of the International Symposium on Genetic Manipulation in Crops. Beijing. 555