Persamaan keadaan
advertisement

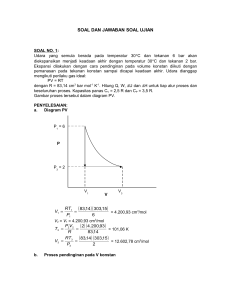
OVERVIEW Persamaan keadaan adalah persamaan yang menyatakan hubungan antara state variable yang menggambarkan keadaan dari suatu sistem pada kondisi fisik tertentu State variable adalah Property dari sistem yang hanya tergantung pada keadaan sistem saat ini, bukan pada jalannya proses. • • • • • • • • Temperatur Tekanan Density Enthalpy Entropy Kapasitas Panas Energi bebas Gibbs Fugasitas GAS IDEAL HUKUM BOYLE (1662) • Merkuri ditambahkan, volume gas diukur dengan teliti • Tekanan diukur berdasarkan beda permukaan merkuri PV = konstan HUKUM CHARLES DAN GAY-LUSSAC (1787) V1 V2 T1 T2 Pada tahun1834 Émile Clapeyron menggabungkan Hukum Boyle dan Hukum Charles menjadi: Hukum Gas Ideal. PV RT Asumsi: • Molekul/atom gas identik dan tidak menempati ruang • Tidak ada gaya antar molekul • Molekul/atom penyusunnya menabrak dinding wadah dengan tabrakan yang elastis sempurna Keberlakuan: P0 (P < 1,5 bar) 25.0 P (bar) 20.0 15.0 10.0 5.0 0.0 0 100 V (l/mol) 200 300 GAS NYATA P D liquid liquid + vapor C dew point B vapor bubble point A V Perbedaan antara gas ideal dan gas nyata Pideal gas > Preal gas Vreal, empty = Vcontainer – Vmolecule Perlu faktor koreksi untuk membandingkan Gas nyata dan gas ideal Copressilbility factor (Z) Definisi compressibility factor V Z Videal Volume gas ideal RT Videal P Persamaan keadaan gas nyata PV ZRT PERSAMAAN VIRIAL P Pc P > 1,5 bar C Jarak antar atom << T > Tc T = Tc T1 < Tc T2 < Tc Vc V Interaksi >> Gas Ideal tidak berlaku Sepanjang garis isotermal T1: P >> V << (Contoh untuk steam pada temperatur 200C) P (bar) V (m3/kg) 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 2.1724 1.0805 0.7164 0.5343 0.4250 0.3521 0.3000 0.260881 0.230421 0.206022 0.186029 0.169339 0.155187 0.143025 0.132454 16 14 P (bar) 12 10 8 6 4 2 0 0.0 0.5 1.0 1.5 V (m3/kg) 2.0 2.5 PV P 2.17243 2.16096 2.149272 2.137336 2.12516 2.112726 2.100028 2.087048 2.073789 2.06022 2.046319 2.032068 2.017431 2.00235 1.98681 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 14 12 PV 10 8 6 4 y = -65.375x2 + 196.53x - 117.41 R² = 1 2 0 1.95 2 2.05 2.1 P 2.15 2.2 Pada contoh di atas: PV = – 117,4 + 196,5 P – 65,37 P2 Secara umum: PV = a + bP + cP2 + … Jika b aB’, c aC”, dst, maka PV = a (1 + B’P + C’P2 + . . . ) PV Z RT Compressibility factor Persamaan virial: Bentuk lain: Untuk gas ideal: Z = 1 + B’P + C’P2 + D’P3 + . . . B C D Z 1 2 3 ... V V V PV = RT Z=1 UNIVERSAL GAS CONSTANT T = 273,16 K (Triple point air) PV (l bar mol-1) H2 N2 Udara (PV)t* = 22,7118 l bar P mol-1 O2 45 (PV)* (bar l/mol) 40 35 30 Slope = 0,083145 25 R = 0,083145 bar l mol-1 K-1 20 200 300 400 T (K) 500 600 CONTOH SOAL Diketahui koefisien virial untuk uap isopropanol pada 200C: B = 388 cm3 mol1 C = 26.000 cm6 mol2 Hitung Z dan V dari uap isopropanol pada 200C dan 10 bar dengan menggunakan persamaan sbb.: a) Persamaan keadaan gas ideal b) Persamaan keadaan virial dengan 2 suku c) Persamaan keadaan virial dengan 3 suku PENYELESAIAN T = 200C = 473,15K R = 83,14 cm3 bar mol1 K1 a) Persamaan gas ideal Z=1 RT 83,14 473,15 V 3.934 cm3 mol 1 P 10 a) Persamaan virial 2 suku PV BP Z 1 RT RT 10 3.546 PV Z 0 ,9014 RT 83,14 473,15 83,14 473,15 RT V B 388 3.546 cm3 mol 1 P 10 a) Persamaan virial 3 suku PV B C Z 1 2 RT V V RT B C V 1 2 P V V Persamaan diselesaikan secara iteratif. RT B C 1 2 Vi 1 P Vi Vi Iterasi 1: RT B C 1 2 V1 P V0 V0 Sebagai tebakan awal digunakan V0 = Vgas ideal = 3.934 Iterasi 2: 388 26.000 V1 3.934 1 2 3.539 3.934 3.934 RT B C 1 2 V2 P V1 V1 388 26.000 V2 3.934 1 2 3.495 3.539 3.539 Iterasi diteruskan sampai selisih antara Vi+1 Vi sangat kecil Setelah iterasi ke 5 diperoleh hasil : V = 3.488 cm3 mol1 Z = 0,8866 PERSAMAAN KEADAAN KUBIK: VAN DER WAALS Terobosan baru terhadap pers. gas ideal van der Waals (1873): pengusul pertama persamaan keadaan kubik • Molekul dipandang sebagai partikel yang memiliki volume, sehingga V tidak boleh kurang dari suatu konstanta V diganti dengan (V – b) • Pada jarak tertentu molekul saling berinteraksi mempengaruhi tekanan, P diganti dengan (P + a/V2) P a V b RT 2 V P a V b RT 2 V RT a P 2 V b V Kondisi kritikalitas: 2 P P 0 2 V V T , P c c Derivat parsial pertama dari P terhadap V P RT 2a V b 2 V 3 V T Derivat parsial kedua dari P terhadap V 2P 2RT 6a 2 3 4 V T V b V Pada titik kritis, kedua derivat sama dengan nol: RTc 2a 2 3 0 Vc b Vc 2RTc 6a 3 4 0 Vc b Vc 27 R 2 Tc2 R 2 Tc2 a a 64 Pc Pc 1 R Tc R Tc b b 8 Pc Pc Ada 2 persamaan dengan 2 bilangan anu (a dan b) Mengapa disebut persamaan kubik? RT a P 2 V b V Samakan penyebut ruas kanan: RTV 2 a V b P V 2 V b Kalikan dengan V2 (V – b): PV2 (V – b) = RTV2 – a (V – b) RT 2 a ab V b V V 0 P P P 3 0.006 0.004 V1 0.002 f(V) V3 V2 0 0 0.1 0.2 0.3 0.4 -0.002 -0.004 -0.006 Vliq Vvap V (L/mol) 0.5 Jika dikalikan dengan (P/RT)3: 2 bP aP abP Z2 Z Z 3 1 2 2 3 0 RT RT R T Z 3 1 B Z 2 AZ AB 0 dengan: 2 2 aP R Tc P Pr 2 2 a 2 A 2 2 a Pc R T RT Tr bP RTc P Pr b B b RT Pc RT Tr PERSAMAAN KEADAAN REDLICH-KWONG Redlich & Kwong (1949) mengusulkan perbaikan untuk pers. kubik lainnya Persamaan RK ini cukup akurat untuk prediksi sifatsifat gas untuk kondisi: P T Pc 2Tc RT a P 0 ,5 V b T V V b R 2 Tc2 ,5 a 0 ,42748 Pc R Tc b 0 ,08662 Pc Bentuk kubik (dalam Z) dari persamaan RK: Z Z A B B Z AB 0 3 2 dengan: Pr A a 2.5 Tr Pr B b Tr 2 PERSAMAAN KEADAAN SOAVE-REDLICH-KWONG Soave (1972)mengusulkan perbaikan pers. RK RT a P V b V V b R 2 Tc2 a 0 ,42748 Pc R Tc b 0 ,08662 Pc 1 0,48508 1,55171 0,15613 2 1 Tr0 ,5 Untuk H2 : 1,202 exp 0,30288Tr T Tr Tc 2 Bentuk kubik (dalam Z) dari persamaan SRK: Z Z A B B Z AB 0 3 2 2 dengan: A a Pr 2 Tr Pr B b Tr PERSAMAAN KEADAAN PENG-ROBINSON Peng & Robinson (1976): mengusulkan persamaan yang lebih baik untuk memenuhi tujuan-tujuan: 1. Parameter-parameter yang ada harus dapat dinyatakan dalam sifat kritis dan faktor asentrik. 2. Model harus bisa memprediksi berbagai macam property di sekitar titik kritis, terutama untuk perhitungan faktor kompresibilitas dan density cairan. 3. Mixing rule harus menggunakan satu binary interaction parameter yang tidak tergantung pada T, P, dan komposisi. 4. Persamaan harus berlaku untuk semua perhitungan semua property dalam proses natural gas. RT a P 2 2 V b V 2bV b a 0 ,45724 R 2 (12) 2 Tc Pc R Tc b 0 ,07780 Pc 1 0,37464 1,54226 0,2699 T Tr Tc 2 1 Tr0 ,5 2 Bentuk kubik (dalam Z) dari persamaan PR: Z 3 1 B Z 2 A 2B 3B2 Z AB B2 B3 0 dengan: A a Pr 2 Tr Pr B b Tr