Stoikiometri gas
advertisement

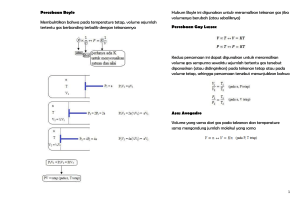
Kimia anorganik By drh. Siti Susanti PhD E-mail: [email protected] [email protected] • • ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia) didasarkan pada hukum-hukum dasar kimia: hukum kekekalan massa hukum perbandingan tetap hukum perbandingan berganda stoikiometri gas • • • • • Hukum Lomonosov-Lavoisier : massa dari suatu sistem tertutup akan konstan meskipun terjadi berbagai macam proses di dalam sistem tersebut Massa zat sebelum dan sesudah reaksi adalah sama (tetap/konstan) Massa dapat berubah bentuk tetapi tidak dapat diciptakan atau dimusnahkan Massa dari reaktan harus sama dengan massa produk. Contoh: Air -> Hidrogen + Oksigen (+ Air) (36 g) • (36 g) Penyimpangannya adalah persamaan Einstein E= m.c2 • • • • Hukum Proust menyatakan bahwa suatu senyawa kimia terdiri dari unsur-unsur dengan perbandingan massa yang selalu tepat sama Misalnya: Air -> 8/9 massa oksigen dan 1/9 massa hidrogen Penyimpangan hukum Proust -> senyawa nonstoikiometris, perbandingan massa unsur-unsurnya berbeda pada berbagai sampel. Misalnya: oksida besi wustite -> memiliki perbandingan antara 0.83 hingga 0.95 atom besi untuk setiap atom oksigen. senyawa dng komposisi isotop yang berbeda. Polimer alami maupun buatan. Komposisi kimia ditunjukkan oleh rumus kimianya Dari dua unsur dapat dibentuk beberapa senyawa dengan perbandingan berbeda-beda, misal: belerang dengan oksigen -> SO2 dan SO3 hidrogen dan oksigen -> H2O dan H2O2 Hukum Dalton: “Bila dua unsur dapat membentuk lebih dari satu senyawa, dimana massa salah satu unsur tersebut tetap (sama), maka perbandingan massa unsur yang lain dalam senyawa-senyawa tersebut merupakan bilangan bulat dan sederhana” Contoh: Nitrogen dan oksigen dapat membentuk senyawa N2O, NO, N2O3, dan N2O4 dengan komposisi massa terlihat pada tabel berikut: Dari tabel tersebut, terlihat bahwa bila massa N dibuat tetap (sama), sebanyak 7 gram, maka perbandingan massa oksigen dalam:N2O : NO : N2O3 : N2O4 = 4 : 8 : 12 : 16 atau 1 : 2 : 3 : 4 LATIHAN Komposisi dua sample A dan B setelah dianalisa ternyata hanya mengandung atom karbon dan oksigen. Hasil analisa dapat dilihat pada tabel berikut: a) Apakah kedua sampel merupakan senyawa yang sama? Atau keduanya berbeda? b) Apakah data tersebut mendukung hukum perbandingan tetap atau hukum perbandingan berganda? Gas memiliki volume dan bentuk sesuai dengan wadahnya, mudah dimampatkan, bercampur dengan segera dan merata, dan memiliki kerapatan yang jauh lebih rendah dibandingkan cairan dan padatan. Stoikiometri gas adalah suatu bentuk khusus, dimana reaktan dan produknya seluruhnya berupa gas. Dalam kasus ini, koefisien zat (yang menyatakan perbandingan mol dalam stoikiometri reaksi) juga sekaligus menyatakan perbandingan volume antara zat-zat yang terlibat. • • • Hukum Avogadro :”Gas-gas yang volumenya sama, jika diukur pada suhu dan tekanan yang sama, akan memiliki jumlah molekul yang sama pula”. Perbandingan volume gas dalam suatu reaksi sesuai dengan koefisien reaksi gas-gas tersebut. Jika volume salah satu gas diketahui, volume gas yang lain dapat ditentukan dengan cara membandingkan koefisien reaksinya. Contoh: 2H2(g) + O2(g) –> 2H2O(g) Jika volume gas H2 yang diukur pada suhu 25°C dan tekanan 1 atm sebanyak 10 L volume gas O2 dan H2O pada tekanan dan suhu yang sama dapat ditentukan dengan cara sebagai berikut: Volume H2 : Volume O2 = Koefisien H2 : Koefisien O2 Massa Molar (Mr) Massa atom relatif atau massa molekul relatif zat yang dinyatakan dalam satuan gram per mol (g/mol).Massa suatu zat merupakan perkalian massa molarnya (g/mol) dengan mol zat tersebut (n) -> Massa= Mr x mol Volume Molar (Vm) Volume satu mol zat dalam wujud gas Avogadro dlm percobaannya: 1 L gas oksigen pada suhu 0° C dan tekanan 1 atm mempunyai massa 1,4286 g, maka, berdasarkan hukum Avogadro dapat disimpulkan: 1 mol gas O2 = 22,4 L (keadaan standar) Volume gas pada keadaan tidak standar Hukum gas ideal : P . V = n . R . T P = tekanan (satuan atmosfir, atm) V = volume (satuan liter, L) n = jumlah mol gas (satuan mol) R = tetapan gas (0,08205 L atm/mol K) T = suhu mutlak (°C + 273,15 K) konversi gas pada suhu dan tekanan yang sama “Perbandingan gas-gas yang jumlah molnya sama memiliki volume sama” V1/V2 =n1/n2 Molaritas (M) menyatakan banyaknya mol zat dalam 1 L larutan (mol/L) M = n/V n = banyaknya zat dlm mol V = volume zat dlm L Rumus Empiris dan Rumus Molekul Rumus Molekul = ( Rumus Empiris )n Mr Rumus Molekul = n x (Mr Rumus Empiris) n = bilangan bulat Penentuan rumus empiris dan rumus molekul suatu senyawa dapat ditempuh dengan langkah berikut: 1. Cari massa (persentase) tiap unsur penyusun senyawa, 2. Ubah ke satuan mol, 3. Perbandingan mol tiap unsur merupakan rumus empiris, 4. Cari rumus molekul dengan cara: (Mr rumus empiris)n = Mr rumus molekul, n dapat dihitung 5. Kalikan n yang diperoleh dari hitungan dengan rumus empiris. Contoh: Suatu senyawa terdiri dari 60% karbon, 5% hidrogen, dan sisanya nitrogen. Mr senyawa itu = 80 (Ar : C = 12 ; H = 1 ; N = 14). Tentukan rumus empiris dan rumus molekul senyawa itu! Persentase nitrogen = 100% – ( 60% + 5% ) = 35%. Misal massa senyawa = 100 g massa C : H : N = 60 : 5 : 35 mol C : mol H : mol N = 5 : 5 : 2,5 = 2 : 2 :1 Rumus empiris = C2H2N Rumus molekul = (Rumus empiris)n atau (C2H2N)n Mr rumus molekul = (Mr rumus empiris)n 80 = (24 + 2 + 14)n 80 = 40n n =2 Jadi, rumus molekul senyawa tersebut = (C2H2N)2 = C4H4N2. See you in the next lecture ........