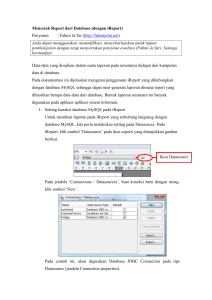
bakteri asosiasi karang yang terinfeksi penyakit brown band
advertisement

BAKTERI ASOSIASI KARANG YANG TERINFEKSI PENYAKIT BROWN BAND (BRB) DI PERAIRAN PULAU BARRANGLOMPO KOTA MAKASSAR SKRIPSI WULAN SARI USMAN L11111012 Pembimbing : Dr. Ir. Arniati Massinai, M.Si Drs. Sulaiman Gosalam, M.Si JURUSAN ILMU KELAUTAN FAKULTAS ILMU KELAUTAN DAN PERIKANAN UNIVERSITAS HASANUDDIN MAKASSAR 2015 1 ABSTRAK WULAN SARI USMAN, L111 11 012. Bakteri Asosiasi Karang Yang Terinfeksi Penyakit Brown Band (BrB) Di Perairan Pulau Barranglompo. Dibimbing oleh Arniati Massinai dan Sulaiman Gosalam. Penelitian ini dilakukan untuk mengetahui jenis bakteri yang berasosiasi dengan karang Acropora muricata yang terinfeksi penyakit Brown Band (BrB). Lokasi pengambilan sampel di perairan pulau Baranglompo. Pengambilan sampel karang Acropora muricata yang terinfeksi penyakit Brown Band (BrB) dilakukan dengan cara dipotong menggunakan scalpel. Kemudian digerus menggunakan mortar dan pestle , selanjutnya dilakukan pengenceran hingga 10¯³. Inokulasi dilakukan dengan metode tuang pada medium Marine Agar (MA), Eosin Methylin Blue Agar (EMBA), Thiosulfate Citrate Bile salts Sucrosa Agar (TCBSA), dan Bismut Sulfit Agar (BSA). Identifikasi bakteri dilakukan berdasarkan pengamatan morfologi sel dan uji Biokimia. Berdasarkan hasil pengamatan morfologi sel dan uji biokimia, didapatkan bakteri asosiasi dengan karang yang terinfeksi penyakit Brown Band (BrB) sebanyak empat genus, keempat genus tersebut adalah Pseudomonas sp., Bacillus sp., Flavobacterium sp dan Vibrio sp. Pseudomonas sp. dengan ciri-ciri berbentuk batang, bersifat Gram negatif, mempunyai flagel, tidak berkapsul. Bacillus sp. dengan ciri-ciri berbentuk batang, tergolong bakteri Gram positif dan bersifat aerob. Flavobacterium sp. dengan ciri-ciri bentuk selnya berupa batang dan Gram negatif. Bakteri Vibrio sp. bersifat aerob, tetapi ada pula yang bersifat anaerob fakultatif. Selain itu, Vibrio sp. juga bersifat motil karena pergerakannya dikendalikan oleh flagella, tergolong bakteri Gram negatif dan berbentuk batang yang melengkung seperti tanda koma. Kata Kunci : Brown Band (BrB), Bakteri Asosiasi, Acropora muricata, Pulau Barranglompo. 2 ABSTRACT WULAN SARI USMAN, L111 11 012. Associated Bacterial from Infected Brown Band Disease (BrB) Stony Coral in waters of Barranglompo Island. Supervised by Arniati Massinai and Sulaiman Gosalam. This study was conducted to determine the type of bacteria associated with infected Brown Band (BrB) Acropora muricata. Sampling sites in the waters of the island Baranglompo. Sampling of Acropora muricata infected Brown Band (BrB) was by cutting with a scalpel. Then it was crushed use in mortar and pestle for further dilution to 10¯³. Inoculation was performed using Marine Agar (MA), eosin Methylin Blue Agar (EMBA), citrate bile salts sucrose order thiosulfate agar (TCBSA), and bismuth sulfite agar (BSA). Bacterial identification was performed based on cell morphology and biochemical test observation. Based on observations of cell morphology and biochemical tests, there were four genus of associated bacterial from infected Brown Band (BrB) coral found, i.e. Pseudomonas sp., Bacillus sp., Flavobacterium sp and Vibrio sp. Pseudomonas sp. with the characteristics of rod-shaped cell, gram-negative, having flagella, and unencapsulated. Bacillus sp. with the characteristics of rod-shaped, gram-positive and an aerobic bacteria. Flavobacterium sp. with the characteristic of rod-shaped cell and a Gram-negative bacteria. Keywords: Brown Band (BrB), bacteria Association, Acropora muricata, Barranglompo Island. 3 BAKTERI ASOSIASI KARANG YANG TERINFEKSI PENYAKIT BROWN BAND (BRB) DI PERAIRAN PULAU BARRANGLOMPO KOTA MAKASSAR Oleh: WULAN SARI USMAN SKRIPSI Sebagai salah satu syarat untuk memperoleh gelar sarjana pada Fakultas Ilmu Kelautan dan Perikanan JURUSAN ILMU KELAUTAN FAKULTAS ILMU KELAUTAN DAN PERIKANAN UNIVERSITAS HASANUDDIN MAKASSAR 2015 4 5 RIWAYAT HIDUP Penulis dilahirkan pada tanggal 30 Oktober 1993 di Kalosi, Kecamatan Duapitue Kabupaten Sidenreng Rappang (SIDRAP). Anak pertama dari tiga bersaudara dari Ayahanda Drs. Usman dan Ir. Darwiyana. Penulis menyelesaikan pendidikan dasar di SDN 045 Lara Utama, Kabupaten Luwu Utara tahun 2005, pendidikan lanjutan di SMPN 1 Duapitue, Kabupaten Sidrap tahun 2008 dan pendidikan sekolah menengah di SMAN 1 Duapitue tahun 2011. Pada tahun 2011 melalui Seleksi Jalur Undangan penulis berhasil diterima dan bebas tes pada Program Studi Ilmu Kelautan, Jurusan Ilmu Kelautan, Fakultas Ilmu Kelautan dan Perikanan, Universitas Hasanuddin, Makassar. Masa perkuliahan penulis aktif di organisasi kemahasiswaan yaitu Himpunan Mahasiswa Ilmu Kelautan (HMIK) Universitas Hasanuddin peroide 2012 - 2013, Penulis juga aktif sebagai asisten beberapa mata kuliah seperti Vertebrata Laut, Biologi Laut, Ekologi Laut, Oseanografi Kimia, Oseanografi Fisika, Mikrobiologi Laut, dan Sedimetologi. Penulis menyelesaikan rangkaian tugas akhir di Fakultas Ilmu Kelautan dan Perikanan dalam mengikuti Kuliah Kerja Nyata (KKN) di Kel. Apala Kec. Barebbo Kab. Bone dan melakukan Praktik Kerja Lapang (PKL) di Desa Bojo Kec. Mallusetasi Kab. Barru Gelombang 87 pada Juli – Agustus 2014 Sebagai tugas akhir, penulis melakukan penelitian dengan Judul Bakteri Asosiasi Karang yang Terinfeksi Penyakit Brown Band (BrB) di Perairan Pulau Barranglompo. 6 UCAPAN TERIMA KASIH Puji dan syukur penulis panjatkan ke hadirat Allah SWT karena atas berkah dan anugerah-Nyalah sehingga penelitian dan skripsi ini dapat terselesaikan dengan baik. Seiring selesainya penulisan skripsi ini, pada kesempatan ini perkenankanlah penulis menyampaikan terima kasih yang setulus-tulusnya dan penghargaan yang setinggi-tingginya kepada: 1. Ucapan khusus kepada kedua orang tua tercinta, Ayahanda Drs. Usman dan Ibunda tercinta Ir. Darwiyana, yang telah melahirkan, membesarkan dan mendidik penulis dalam menimba ilmu pengetahuan sampai kepada penyelesaian studi, demikian pula kepada saudara(i) ku Rahma Sari Usman dan Muhammad Waldi Saputra Usman yang telah banyak mendorong dan memberi semangat, terutama di akhir penyelesaian studi penulis. 2. Komisi pembimbing Dr. Ir. Arniati, M.Si. (Pembimbing Utama), Drs. Sulaiman Gosalam, M.Si. (Pembimbing Anggota) serta penguji, Prof. Dr. Akbar Tahir, M,Sc., Prof. Dr. Chair Rani, M,Si., dan Dr. Safyuddin Yusuf, ST. M.Si., yang telah banyak memberikan masukan, bimbingan dan mengarahkan, serta memberi petunjuk-petunjuk yang sangat berguna dari tahap awal sampai kepada tahap akhir penulisan skripsi ini. 3. Prof. Dr. Ir. Jamaluddin Jompa M.Si. sebagai Dekan FIKP-UH dan Dr. Mahatma, ST, M.Sc. sebagai Ketua Jurusan Ilmu Kelautan FIKP-UH. 4. Prof. Dr. Ir. Abdul Haris, M.Si. sebagai penasehat akademik yang selalu memberikan nasehat dan arahan yang membangun bagi penulis. 7 5. Ibu Dr. Ir. Arniati Massinai, M.Si selaku ketua tim Penelitian dari Bantuan Operasional Perguruan Tinggi (BOPTN) yang terlah mengikut sertakan saya dalam penelitian tersebut dan membantu dalam hal dana penelitian. 6. Seluruh Bapak/Ibu Dosen pengajar pada Jurusan Ilmu Kelautan Universitas Hasanuddin yang tidak sempat disebutkan namanya satu per satu, yang telah membekali ilmu kepada penulis sejak awal terdaftarnya sebagai mahasiswa hingga akhir penyelesaian studi ini. 7. Seluruh staf pegawai Fakultas Ilmu Kelautan dan Perikanan Universitas Hasanuddin yang telah membantu kelancaran dan kemudahan penulis, sejak mengikuti perkuliahan, proses belajar sampai akhir penyelesaian studi ini. 8. Kepada seluruh rekan mahasiswa Ilmu Kelautan Universitas Hasanuddin, Khususnya Angkatan Kosong Sebelas “KEDUBES” (Kla’011) dan untuk teman-teman seperjuangan Widyastuti, Sitti Radiyah Jasrah, Anissa Zuriyah Karimah, Funty Septiyawati Polapa, Raodah Septi Legina, Suci Rahmadani Artika, Hasriani Ayu Lestari S.kel, Sulham Syahid, Mustono, Robby Nimzet, Muh. Afdal, Fajria Sari Sakaria, Sartina, Resa Hidayat, Pajar Pajrin, Asirwan, Mustiara Bakri, Hardin Lakota, Samsul Bahri, Firman Wira Pratama, Abunaim Arifin, Muh. Isman, Aswin Wardana, Wajdiah, Reskiyanto Mahmud, Nur Issatul Mukminin, Asgar Saputra, Dewi Suswati Kamal, Luqman Wahid, Suwigo, Gamaria Nur, Alm. Rina apriana, Irma Pratiwi, Fajaria Saban, Muh. Eza Damar, dan Ivander Tinting. Terima kasih atas segala toleransi yang tinggi dan kerjasamanya selama ini serta kebersamaannya. 8 9. Tim peneliti Widyastuti, Funty Septiyawati Polapa, Raodah Septi Legina, kakak Wawan dan kakak Nur Abu yang telah membantu penulis dalam proses pengambilan data penelitian di lapangan maupun di Laboratorium serta Kakak Yayi yang juga telah membantu di Laboratorium. 10. Seluruh mahasiswa Ilmu Kelautan, penulis banyak belajar tentang rasa persaudaraan, susah, senang, canda dan tawa bersama kalian dan temanteman Posko KKN UNHAS GEL. 87 Kelurahan Apala Kecamatan Barebbo Kabupaten Bone. Guna kesempurnaan dari skripsi ini, kami memohon kepada semua pihak untuk memberikan arahan dan petunjuknya berupa saran dan kritikan, sungguh kami senantiasa berusaha untuk memberikan yang terbaik, namun kamipun tak luput dari salah dan kelemahan sebagai fitrah kemanusiaan yang ada pada kami. Akhir kata, penulis mengharapkan skripsi ini memberikan manfaat dalam perkembangan ilmu pengetahuan di masa depan. Amin ya rabbal alamin. Makassar, Januari 2015 WULAN SARI USMAN 9 DAFTAR ISI Teks Halaman Daftar Tabel ........................................................................................................ xi Daftar Gambar ....................................................................................................xii Daftar Lampiran ................................................................................................. xiii I. Pendahuluan ................................................................................................... 1 A. Latar Belakang ............................................................................................ 1 B. Rumusan Masalah ...................................................................................... 3 C. Tujuan dan Manfaat .................................................................................... 4 D. Ruang Lingkup Penelitian ........................................................................... 4 II. Tinjauan Pustaka ............................................................................................. 5 A. Bakteri ........................................................................................................ 5 B. Faktor - Faktor Yang Mempengaruhi Pertumbuhan Bakteri ........................ 6 C. Bakteri Asosiasi Karang ............................................................................ 15 D. Penyakit Pada Karang .............................................................................. 16 E. Identifikasi Bakteri ..................................................................................... 17 III.Metode Penelitian .......................................................................................... 22 A. Waktu Dan Tempat ................................................................................... 22 B. Alat Dan Bahan......................................................................................... 22 C. Prosedur Penelitian .................................................................................. 24 D. Analisis Data............................................................................................. 33 IV.Hasil Dan Pembahasan ................................................................................. 34 A. Parameter Kualitas Air .............................................................................. 34 B. Penyakit Brown Band (BrB) ..................................................................... 38 C. Karang Yang Terinfeksi Penyakit Brown Band (Brb) ................................. 39 D. Bakteri Pada Penyakit Brown Band (Brb) ................................................. 40 V.Simpulan Dan Saran ...................................................................................... 47 10 A. Simpulan................................................................................................... 47 B. Saran ........................................................................................................ 47 DAFTAR PUSTAKA........................................................................................... 48 11 DAFTAR TABEL Nomor Halaman 1. Perubahan Warna Pada Uji Biokimia.................................................... 32 2. Hasil Pengukuran Parameter Kualitas Air............................................. 34 3. Hasil Pengamatan Morfologi Koloni Bakteri yang Berasosiasi dengan Penyakit Brown Band (BrB).................................................................... 41 4. Hasil Uji Biokimia Isolat Bakteri Asosiasi dengan Karang Acropora muricata yang Terinfeksi Penyakit Brown Band (BrB)........................... 42 5. Identifikasi Bakteri Vibrio........................................................................ 46 DAFTAR GAMBAR xi 12 Nomor Halaman 1. Bentuk Sel Bakteri............................................................................ 5 2. Brown Band Disease........................................................................ 16 3. Peta Lokasi Penelitian...................................................................... 22 4. Pengenceran.................................................................................... 25 5. Karang yang Terinfeksi Penyakit Brown Band (BrB) di Terumbu Karang Pulau barranglompo............................................................. 39 6. Jenis Karang Yang Terinfeksi Penyakit Brown Band (BrB) di Terumbu Karang Pulau Barranglompo............................................................. 39 DAFTAR LAMPIRAN xii 13 Lampiran 1. Foto Isolat Bakteri......................................................................... 53 Lampiran 2. Foto Bentuk Sel Bakteri................................................................ 55 Lampiran 3. Foto Bakteri Vibrio sp.................................................................... 56 xiii 14 I. PENDAHULUAN A. Latar Belakang Pulau Barranglompo merupakan salah satu pulau yang terdapat di perairan Kota Makassar yang memiliki jumlah penduduk sebanyak 4.209 jiwa dengan luas wilayah 20,38 ha (Jaelani, 2014). Dengan penduduk yang padat tersebut menyebabkan pulau ini berpotensi memiliki banyak sampah dan kotoran manusia (tinja). Sampah dan tinja pada umumnya dibuang langsung ke perairan laut, selain itu perairan pulau Barranglompo menerima sampah dan tinja terbawa oleh aliran air dan arus dari daratan utama dan pulau Barranglompo, karena jarak dari Kota Makassar dan pulau Barranglompo 2010). Sampah terutama dari bahan cukup dekat ± 12 km (Arifin, organik merupakan nutrisi untuk pertumbuhan dan perkembangan mikroorganime perairan, salah satu di antaranya adalah bakteri. Bakteri selain yang terdapat di laut juga ada beberapa yang berasal dari daratan seperti bakteri fekal yang hidup pada usus manusia dan hewan berdarah panas, bakteri fekal ini masuk ke laut bersama dengan tinja, karena pergerakannya terpengaruh oleh arus maka kemungkinan berada di terumbu karang. Menurut Sidharta (2000) bakteri di perairan laut dapat mendiami seluruh bagian laut mulai dari permukaan laut hingga dasar baik hidup bebas maupun berasosiasi dengan organisme. Kunarso (1988) melaporkan bahwa jenis bakteri yang termasuk ke dalam bakteri air laut adalah genus Micrococcus, Sarcina, Vibrio bacillus, Bacterium, Pseudomonas, Corynebacterium, Nocardia, Spirillum, Mycoplana, dan Streptomyces. Sedangkan Wahyuni (2013) menemukan Hasil analisa bakteri pada substrat sedimen permukaan dasar yang menggunakan medium Tryptic Soy Agar (TSA) sebagai media untuk pertumbuhan bakteri 15 aerob. Diperkirakan bakteri ini termasuk Bacillus subtilis, Aspergillus niger dan Echerichia coli. Selain hidup di permukaan hingga dasar laut, bakteri dapat berasosiasi dengan organisme lain. Salah satu jenis organisme yang dapat berasosiasi dengan karang adalah bakteri. Kalimutho et.al (2007) menemukan 26 jenis bakteri yang berasosiasi dengan karang Acropora cervicornis yang berasal dari pulau Bidong. Adapun ke-26 jenis bakteri yaitu Pantoea dispersa, Pseudomonas sp., Enterobacter agglomerans, Cadacea darisae, Serratia plymuthica,Citrobacter youngae, Erwinia herbicola, Vibrio sp., Klebsielle pneumonia, subspecies ozanae, Aeromonas caviae, Alteromonas putrefaciens, Serratia sp., Alteromonas sp., Moraxella sp., Photobacterium sp., Yersinia bercovieri, Vibrio metschnikovii, Acinetobacter sp., Yersinia entrocolitica, Brucella sp., Micrococcus sp., Micrococcus varians, Micrococcus roseus, Actinomyces sp., dan Flavobacterium sp., sedangkan Massinai (2013) hanya menemukan 2 jenis bakteri yaitu Choromobacterium sp. dan Flavobacterium sp. di kepulauan Spermonde, Makassar. Peranan bakteri pada terumbu karang sangat besar yaitu sebagai pengurai (dekomposer) yang mampu mendegradasi bahan organik menjadi bahan anorganik berupa nitrat, fosfat dan karbondioksida. Selain sebagai dekomposer, juga berperan dalam aliran energi dan daur ulang unsur hara serta sebagai sumber utama senyawa aktif. Bakteri yang berasosiasi dengan avertebrata laut dari Moluska jenis Conus miles mampu menghambat pertumbuhan bakteri Klebsiella, Pseudomonas, Staphylococcus, E.coli dan Enterobacter (Pringginies, 2010). Ritchie (2006) mendapatkan bakteri asosiasi pada lendir karang Acropora palmata yang berasal dari kanal Florida, dapat menghambat pertumbuhan bakteri Gram positif dan Gram negatif. Bacillus subtilis, Staphylococcus aureus, 16 Salmonella typhimurium, dan Serratia marcescens disolasi dari karang terifeksi penyakit white pox (cacar). Abubakar et.al (2011) menemukan isolat bakteri yang berasosiasi dengan Jaspis sp. memiliki kemampuan antimikroba karena mampu menghambat pertumbuhan Staphylococcus aureus, Vibrio harveyii, Escherichia coli, Pseudomonas aerogenosa, Candida albicans, dan C. tropicalis. Beberapa penelitian sebelumnya menemukan bakteri yang berasosiasi dengan karang sehat, tetapi penelitian tentang bakteri yang berasosiasi dengan karang terinfeksi penyakit khususnya di Indonesia masih sangat terbatas. Massinai dkk (2012) menemukan 7 jenis penyakit di pulau Barranglompo. Jenis penyakit tersebut adalah White Syndome (WS), Atramentous necrosis (AtN), Black Band Disease (BBD), Ulcerative White Spots (UWS), Growth Anomaly (GA), Skeletal Eroding Band (SEB) dan Brown Band Disease (BRB). Brown Band (BrB) merupakan penyakit yang mengakibatkan kematian pada karang yaitu sebesar 1,58 – 6,11 cm/hari. Informasi tentang bakteri asosiasi dengan karang yang terinfeksi penyakit Brown band (BrB) perlu diketahui sebagai salah satu acuan dalam pengendalian penyakit karang. Selain itu, bakteri yang berasosiasi dengan karang terinfeksi penyakit akan mengalami stress dan mengeluarkan metabolit sekunder untuk pertahanan diri terhadap bakteri patogen. Metabolit sekunder tersebut kemungkinan dapat digunakan sebagai antimikroba dan anti kanker. Untuk itu perlu dilakukan penelitian tentang bakteri yang berasosiasi dengan karang yang terinfeksi penyakit Brown Band (BrB) di perairan pulau Barranglompo. B. Rumusan Masalah Berdasarkan uraian latar belakang di atas, maka dapat diturunkan pertanyaan : Jenis bakteri apa yang berasosiasi dengan karang yang sedang terinfeksi penyakit Brown Band (BrB). 17 C. Tujuan dan Manfaat Penelitian ini bertujuan untuk mengetahui jenis bakteri yang berasosiasi dengan karang yang sedang terinfeksi penyakit Brown Band (BrB) di perairan pulau Barranglompo. Manfaat penelitian ini adalah sebagai bahan informasi untuk mengetahui jenis bakteri apa yang berasosiasi dengan karang terinfeksi penyakit Brown Band (BrB) dan sebagai bahan informasi dalam pengendalian penyakit Brown Band (BrB). D. Ruang Lingkup Penelitian Ruang lingkup penelitian ini yaitu pengamatan morfologi dan identifikasi bakteri serta pengukuran parameter oseanografi antara lain suhu, salinitas dan pH yang diukur di lapangan serta pengukuran kekeruhan, amoniak, nitrat, nitrit, sulfat, dan bahan organik karbon yang diukur di Laboratorium. 18 II. TINJAUAN PUSTAKA A. Bakteri Bakteri adalah kelompok organisme yang tidak memiliki membran inti sel dan merupakan organisme yang paling banyak jumlahnya. Bakteri memiliki ratusan ribu spesies yang hidup di darat hingga lautan dan pada tempat-tempat yang ekstrim. Bakteri termasuk dalam golongan prokariotik uniseluler, tidak mempunyai selubung inti, pada umumnya mempunyai ukuran sel 0,5-1,0 μm x 2,0-5,0 μm, dan terdiri dari empat bentuk dasar yaitu bentuk bulat atau kokus, batang atau basil, koma dan spiral (Dwidjoseputro, 1985). Gambar 1. Bentuk sel bakteri : a. batang, b. bulat, (Sumber:http://www.turbosquid.com) c. spiral, d. koma Komposisi bakteri laut diketahui sekitar 80 % jenis yang berbentuk batang dan 95% Gram negatif. Bakteri laut sebagian besar bergerak secara aktif karena memiliki flagel dan mampu mencerna hampir semua senyawa organik yang mengalami perubahan menjadi senyawa anorganik akibat kegiatan bakteri laut. 19 70% mengandung pigmen dan mempunyai toleransi yang besar terhadap suhu tetapi sensitif terhadap suhu tinggi (Sidharta, 2000). Beberapa jenis bakteri yang umum dijumpai di laut adalah Pseudomonas, Vibrio, Flavobacterium, Achromobacter, dan Bacterium (Sidharta, 2000). Penyebaran bakteri laut dipengaruhi oleh banyak faktor, misalnya gerakan air laut yang dapat membawa bakteri berada di dekat pantai, tapi pada saat berikutnya sudah berada sekian kilometer dari pantai. Hal ini membawa akibat pada penyebaran bakteri laut, terutama yang melayang-layang dalam kolom air. Selain berada di kolom air, bakteri juga dapat berada pada sedimen karena sedimen merupakan habitat yang kompleks sehingga menguntungkan tumbuhnya mikroorganisme. Nutrisi partikel yang melewati kolam air mengumpul di dalam permukaan sedimen. Sebagian besar sedimen laut mengandung sejumlah bakteri yang sangat tinggi. Jumlah bakteri menurun dengan berkurangnya jumlah nutrisi yang tersedia pada kondisi anoksida (Sidharta, 2000). B. Faktor - Faktor Yang Mempengaruhi Pertumbuhan Bakteri Menurut Muchtadi dan Betty (1980) dalam Rofi’I (2009) seperti halnya pada makhluk hidup lain, pertumbuhan mikroba sangat dipengaruhi oleh keadaan lingkungannya. Pengaruh lingkungan ini dapat digolongkan menjadi faktor biotik dan faktor abiotik. 1. Faktor Biotik Faktor biotik yang mempengaruhi pertumbuhan mikroba adalah pertumbuhan spesies mikroba lain. Pertumbuhan dan aktifitas tiap spesies mikroba umumnya tergantung pada aktifitas mikroba lain yang banyak jumlahnya, ada yang menguntungkan, ada yang menyaingi dan ada pula yang sifatnya berlawanan. 20 Jaelani (2014) juga menyatakan bahwa faktor biotik yang mempengaruhi pertumbuhan mikroba yaitu bentuk jasad, sifat jasad, terutama di dalam kehidupannya, apakah toleran terhadap suatu perubahan yang tiba - tiba ada, baik yang datang dari lingkungan yang bersifat hidup salah satu contohnya yaitu hama. Kemampuan jasad untuk menyesuaikan diri dan tumbuh berkembang, sekali waktu ditemukan kehadiran jasad yang hidup sebagai biakan murni tetapi selalu berada di dalam asosiasi dengan jasad - jasad lainnya. 2. Faktor abiotik Faktor abiotik merupakan faktor fisik dan kimia yang dapat mempengaruhi pertumbuhan mikroba. Di antara faktor fisik dan kimia tersebut yaitu: a. Suhu Suhu merupakan salah satu faktor yang penting di dalam kehidupan. Beberapa jenis mikroba dapat hidup pada daerah suhu yang luas sedangkan jenis lainnya pada daerah yang terbatas. Pada umumnya batas daerah suhu bagi kehidupan mikroba terletak antara 0ºC dan 90ºC (Musdalifah, 2013). Semua proses pertumbuhan bakteri bergantung pada reaksi kimia dimana adanya laju reaksi yang dipengaruhi oleh suhu, keragaman suhu dapat mengubah proses metabolisme tertentu selain morfologi dari sel bakteri (Pelczar dan Chan, 1988). Suhu selain mempengaruhi pertumbuhan karang juga dapat mempengaruhi laju infeksi penyakit. Menurut Ward et.al (2007) bahwa suhu mampu mempengaruhi dan menyebabkan stres serta tingkat virulensi penyakit karang pada suhu 31,5 ºC. Raymundo (2006) menyatakan peningkatan suhu sejalan dengan peningkatan virulensi patogen, akibatnya penyebaran penyakit semakin cepat meningkat akan meningkatkan tingkat virulensi patogen serta penyebaran 21 penyakit karang. Karang tidak mampu bertahan terhadap penyakit akibat fluktuasi suhu karena patogen lebih ganas atau agresif pada suhu yang lebih tinggi (Harvel et.al, 2007) sehingga tidak mampu bertahan hidup (Raymundo et.al). Hal ini didukung oleh Ritchie (2006) bahwa pada musim panas, suhu perairan akan naik dan karang cenderung mengeluarkan lendir lebih banyak. Akibatnya, bakteri akan lebih mudah menyerang karang yang berlendir tersebut. b. pH Air dapat bersifat asam atau basa tergantung pada besar kecilnya pH air atau besarnya konsentrasi ion hidrogen di dalam air. Air normal yang memenuhi syarat untuk suatu kehidupan mempunyai pH antara 6,5 - 7,5. Air yang mempunyai pH lebih rendah dari pH normal akan bersifat asam (Jaelani, 2014). Mikroba memiliki pH minimum, maksimum, dan optimum. Bakteri memerlukan pH optimum 6,5 - 7,5 ; Khamir 4,0 - 4,5 sedangkan jamur mempunyai kisaran pH yang luas. Mikroorganisme aquatik biasanya tumbuh baik pada pH 6,5 - 8,5. Air laut memiliki pH 7,5 - 8,5 dan sebagian besar mikroorganisme laut tumbuh baik pada media kultur dengan pH 7,2 - 7,6 (Hidayat et.al, 2006). Berdasarkan pH yang ada, mikroba dibagi menjadi 3 kelompok yaitu: 1). Asidofil, mikroba yang dapat tumbuh pada pH antara 2,0-5,0. 2). Neutrofil, mikroba yang dapat tumbuh pada kisaran pH 5,5 - 8,0. 3). Alkalifil, mikroba yang tumbuh pada kisaran pH 8,4 - 9,5. c. Salinitas Salinitas merupakan salah satu faktor pembatas bagi kehidupan karang. Salinitas berperan penting karena mempengaruhi pertumbuhan karang dan salinitas termasuk sebagai faktor pembatas bagi karang. Pertumbuhan optimal pada karang yang baik pada kisaran 34 ‰ sampai 36 ‰. Namun karang rentan pada kisaran salinitas antara 27 ‰ hingga 40 ‰. Karang juga memiliki 22 tingkat pertahanan terhadap salinitas tinggi seperti jenis dari Acropora dan Porites yang mampu bertahan hidup sampai pada salinitas 48 ‰ (Thamrin, 2006). Karang sulit hidup di sekitar muara sungai atau daerah dengan salinitas mendekati 0 ‰ atau pantai di daratan utama (Agussalim, 2014). Tingkat salinitas merupakan salah satu faktor yang mempengaruhi kehidupan serta pertumbuhan mikroorganisme di perairan. Sebaran salinitas di laut dipengaruhi oleh beberapa faktor seperti pola sirkulasi air, penguapan, curah hujan dan aliran sungai. Salinitas permukaan air laut sangat erat kaitannya dengan proses penguapan dimana garam-garam akan mengendap atau terkonsentrasi (Nontji, 1987). d. Kekeruhan Menurunnya aktifitas fotosintesis dapat mengurangi suplai energi unuk karang sehingga berpengaruh terhadap efektifitas mikroorganisme dan kurangnya suplai energi dan ketidakseimbangan transpor energi dapat mengakibatkan kesehatan karang menurun, daya tahan tubuh melemah sehingga rentan terhadap penyakit (Marubini, 1996). Kekeruhan dan sedimentasi yang tinggi dapat menghambat pertumbuhan karang. Respon bentuk pertumbuhan karang terhadap tingkat kekeruhan berbeda-beda, apabila karang tertutup sedimen maka karang akan mengeluarkan lendir untuk menghapus sedimen tersebut, jenis fungia lebih banyak mengekskresi lendir dibanding dengan Porites dan Acropora (Dinsdale, 2000). Marubini (1996) kekeruhan tinggi dapat menyebabkan penetrasi cahaya matahari berkurang ke dalam perairan, akibatnya aktifitas fotosintesis dari zooxanthellae menurun. Nilai kekeruhan yang dapat mematikan karang antara 5 - 10 NTU (Babcock and Smith, 2000). 23 e. Arus Arus merupakan pergerakan air yang berperan penting bagi organisme laut yang ada di dalamnya sirkulasi air atau arus air berperan pada penyediaan oksigen dan makanan bagi zooxanthellae dan karang (Guntur, 2011). Pergerakan air (arus) diperlukan untuk tersedianya aliran yang membawa nutrien dan bahan-bahan organik yang diperlukan oleh karang dan zooxanthellae makanan dan oksigen serta menghindarkan karang dari pengaruh sedimentasi menutupi pemukaan karang sehingga berakibat pada kematian karang (Haapkyla et.al., 2009). f. Bahan Organik Terlarut (BOT) Kandungan bahan organik terlarut suatu perairan sangat erat kaitannya dengan jumlah nutrien yang masuk ke perairan dan dipengaruhi oleh keterdekatan lokasi dengan daratan utama. Sebagian besar bahan buangan organik yang dapat diuraikan oleh mikroorganisme yang berada di dalam perairan, tetapi beberapa komponen organik seperti lignin, sellulosa,dan batu bara tidak dapat atau sukar diurai oleh mikroorganisme. Komponen - komponen tersebut akan menutupi daerah perairan, memperdangkal daerah perairan dan juga dapat mengakibatkan turunnya konsentrasi oksigen terlarut dalam air (Wardoyo, 1974). Bahan organik terlarut (BOT) mengandung karbon, nitrat, fosfat, amoniak dan beberapa mineral yang merupakan nutrien bagi pertumbuhan dan perkembangbiakan mikroba patogen (Sidharta, 2000). Tingginya kadar bahan organik terlarut (BOT) akan meningkatkan pertumbuhan mikroba patogen dan merugikan kesehatan karang. Sehingga bahan organik terlarut (BOT) yang tinggi secara tidak langsung dapat mengakibatkan dan memicu perkembangan penyakit pada karang. 24 g. Dissolved Oxygen (DO) Oksigen terlarut merupakan faktor pembatas dalam pembentukan kehadiran makhluk hidup di dalam air, kepekatan oksigen terlarut tergantung pada suhu, kehadiran tanaman fotosintesis, tingkat penetrasi cahaya yang bergantung kepada kedalaman dan kekeruhan air, tingkat kederasan aliran air, dan jumlah bahan organik yang diuraikan dalam air seperti sampah, ganggang mati atau Iimbah industri (Sastrawijaya, 1991). Bakteri dibagi dalam 3 kelompok menurut keperluannya akan oksigen: 1). Aerob obligat, bakteri ini selalu memerlukan oksigen untuk pertumbuhannya. 2). Anaerob obligat, kelompok ini dapat tumbuh bila tidak ada oksigen. 3). Fakultatif anaerob, kelompok bakteri ini dapat tumbuh dalam keadaan dengan atau tanpa oksigen, meskipun pertumbuhannya jauh Iebih cepat jika ada oksigen. h. Nitrat (NOɜ) Kandungan nitrat dalam suatu perairan dapat menjadi indikator kesuburan perairan tersebut, kadar nitrat layak di perairan adalah 0,9-3,5 ppm. Dalam keadaan cukup oksigen terlarut (aerob), nitrogen dapat diikat oleh organisme renik (bakteri) yang kemudian diubah menjadi nitrat. Jika terdapat nitrat dengan konsentrasi cukup tinggi dalam sebuah perairan, diduga terdapat organisme renik yang melakukan aktifitas mengikat nitrogen dan mengubahnya menjadi nitrat dan perairan tersebut semakin subur (Jaelani, 2014). Kelebihan nutrien terutama nitrogen dan senyawa karbon dapat mempercepat pertumbuhan penyakit pada koloni koral. Endapan bahan organik dapat menutupi jaringan karang (polip) dan memberikan nutrisi bagi mikroorganisme penyebab penyakit pada karang (Jaelani, 2014). 25 i. Fosfat (PO4) Fosfat sangat diperlukan oleh mikroorganisme yakni Cyanobacteri dalam proses metabolisme sel dan penyusunan ikatan firrofosfat untuk fotosintesis serta metabolisme asam amino, fosfat yang terdapat di kolom air digunakan oleh fitoplankton, ganggang, tumbuhan air, bakteri untuk metabolisme tubuhnya. Melalui proses dekomposisi organisme mati (zat organik) oleh bakteri fosfor kembali dilepaskan ke lingkungan perairan (Koesbiono, 1981). Fosfat yang terdapat dalam air laut berasal dari hasil dekomposisi organisme, run-off dari daratan (erosi tanah), hancuran dari bahan-bahan organik dan mineral fosfat serta masukan Iimbah domestik yang mengandung fosfat. Selain itu, fosfor merupakan unsur yang diperlukan untuk pertumbuhan dan reproduksi bakteri serta dapat mendorong kemampuan bakteri untuk membentuk vitamin yang berfungsi sebagai faktor pertumbuhan (Brockman et.al, 1989). j. Amoniak (NH3) Amoniak di perairan yang terukur berupa amoniak total (NH4+ dan NH3) (Effendi, 2003). Pada pH rendah sebagian besar amoniak akan terionisasi, sementara semakin tinggi pH menyebabkan amonia semakin meningkat, karena senyawa amonium yang terbentuk tidak terionisasi dan akan bersifat toksik (Widayat et.al, 2010). Toksisitas air akan meningkat jika terjadi penurunan kadar oksigen terlarut, pH, dan suhu (Febriwahyudi et.al, 2012). Umumnya amoniak akan mengalami perombakan menjadi nitrit dan nitrat yang disebut dengan proses nitrifikasi, (Sidik, 2002; Effendi, 2003; Widayat et.al, 2010). Proses nitrifikasi digolongkan dalam dua tahap (Effendi, 2003; Djokosetiyanto et.al, 2006; Widayat et.al, 2010). Tahap pertama nitrifikasi yakni oksidasi amoniak menjadi nitrit dibantu oleh bakteri Nitrosomonas. 26 k. Nitrit (NO2) Nitrit (NO2) merupakan bentuk nitrogen yang relatif tidak stabil dan mudah teroksidasi, dan biasanya merupakan indikator tingkat polusi. Walaupun dalam konsentrasi rendah, nitrit bersifat toksik bagi organisme. Nitrit merupakan produk awal dari proses nitrififikasi dimana ion amonium dioksidasi oleh bakteri Nitrosomonas menjadi nitrit. Toksisitas nitrit dapat dikurangi dan dihambat dengan adanya ion klorida. Jika konsentrasi ion klorida dalam air besarnya 6 kali dari konsentrasi nitrit, maka nitrit tidak akan ditransportasikan sehingga toksisitas nitrit dapat dicegah. Oleh karena itu nitrit akan lebih toksik pada salinitas rendah. Toksisitas nitrit dipengaruhi oleh spesies, ukuran, serta salinitas (Yuniasari, 2009). l. Sulfat (SO4) Sulfat merupakan unsur yang dibutuhkan oleh organisme autotrof dan bakteri heterotrof serta jamur sebagai sumber nutrisi untuk memenuhi kebutuhan unsur belerang. Melalui proses reduksi dari sulfat (asimilasi sulfat) akan dihasilkan H2S. Dalam kondisi anaerob, sulfat akan dimanfaatkan oleh bakteri desulfurikan (bakteri heterotrof) dalam proses respirasi. Konsentrasi sulfat yang tinggi dalam air (>250 mg/L) mempunyai efek patogen terhadap manusia, terutama gangguan dalam proses pencernaan (Manik, 2010). m. Dissolved Organic Carbon (COD) Banyaknya limbah organik yang berada di perairan dapat mempengaruhi ekosistem perairan tersebut. Terganggunya suatu ekosistem perairan dapat diketahui dari tingkat kesuburan yang semakin rendah. Salah satu indikator kesuburan perairan adalah oksigen terlarut. Kadar oksigen terlarut semakin menurun seiring dengan semakin meningkatnya limbah organik di perairan tersebut. Hal ini disebabkan oksigen yang dibutuhkan oleh bakteri untuk 27 menguraikan zat organik menjadi zat anorganik semakin banyak (Simanjuntak, 2007). Kandungan bahan organik suatu perairan sangat erat kaitannya dengan jumlah nutrien yang masuk ke perairan dan dipengaruhi oleh keterdekatan lokasi dengan daratan utama. Sebagian besar bahan dibuangan organik yang dapat diuraikan oleh mikroorganisme yang berada di dalam perairan, tetapi beberapa komponen organik seperti lignin, selulosa, dan batu bara tidak dapat atau sukar diurai oleh mikroorganisme. Komponen - komponen tersebut akan menutupi daerah perairan, memperdangkal daerah perairan dan juga dapat mengakibatkan turunnya konsentrasi oksigen terlarut dalam air (Wardoyo, 1974). Bahan beberapa organik mineral mengandung yang karbon, merupakan nitrat, nutrien fosfat, amoniak bagi dan pertumbuhan dan perkembangbiakan mikroba, sehingga bahan organik yang tinggi secara tidak langsung dapat mengakibatkan dan memicu perkembangan penyakit pada karang (Sidharta, 2000). Adapun menurut Koesbiono (1981) menyatakan bahwa kadar bahan organik dalam air laut biasanya rendah dan tidak melebihi 3 mg/I. Selanjutnya dikatakan bahwa bahan organik bukan hanya sebagai sumber energi, tetapi juga sebagai sumber bahan organik esensial bagi organisme perairan. Tingginya kadar bahan organik akan meningkatkan pertumbuhan mikroba patogen dan merugikan kesehatan karang (Kline et.al, 2006). Brown et.al (1986), menyatakan bahwa bahan organik di laut yang berukuran antara 5-10 ppm, dapat dibagi lagi menurut ukurannya. Partikel terkecil terdiri dari bakteri, seluler, material detritus, rangka diatom, partikel anorganik dan yang terutama mineral lempung dan Fe (OH)ɜ bahan organik terlarut lebih kecil dari 5 ppm umumnya terdiri dari bakteri-bakteri yang hidup 28 bebas dan mendapatkan makanan dari pecahan-pecahan kecil detritus yang terlarut dalam campuran organik. C. Bakteri Asosiasi Karang Asosiasi merupakan suatu kehidupan bersama antar individu dalam suatu ikatan seperti asosiasi antara bakteri dengan karang, karena bakteri dapat memberikan kontribusi untuk pertahanan inangnya (Abubakar, 2011). Beberapa jenis bakteri berasosiasi dengan karang terutama terdapat pada permukaan (lendir), gastrodermis dan skeleton. Kalimutho et.al (2007) menemukan 26 jenis bakteri yaitu Pantoea dispersa, Pseudomonas sp., Enterobacter agglomerans, Cadacea darisae, Serratia plymuthica, Citrobacter youngae, Erwinia herbicola, Vibrio sp., Klebsielle pneumonia, Aeromonas caviae, Alteromonas putrefaciens, Serratia sp., Alteromonas sp., Moraxella sp., Photobacterium sp., Yersinia bercovieri, Vibrio metschnikovii, Acinetobacter sp., Yersinia entrocolitica, Brucella sp., Micrococcus sp., Micrococcus varians, Micrococcus roseus, Actinomyces sp. dan Flavobacterium sp. yang berasosiasi dengan Acropora cervicornis di pulau Bidong Terengganu, Malaysia. Massinai (2012) menemukan bakteri asosiasi karang keras sehat dan sakit di kepulauan Spermonde Makassar. Bakteri yang berasal dari karang sehat ditemukan Cromobacterium sp. dan Flavobacterium sp. sedangkan dari karang terinfeksi penyakit ditemukan Cromobacterium sp. dan Pseudomonas sp. Boyett (2006) juga melaporkan ada 9 jenis siliata yang berasosiasi pada karang Acropora yaitu Parauronema longum, Schizocaryum dogieli, Cohnilembus verminua, Anophyroides haemophila, Miamiensis avidus, Pseudocohnilembus marinus, Metanophrys similis, Paranophrys magna dan Urenema marinum. 29 D. Penyakit Pada Karang Penyakit karang didefinisikan sebagai semua perusakan dari suatu sistem atau fungsi penting dari organisme. Faktor pemicu terjadinya penyakit pada karang yaitu parameter faktor lingkungan yaitu perubahan suhu yang drastis, bahan cemar, nutrien yang tinggi, predasi, dan sebagainya. Penyakit karang disebabkan oleh mikroorganisme seperti bakteri, jamur, protozoa, alga renik, dan cacing ukuran mikro. Viehman (2000) menemukan penyakit Black Band Disease (BBD) pada jenis karang Faviidae di perairan Karibia, selanjutnya penyakit White Syndrome (WS) ditemukan oleh Haapkyla et.al (2009) di perairan Wakatobi. Massinai (2012) menemukan laju infeksi penyakit Brown Band (BrB) pada karang Acropora bercabang di pulau Barranglompo Makassar. Penyakit Brown Band (BrB) pertama kali ditemukan oleh Borneman (2001) lalu dideskripsikan oleh Willis (2004) pada survei di bagian Utara dan Selatan Great Barrier Reef. Australia. Selanjutnya ditemukan oleh Bourne et.al (2008) dan Massinai (2012). Hasil pengamatan makroskopik karang yang terinfeksi penyakit Brown Band (BrB) terdapat daerah coklat berupa pita (band) dengan ukuran lebar pita tersebut bervariasi yang terdapat antara jaringan sehat dan skeleton yang putih. Gambar 2. Brown Band Disease (BrB) (sumber : Massinai, 2012) 30 E. Identifikasi Bakteri Identifikasi bakteri dilakukan berdasarkan uji biokimia (Cappucino dan Sherman 1987). Uji biokimia bakteri merupakan cara atau perlakuan yang dilakukan untuk mengidentifikasi dan mendeterminasi suatu biakan murni bakteri hasil isolasi. Jenis-jenis uji biokimia sebagai berikut : a. Uji oksidasi Uji oksidasi berfungsi untuk menentukan adanya sitokrom oksidasi yang dapat ditemukan pada mikroorganisme tertentu. Mikroorganisme aerobik dan anaerobik fakultatif memiliki enzim sitokrom oksidasi dan oksigen sebagai akseptor elektron. b. Uji Katalase Uji katalase digunakan untuk mengetahui aktifitas katalase pada bakteri yang diuji. Kebanyakan bakteri memproduksi enzim katalase yang dapat memecah H2O2 menjadi H2O dan O2. c. Uji Oksidasi Fermentasi Uji Oksidasi Fermentasi bertujuan untuk mengatahui apakah suatu bakteri mampu melakukan fermentasi dan oksidasi, yang ditandai dengan munculnya warna kuning pada medium oksidasi fermentasi. d. Uji Motilitas Uji motilitas bertujuan untuk mengetahui ada atau tidak ada pergerakan bakteri. Uji ini menggunakan medium Sulfit Indol Motility (SIM). Motilitas bakteri terlihat ketika adanya pertumbuhan pada medium yaang tidak terbatas pada stab line inokulasi, sedangkan pertumbuhan bakteri nonmotil terbatas pada garis inokulasi. Pergerakan bakteri ini terlihat dengan adanya pemisahan agar yang ditandai dengan adanya warna hitam. 31 e. Uji Indol Uji indol bertujuan untuk menentukan kemampuan bakteri dalam memecah asam amino triptofan dan untuk menentukan mikroorganisme yang mampu mengoksidasi glukosa dengan menghasilkan asam berkonsentrasi tinggi. f. Uji Ornitin Uji ornitin bertujuan untuk mengetahui kemampuan bakteri dalam mengurai ornitin (asam amino) menjadi amine. Hasil positif jika media berwarna ungu dan hasil negatif jika warna berubah menjadi kuning atau kekuningan. g. Uji Methyl Red (MR) Uji Methyl Red (MR) bertujuan untuk mengetahui kemampuan suatu bakteri untuk menghasilkan asam-asam campuran, sehingga dapat mngubah indikator metil merah menjadi merah. h. Uji Poges vosquer (PV) Uji Poges vosquer (PV) bertujuan untuk mengetahui apakah suatu bakteri mampu menghasilkan aceton atau tidak. Namun, keberadaan aceton tidak dapat diidentifikasi, yang dapat diidentifikasi hanyalah keberadaan 2,3 butanadiol. i. Uji Triple Sugar Iron Agar (TSIA) Uji Triple Sugar Iron Agar (TSIA) bertujuan untuk mengidentifikasi bakteri yang berasal dari kelas enterobacteriaceae. Uji ini biasa juga digunakan untuk membedakan Gram negatif antara yang mampu mengkatabolisme glukosa, laktosa, sukrosa, dan mampu membebaskan asam sulfat. j. Uji Kligler Iron Agar (KIA) Media Kligler Iron Agar (KIA) merupakan media diferensial untuk bakteri Gram negatif. Kemampuan bakteri mengubah dekstros dan laktosa serta kemampuan memproduksi hidrogen sulfida adalah merupakan dasar untuk 32 mengetahui jenis bakteri tertentu dari pertumbuhannya dalam media ini (Suyati, 2010). k. Uji Urea Uji urea bertujuan untuk mengetahui bakteri yang memiliki enzim urease. Bakteri tertentu dapat menghidrolisis urea dan membentuk amonia dengan menimbulkan warna merah karena indikator phenol red. Terbentuknya amonia menyebabkan nilai pH menjadi alkali sehingga jika uji urea terjadi warna merah muda pada media berarti tes positif (Suyati, 2010). l. Uji Lysine Iron Agar (LIA) Lysine Iron Agar (LIA) mengandung glukosa, asam amino lisin, dan brom kresol ungu sebagai pH indikator, serta natrium tiosulfat. Lysine Iron Agar (LIA) dapat digunakan untuk identifikasi mikroba penghasil enzim yang mampu mendekarboksilasi asam amino lisin dan memproduksi gas H₂S (Haryani, 2012). m. Uji Arginin Arginin termasuk asam amino non esensial kelompok dua atau kadang disebut sebagai asam amino semiesensial dengan rumus kimia C₆H₁₄O₂N₄. Disamping berfungsi dalam sintesis protein dan perantara siklus urea, arginin merupakan substrat pembentukan NO dan sintesis fosfokreatin, juga sebagai prekusor glutamate, prolin, dan putresin melalui pembentukan ornitin. Arginin merupakan salah satu komponen penting dalam regulasi fungsi magrofag sebagai antibakteri dan antitumor. Arginin merupakan sumber NO yang mempunyai aktifitas antimikroba, karena bersifat toksik terhadap bakteri (Sukmanintyas, 2003). n. Uji Simmon Citrate Agar (SCA) Uji Simmon Citrate Agar (SCA) digunakan untuk melihat kemampuan mikroorganisme menggunakan sitrat sebagai satu satunya sumber karbon dan 33 energi. Simmon Citrate Agar (SCA) merupakan medium sintetik dengan Na sitrat sebagai satu satunya sumber karbon, NH₄+ sebagai sumber N dan bromthymol blue sebagai indikator pH, sedangkan medium sitrat tidak mengandung indikator. Bila mikroorganisme mampu menggunakan sitrat, maka asam akan dihilangkan dari medium biakan, sehingga meenyebabkan peningkatan pH dan mengubah warna medium dari hijau menjadi biru. Perubahan warna dari hijau menjadi biru menunjukkan bahwa, mikroorganisme mampu menggunakan sitrat sebagai satu satunya sumber karbon, sedangkan pada medium sitrat kemampuan menggunakan sitrat ditunjukkan oleh kekeruhan yang menandakan adanya pertumbuhan (Randa, 2012). o. Uji Glukosa Uji glukosa bertujuan untuk mendeterminasi kemampuan bakteri dalam mendegradasi gula dan menghasilkan asam organik yang berasal dari tiap-tiap jenis gula yaitu sukrosa, maltosa, arabinosa, manitol dan inositol (Kasmiyati dkk, 2009). p. Uji Nitrat Uji reduksi nitrat ditandai dengan terbentuknya warna merah atau merah muda setelah menambahkan reagen uji yang menunjukkan nitrat telah tereduksi menjadi nitrit. q. Uji Gelatin Uji gelatin dimana protein diperoleh dari hidrolisis kalogen. Gelatin akan terurai oleh mikrobia yang mensintesis enzim proteolisis. Larutan gelatin bersifat cair pada suhu ruang atau suhu kamar dan padat apabila berada di dalam refrigerator, apabila gelatin sudah dihidrolisis oleh mikroba maka akan tetap bersifat cair (Hadioetomo, 1993). 34 r. Uji Malonate Uji ini dilakukan untuk melihat perubahan malonate. Jika terjadi perubahan warna dari hijau ke biru, maka uji malonate positif, sedangkan apabila tidak terjadi perubahan warna maka uji malonate negatif. s. Uji Sukrosa, D-Xylose, Laktose, Maltosa, Rhamnosa, Trehalose, D-Mannitol, L-Arabinose, Dextrose, Dulcitol, Tryptose, DL-Phenylanine, Sorbitol, Inositol, Inulin, Esculin dan Raffinose Uji gula-gula ini dilakukan untuk mengetahui kemampuan bakteri melakukan fermentasi karbohidrat. 35 III. METODE PENELITIAN A. Waktu dan Tempat Penelitian ini dilakukan pada bulan Mei - Oktober 2014. Pengambilan sampel karang dilakukan di perairan pulau Barranglompo dengan titik koordinat 05º03’14” BT dan 119º19’32 LS” (Gambar 3). Isolasi bakteri, inokulasi, perhitungan koloni dan pemurnian bakteri dilakukan di Laboratorium Mikrobiologi Laut Jurusan Ilmu Kelautan, Fakultas Ilmu Kelautan dan Perikanan. Identifikasi bakteri dilakukan di Laboratorium Balai Karantina Ikan Makassar. Gambar 3. Peta Lokasi Penelitian B. Alat dan Bahan Alat yang digunakan dalam penelitian ini adalah perahu digunakan sebagai kendaraan menuju lokasi pengambilan sampel , Global Positioning System (GPS) digunakan untuk menentukan titik koordinat pengambilan sampel, kompas digunakan untuk menentukan arah pengambilan sampel , alat dasar selam digunakan sebagai alat bantu menyelam untuk pengambilan sampel, alat 36 tulis menulis digunakan untuk mencatat sampel yang diambil , kamera bawah air digunakan sebagai dokumentasi, botol sampel digunakan untuk mengambil sampel air laut, cool box digunakan untuk menyimpan sampel yang telah diambil, tabung reaksi untuk wadah mereaksikan dua atau lebih larutan/ bahan kimia, otoklaf untuk sterilisasi alat yang akan digunakan, oven untuk sterilisasi kering, hot plate with magnetic stirrer untuk menghomogenkan larutan dengan pengadukan, timbangan analitik untuk mengukur berat sampel dan mengetahui seberapa banyak medium yang akan digunakan, erlenmayer untuk penampungan larutan, spatula untuk mengambil larutan, gelas kimia untuk menyimpan larutan, mikropipet untuk memindahkan cairan yang bervolume cukup kecil, gelas ukur untuk mengukur larutan yang akan digunakan, scalpel steril untuk memotong sampel karang , waterbath sebagai pemanas larutan, syringe untuk mengambil larutan dengan volume tertentu, vortex untuk menghomogenkan larutan, kertas saring untuk menyaring sampel air, bunsen untuk memijarkan alat yang akan digunakan, cawan petri untuk menumbuhkan bakteri isolat, laminar air flow untuk pengerjaan bakteri secara aseptik, inkubator sebagai tempat menyimpan bakteri yang telah ditumbuhkan, ose untuk mengambil isolat bakteri, mortar dan pestle untuk menghancurkan sampel karang, gloves dan masker sebagai pelindung agar terhindar dari kontaminasi. Bahan yang digunakan pada saat penelitian adalah Medium Zobell 2216 Marine Agar (MA) berfungsi sebagai medium yang dapat ditumbuhi semua jenis bakteri yang hidup di lingkungan perairan, Thiosulfate Citrate Bile salts Sucrose Agar (TCBSA) berfungsi sebagai medium untuk menumbuhkan bakteri Vibrio sp., Bismut Sulfite Agar (BSA) berfungsi sebagai medium untuk bakteri Salmonella sp., Eosin Methylin Blue Agar (EMBA) berfungsi sebagai medium untuk menumbuhkan bakteri E. coli., alkohol 70% , akuades, parafilm, tissue, kapas, almunium foil, deterjen, kertas saring, kertas serap, air laut steril dan formalin. 37 C. Prosedur Penelitian 1. Pengambilan Sampel Karang Sampel karang Acropora muricata yang terinfeksi Penyakit Brown Band (BrB) diambil dengan menggunakan alat scuba diving pada kedalaman 3 - 5 M. Kemudian sampel karang Acropora muricata dipotong dengan ukuran ± 2 cm menggunakan scalpel. Penyakit Brown Band (BrB) yang ditemukan di perairan pulau Barranglompo disebabkan oleh adanya band coklat yang melingkar pada percabangan Acropora. Lingkaran tersebut tumbuh dengan skeleton dan polip yang masih hidup. Antara polip yang sudah mati dengan jaringan sehat terdapat jaringan berwarna putih. Kemudian sampel yang telah dipotong dimasukkan ke dalam botol steril yang berisi air laut steril 50 ml + gliserol 50 %, selanjutnya disimpan dalam cool box yang telah diisi es kristal untuk selanjutnya dianalisis di laboratorium Mikrobiologi Laut, Jurusan Ilmu Kelautan, FIKP Unhas. 2. Pengambilan Data Kualitas Air Data kualitas air diambil dengan cara sampel air laut diambil dengan menggunakan botol sampel. Sampel yang telah diambil pada lokasi pengamatan dijadikan sampel untuk pengukuran salinitas, pH, suhu, kekeruhan, amoniak (NH3), nitrat (NO3), nitrit (NO2), sulfat (SO4), dan bahan organik karbon. 3. Isolasi Bakteri Bakteri diisolasi dengan cara sampel dari karang bercabang diambil sebanyak 100 gr kemudian ditimbang 3 gr. Selanjutnya dihancurkan dengan menggunakan mortar dan pestle. a. Sterilisasi Sterilisasi dilakukan dengan cara dicuci dan ditiriskan hingga kering, kemudian untuk bahan gelas dibungkus dengan kertas dan disterilkan dengan sterilisasi kering menggunakan oven pada suhu 180oC selama 2 jam. Untuk alat 38 yang tidak tahan panas dan medium disterilkan dengan sterilisasi basah menggunakan otoklaf pada suhu 121oC, tekanan 2 atm selama 15 menit. b. Pengenceran Isolat dari karang bercabang yang telah dihancurkan menggunakan mortar dan pestle diambil dan dimasukkan ke dalam 9 ml air laut steril, kemudian dilakukan pengenceran hingga 10-3, dilakukan dengan cara larutan stok diambil sebanyak 1 ml lalu dimasukkan ke dalam tabung berisi air laut steril lalu dikocok menggunakan vortex. Kemudian sampel dipipet sebanyak 1 ml dari tabung pengenceran 10-1 dimasukkan ke dalam tabung pengenceran 10-2, lalu dikocok menggunakan vortex. Selanjutnya sampel dipipet sebanyak 1 ml dari tabung pengenceran 10-2, lalu dimasukkan ke dalam tabung pengenceran 10-3, dikocok menggunakan vortex (Gambar 4). Gambar 4. Pengenceran c. Pembuatan Medium (1). Marine Agar (MA) Komposisi medium marine agar (MA) sebagai berikut : 5,0 g pepton, 1,0 g yeast extract, 0,1 g ferric citrate, 19,45 g sodium chloride, 8,8 g MgCl, 3,24 g sodium sulfate, 1,88 g calcium chloride, 0,55 pottasium chloride, 0,16 g sodium 39 bicarbonate, 15,0 g agar, 34,0 mg stronsium chloride, 22,0 mg boric acid, 4,0 mg sodium sillicate, 2,4 mg sodium flouride, 1,6 mg ammonium nitrat, dan 8 mg disodium phosphate, aquadest 1000 ml serta pH media diatur 7,4±0,2. Cara membuat marine agar adalah medium ditimbang sebanyak 110,2 g dimasukkan ke dalam beaker glass kemudian dicampur dengan akuades steril sebanyak 1000 ml lalu dipanaskan diatas hot plate with magnetic stirrer. Setelah mendidih dan larutan menjadi jernih, medium disterilkan di dalam otoklaf tekanan 2 atm pada suhu 121oC selama 15 menit. Media kemudian dituang ke dalam cawan petri untuk digunakan. (2). Thiosulfate Citrate Bile salts Sucrosa Agar (TCBSA) Komposisi medium Thiosulfate Citrate Bile salts Sucrosa Agar (TCBSA) sebagai berikut : Pepton from casein 5,0 g, Pepton from meat5,0 g, Yeast extract 5,0 g, Sodium citrate 10 g, Sodium thiosulfate 10 g, Ox bile 5,0 g, Sodium cholate 3,0 g, Sucrose 20 g, Sodium chloride 10 g, Iron citrate 1,0 g, Thymol blue 0,04 g, Bromothymol blue 0,04 g, Agar-agar 14 g. Cara membuat Thiosulfate Citrate Bile salts Sucrosa Agar (TCBSA) adalah medium ditimbang sebanyak 89 g dimasukkan ke dalam beaker glass kemudian dicampur dengan akuades steril sebanyak 100 ml air laut steril lalu dipanaskan di atas hot plate with magnetic stirrer. Setelah mendidih dan larutan menjadi jernih, medium disterilkan di dalam otoklaf dengan tekanan 2 atm pada suhu 121oC selama 15 menit. Media kemudian dituang ke dalam cawan petri untuk digunakan. (3). Bismut Sulfite Agar (BSA) Komposisi medium Bismut Sulfite Agar (BSA) sebagai berikut : Intisari enzimatik dari kasein 5 g, Enzimatik Intisari dari Jaringan Hewan 5 g, Ekstrak daging sapi 5 g, Dekstrosa 5 g , Dinatrium Fosfat 4 g, Ferrous Sulfate 0,3 g, Bismuth sulfit Indikator 8 g, Brilliant Green 0,025 g, Agar 20 g. Cara membuat Bismut Sulfite Agar (BSA) adalah medium ditimbang sebanyak 52 g dimasukkan 40 ke dalam beaker glass kemudian dicampur dengan akuades steril sebanyak 100 ml air laut steril lalu dipanaskan di atas hot plate with magnetic stirrer. Setelah mendidih dan larutan menjadi jernih, medium disterilkan di dalam otoklaf dengan tekanan 2 atm pada suhu 121oC selama 15 menit. Media kemudian dituang ke dalam cawan petri untuk digunakan. (4). Eosin Methylin Blue Agar (EMBA) Komposisi medium Eosin Methylin Blue Agar (EMBA) sebagai berikut : Pepton 10,0 g, Lactose 10,0 g, Dipotasium Hidrogen phosphate 2,0 g, Eosin 0,4 g, Methylene blue 0,065 g, Agar 15,0 g. Cara membuat medium Eosin Methylin Blue Agar (EMBA) adalah medium ditimbang sebanyak 37, 4 gr dimasukkan ke dalam beaker glass kemudian dicampur dengan akuades steril sebanyak 100 ml air laut steril lalu dipanaskan di atas hot plate with magnetic stirrer. Setelah mendidih dan larutan menjadi jernih, medium disterilkan di dalam otoklaf dengan tekanan 2 atm pada suhu 121oC selama 15 menit. Media kemudian dituang ke dalam cawan petri untuk digunakan. d. Inokulasi Sampel diambil masing-masing sebanyak 1 ml yang diinokulasikan ke dalam masing-masing cawan petri yang berisi 15 sampai 20 ml medium Marine Agar (MA), Eosin Methylin Blue Agar (EMBA), Thiosulfate Citrate Bile salts Sucrosa Agar (TCBSA), dan Bismut Sulfit Agar (BSA). Cawan yang telah berisi inokulum dihomogenkan dengan gerakan yang berlawanan dengan arah jarum jam. Kemudian diinkubasi suhu 30oC selama 24 jam. e. Perhitungan Koloni Jumlah koloni bakteri dilakukan dengan cara dihitung dengan metode hitungan cawan dengan berdasarkan karakteristik, morfologi koloni, elevasi, dan warna. Hasil yang paling baik adalah antara 30-300 koloni per cawan. 41 f. Pemurnian Bakteri Koloni isolat bakteri diambil dengan menggunakan ose kemudian digores pada medium marine agar (MA) dengan cara zig-zag, lalu diinkubasi pada suhu 30oC selama 24 jam. g. Identifikasi Bakteri berdasarkan Uji Biokimia Identifikasi bakteri berdasarkan metode identifikasi yang dikemukakan Cappucino dan Sherman (1987). Beberapa uji biokimia yang dilakukan untuk mengetahui genus bakteri adalah sebagai berikut : 1). Uji Oksidasi Koloni bakteri yang berumur 24 jam digores pada kertas saring steril yang telah ditetesi dengan larutan tetramethylparaphenylenediamine dihydrochloride 1 %. Reaksi positif ditunjukkan dengan adanya perubahan warna bakteri pada kertas saring yang menjadi warna ungu gelap setelah 10 hingga 15 detik. 2). Uji katalase Uji katalase dilakukan dengan cara teteskan larutan H₂O₂ 3 % pada kaca obyek, bakteri diambil dengan menggunakan ose dan dicampur pada larutan. Terbentuknya gelembung udara mengindifikasi reaksi katalase positif. 3). Uji Oksidasi dan Fermentasi Bakteri uji ditumbuhkan pada media oksidasi dan fermentasi dengan pH 7,1 dalam tabung reaksi. Bakteri uji diinokulasikan dengan cara menusukkannya sedalam 0,5 cm, kemudian ditutup dengan vaselin steril pada salah satu tabung. Bakteri bersifat oksidasi apabila terjadi perubahan warna menjadi kuning pada media uji tanpa vaselin, tetapi tidak mengalami perubahan warna pada media yang diberi vaselin. 42 4). Uji motilitas Uji motilitas diambil dengan aseptik menggunakan jarum inokulum, kemudian diinokulasikan secara vertikal pada media Sulfit Indol Motility (SIM) dan diinkubasi selama 24 jam. Motilitas bakteri ditunjukkan dengan adanya pertumbuhan pada permukaan medium dan tidak ada bekas pada tusukan. 5). Uji Methyl Red (MR) Uji Methyl Red (MR) dilakukan dengan menambahkan methyl red yang menghasilkan asam campuran (metilen glikon) dari proses fermentasi glukosa yang terkandung dalam medium Methyl Red – Voges Proskueur (MR-VP). Terbentuknya asam campuran pada media akan menurunkan pH sampai 5,0 atau kurang, oleh karena itu bila indikator metil ditambahkan pada biakan tersebut dengan pH serendah itu maka indikator tersebut menjadi merah. Hal ini menandakan bahwa bakteri ini peragi asam campuran. 6). Uji Voges-Proskueur (VP) Uji Voges-Proskueur (VP) dilakukan dengan cara ditambahkan 40% KOH dan 5% larutan alfa naftol pada saat pengamatan. Hal ini dapat menentukan adanya aceton (asetil metil karbinol), suatu senyawa pemula dalam sintesis 2,3 butanadiol. Dengan adanya penambahan KOH 40 %, keberadaan aceton ditunjukkan dengan perubahan warna medium menjadi merah, dan perubahan ini makin jelas dengan penambahan alfa naftol beberapa tetes. 7). Uji Triple Sugar Iron Agar (TSIA) Uji Triple Sugar Iron Agar (TSIA) dilakukan dengan cara bakteri diinokulasikan ke dalam medium Triple Sugar Iron Agar (TSIA) dengan cara menusukkan pada bagian tegak dan goresan pada bagian kering. Setelah diinkubasi selama 14 - 15 jam, diamati perubahan yang terjadi. 43 8). Uji Indol Isolat bakteri diinokulasikan ke dalam medium nutrien gelatin pada tabung reaksi secara aseptik, diinkubasi pada suhu 37oC selama 24 - 48 jam. Setelah diinkubasi ditetesi dengan 10 tetes reagen Kovac’s dan uji akan bernilai positif merupakan indikasi bahwa bakteri mampu memecah asam amoni tryptopan dengan pembentukan warna merah pada permukaan medium. 9). Uji Kigler Iron Agar (KIA) Biakan bakteri diambil dengan menggunakan ose kemudian diinokulasi ke dalam media Kigler Iron Agar (KIA) dengan cara garis lurus ditarik pada media dan ditusuk ke dalam dasar media dan dibuat goresan berbentuk zig-zag di atas permukaan media. Selanjutnya diinkubasi selama 24 jam pada suhu 37ºC. 10).Uji Simmon Citrate Agar (SCA) Koloni bakteri diambil dengan ose dan diinokulasi pada media Simmon Citrate Agar (SCA), selanjutnya diinkubasi pada suhu 37ºC selama 24 jam. Terjadi warna biru pada medium berarti tes positif dari warna dasar media yaitu hijau. 11). Uji Malonate Pertumbuhan bakteri diambil sedikit dengan ose steril, kemudian diinokulasi pada malonate broth. Inkubasi pada suhu 37ºC selama 24 jam. Terjadinya warna biru pada medium berarti tes positif dari warna dasar media yaitu hijau. 12). Uji Lysine Iron Agar (LIA) Pertumbuhan bakteri diambil sedikit dengan ose steril, kemudian dimasukkan ke dalam dasar tabung agar dan dioleskan ke seluruh permukaannya kemudian diinkubasi pada suhu 37ºC selama 24 jam. 44 Terjadinya warna ungu pada seluruh bagian perbenihan berarti tes positif. Jika tidak ada perubahan warna atau dasarnya berwarna kuning maka tes dinyatakan negatif. 13). Uji Fermentasi Karbohidrat (glukosa, laktosa, sukrosa, maltosa dan manitol) Koloni bakteri diambil sedikit dengan ose steril dan diinokulasi pada perbenihan karbohidrat. Inkubasi pada suhu 37ºC selama 24 jam. Terjadinya warna kuning pada medium berarti tes positif dari warna dasar media yaitu merah. 14). Uji Urea Uji hidrolisis urea dilakukan untuk melihat bakteri mampu menghasilkan enzim urease. Dilakukan dengan cara digoreskan 1 ose biakan pada permukaan Urea agar miring, lalu diinkubasi pada suhu 37⁰C selama 24 jam. Timbulnya warna merah muda berarti reaksi positif dan negatif warna tidak berubah. 15). Uji Gelatin Uji gelatin dilakukan dengan cara sampel bakteri diambil dengan menggunakan ose dan dimasukkan ke dalam nutrien gelatin yang ada didalam tabung, kemudian tabung ditutup rapat dan diinkubasi selama 1x24 jam pada suhu 37ºC selanjutnya disimpan pada inkubator suhu 4 ºC selama 30 menit. Terlebih dahulu disimpan dalam kulkas pendingin selama beberapa menit, jika gelatin tetap cair menunjukkan hasil positif pada uji gelatin. 16). Uji Nitrat Pada tabung reaski ditambahkan 1 ml asam sulfanilat dan 1 ml laruan alpha naftilamin, dikocok sampai merata, kemudian amati terbentuknya warna merah sebagai tanda terjadinya reduksi nitrat menjadi nitrit. 45 17). Uji Arginin Sampel bakteri diambil menggunakan ose dan dimasukkan ke dalam tabung reaksi, jika terjadi perubahan warna dari kuning menjadi merah muda berarti uji arginin positif, sedangkan apabila tidak terjadi perubahan warna maka uji arginin negatif. 18). Uji Ornitin Sampel bakteri diambil menggunakan ose kemudian dimasukkan ke dalam tabung reaksi dan apabila terjadi perubahan warna menjadi ungu maka ornitin positif. Tabel 1. Perubahan Warna Pada Uji Biokimia Reaksi Nama uji Positif (+) Uji Oksidasi Uji Katalase Uji Oksidasi Fermentasi Uji Motilitas Uji Methyl Red (MR) Uji Voges Posquer (VP) Uji Triple Sugar Iron Agar (TSIA) Uji Indol Uji Ornitin Ujin kigler Iron Agar (KIA) Uji Lysine Iron Agar (LIA) Uji Simmon Citrate Agar (SCA) Uji Urea Uji Arginin Uji Malonate Uji Glukosa Uji Sukrosa Uji Gelatin Ungu gelap Bening seperti gelembung udara Kuning dan Hijau Menyebar Merah Pink kemerahan Kuning dan merah Uji Nitrat Merah Uji D-Xylosa Uji Laktosa Uji Matosa Uji Rhaminose Uji Trehalose Uji Mannitol Kuning Kuning Kuning Kuning Kuning Kuning Pembentukan cincin merah Ungu Merah Negatif (-) Kuning Kuning Kuning Biru Merah atau Merah Muda Merah atau Merah Muda Biru Kuning Kuning Mencair Membeku Tidak ada perubahan warna 46 Tabel 1. Lanjutan Reaksi Nama uji Uji Arabonose Uji Dextrose Uji Dulcitol Uji Tryptose Uji Phenylalanine Uji sorbitol Uji Inositol Uji Raffinose Positif (+) Negatif (-) Kuning Kuning Kuning Kuning Kuning Kuning Kuning Kuning D. Analisis Data Data hasil identifikasi bakteri asosiasi karang yang terinfeksi penyakit Brown Band (BrB) di perairan pulau Barranglompo dianalisis secara deskriptif yang disusun dalam tabel dan gambar. 47 IV. HASIL DAN PEMBAHASAN A. Parameter Kualitas Air Parameter kualitas air yang diukur pada saat di lapangan adalah salinitas, pH, dan suhu, sementara yang diukur di laboratorium adalah kekeruhan, amoniak (NH3), nitrat (NO3), nitrit (NO2), sulfat (SO4), dan bahan organik karbon. Data parameter kualitas air pada titik sampling di perairan pulau Barranglompo dapat dilihat pada Tabel 2. Tabel 2. Hasil Pengukuran Parameter kualitas air No Parameter 1 2 3 4 5 6 7 8 9 Satuan Salinitas pH Suhu Kekeruhan Amoniak (NH3) Nitrat (NO3) Nitrit (NO2) Sulfat (SO4) Bahan Organik Karbon Ppt ºC NTU Ppm Ppm Ppm Ppm % 1 30.00 7.34 28.00 17.00 0.01 0.07 0.02 623.30 0.19 Ulangan 2 30.00 7.47 27.00 19.00 0.02 0.00 0.03 638.13 0.19 3 30.00 7.46 27.00 18.00 0.01 0.00 0.03 683.84 0.18 RataRata 30.00 7.42 27.00 18.00 0.01 0.02 0.03 648.18 0.18 Parameter kualitas air merupakan salah satu parameter yang berpengaruh terhadap pertumbuhan bakteri. Tabel 2 memperlihatkan bahwa hasil pengukuran salinitas didapatkan 30 ppt. Nilai salinitas ini dapat mendukung pertumbuhan bakteri laut. Supriharyono (2002) menyatakan bahwa karang tumbuh subur pada perairan dengan kisaran salinitas sekitar 34 – 36 ppt sedangkan salinitas yang baik untuk pertumbuhan bakteri adalah 30,5 ppt. Aksornkoae (1993) menyatakan bahwa salinitas merupakan lingkungan yang sangat menentukan perkembangan organisme. Beberapa garam sangat efektif mempengaruhi salinitas untuk pertumbuhan bakteri yaitu NaCl, LiCI, MgCI₂, KCI₂, RbCI (Ljunger, 1962). 48 Nilai rata–rata pH yang didapatkan dari hasil penelitian adalah 7,42. Hal ini sesuai dengan pernyataan Koesoebiono (1981) bahwa pH air laut cenderung konstan. Menurut Nybakken (1998), di lingkungan laut pH cenderung stabil dan biasanya berada dalam kisaran 7,50-8,40 (Hidayat et.al, 2006). Sebagian besar bakteri memiliki nilai pH minimum dan maksimum antara 4 dan 9 dalam pertumbuhannya. Pada umumnya pH optimum pertumbuhan bakteri terletak antara 6,5 dan 7,5. Namun, beberapa spesies dapat tumbuh dalam keadaan asam atau basa (Pelczar dan Chan, 1988). Mikroba memiliki pH minimum, maksimum, dan optimum. Khamir tumbuh baik pada pH 4,0 - 4,5. Mikroorganisme aquatik biasanya tumbuh baik pada pH 6,5 - 8,5. Suhu yang diperoleh di lokasi penelitian adalah 27ºC. Dari hasil yang diperoleh menunjukkan bahwa suhu pada lokasi penelitian tidak menjadi faktor pembatas bagi pertumbuhan karang keras. Sebagaimana diketahui bahwa pada umumnya karang dapat tumbuh dengan kisaran suhu 18 - 36ºC, dengan kisaran paling optimal antara 26 - 28ºC (Birkeland, 1997). Suhu merupakan salah satu faktor yang penting bagi pertumbuhan organisme, karena suhu sangat berpengaruh terhadap proses kimiawi dan biologi. Kaidah umum menunjukkan bahwa reaksi kimia dan biologi meningkat dua kali lipat untuk setiap kenaikan suhu sebesar 10ºC (Austin, 1987). Menurut Wood (1953) bakteri laut pada suhu 37ºC akan terbunuh sebanyak 42%, sedangkan pada suhu 45ºC hanya tinggal 15% sel yang bertahan hidup. Menghangatkan sesaat ketika melakukan inokulasi pada suhu 30 - 40ºC tidak menyebabkan terbunuhnya bakteri, karena sebagian besar bakteri baru akan terbunuh bila berada pada kisaran suhu tersebut selama Iebih dari 10 menit (Zobell dan Conn, 1940). 49 Setiap spesies bakteri tumbuh pada kisaran suhu tertentu. Bakteri psikrofil mampu tumbuh pada suhu minimum 0-5ºC, optimum 5-15ºC, dan maksimum 1520ºC. Bakteri mesofil dapat tumbuh pada suhu minimum 10-20ºC, optimum 2040ºC dan maksimum 40-45ºC. Bakteri dapat tumbuh pada suhu minimum 2545ºC, optimum 45-60ºC dan maksimum 60-80ºC disebut dengan bakteri termofil (Lay, 1994). Kondisi lingkungan yang mendukung dapat memacu pertumbuhan dan reproduksi bakteri. Faktor-faktor pertumbuhan dan lingkungan reproduksi bakteri yang adalah berpengaruh terhadap suhu, beberapa jenis mikroorganisme dapat hidup pada daerah suhu yang luas, sedangkan yang lainnya pada daerah yang terbatas, sehingga untuk masing masing mikroorganisme dikenal dengan suhu minimum, optimum dan maksimum (Suriawiria, 1985). Pengukuran kekeruhan yang diperoleh pada saat penelitian adalah 18 NTU. Dari kisaran nilai kekeruhan tersebut, maka dapat dikatakan bahwa perairan pulau Barranglompo tergolong perairan yang masih jernih. Hal ini sesuai dengan pernyataan Marubini menyebabkan penetrasi (1996), bahwa kekeruhan cahaya tinggi dapat matahari berkurang ke dalam perairan, akibatnya aktifitas fotosintesis dari zooxanthellae menurun. Nilai kekeruhan yang dapat mematikan karang antara 5-10 NTU (Babcock and Smith, 2000). Nilai amoniak yang diperoleh pada saat penelitian adalah 0.001 ppm. Turunnya kadar amoniak ini memungkinkan disebabkan terjadinya pemecahan amoniak menjadi nitrit oleh bakteri Nitrosomonas yang tumbuh pada karang dalam sistem filtrasi (Sudrajat dan Bambang, 2002). Berdasarkan hasil pengukuran nitrat pada saat penelitian, kandungan nitrat yang terdapat di perairan pulau Barranglompo adalah 0.02 ppm. Secara umum kandungan nitrat di Perairan pulau Barang Lompo masih sesuai dengan 50 kandungan nitrat yang umum dijumpai di perairan laut. Kandungan nitrat yang normal di perairan laut umumnya berkisar antara 0.01 - 50 mg/I. Adanya kandungan nitrat yang rendah dan tinggi pada kedalaman tertentu dapat disebabkan oleh berbagai faktor, antara lain adanya arus pada kedalaman tersebut yang membawa fosfat (Edward dan Tarigan, 2003). Kandungan nitrit yang diperoleh saat penelitian adalah 0.031 ppm. Kadar nitrit dalam air juga menurun walaupun hanya sedikit, yaitu dari dari 0,078 menjadi 0,063 mg/l. Nitrit dalam sistem penyaring biologis akan diubah oleh bakteri Nitrobacter menjadi nitrat, selanjutnya dalam kondisi anaerob akan diubah menjadi nitrogen (Coklin and Chang, 1983). Kandungan sulfat yang diperoleh pada saat penelitian adalah 648.18 ppm. Produksi sulfat sangat besar karena proses pembentukannya dipercepat oleh aktivitas bakteri Thiobacillus ferrooxidans, dan pada kondisi yang asam reaksi sulfat berlangsung sangat cepat. Sulfat juga dapat terhidrolisis sehingga menambah keasaman (Suriadikarta, 2005). Dari hasil penelitian nilai bahan organik karbon yang diperoleh adalah 0.018 %. Tingginya bahan organik akan meningkatkan pertumbuhan mikroba patogen dan merugikan kesehatan karang, sebaliknya kesehatan karang akan kembali stabil seiring dengan rendahnya kadar organik (Kline et.al, 2006). Bahan organik mengandung karbon, nitrat, fosfat, amonia, dan beberapa mineral yang merupakan nutrien patogen (Sidharta, tidak langsung bagi 2000), pertumbuhan sehingga dan perkembangbiakan bahan organik yang tinggi mikroba secara dapat mengakibatkan dan memicu perkembangan penyakit pada karang. Bahan organik yang terdapat di laut sebagian besar berasal dari proses pembusukan organisme yang telah mati, penambahan oleh metabolisme ekstraseluler (Riley dan Chester, 1971). 51 Brown et.al (1986), menyatakan bahwa bahan organik partikulat di air laut yang berukuran antara 5-10 ppm, dapat dibagi lagi menurut ukurannya. Partikel terkecil terdiri dari bakteri, seluler, material detritus, rangka diatom, partikel anorganik dan yang terutama mineral lempung dan bahan organik terlarut Iebih kecil dari 5 ppm umumnya terdiri dari bakteri-bakteri yang hidup bebas dan mendapatkan makanan dari pecahan-pecahan kecil detritus yang terlarut dalam campuran organik. Menurut Odum (1971) menyatakan bahwa peningkatan bahan-bahan organik pada batas-batas tertentu akan meningkatkan produksi organisme perairan, akan tetapi jika bahan organik tersebut meningkat sampai melampaui kemampuan daya dukung perairan, hal ini dapat menurunkan kualitas air dan menurunnya oksigen terlarut, karena seperti yang kita ketahui bahwa bahan organik yang ada di perairan akan didekomposisi oleh bakteri yang juga mengkonsumsi oksigen. B. Penyakit Brown Band (BrB) Penyakit Brown Band (BrB) yang ditemukan di perairan pulau Barranglompo. Penyakit ini ditandai dengan pita warna coklat melingkar pada percabangan Acropora muricata terletak antara skeleton mati dengan jaringan hidup dengan ukuran bervariasi antara 2 -7 mm. Antara pita warna coklat dengan jaringan sehat terdapat jaringan berwarna putih (Gambar 5). Ciri-ciri penyakit Brown Band (BrB) ini sama dengan yang ditemukan oleh Boyett (2006); Raymundo et.al (2006) ; Bourne et.al (2008); Massinai dkk., (2012). Brown Band (BrB) pertama kali dideskripsikan oleh Willis (2004) pada survei di bagian Utara dan Selatan Great Barrier Reef, Australia. Karang yang terinfeksi Brown Band (BrB) terdapat daerah coklat berupa pita (band) dengan ukuran lebar pita tersebut bervariasi yang terdapat antara jaringan sehat dan 52 skeleton yang putih. Seringkali ada zona putih antara jaringan sehat dan pita coklat. Kerangka yang sudah putih terlihat kosong (tidak ada jaringan) Terinfeksi Gambar 5. Karang yang terinfeksi penyakit Brown Band (BrB) C. Karang Yang Terinfeksi Penyakit Brown Band (BrB) Penyakit Brown Band (BrB) menginfeksi karang Acropora muricata. Karang Acropora muricata memiliki bentuk koloni aborescent dengan cabang silindris tetapi kadang berbentuk corymbose (Suharsono, 1996). Memiliki axial koralit, dan juga memiliki radial koralit yang berbentuk tabung dengan bukaan membulat atau oval terususun merata dan rapat. Jenis ini memiliki ukuran sama atau bervariasi, dan penyebarannya berkelompok atau tidak beraturan. Spesies ini memiliki warna coklat gelap atau biru, dengan ujung yang berwarna pucat. Karang Acropora muricata biasa ditemukan di tempat dangkal (Veron,1993). Gambar 6. Jenis Karang yang terinfeksi penyakit Brown Band (BrB) di terumbu karang Pulau Barranglompo. 53 Klasifikasi Acropora muricata menurut Veron dan Terrence (1979) adalah sebagai berikut : Kingdom : Animalia Filum : Cnidaria Kelas : Anthozoa Ordo : Scleractinia Famili : Acroporidae Genus : Acropora Spesies : Acropora muricata Penyakit Brown Band (BrB) menginfeksi 3 famili karang yaitu Acroporidae, Pociloporidae, dan Faviidae (Willis et.al, 2004). Bourne et.al (2008) juga menyatakan bahwa penyakit Brown Band menginfeksi jenis karang Acropora yang disebabkan oleh sekelompok ciliata. D. Bakteri Pada Penyakit Brown Band (BrB) 1. Morfologi Koloni Morfologi koloni bakteri diamati secara makroskopis dengan mengacu pada Cappucino dan Sherman (1986). Berdasarkan hasil pengamatan morfologi didapatkan 13 isolat bakteri yang masing-masing memiliki karasteristik yang berbeda antara satu isolat dengan isolat lainnya. Adapun bentuk morfologi yang didapatkan yaitu bentuk koloni adalah bulat dan tidak beraturan. Tepi koloni ada yang utuh dan berombak. Elevasi yang diamati ada yang mencembung, membukit, datar dan naik. Warnanya putih susu, cream, kuning dan hijau. Ukuran koloni ada yang kecil, sedang, dan besar (Tabel 3 dan Lampiran 1). 54 Tabel 3. Hasil pengamatan morfologi koloni bakteri yang berasosiasi dengan penyakit Brown Band (BrB) No 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Kode isolate S.AJ S.AN S.AL S.AB S.AD S.ACK S.AF S.AH S.AM S.ACO S.AG S.AO S.AA Vb.1 Vb. 2 Bentuk koloni Bulat Tidak beraturan Bulat Bulat Tidak beraturan Bulat Bulat Bulat Bulat Bulat Bulat Bulat Tidak beraturan Bulat Bulat Elevasi Mencembung Mencembung Datar Naik Membukit Membukit Mencembung Mencembung Membukit Naik Mencembung Mencembung Membukit Mencembung Mencembung Tepi Warna Utuh Utuh Utuh Berombak Berombak Utuh Utuh Utuh Utuh Utuh Berombak Berombak Utuh Utuh Utuh Putih susu Putih susu Cream Putih susu Putih susu Putih susu Putih susu Putih susu Putih susu Putih susu Putih susu Putih susu Putih susu Kuning Hijau Ukuran koloni Kecil Kecil Sedang Kecil Besar Kecil Kecil Sedang Sedang Kecil Besar Kecil Kecil Kecil Besar Bentuk koloni yang ditemukan pada penelitian ini (Tabel 3) sesuai dengan yang dinyatakan oleh Cappucino dan Sherman (1987) bahwa pada umumnya bentuk koloni bakteri berbentuk circular (bulat), irregular (tidak beraturan), filamentous (filamen), rhizoid (menyerupai akar). Elevasi berbentuk raised (naik), convex (cembung), flat (datar), umbonate (membukit). Pinggiran/tepi yang berbentuk entire (utuh), undulate (berombak), dan filiform (bergerigi). Berdasarkan hasil pewarnaan Gram dan bentuk sel yang diamati dari Laboratorium Uji Balai Penelitian dan Pengembangan Budidaya Air Payau, bakteri asosiasi karang Acropora muricata didapatkan semuanya berbentuk batang (Gambar 7), bentuk bakteri batang ini dapat hidup di perairan karena memiliki flagel yang digunakan sebagai alat gerak. Sidharta (2000) menyatakan flagellum memungkinkan bakteri bergerak menuju kondisi lingkungan yang menguntungkan atau menghindar dari lingkungan yang merugikan bagi kehidupannya. Pada umummya bakteri yang hidup di lingkungan laut adalah bentuk basil dan termasuk Gram negatif (Sidharta, 2000), selanjutnya Macleod (1965) dalam Kalimutho (2007) menyatakan 87% dari total bakteri asosiasi karang Acropora adalah Gram negatif sedangkan pada tanah daratan hanya 27 – 36 %. 55 2. Bakteri Asosiasi Karang Yang Terinfeksi Penyakit Brown Band (BrB) Hasil uji biokimia dari 13 isolat bakteri asosiasi Acropora muricata yang terinfeksi penyakit Brown Band (BrB) disajikan pada Tabel 4 dan Lampiran 2. Tabel 4. Hasil Uji Biokimia isolat bakteri asosiasi dengan karang Acropora muricata yang terinfeksi penyakit Brown Band (BrB) yang berasal dari Pulau Barranglompo Kode Isolat 1 2 3 SIM 4 Indol S.AH 2 S.AA 2 S.AG 2 S.AO 1 S.AB 1 S.AL 2 S.AJ 1 ⁻ ⁻ + ⁻ + ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ S.AN 1 ⁻ ⁻ S.AD 1 ⁻ ⁻ S.AF 1 S.ACO 1 + ⁻ ⁻ ⁻ S.AM 1 ⁻ ⁻ S.ACK ⁻ ⁻ Motil + + + + + + + + + + + + + + + + + + + + + + + + + + + + ⁻ ⁻ ⁻ TSIA Gas H₂S Butt Slant H₂S Gas ⁻ ⁻ Y R ⁻ ⁻ + + ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ Y + Y + + + ⁻ ⁻ ⁻ ⁻ ⁻ R ⁻ ⁻ R ⁻ ⁻ R R ⁻ ⁻ ⁻ ⁻ 6 ⁻ ⁻ ⁻ ⁻ + + + + + + + + + + + + + + + + + + + + + ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ + + ⁻ ⁻ + + ⁻ R + + ⁻ Y + + ⁻ R ⁻ + + R ⁻ ⁻ 8 ⁻ Y R ⁻ 7 + Y Y ⁻ ⁻ Y Y + ⁻ R ⁻ + Y Y ⁻ R 5 ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ Y R ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ Y R ⁻ ⁻ ⁻ ⁻ ⁻ Jenis bakteri Pseudomonas Sp. Pseudomonas Sp. Bacillus sp-1 Flavobacterium sp-1 Bacillus sp-2 Flavobacterium sp-2 Flavobacterium sp-3 Flavobacterium sp Flavobacterium sp-1 Bacillus sp-3 Pseudomonas sp. Flavobacterium sp-4 Flavobacterium sp-4 Keterangan : 1 = pewarnaan Gram 6 = VP R= Red 2 = OF 7 = King A Y = Yellow 3 = Oksidasi 8 = King B 4 = Katalase 5 = MR Tabel 4 menunjukkan bahwa dari 13 isolat, 3 diantaranya adalah bakteri Gram positif dan yang lainnya adalah Gram negatif. Hal ini sesuai dengan pendapat Kathiresan dan Bingham (2001), yang menyatakan bahwa hampir semua bakteri laut bersifat Gram negatif. Keberadaan positif terbanyak ditemukan pada bakteri laut Gram sedimen. Didapatkannya semua isolat Gram negatif diduga karena bakteri Gram negatif memiliki struktur dinding sel yang lebih kompleks dibanding bakteri Gram positif. Sehingga bakteri Gram negatif mampu bertahan pada kondisi lingkungan yang ekstrim. 56 Berdasarkan hasil identifikasi isolat bakteri yang dilakukan di Laboratorium Uji Balai Penelitian dan Pengembangan Budidaya Air Payau Maros didapatkan genus Pseudomonas sp., Bacillus sp. dan Flavopobacterium sp. Massinai dkk., (2013) melaporkan bakteri asosiasi karang Acropora sp. yang terifeksi penyakit Brown Band (BrB) di perairan pulau Barranglompo adalah Cromobacterium sp, Staphylococcus sp. dan Pseudomonas sp. Sedangkan bakteri asosiasi karang Acropora sp. sehat di Pulau Barranglompo yang ditemukan oleh Massinai dkk., (2014) adalah Acinetobacter sp., Bacillus sp., Flavobacterium sp. dan Chromobacterium sp. Pseudomonas sp. merupakan salah satu genus dari famili Pseudomonadaceae. Bakteri ini berbentuk batang, bersifat Gram negatif, mempunyai flagel dan tidak berkapsul. Bakteri ini hanya menguraikan glukosa dan tumbuh pada semua jenis media. Pseudomonas sp. positif terhadap uji oksidasi, dan negatif terhadap uji fermentasi dan merupakan salah satu bakteri antagonis yang dapat menghasilkan senyawa tunggal atau beberapa senyawa. Bakteri genus Pseudomonas sp. mampu menproduksi beberapa enzim seperti potase, amilase, dan lipase (Crymata, 2011). Menurut Hardhianto (2010), bakteri Pseudomonas sp. juga dapat menguraikan protein, karbohidrat dan senyawa organik lain menjadi CO₂, gas amoniak, dan senyawa-senyawa lain yang lebih sederhana sedangkan Alqamari (2011) menyatakan bahwa Pseudomonas sp. merupakan bakteri yang mampu mendegradasi berbagai jenis hidrokarbon. Keberhasilan penggunaan bakteri Pseudomonas sp. dalam upaya bioremediasi lingkungan akibat pencemaran hidrokarbon membutuhkan pemahaman tentang mekanisme interaksi antara bakteri Pseudomonas sp. dengan senyawa hidrokarbon. Kemampuan bakteri Pseudomonas sp. dalam mendegradasi hidrokarbon menunjukkan bahwa isolat 57 bakteri Pseudomonas sp. berpotensi untuk digunakan dalam upaya bioremediasi lingkungan akibat pencemaran hidrokarbon. Bacillus sp. merupakan bakteri berbentuk batang, tergolong bakteri Gram positif pada kultur muda, motil (reaksi nonmotil kadang terjadi), menghasilkan spora yang biasanya resisten pada panas, bersifat aerob (beberapa spesies bersifat anaerob fakultatif), katalase positif, dan oksidasi bervariasi. Tiap spesies berbeda dalam penggunaan gula, sebagian melakukan fermentasi dan sebagian tidak (Nurjannah, 1995). Bacillus sp. semula dikenal sebagai bakteri asal daratan, seperti halnya Micrococcus namun Rosenfeld & Zobell dalam Effendi (1998) menemukan bahwa bakteri ini ternyata merupakan penghuni laut sejati yang dapat menghasilkan antibiotik. Bacillus sp. asal laut telah diteliti oleh ahli-ahli peneliti kelautan dan terbukti mempunyai beberapa kemampuan, diantaranya adalah mampu menghasilkan zat antibiotik yang dapat melawan bakteri patogen Vibrio cholerae sebagai bakteri pemecah minyak, sebagai penghasil enzim pemecah senyawa glukan yaitu Bacillus circulans yang mampu menguraikan minyak mentah dan hidrokarbon lain. Enzim yang dihasilkan oleh Bacillus telah diproduksi dalam skala industri diantaranya enzim alanin dan formiat, α-amilase, isoamilase, β-amilase, glukoamilase, chitinase, dan cholesterol oxidase (Hatmanti 2000). Genus Bacillus digunakan sebagai agen biokontrol secara luas, menghasilkan zat antimikroba berupa bakteriosin. Bakteriosin adalah zat antimikroba polipeptida atau protein yang diproduksi oleh mikroorganisme yang bersifat bakterisida. Bakteriosin membunuh sel targetnya dengan masuk pada membran target dan mengakibatkan fungsi membran sel menjadi tidak stabil sehingga menyebabkan sel lisis (Compant et.al, 2005). 58 Flavobacterium termasuk famili Achromobacteriaceae merupakan bakteri patogen oportunistik. Diameter koloni mulai dari 0,2-2 μm, koloni berwarna kuning tua, habitat pada tanah dan air. Bentuk selnya berupa batang, memiliki ciri – ciri pendek , Gram negatif dengan bentuk batang yang bergerak menghasilkan pigmen kuning, merah atau orange, pengurai protein. Termasuk ke dalam Gram negatif. Kebutuhan terhadap oksigen termasuk aerob, bersifat non motil, oksidasi positif dan katalase positif (Jaelani, 2 014). Flavobacterium merupakan bakteri oportunistik, dapat menyebabkan penyakit pada organisme yang tidak mempunyai immunokompetensi (Levinson, 2008). Flavobacterium columnare menyebabkan penyakit kolumnaris (Columnaris disease) pada insang channel catfish dan pada kulit ikan rainbow trout fingerling (Durborrow et.al, 1998). Selain identifikasi bakteri umum yang dilakukan di Balai Penelitian dan Pengembangan Budidaya Air Payau Maros, juga dilakukan identifikasi bakteri khusus Vibrio sp. di Balai Karantina Ikan Makassar, hasil yang didapatkan adalah Vibrio sp. (Tabel 5). 59 Tabel 5. Identifikasi Bakteri Vibrio sp. Kode Isolat 1 2 3 SIM 4 Indol S.AH 2 S.AA 2 S.AG 2 S.AO 1 S.AB 1 S.AL 2 ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ S.AJ 1 ⁻ ⁻ S.AN 1 ⁻ ⁻ S.AD 1 S.AF 1 ⁻ - ⁻ ⁻ S.ACO 1 ⁻ ⁻ S.AM 1 ⁻ ⁻ S.ACK ⁻ ⁻ + + + + + + + + + + + + + + + + + + + + + + + + + + ⁻ ⁻ Motil TSIA Gas H₂S Butt Slant H₂S Gas ⁻ ⁻ Y R ⁻ ⁻ + + ⁻ ⁻ + ⁻ ⁻ + ⁻ ⁻ ⁻ ⁻ + ⁻ +⁻ ⁻ - Y R Y R Y R Y Y R R ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ + ⁻ ⁻ Y R ⁻ ⁻ ⁻ + ⁻ ⁻ Y R ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ + + + + + - ⁻ ⁻ Y Y R R ⁻ ⁻ ⁻ ⁻ ⁻ ⁻ Y R ⁻ ⁻ ⁻ ⁻ Y R ⁻ ⁻ ⁻ ⁻ Y R ⁻ ⁻ 5 6 7 8 + ⁻ + + + ⁻ + + + ⁻ + + + ⁻ + + - - + + + - + + + - + + + - + + + - + + - + + + ⁻ + + + ⁻ + + + ⁻ + + ⁻ Jenis bakteri Vibrio sp. Vibrio sp. Vibrio sp. Vibrio sp. Vibrio sp. Vibrio sp. Vibrio sp. Vibrio sp. Vibrio sp. Vibrio sp. Vibrio sp. Vibrio sp. Vibrio sp. Keterangan : 1 = pewarnaan Gram 6 = VP R= Red 2 = OF 7 = King A Y = Yellow 3 = Oksidasi 8 = King B 4 = Katalase 5 = MR Bakteri Vibrio bersifat aerob, tetapi ada pula yang bersifat anaerob fakultatif. Selain itu, Vibrio juga bersifat motil karena pergerakannya dikendalikan oleh flagella, tergolong bakteri Gram negatif dan berbentuk batang yang melengkung seperti tanda koma. Vibrio dikenal sebagai bakteri proteolotik yaitu bakteri yang memproduksi enzim protease ekstraseluler (enzim pemecah protein), aktifitas enzim protease ekstraseluler yang mengakibatkan pecahnya protein pada dinding sel sehingga memudahkan penetrasi bakteri ke dalam sel dan merusak jaringan sel karang (Rosenberg et.al, 2007; Sussman et.al, 2003). 60 V. SIMPULAN DAN SARAN A. Simpulan Berdasarkan hasil dan pembahasan maka dapat disimpulkan bahwa hasil uji biokimia bakteri asosiasi karang Acropora muricata yang terinfeksi penyakit Brown Band (BrB) adalah dari genus Flavobacterium sp., Bacillus sp., Pseudomonas sp., dan Vibrio sp. B. Saran Diperlukan penelitian lebih lanjut pada karang yang sehat dan dibandingkan dengan karang sakit yang berhubungan dengan bakteri Flavobacterium sp., Bacillus sp., Pseudomonas sp., dan Vibrio sp. yang berasosiasi dengan karang sehat pada lokasi yang berbeda. 61 DAFTAR PUSTAKA Abubakar, H. Wahyudi, T.A., Yuhana, M. 2011. Skrining Bakteri yang Berasosiasi dengan Spons Jespis. Jurnal. Vol. 16(1) : 35-40 Agussalim. Pengaruh Sea Level Rise Terhadap Ekosistem Terumbu Karang [online]http://bp3ambon-kkp.org/pengaruh-sea-level-rise-terhadapekosistem-terumbu-karang/ [diakses pada tanggal 1 Maret 2014]. Aksornkoae, S. 1993. Ecology and management of mangrove. IUCN. Bangkok, Thailand. Alqamari, 2011. Pemanfaatan Pseudomonas Aeruginosa Sebagai Agen Pengendali Hayati Pada Tanaman Hortikultura. [Skripsi]. Sumatera Utara. Arifin, T. 2010. Optimasi pengelolaan Kawasan Terumbu Karang di Pulau-Pulau Kecil Kota Makassar. [Laporan Hasil Penelitian]. Pusat Penelitian dan Pengembangan Sumberdaya Laut dan Pesisir Badan Penelitian dan Pengembangan Kelautan dan Perikanan. Kementerian Kelautan dan Perikanan. Austin, B and Austin, D.A 1993. Bacterial Fish Pathogens : Disease in Farmed and Wild Fish. Second edition. Taylor & Prancis London. 356.P. Babcook, R., and smith L., 2000. Effects of sedimentation on coralsttlement and survivorship.in Procedings international Coral Reef Symposium, bali, Indonesia 23-27 October 2000, Vol 1. International Societ for reef Studies. Pp. 245-248. Balai Penelitian dan Pengembangan Budidaya Air Payau. 2014. Laboratorium Uji. Kementrian Kelautan dan Perikanan. Maros Birkeland, C., 1997. Life and Death of Coral Reefs. International Thomson Publishing, University of Guam, New York USA. Borneman, E.H. 2001. Aquarium Corals: Selection, Naturalhistory. TFH Publishing, Neptune City, NJ, USA. Husbandry, and Bourne, D.B., Boyett, H.V., Henderson, M.E., Muirhead, A. and Willis, B.L. 2008 Identification of a Ciliate (Oligohymenophorea: Scuticociliatia) Associated with Brown Band Disease on Corals of the Great Barrier Reef. Applied and Environmental Microbiology 74: 883-888. Boyett, H.V. 2006. The Ecology and Microbiology of Black Band Disease and Brown Band Sydrome on The Great Barrier Reef.Master’s [Thesis] James Cook University, Townsville. Brown, B. E., 1986. Human Inducted Damage to Coral Reefs. Result on a Regional UNESCO (Coman) Workshop With Advanced Training. Ed. Diponegoro University, Jepara and Natonal Institute of Oceanology Jakarta. 62 Cappucino, J. G dan Sherman, N. 1987. Microbiology, A Laboratory Manual. California. Menko Park The Benjamin/ Cummins Publishing Company, Menlo Park. Calofornia Cervino, J.M., Hayes, R., Hayes, R., Poison, S.W.,Polson, S.C., Goreau, T.J., Martinez, R. J. & Smith, G.W. 2004. Relationship of Vibrio species infection and elevated temperatturesto yellow blotch/ Band Disease in Caribeanorals. Syimbiosis. 71:6855-6864. Dinsdale. 2000. Abundance of black band disease on coral from one location on the great barrier reef: a comparison with abundance in the carribean region. In Proceeding 9th International Coral reef Symposium, Bali Indonesia, 2327 October 20002: 1239 -1243 Durborrow, R. M., Thune, R. L., Hawke, J. P., and Camus, A. C. (1988), 'Columnaris Disease - A Bacterial Infection Caused by Flavobacterium columnare', SRAC Publication, No. 479. Dwidjoseputro. 1985. Dasar-Dasar Mikrobiologi. Penerbit Djambatan. Surabaya . Effendi, H. 2003. Telaah Kualitas air. Managemen Sumberdaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor Guntur. 2011. Ekologi Terumbu Karang pada Terumbu Buatan. Ghalia, Malang. Haapkyla, J.,Unsworth, R.K.F., Seymour, A.S., Thomas, J.M.,Flavel, M., Willis, B.L., Smith, D.J. 2009. Spation-Temporal Coral Disease Dynamics in the Wakatobi Marine National Park. South-East Sulawesi Indonesia. Disease of Aquatic Organisme 87: 105-115 Hardhianto, M. D. 2010. Efektifitas Bakteri Pseudomonas sebagai Pengurai Bahan Organik (Protein, Karbohidrat, Lemak) pada Air Limbah Pembenihan Ikan Lele Dumbo (Clarias sp.) Sistem Resirkulasi Tertutup. Fakultas Perikanan dan Kelautan Universitas Airlangga. Surabaya. Harvel, Drew.,Smith, Grriet., Azam, Farooq,. Jordan, Eric,. Raymundo, L,. Weil, I.E,. dan Willis, Bette. 2004.Coral Reef Targeted Research and Capacity Building Management. Queensland: The University of Queensland. Haryani, Y., Chainulfiffah, Dan Rustiana. 2012. Fermentasi Karbohidrat Oleh Isolat Salmonella Spp. Dari Jajanan Pinggir Jalan. Jurnal. Vol. 3 (1) Hidayat, N., Masiana dan Suhartini, 2006. Mikrobiologi Industri. ANDI Yokyakarta. Hutching, P. dan Saenger, P. 1987. Ecology of Mangrove Aus. Eco. Series. Universityof Queensland Press St Lucia, Quesland. 63 Jaelani, I. 2014. Bakteri Asosiasi Pada Karang Pachyseris Sp. Yang Terinfeksi Penyakit Bbd ( Black Band Disease) Di Perairan Pulau BarrangLompo. [Skripsi]. Jurusan Ilmu Kelautan. Fakultas Ilmu Kelautan Dan Perikanan. Universitas Hasanuddin. Makassar. Kalimutho, M., Ahmadi, A., Kassim, Z. 2007. Isolation, Characterization and Identification of Bacteria Associated with Mucus of Acropora cervicornis Coral from Bidong Island, Terengganu, Malaysia. Malaysia Journal of Science, 26(2):27 - 39 Kismiyati, Subekti, S., Yusuf, N. W., Kusdarwati, R. Isolasi dan Identifikasi Bakteri Gram Negatif Pada Luka Ikan Maskoki (Carassius Auratus) Akibat Investasi Ektoparasit (Argullus sp.). Jurnal. Vol. 1. No. 2 Kathiresan, K dan Bingham B. L. 2001. Biology Of Mangrove And Mangrove Ecosystems. Centre Of Advanced Study In Marine Biology, Annamalai University. Huxley College Of Environmental Studies, Western Washington University. Annamalai, India. Koesoebiono. 1981. Biologi Laut. Fakultas Perikanan, IPB. Bogor. Kunarso, 1988. Peranan Bakteri Heterotrofik dalam Ekosistem laut. Jurnal. Vol.XIII : 133 -142 Ljunger, C. 1962. Introductory investigations on Ions and thermal resistance. Physiol. 15:148-160. Marubini, F. and Davies, P.S 1996 Nitrate Increase Zooxantellae Population Density and reduces Skeletogenesis in Corals, Marine Biology 127:319328. Massinai, A. 2012. Kondisi dan Sebaran Penyakit Karang Batu (Stony Coral) di Kepulauan Spermonde.[Disertasi] Program Pascsarjana Universitas Hasanuddin. Makassar. Hal 186. Massinai, A. Syafiuddin, J.Jompa, A. Rasyid. 2013. Laju Infeksi Penyakit Brown Band (BrB) dan bakteri asosiasinya. Disampaikan pada seminar nasional dan internasional Muhlis, A. 2011. Penelitian kebudayaan Barrang Lompo. [Online]. http://catatanmuhlis.blogspot.com/2011/06/penelitian-kebudayaan-barranglompo.html. [Diakses pada tanggal 13 Desember 2012] Musdalifah, 2013. Distribusi Dan Kelimpahan Bakteri Enterococcus Spp. Di Perairan Terumbu Karang Kepulauan Spermonde Makassar. [Skripsi]. Jurusan Ilmu Kelautan. Fakultas Ilmu Kelautan Dan Perikanan. Universitas Hasanuddin. Makassar. Nontji, A. 1987. Laut Nusantara. Penerbit Jambatan, Jakarta. Hal. 156-160. 64 Nurhayati, T., Maggy, T.S., Lilis, N., Sri, B.P. 2006. Karakterisasi Awal Inhibitor Protease dari Bakteri yang Berasosiasi dengan Spons Asal Pulau Panggang, Kepulauan Seribu. Jurnal. Vol. 13. No. 2: 58-64 Nurjannah, S. 1995. Isolasi Dan Karakterisasi Bakteri Genus Bacillus Yang Mampu Menghasilkan Enzim Amylase. [Tesis]. Fakultas MIPA. Universitas Diponegoro. Semarang. Odum, E. P. 1971. Press. Yogyakarta. Dasar-Dasar Ekologi. Gadjah Mada University Pelczar, M. J., Chan, E. C. S. 1988. Dasar-Dasar Mikrobiologi. Jilid 2. Hadioetomo, R. S., Imas, T., tjitrosomo, S. S. Angka, S. L., penerjemaah; Jakarta: UI dari lements of Microbiolo. Pringgenies, D. 2010. Karakteristik Senyawa Bioaktif Bakteri Simbion Moluska dengan GC-MS. Jurnal. Vol.2 : 34-40 Raymundo, L.J., Couch, C.S. and Harvel, C.D. 2008. Coral Desease Handbook Guidelines for Assesment, Monitoring & Management. CoralReef Targeted Research and Capacit Building for Management Program. The University of Quesland; Australia. Riley, R.J. dan Chester, 1971. Academic Press. New York. Introduction to Oceanography Chemistry. Ritchie, K.B. 2006. Regulation of microbial populations by coral surface mucus and mucus-associated bacteria. Marine Ecology Progress Series: Florida. 322: 1–14 Rofi’i, F. 2009. Hubungan Antara Jumlah Total Bakteri Dan Angka Katalase Terhadap Daya Tahan Susu. [Skripsi]. Fakultas Kedokteran Hewan. Institut Pertanian Bogor. Bogor. Romansyah, Y. 2011. Kandungan Senyawa Bioaktif Antioksidan Karang Lunak Sarcophyton Sp. Alami Dan Transplantasi Di Perairan Pulau Pramuka,Kepulauan Seribu. Institut Pertanian Bogor. Bogor Rosenberg, E., Koren, 0., Reshef, L., Efrony, R,, Zilber-Rosenberg, I . 2007. The Roole of Microorganisms in Coral Health, Disease and Evolution. Nat Rev Microbiologi 5: 355-362. Sastrawijaya, A.T.,1991. Perencanaan Lingkungan, Penerbit Rineka Cipta. Siddiqhi, M.H. 2011. Eksplorasi Protein Toksin Bacillus Thuringiensis Dari Tanah Di Kabupaten Tanggerang. [Skripsi]. Program Studi Kimia. Fakultas Sains dan Teknologi. Universitas Islam Negeri Syarif Hidayatullah. Jakarta Sidharta, R. B. 2000. Pengantar Mikrobiologi Kelautan. Universitas Atma jaya. Yogyakarta. hal 23-28 65 Simanjuntak, M. 2007. Oksigen Terlarut Apparent Oxygen Utilization di Perairan Teluk Klabat, Pulau Bangka. Jurnal. Vol. 12(2):59-66 Sudrajat, D. dan Bambang, G. 2002. Sistem Bakteriofiltrasi Sebagai Sarana Pasokan Air Terhadap Penampungan Ikan Hidup. Jurnal. Vol. 7:2 Suharsono., 1996. Jenis-Jenis Karang yang Umum Dijumpai di perairan Indonesia. P3O-LIPI, Jakarta. Sukmanityas, H. 2003. Pengaruh Pemberian L-Arginin Terhadap Respon Imunitas Seluler mencit BALB/c Yang Diinokulasi Salmonella typhimurium. [Tesis]. Program Pasca sarjana. Universitas Diponegoro. Semarang. Supriharyono, M.S., 2002. Pelestarian dan Pengelolaan Sumber Daya Alam di Wilayah Pesisir Tropis. PT Gramedia Pustaka Utama, Jakarta. Suriawiria, 1985. Pengantar Mikrobiologi Umum. Penerbit angkasa Bandung. Suriadikarta, D.A. 2005. Pengelolaan Lahan Sulfat Masam Untuk Usaha Pertanian. Jurnal. Vol 24(1) Sussman M, Loya Y, Fine , M. Rosenberg E (2003) The Marine Fire Worm hermodicekaruunculatais a winter reservoir and spring summer vector for the coral Bleaching pathogen Vibrio Shiloi environ Microbiol 5:250-255. Suyati, 2010. Identifikasi Dan Uji Antibiotik Bakteri Gram-Negatif Pada Sampel Urin Penderita Infeksi Saluran Kemih (Isk). [Skripsi]. Jurusan Biologi Fakultas Matematika Dan Ilmu Pengetahuan Alam Universitas Negeri Papua Manokwari. Thamrin. 2006. Karang, Biologi Reproduksi dan Ekologi. Minamandiri Pres, Riau. Veron, JEN., 2000. Coral of The World Volume 1,2,3. Australian Instituteof Marine Since. Australia and CRR Id Pty Ltd. Australia and the Indopacifik. Angus Robertson Publish, Australia. Viehman T.S,. Tifanny, S. 2001. Characterization of Beggiatoa in Black Band Disease of Scleractinian Corals. Florida International University. Wahyuni, A.E. 2013. Studi Pendahuluan Kandungan Mikroba dalam Sedimen Permuakaan Dasar di Perairan, Selat Madura Kabupaten Bangkalan. [Abstrak]. Dalam Seminar Nasional : Menggagas KebangkitanKomoditas Unggulan Lokal Pertanian dan Kelautan Fakultas Pertanian Universitas Trunojoyo Madura. Yuniasari, D. 2009. Pengaruh Pemberian Bakteri Nitrifikasi Dan Denitrifikasi Serta Molase Ddengan C/N Rasio Berbeda Terhadap Profil Kualitas Air, Kelangsungan Hidup Dan Pertumbuhan Udang Vaname Litopenaeus Vannamei. Departemen Budidaya Perairan. Fakultas Perikanan Dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor Willis, B.L., Page, C.A., Dinsdale, E, A. 2004. Coral Disease on the Great Barrier Reef In R`11osenberg E, Loya Y (eds) Coral Disease and Health. Pp 69 104. Australia: James Cook University. 66 Lampiran 1. Isolat bakteri yang digunakan dalam penelitian S.AH = Pseudomonas sp. S.AL = Flavobacterium sp. S.AA = Pseudomonas sp. S.ACO = Pseudomonas sp. S.AL = Flavobacterium sp. S.ACK = Flavobacterium sp. 67 Lampiran 1. Lanjutan S.AN = Flavobacterium sp. S.AD = Flavobacterium sp. S.AF = Bacillus sp. S.AG = Bacillus sp. S.AO = Flavobacterium sp. S.AM = Flavobacterium sp. S.AJ = Flavobacterium sp. 68 Lampiran 2. Foto Bentuk Sel Bakteri Flavobacterium sp. Bacillus sp. Pseudomonas sp. 69 Lampiran 3. Foto Bakteri Vibrio sp. a. Vibrio sp. 1 b. Vibrio sp. 2 70