- Free Documents
advertisement

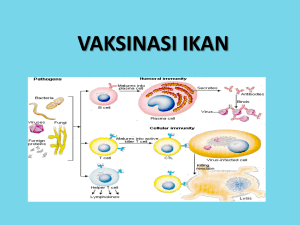
Definisi Vaksin Farmakope Indonesia Edisi IV PRODUKSI VAKSIN Vaksin Marlia Singgih Wibowo School of Pharmacy ITB adalah sediaan yang mengandung zat antigenik yang mampu menimbulkan kekebalan aktif dan khas pada manusia. Vaksin dapat dibuat dari bakteri, riketsia atau virus dan dapat berupa suspensi organisme hidup atau inaktif atau fraksifraksinya atau toksoid. Jenisjenis vaksin menurut FI IV . Vaksin Bakteri dibuat dari biakan galur bakteri yang sesuai dalam media cair atau padat yang sesuai dan mengandung bakteri hidup atau inaktif atau komponen imunogeniknya. . Toksoid Bakteri diperoleh dari toksin yang telah dikurangi atau dihilangkan sifat toksisitasnya hingga mencapai tingkat tidak terdeteksi, tanpa mengurangi sifat imunogenisitas. . Vaksin Virus dan Riketsia adalah suspensi virus atau riketsia yang ditumbuhkan dalam telur berembrio, dalam biakan sel atau dalam jaringan yang sesuai. Mengandung virus atau riketsia hidup atau inaktif atau komponen imunogeniknya. Vaksin virus hidup umumnya dibuat dari virus galur khas yang virulensinya telah dilemahkan. Jenisjenis vaksin virus menurut Kistner, Vaksin virus hidup yang dilemahkan Live Attenuated virus Vaccines. Vaksin virus inaktif/mati Inactivated/killed virus Vaccines. Vaksin subunit subunit Vaccines. Vaksin virus hidup yang dilemahkan Proses Pelemahan Virus Atenuasi Virus Virus virulen dapat dibuat menjadi kurang virulen attenuated dengan cara menumbuhkan virus tersebut pada sel inang yang berbeda dari sel inang normal atau dengan cara mengembangbiakkan virus tersebut pada suhu non fisiologis. Mutan yang mampu berkembang biak lebih baik dibanding virus tipe liar wild type pada kondisi selektif tersebut akan meningkat selama replikasi virus. Jika mutan tersebut diisolasi, dimurnikan, dan diuji patogenisitas pada model yang tepat, beberapa tipe mutan dapat memiliki sifat patogen yang lebih rendah dibandingkan induknya. Mutant tersebut merupakan kandidat yang baik sebagai vaksin karena mereka tidak lagi berkembang dengan baik pada inang alaminya tetapi memiliki kemampuan bereplikasi yang cukup tinggi sehingga dapat menstimulasi respons imun, tetapi tidak menimbulkan penyakit. Contoh Vaksin yang dilemahkan attenuated vaccine Vaksin BCG, Vaksin Sabin polio, Vaksin campak, Vaksin rubella Vaksin virus inaktif/mati Pada metoda ini, virus yang secara alami bersifat patogen diproduksi dalam jumlah besar dan diinaktifkan dengan menggunakan bahan kimia atau prosedur fisik yang dirancang untuk menghilangkan sifat infektif dari virus tanpa kehilangan sifat antigenisitasnya yaitu kemampuan untuk memicu respons imun yang diinginkan. Teknik yang umum digunakan adalah dengan cara perlakuan dengan formalin atau beta propriolactine atau ekstraksi dari partikel envelope virus dengan detergen nonionik seperti Triton X. Jenis vaksin ini relatif tidak memerlukan proses pembuatan yang rumit dan berbiaya murah. Contoh Vaksin virus inaktif Vaksin Influenza, Poliovirus Salk Vaccine, Rabies , vaksin untuk hewan veterinary. Vaksin Subunit Mengambil hanya suatu bagian protein virus untuk dibuat menjadi suatu vaksin, contoh vaksin hepatitis B dan vaksin influenza. atau Vaksin diformulasikan hanya dengan beberapa komponen yang dimurnikan dari virus tanpa memasukkan seluruh bagian virus disebut dengan vaksin subunit. Komponen virus yang diambil adalah protein virus yang dikenali oleh antibodi. Pada banyak kasus, protein yang digunakan adalah protein struktural virus, khususnya protein yang ditemukan pada permukaan virion, yang merupakan target utama dari respons imun. Teknik Rekombinan DNA mengklon suatu gen virus yang cocok pada virus non patogen, bakteri, ragi, atau sel serangga atau sel tanaman untuk memproduksi protein yang imunogenik. Contoh Vaksin Subunit Herpes Simplex Virus Bagian Antigenik dari Herpes Simplex Virus adalah HSV viral envelope glycoprotein D Skema Proses Produksi Vaksin subunit HSV Keuntungan dari Vaksin Subunit CHO cell clone gD gene transfect Hanya genom virus yang digunakan dalam sistem ini, maka tidak ada kemungkinan kontaminasi dari virus terhadap vaksin yang dihasilkan Protein virus dapat diproduksi dengan biaya terjangkau dalam jumlah besar dengan rekayasa organisme pada kondisi yang mempermudah pemurnian dan kontrol kualitas Sebagai contoh, masalah dengan alergi telur setelah vaksinasi dapat dieliminasi apabila protein NA dan HA pada virus influenza diproduksi pada E. coli atau ragi. secreted protein HSV infect infect Not Protected Protected inject purify amp concentrate Teknik terbaru pembuatan vaksin yang sedang dikembangkan VAKSIN DNA DNA digabungkan dalam suatu plasmid yang mengandung Sekuens DNA yang mengkode atau lebih antigen protein, seringkali berupa epitope yang sederhana atau antigen lengkap. Sekuens DNA bergabung dalam suatu promoter yang akan memungkinkan DNA ini ditranskripsi secara efisien pada sel manusia. Seringkali sekuens DNA mengkodekan Costimulatory molecules, juga mengandung sekuens yang mentarget protein yang diekspresikan pada lokasi intraselular spesifik seperti retikulum endoplasma. DNA vaksin dapat diinjeksikan ke otot seperti vaksin konvensional, atau dapat juga diberikan menggunakan pistol gen Dengan vaksin DNA, pasien tidak disuntik dengan antigen tetapi dengan DNA yang mengkode suatu antigen. Keuntungan Vaksin DNA Produksi Vaksin Influenza Inaktif Relatif murah dan mudah diproduksi seluruh vaksin DNA memerlukan proses produksi yang identik. DNA sangat stabil sehingga tidak memerlukan pendingin selama pengiriman atau penyimpanan Mudah dikloning sehingga memungkinkan vaksin untuk dimodifikasi dengan cepat jika diperlukan. Vaksin multivalen dapat disiapkan dengan mudah dengan cara mencampur berbagai plasmid yang berbeda Memicu respons imun yang tahan lama tanpa risiko infeksi yang tidak dikehendaki. Vaksin DNA yang saat ini sedang dalam tahap uji klinik Vaksin HIV Secara umum, vaksin Influenza ditumbuhkan pada media telur ayam yang berembrio embryonated chicken eggs, tetapi sekitar periode tahun an telah ada beberapa perusahaan yang mencoba mengembangkan proses pembuatan vaksin influenza dengan menggunakan media kultur jaringan mamalia tissue culture, tetapi belum diproduksi untuk skala komersial di Eropa. Allantoic Cavity Natural Airspace ChorioAllantoic Membrane Proses produksi vaksin Influenza menggunakan telur ayam berembrio Amniotic Cavity Albumen Sac Shell Membrane ExtraEmbryonic Body Cavity Yolk Sac Tahap Telur ditaruh dalam inkubator hingga usia yang tepat embrio berumur hari. Kemudian telur dilihat dibawah lampu untuk memisahkan telur yang mengandung embrio dan telur yang embrionya tidak tumbuh. Tahap Setelah cangkang telur disterilkan, maka telur diinokulasi dengan cara menyuntikkan virus influenza spesifik ke dalam bagian allantoic dari telur. embryonated chicken eggs Tahap Telur diinkubasi untuk waktu yang optimal biasanya jam pada suhu optimal C dan kemudian dilihat lagi dibawah lampu untuk memisahkan telur yang mati nonviable eggs. Tahap Telur didinginkan chilled terlebih dahulu dalam lemari pendingin untuk meningkatkan hasil pada saat pemanenan dari cairan allantoic yang terinfeksi. Cairan allantioc atau cairan kultur jaringan kemudian diproses lebih lanjut untuk menghilangkan protein telur atau protein sel dan sisasisa sel, kemudian diinaktivasi secara kimia, dan disimpai sebagai bulk vaccines hingga proses formulasi berlangsung Tahap Cairan allantoic yang dipanen harus dijernihkan dengan cara filtrasi dan/ atau sentrifuga sebelum proses pemurnian lebih lanjut. Tahap Penetapan potensi dilakukan pada setiap kelompok vaksin monovalen menggunakan antigen standar yang diketahui jumlah HA Hemagglutininnya dan suatu antiserum HA spesifik. Kekurangan sistem produksi menggunakan telur berembrio Perlu ribuan telur per minggu, sekitar telur untuk dosis Skema proses produksi vaksin dan jangka waktu yang dibutuhkan untuk produksi vaksin cth.influenza, sehingga untuk jutaan dosis vaksin, perlu lebih dari juta telur berembrio yang harus diolah Pada prosesnya, telur harus disinari satu per satu untuk melihat pertumbuhan embrio. Cangkang telur harus disterilkan, dan setiap telur harus diinokulasi dengan menyuntikkan sejumlah virus ke dalam bagian allantoic telur Telur kemudian diinkubasi selama jam dan kemudian harus disinari kembali satu persatu untuk memisahkan telur yang embrionya tumbuh dan yang mati. Selain itu, produksi vaksin dengan metoda telur berembrio memiliki risiko alergi pada pasien terhadap protein yang berasal dari telur egg proteins. Teknik pembuatan dengan media lain telah dikembangkan, antara lain dengan menggunakan teknik lini sel menggunakan VERO African Green Monkey Cells. A Novel Vero Cell Derived Influenza Vaccine produksi Baxter Vaccine AG . Asal sel ginjal monyet hijau afrika Cercopithecus aethiops ATCC CCL yang diperoleh dari American Type Culture Collection at passage no. in . . Cell Banks MCB passage no. telah diuji tidak memiliki tumor genisitas, tidak ada adventitious agent, dan identity/ genetic stability . WCB passage no. . Standard QC tests Bacterial and mycotic sterility, Mycoplasma, Extraneous agents . Sistem Fermentasi Fermentor dgn pengaduk liters, direncanakan yad liters. Karakterisasi Vero Master Cell Bank MCB Study Tumorigenicity Sterility Mycoplasma Mycobact. tubercul. Adventitious Virus Testing In vivo tumorigenicity in nude mice FDA PTC Pharm. Eur. Pharm. Eur. Pharm. Eur. In vitro assay in MRC, Vero, CEC, primary simian cells In vivo assay in suckling and adult mice, guinea pigs and eggs Bovine and Porcine Virus Testing Protocol for bovine virus detection according to CFR requirements In vitro assay for detection of porcine viral contaminants using PPK indicator cells Retrovirus Testing Fluorescent product enhanced reverse transcriptase PERT assay Transmission electron microscopy of sections for the detection of viruses, fungi, yeasts, bacteria and mycoplasmas Human and Simian Virus Testing Identity Detection of HIV/, HTLV/, EBV, HBV, HCV, CMV, HHV//, SFV, SIV, SV, SCMV, SAV, SRV// by PCR Isoenzyme analysis of cell lines Result No evidence for the presence of tumor formation Sterile Free of Mycoplasmas Free of Mycobacterium tuberculosis No adventitious viruses detected No presence of viral contaminants No virus detected Acceptance of Vero Cells for Vaccine Production Vero Cell Technology Teknologi Konvensional using foetal calf serum Vaccine Polio Rabies Regulatory State Licensed for about years today in more than countries Application for EU licensure First National Licensure in February No virus detected Negative for the presence of retroviral RT activity No viruses, viruslike particles, mycoplasmas, fungi, yeasts or bacteria were observed No virus sequences detected Baxters Serum and Protein Free Technology Influenza Identity confirmed Baxters Pilot Plant in Orth, Austria with a Liter Fermenter Vero Cell Microcarrier Cultures a before infection b after days infection with Influenza Vero cells microcarrier Influenza induced CPE cytopathic effect microcarrier Titers of Different Influenza Virus Strains in Vero Cell Cultures and in Embryonated Eggs Type/ Subtype Strain Hemagglutinating Units HAU Vero Egg Ratio Vero/Egg . . . . . . . . . . . . . .............. Sediaan Baxters Vero CellDerived Influenza Vaccine Trivalent g of hemagglutinin per strain, i.e. A/HN, A/HN, and B Ditumbuhkan pada suatu lini sel kontinu yang terkualifikasi VERO menggunakan eggderived wildtype seed viruses yang disediakan WHO Diinaktivasi dengan Formalin Sucrose gradient purified whole virus vaccine Bebas pengawet dan antibiotik Diisikan dalam singleuse syringes A/HN A/PR// A/Brazil// A/USSR// A/Singapore// A/Taiwan// A/Texas// A/Bayern// A/Johannesburg// A/Beijing// A/New Caledonia// A/Singapore// A/Hongkong// A/Texas// A/Shangai// A/Guizho// A/Beijing// A/Johannesburg// A/Wuhan// A/Nanchang// A/Sydney// A/Panama// B/Massachusetts/ B/Yamagata// B/Panama// B/Harbin// B/Shangdong// B/Yamanashi// A/HN A/HN B Keuntungan VeroDerived Influenza Vaccine Tinjauan keamanan Mayoritas reaksi lokal yang diamati pada studi dengan lot vaksin yang berbeda selama musim influenza cukup ringan, sangat sedikit memberikan reaksi yang menengah, dan tidak ada yang memberikan reaksi yang parah. Kasus efek samping sistemik minimal. Frekuensi dan derajat keparahan reaksi lokal dan sistemik dari vaksin virus influenza yang diproduksi dengan media VERO adalah sebanding dengan vaksin influenza yang diperoleh dari media telur yang dilisensikan dari EU. . Kemungkinan kontaminasi lebih kecil pada telur mungkin terkontaminasi avian retroviruses . Penggunaan lini sel yang berkesinambungan, memungkinkan establishment Master Cell Bank MCB and Working Cell Bank WCB yang dapat ditapis secara sempurna terhadap bahan asing . Pengawet misalnya thiomersal tetap penting untuk egg derived vaccines tapi tidak perlu untuk Vero derived vaccine . Residu antibiotik pada terdpt pada egg derived vaccines tidak pada Vero derived vaccine . Bebas protein telur . Mengurangi kemungkinan kandungan endotoksin kirakira kali Baxters Influenza Vaccine Production Plants in Bohumil, Czech Republic and Krems, Austria Titers of Different Influenza A Virus Strains of Human or Animal Origin in Vero Cell Cultures Subtype Host Human Human Swine Duck Human Human Swine Swine Duck Duck Fowl Strain Hemagglutinating Units HAU Vero HN A/PR// A/USSR// A/Swine// A/Duck/Bavaria// A/Singapore// A/Hong Kong// A/Swine/Hong Kong// A/Swine/Hong Kong// A/Duck/Hong Kong// A/Duck/Singapore// A/FPV/Rostock/ HN HN Production Capacity in Approx. million doses of trivalent influenza vaccine HN HN Keuntungan penggunaan sel Vero untuk Vaksin dibandingkan dengan penggunaan Telur pada daerah Pandemik Safety Influenza virus yang berpotensi pandemik memerlukan fasilitas BSL Safety Level containment facilities Hal ini tidak mungkin dipenuhi oleh produksi dengan telur. Namun Baxters Pilot Plant and the new Krems facility didisain untuk unit S / P d digunakan dibawah kondisi S/P. Oleh karena itu, virus wildtype dpt digunakan, tidak perlu attenuasi Logistik Tahun Hongkong Avian flu menyebabkan produksi dengan telur tidak dapat dilakukan. Selain itu, virus demikian dapat memusnahkan ayam betina, sehingga tidak dapat bertelur untuk memenuhi kebutuhan telur berembrio. DAFTAR PUSTAKA .. ........ Departemen Kesehatan RI, Farmakope Indonesia, Edisi IV, Kistner, Otfried, Baxter Vaccine AG, A Novel CellDerived Influenza Vaccine, National Influenza Summit, Chicago, May , Abbas AK, Lichtman AH, Prober JS. Cellular and Molecular Immunology. nd edition. W. B. Saunders Company Philadelphia, . Ada G. Strategies for Exploring the Immune System in the Design of Vaccines. Molecular Immunology . Ertl HCJ, Xiang Z. Novel Vaccine Approaches. Journal of Immunology . Hilleman MR. DNA Vectors Precedents and Safety. Annals New York Academy of Science . Kuby J. Immunology. nd edition. W. H. Freeman and Company New York, . Liu MA. Overview of DNA Vaccines. Annals New York Academy of Science . Siegrist CA, Lamberst PH. DNA Vaccines What Can We Expect. Infectious Agents and Disease . Subbarao EK, Murphy BR. A General Overview of Viral Vaccine Development. Genetically Engineered Vacines. Plenum Press New York, .