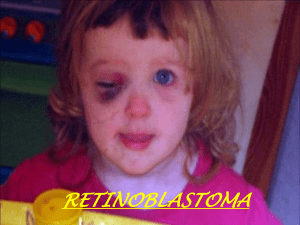
BAB I PENDAHULUAN I.I. Latar Belakang Kanker merupakan
advertisement

BAB I PENDAHULUAN I.I. Latar Belakang Kanker merupakan penyakit dengan karakteristik adanya gangguan atau kegagalan mekanisme pengaturan multiplikasi pada organisme multiseluler sehingga terjadi perubahan perilaku sel yang tidak terkontrol. Perubahan tersebut disebabkan adanya perubahan atau transformasi genetik, terutama pada gen-gen yang mengatur pertumbuhan, yaitu protoonkogen dan gen penekan tumor. Sel-sel yang mengalami transformasi terus-menerus berproliferasi dan menekan pertumbuhan sel normal. Kanker merupakan salah satu penyakit dengan angka kematian yang tinggi. Data Global action against canser (2005) dari WHO (World Health Organization) menyatakan bahwa kematian akibat kanker dapat mencapai angka 45% dari tahun 2007 hingga 2030, yaitu sekitar 7,9 juta jiwa menjadi 11,5 juta jiwa kematian. Di Indonesia, menurut laporan Riskesdes (2007) prevalensi kanker mencapai 4,3 per 1000 penduduk dan menjadi penyebab kematian nomor tujuh (5,7%) setelah sroke, tuberkulosis, hipertensi, trauma, perinatal dan diabetes melitus. Di negara berkembang, kanker merupakan penyebab utama kematian yang disebabkan oleh penyakit pada anak diatas usia enam bulan. Data kanker laporan Riskesdes tahun 2007 menyatakan bahwa Indonesia setiap tahunnya ditemukan sekitar 4.100 pasien kanker anak yang baru. Dari keseluruhan kasus kanker yang ditemukan, meskipun kanker masih jarang ditemukan terjadi pada golongan usia anak atau masih sekitar 2-6%, namun kanker merupakan penyakit degeneratif yang menyebabkan 10% kematian pada anak. Etiologi kanker pada anak masih belum jelas namun penyebabnya diduga oleh karena penyimpangan pertumbuhan sel akibat defek genetik dalam kandungan. Pemicunya diduga oleh faktor lingkungan yang tidak sehat, makanan yang dikonsumsi secara tidak adequat, adanya radiasi, serta infeksi virus. Miller RW (Childhood cancer,1994), proses terjadinya kanker (onkogenesis) pada anakanak sama dengan pada orang dewasa ditinjau dari aspek biomolekuler, perbedaannya yang mendasar adalah pada proses perjalanan penyakitnya. Kanker pada anak biasanya sudah terjadi pada stadium lebih lanjut dibanding pada orang dewasa pada saat mendiagnosisnya. Kanker pada anak cenderung lebih agresif, hal ini disebabkan karena sel kanker pada anak masih merupakan sel primitif sehingga lebih mudah dan cenderung cepat penyebarannya. Kecenderungan kanker terjadi pada tempat tertentu juga menjadi karakteristik pada perbedaanya pada anak. Kanker yang berasal dari jaringan epitel disebut karsinoma. Karsinoma sel skuamosa adalah tumor ganas yang berasal dari jaringan epithelium dengan struktur sel yang berkelompok, mampu berinfiltrasi melalui aliran darah dan limfatik yang menyebar keseluruh tubuh (Cancer Biology, 2000). Karsinoma sel skuamosa merupakan jenis kanker yang paling sering terjadi di rongga mulut yaitu sekitar 90-95% dari total keganasan pada rongga mulut. Lokasi Karsinoma sel skuamosa rongga mulut biasanya terletak pada lidah (ventral, dan lateral), bibir, dasar mulut, mukosa bukal, dan daerah retromolar. Karsinoma sel skuamosa pada lidah merupakan tumor ganas yang berasal dari mukosa epitel rongga mulut dan sebagian besar merupakan jenis karsinoma epidermoid. Karsinoma sel skuamosa lidah berkisar antara 25 sampai dengan 50 % dari semua kanker ganas didalam mulut. Karsinoma ini jarang dijumpai pada wanita dibandingkan pada pria, kecuali dinegara Skandinavia insiden karsinoma rongga mulut pada wanita tinggi oleh karena tingginya insiden penyakit plumer vision syndrome sebelumnya. Dari 441 karsinoma sel skuamosa lidah yang dilaporkan oleh Ash dan Millar, 25 % terjadi pada wanita dan 75 % terjadi pada pria dengan umur rata-rata 63 tahun. Menurut statistic dari NCI’s SEER (National Cancer Institute Surveillance Epidemiology and End Results) U.S. National Institues of Health Cancer diperkirakan 9,800 pria dan wanita (6,930 pria dan 2,870 wanita) didiagnosis terkena kanker lidah. Karsinoma sel skuamosa lidah umumnya mengenai pria di atas 50 tahun, terutama dengan riwayat konsumsi tinggi terhadap tembakau dan alkohol, jarang terjadi pada anak, yaitu sekitar 2-6% dari seluruh kasus, namun literatur menunjukkan adanya peningkatan insidensi tiga hingga tujuh persen selama 25 tahun terakhir. Karsinoma sel skuamosa lidah pada anak merupakan penyakit yang mematikan karena sering kali tidak mampu diprediksi keberadaanya dan memiliki sifat agresif dari awal pembentukannya. Meskipun secara mikroskopik Karsinoma sel skuamosa lidah pada anak dan dewasa hampir sama, namun karena sifat agresif pada anak yang lebih besar, sehingga prognosis pada anak lebih buruk dibanding pada orang dewasa. Karsinoma sel skuamosa lidah mempunyai prognosis yang jelek, sehingga diagnosa dini sangat diperlukan terlebih bila telah terjadi metastase kedaerah lain (leher dan servikal). Karsinoma lidah sering dijumpai bersama-sama dengan penyakit syphilis dan premalignant seperti: leukoplakia, erythroplasia. Menurut penelitian Frazell dan Lucas kasus-kasus kanker lidah yang terjadi bagian dorsum lidah hanya 4%, tetapi lebih ganas (Undifferentiated epidermoid carcinoma). Proliferasi sel yang tinggi dan bersifat tidak terkendali terjadi karena adanya gangguan keseimbangan faktor protoonkogen dan gen penekan tumor sehingga terjadi peningkatan produksi growth factors dan jumlah reseptor permukaan sel yang dapat memacu transduksi sinyal intercelluler untuk meningkatkan produksi faktor transkripsi. Kerusakan DNA menyebabkan berhentinya siklus sel pada fase G1 dan selanjutnya akan terjadi proses perbaikan, jika kerusakan DNA tidak dapat diperbaiki maka sel tersebut akan mengalami apoptosis. Karsinoma sel skuamosa lidah terjadi karena kehilangan kontrol pada siklus sel, yaitu control cell survival (hilangnya kemampuan apoptosis), dan control cell motility (meningkatnya aktivitas invasi dan metastases). Proses terbentuknya karsinoma sel skuamosa merupakan proses bertahap, yang terjadi karena adanya gangguan fungsi pengatur pertumbuhan (protoonkogen dan gen penghambat tumor) sehingga terjadi peningkatan produksi growth factors dan jumlah reseptor permukaan sel, memacu transduksi sinyal interseluler, dan peningkatkan produksi faktor transkripsi. Sifat letal dari kanker adalah memiliki kemampuan untuk menginvasi pada jaringan sekitar, menyebar keseluruh tubuh dan mengalami metastasis pada daerah lain. Jaringan tubuh tersusun dari berbagai sel yang dikelilingi oleh matriks ektraseluler yang terdiri dari protein fibrin (kolagen dan elastin), protein adhesif (fibronektin dan laminin), serta gel proteoglikan dari hialuronan. Matriks ekstraseluler berfungsi mendukung motilitas sel dalam jaringan ikat, mengatur proliferasi sel, bentuk dan fungsi sedemikian rupa sehingga nutrisi dan bahan-bahan kimia dapat berfungsi dengan baik. Matriks metalloproteinase (MMP) merupakan kelompok enzim yang mampu mendegradasi komponen matriks ekstraseluler, mempunyai peranan penting dalam proses fisiologis dan patologis dengan melakukan remodeling pada matriks ekstraseluler. Pada jaringan kanker dijumpai ekspresi berlebih dari matriks ekstraseluler yang diperkirakan merupakan faktor penting pada terjadinya invasi dan metastasis dengan cara merusak komponen dan struktur matriks ekstraseluler dan membrana basalis. Matriks ekstraseluler adalah komponen yang penting pada terjadinya proses invasi sel kanker. Matriks ektraseluler terdiri dari protein fibrin (kolagen dan elastin), protein adhesif (fibronektin dan laminin), serta gel proteoglikan dari hialuronan. Matriks ekstraseluler berfungsi mendukung motilitas sel dalam jaringan ikat, mengatur proliferasi sel, bentuk dan fungsi sedemikian rupa sehingga nutrisi dan bahan-bahan kimia dapat berfungsi dengan baik. Sel-sel tumor harus mampu mengikatkan dirinya pada matriks ekstrasel, menguraikan dan kemudian menembus matriks tersebut untuk terjadinya proses invasi . Setelah perlekatan sel tumor pada matriks ekstrasel, sel tumor menyekresi enzim proteolitik yang kemudian menguraikan komponen matriks dan menciptakan lintasan untuk proses migrasi. Enzim yang penting dalam hal ini adalah kolagenase tipe IV, cathepsin D, dan Matriks metalloproteinase (MMP). Pada jaringan kanker dijumpai ekspresi berlebih dari matriks ekstraseluler yang diperkirakan merupakan faktor penting pada terjadinya invasi dengan cara merusak komponen dan struktur matriks ekstraseluler dan membrana basalis. Manusia adalah organisme multiseluler kompleks, dan semua sel saling bergantung, terkontrol dengan baik oleh suplai oksigen. Difusi okigen melalui jaringan terbatas sekitar 100 sampai 200 μm; oleh karena itu, sistem vaskular yang sangat berkembang terbentuk untuk menjamin bahwa semua sel mendapat suplai oksigen, nutrisi dan faktor pertumbuhan. Sistem ini harus dipertahankan melalui suatu sistem pembuluh darah yang dikenal sebagai angiogenesis. Angiogenesis merupakan suatu proses perkembangan pembuluh darah baru dari vaskularisasi yang sudah ada sebelumnya. Proses ini melibatkan divisi sel endotelial, degradasi selektif dari membran dasar dan matriks ekstraselular di sekitarnya, migrasi sel endotelial, dan pembentukan struktur tubular. Ketika pembuluh darah telah terbentuk, sel-sel endotelial melalui jaringan tertentu berubah menjadi pembuluh darah sesungguhnya. Selama proses embriogenesis, pembuluh darah terbentuk dari proses diferensiasi prekursor sel epitelial (angioblast), yang berhubungan dengan bentuk primitif pembuluh darah. Proses ini dikenal dengan nama vaskulogenesis. Pada sel karsinoma lidah, sebagaimana pada sel kanker lainnya dipengaruhi pula oleh suplai oksigen, nutrisi faktor hormon pertumbuhan, enzim proteolitik, dan diseminasi sel tumor ke daerah sebar yang diperantarai oleh pembuluh darah. Pada saat massa tumor berkembang, pembuluh darah yang sudah ada menjadi kurang mencukupi pada daerah tumor sehingga daerah ini menjadi keadaan hipoksik. Angiogenesis merupakan proses pokok system kontrol kompleks bersama dengan faktor proangiogenik dan antiangiogenik. Angiogenesis terkontrol secara ketat oleh keseimbangan dinamis “angiogenic balance,” yaitu keseimbangan fisiologi antara signal stimulasi dan penghambatan pertumbuhan pembuluh darah. Pada keadaan normal, pembentukan pembuluh darah baru terjadi selama proses penyembuhan luka, regenerasi organ. Angiogenesis juga merupakan suatu faktor penting pada proses patologi seperti pertumbuhan tumor. Perubahan menjadi fenotip angiogenik bergantung pada perubahan lokal kesetimbangan antara stimulator dan inhibitor angiogenik. Salah satu faktor penting dari proangiogenik adalah vascular endothelial growth factors (VEGF). VEGF dapat menyebabkan terjadinya microvascular hyperpermeability, yang dapat terjadi sebelum dan bersamaan dengan angiogenesis. VEGF disebut juga vascular permeability factor (VPF) merupakan faktor proangiogenik paling penting dan paling banyak diekspresikan pada berbagai tipe tumor, baik sel tumor jinak maupun ganas. VEGF berasal dari famili faktor pertumbuhan secara khusus ditargetkan sel endotel untuk meningkatkan permeabilitas sel endotel melalui kaskade transduksi sinyal mitogenactivated protein kinase (MAPk) dengan melonggarkan sambungan antara sel endotel dalam kompleks cadherin. Pemutusan vaskularisasi tersebut penting untuk memulai angiogenesis karena menyebabkan beberapa protein seperti matriks metalloproteinase (MMPs) dideposit dalam cairan ekstraseluler. MMPs memecah matriks ekstraseluler untuk memungkinkan sel endotel migrasi dan menginvasi daerah yang berdekatan dengan kanker. Hipoksia yang terjadi pada pertumbuhan sel kanker disebabkan oleh stress oksidatif yang kemudian mengarah pada keadaan inflamasi. Hipoksia yang terjadi pada sel kanker akan mengaktifkan hypoxia inducible factor-1 (HIF) yang akan menstimulasi VEGF. VEGF merupakan faktor pertumbuhan yang akan memulai proses angiogenesis. Pada sel kanker, hipoksia yang terjadi berkepanjangan yang disebabkan oleh proliferasi cepat sel kanker tidak seiring dengan proses proliferasi sel endotel dalam angiogenesis. Hal ini kemudian memicu keadaan inflamasi yang berkelanjutan sehingga dilepaskan suatu faktor proinflamasi seperti IL-8 yang akan bekerjasama dengan VEGF membentuk pembuluh darah baru. Interleukin 8 merupakan suatu oncoprotein dari famili kemokin, diproduksi oleh berbagai sel, termasuk sel kanker. IL-8 tidak terdapat pada angiogenesis fisiologis tapi terdapat pada angiogenesis kanker. Keberadaan IL-8 bersamaan denga VEGF merupakan indikator terjadinya angiogenesis. Pada sel kanker ekspresi VEGF dan IL-8 diregulasi oleh suatu faktor transkripsi aktif NF-қB. NF-қB itu sendiri dimodulasi oleh mitogen-activated protein kinase (MAPK), yang merupakan protein regulator kunci yang penting pada sel. MAPK banyak terlibat dalam proses seluler seperti proliferasi, diferensiasi, motilitas dan invasi sel kanker. Hambatan pada NF-қB dan MAPK dapat menyebabkan sensitisasi sel kanker terhadap potensi terjadinya proses apoptosis. Meskipun berbagai upaya telah dicapai pada penanganan kanker termasuk kanker lidah, namun masih ditemui rendahnya laju ketahanan hidup pasien. Terapi konvensional pada perawatan kanker lidah sangat terbatas dan bersifat paliatif. Perawatan kanker lidah secara konvensional saat ini menggunakan obat-obatan kemoterapi pada pasien anak, namun sering sekali justru menimbulkan efek samping yang tidak kecil ditimbulkannya sehingga akan memperburuk kondisi anak sehingga pada akhirnya tidak merespon terhadap efek terapeutik obat tersebut. Sehingga peran kemoterapi saat ini lebih diarahkan pada herbal medik yang dapat lebih direspon oleh anak yaitu dengan efek samping yang minimal. Penggunaan obat-obatan konvensional dewasa ini pada kemoterapi telah bergeser kepenggunaan bahan alam (herbal medik), sebagaimana upaya pemerintah dalam program peningkatan, pengembangan, dan pemanfaatan tanaman obat masyarakat. Disamping itu penggunaan obat bahan herbal medik diyakini memiliki efek samping yang minimal dibanding dengan yang konvensional. Selain itu herbal medik dapat juga dipakai sebagai penunjang terapi konvensional untuk meminimalkan efek sampingnya. Tanaman sarang semut (Myrmecodia pendans) sering digunakan oleh masyarakat Indonesia untuk pengobatan. Tanaman epifit yang banyak tumbuh di Papua diyakini mampu mengobati berbagai penyakit berat, seperti kanker, hipertensi, diabetes, liver, asam urat, dan penyakit jantung. Kenyataan tersebut menjelaskan secara empiris bahwa telah banyak penyakit yang dapat disembuhkan dengan obat herbal sarang semut. Apalagi setelah berbagai penelitian ilmiah yang mampu membuktikan khasiat tanaman sarang semut. Beberapa penelitian telah membuktikan khasiat sarang semut untuk pengobatan kanker, hal ini terungkap setelah diteliti obat herbal sarang semut dapat digunakan sebagai obat alternatif kemoterapi kanker payudara dengan efek samping yang minimal. Pengobatan dengan obat tradisional sarang semut tidak banyak memakan biaya dan efek sampingnya minimal dibanding kemoterapi yang memerlukan banyak biaya serta mempunyai efek samping bermacam-macam. Ide penelitian dilakukan berawal dari melihat pengobatan kanker dengan cara kemoterapi yang membuat banyak penderita penyakit kanker menghentikan terapi, karena mengalami beberapa efek samping. Harapannya dengan menggunakan obat herbal sarang semut, hasilnya dapat mengurangi efek samping penderita kanker. Sarang semut diketahui mengandung flavonoid, tanin dan polifenol yang berfungsi sebagai antioksidan, sehingga sangat baik untuk pencegahan penyakit kanker. Selain itu, sarang semut juga mengandung tokoferol dan alfa-tokoferol, zat dengan dengan aktifitas tinggi yang mampu menghambat radikal bebas. Dari hasil uji sitotoksik diketahui ada aktifitas terhadap sel kanker setelah direaksikan dengan ekstrak sarang semut. Ekstrak sarang semut mampu menghambat pertumbuhan sel kanker, bahkan terbukti ekstrak sarang semut dapat membunuh sel kanker melalui mekanisme apoptosis: mematikan sel kanker dengan cara terprogram tanpa menimbulkan rasa sakit pada penderita kanker. Setelah melalui uji sitotoksik, tumbuhan sarang semut mampu menghambat bahkan mematikan sel kanker dengan tidak memecahkan sel kanker yang menimbulkan peradangan yang bisa membahayakan kesehatan pasien kanker. Flavonoid merupakan senyawa polifenol yang ditemukan sebagai komponen penting dari diet manusia. Menurut Kandaswami C, et al (2005) Flavonoid adalah fenil pengganti chromones (derivatif benzopyran) yang terdiri dari rangka dasar karbon-15 (C6-C3-C6), terdiri dari kroman (C6-C3) inti (cincin benzo A dan cincin heterosiklik C), juga berbagi oleh tokoferol, dengan fenil (cincin aromatik B) substitusi biasanya pada posisi-2. Substitusi yang berbeda biasanya dapat terjadi pada cincin A dan B. Penelitian invivo menunjukkan bahwa flavonoid pada makanan tertentu memiliki aktivitas antitumor. Pola hidroksilasi pada cincin B dari flavon dan flavonol, seperti luteolin dan quercetin mempengaruhi penghambatan aktivitas protein kinase dan antiproliferasi. Flavonol dan flavon menargetkan sel permukaan enzim transduksi sinyal, seperti tirosin kinase protein dan adhesi fokal kinase (FAK), dan proses angiogenesis tampaknya menjadi target yang menjanjikan sebagai agen antikanker. Konsumsi diet berbahan herbal seperti sarang semut dapat mencegah perkembangan dan progresifitas penyakit kronis yang berhubungan dengan perluasan neovaskularisasi, termasuk tumor ganas yang bersifat solid. Pada penelitian invitro Fotsis T, et al (1997) menunjukkan bahwa tumbuhan derivat isoflavonoid genistein merupakan inhibitor potensial terhadap proliferasi sel dan angiogenesis. Dilaporkan bahwa beberapa struktur yang berhubungan dengan flavonoid berpotensi berperan sebagai inhibitor dibandingkan genistatin, termasuk 3-hydroxyflavone, 3’,4’dihydroxyflavone, 2',3'-dihydroxyflavone, fisetin, apigenin, dan luteolin menghambat proliferasi sel-sel normal dan tumor, demikian pula dengan hambatan angiogenesis pada penelitian in vitro. Hal ini menunjukkan bahwa flavonoid dapat memberikan kontribusi penting terhadap efek preventif diet berbahan herbal lain seperti myrmecodia pendans terhadap hambatan proliferasi dan hambatan angiogenesis kanker. Flavonoid, terutama derivatif benzo-a-pyrone (phenylchromone), terdiri dari kelompok besar senyawa polifenol. Antioksidan alami ini tersusun lebih dari 4.000 gugus kimia yang unik dan berbeda serta terdistribusi pada berbagai tanaman. Kelompok ini sangatlah beragam dan terdiri dari beberapa kelas yang berbeda seperti flavonol, flavans dan proanthocyanidins, anthocyanidins, flavanones, flavon, isoflavon dan neoflavonoids. Middleton (2000), efek konsumsi flavonoid antara lain anti-inflamasi, anti-alergi, antimikroba, hepatoprotektif, antivirus, antitrombotik, kardioprotektif, penguatan kapiler, efek antidiabetes, anti kanker dan antineoplastik, dan lain-lain. Antioksidan dari diet ini memberikan aktivitas imunomodulator yang signifikan dan menunjukkan kecenderungan untuk mempengaruhi sejumlah proses inflamasi selular, fungsi kekebalan tubuh, dan sel permukaan transduksi sinyal. Flavonoid memiliki kecenderungan untuk mengubah atau memodulasi aktivitas sejumlah sistem enzim yang terlibat dalam transduksi sinyal sel permukaan, fungsi kekebalan tubuh, transformasi sel, pertumbuhan tumor dan metastasis Menurut Harborne JB, (2000) Beberapa tanaman turunan flavonoid telah ditemukan berfungsi sebagai agen preventif penyakit dan agen terapi dalam pengobatan tradisional di Asia selama ribuan tahun. Pada penelitian in vitro flavonoid pada sel tumor, ditemukan berbagai efek antikanker seperti pertumbuhan sel dan penghambatan aktivitas kinase, induksi apoptosis, penekanan sekresi matriks metaloproteinase dan perilaku invasif tumor. Selain itu, beberapa penelitian telah melaporkan hambatan angiogenesis secara invivo dengan diet flavonoid. Penelitian invivo menunjukkan bahwa makanan tertentu yang mengandung flavonoid memiliki aktivitas antitumor. Pola hidroksilasi pada cincin B dari flavon dan flavonol, seperti luteolin dan quercetin, tampaknya mempengaruhi kegiatan sel-sel kanker, terutama pada penghambatan aktivitas protein kinase dan antiproliferasi. Flavonol dan flavon menargetkan sel enzim permukaan transduksi sinyal, seperti protein tirosin dan adhesi fokal kinase, dan proses hambatan angiogenesis tampaknya menjadi target penting yang menjanjikan sebagai agen antikanker. Potensi antikarsinogenik dari flavonoid merupakan hal yang unik sebagai agent kemopreventif. Selain hambatan COX-2, flavonoid juga menghambat protein COX-2independent lainnya seperti Akt dan NF-κB. Flavonoid memiliki peran penting dengan aktifitas biologisnya dalam menghambat protein lain, seperti Akt dan NF-κB. Akt mempunyai peranan penting dalam regulasi pertahanan siklus sel dan proliferasi sel kanker dengan mempengaruhi status phosporilasi berlebihan baik dari Akt. Sehingga blokade signal tersebut menyebabkan hambatan pertumbuhan dengan penghentian siklus sel dan apoptosis dari sel kanker. NF-κB adalah faktor transkripsi yang terlibat dalam fungsi seluler yang luas, di antaranya apoptosis dan kontrol siklus sel. NF-κB meregulasi ekspresi beberapa produk gen yang berhubungan dengan karsinogenesis. Aktivitas antiinvasi dan antiproliferatif. berbagai penelitian mengenai penghambat proliferasi (pertumbuhan sel) tumor oleh flavonoid. Quercetin, flavonol, adalah flavonoid paling dikenal, sangat berlimpah dalam buah dan sayur, dengan perkiraan asupan harian sekitar 25-30 mg di Eropa (8). Menurut Kadaswani (2005) yang dikutip dari Suolinna et al, menyatakan bahwa quercetin flavonoid memberikan efek penghambatan pertumbuhan in vitro pada baris sel tumor ganas, seperti sel Ehrlich ascites, L1210 dan P-388 sel-sel leukemia. Edwards et al, mengamati sitotoksik dan aktivitas antineoplastik secara in vivo pada flavonol, flavon dan isoflavon, dan menyatakan bahwa quercetin dan flavonoid yang lain mengandung katekol (5,7,3 ', 4'tetrahidroksi ¬ 3-glycosyloxyflavone) memiliki aktivitas antineoplastik terhadap Walker karsinoma 256. Molnar et al, melaporkan aktivitas antitumor dari flavonoid polyhydroxylated terhadap tumor NK asites / LY pada tikus. Castillo et al, (1989), mengevaluasi aktivitas antineoplastik dari flavonol polyhydroxylated dan melaporkan penghambatan secara in vivo pada pertumbuhan sel karsinoma kepala dan leher yang ditanamkan pada hewan model. Caltagirone S. et al (2000) Quercetin, selain apigenin, juga menghambat perkembangan tumor pada model binatang lain. Menurut Yoshida M, et al (1999) Flavonoid polyhydroxylated, quercetin memberikan efek penghambatan yang kuat pada pertumbuhan beberapa baris sel ganas tumor secara in vitro, seperti sel kanker lambung (HGC-27, NUGC-2, MKN-7 dan MKN-28), sel kanker usus besar (COLO 320 DM), sel-sel kanker payudara manusia (Hokosawa et al, 1999), dan sel skuamosa gliosarcoma pada manusia (Kandaswani et al, 1991) sel kanker ovarium, kanker epidermoidal (A431), sel kanker hati manusia (Hep G2) dan sel kanker pankreas pada manusia (Scambia G, et al 1990). Kioka et al,. (1992) melaporkan bahwa quercetin menganggu resistensi ekspresi gen MDR1 di hepatocarcinoma sel Hep G2 pada manusia. Aktivitas antiangiogenesis. Angiogenesis pada sel kanker sangat penting untuk pertumbuhan tumor, oleh karena itu proses angiogenesis bisa menjadi target penting untuk menekan pertumbuhan tumor dan metastasis. Angiogenesis diperlukan pada hampir setiap langkah perkembangan tumor dan metastasis, dan vaskularisasi tumor telah diidentifikasi sebagai penanda prognostik yang kuat untuk grading tumor. Sel endotel adalah unsur utama dari proses angiogenesis dan menjadi target untuk terapi antiangiogenesis. Beberapa strategi antiangiogenesis telah dikembangkan untuk menghambat pertumbuhan tumor dengan menargetkan komponen yang berbeda dari tumor angiogenesis. Agen chemopreventive seperti flavonoid telah ditunjukkan untuk menargetkan dan menghambat aspek dan komponen dari proses angiogenesis. Flavonoid berperan penting sebagai agen kemopreventif dan terbukti dapat menghambat angiogenesis, proliferasi sel tumor dan sel endotel secara in vitro. Menurut Kim MH, (2003) Angiogenesis membutuhkan degradasi matriks ekstraseluler yang dimediasi dan dikontrol secara ketat oleh enzim proteolitik ekstraseluler termasuk matriks metalloproteinase (MMP) dan protease serin, khususnya, urokinase-type plasminogen aktivator (UPA) plasmin sistem. Pada studi tentang mekanisme antiangiogenik dari flavonoid, genistein, apigenin, dan 3hydroxyflavone dalam pusar model sel endotel vena manusia (HUVEC). Stimulasi serum HUVECs dengan vaskuler endothel groeth factors /fibroblast growth factors (VEGF / bFGF) ditandai dengan peningkatan produksi MMP-1 dan menyebabkan aktivasi pro MMP-2 disertai dengan peningkatan ekspresi TIMP-1. Genistein memblok stimulasi VEGF / bFGF dengan merangsang peningkatan TIMP-1 yang ditandai dengan penurunan ekspresi TIMP-2. Studi ini juga menunjukkan bahwa genistein, apigenin, dan 3-hydroxyflavone menghambat angiogenesis secara invitro, sebagian melalui hambatan stimulasi VEGF / bFGF yang diinduksi MMP-1 dan ekspresi UPA dan aktivasi pro-MMP-2, dan yang lain melalui inhibitor modulasi TIMP-1 dan TIMP-2. Sel Supri’s-Clone (SP-C1) telah banyak diteliti untuk mendapatkan senyawa antikanker dari tanaman obat (herbal) maupun efektivitas obat sintetik terhadap pertumbuhan sel kanker. SPC1 merupakan sel kanker lidah yang diisolasi dari limfonadi penderita kanker lidah, berasal dari karsinoma sel skuamosa berdiferensiasi sedang dan belum mengalami invasi ke jaringan otot. Sel SP-C1 mempunyai karakteristik pertumbuhan yang cepat, kemampuan invasi dan metastasis yang cepat, penyakit yang sukar disembuhkan, terjadinya rekurensi sangat tinggi walaupun telah dilakukan pembedahan secara radikal dan rerata lamanya hidup penderita pendek. Berdasar pada informasi ilmiah dan latar belakang penelitian, sepanjang penelusuran kepustakaan yang telah dilakukan penulis saat ini, sarang semut (myrmecodia pendans) meskipun masih menjadi tanaman yang sulit didapatkan oleh karena budidaya yang masih kurang di Indonesia, namun ternyata memiliki potensi dan substansi yang berharga dengan aktivitas farmakologisnya melalui senyawa favonoid, yaitu sebagai agen kemopreventif terhadap sel kanker. Beberapa turunan senyawa favonoid dari tanaman dan buah-buahan telah ditemukan efek dan potensi antikankernya berdasarkan uji masing-masing, sehingga dibutuhkan perlunya analisis yang mendalam mengenai senyawa flavonoid lain dari sarang semut (myrmecodia pendans) yang memiliki potensi antikanker serta mengujinya pada aktivitas anti proliferasi, anti invasi serta antiangiogenesis sehingga ditemukan senyawa falvonoid dari sarang semut sebagai obat herbal medik. Penelitian ini menfokuskan isolasi dan identifikasi struktur senyawa flavonoid dari sarang semut (myrmecodia pendans) untuk mendapatkan turunan senyawanya yang memiliki potensi antikanker, serta melakukan pengujian senyawa tersebut untuk mendapatkan beberapa efek kemopreventif kanker yaitu hambatan proliferasi, hambatan invasi dan hambatan angiogenesis sel kanker lidah SP-C1, sehingga didapatkan senyawa flavonoid yang berpotensi antikanker sebagai herbal medik. 1.2. Identifikasi Masalah Bedasarkan latar belakang di atas, maka dapat diidentifikasi masalah: 1. Apakah Sarang Semut (myrmecodia pendans) mengandung senyawa turunan flavonoid yang belum teridentifikasi memiliki potensi anti kanker pada sel kanker lidah Supri’s-Clone (SPC1) ? 2. Apakah senyawa turunan flavonoid anti kanker memiliki potensi hambatan mekanisme protein Akt dan NF-KB pada kultur sel kanker lidah Supri’s-Clone (SP-C1)? 3. Apakah senyawa turunan flavonoid anti kanker dapat menghambat proliferasi (pertumbuhan sel) pada kultur sel kanker lidah Supri’s-Clone (SP-C1)? 4. Apakah senyawa turunan flavonoid anti kanker dapat menghambat angiogenesis (pembentukan sel darah baru) pada kultur sel kanker lidah Supri’s-Clone (SP-C1)? 5. Apakah terdapat korelasi senyawa flavonoid terhadap hambatan proliferasi proliferasi sel SPC1 dan hambatan angiogenesis? 1.3.Tujuan Penelitian Maksud dan tujuan penelitian ini adalah untuk: 1. Mengisolasi dan mengidentifikasi senyawa turunan flavonoid Sarang Semut (myrmecodia pendans) yang memiliki potensi sebagai anti kanker pada sel SP-C1. 2. Menganalisis pengaruh senyawa turunan flavonoid Sarang Semut (myrmecodia pendans) sebagai anti kanker terhadap hambatan proliferasi (pertumbuhan sel) melalui mekanisme hambatan ekspresi Akt dan NF-KB pada sel kanker lidah SP-C1. 3. Menganalisis pengaruh senyawa turunan flavonoid Sarang Semut (myrmecodia pendans) sebagai anti kanker terhadap hambatan angiogenesis (pembentukan sel darah baru) melalui penekanan ekspresi VEGF dan IL-8 pada sel kanker lidah SP-C1. 4. Menganalisis korelasi senyawa flavonoid sebagai antikanker terhadap hambatan proliferasi sel SP-C1 dan hambatan angiogenesis. 1.4. Kegunaan Penelitian Kegunaan Penelitian Menunjukkan Manfaat Teoritis dan Praktis 1. Manfaat ilmiah untuk melengkapi landasan teoritis senyawa flavonoid dari sarang semut (myrmecodia pendans) yang berperan secara invitro terhadap pertumbuhan cell line SP-C1 melalui hambatan proliferasi, mekanisme hambatan Akt dan NF-KB serta hambatan angiogenesis melalui analisis ekspresi VEGF dan IL-8 pada sel kanker lidah Supri’s-Clone (SP-C1). 2. Manfaat praktis penelitian untuk mengeksplorasi potensi dari ekstrak flavonoid pada tumbuhan sarang semut dalam rangka penggunaannya sebagai bahan herbal medik pada terapi kemopreventif. 3. Memberikan informasi di bidang Kedokteran Gigi mengenai turunan senyawa flavonoid dari ekstrak sarang semut yang mempunyai potensi aktivitas antikanker. BAB II TINJAUAN PUSTAKA 2.1. Tinjauan Umum Kanker 2.1.1. Defenisi Kanker adalah pertumbuhan sel tidak beraturan yang muncul dari satu sel. Kanker merupakan pertumbuhan jaringan secara otonom dan tidak mengikuti aturan dan regulasi sel yang tumbuh normal. Tumor adalah istilah umum yang menunjukkan massa dari pertumbuhan jaringan abnormal. 2.1.2. Epidemiologi Pada tahun 2000, kanker telah didiagnosis pada sepuluh juta orang dan menyebabkan kematian sekitar 6,2 juta di seluruh dunia, terjadi peningkatan sekitar 22% sejak tahun 1990. Kanker menjadi penyebab kematian 10% dari morbiditas total di seluruh dunia dan berada pada urutan kedua setelah penyakit kardiovaskular dan menjadi penyebab utama kematian di negaranegara maju. Meskipun kanker dianggap sebagai masalah di negara-negara maju, sekitar dua pertiga dari semua kanker terjadi ditiga perempat penduduk dunia yang hidup di negara-negara yang sedang berkembang. Di seluruh dunia, terdapat sekitar 22 juta orang penderita kanker. Jumlah kasus kanker di seluruh dunia diprediksikan akan mengalami peningkatan 5 juta hingga 15 juta kasus baru setiap tahun pada tahun 2020 (WHO, 2003). Hal ini terutama berhubungan dengan bertambahnya masa hidup banyak penduduk, kemajuan ilmu kedokteran di dalam mengobati penyakit tidak menular lain, dan juga kecenderungan kebiasaan merokok dan gaya hidup tidak sehat masyarakat yang mengarah pada peningkatan munculnya jenis kanker tertentu. 2.2. Karsinoma Sel Skuamosa Rongga mulut Karsinoma adalah tumor ganas yang berasal dari jaringan epithelium dengan struktur sel yang berkelompok, mampu berinfiltrasi melalui aliran limfatik dan menyebar keseluruh tubuh. Karsinoma sel skuamosa merupakan kanker yang paling sering terjadi pada rongga mulut biasanya secara klinis terlihat sebagai plak keratosis, ulserasi, tepi lesi yang indurasi, kemerahan, dan dapat terjadi pada seluruh permukaan rongga mulut. 14,17 Karsinoma pada rongga mulut merupakan salah satu jenis kanker yang menjadi salah satu dari 10 penyebab kematian diseluruh dunia. Di Amerika Serikat, dari sekitar satu juta kanker baru yang didiagnosis setiap tahunnya, ditemukan kurang lebih 3% karsinoma rongga mulut dan orofaring. Kanker kepala dan leher (rongga mulut, lidah, nasofaring, faring, laring, sinus, kelenjar ludah) menunjukkan lebih dari 5% kejadian kanker pada tubuh manusia. Pada perempuan, ditemukan sebanyak 2% kasus karsinoma rongga mulut dari semua jenis kanker. Pada laki-laki sebanyak 2% karsinoma rongga mulut merupakan penyebab kematian akibat kanker, sedangkan pada perempuan 1%. Statistik ini adalah sama di seluruh Amerika Utara tetapi berbeda-beda di seluruh dunia. Pada laki-laki di Prancis, insiden kanker rongga mulut pada laki-laki meningkat hingga 17.9 kasus per 100.000 penduduk, dan angka yang lebih tinggi dilaporkan di India dan negara-negara Asia lain. Sebagian besar kanker rongga mulut adalah karsinoma sel skuamosa. Penyakit-penyakit malignant lain yang bisa terjadi di kepala dan leher meliputi tumor kelenjar air liur, kelenjar tiroid, kelenjar limfa, tulang, dan jaringan lunak. 15 Kurang lebih 95% karsinoma sel skuamosa pada rongga mulut (OSCC) terjadi pada umur lebih dari 40 tahun, dengan usia rata-rata kurang lebih 60 tahun. Namun demikian, angka kejadian karsinoma sel skuamosa pada usia muda telah menjadi perhatian yang cukup serius. Lidah dan bagian dasar lidah serta penyakit keganasan pada tonsil mengalami peningkatan insiden pada usia 20 hingga 44 tahun.16 Sebagian besar kanker rongga mulut melibatkan daerah lidah, orofaring dan dasar mulut. Bibir, gusi, dan palatum rongga mulut jarang ditemui. Karsinoma Sel Skuamosa (SCC) primer jarang terjadi, tetapi sel kanker dapat berkembang dari epitel bebas dan lesi epitelium odontogenik, termasuk kista dan ameloblastoma. Individu yang sebelumnya telah menderita kanker berisiko tinggi mengalami kanker orofaring kedua. 15,16 2.2.1. Etiologi Faktor penyebab karsinoma sel skuamosa rongga mulut belum diketahui secara pasti, namun bersifat multifaktorial dan menyangkut faktor ekstrinsik dan intrinsik. Termasuk faktor ekstrinsik adalah agen eksternal seperti tembakau, alkohol, sifilis dan paparan sinar ultra violet. Sedangkan faktor intrinsik termasuk keadaan sistemik seperti genetik, malnutrisi dan defisiensi zat besi. 2.2.2. Gambaran Histopatologis Karsinoma sel skuamosa secara histologis menunjukkan proliferasi sel epitel skuamosa. Terlihat sel yang atipia disertai perubahan bentuk rete peg processus, pembentukan keratin yang abnormal, penambahan proliferasi sel basaloid, susunan sel menjadi tidak teratur, dan membentuk tumor nest (anak tumor) yang berinfiltrasi ke jaringan sekitarnya, atau membentuk anak sebar ke organ lain (metastasis) 17 Secara histologis karsinoma sel skuamosa diklasifikasikan oleh WHO menjadi: 17 1. Well differentiated (Grade I): yaitu proliferasi sel-sel tumor dimana sel-sel keratin basaloid masih berdiferensiasi dengan baik membentuk keratin (keratin pearl) 2. Moderate differentiated (Grade II): yaitu proliferasi sel-sel tumor dimana sebagian sel-sel basaloid tersebut menunjukkan diferensiasi, membentuk keratin. 3. Poorly differentiated (Grade III): yaitu proliferasi sel-sel tumor dimana seluruh sel-sel basaloid tidak berdiferensiasi membentuk keratin, sehingga sulit dikenali lagi. Gambar 2.1. Gambaran histopatologis SCC well differentiated. Terlihat proliferasi sel-sel skuamous disertai pembentukan keratin (keratin pearl) (tanda panah). Gambar 2.2. Gambaran histopatologis SCC moderate differentiated. Terlihat proliferasi sel karsinoma sebagian sel-sel skuamous berdiferensiasi dengan pembentukan keratin di dalam sitoplasma sel tumor (tanda panah). Gambar 2.3. Gambaran histopatologis SCC poorly differentiated. Terlihat proliferasi sel karsinoma tanpa adanya diferensiasi sel sehingga sel menjadi sangat atipikal dan sulit dikenali. Karsinoma sel skuamosa timbul dari permukaan epitel displastik dan secara histopatologi ditandai dengan gambaran pulau invasi dan rangkaian sel-sel epitel karsinoma skuamosa. Invasi ditandai dengan perluasan secara ireguler dari epithelium sampai ke membrana basalis dan ke dalam jaringan konektif subepitel. Sel yang menginvasi dan masa sel dapat masuk jauh ke dalam jaringan adipose, otot atau tulang dan dapat mendegradasi pembuluh darah, menginvasi kedalam lumina dari vena dan limfatik. Sering terdapat respon inflamasi yang berat atau respon sel imun terhadap epitel yang menginvasi tersebut, dan daerah nekrosis sentral dapat terjadi. Sel-sel kanker superfisial yang berinvasi dalam, biasanya menunjukkan banyak sitoplasma eosinofilik dengan nuklei yang berwarna gelap (hiperkromatik), dan rasio nukleus: sitoplasma meningkat. Terlihat berbagai tingkat pleomorfis seluler dan nuklear. Produk skuamosa sel karsinoma berupa keratin dan keratin pearls yaitu sel yang terkeratinisasi secara abnormal, berlapislapis dan berupa fokus yang bulat yang dapat diproduksi di dalam epitel lesi. Evaluasi secara histopatologis mengenai tingkat kesamaan sel kanker terhadap jaringan asalnya serta produksi normalnya disebut dengan grading. Lesi dibagi menjadi tiga sampai empat tingkat. Tingkat histopatologi tumor dihubungkan dengan sifat biologinya. Sebuah sel kanker yang cukup matang dan sangat mirip dengan jaringan asalnya dan akan tumbuh dengan lambat dan bermetastasis lebih lambat, disebut skuamosa sel karsinoma low grade, grade I atau berdiferensiasi baik. Kanker dengan pleomorfisme celuler dan nuklear dengan keratinisasi yang sedikit atau tidak ada keratinisasi merupakan kanker yang tidak mature sehingga sulit untuk mengidentifikasi jaringan asalnya. Kanker yang demikian seringkali membesar dengan cepat, bermetastasis dini dan disebut dengan karsinoma skuamos sel high grade, grade III/IV, berdiferensiasi buruk atau anaplastik. Kanker dengan gambaran diantara kedua gambaran diatas disebut karsinoma berdiferensiasi sedang. 2.3. Karsinoma Sel Skuamosa Lidah 2.3.1. Defenisi Karsinoma sel skuamosa pada lidah merupakan tumor ganas yang berasal dari mukosa epitel rongga mulut dan sebagian besar merupakan jenis karsinoma epidermoid. Karsinoma sel skuamosa pada lidah terjadi karena akumulasi mutasi genetik pada sel epitel lidah. Perubahan ini dapat disebabkan oleh paparan mutagen, penurunan kondisi tubuh serta iritasi kronis. Tembakau menghasilkan karsinogen kimia yang mempengaruhi metabolisme sel. Paparan karsinogen yang berlangsung terus menerus dapat menyebabkan perusakan genetik sel skuamosa hingga terbentuk kanker. Karsinoma sel skuamosa pada lidah adalah suatu neoplasma malignan yang timbul dari jaringan epitel mukosa lidah dengan selnya berbentuk sel epitel gepeng berlapis (karsinoma sel skuamosa). Manifestasi klinik kanker lidah pada anak tidak berbedah dengan dewasa. Lokasi masa tumor pada lidah tidak menujukkan adanya perbedaan dengan dewasa. Frekuensi metastasis lebih tinggi dibandingkan dewasa . 2.3.2. Gambaran dan Gejala Klinis Faktor etiologi kanker lidah pada anak-anak masih diperdebatkan.Kemungkinan adanya efek karsinogenik tembakau dan alkokhol pada pasien anak rendah. Karena pada kelompok ini waktu paparan relative singkat untuk terbentuknya relasi sebab-akibat. Oleh karena itu, faktorfaktor lain yang diduga sebagai faktor etiologi adalah predisposisi genitik, infeksi viral sebelumnya, keadaan imunodefisiensi, status sosioekonomi, dana kebersihan mulut. Awal dari keganasan biasanya ditandai oleh adanya ulkus. Apabila terdapat ulkus yang tidak sembuh dalam waktu dua minggu, maka keadaan ini sudah dapat dicurigai sebagai awal proses keganasan. Tanda-tanda lain dari ulkus proses keganasan meliputi ulkus yang tidak sakit, tepi bergulung. Lebih tinggi dari sekitarnya dan indurasi ( lebih keras ), dasarnya dapat berbintilbintil dan mengelupas, pertumbuhan karsinoma bentuk ulkus tersebut disebut sebagai pertumbuhan endofitik. Selaian itu karsinoma mulut juga terlihat sebagai pertumbuhan yang eksofitik ( lesi superfisial ) yang dapat berbentuk bunga kolatau papiler, mudah berdarah. Lesi eksofitik ini lebih mudah dikenali keberadaannya dan memiliki prognosis lebih baik. Karsinoma sel skuamosa merupakan kanker yang paling sering terjadi pada rongga mulut biasanya secara klinis terlihat sebagai plak keratosis, ulserasi, tepi lesi yang indurasi, kemerahan, sel skuamosa dapat terjadi pada seluruh permukaan rongga mulut.63 Awal dari keganasan biasanya ditandai oleh adanya ulkus. Apabila terdapat ulkus yang tidak sembuh dalam waktu 2 minggu, maka keadaan ini sudah dapat dicurigai sebagai awal proses keganasan. Tanda-tanda lain dari proses keganasan meliputi ulkus yang tidak sakit, tepi bergulung, lebih tinggi dari sekitarnya dan indurasi (lebih keras), dasarnya dapat berbintil-bintil dan mengelupas. Pertumbuhan karsinoma bentuk ulkus tersebut disebut sebagai pertumbuhan endofitik.4,7 Gejala pada penderita tergantung pada lokasi kanker. Bila terletak pada bagian dua pertiga anterior lidah, kadang-kadang hanya merupakan permukaan yang kasar, keluhan utamanya adalah timbulnya suatu massa yang seringkali terasa tidak sakit, ulkus superfisialis yang tidak sakit, lama kelamaan ulkus melebar, tepinya bulat, berwarna abu-abu seperti nekrosis.19 Bila timbul pada sepertiga posterior lidah, kanker tersebut selalu tidak diketahui oleh penderita, sukar terlihat, cenderung berinfiltrasi ke bagian dalam, dan rasa sakit yang dialami biasanya dihubungkan dengan rasa sakit tenggorokan. Bila lebih parah, lidah terfiksasi pada jaringan sekitar dan tidak dapat digerakkan, dapat menyebabkan disfagia, pembengkakan leher (Gambar 4). Kanker yang terletak dua pertiga anterior lidah lebih dapat dideteksi dini daripada rang terletak pada sepertiga posterior lidah. Kadang-kadang metastase limphonode regional merupakan indikasi pertama dari karsinoma kecil pada lidah.14,19. Gejala pada penderita tergantung pada lokasi kanker tersebut. Bila terletak pada bagian 2/3 anterior lidah, keluhan utamanya adalah timbulnya suatu massa yang seringkali terasa tidak sakit. Bila timbul pada 1/3 posterior, kanker tersebut selalu tidak diketahui oleh penderita dan rasa sakit yang dialami biasanya dihubungkan dengan rasa sakit tenggorokan. Kanker yang terletak 2/3 anterior lidah lebih dapat dideteksi dini daripada yang terletak 1/3 posterior lidah. Kadang-kadang metastasis limfonodi regional mungkin merupakan indikasi pertama dari kanker kecil pada lidah 63 Aspek klinis karsinoma pada rongga mulut tidak menunjukkan penampakan yang berbeda untuk rentang usia mana pun. Penampakan klasik lesi ini adalah inflamasi yang terjadi secara terus-menerus dengan pengerasan dan infiltrasi pada bagian pinggir, dengan atau tanpa vegetasi dengan warna merah atau keputih-putihan. Lokasi paling sering ditemukan pada karsinoma lidah adalah batas posterior dan lateral lidah dan dasar mulut. 15 Gambar 2.4. Kanker lidah (rsyarifario.wordpress.com/.../) Pada stadium awal, secara klinis kanker lidah dapat bermanifestasi dalam berbagai bentuk, dapat berupa bercak leukoplakia, penebalan, perkembangan eksofitik atau endofitik bentuk ulkus. Tetapi sebagian besar dalam bentuk ulkus. Lama-kelamaan ulkus ini akan mengalami infiltrasi lebih dalam jaringan tepi yang mengalami indurasi. 14,10 2.3.3. Letak dan Insidensi Karsinoma sel skuamosa (squamous cell carcinoma, SCC) adalah sekitar 90-95% dari semua tumor ganas rongga mulut. Kanker ini terletak terutama pada lidah, khususnya pada batas posterior lateral lidah. Pada umumnya diderita oleh laki-laki di atas usia 50 tahun, terutama mereka yang memiliki riwayat konsumsi tembakau dan alkohol tinggi. Kanker ini jarang terjadi pada usia muda atau di bawah usia 40 tahun.16 Letak dan insidensi terjadinya karsinoma sel skuamosa berbeda pada daerah anatomi rongga mulut. Terdapat daerah yang resisten namun juga ada daerah rentan, seperti pada daerah lateral lidah, bibir bawah, ventral lidah, daerah dasar mulut dan daerah posterior dasar mulut sering terjadi, sedangkan pada daerah gingiva, palatum durum dan mukosa bukal jarang terjadi.16 . Bagian anterior pada lidah, terutama batas lateral, perbatasan ventral lidah. Kurang lebih 60% atau lebih pasien penderita lesi lokal berdiameter kurang dari 2 cm mampu bertahan hidup selama 5 tahun atau lebih setelah menjalani pengobatan.15 Hampir 80% karsinoma lidah terletak pada dua pertiga anterior lidah (umumnya pada tepi lateral dan bawah lidah) dan dalam jumlah sedikit pada posterior lidah. Secara klinis kanker lidah menyerang dua pertiga anterior lidah dan sepertiga posterior lidah serta dapat juga bermetastase ke daerah sekitar lidah misalnya submaxillary,dan digastricus juga ke daerah leher dan servikal. 5,16 Pada 330 kasus pada karsinoma pada lidah yang dilaporkan rata-rata penderita tersebut berumur 53 tahun dengan jarak umur 32 tahun sampai dengan 87 tahun, sehingga penyakit tersebut merupakan penyakit pada orang tua tetapi dapat juga terjadi pada orang-orang yang relatif muda. Sebagai contoh dari 11 penderita berumur kurang dari 30 tahun, 4 diantaranya berumur kurang dari 20 tahun, kelompok penderita ini mewakili kira-kira 3 % dari seluruh penderita yang dijumpai dirumah sakit Anderson dengan epidormoid carsinoma lidah. 5 Perawatan kanker lidah pada anak mengikuti prinsip perawatan pasien dewasa. Lokasi, ukuran dan tipe histopatologis lesi menetukan pilihan perawatan. Prognosis kanker lidah pada anak sangat buruk, sehinggah penderita memerlukan terapi multimodal.Hal tersebut meliputi pembedahan, radioterapi, dan kemoterapi. Radioterapi digunakan untuk mengontrol masa residual mikroskopis lokal atau luas, sementara kemoterapi sistemik berperan pada sitoreduksi primer dan juga eradikasi luas masa dengan mikrometastasis.6 1. Pembedahan Pembedahan lengkap direkomendasikan jika tidak menganggu secara kosmetik.Pada kasus tidak memungkinkannya reseksi lengkap, biopsi inisial yang diikuti oleh kemoterapi merupakan hal yang tepat.Pembedahan kedua dapat dilakukan dalam dua keadaan berbeda. Dalam kasus yang terlihat remisi lengkap, pembedahan kedua dimaksudkan sebagai metode untuk melihat respon patologis . selain itu, pembedahan kedua dimaksudkan untuk mereseksi setelah pemberian terapi lokal defenitif. 60 2. Kemoterapi Sebelum terapi kombinasi, pembedahan sendiri menghasilkan laju ketahanan< 20%.Perkembangan terapi telah meningkatkan ketahanan hidup pasien sekitar 60%. Bahan yang digunakan dalam kemoterapi adalah vincristin (V), aktinomisin D (A), doksurubisin (Dox), siklofosfamid (C), ifosfamid (I), dan etoposid (E), VAC telah merupakan standar terbaik untuk kemoterapi kombinasi dalam perawatan kanker lidah. 60 3. Radioterapi Radioterapi berperan penting dalam perawatan kanker lidah.Radioterapi merupakan metode efektif untuk mencapai kontrol lokal tumor bagi pasien dengan penyakit residual mikroskopik atau besar setelah biopsi, reseksi pembedahan inisial, atau kemoterapi. Dosis awal yang direkomendasikan adalah 5,500 hingga 6,000 cGƴ untuk mengontrol daerah tomur primer.60 2.1.3 Prinsip Dasar Perawatan Kanker Invasi, proliferasi sel tumor dan penghambatan angiogenesis merupakan target mekanisme perawatan antikanker.29 Sel kanker mengalami kematian dengan disregulasi jalur apoptosis yang relevan, tetapi dapat juga dipicu untuk mati dengan kemoterapi konvensional maupu oabt-obatan modern lainnya. Eradikasi lengkap sel kanker, diperlukan untuk membunuh sel stem kanker, yaitu sel yang dapat memperbaharui diri, proliferasi, dan regenerasi baik tumor primer maupun metastatik. Terdapat bukti bahwa apoptosis dapat secara selektif memicu sel stem kanker dan tidak pada sel stem somatik normal. 9 Selama kemoterapi sitotoksik, apoptosis pada sel tomur didahului oleh apoptosis sel endotel pembuluh darah sekitar tumor. Pemberian inhibitor angiogenesis tidak hanya secara langsung menimbulkan efek sitotoksik terhadap sel tumor namun dapat meningkatkan apoptosis sel tumor dan menghabat pertumbuhan.25,29 Vaskulatur tumor sebagai target strategi perawatan kanker dapat lebih efektif dibandingkan menjadi tumor itu sendiri sebagai target. Hal tersebut disebabkan karena kanker dipertimbangkan sebagai kelompok besar penyakit yang diklasifikasikan oleh asal jaringan dan derajat progresi tumor. Dengan kemajuan teknologi baru yang dapat menampilkan profil genetik tumor, kanker kemudian dibagi ke dalam ratusan subset penyakit yang dikendalikan oleh gen. Obat-kemoterapi konvensional saat ini lebih bersifat efektif merawat satu subset penyakit inidengan menghambat produk gen yang diekspresikan pada kanker tertentu. Namun, karena gen sel kanker sangat tidak stabil serta perubahan gen terus terjadi sehinggah mengubah karakteristik baik tumor primer maupun massametastatiknya, maka hal tersebut tidak menjamin bahwa bahan kemoterapi tersebut dapat menghambat progresi penyakit. Sebaliknya, bahan kemoterapi yang secaraefektif dapat menghambat angiogenesis terlihat lebih efektif pada hampir semua tumor karena bahan tersebut bekerja pada sistem vaskularisasi dengan sel endotel yang lebih stabil.28 2.4. Tinjauan Umum Biologi Molekuler Kanker 2.4.1. Mekanisme Siklus Sel 20,22 Siklus sel adalah proses sel membelah diri secara periodik, meliputi dua tahap yaitu : Tahap Mitosis dan Interfase. Lama berlangsungnya siklus ini untuk setiap jenis sel kini sudah dapat di perhitungkan berdasarkan pengamatan. Siklus paling pendek lamanya 8 jam (pada sel epitel usus) sampai 100 hari atau lebih (pada sel hepar dewasa). Tahap interfase pada siklus sel (Gambar 5), merupakan tahap persiapan menuju pembelahan. Tahap ini dibagi atas tiga fase yaitu (1) fase Gl / Gap 1, adalah fase persiapan sel untuk melakukan replikasi DNA, pada fase ini terjadi pembentukan berbagai RNA dan protein yang berperan dan yang diperlukan dalam proses replikasi, durasi waktu fase ini bervariasi tergantung dari tipe sel. Fase G1 berlangsung sekitar 12 jam pada kebanyakan sel mamalia. Pada fase G1 ditemukan suatu faktor yang menginduksi fase G1 untuk masuk fase S yang disebut S phase Promoting Factor (SPF). Pada fase ini terjadi kegiatan biosintesis yang sangat meningkat. (2) fase S/ Sintesa, merupakan fase sintesa DNA. Permulaan replikasi DNA terjadi saat peralihan fase akhir G1 dan awal fase S. Replikasi DNA terjadi selama fase S, jumlah DNA keseluruhan akan bertambah dari diploid (2n) hingga replikasi komplit menjadi tetraploid (4n). Fase ini berlangsung selama 10-20 jam. (3) fase G2/ Gap 2, yaitu waktu antara akhir fase S sampai terjadinya mitosis atau pembelahan, sel mempersiapkan diri untuk membelah dan mempersiapkan 2 set kromosom. Akhir dari fase G2 dan awal dari fase M ditemukan suatu faktor yang menginduksi fase G2 untuk masuk ke fase M yang di sebut M phase promoting factor (MPF). Fase G2 berlangsung selama 1-12 jam. Phase terakhir dari proses proliferasi adalah fase M (mitosis) yang merupakan fase tersingkat karena hanya berlangsung selama 30-60 menit. Pada fase M terjadi pemecahan DNA yang telah berduplikasi secara komplit. Proses ini akan menghasilkan 2 sel anak kromosom diploid (2n). Sel akan mempunyai 2 pilihan pada akhir siklus sel yaitu melanjutkan siklus sel kedalam fase G1 bila sel masih aktif berproliferasi atau memasuki fase G0 bila sel tidak aktif. Fase G0 adalah fase dalam keadaan isirahat atau tidak aktif melakukan proses proliferasi. Siklus sel dimulai pada fase Gl dimana terjadi penentuan apakah sel meneruskan proses atau keluar dari siklus ( GO/ istirahat atau terminal). Adanya stimuli dari platelet derived growth factors (PDGF), epidermal growth factor (EGF), atau insulin like growth factors (IGF 1 & IGF 2) menyebabkan aktifnya siklus sel di Gl. Apabila replikasi sel telah dimulai pada akhir Gl sel tidak dapat berespon terhadap stimuli faktor pertumbuhan, tetapi berespon terhadap penghambat faktor pertumbuhan, proses ini diatur oleh cyclin dependent kinase inhibitor (CDKi). Ada dua mekanisme yang mengontrol jalannya siklus sel yaitu: Cyclins dan Checkpoints. Cyclin mengatur proses tiap fase dari siklus sel seperti Cyclin B/CDKi berfungsi mengontrol transisi dari fase G2 ke fase M, sedangkan Checkpoints bertugas mengawasi ada tidaknya penyimpangan pada DNA. Apabila mekanisme ini terganggu atau terjadi penyimpangan maka dapat menyebabkan timbulnya kanker Gambar 2.5. Skema siklus sel dan peran siklin, kinase, dependen-siklin (CDK), dan inhibitor kinase dependen-siklin (CDKI) dalam mengendalikan siklus pembelahan sel. (Robin & Cotran, 2007) 2.4.2. Biologi Sel Kanker Kanker adalah penyakit yang ditandai dengan pembelahan sel yang tidak terkendali. Sel kanker memiliki kemampuan untuk menyerang jaringan biologis lainnya, baik dengan pertumbuhan langsung di jaringan yang bersebelahan (invasi) atau dengan migrasi sel ke tempat yang jauh (metastasis). Pertumbuhan yang tidak terkendali tersebut disebabkan adanya kerusakan DNA, menyebabkan mutasi di gen vital yang mengontrol pembelahan sel. Beberapa buah mutasi dibutuhkan untuk mengubah sel normal menjadi sel kanker. Mutasi tersebut dapat diakibatkan oleh agen kimia maupun agen fisik yang disebut karsinogen. Mutasi dapat terjadi secara spontan (diperoleh) ataupun diwariskan (mutasi germline). 21 Kanker disebabkan adanya genom abnormal, terjadi karena adanya kerusakan gen yang mengatur pertumbuhan diferensiasi sel. Gen yang mengatur pertumbuhan dan diferensiasi sel disebut protooncogen dan tumor suppressor genes, dan terdapat pada semua kromosom dengan jumlah yang banyak. Protooncogen yang telah mengalami perubahan hingga dapat menimbulkan kanker disebut onkogen. 21 Suatu pertumbuhan normal diatur oleh kelompok gen, yaitu growth promoting protooncogenes, growth inhibiting cancer supresor genes (antioncogenes) dan gen yang berperan pada kematian sel terprogram (apoptosis). Selain ketiga kelompok gen tersebut, terdapat juga kelompok gen yang berperan pada DNA repair yang berpengaruh pada proliferasi sel. Ketidakmampuan dalam memperbaiki DNA yang rusak menyebabkan terjadinya mutasi pada genom dan menyebabkan terjadinya keganasan. Proses karsinogenesis merupakan suatu proses multitahapan dan terjadi baik secara fenotip dan genetik. Pada tingkat molekuler, suatu progresi merupakan hasil dari sekumpulan lesi genetik. 23 Zat perusak DNA didapat (lingkungan): • kimiawi • radiasi • virus SEL NORMAL Perbaikan DNA berhasil Kerusakan DNA Perbaikan DNA gagal Mutasi herediter pada: • Gen-gen yang memengaruhi perbaikan DNA • Gen-gen yang memengaruhi pertumbuhan atau apoptosis sel Mutasi pada genom sel somatik Pengaktifan onkogen pendorong pertumbuhan Perubahan gen yang mengendalikan pertumbuhan Penonaktifan gen supresor kanker Ekspresi produk gen yang mengalami perubahan dan hilangnya produk gen regulatorik Ekspansi klonal Mutasi tambahan (progresi) Heterogeneitas Neoplasma ganas Invasi dan metastasis Gambar 2.6. Skeme sederhana dasar molecular penyakit kanker The six hallmark of cancer ( 6 karakter sel kanker ) adalah konteks enam perubahan mendasar dalam fisiologi sel yang secara bersama-sama menentukan fenotipe keganasan. (Gambar 6) 24 (1). Growth signal autonomy: Sel normal memerlukan sinyal eksternal untuk pertumbuhan dan pembelahannya, sedang sel kanker mampu memproduksi growth factors dan growth factor receptors sendiri. Dalam proliferasinya sel kanker tidak tergantung pada sinyal pertumbuhan normal. Mutasi yang dimilikinya memungkinkan sel kanker untuk memperpendek growth factor pathways. (2). Evasion Growth inhibitory signal: Sel normal merespon sinyal penghambatan pertumbuhan untuk mencapai homeostasis. Jadi ada waktu tertentu bagi sel normal untuk proliferasi dan istirahat. Sel kanker tidak mengenal dan tidak merespon sinyal penghambatan pertumbuhan, keadaan ini banyak disebabkan adanya mutasi pada beberapa gen (protoonkogen) pada sel kanker. (3). Evasion of Apoptosis Signal: Pada sel normal kerusakan DNA akan dikurangi jumlahnya dengan mekanisme apoptosis, bila ada kerusakan DNA yang tidak bisa lagi direparasi. Sel kanker tidak memiliki kepekaan terhadap sinyal apoptosis. Kegagalan sel kanker dalam merespon sinyal apoptosis lebih disebabkan karena mutasinya gen-gen regulator apoptosis dan gen-gen sinyal apoptosis. (4). Unlimited replicative potential: Sel normal mengenal dan mampu menghentikan pembelahan selnya bila sudah mencapai jumlah tertentu dan mencapai pendewasaan. Penghitungan jumlah sel ini ditentukan oleh pemendekan telomere pada kromosom yang akan berlansung setiap ada replikasi DNA. Sel kanker memiliki mekanisme tertentu untuk tetap menjaga telomere yang panjang, hingga memungkinkan untuk tetap membelah diri. Kecacatan dalam regulasi pemendekan telomere inilah yang memungkinkan sel kanker memiliki unlimited replicative potential. Angiogenesis Unlimited replicative potential Evasion Of Apoptosis signal Invasion and metastasis Evasion Growth Inhibitory signal Growth signal anatomy Gambar 2.7. Enam tanda utama kanker (The hallmarks of cancer, Cell). Sebagian besar kanker memperoleh berbagai kemampuan ini selama perkembangannya melalui mutasi di gen tertentu (Robin & Cotran 2007) (5). Angiogenesis (formation of blood vessel): Sel normal memiliki ketergantungan terhadap pembuluh darah untuk mendapatkan suplay oksigen dan nutrient yang diperlukan untuk hidup. Namun bentuk dan karakter pembuluh darah sel normal lebih sederhana atau konstan sampai dengan sel dewasa. Sel kanker mampu menginduksi angigenesis, yaitu pertumbuhan pembuluh darah baru disekitar jaringan kanker. Pembentukan pembuluh darah itu baru diperlukan untuk survival sel kanker dan ekspansi kebagian lain dari tubuh (metastase). Kecacatan pada pengaturan keseimbangan induser angiogenik dan inhibitornya dapat mengaktifkan angiogenic switch. (6). Invasion and metastasis: Sel normal memiliki kepatuhan untuk berpindah ke lokasi lain di dalam tubuh. Perpindahan sel kanker dari lokasi primernya ke lokasi sekunder atau tertiernya merupakan faktor utama adanya kematian yang disebabkan karena kanker. Mutasi memungkinkan peningkatan aktivitas enzim-enzim yang terlibat invasi sel kanker (MMPs). Mutasi juga memungkinkan berkurangnya atau hilangnya adhesi antar sel oleh molekul-molekul adhesi sel, meningkatnya attachment, degradasi membran basal, serta migrasi sel kanker. Siklus pembelahan sel kanker berbeda dengan sel normal. Perkembangan sel kanker mempengaruhi ekspresi protein-protein pengatur siklus sel, keadaan ini dapat menyebabkan peningkatan ekspresi cyclin dan kehilangan ekspresi CDK inhibitor sehingga mengakibatkan respon yang menyimpang terhadap adanya kerusakan seluler. 2,21 Tidak semua gen menunjukkan ekspresi. Gen akan mengalami ekspresi jika menghasilkan protein. Dalam proses pertumbuhan dan diferensiasi sel ada sejumlah gen yang dihidupkan dan ada pula yang dimatikan. 21 Paparan karsinogen atau infeksi virus pada sel epitel permukan mulut, khususnya pada lidah akan menginduksi terbentuknya karsinoma. Pertumbuhan karsinoma berkaitan dengan adanya leukoplakia dan atau eritroplakia yang dikenal sebagai lesi prekeganasan.4 Leukoplakia adalah lesi prekanker yang mempunyai kecenderungan untuk bertransformasi kearah keganasan. Hiperplasia sel skuamosa yang berlanjut kepada displasia epitel telah terjadi pada leukoplakia.25 Proses proliferasi keratinosit berkesinambungan pada karsinoma sel skuamosa dapat menyebabkan perusakan jaringan ikat di bawahnya. Akibat dari perusakan jaringan ikat tersebut dapat menginvasi jaringan sekitarnya dan bermetastasis kedalam pembuluh limfe atau pembuluh darah. 25 2.4.3. Patologi Karsinona Sel Skuamosa Karsinoma sel skuamosa terjadi karena destruksi kontrol siklus sel, hilangnya kemampuan apoptosis, dan meningkatnya aktivitas invasi dan metastasis. Terbentuknya karsinoma sel skuamosa pada lidah merupakan proses bertahap karena adanya gangguan fungsi gen-gen pemacu pertumbuhan protoonkogen dan gen penghambat tumor.8 Pada karsinoma sel skuamosa terjadi peningkatan produksi protein EGF, EGFr, dan Ras (protoonkogen). Proses terpenting pada karsinogenesis karsinoma sel skuamosa terletak pada peralihan fase G1 dan S. Protein C-myc dan cyclin D yang bekerja pada masa peralihan fase G1 da S mengalami peningkatan ekspresi. 7,26 Pembelahan sel epitel rongga mulut (keratinosit) normalnya distimulasi oleh epidermoid growth factor (EGF) yang terikat dengan Epidermoid growth factor receptor (EGFr) yang kemudian akan mengaktifkan protein Ras. Pada keadaan aktif protein Ras memacu kinase cascade yaitu protei Raf, mitogen enhanced kinase (MEK), dan mitogen activated protein kinase (MAPK) sehingga menyebabkan meningkatnya C-myc dalam nukleus. Hal tersebut menyebabkan terstimulasinya transkripsi Cyclin D yang akan mengaktifkan CDK. CDK yang aktif merupakan katalisator fosforilasi Retinoblastoma Tumor Supressor Genes (pRb). Fosforilasi dari pRb akan melepaskan faktor-kaktor transkripsi E2F yang dibutuhkan untuk transkripsi protein-protein untuk replikasi DNA. Selanjutnya replikasi DNA akan diikuti oleh pembelahan sel. Disregulasi pembelahan sel keratinosit epitel rongga mulut, khususnya pada lidah dapat menyebabkan terbentuknya karsinoma sel skuamosa (Gambar 7). 25 EGF EGFr Membran sel RAS Raf MEK C-myc DNA Damage Cyclin D MAPK CDK p53 pRb-E2F Bax pRb P p21 E2F Nucleus Transcription of DNA Replikasi protein e.g. PCNA Blocks bcl-2 Caspace 3 DNA Replikasi Cell division Apoptosis Gambar 2.8. Mekanisme pembelahan sel keratinosit mukosa mulut. (Sugerman dan Savage, 1999) 2.4.4. Karsinogen Karsinogen merupakan zat atau bahan yang dapat memicu terjadinya kanker atau keganasan. Karsinogen dapat mempengaruhi DNA atau suatu protein yang berperan pada pengaturan siklus pembelahan sel, seperti protoonkogen atau gen penghambat tumor. Bahan yang dapat menimbulkan kanker pertama kali diketahui tahun 1775 oleh Dr. Percival Pott, seorang ahli bedah dari Inggris. Ada beberapa macam agen karsinogenik (karsinogen), yaitu : (1) karsinogen kimiawi, (2) energi radiasi, (3) mikroba (virus). Zat kimia dan radiasi energi sudah terbukti merupakan penyebab kanker pada manusia, dan virus onkogenik berperan pada patogenesis tumor beberapa model hewan dan paling sedikit beberapa tumor manusia. 19,21 Sebagian besar transformasi gen oleh karena karsinogen, terutama karsinogen kimiawi. Karsinogen kimiawi masuk ke dalam tubuh melalui: 1) Kontak langsung melalui kulit 2) Inhalasi udara 3) Makanan dan minuman Direct acting carcinogen umumnya tidak stabil, cepat rusak daya kerjanya sehingga tidak banyak peranannya dalam karsinogenesis. Sebaliknya pro-carsinogen besar sekali peranannya. Pro-carsinogen merupakan proximate carsinogen yang tidak aktif. Di dalam tubuh akan mengalami metabolisme menjadi ultimate carsinogen yang sangat reaktif. Ultimate carsinogen masuk ke dalam inti sel bereaksi dengan DNA, membentuk senyawa kompleks DNA-karsinogen yang dapat mengubah atau merusak transkripsi dan atau translasi genetik dalam gen. 21 2.4.5. Karsinogenesis Kanker terjadi karena adanya kerusakan atau transformasi protoonkogen dan gen penghambat tumor sehingga terjadi perubahan dalam cetakan protein dari yang telah diprogramkan semula yang mengakibatkan timbulnya sel kanker. Karena itu terjadi kekeliruan transkripsi dan translasi gen sehingga terbentuk protein abnormal yang terlepas dari kendali normal pengaturan dan koordinasi pertumbuhan dan diferensiasi sel. Pengaturan sifat individu dilakukan oleh gen (DNA) dengan pembentukan protein melalui proses transkripsi dan translasi. 26 Karsinogenesis merupakan suatu proses multi tahap. Dengan 3 tahapan:27 1. Inisiasi (Initiation) Tahap pertama ialah permulaan atau inisiasi, dimana sel normal berubah menjadi premaligna. Karsinogen harus merupakan mutagen yaitu zat yang dapat menimbulkan mutasi gen. Pada tahap inisiasi karsinogen bereaksi dengan DNA, menyebabkan amplifikasi gen dan produksi copy multipel gen. 2. Promosi (Promotion) Promoter adalah zat non mutagen tetapi dapat meningkatkan reaksi karsinogen dan tidak menimbulkan amplifikasi gen. Sifat-sifat promotor ialah: mengikuti kerja inisiator, perlu paparan berkali-kali, keadaan dapat reversible, dapat mengubah ekspresi gen seperti: hiperplasia, induksi enzim, induksi diferensiasi. 3. Progresi (Progression) Pada progresi ini terjadi aktivasi, mutasi atau hilangnya gen. Pada progresi ini timbul perubahan benigna menjadi pre-maligna dan maligna. Dalam karsinogenesis ada 3 mekanisme yang terlibat: 27 a) Onkogen yang dapat menginduksi timbulnya kanker. b) Antionkogen atau gen suppressor yang dapat mencegah timbulnya kanker. c) Gen modulator yang dapat mempengaruhi eksperimen karakteristik gen yang mempengaruhi penyebaran kanker. Bila ada kerusakan gen, tubuh berusaha mereparasi atau memperbaiki transkripsi gen yang rusak (DNA repair). Kerusakan transkripsi ini mungkin dapat dan mungkin pula tidak dapat diperbaiki lagi. Bila transkripsi gen itu dapat diperbaiki dengan sempurna, maka pada replikasi sel berikutnya terbentuklah sel baru yang normal. Tetapi bila tidak dapat diperbaiki dengan sempurna akan terbentuk sel baru yang defektif. Walaupun sel itu defektif masih tetap ada usaha mereparasi kerusakan transkripsi. Bila berhasil akan terbentuk sel yang normal dan bila gagal akan terbentuk sel yang abnormal, yaitu sel yang mengalami mutasi, atau transformasi, yang pada akhirnya dapat menjadi sel kanker. 27 Teori karsinogenesis untuk menerangkan bagaimana kanker itu terjadi didasarkan atas: 27 1) Mutasi Somatik, yaitu perubahan urutan letak nukleotida dalam asam amino rantai DNA, yang menyebabkan perubahan kode genetik. Menghasilkan produksi protein yang abnormal, sehingga regulasi pertumbuhan dan diferensiasi sel terganggu, sel menjadi otonom dan lepas dari regulasi normal dan sel dapat tumbuh tanpa batas. 2) Penyimpangan Diferensiasi Sel (Teori Epigenetik), terjadinya gangguan sistem atau mekanisme regulasi gen seperti represif, depresi serta ekspresi regulasi, sehingga timbul gangguan pertumbuhan dan diferensiasi sel. Defek yang terjadi karena mekanisme regulasi gen yang mengatur pertumbuhan, dan bukan pada struktur gen itu sendiri, maka teori ini disebut teori epigenetik. 3) Aktivasi Virus. Virus masuk ke dalam inti sel dan berintegrasi dengan DNA penderita serta mengubah fenotype sel dengan menyisipkan (insersi) informasi baru atau mengubah transkripsi dan translasi gen. Virus DNA dapat secara langsung berintegrasi dengan DNA inang dan ditularkan secara vertikal kepada anak-anak sel inang, sedang virus RNA dengan bantuan enzim reverse transkriptase. Menurut teori ini kanker terjadi karena ada infeksi virus yang menyisipkan gennya ke dalam DNA inang yang dapat mengaktifkan protoonkogen menjadi onkogen. 4) Seleksi Sel. Pada sel tubuh manusia diperkirakan terdapat lebih dari 50.000 gen dan masingmasing gen mempunyai fungsi tersendiri. Di dalam tubuh setiap saat ada sel yang mati dan ada pula sel baru yang terbentuk melalui proses mitosis. Karena adanya mutasi maka timbul sel yang defektif dan akan mati atau tidak dapat mengadakan mitosis lebih lanjut. Hanya sel-sel yang baik dan memenuhi syarat tertentu yang akan dapat tetap bertahan hidup. Dalam menyeleksi sel mana yang boleh terus hidup dan berkembang, terjadi kekeliruan. Di sini ada sel yang mengalami mutasi atau transformasi yang lepas dari seleksi dan terus berkembang menjadi sel kanker. Keganasan pada sel eukariota terjadi akibat adanya perubahan perilaku sel yang abnormal, yaitu sel mempunyai kemampuan proliferasi dan diferensiasi yang sangat tinggi. Perubahan perilaku tersebut terjadi karena sel mengekspresikan berbagai protein yang abnormal. Berbagai protein abnormal muncul karena sel mengalami mutasi/kecacatan gen, khususnya gen yang mengkode protein, yang sangat berperan pada pengaturan siklus pembelahan sel. Contohnya adalah gen yang termasuk kelompok protooncogen atau kelompok tumor suppressorgene, serta gen yang mengatur dan menghambat pemendekan telomer pada ujung kromosom. 28 2.4.5.1. Protoonkogen Beberapa gen dikelompokkan sebagai protooncogen. Jika protooncogen mengalami mutasi, maka gen tersebut dikenal sebagai onkogen. Protein yang dikode oleh gen tersebut akan bersifat overaktif. Contoh onkogen adalah gen erb-B atau erb-B2 merupakan gen yang mengkode suatu protein, yang mempunyai peranan spesifik dalam pembentukan reseptor dari faktor pertumbuhan dipermukaan sel. Onkogen yang lain adalah Gen ras, adalah suatu gen yang mengkode protein ras, protein ini merupakan salah satu protein pada membran sel yang berperan sebagai hantaran sinyal untuk memicu pembelahan sel. Famili protein ras adalah protein Rac. Protein ini dalam keadaan inaktif dalam bentuk ikatan “ras-GDP” (ras-Guanin Di Fosfat), sedangkan dalam keadaan aktif dalam bentuk ikatan “ras-GTP” (ras-Guanin Tri Fosfat) (Gambar 8). Pengaturan keseimbangan antara “ras-GDP” dan “ras-GTP” dipengaruhi oleh suatu protein, yaitu ras exchange factor dan GTP-ase activating protein. Ras exchange factor mengubah rasGDP menjadi ras-GTP, sedangkan GTP-ase activating protein mengubah “ras-GTP” menjadi “ras-GDP”. Tanpa adanya suatu rangsang, protrein ras tetap dalam keadaan tidak aktif. Protein ras akan berubah menjadi matang bila mengalami reaksi biokimia pada prekursor protein ras oleh suatu ensim farnesil transferase, sehingga menjadi aktif (matang). Setelah matang, protein ras aakan berinteraksi dengan protein pada membran sel. Selanjutnya, dengan adanya ikatan tersebut akan memberikan informasi untuk merangsang pembelahan sel. Pada keadaan protein ras yang abnormal sebagai akibat adanya mutasi dari gen ras maka protein ras akan bersifat overaktif, yaitu selalu pada posisi “ON”. Pada kondisi ini, selain menekan aktivitas GTP-ase sehingga posisi protein ras selalu dalam keadaan ”ON”, juga akan memberikan informasi kepada sel untuk melakukan pembelahan secara terus menerus walaupun tidak diperlukan, sehingga terus melakukan sintesis protein dan DNA, yang selanjutnya akan berkembang menjadi penyakit keganasan.28 2.4.5.2. Tumor Supressor Gene Pada sel ditemukan suatu protein yang berperan sebagai faktor pengendalian pertumbuhan sel, yang disebut sebagai tumor supressor protein. Yang termasuk kelompok dari protein tersebut adalah protein retinoblastoma (p-Rb) yang dikode oleh gen p-Rb (pRb) dan protein 53 (p-53) yang dikode oleh gen p-53 (p53). Protein p-Rb dan p-53 dapat bekerja di dalam inti sel, khususnya pada proses pengendalian siklus pembelahan sel. P-Rb berperan pada pengendalian faktor transkripsi pada siklus pembelahan sel, sedangkan p-53 berperan pada pengendalian CDK pada siklus pembelahan sel. Selain itu p-53 juga mempunyai peran dalam pengaturan kematian sel (apoptosis) yaitu merusak sel yang memiliki urutan nukleotida yang abnormal.28 Secara fisiologis pada sel ada suatu sistem yang mengatur susunan nukleotida pada rantai DNA yang mengalami perubahan (mutasi). Sistem tersebut dikenal sebagai DNA repair. Kerja dari sistem ini adalah dengan memperbaiki urutan DNA yang mengalami mutasi. Artinya apabila terjadi kerusakan susunan DNA baik disebabkan oleh suatu karsinogen atau ultraviolet, maka akan muncul suatu respon sel yang disebut sebagai NER (Nucleotide Excision Repair). Secara konseptual target kerja dari NER ini dibagi dalam lima fase, yaitu: (a) damage recognition; (b) incision; (c) excision; (d) synthesis repair; dan (e) ligation. Oleh karena itu secara normal sel yang hanya dapat melakukan proliferasi dan diferensiasi adalah sel yang DNA-nya memiliki susunan nukleotida yang tidak menyimpang. Apabila perbaiakan DNA kurang sempurna, maka akan dilakukan penghentian pertumbuhan sel melalui penghambatan siklus pembelahan sel, dan selanjutnya terjadi apoptosis. Selain p-21 yang ekspresinya dikendalikan oleh p-53, yang bekerja dengan menghambat semua CDK, juga ditemukan beberapa protein yang berperan pada siklus pembelahan sel, seperti p-15 dan p-16. Namun pengaturan ekspresi dari protein p-15 dan p-16 sampai saat ini belum jelas. Akan tetapi target kerja dari kedua protein tersebut telah diketahui dengan jelas, yaitu menghambat CDK-4 dan CDK-6 pada fase G-1. Kinase yang bekerja memicu aktivitas p-53 untuk memodulasi protein BAX pada proses apoptosis, antara lain CPK-2 (Cystein Protein Kinase-2) dan PKC. Pada kanker terjadi overekspresi oncogene seperti BCL-2 dan BCL-XL yang berperan sebagai antiapoptosis, yaitu melalui penghambatan pembukaan Pt-pore pada membran mitokondria, sehingga sel menjadi immortal. Pemahaman mengenai pengendalian siklus pembelahan sel merupakan hal yang sangat penting dalam memecahkan penyakit keganasan karena pada penyakit keganasan terjadi kegagalan dalam pengendalian siklus pembelahan sel, di mana sel mengalami pembelahan yang sangat cepat dan terus-menerus. Protein yang berperan pada pengendalian siklus pembelahan sel ini adalah tumor supressorgene (antara lain p-53, p-21, BAX) dan protooncogene (antara lain BCL-2). Peran p-53 pada pengaturan siklus pembelahan sel adalah untuk menghambat pembelahan sel, di mana p-53 akan memicu proses transkripsi dari p-21. Dengan meningkatnya p21, p-53 kemudian menghambat semua CDK (CDK-4 dan CDK-6 pada fase G-1, CDK-2 pada fase S, dan CDK-1 pada fase M). Oleh karena itu bila CDK tidak berfungsi, siklin tidak membentuk kompleks dengan CDK dan hal ini dapat mengakibatkan siklus sel berhenti. Untuk memicu kembali siklus pembelahan sel, maka yang berperan adalah protein MDM-2, di mana protein ini bekerja untuk menekan aktivitas p-53. Rendahnya aktivitas p-53 mengakibatkan terjadi penurunan p-21. Selanjutnya kadar p-21 yang rendah mengakibatkan CDK tidak mengalami penghambatan, sehingga siklin akan membentuk kompleks dengan CDK. Ikatan kompleks antara CDK-siklin mengakibatkan siklus sel akan terus berlanjut. Bila terjadi mutasi (MT) dari gen p-53 atau BCL-2, maka p-53 mutan yang dihasilkan bersifat inaktif, sehingga protein ini tidak mampu memicu pembentukan p-21. Rendahnya kadar p-21 mengakibatkan CDK tidak dihambat dan akhirnya siklus pembelahan sel berjalan terus. Di sisi lain p-53 tidak mampu memicu aktivitas protein BAX, sehingga Pt-pore pada membran mitokondria tidak mampu membuka dan akhirnya sel tidak bisa diapoptosis. Demikian juga halnya bila terjadi mutasi pada gen BCL-2, maka protein BCL-2 yang dikode akan bersifat overaktif. Hal ini mengakibatkan terjadi penekanan terhadap protein BAX. Penekanan ini mengakibatkan Pt-pore semakin sulit mengalami pembukaan dan akhirnya sel menjadi immortal. Jadi hanya dengan adanya dua macam gen saja yang mengalami mutasi seperti gen p-52 dan gen BCL-2, sel sudah mampu melakukan pembelahan secara terus-menerus dan bersifat immortal. Kondisi inilah yang mengakibatkan terjadinya massa sel yang membentuk tumor atau penyakit keganasan. Untuk menanggulangi terjadi perubahan perilaku sel, maka sel sudah memiliki seperangkat mekanisme untuk mencegah terjadinya penyakit keganasan. Mekanisme tersebut dapat melalui aktivasi NER. Apabila mekanisme ini tidak berhasil, maka sel akan melakukan bunuh diri melalui mekanisme apoptosis yang diperankan oleh p-53 yang selain bekerja untuk menekan aktivitas CDK juga memicu peningkatan aktivitas protein BAX. Protein BAX-lah yang menekan aktivitas BCL-2 pada membran mitokondria, sehingga terjadi penurunan fungsi BCL-2 yang mengakibatkan perubahan permeabilitas membran dari mitokondria. Kondisi ini dapat mengakibatkan terjadi pelepasan cytochrome-C ke sitosol. Cytochrome-C kemudian mengaktifkan Apaf-1. Selanjutnya Apaf-1 yang aktif mengaktivasi kaspase kaskade dan terjadilah kematian sel (apoptosis). Jika mekanisme ini tidak mampu dilakukan oleh sel maka yang memegang peranan penting untuk mengeliminasi sel yang bersangkutan adalah sel imunokompeten. Jika sel imunokompeten juga mengalami kegagalan atau tidak mampu mengeliminasi sel abnormal tersebut, maka sel abnormal ini akan membentuk klon baru yang kemudian dapat berkembang menjadi keganasan (malignant). 2.5. Invasi Sel Kanker Pada mekanisme terjadinya kanker akan melalui empat fase yakni, fase induksi, fase in situ , fase invasi, serta fase disseminasi. Pada fase invasi sel-sel telah menjadi ganas, berkembang dengan cepat dan menginfiltrasi melewati membran sel kejaringan sekitarnya dan pembuluhpembuluh darah serta pembuluh limfe. Dari percobaan binatang diketahui ada beberapa faktor yang mempengaruhi proses invasi sel-sel tumor ganas tersebut yakni: 27 - Penambahan tekanan di dalam tumor akibat pembelahan sel-sel yang aktif, - Bertambahnya gerakan amoeboid, dari sel-sel tersebut, .- Berkurangnya daya kohesi antar sel, mungkin ada hubungan dengan berkurangnya ion Kalsium atau perubahan muatan listrik dari membran sel, - Meluasnya bahan-bahan yang lysis oleh karena sel-sel kanker tersebut, - Hilangnya jembatan interseluler yang biasa ditemukan dalam sel-sel normal. Invasi sel-sel kanker tersebut sementara dapat ditahan oleh jenis-jenis jaringan tertentu, misalnya fascia, tulang rawan, arteri dan sistem syaraf, dan kadang-kadang ia mengikuti jalannya pembuluh syaraf tersebut tanpa menginfiltrasinya. Serangkaian jaringan pada setiap organisme mamalia dipisahkan satu sama lain oleh dua jenis matriks ekstraseluler: membran basal dan jaringan ikat interstisium. Matriks ini menentukan bentuk arsitektur jaringan, memiliki fungsi biologis yang penting, dan berperan sebagai pelindung mekanis terhadap invasi. Selama transisi dari karsinoma in situ menjadi karsinoma invasif, sel tumor mempenetrasi membran basal epitelial dan masuk ke jaringan ikat iterstisium. Setelah sel tumor masuk ke dalam stroma, dapat mengakses limfatik dan pembuluh darah untuk melakukan diseminasi lebih lanjut. Sel tumor harus melewati membran basal apabila akan menginvasi sebagian besar organ parenchyma. Selama intravasasi atau ekstravasasi, sel tumor yang memiliki asal histologis dari manapun harus mempenetrasi membran basal endotelial. Koloni metastastasis pada organ yang jauh, dengan sel tumor yang telah diekstravasasi harus bermigrasi melalui jaringan ikat pembuluh darah agar koloni tumor dapat tumbuh di organ parenchym. Oleh karena itu, interaksi sel tumor dengan matriks ekstraseluler terjadi pada berbagai tahap pada tahapan metastasis. 27,29 Proses invasi dan metastasis merupakan tanda biologis dari keganasan dan merupakan penyebab utama kanker yang berhubungan dengan morbiditas dan mortalitas, oleh karena itu lesi kanker ini harus diperiksa dengan teliti. Sel-sel kanker yang terlepas dari masa primer, akan masuk ke dalam pembuluh darah dan limfatik, menyebabkan pertumbuhan sel-sel kanker sekunder di tempat yang jauh melewati berbagai tahap. Setiap tahap dari rangkaian ini mempunyai pengaruh yang besar, oleh karenanya dari setiap langkah pada rangkaian pemecahan sel tidak dapat dihindari (Gambar 9).27,29 Struktur dan fungsi dari jaringan normal ditentukan oleh interaksi antara sel dan matriks ektraseluler. Jaringan dibagi menjadi bagian kecil yang terpisah satu dari lainnya, oleh dua tipe matriks ektraseluler yaitu membran basal dan jaringan ikat interstisium. Masing-masing komponen matriks ektraseluler dibentuk dari kolagen, glikoprotein, dan proteoglikan. Sel-sel tumor harus berinteraksi dengan matriks ektraseluler pada beberapa tahap metastasis. Tahap pertama sebuah karsinoma harus dapat menembus membran basal epithelial dibawahnya kemudian berjalan melewati jaringan ikat intersitium stroma, dan akhirnya mencapai akses sirkulasi melalui penetrasi membran basal vaskular. Siklus ini diulang ketika emboli sel tumor dikeluarkan pada tempat yang jauh. 21,27 Membrana basalis merupakan membran tipis, resilien terdiri dari anyaman padat seratserat kolagen tipe IV, glikoprotein (laminin, fibronektin, proteoglikan) dan faktor-faktor pertumbuhan (Gambar 10). Sel-sel kanker terlepas satu dengan yang lain karena berkurangnya adhesifitas, dan sel kanker akan terlepas ke membran basal melalui reseptor laminin dan sekresi enzim proteolitik, termasuk kolagenase tipe IV dan aktivator plasminogen. degradasi membran basal dan diikuti dengan migrasi dari sel-sel kanker. 21,27 Sel-sel normal melekat satu sama lain dan dikelilingi oleh berbagai integrin adhesif. Adhesi sel yang diperantarai oleh integrins, chaderins dan molekul sel berfungsi untuk menjaga integritas jaringan, hilangnya adhesi atau berubahnya protein permukaan sel berhubungan dengan meningkatnya potensi invasi dan metastasis. Epite l Integrin Membrana Basalis Lamini n Kapiler Proteoglikan Kolagen tipe IV Matriks Interstisial Gambar 2.11. Struktur histologi yang membentuk membran basal (Kumar, 2007) Polaritas dan struktur sel selama penyebaran dan migrasi diatur oleh interaksi sel dengan protein matriks ekstraseluler melalui transmembran glikoprotein cadherins.13,22 E-Cadherin merupakan transmembran glicoproteins yang mengatur interaksi sel calcium-dependent ekstraseluler. E (epithelial} chaderin berperan dalam komunikasi antar sel epithelial, ditemukan pada membran basal. E-cadherin berfungsi sebagai adhesifitas antar sel, hilangnya ekspresi gen ini berhubungan dengan meningkatnya daya invasi dan metastasis. Pada beberapa tumor epitelial, termasuk adenokarsinoma kolon (WNT) dan payudara, terdapat penurunan regulasi dari Ecadherin, yang mengurangi kemampuan sel untuk melekat satu sama lain dan menfasilitasi pelepasan tumor primer (Gambar..). E-cadherin berhubungan dengan sitoskeleton melalui katenin, yaitu protein yang terdapat di bawah membran plasma. Fungsi normal dari E-cadherin tergantung pada kaitannya dengan katenin. Pada beberapa tumor, E-cadherin normal namun ekspresinya berkurang disebabkan mutasi yang terjadi pada gen. 13,21 Gambar 2.12. Peran E-Cadherin dalam komunikasi antar sel epithelial pada membrana basalis. Berfungsi sebagai adhesifitas antar sel, hilangnya ekspresi gen ini berhubungan dengan meningkatnya daya invasi dan metastasis (Robin&Cotran, 2007). Sel-sel epitelial tumor dipisahkan dari stroma dasar membran. Maka, sel-sel tumor yang berpenetrasi ke dasar membran tersebut harus dihancurkan dan diremodeling. Komponen dasar membran mengirimkan sinyal positif dan negatif ke sel tumor dan berperan penting dalam regulasi angiogenesis. Sel epitelial normal mempunyai reseptor dengan afinitas tinggi seperti anggota dari integrin dan protein imunoglobulin pada dasar membran, yang terletak di permukaan basal. Sebaliknya, beberapa sel karsinoma memiliki reseptor lebih banyak, yang terdistribusi mengelilingi membran sel. Terlihat adanya hubungan antara densitas reseptor laminin dan invasi pada kanker payudara dan kolon. Sel tumor, seperti sel normal memperlihatkan integrin yang berfungsi sebagai reseptor untuk komponen matriks ekstraseluler, seperti fibronektin, laminin, kolagen, dan fibronektin. Setelah mengalami perlekatan dengan komponen membran basal atau intersitial matriks ekstracelluler, sel tumor harus membuat jalan untuk migrasi. Invasi matriks ekstraseluler tidak selalu dengan tekanan pertumbuhan pasif tetapi memerlukan degradasi enzim aktif pada komponen matriks ekstraseluler. 21,27 Sel tumor mensekresikan enzim proteolitik atau merangsang sel inang seperti fibroblas stroma dan makrofag yang berinfiltrasi untuk membuat kompleks protease. Aktivitas protease ini diregulasi secara ketat oleh antiprotease. Pada tepi yang diinvasi tumor, keseimbangan antara protease dan antiprotease terganggu, sehingga protease lebih banyak dibentuk. 21,27 2.5.1. Invasi Klinis Sel Kanker Penyebab utama terjadinya kegagalan perawatan pada pasien kanker lebih disebabkan oleh adanya invasi dan metastasis. Sekitar 30% pasien yang baru didiagnosa menderita tumor solid sudah memiliki metastasis yang dapat dideteksi secara klinis. Dari 70% pasien kanker, sekitar 35% dapat dirawat dengan menggunakan terapi tumor lokal saja. Sisanya (35%) memiliki mikrometastasis tersembunyi yang pada akhirnya akan bermanifestasi. Dengan demikian, sekitar 60% pasien memiliki metastasis yang mikroskopis ataupun yang terlihat secara klinis pada saat mereka menjalani perawatan tumor primer. Pembentukan koloni metastasis merupakan proses yang berlangsung terus menerus yang dimulai sejak awal pertumbuhan tumor primer dan terus meningkat seiring dengan berjalannya waktu. Beberapa metastasis besar yang ada di organ tertentu seringkali disertai oleh adanya mikrometastasis dalam jumlah yang lebih banyak. Metastasis bervariasi dalam ukuran dan usia, penyebaran lokasi, dan komposisinya yang heterogen tidak memungkinkan kita untuk menghilangkannya melalui operasi dan juga membatasi keefektifan konsentrasi obat anti kanker yang bisa diberikan pada koloni metastasis. 29 Tumor yang memiliki ukuran hampir sama bisa memiliki potensi metastasis yang sangat berbeda tergantung dari tipe histologi dan tingkat keagresifannya. Pada umumnya kebanyakan tumor epitelial, penyebaran sel tumor terjadi segera setelah vaskularisasi tumor primer. Berdasarkan perhitungan diketahui bahwa kebanyakan metastasis dari karsinoma payudara dimulai pada saat tumor primernya berukuran kurang dari 0,125 cm3, dan hal tersebut sejalan dengan yang ditemukan pada berbagai studi percobaan. Kesulitan utama yang dihadapi adalah rumitnya interaksi tumor inang, yang terdiri dari mekanisme immunologi dan angiogenesis. Untuk menghadapi masalah ini, para ahli memisahkan invasi dan metastasis menjadi sekumpulan langkah sekuensial. Metastasis disebabkan oleh sekumpulan proses selular yang terkoordinasi, dan bukan oleh satu gen saja. 29 Proliferasi yang tidak terkontrol dapat diakibatkan oleh peningkatan faktor pertumbuhan atau aktivasi oncogene dan hilangnya inhibitor pertumbuhan serta penghambat onkogen seperti p53 atau RB. Perkembangan selanjutnya, menjadi phenotype invasif melibatkan augmentasi produk gen yang memfasilitasi invasi atau hilangnya protein yang menghambat invasi. 29 2.5.2. Invasi Matriks Ekstrasel Invasi sel pada matriks ekstraseluler merupakan suatu proses aktif yang diselesaikan dalam empat langkah (Gambar 12). Langkah pertama adalah merenggang dan kemudian terlepasnya satu sel kanker dengan sel kanker lainnya karena berkurangnya adhesivitas antar sel yang fungsinya dilakukan oleh E-kaderin. E-kaderin bekerja sebagai lem antar sel. Molekul EKaderin yang berdekatan mempertahankan agar sel tetap menyatu, sedangkan perlekatan homotipik yang diperantarai oleh E-kaderin menyalurkan sinyal anti pertumbuhan melalui ßkatenin. Bagian E-kaderin yang berada disitoplasma berikatan dengan ß-katenin. ß-Katenin bebas dapat mengaktifkan transkripsi gen yang mendorong pertumbuhan. Langkah kedua, melekatnya sel tumor ke berbagai protein matriks ekstraseluler, seperti laminin dan fibronektin yang penting untuk invasi dan metastasis. Sel epitel normal memiliki reseptor untuk laminin membran basal yang terpolarisasi di permukaan basalnya. Sebaliknya pada sel karsinoma memiliki lebih banyak reseptor yang tersebar diseluruh permukaan membran sel. Perubahan pola integrin juga mendorong terjadinya invasi sel karsinoma. Pada banyak sel karsinoma, perlekatan ke stroma dipermudah oleh hilangnya integrin yang berikatan dengan matriks ekstraseluler normal dan digantikannya integrin tersebut oleh integrin yang berikatan dengan matriks ekstraseluler yang telah diuraikan oleh protease. Langkah ketiga dalam invasi adalah degradasi lokal membran basal dan jaringan ikat interstisium. Sel tumor itu sendiri mengeluarkan enzim proteolitik atau menginduksi sel pejamu untuk mengeluarkan protease. Beberapa enzim yang mendegradasi matriks ekstraseluler seperti metalloproteinase, termasuk gelatinase, kolagenase, dan stromelisin ikut berperan. Kolagenase tipe IV adalah gelatinase yang memecah kolagen tipe IV epitel dan membran basal vaskular. Langkah terakhir pada invasi adalah proses migrasi. Sel tumor berjalan menembus membran basal yang telah rusak oleh proses degradasi enzim proteolitik dan lisis. Migrasi diperantarai oleh berbagai sitokin yang berasal dari sel tumor, seperti faktor motilitis autokrin. Disamping itu produk penguraian komponen matriks (kolagen, laminin) dan sebagian faktor pertumbuhan (insulin-like growth factor I dan II) memiliki aktivitas kemotaktik untuk sel tumor. 21, Gambar 2.13. Ilustrasi skematik (Robbins&Cotran, 2005) invasi sel kanker pada membran basalis epitel Proliferasi Sel normal tumbuh secara seimbang dengan pengendalian antara sinyal pertumbuhan dan sinyal yang menimbulkan kematian. Secara umum jumlah sel yang ada pada suatu jaringan merupakan fungsi kumulatif antara masuknya sel baru dan keluarnya sel yang ada pada populasi. Masuknya sel baru ditentukan oleh kecepatan proliferasinya, sedangkan yang keluar karena kematian sel atau berdiferensiasi menjadi jenis sel lain. Oleh karena itu, meningkatnya jumlah sel dapat dikarenakan peningkatan proliferasi atau karena penurunan kematian atau diferensiasi sel. 35 Gambar 2.10. Pertumbuhan dapat diregulasi dengan perubahan proliferasi, diferensiasi dan kematian sel. 35 Sebagian besar sel normal yang terdapat dalam tubuh sudah mengalami diferensiasi yang berarti sel-sel tersebut telah mengalami berbagai perubahan demikian rupa sehingga menunjukkan morfologi dan fungsi spesifik. Selama proses diferensiasi, sel normal umumnya tidak memiliki kemampuan untuk berproliferasi, tetapi di lain fihak banyak sel-sel jaringan tubuh mengalami proses renewal untuk mengganti sel-sel yang hilang karena rusak atau menua, dengan sel-sel prekursor baru (stem-cells), yang kemudian diikuti oleh proliferasi sel sel keturunannya, diduga bahwa sebagian besar sel kanker berasal dari sel-sel progenitor Kehilangan kemampuan berdiferensiasi menyebabkan maturation arrest yang berakhir dengan peningkatan proliferasi sel dan perkembangan tumor.35 Gambar 2.11 Produksi sel normal dan proliferasi tidak terkontrol. (A) Jalur normal untuk memproduksi sel yang berdiferensiasi. (B) Stem-cell gagal memproduksi sel anak non stem-cell pada setiap pembelahan kemudian berproliferasi membentuk tumor. (C) Sel anak gagal berdiferensiasi dan berproliferasi membentuk tumor. 35 Proliferasi sel dapat dirangsang oleh faktor pertumbuhan intrinsik, jejas, kematian sel, atau bahkan oleh deformasi mekanisme jaringan. 35 Pusat proses kompleks proliferasi sel ialah pengendalian terhadap proses yang melibatkan siklus sel. Siklus sel melibatkan sejumlah kejadian yang menghasilkan duplikasi dan pembelahan sel. Dalam sel normal proses tersebut sangat terkontrol, namun pada sel tumor adanya mutasi pada gen yang berhubungan dengan siklus sel akan menghasilkan bertambahnya sel dengan kerusakan DNA pada siklus sel. 37 Gambar 2.12 Proliferasi sel yang berlebihan.35 Angiogenesis Angiogenesis adalah pertumbuhan pembuluh darah baru dari pembuluh darah yang sudah ada dan merupakan bagian integral dari proses perkembangan normal ( perkembangan embrio dan siklus menstruasi) serta sejumlah keadaan patologis termasuk tumorigenesis.69;70;18 Merupakan proses multi-step kompleks yang diperantarai oleh sel endotel yang melapisi pembuluh darah. 28 Proses angiogenesis terdiri dari tahapan degradasi membran basal oleh protease, migrasi sel endotel ke dalam rongga interstisial, proliferasi serta migrasi sel endotel menuju stimulus angiogenik, dan pembentukan lumen.71 Dua perbedaan utama antara angiogenesis normal dan patologis, adalah pertama, pada jaringan patologis, mekanisme pengaturan yang turn off neovaskularisasi pada jaringan sehat tidak berfungsi secara normal. Perbedaan kedua adalah pembuluh darah yang terbentuk pada jaringan patologis sangat tidak terorganisasi dengan banyaknya lubang pada dinding-dindingnya. Hal tersebut terjadi karena pembuluh darah tumor tidak dapat matang melalui rekruitmen sel otot polos dan perisit, sehingga terjadi banyak kebocoran pada pembuluh.28,72 Pembentukan pembuluh darah baru tergantung pada keseimbangan faktor angiogenik dan inhibitor angiogenik. Faktor angiogenik meliputi vascular endothelial growth factor (VEGF), acidic fibroblast growth factor. Basic fibrolast growth factor (bFGF), angiogenin, placenta growth factor (PGF), transforming growth factor α (TGF-α), hepatocyte growth factor, dan aktivator plasminogen. Faktor angigenik lain yang hanya terdapat dalam angiogenesis tumor adalah IL-8. Inhibitor angiogenik meliputi adalah IL-12, interferon α dan β, trombospondin, fragmen prolaktin, tissue inhibitor of metalloproteinases, dan platelet factor-4. Tumor necrosis factor α dapat berfungsi sebagai faktor angiogenik pada satu sistem dan sebagai faktor antiangiogenik di sistem lainnya.74 1. Vascular Endothelial GrowthFactor (VEGF) Faktor pertumbuhan yang menstimulasi angiogenesis dapat dibagi menjadi molekul angiogenik langsung dan tidak langsung. VEGF termasuk ke dalam molekul angiogenik langsung.75 VEGF disebut juga vascular permeability factor (VPF) merupakan faktor proangiogenik paling penting dan paling banyak diekspresikan pada berbagai tipe tumor, baik sel tumor jinak maupun ganas,71,76 VEGF berasal dari famili faktor pertumbuhan secara khusus ditargetkan sel endotel untuk meningkatkan permeabilitas sel endotel melalui kaskade transduksi sinyal mitogen-activated protein kinase (MAPk) dengan melonggarkan sambungan antara sel endotel dalam kompleks cadherin.77 VEGF berperan penting dalam vaskulogenesis selama embriogenesis, angiogenesis fisiologis, dan neovaskularisasi malginansi. Transkiripsi VEGF dipicu oleh hipoksia dan berbagai sinyal pertumbuhan. Sel endotel yang distimulasi oleh VEGF bermigrasi dan berproliferasi, menyebabkan peningkatan permeabilitas vaskuler, merangsang MMPs, membelah dan merekrut elemen pendukung, seperti perisit.75 Efek VEGF ditransduksikan melalui dua reseptor tirosin kinase, VEGFR1 dan VEGFR2. Efek tersebut dimodulasi oleh neuropilin-1 (NRP-1) dan neuropilin-2 (NRP-2) yang bertindak sebagai co-reseptor pada VEGFR. VEGFR1 inaktif dalam sel endotel yang menujukkan bahwa VEGFR2 merupakan tranduser utama pensinyalan VEGF selama angiogenesis fisiologis. Angiogenesis tumor tergantung baik pada VEGFR1 maupun VEGFR2 sehingga upaya mengahambat angiogenesis tumor ini lebih poten jika dilakukan dengan blokade kedua reseptor.78 Fungsi VEGF pada sel endotel meliputi hai-hal sebagai berikut:79 1) Permeabilitas VEGF adalah faktor pertumbuhan yang memperantarai fungsi multipel melalui simulasi reseptornya pada sel endotel. VEGF pada awalnya ditemukan kerena kemampuannya untuk menyebabkan venula dan vena kecil lainnya hipermiabel untuk mensirkulasikan makromolekul dan oleh karenanya pada awalnya disebut sebagai VPF. VEGF merupakan salah satu pemicu permeabilitas vaskuler paling poten. Kemampuan untuk meningkatkan permeabilitas vaskuler ini menjadi salah satu sifat VEGF paling penting, terutama mengenai hiperpermeabilitas pembuluh darah tumor. Peningkatan permeabilitas menyebabkan bocornya beberapa protein plasma, termasuk fibrinogen. Hal tersebut mengarah pada deposisi fibrin dalam ruang ekstravaskuler yang selanjutnya memperlambat penyerapan cairan edema dan mengubah stroma antiangiogenik normal dalam jaringan normal menjadi lengkungan proangiogenik. VEGF memicu penetrasi endotel yang memberikan jalur transseluler tambahan untuk menimbulkan ekstravasasi pembuluh darah atau VEGF meningkatkan jalur sel interendotel dengan membuka hubungan antara sel endotel berdekatan. Permeabilitas yang dipicu oleh VEGF dapat diperantarai oleh jalur calcium dependent yang melibatkan produksi nitri oksida (NO) dan aktivasi Akt serta meningkatkan cGMP, sebagai tambahan pada aktivasi jalur Erk 1/2 dengan stimulasi prostaglandin PG12. 2) Aktivasi Sel Endotel VEGF menunjukkan sejumlah efek berbeda pada endotelium vaskuler dan sel endotel. Efek tersebut meliputi perubahan morfologi sel endotel, perubahan sitoskeleton, dan stimulasi migrasi serta pertumbuhan sel endotel. VEGF menyebabkan peningkatan ekspresi berbagai gen sel endotel yang berbeda, termasuk faktor prokoagulan jaringan, protein jalur fibrinolitik. 3) Survival Secara in- vitro, VEGF telah diketahui dapat menghambat apoptosis dengan mengaktivasi jalur PI3K-Akt dan meningkatkan regulasi protein antiapoptotik seperti Bcl 2. Hal tersebut sebaliknya menghambat aktivasi kaspase hulu. 4) Proliferasi VEGF adalah mitrogen untuk sel endotel. Proliferasi sel endotel tampak melibatkan aktivasi kinase ekstraseluler Erk 1/2 yang diperantarai oleh VEGFR2. 5) Invasi dan migrasi Degradasi membran basalis diperlukan untuk migrasi dan invasi sel endotel dan juga merupakan tahap awal yang penting dalam angiogenesis. VEFG memicu berbagai enzim dan protein yang penting dalam proses degradasi, termasuk matriks metalloproteinase. Regulator ekspresi VEGF dan VEGFR adalah sebagai berikut: 1) Hipoksia Hipoksia berperan penting dalam regulasi ekspresi VEGF. Hypoxia inducible factor-1(HIF-1) merupakan mediator kunci untuk respon hipoksik ini dan produk gen supresor tumor von Hipple Lindau (vHL) memiliki perang penting. Di bawah kondisi normoksik, HIF-lα secara cepat didegradasi oleh jalur ubiquitin-proteosom, suatu proses yang dikontrol oleh produk gen supresor tumor vHL. Jika vHL tidak ada atau bermutasi, HIF-lα akan bersatu dengan HIF-lβ, sehingga kompleks ini akan bentranslokasi pada nukleus dan terikat pada promotor VEGF yang mengarah pada peningkatan transkripsi VEGF.79 2) Faktor pertumbuhan dan sitokin Faktor dan pertumbuhan sitokin dapat merupakan ekspresi faktor angiogenik pada sel tumor dan karenanya secara langsung memicu angiogenesis. Insulinilike growth factor I receptor (IGF-IR) diekspresikan berlebih dalam berbagai kanker manusia dengan pembentukan metastasis. Hepatocyte growth factor dapat memicu ekspresi VEGF pada sel normal maupun sel tumor melalui aktivasi c-MET,79 Prostaglandin berperang dalam berbagai proses biologis, dan beberapa prostaglandin tertentu berimplikasi dalam angiogenesis tumor melalui upregulation ekspresi VEGF. Prostaglandin-endoperoxide-synthhase (juga dikenal sebagai siklooksigenase (COX]) merupakan enzim yang terlibat dalam transformasi oksidatif asam arachidonat ke dalam berbagai senyawa prostaglandin. Beberapa penelitian menujukkan bahwa COX-2 memperantarai ekspresi VEGF dalam berbagai sel tumor. 79 3) Onkogen dan gen supresor tumor Banyak onkogen memiliki implikasi dalam proses angiogenesis tumor. Hal ini tersebut sebagian disebabkan karena kemampuan onkogen untuk memicu faktor pertumbuhan proagiogenik seperti VEGF. Salah satu gen supresor tumor yang paling banyak memiliki implikasi adalah peran penting p53 dalam regulasi VEGF pada beberapa kanker. Intraksi langsung protein p53 dengan faktor transkripsi Sp1 mencegah aktivasi transkripsional promotor VEGF dan menghambat induksi hipoksik Src kinase. Transkripsi p53 dapat menurunkan ekspresi VEGF.79 1. Interleukin-8 (IL-8) Interleukin-8 pertama kali terindentifikasi sebagai faktor kemotaksis neutrophil dalam supernatan monosit manusia yang diaktivasi. Sebagian member famili kemokin CXC, IL-8 beberapa penting sebagai aktivator dan kemoatraktan neutrofil. Ekspresi IL-8 dikaitkan dengan pertumbuhan tumor pertama kali berdasarkan temuan bahwa sinyal IL-8 berkaitan dengan jumlah protein IL-8 yang diekspresikan oleh sel tumor yang distimulasi oleh TNF-α.80 Interleukin-8 dihasilkan oleh berbagai sel normal dan sel tumor, pada sel normal, IL-8 bertindak sebagai kemokin proinflamasi, sedangkan pada sel tumor, IL-8 banyak diekspresikan pada saat angiogenesis.81,80 Infiltrasi sel-sel inflamasi diaktivasi oleh kanker yang kemudian merangsang terjadinya angiogenesis. Tumor associated macrophage telah diketahui sebagai kandidat sel inflamasi untuk angiogenesis tumor. Macropage yang menginfitrasi tumor meningkatkan ekspresi VEGF dan TNF-α tidak merangsang angiogenesis secara langsung, namun dengan memodulasi induksi IL-8 dengan jalur yang diregulasi melalui mekanisme parakrin dan atau otokrin.82 Regulator IL-8 adalah sebagai berikut: 1) Nitri Oksida (NO) NO adalah molekul biologis poten yang memperantarai berbagai aktivitas, termasuk vasodilatasi, neurotransmisi, metabolise zat besi, dan pertahanan imun. Beberapa penelitian menujukkan bahwa NO yang berkaitan dengan tumor, yang dihasilkan oleh sel tumor dan/atau sel inang yang menginfiltrasi tumor, memiliki efek pleiotropik pada karsinogenesis, pertumbuhan tumor, dan metastasis NO menekan ekspresi IL-8.80 2) Hipoksia dan Anoksia Pertumbuhan dan metastasis sel kanker tergantung pada perkembangan pembuluh darah yang memadai. Kekurangan oksigen memicu keadaan hipoksia dan anoksia pada daerah sekitar tumor. Hal tersebut memicu ekspresi IL-8 melalui aktivasi dan kerjasama NFҡB dan AP-180 3) Asidosis Abnormalitas dalam fungsi dan struktur pembuluh darah mengarah pada perkembangan daerah hipoksik pada kanker. Hipoksia meningkatkan metabolisme anaerob sel kanker dan menyebabkan peningkatan produksi metabolit asidik. Berkurangnya aliran darah mempengaruhi pembuangan metabolit tersebut, sehingga sebagai akibatnya ion hidrogen akan berakumulasi dan menyebabkan penurunan pH ekstraseluler. Penelitian pada sel kanker pankreas COLO357 yang dinkubasi dalam pH media yang berbeda menujukkan kadar IL-8 meningkat seiring dengan penurunan pH. Sehingga dapat disimpulkan bahwa keadaan asidosis dapat memicu ekspresi IL-8.80 2.5.3. Peran angiogenesis dan Invasi Peran angiogenesis sangat penting pada perjalanan kanker, tanpa angiogenesis kanker tidak dapat menyebar dan akan mati. Pada angiogenesis terjadi proliferasi dari jaringan pembuluh darah yang berpenetrasi ke dalam pembuluh darah kanker, mensuplai zat makanan dan oksigen agar kanker dapat menyebar pada organ lain. Angiogenesis diatur oleh molekul aktivator (angiogenic growth factors) dan inhibitornya (angiogenic inhibitor factors). Normalnya inhibitor lebih dominan untuk menghalangi pertumbuhan, pada saat diperlukan membentuk pembuluh darah baru, maka aktivator angiogenesis meningkat dan inhibitor menurun. Angiogenesis bukanlah kejadian yang berdiri sendiri, tapi merupakan rangkaian proses yang berasal dari sel mikrovaskular endotelial. Sel endotelial dirangsang untuk mendegradasi membran basal endotelial, bermigrasi ke perivaskular stroma (jaringan ikat). Migrasi dilakukan kearah sumber stimulus angiogenesis. Sel endotelial yang telah distimulasi menghasilkan proteinase yang bisa mendegradasi dan menginvasi matriks ektraselular. Keseimbangan yang baik diantara proteinase dan proteinase inhibitor mampu meregulasi morfogenesis vaskular dan invasi. Sel endotelial yang bermigrasi memproduksi kolagenase tipe IV dan anggota lain keluarga matriks metaloproteinase dan serine proteinase. Inhibitor kolagenase tipe IV, inhibitor metaloproteinase, dan inhibitor serine proteinase mampu menghambat invasi sel endotelial pada matriks ektraselular. Agen yang memicu terjadinya angiogenesis, seperti bFGF, memiliki tiga stimulasi multifungsi pada sel endotel kapiler. Ketiga fungsi tersebut adalah motilitas, proteolisis, dan pertumbuhan. Transisi dari karsinoma insitu menjadi karsinoma invasif dihubungkan dengan adanya kerusakan membran basalis dan migrasi kedalam jaringan ikat intersitium. Fase awal angiogenesis melibatkan perusakan membran basalis pembuluh darah dan migrasi endotelial ke dalam stroma, membentuk cabang kearah stimulus angiogenik. Proteolisis lateral dari stroma jaringan ikat memungkinkan terjadinya pembesaran diameter cabang dan pembentukan lumen. Faktor angiogenik seperti faktor pertumbuhan basic fibroblast memicu migrasi endotelial, proteolisis dan proliferasi. 2.5.4. Peran Matriks Metalloproteinase pada matriks Ekstraseluler Matriks ekstraseluler berperan secara dinamik pada berbagai kegiatan sel, termasuk pergerakan sel, migrasi sel, proliferasi, apoptosis serta morfogenesis jaringan. Kualitas dan kuantitas matriks ekstraseluler selain ditentukan oleh komponen strukturalnya seperti kolagen, elastin, laminin dan proteoglikan, juga melalui pengendalian ekspresi berbagai proteinase yang dapat memecah matriks dan inhibitornya. Aktivasi proteinase dan inhibitornya diduga mempunyai peran dalam proses invasi sel kanker. Matriks metalloproteinase (MMP) merupakan kelompok enzim yang mampu mendegradasi komponen matriks ekstraseluler, mempunyai peranan penting dalam proses fisiologis dan patologis dengan melakukan remodeling pada matriks ekstraseluler. Pada jaringan kanker dijumpai ekspresi berlebih dari matriks ekstraseluler yang diperkirakan merupakan faktor penting pada terjadinya invasi dan metastasis dengan cara merusak komponen dan struktur matriks ekstraseluler dan membrana basalis. Tissue inhibitor merupakan kelompok endogenous mayor yang menginhibisi aktivasi dari matrik metalloproteinase dan menurunkan regulasi dari metalloproteinase serta mempengaruhinya pada proses transkripsi sel. Matriks ektraseluler merupakan golongan gelatinase, yang memiliki potensi menginduksi invasi sel kanker dengan cara memecah filamen pada kompleks hemidesmosom. Tissue inhibitor metalloproteinase merupakan inhibitor kuat sel-sel kanker yang invesif pada matriks ekstraseluler. MTT Assay MTT assay digunakan untuk menentukan viabilitas sel. MTT adalah sistem pengujian kolorimetrik yang mengukur reduksi komponen garam tetrazolium yang dipecah formazan.55 Setelah inkubasi sel dengan reagen MTT selama sekitar 2 sampai 4 jam, sebuah larutan deterjen ditambahkan untuk melisi sel dan melarutkan kristal berwarna. Sampel dibaca menggunakan pelat pembaca Bio-Rad pada panjang gelombang 540 nm. Jumlah warna yang dihasilkan adalah proporsional terhadap jumlah viabilitas sel . Sistem MTT adalah tes kuantitatif yang lebih sensitif. Karena ada hubungan linear antara aktivitas sel dan absorbance, pertumbuhan atau kecepatan kematian sel dapat diukur. KERANGKA PEMIKIRAN Kanker lidah merupakan penyakit yang disebabkan oleh rusaknya mekanisme pengendalian dalam siklus sel yang diatur oleh sejumlah gen-gen yang termasuk dalam gen regulatorik normal terdiri dari onkogen (gen pemicu pertumbuhan), gen penekan tumor yang menghambat pertumbuhan sel, dan gen yang mengatur kematian sel terencana (apoptosis), apabila terjadi gangguan pada ketiga gen tersebut, maka akan terjadi kanker. Pertumbuhan dan perkembangan kanker itu sendiri meliputi tahapan yang multipel, berangkai, dan berhubungan satu sama lain yang mengarah pada suatu sel-sel otonom dengan potensi pertumbuhan yang agresif. Invasi sel, Proliferasi dan angiogenesis merupakan hal yang menunjang dalam pertumbuhan tumor dan memiliki implikasi dalam perawatannya. Invasi merupakan sifat karakteristik pada terjadinya kanker. Invasi menunjukkan kemampuan sel kanker merusak atau mendegradasi batas antara jaringan epitel dan membran basalis. Proses invasi terjadi dengan cara infiltrasi ke dalam jaringan pembatas, merusak membran basalis, matriks ekstraseluler dan merusak arsitektur jaringan bahkan dapat merusak fungsi organ. Invasi sel tumor melibatkan proses ikatan antara reseptor dengan ligan dan interaksi antara protein-protein oleh enzim membran basal. Proliferasi sel merupakan suatu pertambahan jumlah sel yang prosesnya melibatkan siklus sel. Siklus sel dapat dibagi menjadi empat fase, yaitu fase G1 (Gap 1), S (Sintesis), G2 (Gap 2) dan M (Mitosis). Fase G1 merupakan akhir fase mitosis dan sampai awal sintesis tersebut. Pada tahap tersebut sel terus tumbuh dan melakukan persiapan untuk sintesis DNA. Sel akan masuk ke fase S untuk melakukan sintesis DNA dan terjadi proses replikasi kromosom. Pada fase G2 sel yang telah mereplikasi kromosom akan menduplikasi keseluruhan komponen selular lainnya. Selain itu terjadi pula sintesis mRNA dan beberapa protein tertentu. Fase terakhir dari proliferasi adalah fase M yang merupakan fase tersingkat. Pada fase M terjadi pemecahan DNA yang telah berduplikasi secara komplit. Fase G0 adalah fase sel dalam keadaan istirahat atau tidak aktif melakukan proliferasi. Pertumbuhan dan progresi kanker juga memerlukan proses tambahan yang memberikan potensi metastasis dan vaskularisasi untuk mendukung pertumbuhan yang berkelanjutan dan penyebarannya. Proses tersebut yang disebut sebagai angiogenesis atau pembentukan darah baru dari pembuluh darah yang sudah ada. Angiogenesis merupakan proses yang kompleks dan terkoordinasi yang memerlukan serangkaian aktivasi beberapa gen, namun vascular endothelial growth factor (VEGF) menujukkan gen yang paling berpotensi terdapat pada angiogenesis kanker (protoonkogen). Selain VEGF, terdapat proonkogen lain, yaitu iterleukin-8 (IL-8) yang memiliki peran pada angiogenesis kanker. VEGF dan IL-8 bersama-sama meningkatkan pertumbuhan kanker dan juga proses metastasis.. Ekspresi berlebih VEGF dan IL-8 menujukkan progresi tumor. Sel kanker tergantung pada angiogenesis untuk pertumbuhannya. Pemberian inhibitor angiogenesis tidak secara langsung akan berefek sitotoksik pada sel kanker, tetapi dapat meningkatkan laju apoptosis sel kanker dengan mekanisme menurunnya produksi VEGF sehingga menekan pertumbuhan tumor dengan menghambat proliferasi sel edontel dan memicu apoptosis sel edontel yang berakhir dengan apoptosis sel kanker itu sendiri. Hambatan invasi dan proliferasi pada sel tumor serta hambatan angiogenesis merupakan mekanisme perawatan antikanker yang paling banyak diteliti saat ini. Saat ini penggunaan pengobatan komplementer dan alternatif di Indonesia semakin populer. Adanya bukti-bukti empiris dan dukungan ilmiah yang semakin banyak terhadap khasiat pengobatan tersebut menyebabkan masyarakat banyak menggunakannya sebagai pencegahan dan pengobatan berbagai penyakit, termasuk penyakit-penyakit berat seperti kanker. perawatan kanker dengan memanfaatkan aktivitas antiangiogenik dan antiproliferasi dan hambatan invasi banyak didapat dari bahan-bahan kemoterapi tradisional yang menggunakan bahan alam yang dikenal sebagai herbal medik. Keuntungan herbal medik adalah kurangnya toksisitas dan efek samping obat, secara umum memiliki aktivitas dengan spektrum luas, dan kurangnya resiko terjadinya resistensi terhadap obat. Salah satu tanaman obat yang ada di Indonesia adalah sarang semut (Myrmecodia pendans). Penggunaan sarang semut sebagai bahan obat diperoleh dari penduduk lokal Papua. Sarang semut dipercaya dapat menyembuhkan beragam penyakit berat seperti tumor, kanker, jantung, stroke, TBC, rematik, gangguan asam urat, maag, gangguan fungsi ginjal dan prostat. Uji penapisan kimia dari tumbuhan Sarang Semut (Myrmecodia pendans) menunjukkan bahwa tumbuhan ini mengandung senyawa-senyawa kimia dari golongan flavonoid dan tanin. Hal ini sesuai dengan hasil penelitian yang telah dilakukan oleh para peneliti yang mempelajari golongan senyawa ini dalam kaitannya dengan sistem pertahanan diri tumbuhan Sarang Semut. Banyak mekanisme kerja dari flavonoid yang sudah terungkap, termasuk inaktivasi karsinogen, antiproliferasi, penghambatan siklus sel, induksi apoptosis dan diferensiasi, serta inhibisi angiogenesis. Kemampuan Sarang Semut secara empiris untuk pengobatan berbagai jenis kanker atau tumor, diduga kuat berkaitan dengan kandungan senyawa flavonoid dari Sarang Semut. Flavonoid merupakan golongan senyawa bahan alam dari senyawa fenolik yang banyak merupakan pigmen tumbuhan. Saat ini lebih dari 6.000 senyawa yang berbeda masuk ke dalam golongan flavonoid. Flavonoid merupakan bagian penting dari diet manusia karena banyak manfaatnya bagi kesehatan. Fungsi kebanyakan flavonoid dalam tubuh manusia adalah sebagai antioksidan sehingga sangat baik untuk pencegahan kanker. Manfaat flavonoid antara lain adalah untuk melindungi struktur sel, memiliki hubungan sinergis dengan vitamin C (meningkatkan efektivitas vitamin C), antiinflamasi, mencegah keropos tulang, dan sebagai antibiotik. Senyawa flavonoid memiliki struktur umum phenylbenzopyrone (C6-C3-C6), dan dikategorikan berdasarkan level saturasi dan pelepasan cincin sentral pyran, secara garis besar dikelompokkan menjadi flavones, flavanols, isoflavones, flavonols, dan flavanonols. Dalam uji invitro, …………………………..telah dibuktikan bahwa Sarang Semut ampuh mengatasi sel kanker. Dalam penelitian dengan menggunakan Sarang Semut yang berbobot 2-3 kg, kemudian diekstrak dengan berbagai pelarut seperti air, methanol, dan campuran methanolair, didapatkan bahwa seluruh ekstrak sarang semut menekan proliferasi sel tumor manusia. Dalam uji tersebut terbukti tingkat efektivitas EC50 mencapai 9,97 mg/ml pada ekstrak methanol. Artinya hanya dengan dosis kecil, 9,97 mg/ml, ekstrak sarang semut mampu menekan 50% laju pertumbuhan sel kanker. Senyawa flavonoid yang terkandung dalam herbal medicine mempunyai efek memblok reseptor growth factors, menginhibisi Mitogen Activated Protein Kinase (MAPK), pada jalur sinyal Receptor Tirosin Kinase (RTKs). Pada Penelitian Deguchi H. (2002), menyimpulkan bahwa senyawa flavonoid yang terkandung dalam herbal medicine (teh hijau) mempunyai efek inhibisi pertumbuhan pada sel kanker payudara (sel T47D). Mekanisme inhibisi pertumbuhan tersebut terutama pada MAPK, di mana memphosporilasi berbagai protein termasuk transcription factors yang dibutuhkan pada sintesa protein dalam differensiasi dan siklus dan siklus sel. Flavonoid dalam herbal medicine juga dilaporkan mempunyai kemampuan untuk menghambat aktivasi Nuclear Factors Kappa B (NF-қB). Suatu transcription factors yang berperan penting dalam regulasi molekul pembentukan sitokin. Penelitian Tazulakhova (2002), menyatakan bahwa flavonoid alamiah dapat menstimulasi produksi interferon-γ (IFN-γ) dalam suatu populasi immunosit. Gangguan perkembangan siklus sel dapat menjelaskan efek anti kanker flavonoid. Sinyal mitogenik pada sel akan masuk ke serangkaian langkah yang diatur melintasi sel siklus. Sintesis DNA (fase S) dan pemisahan dua sel anak (M fase) adalah fitur utama dari progresi siklus sel. Waktu antara fase S dan M ini dikenal sebagai fase G2. Fase ini penting untuk memungkinkan sel untuk memperbaiki kesalahan yang terjadi selama duplikasi DNA, mencegah propagasi dari kesalahan ini ke sel anak. Sebaliknya, fase G1 merupakan periode komitmen untuk progresi siklus sel yang memisahkan fase M dan S sebagai sel mempersiapkan DNA duplikasi pada sinyal mitogenik. CDKs diakui sebagai regulator kunci dari progresi siklus sel. Perubahan dan disregulasi sejumlah kanker dengan hiperaktivasi dari CDKs sebagai akibat dari mutasi gen atau gen inhibitor CDK. Oleh karena itu, inhibitor pada jalur siklus sel akan menarik untuk dieksplorasi sebagai agen terapi baru pada kanker. Checkpoints pada fase G1 / S dan G2 / M pada siklus sel tumor telah ditemukan terganggu oleh flavonoid seperti silymarin, genistein, quercetin, daidzein, luteolin, kaempferol, apigenin, dan epigallocatechin 3-gallate. Studi dari laboratorium yang berbeda mengungkapkan bahwa flavopiridol dapat menginduksi penahanan siklus sel selama G1 atau G2 / M oleh penghambatan semua CDKs. Mekanisme molekuler yang menyebabkan penghentian siklus sel oleh flavonoid masih belum diketahui dengan jelas. Berdasarkan beberapa penelitian, terdapat target molekular yang dapat menyebabkan antiproliferasi flavonoid, yaitu penghambatan signal Akt dan NF-κB. Akt mempunyai peranan penting dalam regulasi pertahanan siklus sel dan proliferasi sel kanker dengan mempengaruhi status phosporylation berlebihan dari Akt. Sehingga blockade signal tersebut menyebabkan hambatan pertumbuhan dengan penghentian siklus sel dan apoptosis dari sel kanker. Flavonoid juga merubah ikatan DNA faktor transkripsi nuclear factor-kappa B (NFκB). NF-κB dapat diinduksi atau overexpresi pada beberapa sel kanker, dan aktifasinya menyebabkan proliferasi sel dan transformasi keganasan dengan diferensiasi dan apoptosis. Perawatan pada sel kanker dengan flavonoid mengakibatkan pengikatan NF-κB pada DNA yang mengakibatkan apoptosis. PI3K/Akt sinyal jalur. PI3K diaktifkan oleh reseptor tirosin kinase dan RAS dan pada gilirannya mengaktifkan efektor hilir dengan menghasilkan PIP3 pada membrana basalis. PIP3 mengikat kedomain homologi pleckstrin Akt, lokalisasi ke membrana. Akt kemudian terfosforilasi pada Thr308 dan Ser473. Akt mengatur kelangsungan hidup sel, proliferasi (jumlah sel meningkat), pertumbuhan (peningkatan ukuran sel), dan perantara metabolisme oleh fosforilasi berbagai substrat. PTEN supresor tumor adalah pengatur negatif dari Akt. PTEN mengkatalisis defosforilasi PIP3, ini mencegah perekrutan Akt ke membran plasma dan menghambat aktivasi. Protein kinase memainkan peran penting dalam pengaturan jalur sinyal beberapa sel dan fungsi sel. Deregulasi fungsi protein kinase telah terlibat dalam karsinogenesis. Penghambatan kinase protein telah muncul sebagai target penting untuk chemoprevention kanker dan terapi. Flavonoid memberi efek kemopreventif kerjanya pada jalur kinase protein signal. Penelitian terbaru menunjukkan bahwa flavonoid dapat mengikat langsung ke beberapa protein kinase, termasuk Akt / protein kinase B (Akt / PKB), Fyn, Janus kinase 1 (JAK1), mitogen-activated protein kinase kinase 1 (MEK1), phosphoinositide 3-kinase ( PI3K), mitogen-activated protein (MAP) kinase kinase 4 (MKK4), Raf1, dan rantai zeta terkait 70-kDa protein (ZAP-70) kinase, dan kemudian mengubah fosforilasi mereka untuk mengatur jalur sinyal beberapa sel dalam proses karsinogenesis. Data menunjukkan bahwa flavonoid bertindak sebagai inhibitor protein kinase. Flavonoid memiliki berbagai aktivitas biologis pada konsentrasi toksisitas dalam organisme. Data dari laboratorium penelitian, penyelidikan epidemiologi, dan uji klinis pada manusia menunjukkan bahwa flavonoid memiliki penting efek pada chemoprevention kanker dan kemoterapi. Banyak mekanisme telah diidentifikasi, termasuk inaktivasi karsinogen, antiproliferasi, intervensi siklus sel, induksi apoptosis dan diferensiasi, inhibisi angiogenesis. Penekanan aktivasi NF-κB terkait dengan antitumor, kemopreventif, kemosensitivitas, tekanan inflamasi, antiangiogenesis, dan apoptosis. flavonoid memperantarai efeknya melalui penekanan aktivasi NF-κB. NF-κB diketahui memperlihatkan regulasi ekspresi sejumlah gen yang produknya terlibat dalam tumorigenesis. Produk tersebut diantaranya adalah gen antiapoptosis (misalnya inhibitor seluler dari apoptosis, surviving, faktor TNF terkait-reseptor (TRAF), bcl-2 dan Bcl-xL); COX2, matriks metalloproteinase-9, gen penyandi molekul adhesion, kemokin, sitokin inflamasi, dan sintesa NO inducible, dan gen pengatur siklus sel (misalnya D1 siklin). NF-κB adalah faktor transkripsi yang terlibat dalam fungsi seluler yang luas, diantaranya apoptosis dan kontrol siklus sel. NF-κB meregulasi eksresi beberapa produk gen yang berhubungan dengan karsinogenesis. Gen-gen tersebut di antaranya gen antiapoptosis, COX-2, dan gen regulasi siklus sel. NF-κB dipertahankan dalam sitoplasma oleh protein inhibitor IκB. Beberapa mediator dalam jalur transduksi di antaranya Akt diketahui mengaktivasi NF-κB melalui fosforilasi dari IκB. NF-κB yang teraktivasi bertranslokasi ke inti, menyebabkan transkripsi beberapa gen (misalnya COX-2). Akibatnya, produksi prostaglandin selanjutnya akan mengaktivasi NF-κB. Oleh karena itu, aktivasi NF-κB dapat menyebabkan efek yang berlebihan dan menetap, melalui aktivasi jalur COX-2. Selain menghambat produksi prostaglandin flavonoid diketahui menghambat jalur fosfoinositid 3-kinase/Akt, dengan menghambatan aktivitas Akt maka Akt tidak dapat mengaktifasi NF-κB. Flavonoid sebagai obat terapi antikanker bekerja menekan COX-2 sehingga tidak terjadi produksi prostaglandin yang selanjutnya akan menekan NF-κB. Berdasarkan studi kasus-kontrol sebuah populasi di Hawaii tentang hubungan antara asupan flavonoid kuat pola makan dan risiko kanker paru, ditemukan bahwa beta-karoten dan vitamin E juga terkait dengan penurunan risiko kanker paru-paru. Selain itu, kelompok penelitian di Uruguay melakukan penelitian kasus-kontrol pada periode Januari 1996-Desember 1997, menemukan bahwa penggunaan flavonoid memberikan pengurangan 70% dalam risiko kanker rongga mulut, faring, laring, dan esofagus. Alur Kerangka Pemikiran Growth Factors Membrana basalis Growth Factors (TGF) RTKs PTEN PIP2 Ras P110 P85 P85 PIP3 AKT P110 PIP3 TGFR PDK1 P85 Class IA PI3K P110 Class IA PI3K SMAD PKC IқB Flavonoid COX-2 P21 ß-Catenin NFқB Myrmecodia Pendans NFқB Nucleus Cytosol ? ? Angiogenesis ? Proliferasi Akt & NF-KB Gambar 2.7 Alur kerangkah pemikiran 2.3 Hipotesis Berdasarkan premis-premis yang telah diuraikan pada kerangka pemikiran di atas, maka dideduksi hipotesis sebagai berikut: Hipotesis 1: Senyawa turunan flavonoid yang teridentifikasi sebagai antikanker dari sarang semut (myrmecodia pendans) memiliki potensi hambatan proliferasi sel kanker lidah Supri’s Clone-1 (SP-C1). Hipotesis 2: Senyawa turunan flavonoid yang teridentifikasi sebagai antikanker dari semut (myrmecodia pendans) memiliki potensi menghambat proses angiogenesis sel kanker lidah supri’s Clone-1 (SP-C1) ditandai dengan penurunan ekspresi vascular endothelial growth factor (VEGF) dan interleukin-8 (IL-8) Hipotesis 3: Senyawa turunan flavonoid yang teridentifikasi sebagai antikanker dapat memiliki potensi hambatan mekanisme protein Akt dan NF-KB pada sel anti kanker lidah Supri’s Clone-1 (SPC1) BAB III METODOLOGI PENELITIAN 3.1. Bahan dan Subjek Penelitian 3.1.1. Bahan Penelitian Bahan baku penelitian yang digunakan untuk mendapatkan senyawa murni adalah tanaman sarang semut (myrmecodia pendans) 3.1.2. Subjek Penelitian Subjek penelitian ini adalah Sel Supri’s-Clone (SP-C1), merupakan sel kanker lidah yang diisolasi dari limfonadi penderita kanker lidah, berasal dari karsinoma sel skuamosa berdifferensiasi sedang dan belum mengalami invasi ke jaringan otot. Sel SP-C1 mempunyai karakteristik pertumbuhan yang cepat, kemampuan invasi dan metastasis yang cepat, penyakit yang sukar disembuhkan, terjadinya rekurensi sangat tinggi walaupun telah dilakukan pembedahan secara radikal dan rerata lamanya hidup penderita pendek. Sel kanker lidah SP-C1 diambil dari tangki nitrogen cair lalu dicairkan dalam water bath suhu 370C sampai mencair, kemudian disemprot alkohol 70%. Sel dimasukkan ke dalam tabung sentrifuse yang berisi 10 ml medium DMEM serum (DMEM ditambah FBS 10%, penicilin streptomisin 3%, dan Fungizone 0,5%) dalam ruang laminary airflow, dan disentrifuse dengan kecepatan 1200 rpm selama 5 menit. Supernatan dibuang, endapan yang terbentuk ditambahkan dengan DMEM serum. Setelah didiamkan 20 menit sel disentrifuse dengan kecepatan 1200 rpm selama 5 menit. Supernatan dibuang, disisakan 1 ml untuk resuspensi. Suspensi sel dimasukkan ke dalam TFC (Tissue Culture Flask) dengan media pertumbuhan yang mengandung FBS 10% dan dilihat di bawah mikroskop inverted. Se hidup nampak pipih, utuh, jernih dan bersinar. Tissue Culture flask yang berisi sel diinkubasi dalam inkubator dengan tutup dikendorkan. 3.2. Metode Penelitian 3.2.1. Jenis Penelitian Penelitian dilakukan dengan cara eksperimental murni laboratorik dengan menggunakan biakan sel kanker lidah manusia Supri’s-Clone (SP-C1).................................. 3.2.2. Bahan dan alat penelitian : Bahan yang digunakan sekama pengujian aktifitas sel adalah SP-C1 cell lines, Dulbeco’s Modified Eagle Medium (DMEM), Fetal bovain serum (FBS), Fungizone liquid, Penisilinstreptomisin, Trypsin-EDTA, Phosphat buffer saline (PBS), Mill-Q, Membran polycarbonate 5 milipore, Etanol, Alkohol 70%, Hematoksilin, dan dimetilsulfoksida (DMSO). Sedang peralatan yang digunakan untuk uji aktivitas seprti ELISA microplate reader (BioRad-Jepang), Plat 96 sumuran (Iwaki jepang), Boyden chamber, Sentrifuse HC-1180T (Health), Mikropipet berbagai ukuran (Eppendorf), Vortex (Maxi mix II), Conical tube eppendorf (15 ml), Inkubator 370C, CO2 5%, Refrigerator (Biomedical freezer) 40C, -200C dan -300C, Laminar airflow (Sanyo), Water bath (Eyela, Tokio rikakikai, 5-800C), Neraca digital elektronik (Mettler Toledo), Flasks , Suction pump (Asaniika), Handyclave (Rexall), Mikroskop cahaya (Nikon eclipse TE. 2000-U), Human IL-8 Elisa Kit (Boster-Cina), Human VEGF Elisa Kit (Boster-Cina) 3.2.3 Tempat dan Waktu Penelitian Penelitian dilaksanakan di Laboratorium Riset Terpadu Fakultas Kedokteran Gigi Universitas Gadjah Mada pada bulan Agustus 2012 - Nopember 2012, dan di Laboratorium Penelitian dan Penguji Terpadu (LPPT) Universitas Gadjah Mada pada bulan Juli - Agustus 2011. 3.2.4. Variabel Penelitian dan Defenisi Operasional 1. Variabel bebas: senyawa golongan flavonoid 2. Variabel terikat : - Hambatan Akt - Hambatan NF-KB - Proliferasi. -Hambatan angiogenesis Defenisi operasional a) Proliferasi sel adalah penambahan jumlah sel sebagai hasil dari pertumbuhan dan pembelahan sel. b) Kultur sel kanker lidah SP-C1 : Biakan sel cloning dari penderita kanker lidah manusia dalam media pertumbuhan yang sesuai (DMEM). c) VEGF adalah sinyal kimia yang diproduksi oleh sel yang merangsang pertumbuhan pembuluh darah baru (angiogenesis). Dideteksi dengan menggunakan ELISA VEGF kit. Prinsip kerja berdasarkan pengukuran densitas warna kuning (OD) pada panjang gelombang 450 nm yang diproporsikan sebagai jumlah VEGF manusia dari sampel uji. Pada setiap percobaan dibuat larutan standar beberapa konsentrasi VEGF vs OD relatif standar (OD tiap sumuran-OD nol) untuk menampilkan kurva standar. Perhitungan konsentrasi VEGF (dalam μg/ml) sampel didasarkan pada interpolasi pada kurva larutan standar. Data yang dihasilkan tersaji dalam bentuk interval. d) IL-8 adalah kemokin dihasilkan oleh makrofag dan jenis sel lain seperti sel-sel epitel. IL-8 meningkat pada saat pembentukan pembuluh darah. Dideteksi dengan menggunakan ELISA. Prinsip kerja berdasarkan pengukuran densitas warna kuning (OD) pada panjang gelombang 450 nm yang diproporsikan sebagai jumlah IL-8 manusia dari sampel uji. Pada setiap percobaan dibuat larutan standar beberapa konsentrasi IL-8 vs OD relatif standar (OD tiap sumuran-OD nol) untuk menampilkan kurva standar. Perhitungan konsentrasi IL-8 (dalam μg/ml) sampel didasarkan pada interpolasi pada kurva larutan standar: data yang dihasilkan tersaji dalam bentuk skala interval. e) Hambatan Akt adalah penurunan ekspresi protein Akt setelah diberi perlakuan senyawa flavonoid sarang semut melalui uji western bloth f) Hambatan NF-KB adalah penurunan ekspresi protein NF-KB setelah diberi perlakuan senyawa flavonoid sarang semut melalui uji western bloth 3. Uji Hambatan Proliferasi (Pertumbuhan Sel) MTT Assay 1) Disiapkan 4 buah plate yang berisi 24 sumuran, untuk pengujian MTT assay jam ke 24, 48, jam. 2) Kemudian pada masing-masing plate masukkan sel kanker lidah SP-C1 sebanyak 5 X 103 sel/sumuran dalam 100 µl DMEM (Dulbelco’s Modified Eagle Medium) sesuai dengan konsentrasi senyawa flavonoid. Berdasarkan perhitungan maka total jumlah sel yang dibutuhkan adalah 12,8 X 105 sel untuk seluruh sumuran dan jumlah larutan DMEM yang diperlukan sebanyak 25,6 ml. Perhitungan jumlah sel kanker ditentukan dengan menggunakan hemositometer. 3) Semua sel kemudian diinkubasikan pada suhu 37˚ C selama 24 jam. 4) Semua medium diaspirasi dan diganti dengan medium baru yang berasal dari senyawa flavonoid 5) Medium diinkubasikan pada suhu 37˚ C selama 24, 48 jam. 6) Diambil plate jam k 0, masukkan 15 µl larutan MTT, diinkubasikan pada suhu 37˚ C 4 jam, buat foto. 7) Larutan dibuang, kemudian masukkan larutan isopropanol 100 µl. 8) Shaker 10–15 menit sampai homogen. 9) Plate 24 sumuran diukur dengan Bio-rad Microplate Reader OD dengan panjang gelombang 540 nm 10) Dilakukan pengujian yang sama pada jam ke 24, 48 dengan cara seperti diatas. 5. Uji angiogenesis Senyawa Turunan Xanton yang Terindentifikasi Memiliki Potensi Antikanker terhadap Sel SP-CI Uji angiogenesis baik untuk analisis ekspresi VEGF maupun IL-8 dimulai dengan tahap mempersiapkan larutan senyawa xaton uji sebanyak 3 konsentrasi di bawah konsentrasi IC50 dari senyawa flavonoid yang memiliki hambatan pertumbuhan maksimal. Empat buah plate 24 sumuran disiapkan untuk analisis ekspresi VEGF dan IL-8 masingmasing 2 plate untuk masa inkubasi 24 dan 48 jam. Sebanyak 2x104 sel SP-CI dimasukkan ke dalam masing-masing sumuran plate 24 dan ditambahkan 100 μI larutan senyawa sebagai konsertrasi. Semua sel kemudian diinkubasikan pada suhu 370 C selama 24 dan 48 jam. Setelah 24 jam, supernata dikumpulkan ke dalam conical Eppendorf sesuai dengan konseterasi masing-masing. Supernatan kemudian disimpan dalam kulkas bersuhu 40C. Hal yang sama dilakukan untuk sampel uji 48 jam. Tahapan-tahapan di bawah ini merupakan prosedur yang sama untuk dilakukan baik analisis ekspresi VEGF maupun IL-8 dengan menggunakan kit masing-masing secara terpisah. 1). Larutan standar VEGF dan IL-8 dibuat sesuai petunjuk pabrik yaitu dalam konsentrasi 2000 μg/ml, 100 μg/ml, 500μg/ml, 250μg/ml 125μg/ml, 62,5μg/ml, dan 31,2μg/ml. 2). Pembuatan larutan standar VEGF dan IL-8 masing-masing dimulai dengan pembuatan 10.000 pg/ml larutan standar VEGF dengan melarutkan 10 ng VEGF standar dengan 1 ml buffer diluen. Larutan disimpan dalam suhu ruang selama 10 menit, kemudian dikocok, 3) Larutan standar konsentrasi 2000μg/ml dibuat dengan melarutkan 0,2 ml larutan standar 10.000 pg/ml di atas dengan 0,8 ml buffer diluen. Kemudian alikuot 0.3 ml larutan standar 2000 μg/ml dan dimasukkan ke dalam conical tubeyang telah berisi 0,3 ml buffer diluen untuk membuat larutan standar 1000μg/ml. Demikian seterusnya sampai konsentrasi 31,2 μg/ml 4) Setelah larutan standar VEGF dan IL-8 siap, maka disiapkan 2 buah plate 24 sumuran yang masing-masing telah dilapisi antibodi monoklonal spesifik VEGF serta IL-8 manusia (telah tersedia dalam kit). Dua baris sumuran paling kiri diisi dengan 0,1 ml larutan standar no 3). Dua sumuran terakhir diisi dengan buffer diluen sebagai kontrol (sumuran Nol). Sumuran kosong diisi dengan 0,1 ml supernata berbagai konsentrasi. Plate kemudian ditutup dan diinkubasi dalam waterbath selama 90 menit dengan suhu 37oC. 5) Setelah 90 menit, isi plate dibuang tanpa cuci dan ditambahkan 0,1 ml antibody biotinilasi VEGF manusia ke dalam setiap sumuran. Plate diinkubasi kembali selama 60 menit 6) plate dicuci dengan 0,01 M PBS sebanyak 3 kali, setiap kali pencucian PBS didiamkan dalam plate selama 1 menit. Kemudian ditambahkan 0,1 ml larutan kerja avidin-biotinperoksidase complex (larutan ABC, tersedia dalam kit) ke dalam setiap sumuran dan diinkubasi selama 30 menit. 7) Plate dicuci kembali dengan 0,01 M PBS sebanyak 5 kali, setiap kali pencucian didiamkan selama 1-2 menit. Larutan pencucian dibuang kemudian masing-masing sumuran ditambahkan 90 μl pewarna TMB (3,3’, 5,”- tetramethylbenzidine) dan diinkubasi selama 15-20 menit. Warna biru akan terlihat pada 4 larutan standar dengan konsentrasi VEGF/IL8 tertinggi, sumuran lain tidak terlihat perubahan warna yang nyata. 8) Setelah 20 menit, masing-masing sumuran ditambahkan 0,1 ml larutan TMB stop. Perubahan warna menjadi kuning akan terlihat seketika. 9) OD dibaca menggunakan microplate reader pada panjang gelombang 450 nm segera setelah pemberian larutan stop. DAFTAR PUSTAKA Warshawsky S, Landolph JR. Molecular Carcinogenesis and the Molecular Biology of Human Cancer, 1st ed. Boca Raton USA, Taylor & Francis Group, 2006 : 6 King RJ, Robins MW. Cancer Biology, 3rded. England, Pearson Education Limited, 2006 : 209-29 Dorland, W.A.. Medical Dictionary. 29th ed. Philadelphia. WB Saunders Co. 2000: 349 Wood, N.K and Sawyer D.R., 1997, Oral Cancer, dalam Wood, N.K. dan Goaz, P.W. (eds): Differential Diagnosis Of Oral and Maxillofacial lesion, Mosby Inc., St. Louis Missouri, 587-595 Hasibuan S., 2004. Prosedur Deteksi Dini dan Diagnosis Kanker Rongga Mulut, Digitized by USU digital library. p.1-7 Shah J.P., Zelefsky M.J., Cancer of Oral Cavity. In: Harrison et al Head and Neck Cancer. A Multidisciplinary Approach. 2nd ed. Lippincott Williams & Wilkins. Philadelphia, 2004, . 266-80 Williams, H.K., 2000 Molecular Pathogenesis of Oral Squamosus Carsinoma, J. Clin Pathol, Mol. Pathol., 53: 165-172 Regezi J.A.; Sciubba J.J. 1999. Oral Pathology. Clinical Pathologic Correlations. 3 rd ed. Philadelphia: WB Saunders Co., 76-90 Revianti S, Parisihni K, 2005, peran Matriks Metalloproteinase (MMP) pada metastasis Karsinoma Sel Skuamosa Rongga Mulut, Jurnal PDGI, Edisi khusus tahun ke-55, 232-236 Liotta L.A., 1993. Principles of Molecular Cell Biology of Cancer: Cancer Metastasis. In: DeVita. Cancer. Principles & Practice of Oncology. 4th ed. Lippincot- Raven. Philadelphia. 134-40 Supriatno, Yuletnawati, 2006. Aktifitas Anti Kanker Cepharantine Pada Kanker Lidah Manusia In Vitro (tinjauan proliferasi, invasi, dan metastasis sel), Majalah Kedokteran Gigi UGM, Jogyakarta, p.141-145 Neville, B.W., Damm, D.D., Alien, C.M., Bouquot I.E. 2002 , Oral and Maxillofacial Pathology, 2nd ed. Philadelphia, WB Saunders Co Praga SM, Dickson RB, Hawkins MJ. Matrix Metalloproteinase inhibitors. J Investigational New Drug, , 15: 61-75 Crawson R.A, Odell E.W, 2008. Cawson’s Essentials Of Oral Pathology And Oral Medicine. Phila Delphia, Churchill Livingstone Elsevier., p.277-284 Epstein J.B, Der Waal I, 2008. Oral Cancer, in : Greenberg M.S, Glick M, Ship J.A., Burket”s Oral Medicine, 11th ed. BC Decker Inc, Hamilton, 153-4 Syafriadi M. Patologi Mullut. Tumor Neoplastik dan Non Neoplastik Rongga Mulut. Yogyakarta, ANDI, 2008: 74-7 Sapp J.P., Eversole, L.R., Wysocki, G.P. 2004. Pathology. 2nd ed. Mosby. St Louis. 134-43 Contemporary Oral and Maxillofacial Sudiono J, Kurniadhi B, Hendrawan A, Djimantoro B. Ilmu Patologi. Jakarta, EGC, 2003: 144-47 Istindiah H.N, Auerkari E.I., 2001, Mekanisme Kontrol Siklus Sel (Suatu tinjauan khusus peran protein regulator pada jalur retinoblastoma (Rb), JKG. UI, 8(1): 39-47 Kumar V, Cotran R.S, Robbins S.L., 2007. Robbins Basic Pathologic, . 7th ed. Jakarta, Penerbit Buku Kedokteran EGC. p.185-224 Fuller GM, Shields D., 1998, Molecular Basis of Medical Cell Bilogy, 1st ed., Appleton & Lange, Connecticut, 106-23 Kumar V, Abbas AK, Fausto N., 2005. Robbins and Cotran Pathologic Basis of Disease. 7th ed. Philadelphia, Elsevier Budiani D.R., Mengenal Ciri-ciri Sel kanker, Sebagai Bekal Dalam Mengkaji Potensi Chemopreventive Suatu Senyawa anti tumor, Available at : http://ccrcfarmasiugm.wordpress.com/2009/03/16/ Diakses (20 mei 2009) Hanahan, D., Weinberg, R.A., 2000, The Hallmarks of Cancer, Cell, 100: 57-70 Sugerman P.B, Savage, NW., 1999, Current Concept in Oral Cancer, ADJ, 44(3): 147-156 Field JK., 1995, The role of Oncogenes and Tumour-Supressor genes In The Aetiology of Oral, Head and Neck Squamous Cell Carsinoma, J.R. Soc. Med., (88); 35-39 Robbins and Cotran, Pathologic Basis of Disease. 7th ed. WB Saunders Co. Philadelphia, 2005: 309-13 Scully, C. 1992. Oncogen, Onco-Supressor, Carcinogenesis and Oral Cancer. British Dental Journal. 173. 53. Sudiana I.K, 2008. Patobiologi Molekuler Kanker, Salemba medika, Jakarta, 53-9 Liotta L.A and Kohn A.C., 2003. Invasion and Metastases. In: Cancer Medicine. 2nd ed. BC Becker Inc. London Kresno S.B., 2002. Angiogenesis dan Metastasis dalam Onkologi., Bagian Pastologi Klinik FKUI, Jakarta McDonnell S, Morgan M, Lignal C. 1999. Role of matrix metalloproteinases in normal and disease processes. Biochem Soc Trans 27:734-40 Birkedal-Hansen H, Moore W.G., Bodden M.K., Windsor L.J., Birkedal-Hansen B, DeCarlo A, Engler JA. 1993. Matrixmetalloproteinases: a review. Crit Rev Oral Biol Med 4:197-250. Motoharu, 2002. The cell surface: the stage for matrix metalloproteinase regulation of migration. Current Opinion in Cell Biology 14: 624-632 Nabeshima K, Inoue T, Shimao Y, Sameshima T. 2004. Matrix metalloproteinases in tumor invasion: Role for cell migration. J.Pathol Int. 52:255-64. Kudo, Yasusei., et al. 2004. Invasion and Metastasis of Oral Cancer Cells Require Methylation of E-Cadherin and/or Degradation of Membranous ß-Catenin. Clinical Cancer Research (10): 5455-5463. John, A, Tuszynski G. 2001. The Role of Matrix Metalloproteinases in Tumor Angiogenesis and Tumor Metastasis. Pathology Oncology Research 7(1):14-23 Stevenson, W.G., et al. 1993. Tumor Cell Interactions with Extracellular Matrix During Invasion and Metastasis. Annu. Rev. Cell. Bio. 9:541-73. Kähäri V.M., Saarialho-Kere U. 1999. Matrix metalloproteinases and their inhibitors in tumour growth and invasion. Ann Med 31: 34-35 Ikebe T, et al. 1999. Gelatinolytic activity of matrix metalloproteinase in tumor tissues correlates with the invasiveness. Clin Exp Metastasis 17:315-323. Holsinger F.C.,. Invasion and Metastases in Head and Neck Cancer. In: Harrison et al. Head and Neck Cancer. A Multidisciplinary Approach. 2nd ed. Lippincott Williams & Wilkins. Philadelphia. 2004: 948-62. Kakizoe, T., 2003, Chemoprevention of Cancer Focusing on Cinical Trial, Nationa Cancer Center, Jpn.J.Clin.Oncol., 33(9): 421-442 Chang, L.C., Kinghorn, A.D., 2001, Flavonoid as Chemopreventive Agent, Boiactive Compound from Natural Sources, Isolation, Characterization and Biological Properties, Tailor & Friends, New York. Surh J.Y, Chun K.S,. 2004. Signal transduction pathways regulating cyclooxygenase-2 expression: potential molecular targets for chemoprevention. Proceedings from the 6th and 7th international conferences, Signal Transduction 2004 and Chromatin 2004, 68(6) p.10891100 Rubnitz JE.Christ WM.Molecular genetics of childhood cancer : implications for pathogenesis, diagnosis, and treatment.pediatrics. 1997; 100 (1): 101-8 Miller RW, Young JL, Novakovic PH. Childhood cancer. Cancer. 1994; 75: 395-405. Sayedmajidi M. squamous cell carcinoma of the tongue in a 13 year old boy. Arch. Iranian. Med. 2008; 11(3): 341-3. Todd R, Hind PW, Munger K, Rustgi AK, Opitz OG, Sulaiman Y. Cell cycle dysregulation in oral cancer. Crit. Rev. oral. Boil. Med. 2002; 13(1): 51-61. Collins K, Jacks T, Pauletich N. the cell cycle on cancer. Proc. Natl. acad. Sci. 1997; 94:2776-8. Lyons JM, Schwimer JE, Anthony CT, Thomson JL, Cundiff JD, Casey DT, et al. The role of VEGF pathways in human physiologic and pathologic angiogenesis. J. Surg.Res. 2010; 159(1): 517-27 Heinzman JM, Brower SL, Bush JE. Comparison of angiogenesis-related factor expression in primary tumor cultures under normal and hypoxic growth condition. Cancer cell Int. 2008: 1-9. Chavakis E, Dimmeler S. Regulation of endothelial cell survival and apoptosis during angiogenesis. Arterioscler. Thromb. Vasc. Biol. 2002; 22(6): 887-93 Fayette J, Soria JC Armand JP. Use of angiogenesis inhibitors in tumour treatment. Eur. J Cancer. 2005; 41(8): 1109-16 Nor JE, Christensen J, Mooney DJ, Polverini PJ. Vascular endothelial growth factor (VEGF)mediated angiogenesis is associated with enhanced endothelial cell survival and indction of Bcl-2 espression. Am. J. pathol. 1999; 154(2): 375-84 Pepetti M, Herman IM. Mechanism of normal and tumor-derived angiogenesis. Am J Physiol Cell Physiol 2002; 282(5): 947-70. Li A, Dubey S, Varney ML, Dave BJ, Singkh RKJ. IL-8 directly enhanced endothelial cell survival, proliferation, and matrix metalloproteinases production and regulated angiogenesis. J Immunol 2003; 170(6): 3369-76. Konno H, Ohta M, Baba M, Suzuki S, Nakamura S. The role of circulating IL-8 and VEGF protein in the progression of gastric cancer. Cancer Sci 2003; 94(8): 735-40. Folkman J. Angiogenesis and apoptosis. Semin Cancer Biol 2003; 13(2): 159-67. Ferrara N. Role of vascular endothelial growth factor in regulation of physiological angiogenesis. Am J Physiol Cell Physiol 2001; 280(6): 1358-66. Terman BI, Stoletov KV. VEGF and tumor angiogenesis. Einstein Quart J Biol and Med 2001; 18: 59-66. ThippeswamyG, Salimath BP. Cricia aromatic extract indices apoptosis and inhibits angiogenesis in ehrlich ascites tumour cells in vivo. myScience 2006;1(1): 79-92. Gaedcke F. Herbal medicine product. New York: CRC Press. 2003. Daley T, Mark D. Nonsquamous cell malignant tumours of the oral cavity. J Canad Dent Assoc 2003; (69); 577-82. Henderson BE. Etiology of cancer: hormonan factors. Dalam: DeVita VD.Cancer Principles and Principles and Practice Oncology.5th Edition. S.l.: Lippincott-Raven Publ, 1997: 219-29. Martinez JD, Parker MT, Fultz KE, Inganteko NA, Gerner EW. Molecular biology of cancer. Dalam: Abraham DJ. Burger’s medicinal chemistry and drugs discovery. 6th Edition. Arizona: John Wiley & Sons 2003: 5-15. Bertram JS. The molecular biology cancer. Mol Aspects Med 2000; 21(6): 167-223. Valko M, Izakovic M, Mazur M, Rhodes CJ, Telser J. The role of oxygen radicals in DNA damage and cancer incidence. Mol Cell Biochem 2004; 266(1-2): 37-56. Lewis B, Cassimeris L, Lingappa VR, Plopper G. Cells. Boston: Jones and Bartlett Publisher 2007: 34-7. Copstead LC, Banasik JL. Patophysiology: biological and behavioural perspectives. Philladelphia: W.B. Saunders Company. 2000: 57-99. Barasch A, Safford M, Eisenberg E. Oral cancer and oral effects of anticancer therapy. Mt. Sinai J Med 1998; 6595-6): 370-7. Ra, Sheemena PM, Sudha S, Nair RG. Squamous carciona of a tongue in 19 year old female. Indian J Cancer 2008: 45(3): 128-30. Usneius T, Urja J, Collan Y. Squamous cell carcinoma of the tongue in children. Cancer 1987; 60: 263-9. Neville BW, Douglass DD, Carl MA, Jerry EB. Oral and maxillofacial pathology. 2nd Edition. London: W.B. Saunders Company, 2002: 486-8. Folkman J. The role of angiogenesis. Semin Oncol 2002; 29 (6): 15-8. Auerbach R, Lewis R, Shinners B, Kubai L, Akhtar N. Angiogenesis assays: a critical overview. Clin Chem 2003; 49(1): 32-40. Gupta MK, Qin RY. Mechanism and its regulation of tumor-induced angiogenesis. World J Gastroenterol 2003; 9(6): 1144-55. Ferrara N. Pathways mediating VEGF-independent tumor angiogenesis. Cytokine Growth Factor Rev 2010; 21(1): 21-6. Singhal S, Vachani A, Antin-Ozerkis A, Kaiser LR, Albelda SM. Prognostic implication of cell cycle, apoptosis, and angiogenesis biomarkers in non-small cell lung cancer: a review. Clin Cancer Res 2005; 11: 3974-86. Yoshida S, Ono M, Shonot T, Izumi H, Ishibashi T, Suzuki H, Kuwano M. Involvement of interleukin-8, vascular endothelial growth factor, and basic fibroblastgrowth factorin tumor necrosis factor alpha-dependent angiogenesis. Mol Cel Biol; 17(7): 4015-23. List AF. Vascular endothelial growth factor signalling pathway as emerging target in hematologic malignancies. The oncologist 2001; (6)5: 24-31. Hoeben A, Landy B, Highley M, Wildiers H, Ooseterom ATV, Bruijn ED. Vascular endothelial growth factor and angiogenesis. Pharmacol Rev 2004; 56: 549-80. Gee MFW, Tsuchida R, Eichler C, Das B, Baruchel S. Vascular endothelial growth factor acts in an autocrine manner in rhabdomysarcoma cell lines and can be inhibited with all-transretinoic acid. Oncogene 2005; 24: 8025-37. Hicklin DJ, Ellis M. Role of vascular endothelial growth factor pathway in tumor growth and angiogenesis. J Clin Oncol 2005; 23(5): 1011-27. Waugh DJJ, Wilson C. The interleukin-8 pathway in cancer. Clin Cancer Res 2000; 60(10): 26325. Sonis SE, Elting LS, Keefe D, Peterson DE, Schubert M, Hauer-Jensen M, et al. Perspective on cancer therapy-induced mucosal injury: pathogenesis, measurement, epidemiology, and consequences for patients. Cancer 2004; 100(9): 1999-2025. Kamboj VP. Herbal medicine. Current Sc 2000; 78(1): 34-6. Balunas MJ, Kinghorn AD. Drug discovery from medical plant.Life Sci 2005; 78(5): 431-41. Rao EV. Drug discovery from plant. Curr Sci 2007; 93(8): 1060-3. Park EJ, Pezzuto JM. Botanicals in cancer chemoprevention. Cancer Metastasis Rev2000; 21(34): 231-55. Kantor Deputi Menegristek Bidang Pendayagunaan dan Pemasyarakatan Ilmu Pengetahuan dan Teknologi. www.warintek.ristek.go.id/pertanian/manggis.pdf Fessenden RJ, Fessenden JS. Kimia Organik. [penerj.]Pudjaatmaka AH. Edisi Ke-3. Jakarta: Penerbit Erlangga, 1990. Tortara G, Melisi D, Ciardiello F. Angiogenesis: a target for cancer therapy. Curr Pharm Des 2004; 10(1): 11-24. Bancroft CC, Chen Z, Dong G, Sunwoo JB, Yeh N,Park C, et al.Coexpression of proangiogenic factors IL-8 and VEGF by human head and neck squamous cell carcinoma involves coactivation by MEK-MAPK and IKK-NFKB signal pathways. Clin Cancer Res 2001; 7(2): 435-42. Sidik. Panduan ekstraksi untuk sediaan herbal. Bandung. Unpad Press, 2007. Suryanto E, Wehentouw F, Raharjo S. Aktivitas penstabilan senyawa oksigen reaktif dari beberapa herbal. J Obat Bahan Alam 2008;1(7): 62-8. Malhotra S, Shakya g, Kumar A, Vanchoecke BW, Cholli AL, Raj HG, et al. Antioxidant, antiinflamatory, and antiinvasive activities of biopolyphenolics.Arkivoc 2008; 6: 119-39. Matsunaga N, Chikaraishi Y, Shimazawa M, Yokota S, Hara H. Vaccinium myrtillus (Bilberry) extract reduce angiogenesis in vitro and in vivo. Evid Based Complement Alternat Med 2010; 7(1): 47-56. Taso AS, Kim ES, Hong WK. Chemopreventive agent in cancer therapy. Cancer Lett 2004; 215(2): 129-40. Mizukami Y, Jo WS, Duerr EM, Gala M, Li J, Zhang X, et al. Induction of interleukin-8 preserves the angiogenesis response in HIF-1alpha-deficient vcolong cancer cells. Nat Med 2005; 11(9): 992-6.