biomarker pencemaran insektisida organofosfat dalam tanah
advertisement
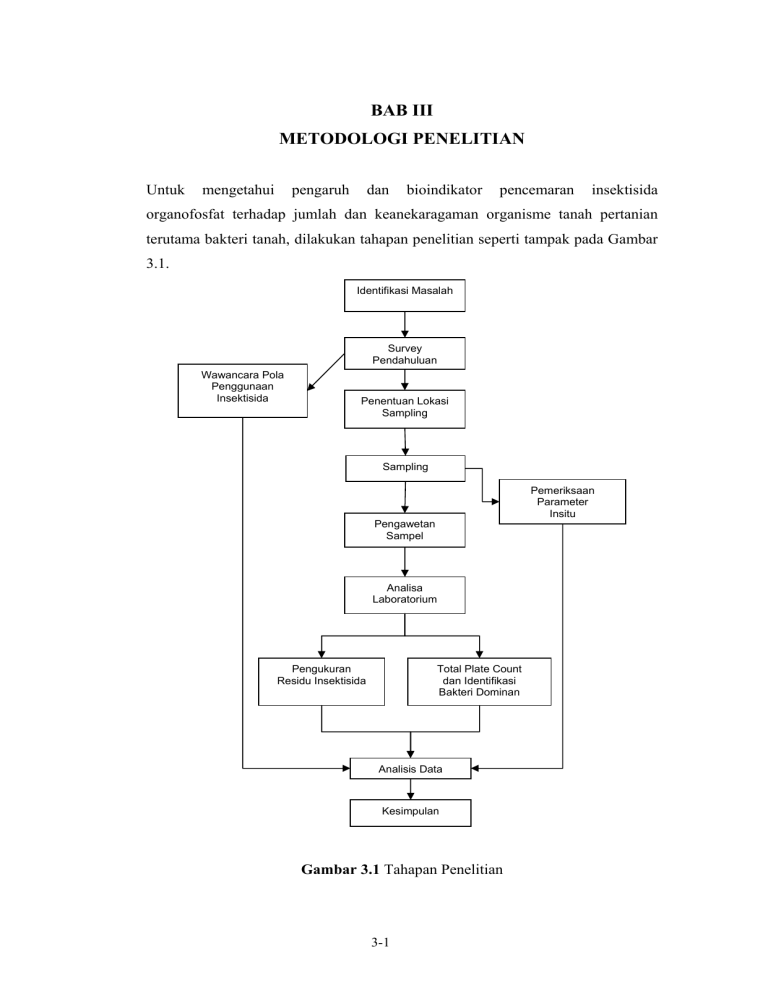
BAB III METODOLOGI PENELITIAN Untuk mengetahui pengaruh dan bioindikator pencemaran insektisida organofosfat terhadap jumlah dan keanekaragaman organisme tanah pertanian terutama bakteri tanah, dilakukan tahapan penelitian seperti tampak pada Gambar 3.1. Identifikasi Masalah Survey Pendahuluan Wawancara Pola Penggunaan Insektisida Penentuan Lokasi Sampling Sampling Pemeriksaan Parameter Insitu Pengawetan Sampel Analisa Laboratorium Pengukuran Residu Insektisida Total Plate Count dan Identifikasi Bakteri Dominan Analisis Data Kesimpulan Gambar 3.1 Tahapan Penelitian 3-1 3-2 3.1 Identifikasi masalah Identifikasi masalah pada penelitian ini dititikberatkan pada kemungkinan timbulnya permasalahan terhadap keanekaragaman bakteri yang terdapat didalam tanah akibat pemaparan insektsida organofosfat dalam tanah pertanian. 3.2 Pemilihan Daerah Studi Dan Pola Pemakaian Penyemprotan Pestisida Daerah yang dijadikan objek penelitian ini diambil dari dua jenis pertanian yaitu pertanian organik dan non organik. Lahan pertanian non organik yang dijadikan objek penelitian berlokasi di daerah lahan pertanian Desa Sukapura, Kecamatan Sukasari, Kabupaten Bandung dan sebagai pembanding pengambilan sampel dilakukan di Pertanian Organik Cisarua Bogor. Perbedaan pada kedua daerah studi ini adalah dari penggunaan insektisida. Pada lahan pertanian di Desa Sukapura digunakan insektisida jenis organofosfat sedangkan pada pertanian organik Cisarua tidak digunakannya insektisida. Identifikasi pola pemakaian insektisida organofosfat di lahan pertanian non organik Desa Sukapura, Kecamatan Sukasari, Kabupaten Bandung dilakukan dengan cara wawancara dengan petani pengolah lahan untuk mengetahui jenis insektisida organofosfat yang digunakan, dosis formulasi dan periode penyiramannya. 3.3 Penentuan Titik Sampling Pengambilan sampel tanah dengan metode acak stratifikasi. Penentuan lokasi dan titik pengambilan sampel tanah berdasarkan pada luas dan kondisi tanah. Pengambilan sampel tanah juga berdasarkan penggunaan lahannya. Titik pengambilan sampelnya dapat dilihat pada Gambar 3.3 dan Gambar 3.4. Untuk menentukan posisi pengambilan sampel tanah (petak lahan) digunakan alat GPS (Global Positioning System) ketelitian posisi alat ini mencapai 20 m. Penentuan titik sampling pemetaan lahan dilakukan dengan menggunakan alat “GPS MAP 60” untuk menentukan posisi bumi batas persil setiap lahan. Setiap 3-3 koordinat bumi dari titik batas persil petak lahan direkam ke dalam memori alat, kemudian ditransfer ke komputer dengan menggunakan program “Expert GPS”. Gambar 3.2 Alat Receiver GPS (GPS MAP 60) Gambar 3.3 Titik Sampling Lahan Desa Sukapura, Kecamatan Kertasari, Kabupaten Bandung 3-4 Gambar 3.4 Titik Sampling Lahan Pertanian Organik 3.4 Pengambilan sampel tanah Sampel tanah diambil pada kedalaman 0-10 cm dengan menggunakan alat ”Soil Sampler”. Sampel tanah yang diambil di lapangan haruslah representatif, artinya sampel tanah tersebut harus dapat mewakili suatu areal atau luasan tertentu. Setelah titik sampling diketahui maka sampel tanah diambil dengan menggunakan botol vial yang steril dan plastik bersegel. Untuk mendapatkan sampel tanah yang representatif digunakan ”Metode Komposit Terganggu”. Satu sampel komposit yang mewakili satu petak lahan, terdiri dari 5 sampel tanah individu, diambil pada permukaan yakni pada kedalaman 0-10 cm. Parameter–parameter seperti temperatur, pH, dan kelembaban, serta cuaca dicatat. Untuk mengambil kelima sampel individu, digunakan metode sistematik (sistem diagonal) seperti ditunjukkan pada Gambar 3.5 dan cara pengambilan sampelnya dapat dilihat pada Gambar 3.6. 3-5 Gambar 3.5 Pengambilan sampel komposit dengan metode sistematik Gambar 3.6 Cara pengambilan sampel dilapangan 3.5 Pengawetan sampel tanah Sampel tanah segar yang diambil diawetkan pada plastik bersegel kemudian disimpan di dalam cool box selama perjalanan dari lapangan ke laboratorium. Di laboratorium, disimpan pada suhu 3-5°C serta diusahakan tidak terpapar sinar matahari. Hal ini dilakukan agar menghambat aktivitas metabolisme dan mencegah terjadinya fotodegradasi serta volitilisasi residu insektisida dari sampel tanah. 3.6 Metode Analisis Residu insektisida organofosfat a. Metode Ekstraksi yang digunakan adalah Metode ekstraksi insektisida dari tanah yang digunakan adalah Metode Shaker. Metode ini adalah penyederhanaan dari Metode 5-1 yang dibakukan oleh Komisi Pestisida 3-6 pada tahun 1997, sebagai metode standar untuk menganalisis multiresidu pestisida organoklor dan organofosfat dalam berbagai matriks hasil pertanian. Validitas dan reabilitas dari metode yang disederhanakan ini dapat diuji dengan membuat recovery sample atau sampel yang diperkaya, untuk mendapatkan nilai perolehan kembali. Prinsip kerjanya adalah Residu senyawa organofosfat dari cuplikan tanah diekstraksi dengan pelarut organik aseton. Residu terlarut dibersihkan secara kromatografi pada kolom kromatografi Florisil, dielusi dengan campuran n-heksan dan aseton. Setelah dipekatkan, residu dalam eluat ditetapkan secara kromatografi gas. b. Metode Analisis Gas Kromatografi atau Chromatograph Gas (CG) Konsentrasi residu dihitung dengan cara mengukur puncak kromatogram. Analisis kuantitatif ini dilakukan dengan membandingkan tinggi atau luas puncak kromatogram dari senyawa klorpirifos yang dianalisis dengan tinggi atau luas puncak kromatogram dari reference atau standar baku kemudian dimasukkan rumus perhitungan (Komisi Pestisida, 1997): Tinggi contoh vol. sampel terekstraksi × konsentrasi standar × Tinggi standar berat contoh Analisis kromatografi gas dilakukan di Laboratorium Residu Bahan Agro Kima, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian, Bogor. Gambar 3.7 Gas Kromatografi 3-7 3.7 Analisis Sifat Fisik – Kimia Tanah Pengukuran pH dan temperatur dan juga kadar air pada titik pengambilan sampel. Untuk mengetahui kemungkinan insektisida organofosfat terdegradasi dalam tanah dan juga kondisi lingkungan yang mendukung pertumbuhan bakteri. 3.8 Perhitungan Total plate count bakteri tanah Perhitungan koloni dilakukan dengan cara lempeng pembiakan (Plate Count). Hasil hitungan yang dapat dianggap adalah 30 – 300 koloni pada setiap lempeng pembiakan dengan tingkat pengenceran tertentu (Usman, 1986). Sedangkan menurut Salle (1961), perhitungan dengan menggunakan plate count beragam dari 200.000 hingga 100.000.000 per gram tanah. Perhitungan Total Plate Count dilakukan dengan cara menghitung jumlah koloni yang tumbuh diambil pada pengenceran yang menghasilkan jumlah koloni dengan rentang 30-300sampel. Caranya 1 gram sampel tanah yang telah diambil diencerkan dalam beberapa tingkat pengenceran. Kemudian dari masing-masing pengenceran tersebut diambil dalam jumlah tertentu kemudian ditanam pada media pertumbuhan. Gambar 3.8 merupakan cara pengenceran penanaman pada agar cawan petri dan untuk perhitungan menggunakan colony counter yang dapat dilihat pada Gambar 3.9. 3-8 Gambar 3.8 Prosedur pengenceran penanaman pada agar cawan petri Gambar 3.9 Colony Counter 3-9 3.9 Identifikasi Bakteri Tanah Sistem identifikasi bakteri adalah kunci untuk mengatur sifat-sifat bakteri dalam suatu cara sehingga memudahkan identifikasi oganisme secara efisien. Sistem identifikasi yang ideal sebaiknya mengandung sesedikit mungkin gambaran yang diperlukan untuk diagnosis yang tepat. Kelompok-kelompok dipecahkan menjadi sub kelompok atas dasar ada (+) atau tidaknya (-) spora. Proses yang berkelanjutan mengenai berbagai macam mikroorganisme, menuntun para peneliti sampai kepada sub kelompok terkecil yang terdiri dari organisme yang telah dianalisis. Pada tahap awal proses ini, organisme ditetapkan menjadi sub kelompok berdasarkan ciri khas yang tidak memperlihatkan hubungan simbiosis. Isolasi langsung dengan menggunakan nutrient agar (NA) dilakukan sebelum identifikasi bakteri dominan dalam tanah. Caranya sampel tanah diencerkan lalu ditanam pada media nutrient agar. Setelah diperoleh koloni yang mampu hidup pada media, maka setiap koloni yang diperoleh diisolasi dengan memperhatikan morfologi dari koloni yang tumbuh. Koloni-koloni yang tumbuh dominan ditanam kembali pada media nutrien agar dalam cawan petri dengan teknik menggores (streak plate). Isolasi ini dilakukan beberapa kali. Setelah beberapa kali pengulangan ditemukan isolat murni dari bakteri tanah tersebut. Tahap isolasi merupakan tahap pemurnian dimana tujuannya adalah agar diperoleh koloni bakteri murni yang tidak dikontaminasi oleh koloni lain. Setelah isolasi dilakukan dilanjutkan dengan identifikasi isolat. Penyimpanan koloni bakteri dilakukan pada suhu 40C dan siap untuk digunakan pada pengujian selanjutnya. Identifikasi bakteri dilakukan terhadap isolat isolat yang diperoleh dengan berpedoman pada buku Bergey’s determinative bacteriology (Holt, 1994) dan Manual For The Identification Of Medical Bacteria (Cowan, 1974) dengan melakukan serangkaian uji morfologi dan biokimia yaitu uji pewarnaan Gram, uji motilitas, pengamatan bentuk sel, kemampuan tumbuh pada suhu 50C, 200C, dan 300C. Pengamatan dilakukan juga pada warna koloni, ukuran koloni, bentuk koloni, untuk menentukan jenis dari bakteri tanah tersebut. 3-10 Gambar 3.10 Uji Biokimia 3.10 Analisis Analisis dilakukan terdahap residu insektisida organofosfat didalam tanah kemudian dari hasil pengukuran residu insektisida organofosfat dan hasil perhitungan total plate count serta jenis bakteri dominan yang berada dalam tanah dilakukan analisa pengaruh dari insektisida organofosfat terhadap organisme terutama bakteri dalam tanah dan juga membandingkan jumlah total bakteri sesuai dengan pengunaan tata guna lahan serta menentukan bioindikator berdasarkan hasil dari penelitian dan studi literatur.











