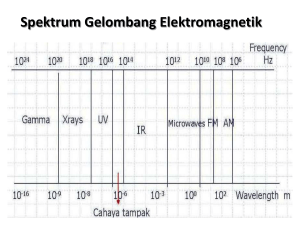
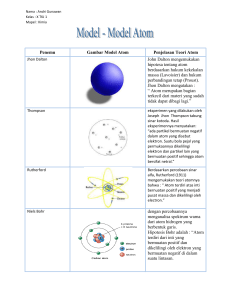
teori atom niels bohr
advertisement

Isi Teori Niels Bohr Gambar Niels Bohr dan Model Atom Niels Bohr Kelebihan Niels Bohr Kelompok 3 : Wahyu Trifandi Octa Cyntya Dewi Syarifah Aini Yayu Purnamasari Dini Andriani Kekurangan Niels Bohr Shella Satiwi Guci Dian Apriliya KELUAR Isi Teori Niels Bohr Gambar Niels Bohr dan Model Atom Niels Bohr Kelebihan Niels Bohr Kekurangan Niels Bohr Di dalam fisika atom, model Bohr adalah model atom yang diperkenalkan oleh Niels Bohr pada 1913 Model ini menggambarkan atom sebagai sebuah inti kecil bermuatan positif yang dikelilingi oleh elektron yang bergerak dalam orbit sirkular mengelilingi inti mirip sistem tata surya, tetapi peran gaya gravitasi digantikan oleh gaya elektrostatik. Model ini adalah pengembangan dari model puding rem(1904), model Saturnian (1904), dan model Rutherford (1911). Karena model Bohr adalah pengembangan dari model Rutherford, banyak sumber mengkombinasikan kedua nama dalam penyebutannya menjadi model Rutherford-Bohr. Isi Teori Niels Bohr Gambar Niels Bohr dan Model Atom Niels Bohr Kelebihan Niels Bohr Kekurangan Niels Bohr Bohr adalah orang pertama di dunia yang menerapkan teori kuantum untuk mengatasi problem struktur atom. Ia menggunakan teori berkas cahaya Planck dan model atom Rutherfrod untuk menjelaskan cahaya yang muncul pada atom hydrogen. Menurut Bohr, electron menggelilingi inti pada orbit tertentu. Di dalam atom terdapat orbit luar dan orbit dalam. Orbit dalam adalah orbit electron didekat inti Orbit luar dapat menampung lebih banyak electron. Elektron pada orbit luar menentukan sifat-sifat kimia atom.Kadang-kadang electron pada orbit luar melompat ke orbit dalam. Pada waktu melompat electron itu mengeluarkan cahaya. Isi Teori Niels Bohr Niels Bohr mengusulkan, pada 1913, apa Gambar Niels Bohr dan Model Atom Niels Bohr Kelebihan Niels Bohr Kekurangan Niels Bohr yang sekarang disebut model atom Bohr. Gagasan itu adalah 1. Dalam elektron terdapat lintasanlintasan tertentu tempat elektron dapat mengorbit inti tanpa disertai pemancaran atau menyerap energi. lintasan itu, yang juga disebut kulit atom, adalah orbit berbentuk lingkaran dengan jari-jari tertentu. Setiap lintasan ditandai dengan satu bilangan bulat yang disebut bilangan kuantum utama (n), mulai dari 1, 2, 3, 4, dan seterusnya, yang dinyatakan dengan lambang K, L, M, N, dan seterusnya. Lintasan pertama, dengan n = 1, dinamai kulit K, dan seterusnya Isi Teori Niels Bohr Gambar Niels Bohr dan Model Atom Niels Bohr Kelebihan Niels Bohr Kekurangan Niels Bohr Kunci sukses model ini adalah dalam menjelaskan formula Rydberg mengenai garis-garis emisi spektral atom hidrogen; walaupun formula Rydberg sudah dikenal secara eksperimental, tetapi tidak pernah mendapatkan landasan teoretis sebelum model Bohr diperkenalkan. Tidak hanya karena model Bohr menjelaskan alasan untuk struktur formula Rydberg, ia juga memberikan justifikasi hasil empirisnya dalam hal suku-suku konstanta fisika fundamental. Model Bohr adalah sebuah model primitif mengenai atom hidrogen. Sebagai sebuah teori, model Bohr dapat dianggap sebagai sebuah pendekatan orde pertama dari atom hidrogen menggunakan mekanika kuantum yang lebih umum dan akurat, dan dengan demikian dapat dianggap sebagai model yang telah usang. Namun demikian, karena kesederhanaannya, dan hasil yang tepat untuk sebuah sistem tertentu, model Bohr tetap diajarkan sebagai pengenalan pada mekanika kuantum. Isi Teori Niels Bohr Gambar Niels Bohr dan Model Atom Niels Bohr Kelebihan Niels Bohr Kekurangan Niels Bohr 2. Elektron hanya boleh berada pada lintasan-lintasan yang diperbolehkan (lintasan yang ada), dan tidak boleh berada di antara dua lintasan. lintasan yang akan ditempati oleh elektron bergantung pada energinya. pada keadaan normal (tanpa pengaruh luar), elektron menempati tingkat energi terendah. keadaan seperti itu disebut tingkat dasar (ground state). 3. Elektron dapat berpindah dari satu kulit ke kulit lain disertai pemancaran atau penyerapan sejumlah tertentu energi. perpindahan elektron ke kulit lebih dalam akan disertai penyerapan energi. sebaliknya, perpindahan elektron ke kulit lebih dalam akan disertai pelepasan energi. Isi Teori Niels Bohr Gambar Niels Bohr dan Model Atom Niels Bohr Kelebihan Niels Bohr Kekurangan Niels Bohr a. Elektron-elektron dalam atom hanya dapat melintasi lintasanlintasan tertentu yang disebut kulitkulit atau tingkattingkat energi, yaitu lintasan di mana elektron berada pada keadaan stationer, artinya tidak memancarkan energi. b. Kedudukan elektron dalam kulitkulit, tingkat-tingkat energi dapat disamakan dengan kedudukan seseorang yang berada pada anakanak tangga. Seseorang hanya dapat berada pada anak tangga pertama, kedua,ketiga, dan seterusnya, tetapi ia tidak mungkin berada di antara anak tangga-anak tangga tersebut. Isi Teori Niels Bohr Gambar Niels Bohr dan Model Atom Niels Bohr Kelebihan Niels Bohr Kekurangan Niels Bohr Atom terdiri dari inti yang bermuatan positif dan dikelilingi oleh elektron yang bermuatan negatif di dalam suatu lintasan. 2. Elektron yang bergerak tidak melepas dan tidak menyerap energi. 3. Elektron bergerak pada lintasan tertentu dan lintasannya diberi nomor 1, 2, 3, ….. Dan diberi lambang K, L, M, ….. 4. Elektron dapat berpindah dari satu lintasan ke lintasan lain dengan cara melepas dan menyerap energi. 1. Isi Teori Niels Bohr Gambar Niels Bohr dan Model Atom Niels Bohr Kelebihan Niels Bohr Kekurangan Niels Bohr Gambar dari Niels Bohr Isi Teori Niels Bohr Model Atom Niels Bohr Gambar Niels Bohr dan Model Atom Niels Bohr Kelebihan Niels Bohr Kekurangan Niels Bohr Model Atom Bohrs Konfigurasi Elektron menurut Bohrs Memancarkan energi dari n besar ke n kecil Menyerap energi ,dari n kecil ke n besar Foton n=1 n=2 n=3 n=4 Isi Teori Niels Bohr Gambar Niels Bohr dan Model Atom Niels Bohr Kelebihan Niels Bohr Kekurangan Niels Bohr Kelebihan Niels Bohr Kelebihan atom Bohr adalah bahwa atom terdiri dari beberapa kulit untuk tempat berpindahnya elektron. 1. Elektron tidak mengorbit mengelilingi inti melalui sembarang lintasan, tp hanya melalui lintasan tertentu dengan momentum sudut tertentu tanpa melepaskan energi (= Lintasan Stasioner ) 2. Elektron dapat berpindah hanya dengan melepaskan dan menyerap energi sebesar hf (energi foton) Isi Teori Niels Bohr Kelemahan Niel Bohr Kelemahan model atom ini adalah: tidak dapat Gambar Niels Bohr dan Model Atom Niels Bohr Kelebihan Niels Bohr Kekurangan Niels Bohr menjelaskan spekrum warna dari atom berelektron banyak. Sehingga diperlukan model atom yang lebih sempurna dari model 1. Lintasan electron yg sebenarnya, masih mempunyai sub kulit orbital bukan hanya berupa lingkaran, jadi tidak sesederhana teori Bohr 2. Model atom Bohr hanya dapat menerangkan model atom hydrogen, belum dapat menerangkan model atom berelektron banyak 3. Teori Bohr tidak dapat menerangkan kejadiankejadian dalam kimia dengan baik, termasuk pengaruh medan magnetik terhadap atom Bohr. Atom terdiri dari inti yang bermuatan positif dan dikelilingi oleh elektron yang bermuatan negatif di dalam suatu lintasan. Elektron dapat berpindah dari satu lintasan ke yang lain dengan menyerap atau memancarkan energi sehingga energi elektron atom itu tidak akan berkurang. Isi Teori Niels Bohr Gambar Niels Bohr dan Model Atom Niels Bohr Kelebihan Niels Bohr Kekurangan Niels Bohr Kelemahan Niel Bohr kelemahannya ini tidak diketahui saat Bohr menemukan teori spektrum, tetapi kelemannya teori Bohr ini diketahui setelah beberapa ahli mengemukakan penelitiannya lebih lanjut. Berikut ini beberapa ilmuan yang dianggap sebagai penyempurna teori atom Niels Bohr : a. Werner Heisenberg ==> menurut teori ketidak pastian Werner Heisenberg, kecepatan dan kedudukan elektron adalah suatu ketidakpastian, kedudukan elektron makin melenceng ketika kecepatannya meningkat b. Erwin Schordinger ==> elektron-elektron melaju dalam lintasan-lintasan dalam kecepatan tertentu dimana lintasan tersebut yang dinamakan orbital c. Summer Field ==> elektron tidak ditentukan oleh kuantum utamanya saja. Kedudukan elektron pada atom ditentukan oleh 4 bilangan kuantum