Ruang Lingkp Kimia
advertisement

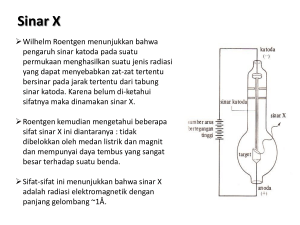
Kimia Kun Sri Budiasih Silabus Mata Kuliah KIMIA Tinjauan Umum Struktur Atom Ikatan Kimia Larutan dan Campuran Perhitungan Kimia Kimia Dalam Lingkungan Kimia dalam sistem hidup Materi Khusus: Kimia dalam metabolisme tubuh Kimia dalam bahan obat dan analisa khusus. Tinjauan Umum Luasnya penggunaan Kimia OBAT & KESEHATAN BAHAN PANGAN BAHAN BANGUNAN HOBI & HIBURAN ELEKTRONIKA KIMIA ENERGI (minyak-nuklir) TEKNOLOGI POLIMER PERTANIAN GENETIKA Dunia tersusun oleh unsur kimia Unsur (104): 92 alami, 22 buatan unsur: 11 gas, 2 cair, sisanya padat Di alam: Tdk murni Dalam kerak bumi:46% O, 28 % Si,8 % Al,(,5% Fe,3,5% Ca, Sisa : dll. Dalam tubuh manusia: 65% O, 18%C,10%H,3%N,2%Ca,1% P, 1% dll. Di atmosfer; 78% N, 20%O,1% Ar, sisa : dll Sebagian besar unsur adalah logam Logam: Tl, Td >, Penghantar listrik, rapatan>, dengan udara membentuk oksida, Mengion +, Membentuk paduan (Zn/Cu kuningan), alkali: reaktif, Al : air menajdi basa. Non logam: Halogen : beracun C: bahan hidup gas mulia : inert Bagian – Bagian Ilmu Kimia Ilmu Kimia Kimia Anorganik Kimia Analitik Kimia Organik Radiokimia Mineralogi Sintesa bahan anorganik Metodologi Analisis Instrumentasi Aplikasi Biokimia Kimia farmasi Bahan Alam Sintesa bahan organik Ilmu Kimia Material Dasar : Atom Teori Atom Dalton (1808). Setiap materi atau zat tersusun oleh partilkel-pertikel terkecil yang tak dapat lagi, yang disebut atom. Suatu unsur adalah materi tunggal yang tersusun oleh atom-atom sejenis. Setiap atom dari unsur yang sama memiliki massa dan komposisi yang sama, khas dan berbeda dari atom unsur lain. Atom-atom dari unsur yang berbeda dapat bergabung membentuk senyawa dengan pola perbandingan yang sederhana. Contoh, gabungan dari H dan O membentuk H2O dan H2O2. Teori Atom Thomson dan Rutherford Thomson Atom adalah sebuah bola awan bermuatan positif, dengan sejumlah partikel bermuatan negatif (yang disebut elektron) menempel pada permukaannya. Jumlah muatan positif = negatif. Seperti kue kismis. Bagaimana susunan partikel bermuatan yang terdapat dalam atom? Benarkah menyebar begitu saja seperti kismis atau onde-onde? ⇓⇓⇓ Ernest Rutherford (Ahli fisika Inggris ) Atom merupakan sebuah bola yang memiliki sebagian besar rongga hampa, dan muatan positifnya terpusat pada pusat bola dan muatan negatif berada di sekelilingnya. Inti atom mengandung hampir semua masa atom namun hanya menempati bagian yang sangat kecil dari atom. Diameter inti atom hanya sekitar 1 × 1014 m atau sekitar 1/100,000 dari diameter atom keseluruhan. Jika sebuah atom diperbesar sebesar stadion sepakbola, inti atomnya hanya sebesar buah anggur Muatan positif setiap atom adalah unik, berbeda satu sama lain. Jumlah elektronnya = muatan positifnya sehingga setiap atom bersifat netral. Teori Atom Bohr dan Schrodinger Niels Bohr : Elektron harus bergerak dalam orbit yang berbentuk lingkaran dan hanya dapat menempati orbit-orbit / lintasan tertentu yang diperbolehkan yang disebut orbit stasioner. Di posisi ini elektron tidak memancarkan energi sehingga tidak kehilangan energinya sehingga tak kuatir jatuh ke dalam inti. Elektron dapat berpindah dari orbit satu ke orbit lain, dengan menyerap atau memancarkan energi . ⇓⇓⇓ Schrodinger : Dalam atom, elektron tidaklah mengorbit inti atom tetapi berkelakuan seperti gelombang pada jarak tertentu dengan energi tertentu di sekitar inti. Dengan pendapat ini, ilmuwan tak lagi mencari lintasan elektron, melainkan menggunakan persamaan matematika untuk menentukan posisi area yang menunjukkan kemungkinan/kebolehjadian elektron akan ditemukan. Gambaran Atom Menurut Para Ilmuwan Model Bohr &Schrodinger