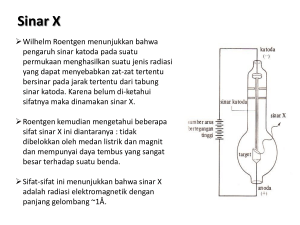
Ikatan kimia
advertisement

Materi: Subtansi yang tersusun atas beberapa zat yang memiliki masa dan menempati ruang. Klasifikasi materi: Zat tunggal: o materi yang mempunya sifat dan komposisi sama di seluruh bagiannya o Terdiri dari unsur dan senyawa Campuran: o materi yang terbentuk dari campuran dua zat tunggal atau lebih dengan komposisi yang bervariasi o Sifat & karakteristik campuran tergantung dari sifat zat tunggal penyusunnya Unsur: o Materi yang tidak dapat diuraikan dengan reaksi kimia menjadi zat yang lebih sederhana o Contoh: Hidrogen (H), Besi (Fe), dll Senyawa: materi yang terbentuk dari dua unsur atau lebih dengan perbandingan tertentu Contoh: air (H2O), NaCl, dll Hukum Perbandingan Tetap (Hukum Proust) Perbandingan massa unsur dalam suatu senyawa adalah tertentu dan tetap Contoh: o Perbandingan massa hidogen : oksigen dalam air = 1 : 8 o Perbandingan massa magnesium : oksigen dalam magnesium oksida = 3 : 2 Campuran Terbentuk dari dua atau lebih zat yang masih mempunyai sifat asalnya Misal: larutan gula, Campuran dapat dibedakan : o Campuran homogen: penggabungan dua zat tunggal atau lebih yang semua partikelnya merata sehingga membentuk satu fasa. contoh: campuran air dan gula o Campuran heterogen: penggabungan yang tidak merata dari dua zat tunggal atau lebih contoh: campuran air dan minyak TEORI ATOM Leucippos dan Demokritos Bagian terkecil suatu zat yang tidak dapat dibagi lagi o John Dalton Partikel-partikel terkecil yang terdapat dalam zat Tidak dapat diuraikan dan tidak dapat diubah menjadi atom lain o JJ. Thomson Merupakan bola pejal, didalamnya tersebar proton dan elektron Muatan posirif = muatan negatif o Rutherford Terdiri dari inti atom yang merupakan pusat massa dan bermuatan positif, sedang elektron yang bermuatan negatif berputar mengelilingi inti atom o Niels Bohr Terdiri dari inti atom yang merupakan pusat massa dan bermuatan positif, sedang elektron yang bermuatan negatif berputar mengelilingi inti atom pada tingkat energi (lintasan) tertentu o Louis de Broglie Terdiri dari inti atom yang merupakan pusat massa dan bermuatan positif, sedang elektron yang bermuatan negatif berputar mengelilingi inti atom pada orbitalnya DALTON : Atom yang terikat berbeda harus terikat bersamasama dengan kombinasi yang spesifik. suatu perubahan kimia dapat terjadi karena penggabungan,pemisahan atau pengaturan kembali atom-atom penyusun zat yang bereaksi. Ikatan kimia : gaya untuk mempertahankan susunan (kombinasi) Perbedaan ikatan kimia dapat menentukan sifat zat . Contoh : Garam padat Air cair IKATAN KIMIA Menurut teroi atom Dalton, suatu perubahan kimia dapat terjadi karena penggabungan, pemisahan atau pengaturan kembali atom-atom penyusun zat-zat yang bereaksi. Gabungan atom-atom tersebut selanjutnya dikenal sebagai molekul. Molekul ini akan menyusun suatu zat. PERANAN ELEKTRON DALAM MOLEKUL Apabila terjadi interaksi antara dua atom maka akan terjadi perubahan susunan elektron dalam masing-masing atom. Perubahan ini dapat mengakibatkan terjadinya tarik menarik antara kedua atom tersebut sehingga atom-atom akan bergabung satu dengan yang lain MACAM-MACAM IKATAN KIMIA 1. 2. 3. Ikatan ionik Ikatan kovalen Ikatan kimia yang lain IKATAN IONIK Ikatan ini terbentuk bila salah satu atom yang bergabung melepaskan elektron yang membentuk ion positif selanjutnya elektron tersebut di tangkap oleh atom yang lain sehingga terbentuk ion negatif. Antara ion positif dengan ion negatif yang terbentuk akan terjadi gaya tarik menarik elektrostatik. Ikatan ionik antara 2 atom dalam sutu molekul dapat terbentuk bila salah satu atom tersebut melepaskan elektron dan atom lain mempunyai kemampuan yang cukup tinggi untuk menangkap elektron yang dilepaskan oleh atom pertama. Hal ini terjadi : Bila atom yang pertama memiliki potensial ionisasi rendah, sehingga bersifat mudah melepaskan elektronnya. Sedang atom kedua harus memiliki afinitas selektron yang cukup besar untuk menangkap elektron tersebut. Pada ikatan ion ikatan antara dua atom, atom yang satu melepaskan e- membentuk ion (+) dan atom yang lain mempunyai kemampuan menangkap emembentuk ion (-). NaCl Kristal putih 11 P + 12 n 11 P + 12 n + 10 P + 10 n 11 P + 17 P + 11 P + 17 P + 12 n 18 n 12 n 18 n IKATAN KOVALEN Ikatan ini terjadi karena penggunaan bersama (sharing) satu pasang atau lebih elektron. penggunaan bersama pasangan elektron ini dapat terjadi karena atom-atom penyusun menjadi lebih stabil. Terjadi pada unsur dengan selisih elektronegativitas kecil atau sama Contoh: H2, Cl2, O2 IKATAN KIMIA YANG LAIN Ikatan logam Ikatan antar atom dalam suatu unsur logam Terjadi akibat adanya interaksi antar ion logam dengan elektron yang bergerak bebas Contoh: ikatan logam pada logamlogam alkali (seperti Na) Ikatan hidrogen Ikatan antar molekul yang mengandung atom H dengan atom lain yang sangat elektronegatif (F, N, O) Contoh: H2O, NH3, HF Ikatan Van Der Waals Ikatan yang terjadi akibat gaya tarik menarik antara molekulmolekul sangan lemah Contoh: uap air