Pengaruh yogurt sinbiotik berbasis probiotik lokal terhadap
advertisement

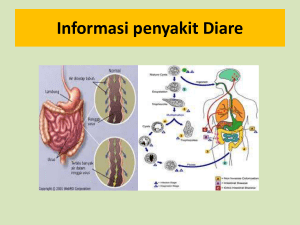
II.TINJAUAN PUSTAKA 2.1 Mikrobiota di dalam Saluran Pencernaan Mikrobiota dalam saluran pencernaan manusia terdiri dari populasi mikroorganisme yang kompleks. Populasi bakteri pada usus besar sangat banyak, mencapai 1012 cfu/g. Pada usus halus jumlah bakteri lebih sedikit yaitu berkisar antara 104-108 cfu/g dan pada lambung hanya sekitar 101102 cfu/g. Jumlah bakteri yang sedikit pada lambung disebabkan karena pH lambung yang rendah (Hoier 1992). Bakteri dalam saluran pencernaan diklasifikasikan menjadi tiga kategori berdasarkan pengaruhnya terhadap kesehatan manusia yaitu bakteri yang menguntungkan, bakteri yang berbahaya, dan bakteri netral. Bakteri yang menguntungkan di antaranya adalah bakteri yang berasal dari genus Bifidobacteria dan Lactobacillus. Bakteri yang berbahaya yaitu Escherichia coli, Clostridium, Proteus, dan golongan Bacteroides. Bakteri ini menghasilkan berbagai macam substansi yang membahayakan di antaranya amina, indol, hidrogen sulfida, atau fenol dari komponen makanan dan dapat menyebabkan gangguan pada sistem pencernaan bahkan dapat bersifat patogenik (Ishibashi & Shimmamura 1993). Oleh sebab itu, keseimbangan mikrobiota dalam saluran pencernaan perlu dijaga. Tubuh kita memiliki mekanisme untuk mengontrol pertumbuhan bakteri yaitu melalui produksi asam lambung, sekresi enzim-enzim dalam saluran pencernaan seperti enzim-enzim protease (pepsin, tripsin, kemotripsin, dan lizozim) yang berasal dari usus halus dan pankreas, mengeluarkan garam empedu, serta mensekresikan peptida yang bersifat bakterisidal dan IgA dari usus (Lakewille et al. 2007). Selain hal tersebut, kompetisi bakteri dalam menempati mukosa usus juga sangat mempengaruhi kesimbangan mikrobiota dalam saluran pencernaan. Kemampuan bakteri baik dalam menempati mukosa usus sangat diharapkan untuk mencegah bakteri yang berbahaya bagi tubuh melekat pada permukaan usus. Bifidobacteria dan Lactobacillus mampu menghambat pertumbuhan bakteri patogen melalui kemampuannya dalam berkompetisi dengan bakteri patogen pada permukaan usus, memproduksi asam laktat dan asam asetat, serta komponen organik lain, seperti H2O2 dan peptida antimikroba (Lakewille et al. 2007). 2.2 Diare Definisi diare menurut WHO (2010) adalah kondisi tubuh yang mengeluarkan air besar tiga kali atau lebih dalam satu hari, lebih dari frekuensi normal individu tersebut. Biasanya merupakan gejala infeksi penyakit gastrointestinal yang dapat disebabkan oleh berbagai macam bakteri, virus, dan organisme parasit. Penyebaran penyakit ini melalui makanan atau minuman yang terkontaminasi, atau dari manusia ke manusia yang kondisi sanitasinya buruk. Berdasarkan lama terjadinya diare, diare diklasifikasikan menjadi dua kategori yaitu diare akut dan diare kronis. Diare akut adalah diare yang terjadi kurang dari dua minggu, sedangkan diare kronis yaitu diare yang terjadi lebih dari empat minggu. Kondisi tubuh ketika mengalami diare awalnya dikategorikan sebagai diare akut dan biasanya disebabkan oleh infeksi virus, bakteri atau 3 parasit, perubahan konsumsi obat yang mendadak, dan ketidakmampuan tubuh dalam menerima suatu makanan tertentu, contohnya konsumsi buah atau kacang-kacangan dalam jumlah terlalu banyak. Diare akut yang mengeluarkan darah dapat menyebabkan ischemia, diverticulitis, atau inflammatory bowel disease. Virus yang biasanya menyebabkan diare ini adalah norwalk virus dan rotavirus. Toksigenik diare dapat disebabkan oleh tiga hal, yaitu karena mengonsumsi makanan yang telah terkontaminasi enterotoksin yang berasal dari Staphylococcus aureus, Bacillus cereus, atau Clostridium perfringens; karena mengonsumsi makanan yang terkontaminasi bakteri E. coli, Clostridium difficile, Vibrio cholerae, Clostridium botulinum, atau Vibrio parahaemolyticus, kemudian bakteri ini mengeluarkan enterotoksin di dalam tubuh yang dapat menyebabkan infeksi gastroenteritis; serta karena diare invasif yang disebabkan oleh Shigella, Salmonella, Campylobacter, atau Yersinia (Merck 2010). Diare kronis diklasifikasikan menjadi tiga yaitu diare berair, diare berdarah, dan diare berlemak. Diare berair disebabkan oleh benda asing yang dapat menstimulasi keluarnya cairan dan elektrolit pada saluran pencernaan. Diare berdarah adalah diare yang ditandai oleh feses yang mengandung darah dan leukosit yang disebabkan oleh adanya infeksi dan inflamasi pada jaringan mukosa usus halus dan usus besar, biasanya karena infeksi Campylobacter jejuni, C. difficile, Yersinia enterocolitica, cytomegalovirus, dan Entamoeba histolytica. Diare ini dapat menyebabkan penyakit Crohn’s dan carcinoma colitis. Diare berlemak yaitu diare karena ketidakmampuan untuk mencerna atau mengabsorpsi lemak dalam suatu makanan, yang menyebabkan feses keluar dalam bentuk besar, berbau busuk, dan mengandung droplet lemak (Merck 2010). 2.3 Escherichia coli penyebab diare Eschericia coli merupakan anggota mikrobiota usus yang paling dikenal pada saluran pencernaan manusia. Varietas E. coli yang dapat menyebabkan diare dinamakan sebagai pathotypes, termasuk di antaranya enterotoxigenic, enteroinvasive, enteropathogenic, dan enterohemorrhagic E. coli. Individual strain pathotypes memiliki perbedaan sekumpulan virulensi yaitu karakteristik yang ditentukan secara klinis, patologi, dan ciri epidemologi dari penyakit yang ditimbulkannya (Brownie dan Hartland 2002). Escherichia coli enterotoxigenic merupakan penyebab utama dari travelers diarrhea dan diare pada bayi yang berada pada negara-negara berkembang. Enteroinvansive menyebabkan disentri, Enteropathogenic penyebab penting diare pada bayi, dan enterohemorrhagic penyebab hemorrhagic colitis dan hemolytic uremic syndrome (Jay et al. 2005). EPEC melekat pada permukaan mukosa usus dan menyebabkan terjadinya perubahan struktur sel. EPEC kemudian melakukan invasi menembus sel mukosa. Pada dosis 10 5-1010 sel, EPEC dapat menyebabkan diare (Sussman 1997). EPEC melekat pada sel mukosa yang kecil. Infeksi EPEC yang melibatkan gen EPEC adherence factor (EAF) menyebabkan perubahan konsentrasi kalsium interseluler dan arsitektur sitoskleton di bawah membran mikrovilus. EPEC menyebabkan diare melalui molekular kolonisasi pada sel usus. EPEC memiliki sedikit fibria, menghasilkan sitotoksin, dan menggunakan adhesin yang dikenal sebagi intimin untuk mengikat inang sel usus. Sel EPEC tersebut invasif jika memasuki sel inang dan menyebabkan radang (Collier 1998). Tanda-tanda infeksi yang disebabkan oleh E. coli dimulai kira-kira tujuh hari setelah seseorang terinfeksi oleh bakteri. Tanda awal adalah kram pada bagian perut yang hebat. Setelah beberapa jam, diare berair dimulai. Diare akan menyebabkan tubuh kehilangan cairan dan elektrolit sehingga penderita mengalami dehidrasi, sakit dan lemas. Infeksi ini menyebabkan usus besar penderita mengalami infeksi bahkan dapat menyebabkan diare berdarah. Diare berdarah dapat 4 berlangsung selama 2 hingga 5 hari. Penderita juga dapat mengalami pergerakan isi perut selama sepuluh kali atau lebih dan dapat juga mengalami pusing (Kelly 2006). 2.4 Yogurt Menurut Standar Nasional Indonesia (2009), yogurt merupakan produk yang diperoleh dari fermentasi susu atau susu rekonstitusi dengan menggunakan bakteri Lactobacillus bulgaricus dan Streptococcus thermophillus dan/atau bakteri asam laktat lain yang sesuai, dengan atau tanpa penambahan bahan pangan lain dan bahan tambahan pangan yang diizinkan. Yogurt yang berupa minuman cair kental dengan rasa asam (dari akumulasi asam laktat) dan flavor yang khas (dari komponen asetaldehida, sejumlah kecil diasetil, aseton, asetoin) merupakan hasil dari aktivitas starter BAL melalui proses fermentasi susu. Yogurt diproduksi menggunakan kultur aktif BAL untuk memfermentasi krim atau susu. Yogurt yang diproduksi di Amerika Serikat dibuat dari dua spesifik kultur yang hidup dan aktif dari golongan bakteri asam laktat yaitu Lactobacillus bulgaricus (L. bulgaricus) dan Streptococcus thermophilus (S. thermophilus). Bakteri ini memetabolisme beberapa gula susu (laktosa) dan mengubahnya menjadi asam laktat. Kerja bakteri tersebut menyebabkan perubahan konsistensi dari cairan susu menjadi yogurt. Produksi yogurt memerlukan susu yang pada awalnya dikonsentrasikan dengan penambahan dairy solid, kemudian dievaporasi atau disaring dengan membran filter. Campuran ini kemudian dipanaskan untuk membunuh mikroorganisme yang tidak diinginkan, dan didinginkan. Kemudian, starter kultur ditambahkan. Yogurt juga dapat ditambahkan dengan ingridien seperti gula, pemanis, buah-buahan atau sayur-sayuran, komponen flavor, sodium chloride, coloring stabilizers, dan pengawet. Di Amerika Serikat, L. bulgaricus dan S. thermophilus diwajibkan untuk standar produk yang disebut sebagai yogurt (Water et al. 2008). Lactobacillus bulgaricus dan Streptococcus thermophilus berperan untuk membentuk tekstur dan flavor yogurt. L. bulgaricus berkontribusi terhadap flavor yogurt melalui produksi asam laktat, asetaldehida, asam asetat, dan diasetil (Ma’rifah 2008). Yogurt dapat menghambat pertumbuhan bakteri patogen dalam tubuh, seperti Enteropathogenic Escherichia coli (EPEC). Mekanisme penghambatan yogurt terhadap EPEC adalah dengan menurunkan pH lingkungan pertumbuhan EPEC. Asam organik yang dihasilkan oleh BAL dapat menurunkan pH hingga kurang dari 4 sehingga pertumbuhan Escherichia coli enteropatogenik dapat terhambat. Dalam penelitian kali ini, selain probiotik, ditambahkan juga prebiotik sehingga yogurt yang dihasilkan adalah yogurt sinbiotik. Sinbiotik adalah campuran probiotik dan prebiotik yang bermanfaat terhadap inang dengan memperbaiki ketahanan dan implantasi dari suplemen pangan berupa mikroba hidup di dalam saluran pencernaan inang (Andersson et al. 2001). Yogurt sinbiotik merupakan salah satu produk susu fermentasi yang dibuat dengan menggunakan campuran beberapa kultur bakteri asam laktat seperti Lactobacillus bulgaricus, Streptococcus thermophilus, Lactobacillus achidophilus, dan Bifidobacterium bifidum, yang dikombinasikan dengan prebiotik seperti fruktooligosakarida (FOS). Kombinasi probiotik dan prebiotik dapat meningkatkan daya tahan bakteri probiotik oleh karena substrat yang spesifik telah tersedia untuk fermentasi sehingga tubuh mendapat manfaat yang lebih sempurna dari kombinasi ini. Syarat mutu yogurt berdasarkan SNI 2981-2009 diperlihatkan pada Tabel 1. Syarat mutu pada SNI memperlihatkan standar umum yang digunakan di Indonesia. 5 Tabel 1. Syarat mutu yogurt SNI 2981-1999 No . Kriteria Uji Satuan Yogurt tanpa perlakuan panas setelah fermentasi Yogurt 1. 1.1 1.2 1.3 1.4 2. 3. 4. 5. 6. 7. 7.1 7.2 7.3 7.4 8 9 9.1 9.2 9.3 10 Keadaan Penampakan Bau Rasa Konsistensi Kadar Lemak (b/b) Total padatan susu bukan lemak Protein (N ×6.38) b/b Kadar abu (b/b) Keasaman (dihitung sebagai asam laktat) (b/b) Cemaran logam Timbal (Pb) Tembaga (Cu) Timah (Sn) Raksa (Hg) Arsen Cemaran mikroba Bakteri coliform Sallmonella Listeria monocytogenes Jumlah bakteri starter* % Yogurt rendah lemak Yogurt tanpa lemak cairan kental-padat normal atau khas asam atau khas Homogeny Min 0.6 – Max 3.0 2.9 0.5 Yogurt dengan perlakuan panas setelah fermentasi Yogurt Yogurt rendah lemak Yogurt tanpa lemak cairan kental-padat normal atau khas asam atau khas Homogeny Min 0.6 – Max 3.0 2.9 0.5 % Min 8.2 Min 2.7 Min 8.2 Min 2.7 Maks 1 Maks 1 0.5 – 2.0 0.5-2.0 mg/kg mg/kg mg/kg mg/kg mg/kg Maks 0.3 Maks 20.0 Maks 40.0 Maks 0.03 Maks 0.1 Maks 0.3 Maks 20.0 Maks 40.0 Maks 0.03 Maks 0.1 APM/g koloni/g - maks.10 maks.10 negatif/25 g negatif/25 g negatif/25 g negatif/25 g koloni/g min 107 - % % % * sesuai dengan Pasal 2 (istilah dan definisi) 2.5 Probiotik dan Prebiotik Probiotik dan prebiotik pada hakekatnya memiliki tujuan yang sama, keduanya memperbaiki komposisi populasi mikroba dalam saluran pencernaan melalui media makanan. Probiotik berisi mikroorganisme hidup yang menunjukkan keuntungan ketika dikonsumsi, sedangkan prebiotik adalah ingredient makanan yang secara sepesifik dimetabolisme oleh strain indigenus dalam saluran pencernaan. Keduanya dikonsumsi secara sengaja dan diklasifikasikan sebagai pangan fungsional, yaitu ingredient pangan yang memberikan efek positif bagi kesehatan di luar nilai fisiologisnya (Gibson 2000). Beberapa syarat yang harus dipenuhi oleh bakteri asam laktat yang berfungsi sebagai mikroba probiotik antara lain (Salminen et al. 2004): 6 1. Suatu probiotik harus nonpatogenik yang mewakili mikrobiota normal usus dari inang tertentu serta masih aktif pada kondisi asam lambung dan konsentrasi garam empedu yang tinggi dalam usus halus 2. Suatu probiotik yang baik harus mampu tumbuh dan bermetabolisme dengan cepat serta terdapat dalam jumlah yang tinggi dalam usus 3. Probiotik yang ideal dapat mengkolonisasi beberapa bagian dari saluran usus untuk sementara 4. Probiotik dapat memproduksi asam-asam organik secara efisien dan memiliki sifat antimikroba terhadap bakteri merugikan 5. Mudah diproduksi, mampu tumbuh dalam sistem produksi skala besar, dan hidup selama kondisi penyimpanan. Ketahanan terhadap asam lambung merupakan syarat penting suatu organisme untuk dapat menjadi probiotik karena pH asam lambung yang sangat rendah (sekitar 2.5) (Jacobsen et al. 1999). Setelah BAL berhasil melalui lambung, mereka akan memasuki saluran usus bagian atas di mana garam empedu disekresikan sehingga ketahanan BAL terhadap garam empedu juga sangat penting (Zavaglia et al. 1998). Beberapa keuntungan kesehatan yang diberikan oleh probiotik yaitu mampu menyeimbangkan mikroflora pada usus halus, memiliki efek antidiare, menurunkan serum kolesterol, memperbaiki metabolisme laktosa, meningkatkan respon sistem imun, memiliki sifat antikarsinogenik, meningkatan biovailability zat gizi, memiliki aktivitas antimikroba, dan menekan infeksi Heliobacter pylori di perut (Baek & Lee 2009). Definisi probiotik dimulai sekitar tahun 1960-an oleh Lilley dan Stillwell. Keduanya menggunakan istilah tersebut untuk menggambarkan subtansi mikroba yang dapat menstimulasi pertumbuhan dari mikroorganisme lain. Fuller (1989) kemudian merevisi definisi tersebut dengan menghilangkan istilah substansi. Hal ini memberikan definisi yang lebih jelas. Hasil revisinya yang hingga saat ini masih banyak dipakai dan diterima yaitu “suplemen mikroba hidup yang dimakan dan memberikan efek yang menguntungkan pada tubuh dengan meningkatkan keseimbangan mikroba pada saluran pencernaan”. Penghilangan kata “substansi” dari definisi sebelumnya memberikan kesempatan perkembangan bagi prebiotik (Gibson 2000). Pada penelitian ini bakteri probiotik yang diuji aktivitas penghambatan antimikrobanya adalah bakteri Lactobacillus plantarum dan Lactobacillus fermentum. Lactobacillus plantarum adalah bakteri gram positif yang memproduksi asam laktat dan hidup pada berbagai lingkungan yang berbeda, termasuk pada beberapa pangan dan saluran pencernaan manusia (EBI 2010). L. plantarum merupakan bakteri yang bersifat aerotoleran yang dapat tumbuh pada suhu 15°C, tetapi tidak dapat tumbuh pada suhu 45°C (Wikipedia 2010). Menurut Liong (2007), strain L. plantarum dapat menginduksi pelepasan sitokin dari donor manusia sehat melalui leukosit darah periferal mononuklear dan meningkatkan produksi interleukin-10 (IL-10) oleh makrofag dan sel T dari mukosa usus. Lactobacillus fermentum adalah bakteri gram positif yang umumnya ditemukan pada bahan tumbuhan dan hewan fermentasi (Wikipedia 2010). Kullisaar et al. (2003) diacu dalam Liong (2007) melaporkan bahwa konsumsi susu fermentasi yang mengandung L. fermentum menunjukan efek antioksidatif dan antiaterogenik. Sementara itu, menurut Reid (2000), strain L. fermentum dapat memproduksi hidrogen peroksida yang berperan sebagai senyawa antimikroba. Menurut Zoumpopoulou et al. (2008), L. fermentum menunjukkan potensi probiotik karena memiliki karakteristik probiotik, di antaranya memiliki aktivitas mikrobial dan immunomodulator yang diuji secara in vitro yang dikonfirmasi dengan pengujian in vivo menggunakan tikus percobaan. Penelitian yang hampir sama dilakukan oleh Bao et al. (2010) yang menyatakan bahwa L. fermentum memiliki 7 karakteristik probiotik yang potensial karena bakteri ini memiliki ketahanan terhadap pH rendah serta mampu menstimulasi enzim pada saluran pencernaan dan garam empedu. Prebiotik telah digunakan untuk beberapa waktu, terutama di Jepang. Definisi dari prebiotik yaitu komponen pangan yang memberikan efek bagi inang dengan menstimulasi secara selektif pertumbuhan dan aktivitas dari satu atau sejumah kecil bakteri di kolon, yang dapat meningkatkan kesehatan inang. Agar prebiotik dapat digunakan secara efektif, beberapa hal yang disarankan adalah tidak dapat diserap di bagian atas saluran pencernaan dan difermentasi secara selektif sehingga komposisi dari mikrobiota usus diubah menjadi komposisi yang lebih sehat (Gibson 2000). Substrat prebiotik secara selektif digunakan oleh mikroba indigenus di saluran pencernaan tetapi tidak meningkatkan pertumbuhan bakteri patogen pada saluran pencernaan seperti Clostridia penghasil toksin, bakteri proteolitik, dan Escherichia coli (Rastall & Gibson 1998 diacu dalam Salminen et al. 1998). Prebiotik banyak diperoleh dari tumbuh-tumbuhan, di antaranya ß-glucans yang berasal dari oat, inulin yang berasal dari chicory roots, serta oligosakarida yang berasal dari kacang-kacangan dan bawang (Baek & Lee 2009) Salah satu jenis oligosakarida yang dapat digunakan sebagai prebiotik yaitu fruktooligosakarida (FOS). FOS merupakan kelas karbohidrat sederhana yang terkandung secara alami di berbagai tanaman seperti Jerusalem artichoke, bawang, dan pisang. Senyawa ini merupakan serat pangan yang tidak tercerna yang membantu menjaga kesehatan saluran pencernaan dengan cara memberi nutrisi dan meningkatkan bakteri alami yang terdapat dalam saluran pencernaan, khususnya Bfidobacteria dan Lactobacilli, sehingga dapat mencegah infeksi saluran pencernaan. Fruktooligosakarida (FOS) merupakan oligosakarida dengan berat molekul yang rendah yang memiliki efek terhadap Bifidobacteria usus dan merupakan prebiotik yang penting. FOS ini memiliki sifat larut dalam air, tidak dicerna di dalam usus halus, tidak bersifat viscous, tidak mengikat asam empedu, dan sangat mudah difermentasi (Schneeman 1999). Menurut Pascal (2008), dalam pengumuman yang disampaikan oleh Food and Drug Administration (FDA) pada tahun 2000, FOS dinyatakan GRAS untuk digunakan pada tingkat yang berbeda (antara 0.1% dan 5%). Penggunaan probiotik dan prebotik dapat meningkatkan daya hidup dari bakteri yang menguntungkan pada inang. Penggunaan probiotik dan prebiotik secara bersama-sama disebut sebagai sinbiotik. Sinbiotik adalah campuran probiotik dan prebiotik yang memberikan efek kesehatan yang menguntungkan bagi inang dengan meningkatkan daya hidup dan implantasi dari mikroba hidup yang berasal dari suplementasi dalam saluran pencernaan (Gibson & Roberfroid 1995). Dalam kasus ini, probiotik akan secara spesifik memetabolisme prebiotik di usus, sehingga meningkatkan pertumbuhan dan keberadaanya (Gibson 2000). Jumlah minimal sel probiotik yang dapat memberikan efek kesehatan masih kontroversial, tetapi beberapa peneliti menyebutkan bahwa dosis terapinya adalah harus lebih dari 10 7 dan 108 cfu/ml (Kailasapathy & Rybka 1997), harus mencapai 108 sel probiotik hidup per hari (LourensHattingh & Viljoen 2001), atau minimum 105 sel hidup setiap gram atau ml produk (Farida 2005). Walaupun demikian, dosis tersebut sebetulnya sangat tergantung dari jenis makanan dan strain yang digunakan (Rahayu 2004). Beberapa keuntungan dari konsumsi sinbiotik adalah menaikkan toleransi laktosa, melindungi dari penyakit gastroenteritis, kanker usus, dan jantung koroner, meningkatkan sintesis vitamin, meningkatkan pencernaan dan fungsi usus, menurunkan alergi terhadap makanan, dan mengatur sistem imun (Gibson 2000). 8 2.6 Sistem Pencernaan dan Sistem Pertahanan Tubuh Mikroflora saluran pencernaan adalah komponen yang sangat penting untuk pertahanan tubuh. Sebuah kajian kritikal literatur mengindikasikan bahwa suplementasi probiotik pada mikloflora saluran pencernaan mungkin meningkatkan pertahanan tubuh, terutama dengan mencegah kolonisasi dari patogen secara tidak langsung, melalui adjuvant like stimulation dari pertahanan nonspesifik dan fungsi imun. Meskipun demikian, bukti bahwa probiotik yang memediasi peningkatan dari daya imun belum cukup meyakinkan. Untuk secara penuh mengetahui mekanisme dari mikroorganisme probiotik yang mungkin memodulasi fungsi imun, kita perlu meninjau kembali peranan dari nonpatogenik bakteri dalam perkembangan sistem imun dan melindungi inang dari serangan patogen, khususnya pada hewan dan manusia secara spesifik (McCracken & Gaskin 1999). Saluran pencernaan mamalia dihuni oleh banyak dan berbagai mikroorganisme dari luar. Namun mekanisme sistem imun tubuh kita tetap berjalan dengan normal dan dalam kondisi homeostatis. Hal ini karena terdapat simbiosis mutualisme antara mikroflora alami usus dan inang. Sebagai contoh, bakteri saluran pencernaan menyediakan inang dengan berbagai nutrisi, termasuk di dalamnya short chain fatty acids, beberapa vitamin B, dan asam amino. Berbagai pertahanan antimikroba baik secara spesifik maupun nonspesifik terdapat pada saluran pencernaan yang mampu membatasi kolonisasi bakteri asing. Pertahanan nonimunologis meliputi keasaman lambung, gerak peristaltik usus kecil, penutupan dan penghilangan secara tidak langsung bakteri oleh mukus, dan kehadiran komponen antimikroba dari inang seperti lizozim dan defensins yaitu sekelompok peptida yang bersifat antimikroba yang memiliki spektrum yang luas dalam melawan bakteri, fungi, protozoa, dan virus. Pertahanan nonspesifik (innate defense) walaupun bukan bagian dari kumpulan sistem imun, berkontribusi penting dalam perlindungan inang dan banyak kasus penyimpangan dari mikloflora patogen. Lapisan pertama pada sel epitel berperan penting dalam meregulasi pertahanan inang dan sebagai tambahan untuk menyediakan pertahanan fisik. Sebagai contoh, sel epitel usus kecil dan usus besar menghasilkan sel epitel yang menghasilkan lysozim dan defensins seperti yang dilakukan oleh Paneth cells, sebuah sel epitel khusus yang terletak di dalam usus kecil (McCracken & Gaskin 1999). Peneth cells atau sel mukosa di usus mengeluarkan zat-zat yang menjaga kestabilan mukosa. Sel-sel ini mengeluarkan zat-zat kimia seperti laktoferin, laktoperoksidase, dan lizozim yang bersifat bakteriolitik atau bakteriostatik serta menghasilkan pula peptida seperti kriptidin (Schroder 1999). Mukosa usus membentuk lapisan pelindung pada enterocytes sehingga mampu mengurangi penempelan bakteri patogen pada enterocytes (Kudsk 2002) Sel epitel usus diperlengkapi dengan beberapa fungsi imunologis, termasuk di dalamnya terdapat molekul antigen major histocompability complex (MHC). Sel epitel saluran pencernaan juga menghasilkan berbagai respon inflamasi dan regulasi cytokines yang diproduksi oleh makrofag. Bioaktif cytokines yang diproduksi oleh sel epitel secara kolektif menstimulasi perkembangan seluler dari sistem imun usus dan menjaga kesetimbangan imun di dalam usus. Selama terpapar dengan bakteri patogen, sel epitel saluran pencernaan meregulasi kembali produksi dari proinflamatory dan kemotaksis dari cytokines, termasuk interlukin-8 (IL-8), monocyte chemoattractant protein (MCP-1), dan tumor necrosis factor- (TNF- ), dengan demikian menstimulasi neutrofil dan migrasi makrofag ke sisi infeksi selanjutnya mengaktifasi sel T dan sel B, yang kemudian akan berusaha melawan patogen yang menginvasi jaringan usus inang (McCracken & Gaskin 1999). 9 2.7 Probiotik dan Limfosit Sistem limfatik terdiri dari jaringan penghubung spesial yang mengandung sel pertahanan yang disebut sistem imun. Sel di jaringan limpa yang disebut limfosit membantu tubuh terhadap sel asing dan sel kanker. Pusat limfe terdapat pada daerah di sepanjang saluran limfatik. Pada pusat limfe ini terjadi penyaringan limfa dan penghancuran berbagai materi asing serta mikroorganisme. Sel yang melawan infeksi dari mikroorganisme ini disebut limfosit. Pusat limfe seperti tonsil, payer patches pada ileum dari usus halus, dan pusat limfe pada usus buntu terdiri dari banyak jaringan limfatik (Ronzio 2003). Sistem imun yaitu sel T dan sel B dalam saluran pencernaan terletak pada lamina propria (McCracken & Gaskin 1999). Sel T dan sel B di dalam lamina propria menseksresi antibodi pada target antigen yang ada pada usus. Antibodi yang dihasilkan oleh sel limfosit pada usus dan jaringan mukosa yang lain, adalah imunoglobulin A atau IgA. Probiotik dilaporkan mampu menstimulasi komponen pada sistem imun, termasuk di dalamnya menstimulasi aktivasi limfosit dan produksi antibodi (Gibson et al. 1995). Mekanisme utama probiotik dalam memodulasi sistem imun adalah melalui adjuvant effect. Adjuvant effect meningkatkan respon imun untuk spesifik antigen (Freund et al. 1942). Sebagai contoh L. casei GG mampu meningkatkan IgA yang spesifik untuk ß-lactobumin dan kasein pada pasien yang menderita Crohn’s disease dan juga mampu meningkatkan antibodi ß-lactobumin pada tikus yang diberi protein susu sapi (Isolaurie et al. 1993). Penelitian lain yang dilakukan oleh Link et al. (1994) menunjukkan bahwa infeksi tikus yang diberi konsumsi susu yang mengandung L. acidophilus La1 dan B. bifidum Bb 12 yang juga dipapar dengan Salmonella typhii dapat menaikkan total serum IgA dan sIgA dalam melawan S. typhi. 2.8 Malonaldehida dan Superoksida dismutase Ketika terinfeksi mikorganisme, tubuh melakukan mekanisme pertahanan, di antaranya yaitu melalui sel makrofag dan netrofil. Sel makrofag dan netrofil yang teraktivasi akan mengaktifkan enzim oksidase dan oksigenase. Enzim ini mengubah molekul oksigen menjadi anion superoksida, radikal bebas, dan H2O2 yang merupakan bahan potensial untuk membunuh mikroba (Baratawidjaja 2006). Namun di sisi lain, terbentuknya senyawa radikal tersebut sangat berbahaya karena juga berpotensi menyerang sel tubuh. Jika hal ini tidak terkontrol secara benar oleh sistem pertahanan tubuh, akan memicu munculnya berbagai penyakit kronis (Winarsi 2007). Radikal hidrogen, anion superoksida, dan radikal hidroksil merupakan kelompok reactive oxygen spesies (ROS). ROS bersifat sitotoksik. Salah satu jenis radikal bebas yang dikenal adalah malonaldehida (MDA). Menurut Leibler et al (1997), MDA merupakan produk enzimatis dan nonenzimatis dari pemecahan prostaglandin endoperoksida dan produk akhir dari lipid peroksidasi. Malondialdehida lebih dikenal sebagai penanda (marker) peroksidasi lipid. Malondialdehida (C3H4O2) merupakan molekul reaktif yang memilki tiga atom C. Malonaldehida adalah salah satu hasil peroksidasi lemak tidak jenuh terutama asam arakidonat serta produk samping biosintesa prostaglandin. Pengukuran MDA telah digunakan sebagai indeks tidak langsung kerusakan oksidatif yang disebabkan oleh peroksidasi lipid. Pengukuran kadar MDA digunakan sebagai indeks tidak langsung mengukur kerusakan oksidatif yang disebabkan peroksidasi lipid. Subyek yang mengalami stres oksidatif diperkirakan memiliki kadar MDA yang tinggi. Prinsip pengukuran MDA adalah adanya reaksi antara satu molekul MDA dengan dua molekul TBA membentuk kompleks MDA- 10 TBA yang berwarna pink (merah muda) dan dapat dibaca pada panjang gelombang 532 nm (Prangdimutri et al. 2009). Dengan demikian, semakin banyak ROS yang terdapat dalam tubuh, maka kadar MDA akan semakin tinggi. Reduksi O2 menjadi superoksida pada proses fagositosis yang merupakan salah satu sistem pertahanan humoral dalam melawan infeksi atau bahan asing yang masuk dalam tubuh dapat menghasilkan radikal bebas dan ROS. Reaksi ini terjadi dengan bantuan NADPH-oksidase, netrofil, dan makrofag (Halliwell & Gutteridge 1999). Radikal bebas dapat menyebabkan kerusakan membran karena adanya produk peroksidase lipid. Detoksifikasi ROS adalah salah satu prasyarat dalam sistem aerob dan merupakan jalur gabungan dari sistem pertahanan tubuh. Salah satu enzim antioksidan yang mampu mengkatalis dismutase radikal anion superoksida menjadi hidrogen peroksida dan oksigen adalah enzim superoksida dismutase (SOD). Superoksida dismutase (SOD) adalah enzim yang memilki kemampuan mengkatalisis reaksi dismutase atau reduksi dari anion superoksida (O2) menjadi H2O2. Jika O2 dapat direduksi dengan baik oleh SOD, SOD akan dapat mengurangi potensi pembentukan radikal hidroksil (HO·). Fungsi katalitik dari enzim ini pertama kali ditemukan oleh McCord dan Fridovich pada akhir 1960-an ketika mereka mendemonstrasikan bahwa protein yang dikenal sebagai cuprein mengkatalisis dismutase radikal superoksida, seperti pada reaksi berikut: 2O2 + 2H+ SOD H2O2 + O2 SOD terdapat pada semua organisme yang mengonsumsi oksigen, beberapa aerotolerant anaerob dan obligat anaerob. Semua SOD adalah metaloprotein yang mengandung copper (Cu), besi (Fe), atau mangan (Mn) pada sisi aktifnya (Deshpande et al. 1996). SOD diklasifikasikan sebagai: 1. Cu/Zn-SOD (Copper/Zink SOD), terdapat pada sel-sel eukariot seperti pada yeast, tanaman, dan hewan, tetapi pada umunya tidak ditemukan pada sel-sel prokariot seperti bakteri atau ganggang hijau biru. Memiliki berat molekul sekitar 32,000 dan mengandung subunit protein, yang masingmasing mengandung satu ion Cu2+ dan satu ion Zn2+. Enzim ini terdapat pada sitosol dan inti sel. 2. Mn-SOD (Manganase-SOD), pertama kali diisolasi dari E. coli dengan berat molekul sebesar 40,000, sedangkan dari organisme yang lebih tinggi, enzim ini mengandung empat subunit protein dengan 0.5 atau 1 ion Mn per unit. Enzim ini terdapat di dalam mitokondria dan beberapa sel-sel prokariot. 3. Fe-SOD (Iron-SOD), tersusun atas dua unit protein, mengandung satu atau dua ion Fe per molekul enzim dengan berat molekul rata-rata 22,000. Fe yang terikat pada Fe-SOD adalah Fe3+. Enzi mini terdapat pada bakteri, alga, dan tumbuhan tingkat tinggi. 4. Ekstraseluler SOD (EC-SOD), termasuk enzim yang relatif jarang dan biasanya ditemukan di ruangan ekstraseluler dan paru-paru (Desphande et al. 1996, Mates et al. 1999). Di antara berbagai sistem pertahanan atioksidan, aktivitas SOD merupakan sistem pertahanan enzimatik yang paling berperan dalam melawan efek negatif metabolisme oksigen (radikal bebas). Oleh karena itu, setiap organisme yang menggunakan oksigen tidak dapat hidup tanpa SOD. Enzim SOD bekerja sama dengan katalase dan glutation peroksidase dapat mempertahankan konsentrasi senyawa oksigen reaktif dalam level yang masih dapat diterima oleh kondisi fisiologis tubuh (Jadhav et al. 1996). SOD tidak stabil terhadap panas, cukup stabil pada kondisi basa, dan SOD masih mempunyai aktivitas walaupun disimpan selama lima tahun pada suhu 5ºC (Chalid 2003). Aktivitas SOD (U/g jaringan) tertinggi ditemukan di dalam hati. Selain ditemukan pada organ hati, SOD juga ditemukan 11 pada kelenjar adrenalin, ginjal, darah, limfa, pankreas, otak, paru-paru, lambung, usus, ovarium, dan timus (Halliwell & Gutteridge 1999). Aktivitas SOD diukur berdasarkan pengukuran aktivitas enzim secara tidak langsung, salah satunya dengan metode yang dikembangkan oleh Misra dan Fridovich (1972). Metode ini berdasarkan pada kemampuan penghambatan autooksidasi epinefrin menjadi adenokrom oleh SOD. Perubahan epinefrin menjadi adenokrom menimbulkan warna coklat. Semakin besar kadar SOD sampel, maka semakin besar penghambatan dan semakin berkurang intensitas warnanya. Warna coklat dideteksi dengan spektrofotometer pada panjang gelombang 480 nm. 12