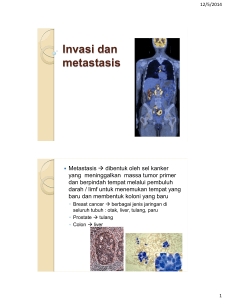
peran urokinase plasminogen activator, cancer associated fibroblast
advertisement

KARYA AKHIR PERAN UROKINASE PLASMINOGEN ACTIVATOR, CANCER ASSOCIATED FIBROBLAST ,GRADE, LYMPHOVASCULAR INVASION SEBAGAI FAKTOR RISIKO METASTASIS KE KELENJAR GETAH BENING AKSILA PADA KARSINOMA PAYUDARA STADIUM DINI Oleh: Ni Gusti Ayu Agung Manik Yuniawaty Wetan PROGRAM PENDIDIKAN DOKTER SPESIALIS II (KONSULTAN) BEDAH ONKOLOGI FAKULTAS KEDOKTERAN UNIVERSITAS UDAYANA RUMAH SAKIT UMUM PUSAT SANGLAH DENPASAR 2015 1 2 KARYA AKHIR PERAN UROKINASE PLASMINOGEN ACTIVATOR, CANCER ASSOCIATED FIBROBLAST ,GRADE, LYMPHOVASCULAR INVASION SEBAGAI FAKTOR RISIKO METASTASIS KE KELENJAR GETAH BENING AKSILA PADA KARSINOMA PAYUDARA STADIUM DINI Oleh: Ni Gusti Ayu Agung Manik Yuniawaty Wetan Pembimbing : Prof.Dr.dr.I.B. Tjakra Wibawa ManuabaSpB(K)Onk.MPH. Dr.dr. Ketut Widiana SpB(K)Onk. PROGRAM PENDIDIKAN DOKTER SPESIALIS II (KONSULTAN) BEDAH ONKOLOGI FAKULTAS KEDOKTERAN UNIVERSITAS UDAYANA RUMAH SAKIT UMUM PUSAT SANGLAH DENPASAR 2015 3 DAFTAR ISI JUDUL ............................................................................................................. i LEMBAR PENGESAHAN ............................................................................. i DAFTAR ISI .................................................................................................... iii DAFTAR TABEL…………………………………………………………… v DAFTAR GAMBAR………………………………………………………… vi DAFTAR SINGKATAN……………………………………………………. vii DAFTAR LAMPIRAN .................................................................................... i BAB I PENDAHULUAN ........................................................................... 1 1.1 Latar Belakang Masalah……………………………………… 1 1.2 Rumusan Masalah……………………………………………. 6 1.3 Tujuan Penelitian…………………………………………….. . 6 1.3.1 Tujuan Umum…………………………………………. 6 1.3.2 Tujuan Khusus………………………………………… 6 1.4 Manfaat Penelitian…………………………………………… . 7 1.4.1 Manfaat Akademik……………………………………. . 7 1.4.2 Manfaat Praktis……………………………………….. . 7 TINJAUAN PUSTAKA…………………………………………. . 8 2.1 Epidemiologi Karsinoma Payudara .......................................... 8 2.2 Karsinoma Payudara Stadium Dini .......................................... 9 BAB II 2.3 Metastasis Ke Kelenjar Getah Bening Aksila Pada Kanker Payudara……………………………………………. 12 2.4 Tumor microenvironment………………………. .................... 17 2.4.1 Urokinase plasminogen activator ................................. 18 2.4.2 Cancer associated fibroblast ......................................... 22 2.5 Faktor-Faktor yang Mempengaruhi Metastase KGB Ke Aksila……………………………………………………. . 26 2.5.1 Grade............................................................................. 27 2.5.2 Lymphovascular invasion ............................................. 28 2.5.3 Usia ............................................................................... 29 4 2.5.4 Ukuran tumor ................................................................ 30 2.5.5 Jenis histopatologi tumor…………………….. ............ 30 2.5.6 Subtipe Intrinsik Tumor Primer…………………….. .. 31 BAB III KERANGKA KONSEP & HIPOTESIS PENELITIAN ................. 35 3.1 Kerangka Berpikir ..................................................................... 35 3.2 Kerangka Konsep ...................................................................... 37 3.3 Hipotesis Penelitian ................................................................... 37 BAB IV METODE PENELITIAN ................................................................ 39 4.1 Rancangan Penelitian ............................................................... 39 4.2 Tempat dan Waktu Penelitian .................................................. 40 4.3 Populasi Penelitian………………………………………….. . 40 4.3.1 Populasi Target……………………………………….. .. 40 4.3.2 Populasi Terjangkau………………………………….. .. 40 4.4 Sampel Penelitian dan Cara Pengambilan Sampel ................... 40 4.4.1 Kriteria Inklusi…………………………………………. 40 4.4.2 Kriteria Ekslusi……………………………………….. .. 41 4.4.3 Sampel Penelitian……………………………………… 41 4.4.4 Cara Pengambilan Sampel…………………………….. . 41 4.4.5 Besar Sampel………………………………………….. . 41 4.5 Variabel Penelitian ................................................................... 42 4.6 Definisi Operasional…………………………………………. 43 4.7 Hubungan Antar Variabel……………………………………. 46 4.8 Prosedur Penelitian………………………………………….. . 47 4.8.1 Pemeriksaan Histopatologi Awal……………………... . 47 4.8.2 Pemeriksaan Imunohistokimia untuk reseptor Estrogen dan Progesterone……………………………. . 48 4.8.3 Pemeriksaan Imunohistokimia untuk HER2/neu……… 49 4.8.4 Pemeriksaan Imunohistokimia untuk uPA……………. . 50 4.8.5 Pemeriksaan Imunohistokimia untuk CAFs…………… 50 4.9 Alur Penelitian .......................................................................... 52 4.10 Analisis Data ........................................................................... 53 5 BAB V HASIL PENELITIAN ..................................................................... 54 5.1 Karakteristik dasar subyek penelitian ............................................ 54 5.2 Analisis bivariat ekspresi uPA dengan metastasis kgb .................. 57 5.3 Analisis bivariat over ekspresi CAFs dengan metastasis kgb ........ 58 5.4 Analisis bivariat grade dengan metastasis kgb............................... 59 5.5 Analisis bivariat LVI dengan metastasis kgb ................................. 60 5.4 Analisis multivariat faktor risiko metastasis kgb .......................... 61 BAB VI PEMBAHASAN .............................................................................. 63 BAB VII SIMPULAN DAN SARAN............................................................. 72 7.1 Simpulan ........................................................................................ 72 7.2 Saran ............................................................................................... 72 DAFTAR PUSTAKA ...................................................................................... 46 6 DAFTAR TABEL Tabel 2.1 Tabel Rekomendasi pengukuran uPA dan PAI-1 ............................ 22 Tabel 2.2 Tabel Varian histopatologi dengan frekuensi dan survival rate ....... 31 Tabel 5.1 Tabel Gambaran karakteristik subyek penelitian ............................. 56 Tabel 5.2 Tabel Analisis bivariat uPA dengan metastasis kgb ........................ 57 Tabel 5.3 Tabel Analisis bivariat CAFs dengan metastasis kgb ...................... 59 Tabel 5.4 Tabel Analisis bivariat grading dengan metastasis kgb ................... 60 Tabel 5.5 Tabel Analisis bivariat LVI dengan metastasis kgb......................... 60 Tabel 5.6 Tabel Analisis multivariate faktor risiko metastasis kgb ................. 61 7 DAFTAR GAMBAR Gambar 2.1 Tahapan Metastasis ..................................................................... 14 Gambar 2.2 Jalur Metastasis Tumor Primer Menuju KGB Regional .............. 15 Gambar 2.3 Kemokin Memediasi Metastasis Melalui Sistem Limfatik .......... 16 Gambar 2.4 uPA System dan fungsinya ……………………………………. 20 Gambar 2.5 Peranan BMDC sebagai CAFs ..................................................... 24 Gambar 2.6 Interaksi sel tumor dan TME…………………………………. ... 26 Gambar 3.1 Kerangka Konsep ......................................................................... 37 Gambar 4.1 Bagan Rancang Penelitian ............................................................ 39 Gambar 4.2 Hubungan Antar Variabel……………………………………… 46 Gambar 4.3 Skema Penelitian .......................................................................... 52 Gambar 5.1 Pengecatan IHK uPA negatif ....................................................... 58 Gambar 5.2 Pengecatan IHK uPA positif ........................................................ 58 Gambar 5.3 Pengecatan IHK CAFs negatif ..................................................... 58 Gambar 5.4 Pengecatan IHK CAFs positif ...................................................... 59 Gambar 6.1 Distribusi status KGB aksila negatif ............................................ 64 8 DAFTAR SINGKATAN KPD Karsinoma Payudara MRM Modified Radical Mastectomy KGB Kelenjar Getah Bening VEGF Vascular Endothelial Growth Factor LVI Lympho Vascular Invasion CAFs Cancer Associated Fibroblasts uPA Urokinase Plasminogen Activator PAI-1 Plasminogen Activator Inhibitor-1 ECM Extra Cellular Matriks T Tumor N Node M Metastase AJCC American Joint Committee on Cancer ITC Isolated Tumor Cell IHK Imunohisto Kimia RT-PCR Reverse Transkriptase – Polymerase Chain Reaction BCT Breast Conserving Therapy DFS Disease Free Survivor ER Estrogen Receptor PR Progesteron Receptor LYVE-1 Lymphatic Vascular Endothelial – 1 CCR7 Chemokine Receptor type 7 CXCR 4 Chemokine (C-X-C modif) 4 CXCR 12 Chemokine (C-X-C modif) 12 IDC Infiltrating Ductal Carcinoma 9 ILC Infiltrating Lobular Carcinoma DCIS Ductal Carcinoma In Situ HER2 Human Epidermal Growth Factor Receptor2 GFD Growth Factor Domain HGF Hepatocyte Growth Factor FGF Fibroblast Growth Factor IGF Insulin-like Growth Factor PDGF Platelet-Derived Growth Factor SDF1 Stromal Cell-Derived Factor 1 TGF – β Transforming Growth Factor Beta 10 DAFTAR LAMPIRAN Lampiran 1 Kelaikan etik ................................................................................ Lampiran 2 Surat Ijin Penelitian ...................................................................... Lampiran 3 Lembar inform consent dan persetujuan ...................................... Lampiran 4 Data subyek penelitian ……………………………………......... Lampiran 5 Analisis data ................................................................................. 11 BAB I PENDAHULUAN 1.1 Latar Belakang Karsinoma payudara (KPD) adalah jenis keganasan wanita terbanyak, sekitar 25% dari semua kasus dan merupakan penyebab kematian kedua setelah kanker paru (Sawaki, et al., 2014). Perkembangan KPD dari penyakit lokal menjadi sistemik dapat menyebabkan gangguan fungsi organ, kegagalan sistemik luas, dan akhirnya, kematian. Penyebab utama kematian pada pasien dengan tumor solid ganas adalah metastasis jauh. Penyebaran sel kanker dimulai dari pelepasan (detachment), migrasi melalui stroma lokal, intravasasi, kemudian ekstravasasi untuk berkembang biak di lokasi baru untuk membentuk tumor metastatik (Pillay et al.,2006). Sejumlah 7% penderita KPD datang dalam keadaaan metastasis saat awal terdiagnosis. Pada penderita pasca operasi MRM terapeutik, 20-30% pasien dengan metastasis kelenjar getah bening (KGB) negatif, dan 50 % dengan metastasis KGB positif, akan mengalami metastasis jauh. (Cunnick, et al., 2002). Data klinikopatologi menunjukkan bahwa penyebaran ke KGB merupakan rute awal untuk terjadinya metastasis pada kanker solid. Sel-sel kanker dalam pembuluh limfatik dan KGB regional adalah 12 faktor kunci dalam penyebaran sel kanker, akan tetapi bagaimana mekanisme sel-sel tumor masuk ke sistem limfatik tidak pasti (Stacker, et al., 2002) Status KGB aksila merupakan salah satu indikator prognosis penting dalam KPD dan deteksi metastasis ke KGB aksila merupakan kunci menentukan pengobatan yang akan diberikan. Pasien tanpa metastasis ke KGB aksila memiliki prognosis lebih baik, yakni metastasis ke lebih dari 6 KGB menunjukkan risiko metastasis jauh (Tseng, et al.,2014). Terdapat perbedaan yang bermakna dari tingkat kelangsungan hidup selama lima tahun (5 years survival rate) antara pasien tanpa metastasis KGB aksila (> 90%) dibandingkan dengan mereka yang metastasis KGB aksila (<70%) (Sawaki, et al., 2014). Selain menggunakan faktor prognostik yang telah ada, pedoman terapi KPD stadium dini, ASCO, merekomendasikan pemeriksaan uPA dan PAI-1, sebelum pemberian kemoterapi adjuvan (ASCO,2007). Dengan tujuan menghindari over treatment, yang nantinya berimbas pada meningkatnya kualitas hidup serta mengurangi biaya kesehatan. Urokinase plasminogen activator (uPA) adalah protease serin yang terlibat dalam degradasi extracelullar matrix (ECM), invasi kanker dan metastasis (Al-Jubour, 2013). uPA mengaktifkan plasminogen menjadi plasmin aktif, plasmin ini akan mengaktifkan beberapa jenis MMP , yang pada akhirnya terjadi degradasi ECM. Ekspresi uPA telah terbukti pada banyak kanker, di mana ekspresi telah berkorelasi dengan invasi 13 dan metastasis (Dass, et al., 2008). Urokinase plasminogen activator ini dihasilkan oleh cancer associated fibroblasts(CAFs). Kanker solid terdiri dari berbagai sel, yakni sel kanker dan stroma, termasuk fibroblast, sel endotel dan sel imun. Berbeda dengan fibroblast pada jaringan payudara normal, pada kanker fibroblast merupakan bentuk aktif. Cancer associated fibroblast terdiri dari fibroblast reaktif, pericyte, sel endotel, myofibroblasts, sel adiposit dan juga sel mesenkimal. Sel ini mengekspresikan α smooth muscle actin (a-SMA), vimentin dan desmin, tetapi negatif cytokeratin, CD31 dan smooth muscle myosin. Sebagian besar CAFs adalah fibroblas aktif, sebagian kecil tetap tidak aktif. Cancer associated fibroblast mengeluarkan protease berbagai faktor pertumbuhan, sitokin, kemokin, dan yang berperanan dalam proses invasi dan metastasis (Bhowmick, et al., 2004). Selain itu dikatakan pula bila kadar CAFs tinggi, berhubungan dengan respon kemoterapi (Liaou, et al., 2009). Penelitian ini dilakukan untuk mengetahui biomarker spesifik uPA, CAFS dan faktor klinikopatologi tradisional grade dan LVI sebagai faktor risiko metastasis ke KGB aksila pada KPD stadium dini, khususnya di RSUP Sanglah Denpasar. Penelitian ini melihat adanya perubahan distribusi pasien kanker payudara di RSUP Sanglah. Berdasarkan data registrasi kanker payudara di Sub bagian bedah onkologi, dari hanya ada 2 pasien stadium dini pada tahun 2012, menjadi 25 dan 42 orang pada tahun 2013 dan 2014. Tentu saja hal ini 14 merupakan tantangan baru bagi para klinisi untuk memberikan terapi yang optimal. Karena selama ini hampir semua pedoman terapi berdasarkan penelitian dinegara barat, padahal dari karakteristik penderita saja sudah berbeda, yakni di negara barat penderita KPD terbanyak adalah usia >60 tahun, sedangkan di Bali khususnya berusia 40-50 tahun. Meskipun uPA telah direkomendasikan oleh ASCO, akan tetapi karena prosedur pemeriksaan yang beragam, memerlukan penanganan specimen khusus, serta hasil yang bervariasi, maka pemeriksaan uPA dan PAI-1, belum rutin dikerjakan. Begitu pula dengan dinegara eropa (Cancer Research UK, 2015). Di Amerika, pemeriksan menggunakan ELISA, TMA dan yang standar digunakan adalah Femtelle uPA/PAI-1 (Weigelt, et al., 2005). Beberapa penelitian telah dilakukan untuk mevalidasi penggunaan biomarker ini, khususnya dengan pegecatan imunohistokimia sehingga dapat secara rutin dikerjakan pada paraffin blok. Akan tetapi hasilnya masih bervariasi tergatung dari jaringan, lama proses inkubasi, cat yang digunakan, sehingga sampai sekarang masih terus diteliti (Duffy, et al., 2014). Demikian pula dengan CAFs, belum ada konsensus tentang protein spesifik untuk CAFs. Sebuah tinjauan sistematik dilakukan untuk mengevaluasi biomarker CAFs pada kanker payudara, antara lain matrix metalloproteinase 13 (MMP13), tissue inhibitor of metaloproteinases-2 (TIMP2), thrombospondin1 (THBS1), LGALS1 15 (lectin, galactoside-binding, soluble, 1), PDPN (podoplanin), PLAU (plasminogen activator urokinase), PLAUR (plasminogen activator, urokinase receptor), CAV1 (caveolin 1). Namun hanya THBS1, LGALS1, MMP13 berhubungan dengan metastasis regional (Folgueira, 2013). Sedangkan studi lain menyatakan ekspresi vimentin pada kanker payudara berhubungan dengan grade, ukuran tumor, tetapi tidak berhubungan dengan metastasis (Hemalatha, et al., 2013). Selain itu secara klinikopatologi faktor risiko metastase ke KGB aksila antara lain usia pasien, ukuran tumor, jenis histopatologi, grade, lymphovascular invasion (LVI). Studi dari Arisio menyatakan usia, besar tumor, invasi vaskular merupakan faktor prediktor metastase ke KGB aksila (Arisio, et al, 2000). Sedangkan studi lain menyatakan tidak ada korelasi antara usia pasien dan ukuran tumor dengan metastasis aksila, akan tetapi jenis histopatologi dan hormonal reseptor berhubungan dengan metastasis aksila (Ashtukar, et al, 2010). Karsinoma payudara dengan subtype triple negative paling banyak metastase ke KGB aksila (Cengshuai, et al, 2014). Penelitian kami lakukan sehingga konseling dapat ditingkatkan, pasien dapat dikelompokkan menjadi kelompok risiko tertentu sehingga terapi akan optimal, bukan under atau over treatment untuk pasien berisiko tinggi pasca operasi. Dengan tujuan akhir DFS dan OS ditingkatkan, dan meminimalisasi efek samping terapi yang tidak diperlukan. 16 1.2 Rumusan Masalah 1. Apakah overekspresi uPA merupakan faktor risiko metastasis ke KGB aksila pada KPD stadium dini ? 2. Apakah overekpresi CAFs merupakan faktor risiko metastasis ke KGB aksila pada KPD stadium dini ? 3. Apakah grade merupakan faktor risiko metastasis ke KGB aksila pada KPD stadium dini ? 4. Apakah LVI merupakan faktor risiko metastasis ke KGB aksila pada KPD stadium dini ? 1.3 Tujuan Penelitian 1.3.1 Tujuan umum Mengetahui faktor- faktor yang mempengaruhi metastasis ke KGB aksila pada KPD stadium dini 1.3.2 Tujuan khusus 1. Mengetahui overekspresi uPA merupakan faktor risiko metastasis ke KGB aksila pada KPD stadium dini. 2. Mengetahui overekpresi CAFs merupakan faktor risiko metastasis ke KGB aksila pada KPD stadium dini. 3. Megetahui grade merupakan faktor risiko metastasis ke KGB aksila pada KPD stadium dini. 4. Mengetahui LVI merupakan faktor risiko metastasis ke KGB aksila pada KPD stadium dini. 17 1.4 Manfaat Penelitian 1.4.1 Manfaat Akademik 1. Mengetahui faktor faktor klinikopatologi dan biomarker yang mempengaruhi metastasis ke KGB aksila pada KPD stadium dini 2. Menambah khasanah keilmuan terutama dalam bidang biologi molekuler 1.4.2 Manfaat Praktis 1. Hasil penelitian ini dapat digunakan untuk mementukan kelompok resiko pada pasien KPD stadium dini pasca operasi 2. Hasil penelitian ini dapat dijadikan pertimbangan dalam menentukan terapi yang akan diberikan pada pasien KPD stadium dini. 3. Hasil penelitian ini dapat dijadikan pertimbangan sebagai faktor prediktor dan juga prognosis pada pasien KPD stadium dini 18 BAB II TINJAUAN PUSTAKA 2.1 Epidemologi Kanker payudara Kanker payudara adalah kanker terbanyak kedua di dunia , dengan perkiraan 1,67 juta kasus kanker baru yang didiagnosis pada tahun 2012 (25% dari semua jenis kanker) (Globocan, 2012). Selain perempuan, KPD juga dapat terjadi pada laki- laki walaupun jumlahnya lebih sedikit (Kwon and Ching, 2012). Data terbaru dari American Cancer Society menyatakan bahwa di tahun 2013, ada 2240 kasus baru KPD pada laki- laki (ACS, 2013). Kanker ini merupakan kanker pada perempuan terbanyak baik pada negara maju maupun negara berkembang . Insidennya juga bervariasi, yakni hampir 4 kali lipat diseluruh dunia, mulai dari 27 kasus per 100.000 di Afika Tengah dan Asia timur sampai 96 kasus di Eropa barat (Globocan, 2012). Kanker payudara menempati urutan kelima sebagai penyebab kematian dari kanker secara keseluruhan (522.000 kematian) dan merupakan penyebab kematian kedua kanker (198.000 kematian, 15,4%) setelah kanker paru-paru (Globocan, 2012). Metastasis atau penyebaran ke organ lain pada tubuh merupakan penyebab utama kematian. Dan keadaan ini menjadi lebih buruk karena 10% penderita telah mempunyai metastasis pada saat terdiagnosis (Roche dan Vahdat, 2010). 19 Di Bali sendiri, berdasarkan data yang ada di Rumah Sakit Umum Pusat (RSUP) Sanglah, insiden kanker payudara juga mengalami peningkatan selama 3 tahun terakhir. Dari 99 kasus baru pada tahun 2010 menjadi 134 kasus baru pada tahun 2011, dan kembali meningkat menjadi 162 kasus baru pada tahun 2012. Kasus ini dengan distribusi 3% pada stadium I, 28% pada stadium II, 43% pada stadium III dan 26% pada stadium IV (Yarsa, et al., 2012). 2.2 Kanker Payudara Stadium Dini Penyebab pasti KPD masih belum diketahui. Beberapa faktor resiko yang dihubungkan salah satunya jenis kelamin, dimana jenis kelamin wanita beresiko 100 kali dibandingkan dengan laki- laki. Bertambahnya usia, riwayat keluarga yang menderita kanker payudara, terpapar hormon reproduksi (usia menarche pertama kali, umur saat menopause, umur pertama kali melahirkan anak aterm, pemakaian terapi hormonal), pola makan, obesitas dan juga beberapa kelainan jinak pada jaringan mamma (atypical ductal hyperplasia) juga meningkatkan resiko terjadinya kanker payudara, selain faktor mutasi genetik (Kwon dan Ching 2012). Penentuan stadium pada KPD penting, karena merupakan kunci pada perencanaan terapi dan untuk penentuan prognosis. Salah satunya yang sering dipakai dan dipakai juga di Indonesia adalah TNM classification system dari American Joint Committee on Cancer dan the International Union for Cancer Control (AJCC-UICC) merupakan sistem klasifikasi kanker payudara yang diterima di dunia internasional (Compton, et al.,2010). 20 Berdasarkan pembagian stadium diatas yang termasuk dalam KPD stadium dini adalah KPD stadium I, IIA, dan II B (Kwon dan Ching, 2012) yakni stadium I adalah semua KPD dini dengan tumor primer dengan diameter kurang dari 2cm (T1), tanpa metastasis KGB atau limfonodi (N0), dan stadium II adalah semua KPD lokal dini, yaitu tumor primer dengan diameter 0- 5 cm (T0-2), tidak terdapat metastasis KGB atau limfonodi (N0) atau terdapat metastasis tanpa perlengketan (N1) (AJCC, 2010). Metastasis ke KGB aksila dibedakan menjadi 3 kategori, yaitu isolated tumor cells (ITC), mikrometastasis dan makrometastasis. Pembagian ini berdasarkan ukuran deposit tumor pada KGB sentinel secara mikroskopis. American Joint Committee on Cancer (AJCC, 2010) menyatakan bila ditemukannya kumpulan isolated tumor cells clusters dan deposit tumor dengan ukuran ≤ 0,2 mm, atau bila kumpulan sel yang menyebar maupun yang menjadi satu dengan jumlah tidak lebih dari 200 sel dalam satu potongan KGB, diklasifikasikan sebagai isolated tumor cells , merupakan N0. Sedangkan deposit tumor dengan ukuran 0,2mm -2,0 mm dinyatakan sebagai mikrometastasis (pN1mi) dan yang ukuran deposit tumor > 2,0 mm disebut makrometastasis. Occult metastasis adalah metastasis pada KGB yang tidak terdeteksi pada pemeriksaan rutin H&E tapi terdeteksi setelah melalui pemeriksaan imunohistokimia (IHK) atau dengan pemeriksaan reverse transcriptase polymerase chain reaction (RT-PCR). Metastasis jenis ini tidak memiliki perbedaan signifikan dilihat dari overall survival (Giulano, et al., 2011). 21 Penanganan standard pada KPD di Indonesia sesuai dengan panduan penatalaksanaan Peraboi tahun 2010. Penanganan ini meliputi beberapa modalitas yakni pembedahan, terapi tambahan sistemik maupun radiasi. Modalitas utama pada kanker payudara stadium dini adalah pembedahan. Teknik pembedahan yang dianjurkan ada beberapa macam yaitu BCT (breast conserving therapy), mastektomi radikal yang dimodifikasi, baik dengan atau tanpa rekonstruksi. Terapi tambahan lainnya tergantung beberapa faktor prediktor dan prediktif, salah satunya status KGB aksila. Dengan demikian terapi sistemik adjuvan dapat memperpanjang disease free survival (DFS), sedangkan terapi radiasi digunakan untuk meningkatkan kontrol lokal pada kanker payudara dengan batas aman yang sempit. Sedangkan terapi hormonal hanya diberikan pada ER (+) dan atau PR(+) (Manuaba, 2010; NCCN, 2012). Salah satu problem yang sering dihadapi pada KPD stadium dini adalah yang tanpa metastasis ke KGB aksila (node negatif). Pada umumnya KPD stadium dini tidak memerlukan kemoterapi adjuvan. Akan tetapi beberapa diantaranya datang dengan rekurensi, baik lokal maupun jauh. Disinilah para klinisi sulit memutuskan mana yang memerlukan sistemik terapi tambahan. Dari studi yang dilakukan tahun 2002 terhadap 8000 pasien KPD node negatif, didapatkan tingkat rekurensi lebih banyak terjadi pada pasien dengan level uPA tinggi. Sehingga ASCO merekomendasikan pemeriksaan uPA untuk menetukan status risiko pasien KPD pasca operasi, pasien manakah yang perlu diberikan kemoterapi adjuvan (Weigelt, et al., 2005). Pada NCCN 2015, KPD stadium dini dengan Her2 positif, disarankan untuk 22 pemberian kemoterapi adjuvan. Sedangkan pada Her2 negatif, tumor >0,5 cm disarankan untuk pemeriksaan gene 21 RT-PCR, untuk menentukan pemberian adjuvan kemoterapi atau tidak. 2.3. Metastasis Ke Kelenjar Getah Bening Aksila pada Kanker Payudara Penilaian secara klinis dan radiologis terhadap KGB aksila dilakukan saat penegakan diagnosis untuk dapat menentukan stadium KPD, rencana terapi dan prognosis pasien. Status metastasis KGB aksila KPD dipengaruhi oleh ukuran tumor primer, lokasi tumor, grade secara histologi dan LVI dan subtipe intriksik tumor (Arisio, et al., 2000; Ashtukar, et al., 2010; Cengshuai, et al., 2014). Dalam keadaan normal, sel akan berada dalam organ yang semestinya dan tidak dapat berpindah dari organ asal ke organ lain. Pada proses keganasan keadaan ini akan berubah, suatu sel akan dapat berpindah dan tumbuh di organ lain maka keadaan inilah yang disebut metastasis. Proses metastasis pada pembuluh darah adalah sebagai berikut (Stricker and Kumar, 2010): 1. Invasi : Sel tumor menembus lapisan membrana basalis dan masuk ke matriks ekstrasel Tahapan invasi adalah sebagai berikut: a. Meregangnya sel tumor 23 b. Melekatnya sel tumor ke berbagai protein ECM c. Degradasi lokal membrana basalis dan jaringan ikat interstisium d. Migrasi sel tumor menembus membrana basalis 2. Intravasasi: Dari matriks ekstrasel, sel tumor masuk menembus endotel pembuluh vaskuler dan mulai menyebar melalui aliran pembuluh tersebut. 3. Sirkulasi: di dalam aliran darah, sebagian sel tumor membentuk embolus (gumpalan) yang melekat ke leukosit dan trombosit. 4. Eksravasasi: ketika sampai di lokasi organ yang akan diinangi, sel tumor ataupun embolus akan melekat ke endotel vaskular yang diikuti dengan pergerakan melalui membran basalis dengan mekanisme yang serupa dengan yang berperan dalam invasi. 5. Angiogenesis : Sesampainya sel tumor di organ yang diinangi, sel tersebut akan mengeluarkan faktor pertumbuhan untuk merangsang pembentukan pembuluh darah baru. 6. Pertumbuhan : setelah semua fasilitas cukup untuk mendukung kehidupan sel tumor tersebut, maka sel tumor mulai tumbuh dan membelah sehingga membentuk tumor baru. 24 Gambar 2.1 Tahapan metastasis (Stricker and Kumar, 2010) Beberapa jalur penyebaran sel kanker ganas : invasi lokal ke jaringan sekitarnya, metastasis sistemik melalui darah ke organ jauh, dan metastasis limfatik melalui pembuluh limfatik (KGB sentinel, KGB distal, dan dari sana ke organ distal). 25 Gambar 2.2 Jalur metastasis tumor primer menuju KGB regional dan organ jauh (Christiansen dan Detmar 2011) Metastasis ke KGB adalah penentu untuk menentukan stadium dan prognosis yang berfungsi sebagai panduan perencanaan terapi. Akan tetapi bagaimana mekanisme molekuler yang memicu terjadinya metastasis ke KGB sentinel, KGB distal dan seterusnya, belumlah jelas. Dahulu dikatakan sel tumor secara pasif diambil oleh pembuluh limfatik, karena tingginya permeabilitas pembuluh darah limfatik bila dibandingkan dengan pembuluh darah biasa yang memiliki membran basalis. Penelitian terhadap peran sistem limfatik dalam metastasis kanker telah terhambat oleh kurangnya penanda spesifik yang membedakan pembuluh limfatik dari pembuluh darah dan oleh kurangnya faktor spesifik untuk pertumbuhan limfatik yang diketahui (Stacker, et al. 2014; Tobler, et al., 2006; Christiansen, et al,. 2011). 26 Beberapa penelitian terakhir telah penanda khusus limfatik, antara lain podoplanin, lymphatic vascular endothelial cell hyaluronan receptor-1 (LYVE-1), dan Prox1, faktor transkripsi yang menginduksi sistem limfatik, yang berperan penting pada proses diferensiasi dan perkembangan embrio dari sistem limfatik dan sistem vaskular darah. Selain itu, ditemukan pula vascular endothelial growth factor (VEGF-C) dan VEGF-D yang spesifik mengaktivasi reseptor VEGF 3 (VEGFR-3) yang ada pada sistem endotel limfatik. Bahkan overekspresi VEGF-C di kulit memicu limfangiogenesis kulit, sedangkan pada percobaan dengan tikus, ditemukan adanya overexpression VEGF-C yang memicu pertumbuhan tumor dan pembentukan pembuluh limfe disekitar tumor (Pepper, 2001; Tobler, et al., 2006; Burstein, et al., 2008). Gambar 2.3 Kemokin memediasi metastasis melalui sistem limfatik. Sel tumor mengekspresikan reseptor kemokin , CCR7 dan CXCR4. Adanya ligand kemokin (CCL19/21) yang dihasilkan oleh sistem limfatik dari sel tumor, akan memandu kemokin pada sel tumor metastasis menuju pembuluh limfatik dan KGB. Dan VEGF3 juga memicu ekspresi dari kemokin, sehingga terjadi proses metastasis lebih lanjut. Kemokin juga memandu sel tumor menuju 27 organ distal, yang ditandai dengan peningkatan kadar CXCL12 (Pepper, 2001; Tobler, et al., 2006; Christiansen dan Detmar, 2011). 2.3 Tumor microenvironment Solid tumor merupakan “organ like structure” terdiri dari sel tumor dan stromal (microenvironment). Pada dekade terakhir, penelitian tentang tumor microenvironment (TME) berkembang dengan pesat. Penelitian yang awalnya hanya berfokus pada sel tumor saja, sekarang mulai beralih pada lingkungan yang mendukung. Teori “seed and soil” pertama kali dikemukakan oleh Stephen Paget, 1889, yang menyatakan kanker yang berbeda mempunyai kecenderungan metastasis ke organ spesifik (soil) tergantung dari jenis kanker (seed) . Namun hipotesa ini disanggah oleh James Ewing yang menjelaskan metastasis adalah murni dipengaruhi oleh faktor mekanikal dan pola sirkulasi/hemodinamik yaitu jumlah sel kanker yang dilepaskan ke sirkulasi dan yang berhenti di pembuluh darah kapiler organ. Kemudian pada tahun 1984, teori “seed and soil” ini ditinjau kembali, karena adanya berbagai bukti sel kanker hanya dapat tumbuh bila lingkungan mikro organ tersebut dapat mendukung pertumbuhan sel tersebut (Scully, et al., 2012). Tumor microenvironment terdiri dari sel stromal, sel sistem imun dan inflamasi, faktor pertumbuhan, jaringan pembuluh darah dan limfe, serta matriks ekstraseluler (ECM). Pada keaadan normal jaringan stroma memiliki kemampuan sebagai pertahanan terhadap keganasan melalui mekanisme supresi respon imun dan supresi karsinogenesis. Akan tetapi sel kanker dapat merubah dan memodulasi lingkungan mikro di sekitar tumor untuk mendukung 28 pertumbuhan dan sifat progesifitas tumor melalui sekresi berbagai sitokin, kemokin dan faktor pertumbuhan serta enzim-enzim proteinase. Stroma akan menjadi reaktif terhadap stimulus dari sel-sel kanker. Sel stromal aktif ini yang dikenal dengan carcinoma-associated fibroblast (CAFs), yang akan mensekresi EGF,HGF,FGF,IGF-1 kemokin CXCL12, protease uPA dan MMP, menurunkan sistem imun melalui sekresi TGF-β, pada akhirnya akan membantu progresivitas pertumbuhan sel kanker (Rohan, et al., 2014; Li, et al., 2007) 2.3.1 Urokinase Plasminogen Activator (uPA) Sistem urokinase plasminogen activator (uPA) terdiri dari uPA, urokinase plasminogen activator reseptor (uPAR), dan dua inhibitor protease serin spesifik: plasminogen activator inhibitor 1 (PAI-1) dan plasminogen activator inhibitor 2 (PAI- 2) (Al-Jubour, 2013). Urokinase plasminogen activator (uPA) adalah protein yang memiliki rantai 411 asam amino, terdiri dari 2 buah helix dan 2 rantai antipararel b. uPA diproduksi dan disekresi sebagai rantai tunggal polipeptida - sebuah zymogen dikenal sebagai pro-uPA - yang tidak memiliki aktivitas mengaktifkan plasminogen. Rantai tunggal pro-uPA memiliki aktivitas ratusan kali lebih lemah daripada rantai ganda uPA. Terdiri dari 2 jembatan disulfide, yang berikatan dengan rantai polipeptida, ujung rantai carboxy dan ujung lainnya terdiri dari kringle dan growth factor domain (GFD), GFD inilah yang nantinya berikatan dengan uPAR. . Setelah mengikat pro-uPA ke uPAR, uPA diaktifkan melalui pembelahan ikatan 29 peptida Lys158-Ile159 setelah mengikat reseptor, uPAR menjadi dua rantai uPA molekul aktif (Tang, et al., 2012). Enzim uPA aktif ini kemudian mengubah plasminogen menjadi serin protease plasmin dengan membelah ikatan arginin-valin, yang terlibat dalam degradasi matriks ekstraselular (ECM) dan membran basement dengan baik pencernaan proteolitik langsung atau dengan aktivasi zymogen lainnya protease, seperti pro-metalloproteases dan procollagenases, sehingga meningkatkan migrasi tumor dan membantu dalam kegiatan anti-trombolitik untuk menghilangkan bekuan darah dan membantu merangsang angiogenesis pada sel tumor (Tang, et al., 2012). 30 Gambar 2.4 Urokinase plasminogen activator system dan fungsinya. uPA:Urokinase-type plasminogen activator; uPAR:urokinase-type plasminogen activator receptor; PAI:plasminogen activator inhibitor; Bcl-2:B cell lymphoma 2; ECM:extracellular matrix; ERK:extracellular signalregulated kinase; FAK:focal adhesion kinase; FGF-2:fibroblast growth factor 2; MAPK:mitogen-activated protein kinase; MMPs:matrix metalloproteinases; mTOR:mammalian target of rapamycin; PI3K:posphatidylinositol 3-kinase; TGF-β:transforming growth factor beta; VEGF:vascular endothelial growth factor; Vn:vitronectin (Bevan dan Mala, 2008). 31 Pada beberapa tahun terakhir, berbagai penelitian dilakukan untuk menentukan faktor prognosis dari KPD, termasuk diantaranya Mammaprint, Oncotype gene, akan tetapi masih belum ada yang bisa digunakan secara rutin di klinik, serta memerlukan biaya mahal. Pengukuran uPA dan PAI-1 pada saat ini banyak direkomendasikan oleh berbagai pedoman. Tetapi karena memerlukan cara pemeriksaan yang khusus , biasanya dengan RT PCR atau tissue micro array, maka masih belum lazim digunakan diklinik. Demikian pula dengan hasil yang masih bervariasi, dan faktor apa saja yang mempengaruhi pengukuran tersebut, maka pemeriksaan uPA ini masi diteliti penggunaannya. Antara lain studi NNBC-3, yang mencakup 4,147 pasien, membandingkan, fluorouracil (5-FU),epirubicin, dan cyclophosphamide dilanjutkan docetaxel (3xFEC-3xDoc; FEC-D) dengan 5-FU, epirubicin, dan cyclophosphamide (6xFE100C; FEC) sebagai kemoterapi adjuvan pada psien KPD node negatif yang risiko tinggi. Risiko rekurensi diukur dengan menentukan kriteria klinikopatologi dan kadar uPA. Sedangkan penelitian lainnya adalah WSG Plan B trial, mencakup 2,448 pasien Her2 negatif. Desain studi ini adalah membandingkan kemoterapi anthracycline dan taxane dengan kemoterapi tunggal anthracycline (Duffy, et al., 2014). Meskipun uPA dan PAI-1 memiliki nilai prognostik pada populasi umum pasien kanker payudara, penggunaan klinis utama mereka adalah pada kanker payudara nodus-negatif, dimana kadar rendah uPA dan PAI-1 pada jaringan dapat menghindari over-treatment dengan kemoterapi adjuvan pada pasien dengan penyakit non-agresif. Demikian sebaliknya, kadar yang tinggi 32 mengidentifikasikan pasien risiko untuk terjadinya rekurensi bahkan metastasis (Noh, et al., 2013; Duffy, et al., 2014) Tabel 2.1 Tabel rekomendasi pengukuran uPA dan PAI-1 (Duffy, et al., 2014). 2.4.2 Cancer Associated Fibroblast (CAFs) Tumor adalah jaringan yang kompleks yang terdiri dari sel-sel kanker, berbagai jenis sel stroma dan ECM. Penelitian terbaru menunjukkan peran tumor memicu sel stroma, demikian juga yang terjadi pada sel-sel pembuluh darah, sel imun, fibroblas, myofibroblasts, adiposit dan sumsum tulang (Agusten, 2014). Sel-sel ini mengandung subpopulasi yang berbeda dari fibroblas pada jaringan normal, fibroblast ini bersifat aktif. Activated stromal fibroblast ini sering diidentifikasi dengan beberapa penanda antara lain -SMA, tenascin-C (TN-C) , periostin (POSTN), NG2 kondroitin sulfat proteoglikan (NG2), platelet derived growth factor receptor alpha/ beta (PDGFR/ β) dan protein aktivasi fibroblast (FAP), vimentin, fibronektin , kolagen tpe prolyl 4-hidroksilase, fibroblast spesifik protein-1 (FSP-1) / S100A4 (Folgueira, et al., 2013; Togo, et al., 2013). 33 CAFs terdiri dari berbagai populasi fibroblast dengan asal-usul seluler yang berbeda mereka. Infiltrasi terus menerus dari massa tumor dengan berbagai progenitor fibroblast, dan perubahan selanjutnya ke CAFs, dapat memfasilitasi generasi dan perluasan yang disebut desmoplastic, stroma reaktif yang pada gilirannya mendukung perkembangan tumor. Myofibroblasts yang diaktifkan menunjukkan kemampuan lebih besar untuk kontak dengan gel kolagen in vitro. Ini menunjukkan bahwa kemampuan CAFs kontak gel kolagen berkorelasi secara signifikan dengan kemampuan mereka untuk lebih efektif mempromosikan pertumbuhan payudara manusia sel kanker yang ditanamkan pada tikus coba. Telah terbukti dan diterima secara luas bahwa sel-sel kanker dan sel stroma berevolusi selama perkembangan tumor, sel kanker mempengaruhi sel-sel stroma di sekitarnya berubah menjadi sel tumor pendukung yang aktif. Ada beberapa teori tentang asal CAFs, termasuk aktivasi sel stromal oleh sel kanker, atau sel epitel yang mengalami epitel-to-mesenchymal transition (EMT) atau migrasi dari sel sumsum tulang. Dari tinjauan sistematik, data tentang signal apa yang menyebabkan aktivasi sel fibroblast ini masih belum jelas. Pada studi eksperimental TGF-b dapat menginduksi fibroblas yang normal untuk mengekspresikan α SMA, tapi tidak jelas apakah apakah hanya karena signal ini, atau karena pengaruh lain. Tetapi studi ini menunjukkan bahwa faktor yang disekresikan oleh sel-sel tumor akan menyebabkan perubahan fenotip dan fungsi sel fibroblast. Bila EMT merupakan komponen utama dari CAFs maka perubahan genetik pada sel kanker akan dapat terdeteksi pada sel stroma. Studi genetik pada sel kanker maupun sel stromal, sama- sama menunjukkan adanya perubahan 34 genetik, meskipun tidak identik, menunjukkan kemungkinan asal dan aktifasinya berbeda. Studi terbaru menunjukkan meningkatnya keterlibatan bone marrow derived tumor cell (BMDC). Dalam studi menunjukkan BMDC langsung membentuk adenokarsinoma lambung,kulit, dan sstem vaskular tumor pada lingkungan yang mendukung (Li, et al., 2007). Selain itu, pada studi lain diddapatkan BMDC akan masuk ke sel tumor dan bertindak sebagai CAFs. Masih belum jelas, apakah sel stromal aktif akibat dari pengaruh TME atau memang merupakan sel aktif dari sumsum tulang. Gambar 2. 5 Peranan BMDC sebagai CAFs . BMDC mengekspresikan CXCR4 (sel merah muda) chemotax ke daerah hipoksia dan peradangan sebagai respon terhadap SDF-1 (disekresi oleh CAFs dan sel inflamasi) dan memasukkan ke dalam pembuluh sebagai EC, ke dalam stroma sebagai CAFS, dan sebagai sel tumor (Li, et al., 2007) Sel stroma ini kemudian mengeluarkan faktor pertumbuhan, faktor angiogenesis, protease (uPA) dan sitokin. Sampai saat ini, berbagai laporan telah menunjukkan pentingnya beberapa jalur sinyal dalam mengatur diaktifkan, 35 termasuk TGF-β-Smad2 / 3, CXCL12 / SDF-1 - CXCR4, interleukin 1β (IL-1β) NF-kB, platelet-derived growth factor(PDGF) reseptor -PDGF (PDGFR), homolog fosfatase tensin (PTEN) homolog v-ets eritroblastosis virus E26 onkogen 2 (Ets2) dan Sonic hedgehog (Shh) -Smoothened (Elective). CAFs mensekresi beberapa faktor pertumbuhan (EGF family members, HGF,FGFs,IGF1). TGF-β yang berasal dari fibroblast menyebabkan perubahan epitel menjadi mesenkim epithelial–mesenchymal transition (EMT) dan menyebabkan supresi imun. Selain kemampuan CAFs untuk mempromosikan neoangiogenesis dan pertumbuhan tumor , laporan terbaru telah menunjukkan peran CAFs dalam modulasi sifat sel induk kanker (CSC) dan metastasis. Interaksi CAFs dengan sel kanker dan sel stroma lainnya demikian telah terbukti penting untuk agresivitas tumor selama perkembangan kanker. Namun, mekanisme molekuler yang mendasari hal ini, dan intervensi terapeutik yang tepat, masih memerlukan penelitian lebih lanjut. Selain itu CAFs berhubungan dengan kegagalan pengiriman obat sistemik kanker akibat adanya jaringan yang kaku,padat seperti “tameng” sehingga terjadi resistensi obat . Identifikasi target seluler dan molekuler yang dapat membatalkan interaksi sel stroma dengan sel kanker diharapkan akan memperbaiki efektivitas terapi.(Lotti, et al., 2013; Togo, et al., 2013) 36 uPA Gambar 2.6 Interaksi sel tumor dan TME (Ungefroken, et al., 2011) 2.4 Faktor – Faktor Klinikopatologi Sebagai Faktor Risiko Metastasis Ke KGB Aksila Pada pasien KPD dengan stadium I dan II, status limfonodi adalah salah satu faktor prognosis yang paling penting untuk menentukan survival. Sampai saat ini, diseksi KGB aksila rutin dilakukan dan ditemukan KGB positif pada 30% pasien (Ran, et al., 2010). Namun, diseksi KGB aksila dikaitkan dengan morbiditas jangka panjang dan kualitas hidup yang buruk, menyebabkan berkurangnya mobilitas bahu, gangguan sensorik, dan lymphedema (Ashtukar, et al., 2011). 37 2.5.1 Grade Histopatologi Grade pada kanker payudara memberikan informasi mengenai potensi kanker tersebut untuk menjadi agresif, semakin tinggi grade dari kanker maka potensi untuk agresif semakin meningkat. Sistem yang sering digunakan adalah Notthingham Histologic Score system (the Elston-Ellis modification of Scarff-Bloom-Richardson grade system). Dalam Notthingham Histologic Score system terdapat beberapa faktor yang dinilai : gland formation (differensiasi), nuclear features (pleomorphism), aktifitas mitosis (seberapa sel tumor membelah) (Rosai dan Ackerman's, 2004): Tubular formation (1) poin Tubular formation pada > 75% tumor (2) Poin: Tubular formation pada 10 - 75% tumor (3)Poin: Tubular formation pada <10% tumor Nuclear pleomorphism (1)Poin: Nuclei dengan minimal variasi bentuk dan ukuran (2)Poin: Nuclei dengan variasi bentuk dan ukuran sedang (3)Poin: Nuclei dengan variasi bentuk dan ukuran yang sangat nyata Mitotic count (1)Poin: 0-9 mitosis/per 10 lp x25 objective tergantung tipe mikroskop yang digunakan ( mikroskop cahaya) (2)Poin: 10-19 mitosis (3)Poin: 20 atau lebih mitosis 38 Setiap poin tersebut akan dinilai masing-masing dengan nilai yang berkisar antara 1 hingga 3, dan hasil penilaian tersebut akan dijumlahkan dengan kisaran nilai sebesar 3 hingga 9. Grade dibagi menjadi 3 kelompok, grade 1/well differentiated (nilai 3 hingga 5), grade 2 / moderately differentiated (nilai 6 hingga 7), grade 3/ poorly differentiated (nilai 8 hingga 9) (Simpson, et al., 2000). Surveillance, Epidemiology, and End Result (SEER) menyatakan grade berhubungan dengan insiden metastasis pada KGB aksila (grade 1 vs grade 3= 3,4 vs 21) (Ravdin, et al.,1994). Berbagai penelitian telah menganalisis pentingnya derajat keganasan sebagai faktor prognostik pada kanker payudara. Pasien kanker payudara dengan grade tinggi, sering ditemukan KGB aksila positif ≥4, lebih sering mengalami rekuren dan metastasis dibandingkan dengan kanker grade rendah (Ashtukar, et al,, 2010). 2.5.2 Lymphovascular invasion (LVI) Lymphovascular invasion (LVI) adalah terdapatnya sel kanker dalam lumen pembuluh limfatik atau sistem mikro vascular di dalam tumor primer (Matsuo, et al, 2012). Adanya LVI pada tumor sering dikaitkan dengan metastasis (khususnya ke KGB), rekurensi, dan menurunnya survival. Studi sebelumnya menunjukkan bahwa metastasis melalui pembuluh limfatik lebih mudah, dikarenakan membran basalisnya terputus-putus, ikatan antar sel lemah, kecepatan aliran limfatik jauh lebih rendah, mengandung banyak asam hyaluronic yang berfungsi sebagai 39 molekul pelindung (Ran, et al., 2010). Pada tahun 1997 Barth,et al., menemukan LVI, ukuran tumor, dan jenis histologi dapat digunakan untuk memprediksi terjadinya metastasis ke KGB aksila. Diantara semua faktor tersebut, LVI merupakan faktor prediktor terkuat (odds ratio : 8,2) (Tseng, et al., 2014). LVI berhubungan dengan resiko terjadinya rekurensi lokoregional, tetapi tidak mempengaruhi kelangsungan hidup pada kanker payudara stadium dini (Freedman, et al., 2012). Adanya invasi limfatik peritumoral juga dimasukkan sebagai salah satu kriteria St. Gallen untuk seleksi pasien dalam memberikan terapi ajuvan sistemik pada pasien kanker payudara yang operable Untuk alasan-alasan tersebut maka pelaporan ada tidaknya invasi limfatik dan kesesuaian diagnosis invasi limfatik di antara ahli patologi menjadi sangat penting (Sumadi, 2010) 2.5.3 Usia Pada studi yang melibatkan 1075 kasus tumor <1cm, pasien berumur dibawah 50 tahun memiliki resiko 7 kali lipat untuk mengalami metastasis ke KGB. Hal ini mungkin dipengaruhi oleh status hormonal, dan banyaknya faktor pertumbuhan yang memicu angiogenesis, serta adanya mutasi genetik (Arisio, et al., 2000; Coleoni,et al., 2005). Sehingga, makin muda usia saat didiagnosis KPD, maka angka survival juga makin rendah ( 85% vs 90% pada wanita diatas 40 tahun) (ACS, 2013).Akan tetapi hal ini tidak sesuai dengan studi lainnya, yakni usia, grade, status hormonal dan juga ekspresi HER2 tidak berhubungan dengan metastasis ke KGB aksila. (Ivkoviæ-Kapicl , et al., 2006). 40 2.5.4 Ukuran Tumor Ukuran tumor yang semakin besar meningkatkan resiko metastasis pada KGB aksila dan klasifikasi metastasis KGB meningkat berbanding lurus dengan semakin membesarnya ukuran tumor primer (Carter,et al.,1989). Metastasis ke KGB aksila lebih banyak didapatkan pada tumor >2 cm (Kaur,et al., 2006). Penelitian pada 2282 sampel dengan KPD invasif dan DCIS, angka insiden keterlibatan KGB aksila pada Tis (0,8%), T1a (5%), T1b (16%), T1c (28%), T2 (47%), T3 (68%) dan T4 (86%) (Silverstein, et al., 2003 ; Tan, et al, 2005). Insiden terjadinya metastasis ke KGB aksila pada pasien T1N0M0 adalah 25% ( 208/823). Metastasis KGB aksila lebih banyak didapatkan pada pasien premenopause, dengan insiden T 1cm =17%, T 1,5cm= 25%, T 2cm = 29% (Iwasaki, et al., 1998). Demikian pula dengan angka survival akan turun sesuai dengan ukuran tumor yakni 95% pada tumor ≤2,0cm, 83% untuk tumor ukuran 2-5 cm, dan 65% untuk tumor >5cm (ACS, 2013). Ukuran tumor berhubungan dengan LVI dan metastasis ke KGB aksila (Koscielny, et al. 2009; Tseng, et al., 2014) 2.5.5 Jenis Histopatologi Tumor Infiltrating ductal carcinoma ( IDC) menunjukkan tingkat metastasis ke KGB aksila lebih banyak daripada infiltrating lobular carcinoma (ILC), karsinoma tubular dan karsinoma mucinous. Ini menunjukkan bahwa bahwa jenis histologis tumor dapat digunakan sebagai penanda untuk memprediksi metastasis ke KGB aksila (Ashtukar, et al., 2010). 41 Begitupula dengan studi yang dilakukan pada tumor T1,T2 di Singapura seluruh tumor dengan jenis tubuler, meduler dan koloid memberikan hasil SLNB negatif (Tan, et al., 2005). Metastasis ke KGB aksila ditemukan pada tumor dengan jenis histologi 35% IDC, 40% ILC, 7% karsinoma papiler, 6% karsinoma koloid atau musinus, 21% medulari karsinoma dan 8% dengan DCIS yang disertai microinvasi (Wong, et al., 2002). Tabel 2.2 Tabel varian histopatologi dengan frekuensi dan survival rate (Weigelt, et al., 2005) 2.5.6 Subtipe intrinsik tumor primer 2.5.6.1 Estrogen merupakan salah satu hormon yang berperan dalam perkembangan payudara normal maupun kanker payudara. Estrogen berinteraksi dengan sel-sel epitel payudara (mammary epithelial cells) 42 melalui reseptor estrogen (ER) yang spesifik. Dua jenis reseptor yang diketahui adalah ERα dan ERβ. ERα merupakan reseptor yang paling erat kaitannya dengan kanker payudara. Reseptor ini umumnya diekspresikan di payudara, ovarium, dan di rahim (uterus). Sementara ERβ diekspresikan secara luas dan kaitannya dengan kanker payudara masih belum jelas. Sekitar 70% dari kasus kanker payudara mengekspresikan reseptor (ER+) dan mempunyai karakteristik tumor yang membesar secara lambat. (Conzen dan Grushko, 2008) 2.5.6.2 Reseptor progesterone (PR), gen yang meregulasi estrogen, terbagi menjadi dua bentuk, PRA dan PRB, PRB merupakan reseptor yang lebih spesifik terhadap kanker payudara. PR secara bervariasi diekspresikan pada tumor dengan ER+ dimana hal ini memberikan nilai prognostik yang berbeda. Pada kasus tumor dengan ER+/PR-, yang umumnya terjadi pada wanita dengan usia di atas 50 tahun, mempunyai karakteristik kromosom aneuploid dan timbul dengan ukuran tumor yang lebih besar dibandingkan dengan tumor dengan ER+/PR+. Terlebih lagi, tumor dengan ER+/PR+ lebih responsif terhadap terapi antiestrogen (Conzen dan Grushko, 2008) 2.5.6.3 Human Epidermal Growth Factor Receptor 2 (HER-2/neu) Amplifikasi dan/atau overekspresi protein HER-2 (ditemukan pada 20% sampai 30% kasus kanker payudara baru) berhubungan dengan peningkatan kecepatan pertumbuhan dan pembelahan sel (menjadi lebih agresif), dan meningkatkan resiko terjadinya kekambuhan atau rekurensi serta mengurangi ketahanan hidup jika dibandingkan dengan tumor 43 dengan gen HER-2 yang normal. Pada tingkat molekuler, amplifikasi HER-2 berhubungan dengan deregulasi dari fase G1/S pada cell cycle melalui regulasi cyclins D1, E, dan cdk6, serta degradasi p27 (Conzen dan Grushko, 2008) 2.5.6.4 Protein Kiehl 67 (Ki67) Ki-67 adalah protein inti yang dikaitkan dengan proliferasi sel, awalnya diidentifikasi oleh Gerdes, et al., di awal 1980-an, dengan menggunakan antibodi monoklonal tikus ditujukan terhadap antigen inti dari sel Hodgkin limfoma (Inwald, et al., 2013). Protein Ki 67 merupakan protein inti yang labil, ditemukan pada hampir seluruh siklus sel, mulai dari fase G1,S,G2, mitosis, tapi tidak pada sel yang diam atau G0. Protein ini ditemukan pada semua sel yang berproliferasi, baik sel normal maupun sel kanker. Sehingga dapat digunakan sebagai penanda untuk mengevaluasi pertumbuhan tumor (Park, et al., 2007) 2.5.6.5 Subtipe kanker payudara Klasifikasi molekular yang telah diterima secara luas adalah pembagian dibawah ini. Luminal A: yaitu kanker dengan ekspresi hormon reseptor (+) dan HER-2 (-), Luminal B: dengan Hormon Reseptor (+) HER2 (+), Triple negatif: ketiganya negatif dan HER-2 hanya HER-2 yang positif. Masih ada beberapa pembagian seperti tipe basal, normal tipe maupun claudin low. Akan tetapi yang standard pemeriksaan terutama untuk di Indonesia adalah luminal A, luminal B, Triple negatif dan HER-2. Pertemuan terakhir di St Gallen menyepakati KI67 dimasukan sebagai prognostik 44 faktor dengan cut off point sebesar 14% (Falck, et al., 2013; Cheang, et al., 2009). Protein Ki 67 berperan dalam membedakan luminal B Her2- dengan Luminal A, bahkan Ki67 merupakan faktor prediktor metastasis ke KGB (Ivkoviæ-Kapicl, et al., 2006). Ekspresi positif untuk ER dan PR secara signifikan berkorelasi dengan derajat keganasan, MAI dan pleomorfisme nukleus. Selain itu, status ER, PR, and HER2 juga berhubungan dengan usia pasien dan jenis histopatologi (Zhu, et al., 2014). Biasanya HER2 sering didapat pada tumor yang agresif, grade tinggi, sedangkan triple negative lebih sering ditemukan pada usia <50 tahun. Dalam salah satu studi didokumentasikan bahwa pasien yang menjalani biopsi KGB sentinel menunjukkan bahwa prevalensi metastasis KGB sentinel berhubungan terbalik dengan kurangnya reseptor progesteron. Sedangkan pada studi lain menyatakan ER dan PR tingkat berhubungan dengan terjadinya metastasis ke KGB aksila (Asthukar, et al., 2010). Triple negative dan HER2 memiliki insiden metastasis lebih tinggi (Jans, et al., 2014; Sawaki, et al.,2014), sedangkan studi lain menyatakan insiden metastasis lebih jarang pada basal type (Crabb, et al., 2008). 45 BAB III KERANGKA BERPIKIR, KONSEP PENELITIAN DAN HIPOTESIS 3.1 Kerangka Berpikir Seiring dengan kemajuan teknologi di bidang kesehatan,dan kesadaran masyarakat, distribusi kanker payudara mengalami perubahan. Terjadi peningkatan insiden KPD stadium dini. Terapi adjuvan terhadap kanker yang bersifat personalisasi menjadi hal yang wajib dikembangkan pula. Selama ini sebagian besar KPD tidak memerlukan kemoterapi adjuvan, kecuali bagi kelompok pasien risiko tinggi berdasarkan faktor progonosis yang telah ada, antara lain usia, grade, overekspresi HER2, reseptor hormonal negatif. Akan tetapi pada perjalanannya, pada kelompok pasien risiko rendah ini 15% diantaranya akan kembali dengan loko regional ataupun metastasis jauh. Sehingga diperlukan beberapa biomarker tambahan untuk mengelompokkan ulang pasien pasca operasi. Penyebaran ke kgb merupakan rute awal untuk terjadinya metastasis pada kanker solid. Beberapa faktor yang menyebabkan terjadinya metastasis kgb aksila adalah faktor klinikopatologi (usia, grade, ukuran tumor, LVI, jenis histopatologi, reseptor hormonal, ekspresi reseptor HER2, Ki67, subtype). Berdasarkan buktibukti yang telah ada menunjukkan bahwa perkembangan suatu tumor tidak hanya dipengaruhi oleh perubahan genetik intrinsik dari sel-sel tumor tersebut, tetapi juga dipengaruhi oleh faktor lingkungan mikro di sekitar sel tumor antara lain uPA, CAFs, tumor imunologi, faktor angiogenesis dan faktor genetik. 46 Pada usia muda, biasanya didapatkan tumor dengan grade tinggi, LVI positif, reseptor hormonal biasanya negatif dan atau tanpa disertai ekspresi HER (subtype HER/TNBC). Hal inilah yang menyebabkan tumor bersifat lebih agresif. Selain itu sel tumor juga memodulasi jaringan sekitar, dikenal dengan CAFs, yang akan memproduksi sejumlah faktor pertumbuhan, protease,termasuk uPA, kemokin CXCl12, faktor angiogenesis(VEGF), yang mempengaruhi sel secara autokrin maupun parakrin, sehingga dihasilkan lingkungan yang cocok untuk tumbuh. CAFs juga menghasilkan TGFβ yang akan menyebabkan imunosupresi, sehingga tumor dapat berkelit dari sistem imun tubuh (tumor escape). Yang pada akhirnya tumor tumbuh, progresif, serta metastasis. 47 3.2 Kerangka Konsep Berdasarkan tinjauan pustaka dan permasalahan yang dihadapi maka dibuat kerangka konsep sebagai berikut : karsinoma payudara uPA CAFs Grade LVI metastasis kgb aksila ipsilateral Gambar 3.1 Kerangka konsep 3.3 Hipotesis penelitian 1. Overekspresi uPA sebagai faktor risiko terjadinya metastasis ke kgb aksila pada KPD stadium dini 2. Overekspresi CAFs sebagai faktor risiko terjadinya metastasis ke kgb aksila pada KPD stadium dini 3. Grade tinggi sebagai faktor risiko terjadinya metastasis ke kgb aksila pada KPD stadium dini 4. LVI positif sebagai faktor risiko terjadinya metastasis ke kgb aksila pada KPD stadium dini 48 49 DAFTAR PUSTAKA Aboussekhra, A., 2011. Role of cancer-associated fibroblasts in breast cancer development and prognosis, Int. J. Dev. Biol. 55: 841-849 doi: 10.1387/ijdb.113362aa AJCC , 2010, The New Edition (7th) AJCC Staging System For Breast Cancer A Summary Of Key Changes American Cancer Society (ACS), 2013, Breast Cancer Facts & Figures 20132014. Atlanta: American Cancer Society, Inc. Ali ,E.M., Ahmed R.H., Ali, Ayman M,A., 2014. Correlation Of Breast Cancer Subtypes Based On Er, Pr And Her2 Expression With Axillary Lymph Node Status. Cancer And Oncology Research. Egypt, 2(4):51-57. Al-Jubouri, RSM., 2008. Immunohistochemical Assessment for Urokinase-type Plasminogen Activator System by Using Tissue Microarray Technique in Human Breast Tumors (A Thesis) Council of the College of Science / University of Baghdad Arisio, R., Sapino, A., Cassoni, P., Accineli, G., Cuccorese, M., Mano, M., et al., 2000. What Modifies The Relation Between Tumour Size And Lymph Node Metastases In T1 Breast Carcinomas?. Journal Clinical Pathology. Italy, 53:84650. Ariagada,R., Rutqvist, L.,Johansson, H.Kramar, A., Rosterin, S., 2008. Predicting Distant Dissemination In Patients With Early Breast Cancer. Acta Oncologica. Sweden, 47:1113-21. Ashturkar A.V., Pathak, G.S., Desmukh, S.D., Pandave, H.T., 2011. Factors Predicting The Axillary Lymph Node Metastasis In Breast Cancer: Is Axillary Node Clearance Indicated In Every Breast Cancer Patient?. Indian J Surgery. India, 73(5):331-35. Augsten, M., 2014. Cancer-associated fibroblasts as another polarized cell type of the tumor microenvironment, Frontiers in Oncology, , articel 62, doi 10.3389/fonc.2014.00062 Bevan,P., Mala,C.C., 2008. The Role of uPA and uPA Inhibitors in Breast Cancer, Breast Care , vol 3(suppl 2):1–2 Published online: October 15 Bhowmick, N.A., Neilson, E.G., Moses, H. L., 2004. Stromal fibroblasts in cancer initiation and progression. Nature 432, 332-337 Burstein, H.J., Chen, Y., Parker, L.M., Savoie, J., Younger ,J., Kuter, I., RCvan, P.D., et al., 2008. VEGFAs A Marker For Outcome Among Advanced Breast 50 Cancer Patients Receiving Anti-Vegf Therapy With Bevacizumab And Vinorelbine Chemotherapy, Clinical Cancer Research, United States: American Association For Cancer Research, 14(23):7871-77. Cabioglu N., Sahin, A.A., Morandi, P., Meric- Berstam, F., Islam, R., Lin, H.Y., et al., 2009. Chemokine Receptors In Advanced Breast Cancer: Differential Expression In Metastatic Disease Sites With Diagnostic And Therapeutic Yen, F. Annals Of Oncology, United States: Oxford University Press, 20:1013-19. Carter, C.L., Allen, C., Henson, D.F., 1989. Relation Of Tumor Size, Lymph Node Status, And Survival In 24.740 Breast Cancer Cases, Cancer, 63(1), 181-7 Chaterine, L., Rabbani, S.A., 2015, Plasminogen Activator- Diagnostic, Prognostic, and Therapeutic implications in breast cancer, A Concise review of Molecular Pathology Breast Canncer, Mehmet Gunduz, section 6, 2030- 8. Cheang,M.C., Chia,S.K., Voduc, D., Gao, D., Leun S., Snider, J, et al., 2009. Ki67 Index,Her2 Status And Prognosis Of Patients With Luminal B Breast Cancer, J.Natl.Cancer Inst., 101(10):736-50 Chengshuai S., Jin, Y., Zou, Q., 2014. Association Between Molecular Subtypes And Lymph Node Status In Invasive Breast Cancer, Int J Clin Exp Pathol. China, 7(10):6800-06. Cianfrocca, M.L.J., Rotmensz, G.M., Peruzzott,M., 2014. Prognostic And Predictive Factors In Early-Stage Breast Cancer, The Oncologist Breast Cancer., Colleoni, M., Zahrieh, D., Gelber, R.D., Holmberg, S.B., Mattsson, JE.,Rudenstam,C.M., et al., 2005. Site of primary tumor has a prognostic role in operable breast cancer: the international breast cancer study group experience, J Clin Oncol., 1;23(7):1390-400. Compton, C.C., Edge, S., Byrd, D.R., Fritz, A.G., Greene, F.L., Trotti, A., et al., 2010. AJCC Cancer Staging Manual, 7th Ed., Springer, Newyork, 347-76. Crabb,S.J, Cheang, M.C.,Leung, S., Immonen, T., Nielsen, T.O., Hunstman, D.D., et al., 2008. Basal Breast Cancer Molecular Subtype Predicts For Lower Incidence Of Axillary Lymph Node Metastases In Primary Breast Cancer, Clin Breast Cancer, 8(3):249-56. Christiansen, A., Detmar, M., 2011. Lymphangiogenesis And Cancer, Genes & Cancer, Vol 2 No 12,1146-59 Conzen, Suzanne D.; Grushko, Tatyana A. 2008. Cancer Of Breast. In Devita, Hellman & Rosenberg’s Cancer: Principles & Practice Of Oncology, 8th Edition. Devita, Vincet T., Lawrence, Theodore S.; Rosenberg, Steven A., Editors Lippincott Williams & Wilkins. Pp.1596-1601. 51 Dass ,K., Ahmad A., Azmi, A.S., Sarkar, S.H., Sarkar FH., 2008. Evolving role of uPA/uPAR system in human cancers, Cancer Treat Rev.34(2):122-36. Epub 2007 Dec 26. Didiasova, M., Wujak, L., Wygrecka, M., Zakrzewicz, D., 2004. Review From Plasminogen to Plasmin: Role of Plasminogen Receptors in Human Cancer , Int. J. Mol. Sci.15, 21229-21252 Duffy, M.J., McGowan,P.M., Harbeck, N., Thomssen,C., 2014, uPA and PAI-1 as biomarkers in breast cancer: validated for clinical use in level-of-evidence-1 studies, Breast Cancer Research , 16:428 Folgueira, M.A., Maistro, S., Katayama, M.L.H., Roela, R.A.,Mundim, F.G., Nagogaki, S., et al., 2013. Markers Of Breast Cancer Stromal Fibroblasts In The Primary Tumour Site Associated With Lymph Node Metastasis: A Systematic Review Including Our Case Series, Biosci. Rep., 33 , Art:E00085 / Doi 10.1042/Bsr20130060 Freedman, G.M., Li,T., Polli, L.V., Anderson, R.R., Bleicher, R.J., Siqurdson, E., et al., 2012. Lymphatic Space Invasion Is Not An Independent Predictor Of Outcomes In Early Stage Breast Cancer Treated By Bcs And Radiation, Breast J.18(5);415-9 Giuliano, A., Hawes, D., Ballman, K., Beitsch, P.D., Whitworth, P.W., Blumencranz, P.W., et al., 2011. Association Of Occult Metastases In Sentinel Lymph Nodes And Bone Marrow With Survival Among Women With EarlyStage Invasive Breast Cancer. Jama. 306: 385. Globocan, 2012, Estimated Cancer Incidence, Mortality And Prevalence Worldwide In 2012, Section Of Cancer Surveillance, International Agency For Research On Cancer. Available From Url: Http://Globocan. Basal Type Iarc.Fr/Pages/Fact_Sheets_Cancer.Aspx Golhirsch, A., Wood,W.C., Coates, A.S., Gelber, R.D., Thurlimann, B., Senn, HJ., et al., 2011. Strategies For Subtypes – Dealing With The Diversity Of Breast Cancer: Highlight Of The St Gallen International Expert Consensus On The Primary Therapy Of Early Breast Cancer 2011. Annals Of Oncology. Switzerland, 22:1736-47. Gurleyik, G., Gurleyik, E., Aker, F., Aktekin, A., Emir,S., Gungor, O., et al., 2007, Lymphovascular Invasion, as a Prognostic Marker in Patients with Invasive Breast Cancer Acta chir belg, 107, 284-287 Goodpaster, T., Legesse-Miller, A., Hameed, A.R., Aisner, S.C., Randolph Habecker, A., Coller,H.A., 2008. An Immunohistochemical Method for Identifying Fibroblasts in Formalin-fixed, Paraffin-embedded Tissue, 52 Experimental Histopathology, Fred Hutchinson Cancer Research Center, J Histochem Cytochem 56:347–358 Haugsten, E.M., Wiedlocha, A., Olsnes, S., Wesche, J., 2010. Roles of Fibroblast Growth Factor Receptors in Carcinogenesis ,Mol Cancer Res; 8(11),1441- 1456. Hawsawi, N.M., Ghebeh,H., Hendrayani,SF., Tulbah,A., et al., 2008., Breast Carcinoma–Associated Fibroblasts and Their Counterparts Display NeoplasticSpecific Changes, Cancer Res April 15, 68; 271 Hemalatha, A., Suresh, T.N., Kumar, M.L.H., 2013. Expression of vimentin in breast carcinoma, its correlation with Ki67 and other histopathological parameters, PMC., 189-194 Hunter Kent W., Nigel, PS., Crawford, Alsarraj, J., 2009. Mechanism Of Metastases. Breast, Cancer Research. 9 December 2008. Available From Url: Http://Www.Breast-Cancer-Research.Com/Content/10/S1/S2.Htm. Ikpatt,O.F., Kuopio, T., Collan,Y., 2002. Proliferation In African Breast Cancer: Biology And Prognostication In Nigerian Breast Cancer Material, Mod Pathol The United States And Canadian Academy Of Pathology, Inc., Vol. 15, No. 8 2002;15(8):783–789 Ivkoviæ-Kapicl T., Panjkovic, M., Ninèie, D., 2006. Factors Correlating With Lymph Node Metastases In Patients With T1 Ductal Invasive Breast Cancer, Arch Oncol. Serbia: Institute Of Oncology, 14(1-2):19-22. Iwasaki Y., Fukutomi,t., Akashi,S., Nawasawa, T., Tsuda,H., 1998. Axillary Node Metastasis From T1N0M0 Breast Cancer: Possible Avoidance Of Dissection In A Subgroup. Japan Journal Clinical Oncol. Japan,28(10):601-03. Kaneko,T., Konno,H., Baba,M., Tanaka, T, Nakamura, S., et al., 2003, Urokinase-type plasminogen activator expression correlates with tumor angiogenesis and poor outcome in gastric cancer ,Cancer Sci Vol. 94 | no. 1 | 43– 49 Kangkang, Z., Xiaojun, S., Hao, Z., Jianwei, B., 2010. Cancer Associated Fibroblasts Are Positively Correlated With Metastatic Potential Of Human Gastric Cancers, Journal Of Experimental & Clinical Cancer Research, 29:66 Kakinuma T., Hwang, S.M., 2006. Chemokines, Chemokine Receptors, And Cancer Metastasis. Journal Of Leukocyte Biology. United States: Society For Leukocyte Biology, 79:639-51 Karagiannis, G.S., Poutahidis,T., Erdman,S.E., Kirsch,R., Riddell, R.H, 2012. Cancer-Associated Fibroblasts Drive the Progression of Metastasis through both Paracrine and Mechanical Pressure on Cancer Tissue, Mol Cancer Res; American Association for Cancer Research.( AACR), 10(11); 1403–18. 53 Kaur,G., Ismail, R., Suk Kam, L., Sabaratnam, S., Ahmad, N., 2006. Assessment Of Correlation Between Clinicopathological Features And Lymph Node Metastases In Breast Cancer , Journal Of Pathology, Vol5. No 2. Kerstin Regner, 2013. Assessment of clinical utility of breast cancer biomarkers uPA and PAI-1 (dissertasion) TECHNISCHE UNIVERSITÄT MÜNCHEN Frauenklinik und Poliklinik des Klinikums rechts der Isar Koscielny, S., Arriagada, R.., Adolfsson, J., et al., 2009. Impact Of Tumour Size On Axillary Involvement And Distant Dissemination In Breast Cancer. British Journal Of Cancer. Sweden, 101:902-07. Kwon, D.S., Kelly, C.M., Ching, C.D., 2012. Invasive Breat Cancer, The Md Anderson Surgical Oncolgy Handbook, 5th Edition., Feig, Barry W., Ching, C.Denise,Editors, Lippincot Williams And Wilkins, Philadelpia, USA, 27-84 Liao, D., Luo, Y., Markowitz, D., Xiang, R., Reisfeld, R.A., 2009. Cancer Associated Fibroblasts Promote Tumor Growth and Metastasis by Modulating the Tumor Immune Microenvironment in a 4T1 Murine Breast Cancer Model ,PLoS One.4(11): e7965 Manuaba Tjakra Wibawa. 2010. Panduan Penatalaksanaan Kanker Solid Peraboi 2010. Indonesia: Cv Sagung Seto. Pp. 17-48. Marsh,T., Pietras, K., McAllister,S.S., 2013. Review Fibroblasts as architects of cancer pathogenesis, Biochimica et Biophysica Acta 1832, 1070–1078 Masuo,K., Sheriddan, T.B., Roman, L.D., 2012. Significance Of Lymphovascular Space Invasion In Epithelial Ovarian Cancer, Cancer Med.1(2):156-164 Meyer,J.S., Alvarez,C., Milikowski, C., Olson,N., Russo,J., Russo, I., et al., 2005. Breast Carcinoma Malignancy Grading By Bloom–Richardson System Vs Proliferation Index: Reproducibility Of Grade And Advantages Of Proliferation Index, Modern Pathology Vol.18, 1067–1078 Micke, P., Östman, A., 2005. Exploring the tumour environment: cancerassociated fibroblasts as target in cancer therapy Expert Opin. Ther. Targets, 9(6):1217-1233 Minisini, A. M., Puglisi, F., De Angelis, C., Arpino, G., 2012. Overcoming treatment resistance in HER2-positive breast cancer: potential strategies. Drugs 72, 1175–1193 Muller, A., Homey, B., Soto, H., Ge, N., Catron, D., Buchanan, ME., et al., 2001. Involvement Of Chemokine Receptors In Breast Cancer Metastasis. Nature Reviews Cancer. Mexico: Macmillan Magazines Ltd, 410:50-56. 54 National Comprehensive Cancer Network (NCCN), 2012. NCCN Clinical Practice Guidelines In Oncology, Breast Cancer Version 3.2014 Available In Https;//Www.Nccn.Org/Professionals/Physician_Gls/Pdf Noh,H., Hong, S., Dong, Z., Pan, Z.K., Jing, Q., Huang,S., 2011. Impaired MicroRNA Processing Facilitates Breast Cancer Cell Invasion by Upregulating Urokinase-Type Plasminogen Activator Expression, Genes Cancer. Feb; 2(2): 140–150. Pedersen, A.N., Christensen, I.J., Stephens, R.W., Briand, P., 2000. Determination the complex between urokinase and its type-1 inhibitor in primary breast cancer: relation to survival, Cancer Res.Dec, 15;60(24):6927-34 Pepper, M.S.,2001. Lymphangiogenesis And Tumor Metastasis: Myth Or Reality?. Clinical Cancer Research. Switzerland, 7:462-68. Ravdin, P.M., De Laurentis, M., Vendely,T., et al., 1994, Prediction Of Axillary Lymph Node Status In Breast Cancer Patients By Use Of Prognostic Indicators,J Natl Cancer Inst.86(23):1771 Roche H., Vahdat L.T. 2010. Treatment Of Metastatic Breast Cancer: Second Line And Beyond, Annals Of Oncology. New York: Oxford University, 22:100010 Sawaki M., Idota, A., Ichikawa, M., Gondo,N., Horio,A., Kondo,N., et al., 2014. Impact Of Intrinsic Subtype On Predicting Axillary Lymph Node Metastasis In Breast Cancer. Oncology Letters. Japan, 8:1707-12. Scully,O.J., Bay, Boon-Huat, Yip, George, Yingnan Yu , 2012. Breast Cancer Metastasis ,Cancer Genomics & Proteomics 9: 311-320 Simpson, J.F.,Gray,R., Dressler, R.G., Cobau,c.D., Falkson, C.I., Gilchrist, K.W., et al., 2000. Prognostic Value Of Histologic Grade And Proliferative Activity In Axillary Node–Positive Breast Cancer: Results From The Eastern Cooperative Oncology Group Companion Study, Est 4189. J Clin Oncol. United States: American Society Of Clinical Oncology, 18:2059-69. Silverstein, M., Michaelson, J.S., Sgrol, D.,Cheongsiatmoi,J.A., Taghian,A., Powell,S., et al., 2003. The Effect Of Tumor Size And Lymph Node Status On Breast Carcinoma Lethality, Cancer,98 ;2133-43. Stacker, S.A., William,S., Shayan,R., Fox, S., 2014. Lymphangiogenesis And Lymphatic Vessel Remodelling In Cancer. Nature Reviews Cancer. Australia: Macmillan Publishers Limited, 14:159-72. 55 Stricker, T.P., Kumar, V., 2010. Neoplasia, In Robbins And Cotran Pathologic Basis Of Disease, 8th Ed., Kumar, Abbas, Fausto, Aster,Editors, Saunders Elsevier, Philadelphia, P 19103-2899 Sumadi, J., 2010. Tingkat Kesesuaian Diagnosis Invasi Limfatik Peritumoral Karsinoma Duktal Invasif Payudara Pada Pulasan Hematoksilin-Eosin Dibandingkan Dengan Pulasan Imunohistokimia Vegfr-3 (tesis), FK Universitas Udayana Tang, L., Han, X., 2013. The urokinase plasminogen activator system in breast cancer invasion and Metastasis, Biomedicine & Pharmacotherapy 67 (2013) 179– 182, 2012 Elsevier Masson SAS. Tan L.G.L., Tan, YY., Heng, D., Chan, M.Y., 2005. Predictors Of Axillary Lymph Node Metastases In Women With Early Breast Cancer In Singapore. Singapore Med J. Singapore, 46(12):693-98. Tobler, N.E., Detmar, M., 2006. Tumor And Lymph Node Lymphangiogenesis— Impact On Cancer Metastasis. Journal Of Leukocyte Biology. United States: Society For Leukocyte Biology, 80:691-96. Togo,S., Polanska,U.M., Horimoto,Y., Orimo,A., 2012 Carcinoma-Associated Fibroblasts Are a Promising Therapeutic Target, Cancers 2013, 5, 149-169; doi:10.3390/cancers5010149 Toikkanen, S., Helin, H., Isola, J., Joensuu, H., 1992. Prognostic significance of HER-2 oncoprotein expression in breast cancer: a 30-year follow-up, J Clin Oncol. 1992 Jul;10(7):1044-8. Tseng, Hsin-Shun,Chen,L., Chen, D., 2014, Tumor Characteristics Of Breast Cancer In Predicting Axillary Lymph Node Metastasis. Medical Science Monitor. China, 20:1155-61. Van Der Wall, Elsken , 2001. Mitotic Activity Index Is High-Risk Node-Negative Breast Cancer, Presented At The 23rd Annual San Antonio Breast Cancer Symposium. Weigelt, B., Peterse, J.L., Van ’T Vee, L.J., 2005. Breast Cancer Metastasis:Markers And Models, Nature Review Wong, S.L., Chao, C., Edwards, M.J.,Ross, M.I., Noyes,R.D., Viar,V., 2002, Frequency Of Sentinel Lymph Node Metastases In Patients With Favorable Breast Cancer Histologyc Subtypes, Presented At The 54th Annual Meeting Of The Southwestern Surgical Congress, Coronado, Calofornia Yarsa,K.Y., Sudarsa, I W.,Manuaba, IBT., 2012. Cinical Initial Response Of Neoadjuvant Chemotherapy In Triple Negative, Her2 And Luminal Types Of 56 Breast Cancer In Breat Cancer In Denpasar (A Preliminary Study), Bali Medical Journal,Vol1 No1,P12-16. Zhu,X.; Ying,J.; Wang,F., Yang, H., 2014, Estrogen Receptor, Progesteron Receptor, And Human Epidermal Growth Factor Recdeptor 2 Status In Invasive Breast Cancer,: A 3.198 Cases Study At National Cancer Cancer, China, Breast Cancer Res Treat, 147(3):551-5