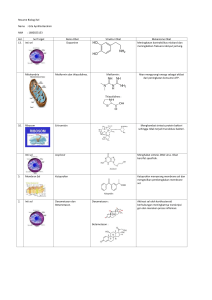
Struktur ribosom
advertisement

Anggota Kode : : Nurlina Ramdianti B1J006004 Hari Kartiko B1J006010 Ahmad Ridwan B1J006012 K37-TD-08 Ringkasan : Sebuah sel E.coli memiliki kira-kira 20.000 ribosom yang terdistribusi dalam sitopalasma. Rata-rata sel manusia mengandung lebih dari itu (sekalipun belum pernah ada orang yang menghitungnya). Beberapa diantaranya berada bebas dalam sitoplasma dan bebrapa lainnya terikat pada permukaan RE (reticulum endoplasma). Pada mulanya ribosom dipandang memiliki hubungan pasif pada proses sintesis protein, melalui struktur yang terjadi pada proses translasi. Pandangan ini berubah pada beberapa tahun kemudian, dan ribosom sehingga dianggap memiliki 2 peran aktif dalam dalam proses sintesis protein : 1. Ribosom mengkoordinasi sintesis protein dengan menempatkan mRNA aminoacyl, tRNA dan menghubungkan faktor protein dengan posisi yang relatif benar satu sama-lainnya. 2. Komponen ribosom meliputi rRNAs, mengkatalisis sedikitnya reaksi kimia yang terjadi selama translasi. Untuk memahani bagaimana peranan ribosom, kita amati fitur struktur ribosom prokakariot bakteri dan eukariot, dan kemudian menguji mekanisme terperinci proses sintesis protein pada kedua tipe organisme ini. Struktur ribosom Pemahaman mengenai struktur ribosom telah dikembangkan secara berangsur-angsur lebih dari 50 tahun, dan semakin banyak struktur yang telah diaplikasikan untuk masalah ini. Awalnya disebut microsome, ribosom yang pertama diamati pada awal abad 20 sebagai partikel kecil hampir diluar kemampuan mikroskop cahaya. Pada tahun 1940 dan 1950, mikroskop elektron pertama menunjukan bahwa ribosom bakteri berbentuk oval dengan ukuran 29 nm x 21 nm, lebih kecil dari ribosom eukariot, dan bermacam-macam ukuran kecil tersebut bergantung pada spesiesnya dengan ciri-ciri sekitar 32 nm x 22nm. Dalam pertengahan 1950an penemuan ribosom adalah pada daerah sintesis protein yang distimulasi percobaan untuk menggambarkan struktur patikel ini dengan lebih detail. Ultrasentrifugasi telah digunakan untuk mengukur ukuran ribosom dan komponennya. Awal proses kemajuan dalam memahami struktur ribosom secara terperinci, tidak datang dari pengamatan dengan mikroskop elektron tetapi dari analisis komponennya dengan ultrasentifugasi. Ribosom utuh memiliki koefisien sedimentasi 80s untuk eukariot dan 70s untuk bacteria, dan masing-masing dapat dipecah / dibagi dalam komponennya lebih kecil [figure.11.10]. • Masing-masing ribosom meliputi 2 subunit, pada prokariot subunit ini 60s dan 40s. Pada bakteria adalah 50s dan 30s, dengan catatan koefisien sedimentasi tidak additive karena hal terebut tergantung pada bentuk seperti halnya masa. • Subunit terbesar berisi 3 rRNAs pada eukariot ( 285, 5.85 dan 55 rRNAs ) tapi hanya ada 2 pada bacteria ( 235 dan 53 rRNAs ). Pada bacteria eukariot sepadan dengan 5.8 rRNA termuat dalam 23 rRNA. • Subunit ribosom mengandung rRNA tunggal pada kedua tipe organisme, masing-masing sebuah 18s rRNA pada eukariot dan sebuah 16s rRNA pada bakteria. • Kedua subunit berisi berbagai protein ribosomal. Dengan angka-angka yang lebih detail ada pada gbr. 11.10. protein ribosom yang kecil disebut S1, S2 dan seterusnya dan yang besar disebut L1, L2 dan seterusnya. Hanya ada satu dari masing-masing protein tiap ribosom, kecuali L7, L12 yang ada sebagai dimer. Gambar 10.11. Komposisi ribosom pada eukariot dan prokariot. Gambar yang lebih detail menunjukan type ribosom eukariot dan ribosom E. coli. Variasi diantara perbedaan spesies berhubungan dengan protein ribosomal. Penyelidikan struktur halus ribosom Sekali komposisi dasar ribosom eukariot dan ribosom bakteria diketahui, maka pengamatan/perhatian di fokuskan pada cara dengan variasi rRNA dan protein di cocokan bersama-sama. Informasi penting telah disajikan oleh urutan RNA pertama, perbandingan diantara daerah yang telah di identifikasi dapat berupa basepair untuk membentuk komponen struktur 2 dimensi [ gbr. 11.11]. Gambar 11.11. Struktur basa RNA 165 pada E.coli. Hal ini menunjukan pasangan basa standar (G-C, A-U) dinyatakan sebagai bar/palang dan pasangan basa yang tidak standar (misalnya G-U) dinyatakan sebagai titik. Hal ini menunjukan bahwa RNA menyediakan sebuah scaffolding dalam ribosom, untuk protein yang diikat, sebuah interpretasi bahwa dibawah penekanan memainkan peranan aktif rRNA yang utama pada proses sintesis protein, tetapi meskipun demikian adalah suatu fondasi yang digunakan untuk penelitian subsequen. Banyak penelitian berikutnya yang dikonsentarikan pada ribosom bakteri yang lebih kecil dari eukariot dan tersedia dalam jumlah besar dari sekitar ekstra sel, yang tumbuh dalam kepadatan tinggi dalam kultur cairan. Sejumlah pendekatan ini telah digunakan untuk mempelajari ribosom bakteri : • Mempelajari perlindungan nuklease yang memungkinkan kontak antara rRNAs dan protein untuk di identifikasi. • Protein-protein crosslinking yang mengidentifikasi pasangan atau kelompok protein, yang ditempatkan tertutup dari satu ribosom ke ribosom lain. • Mikroskopis elektron secara berangsur telah lebih canggih dan memungkinkan untuk mengenal struktur ribosom lebih detail. Sebagai contoh, inovasi rapat mikroskopis imunoelektron, dimana ribosom diberi label dengan anti bodi spesifik sebelum dilakukan pengujian, dan telah digunakan untuk menempatkan posisi protein ini pada permukaan atas ribosom. • Site directed hydroxyl, penyelidikan radikal dengan menggunakan kemampuan ion Fe(11) untuk menghasilkan hydroxyl radical yang membelah ikatan RNA phosfodiester, yang ditempatkan setelah 1 nm dari daerah produksi radicula. Teknik ini telah digunakan untuk menentukan posisi yang tepat protein ribosom S5 pada ribosom E. coli. Asam amino berbeda pada S5 telah dilabeli dengan Fe (11) dan hydroxyl radical diinduksi untuk menyusun kembali ribosom. Posisi pada 16S rRNA telah di bagi kemudian digunakan untuk menyimpulkan / menduga topologi rRNA sekitar protein 55. (gbr. 11.12). Gambar 11.12. Posisi rRNA 165 pada E. coli yang berhubungan dengan protein ribosom S5. Distribusi posisi hubungan (ditunjukan dengan warna merah) untuk ribosom tunggal menekankan tingkat pasangan basa sekunder struktur RNA lebih jauh di lipat dengan struktur 3 dimensi pada ribosom. Ditahun-tahun terakhir teknik ini terus meningkat, dilengkapi dengan X-ray crystallography yang bertanggung jawab untuk mengarahkan pengertian yang mendalam pada struktur ribosom. Analisis sejumlah data yang difraksi X-ray yang diproduksi cyristal dari suatu objek yang sama besar, seperti ribosom adalah tugas yang sangat besar terutama untuk memperoleh struktur yang detail yang cukup informative, tentang bagaimana ribosom bekerja. Tantangan ini telah dijumpai dan strukturnya telah di simpulakan bahwa ribosomal protein mengelilingi segmen rRNA mereka, untuk subunit yang besar dan kecil dan untuk keseluruhan ribosom bakteri yang terlihat pada mRNA dan tRNA. Seperti halnya menyatakan struktur ribosom [ gambar 11.13 ] ini merupakan informasi terbaru, dan mempunyai dampak penting pada pemahaman proses translasi. Gambar 11.13. Gambar ini menunjukan ribosom pada bakteri Thermus thermophilus. Sub unit yang kecil yang berada di atas, dengan 165 RNA pada daerah berwarna biru terang dan sub unit kecil protein ribosom pada daerah yang berwarna biru gelap. Sub unit rRNA yang besar pada daerah berwarna abu-abu dan protein berwarna ungu. Area berwarna emas adalah daerah A site, titik dimana aminoacylated memasuki ribosom selama proses sintesis protein. Daerah ini dan kebanyakan daerah yang benar-benar terjadi proses sintesis protein terletak diantara celah pada kedua subunit. Daftar Pustaka Pustaka utama : http://www.ncbi.nlm.nih.gov/books/bv.fcgi?rid=genomes.section.7627 Daftar gambar : http://www.ncbi.nlm.nih.gov/books/bv.fcgi?rid=genomes.figgrp.7636 http://www.ncbi.nlm.nih.gov/books/bv.fcgi?rid=genomes.figgrp.7638 http://www.ncbi.nlm.nih.gov/books/bv.fcgi?rid=genomes.figgrp.7643 Situs Terkait Animasi http://web.centre.edu/bmb/movies/bmb210translation2.swf http://www.johnkyrk.com/DNAtranslat.de.swf http://jingpinke.syict.edu.cn/jcswx/resources/xijundejiegoujigongenng.swf http://www.acgt.no/pub/acgt/files/cellebioboksen.swf http://www.schule-bw.de/unterricht/faecher/biologie/dna/dna_data/21/21frag.swf http://www.johnkyrk.com/er.de.swf http://www.cmbi.ru.nl/edu/VWO/4vwodag/gene3.swf http://www.ucopenaccess.org/courses/CPBiology/bio_3_1_2_4.swf http://bio3400.nicerweb.com/med/Vid/Klug8e/ch13/13_1_8a.swf http://www.nrc-cnrc.gc.ca/swf/biology_e.swf Html http://www.callutheran.edu/Academic_Programs/Departments/BioDev/omm/ribosom /ribosome.htm http://www.callutheran.edu/Academic_Programs/Departments/BioDev/omm/jmol/rib ome/ribosome.html http://www.molgen.mpg.de/~ag_ribo/ag_franceschi/franceschi-main.html http://www.molgen.mpg.de/~ag_ribo/ag_franceschi/franceschi-projects-50S.html http://cellbio.utmb.edu/CELLBIO/ribosome.htm http://www.cs.stedwards.edu/chem/Chemistry/CHEM43/CHEM43/Ribosomes/Ribos ome.HTML#struct http://www.als.lbl.gov/als/science/sci_archive/125ribosome.html http://biblioteca.universia.net/html_bura/ficha/params/id/31418735.html http://www.biology4kids.com/files/cell_ribos.html http://www.bio.mtu.edu/campbell/ribosome.htm Pdf http://www.new-science-press.com/content/pdf/nsp-ribosomes.pdf http://puglisi.stanford.edu/pdf/pub59.pdf http://www.eknigu.org/info/B_Biology/Spirin%20A.S.%20Ribosomes%20(1998)(33 7s).pdf http://ocw.mit.edu/NR/rdonlyres/Chemistry/5-08JSpring2004/DE61C47F-24C44EB4-85C6-CD63ED84EE1E/0/TD6.pdf http://www.biochemsoctrans.org/bst/030/1159/0301159.pdf