BAB 2 TINJAUAN PUSTAKA 2.1 Siwak
advertisement

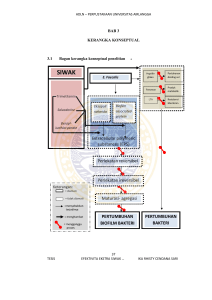
ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA BAB 2 TINJAUAN PUSTAKA 2.1 Siwak ( Salvadora persica.L ) 2.1.1 Klasifikasi siwak Karakteristik, taksonomi, morfologi Salvadora persica.L sudah digunakan penduduk Babilonia semenjak awal abad 3500 SM. Bangsa Arab lebih mengenalnya sebagai siwak, arak, miswak, dalam bahasa Prancis lebih dikenal dengan sebutan arbre a cure- dents. Bahasa Jepang siwak disebut Koyoji, sedangkan dalam bahasa Inggris disebut chewing stick dan toothbrush tree. (Kusumasari, 2012) Gambar 2.1 Tanaman Siwak (Salvadora persica L.). (Kusumasari, 2012) Klasifikasi tanaman siwak (S. persica.L) di dalam Tjitrosoepomo (1998) adalah : TESIS Divisio : Embryophyta Sub Divisio : Spermatophyta Class : Dicotyledons 6 EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA Sub Class : Eudicotiledons Ordo : Brassicales Family : Salvadoraceae Genus : Salvadora Spesies : Salvadora persica Linn 7 Gambar 2.2 Batang kunyah tanaman siwak (Salvadora persica.L). (Kusumasari, 2012) 2.1.2 Morfologi siwak Batang utama siwak diselimuti oleh cabang-cabang yang sangat lebat. Pertumbuhan tanaman ini menuju ke segala arah, sampai cabang-cabangnya menyentuh tanah. Daunnya berbentuk oblongeliptic (seperti telur) sampai bulat dengan ukuran 3x7 cm, berwarna hijau gelap, agak tebal, bagian apeksnya meruncing sampai membulat, mengecil tajam, bagian basis umumnya menyempit, terdapat batas daun yang jelas, tulang daun memiliki panjang sampai 10 mm dan tersusun berlawanan berpasangan. Bunga berwarna kehijauan sampai kekuningan, sangat kecil, mudah lepas dari batang dan terdapat mulai dari bagian aksial sampai ujung panikel (batang dengan cabang bunga yang banyak) sepanjang 10 cm. Buah berbentuk bola, berdaging, memiliki diameter 5-10 mm, TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 8 berwarna merah muda sampai ungu dan semi transparan ketika sudah matang. Siwak yang digunakan biasanya diambil dari akar dan ranting tanaman S. persica.L yang berdiameter antara 0,1 sampai 5 cm.( Pratama, 2005 ; Sher et al., 2010) 2.1.3 Kandungan kimiawi siwak Banyak penelitian yang telah dilakukan untuk mengetahui kelebihan kayu siwak sehubungan dengan kebersihan dan kesehatan rongga mulut. Manfaat siwak terhadap kebersihan dan kesehatan rongga mulut tidak hanya diperoleh dari komponen mekanik yang berupa serat-serat dari batang siwak, akan tetapi juga didapatkan dari komponen kimia yang terkandung di dalamnya. (Mahanani, 2007; Sihotang, 2013) Siwak mengandung trimetilamin, benzylisothio-cyanate, klorida, fluorida, silika, sulfur, klorin, vitamin C, resin, tannin, saponin, flavonoid, alkaloid yang disebut salvadorini, herbal steroid yang disebut 1-sitostreol, sterol dan berkembang, sejumlah besar mineral. Semakin banyak penelitian yang maka semakin banyak ditemukan berbagai macam kandungan kimia bermanfaat yang ada pada siwak. (Mahanani, 2007) 2.1.4 Manfaat siwak Manfaat siwak sudah digunakan berabad- abad yang lalu pada masa kekaisaran Yunani dan Romawi. Siwak semakin dikenal di wilayah Timur Tengah dan Amerika Selatan, dan sekarang siwak sudah digunakan oleh TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 9 penduduk Afrika, Asia, Mediterania, Amerika Selatan dan diberbagai negara lain. (Almas et al., 2004 ; Endarti dkk, 2007) Manfaat dari tanaman ini tidak hanya di dapatkan dari batang, akar, dan ranting. Akan tetapi daun, buah, bunga, dan bijinya pun dapat di manfaatkan pula. Buahnya yang memiliki cita rasa manis bisa dimakan, dimasak dan sering digunakan untuk minuman. Daun biasanya digunakan untuk bahan pembuat saus dan dapat dimakan sebagai salad. Selain itu daun juga bisa digunakan untuk mengobati berbagai macam penyakit seperti skabies, leukoderma, dan sebagainya. Bijinya yang memiliki rasa pahit dapat digunakan sebagai diuretik dan bisa dioleskan pada permukaan kulit pada daerah yang mengalami rematik. (Khatak et al., 2010) Manfaat kandungan siwak dalam bidang kedokteran gigi dapat dijabarkan sebagai berikut (Kusumasari, 2012): 1. Sebagai antibakteri, astringen, abrasif dan detergen yang berfungsi untuk membunuh bakteri, mencegah infeksi, serta dapat menghentikan perdarahan gusi. Pada penggunaan kayu siwak segar untuk pertama kali sering terasa agak pedas karena terdapat kandungan serupa mustard yang merupakan substansi antibakteri. 2. Zat anti pembusukan menurunkan jumlah bertindak sebagai penisilin yang bakteri dalam rongga mulut dan dapat mencegah terjadinya proses pembusukan. Menurut Lewis (1982) , penelitian yang bertujuan untuk mengetahui kandungan Salvadora persica.L sudah dilakukan semenjak abad ke-19, dan ditemukan sejumlah besar klorida, fluor, trimetilamin dan resin. TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 10 Hasil penelitian Farooqi dan Srivastave (1990) ditemukan bahwa batang siwak juga mengandung silika, sulfur dan vitamin C. Kandungan kimia tersebut sangat berpengaruh dalam menjaga kesehatan gigi dan mulut dimana trimetilamin dan vitamin C membantu penyembuhan dan perbaikan jaringan gusi. Vitamin C juga diketahui dapat menimbulkan lingkungan yang tidak menguntungkan pada pertumbuhan bakteri, salah satunya Porphyromonas gingivalis, dimana vitamin C memiliki sifat kemotaktik sehingga meransang sel darah putih untuk menuju sel radang dan melawan bakteri yang ada sehingga baik untuk penyembuhan jaringan periodontal. Kandungan nitrat pada siwak juga diketahui sebagai bahan anionik alami yang dapat berpengaruh pada proses transport aktif bakteri Escherichia Coli dan juga berpengaruh dalam menghambat fosforilasi oksidatif dan intake oksigen bakteri Staphylococcus aureus dan Pseudomonas aeruginosa. Adanya kandungan klorida pada siwak bermanfaat untuk menghilangkan noda dan kalkulus pada gigi, sedangkan silika dapat bereaksi sebagai penggosok. Adanya sulfur memberikan rasa yang hangat dan aroma yang khas, adapun florida berguna sebagai pencegah karies dengan cara memperkuat lapisan email dan mengurangi larutnya terhadap asam yang dihasilkan dari metabolisme bakteri. Kandungan salvadorine sebagai salah satu jenis alkaloid spesifik pada siwak diketahui dapat menghambat kerja enzim yang dihasilkan bakteri untuk mensintesis protein dan menjalankan proses metabolik sehingga energi yang dihasilkan bakteri untuk bertahan hidup tidak mencukupi. (Dwiandari, 2006; Kusumasari, 2012) Di dalam siwak terdapat kandungan bikarbonat yang berfungsi sebagai komponen TESIS untuk mempertahankan sistem bufer dalam rongga mulut. Sistem EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA bufer tersebut turut merangsang 11 produksi saliva, dimana saliva merupakan organik mulut yang berfungsi melindungi dan membersihkan mulut dari sisa-sisa makanan dan bakteri oral. Tanaman siwak mengandung zat-zat antibakteri. Selain itu bahan antimikrobial dan efek pembersih pada siwak telah ditunjukkan oleh variasi kandungan kimiawi yang terdeteksi pada ekstraknya. Efek ini dipercaya berhubungan dengan tingginya kandungan sodium klorida dan potassium klorida seperti salvadourea, salvadorine, saponin, tannin, vitamin C, silika dan resin, serta sianogenik glikosida dan benzylsothio-cyanate. Benzylsothio-cyanate diketahui memiliki mekanisme antibakteri pada bakteri anaerob maupun aerob, terutama bakteri gram negatif yang berbentuk batang secara kuat. Kandungan benzylsothio-cyanate juga diketahui memiliki efektivitas sebagai antimikroba pada jamur Candida albicans serta bakteri S. mutans dan S. aureus. Kajian yang ada sebelumnya juga menjelaskan bahwa tubuh manusia akan memproduksi thiosianat secara alami dan saat mengkonsumsi sayuran tertentu akan terinduksi menjadi benzylsothio-cyanate. Oleh karena itu, kandungan ini berpotensi menjadi bahan aktif antibakteri yang dapat dicerna secara alami oleh tubuh tanpa menyebabkan terjadinya toksisitas pada sel manusia, bahkan dapat menjadi bahan potensial antikarsinogenik. (El Rahman et al., 2002; Sofrata, 2010; Kusumasari, 2012; Naseem et al., 2014) Disisi lain benzylisothio-cyanate bersama trimetilamin dapat menghambat pembentukan asam yang didapatkan dari hasil metabolisme bakteri, sehingga dapat menghambat perkembangan bakteri tersebut. Melalui penelitian yang dilakukan Tennovo (2000), ditemukan bahwa ekstrak siwak dapat menghambat pembentukan asam oleh bakteri S. mutans dalam plak gigi secara in vitro, TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 12 karena adanya kandungan benzylisothio-cyanate di dalam ekstrak siwak tersebut. benzylisothio-cyanate dapat bereaksi terhadap gugus sulfidril dalam enzim yang dihasilkan oleh bakteri sehingga menyebabkan kematian sel pada bakteri. Sedangkan sejumlah kecil flavonoid pada siwak dapat berikatan dengan protein ekstraseluler bakteri dan melarutkannya serta merusak dinding sel bakteri tersebut. Kandungan siwak berupa herbal steroid, yaitu sterol, juga berpengaruh sebagai antibakteri dengan cara mengurangi penumpukan plak yang berpotensi dalam pembentukan koloni awal biofilm. (Darout et al., 2000 ; Dutta, 2012; Kusumasari, 2012; Idris, 2013). Salvadorine merupakan alkaloid spesifik dalam bentuk subtansi organik yang terkandung dalam siwak. Salvadorine mengadung ion klorida yang sangat penting dalam memberikan efek antibakteri dan stimulasi gingiva. Salvadorine menghambat kerja enzim yang dihasilkan bakteri untuk mensitesis protein, menghambat sintesis dinding sel sehingga lapisan dinding sel bakteri tidak terbentuk secara utuh, menjalankan proses metabolik dan menghasilkan anionik organik serta menyebabkan tidak stabilnya membran sel bakteri sehingga terjadi lisis dan kematian sel. (Darout et al., 2000) Tanin ( asam tanan ) yang terkandung di dalam siwak dapat mengurangi perlekatan bakteri pada permukaan gigi yang menjadi biofilm dan plak. Mekanisme tannin dalam menghambat dan mengurangi terbentuknya plak dan menyembuhkan gingivitis adalah dengan cara menghambat enzim glukosil transferase yang diproduksi oleh S. mutans. Apabila enzim glukosil transferase berikatan dengan permukaan sel bakteri, maka lapisan bakteri tersebut akan menghasilkan glukan yang tidak larut dalam air. Pada bakteri golongan TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 13 Streptococci, glukan ini berperan dalam menimbulkan koloni bakteri pada permukaan gigi. Tannin juga diketahui memiliki efektivitas sebagai antiseptik karena adanya gugus ptirogalol dan gugus galoil yang merupakan senyawa fenol. (Darout et al., 2000 ; Dutta, 2012; Idris, 2013). Beberapa penelitian melaporkan bahwa siwak mengandung bahan antibakterial yang memiliki efek terhadap bakteri karies dan bakteri periodontal yang patogen. Penelitian secara in vitro yang dilakukan menyebutkan bahwa siwak dapat menghambat pertumbuhan dilakukan oleh S. mutans, dan Abdelrahman (2000) tentang efek penelitian yang larutan ekstrak siwak terhadap bakteri patogen mulut juga menunjukkan adanya aktivitas antimikrobial pada larutan siwak. Pada konsentrasi 50%, ekstrak siwak diketahui dapat menghambat pertumbuhan bakteri S. mutans. (Darout et al., 2000) Sedangkan hasil penelitian yang lain secara in vitro dari ekstrak siwak sebagai bahan irigasi saluran akar, ternyata memiliki efek antimikrobial terhadap bakteri baik aerob maupun anaerob yang dihasilkan pada gigi nekrosis. Hasil penelitian sebelumnya menunjukkan bahwa 15% ekstrak alkhohol dari siwak menunjukkan efek anti mikrobial yang tidak secara signifikan berbeda dengan cairan antiseptik sodium hipoklorit namun berbeda secara signifikan dari normal saline dan chlorhexidine 0,1%, sedangkan ekstrak siwak 50% dilaporkan memiliki efektivitas yang sama besar dengan chlorhexidine 0,2% dalam melindungi dentin dan bahkan lebih baik dalam menghilangkan smear layer. Hal ini dapat disebabkan karena adanya sejumlah kecil saponin pada siwak yang bekerja serupa detergen. Saponin diketahui memiliki kemampuan sebagai foaming agent yang dapat mereduksi permukaan membran sel dan substrat dalam TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 14 mempertahankan biofilm bakteri. Chlorhexidine merupakan derivat biguanidin yang umumnya digunakan dalam bentuk glukonat. Chlorhexidine bekerja dengan cara melekat dan kemudian merusak membran sitoplasma sel bakteri sehingga kandungan intraselular keluar dari dalam sel. Melalui mekanisme tersebut chlorhexidine menjadi zat antibakteri dengan spektrum luas, yaitu cukup efektif terhadap bakteri Gram positif dan juga pada sedikit Gram negatif. Seperti halnya chlorhexidine, kandungan alkaloid pada siwak dilaporkan memiliki daya antibakteri terhadap bakteri Gram negatif fakultatif anaerob. (Al-Sabawi, 2007). Chlorhexidine memiliki efek anti plak dan bersifat tidak hanya bakteriostatik tetapi juga mempunyai daya lekat yang lama pada permukaan gigi sehingga memungkinkan efek bakterisid . Penelitian yang dilakukan oleh Batwa (2009) tentang penggunaan siwak sebagai penghilang plak, menunjukan hasil bahwa siwak juga sama efektifnya dengan sikat gigi konvensional untuk mengurangi plak pada permukaan bukal gigi. Pemberian ekstrak siwak dengan berbagai konsentrasi, menunjukkan efektivitas dalam menghambat pembentukan plak gigi pada konsentrasi 25%. (Batwa et al., 2009; Paramitha, 2011). Sebuah penelitian lain tentang perbandingan tekstur permukaan dentin setelah diberikan larutan ekstrak siwak dengan pelarut saline, akuades, dan alkohol, menyimpulkan bahwa larutan ekstrak siwak dengan pelarut alkohol dapat lebih banyak menghilangkan smear layer yang ada pada permukaan dentin. Larutan ekstrak ini diberikan dalam konsentrasi 5%, 10%, dan 25% dalam waktu 120 detik. Pemberian ekstrak siwak dengan pelarut normal saline selama 60 detik maupun akuades selama 120 detik tidak dapat menghilangkan smear layer secara sempurna, sedangkan pemberian ekstrak siwak dengan pelarut TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 15 alkohol dapat menjadikan permukaan dentin bebas dari smear layer sehingga koagregasi bersama bakteri untuk mendukung pembentukan biofilm pembentuk plak terhambat. (Almas, 2010). 2.2 Mikroorganisme patogen pada kasus endodontik Mikroorganisme adalah organisme yang berukuran mikroskopik yang hidup sebagai sel tunggal atau dalam bentuk koloni sel, meliputi virus yang terkecil berukuran 20 nm, bakteri, fungi, algae, hingga protozoa terbesar yang berukuran 5 mm. Organisme mempunyai peranan yang sangat beranekaragam, mulai dari penyebab penyakit hingga peranan pentingnya dalam meningkatkan kualitas kehidupan dan kesejahteraan manusia, serta penentu kelangsungan hidup dalam biosfer. (Hidayati, 2011) Patogenitas pada mikroorganisme, menjadi hal yang sangat penting diketahui dalam menangani kasus endodontik. Faktor-faktor virulensi yang menyebabkannya, antara lain berupa eksotoksin yang dikeluarkan oleh bakteri. Selain itu terdapat endotoksin, antara lain berupa lipopolisakarida (LPS), yang menjadi bagian integral pada dinding sel bakteri, khususnya bakteri Gram negatif. LPS dapat meningkatkan immunosurveilance bakteri pada pulpa. Peptidoglikan pada bakteri Gram positif maupun Gram negatif yang juga menjadi komponen utama penyusun dinding sel yang dapat bereaksi dengan sistem imun dan menyebabkan sel pulpa mengalami lisis dan menginduksi makrofag. Pada bakteri Gram positif terdapat Lipoteichoic acid (LTA) tersusun atas teichoic acid dan lipid, yang ada pada dinding sel bakteri mampu melakukan mekanisme patogenitas bersama LPS menuju sel target dan berinteraksi dengan melawan TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 16 antibodi sehingga menyebabkan kerusakan sel target. Fimbriae yang ditemukan pada permukaan bakteri Gram negatif juga terlibat dalam proses adesi permukaan pada substrat dan menginduksi interaksi dengan bakteri yang lain. Kapsul polisakarida juga menjadi faktor virulensi dengan cara melindungi bakteri dari terjadinya kekeringan sel, fagositosis, dan material hidrofobik yang toksik seperti detergen. Vesikel ekstraselular pada bakteri Gram negatif juga memiliki mekanisme patogenitas dengan mengeluarkan lipid dan protein di lingkungan ekstraselular. Protein ekstraselular tersebut memiliki aktivitas proteolitik yang meningkatkan adesi bakteri. Protein ekstraselular berupa enzim juga dapat menyebabkan terjadinya disintegrasi jaringan target dan menyebabkan infeksi. (Narayanan et al., 2010) Menurut Neidhardt terdapat tiga masalah utama yang dihadapi mikroorganisme, termasuk mikroorganisme patogen penyebab kasus endodontik, pada situasi habitat alamiahnya , yaitu: 1. Starvasi dan deplesi nutrien esensial yang berpengaruh langsung terhadap aktivitas metabolismenya. 2. Kompetisi untuk mendapatkan sisi permukaan substrat sebagai tempat melekat. 3. Paparan dari senyawa kimia berbahaya, baik dari lingkungan maupun yang dihasilkan oleh mikroba itu sendiri. Kenyataan ini mendorong munculnya terapi endodontik yang mengacu pada ketiga hal tersebut. Terapi endodontik menjadi populer dengan adanya prediksi semakin meningkatnya kesuksesan prosedur endodontik terhadap pasien. Hal ini mendorong adanya pemahaman lebih lanjut mengenai patologi TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 17 endodontik. Hal yang penting dari terjadinya infeksi endodontik adalah adanya infeksi pada sistem saluran akar gigi dan hal ini menjadi agen etiologi mayor dari terjadinya kasus periodontitis apikalis. Dalam proses terjadinya infeksi endodontik, terdapat banyak mikroba yang terlibat didalamnya dengan bakteri anaerob obligat mendominasi pada infeksi primernya. (Siqueira & Rocas, 2008). Tabel 2.1 : Bakteri penyebab infeksi endodontik (Siqueira & Rocas, 2008) Diantara banyak jenis bakteri, E. faecalis merupakan bakteri anaerob Gram positif berbentuk kokus. Bakteri ini banyak terlibat pada infeksi endodontik. E. faecalis dapat meningkatkan aktivitas lebih lanjut dan menyebabkan infeksi yang lebih dalam lagi sehingga dijumpai pada saluran akar yang sebelumnya telah dilakukan perawatan. (Narayanan et al., 2010) TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 2.3 18 Bakteri Enterococcus faecalis 2.3.1 Klasifikasi bakteri Enterococcus faecalis Klasifikasi bakteri E. faecalis adalah sebagai berikut (Fisher & Philips, 2009): Kingdom : Bacteria Phylum : Firmicutes Class : Bacilli Ordo : Lactobacillales Family : Enterococcaceae Genus : Enterococcus Species : Enterococcus faecalis 2.3.2 Karakteristik dan morfologi Enterococcus faecalis Nama “Enterocoque” pertama kali digunakan oleh Thiercelin pada surat kabar di Prancis pada tahun 1899 untuk mengidentifikasi organisme pada saluran intestinal. Pada tahun 1930, Lancefield mengelompokkan enterococci sebagai streptococci grup D. Kemudian pada tahun 1937, Sherman mengajukan skema klasifikasi dimana nama enterococci hanya digunakan untuk streptococci yang dapat tumbuh pada 100◦C dan 450◦C, pH 9,6 serta dalam 6,5% NaCl dapat bertahan pada suhu 600◦C selama 30 menit. Akhirnya pada periode tahun 1980, berdasarkan perbedaan genetik, enterococci dipindahkan dari genus Streptococcus dan ditempatkan digenusnya sendiri yaitu Enterococcus. (Rocas et al., 2004) TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 19 E. faecalis merupakan flora normal pada manusia yang biasanya terdapat pada rongga mulut, saluran gastrointestinal, dan saluran vagina. E. faecalis merupakan bakteri yang tidak membentuk spora, tidak bergerak, metabolisme fermentatif (karbohidrat menjadi asam laktat), fakultatif anaerob, kokus gram positif dan tidak menghasilkan reaksi katalase dengan hidrogenperoksida. Bakteri ini berbentuk ovoid dengan diameter 0,5-1 μm dan terdiri dari rantai pendek, berpasangan atau bahkan tunggal. (Rocas et al., 2004) Gambar 2.3: Gambaran mikroskopik Enterococcus faecalis (Awawdeh et al., 2009) 2.3.3 Patofisiologi Enterococcus faecalis E. faecalis adalah salah satu spesies bakteri Gram positif dari golongan spesies Enterococci yang dapat diisolasi dari saluran akar. E. faecalis merupakan mikoorganisme yang paling resistan pada penderita infeksi endodontik. E. faecalis sangat resisten terhadap medikasi selama perawatan saluran akar dan menyebabkan kegagalan perawatan saluran akar dalam kasus endodontik. Bakteri ini resisten terhadap antibakteri seperti aminoglikosid, aztreonam, sefalosporin, klindamisin, penisilin semi sintetik serta trimetoprimsulfametoksasol. E. faecalis mempunyai kemampuan penetrasi ke dalam tubuli dentin sehingga memungkinkan bakteri tersebut terhindar dari instrumentasi alat preparasi dan bahan irigasi yang digunakan. (Siqueira, 2002; Rezaei, 2011) TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 20 Bakteri ini sembilan kali lebih banyak terdapat pada infeksi pasca perawatan saluran akar dibandingkan pada infeksi primer . E. faecalis mampu mengkatabolisme sumber energi dan mampu bertahan hidup dalam berbagai lingkungan termasuk pH alkali yang ekstrim maupun pada berbagai suhu. Pada beberapa kasus ditemukan E. faecalis adalah satu-satunya bakteri yang ada pada saluran akar yang sudah diobturasi dengan lesi periradikuler. Kemampuan bertahan hidup dan virulensi dari E.faecalis berasal dari enzim litik, sitolisin, senyawa substansi agregasi, feromon, peptidoglikan dan LTA. Peptidoglikan dan LTA tersebut terdapat pada dinding sel E. faecalis. Peptidoglikan berperan untuk mempertahankan bentuk sel dan menjadi lapisan pelindung terhadap kerusakan oleh tekanan osmotik internal yang tinggi, sedangkan LTA berfungsi untuk menjaga membran sel dan pertahanan permeabilitas eksternal bakteri. Feromon pada E. faecalis juga mampu meningkatkan resistensi dengan menginduksi produksi superoxide dan sekresi enzim lisosom sehingga menyebabkan apoptosis sel osteoblas, osteoklas dan jaringan periodontal sehingga menyebabkan lesi periradikular. E. faecalis juga dapat menghasilkan secreted exotoxin berupa serinprotease dan gelatinase yang berperan dalam proses adesi permukaan. E.faecalis mampu menekan aksi limfosit yang mempunyai potensi untuk berkontribusi dalam kegagalan endodontik. (Pinheiro et al., 2003; Stuart et al., 2006). 2.4 Biofilm Pada habitat alamiahnya, mikroba memiliki dua bentuk kehidupan, yaitu planktonik dan sesil. Sesil terbentuk dengan cara melekatnya mikroba pada TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA permukaan substrat sebagai suatu struktur kompleks 21 yang disebut dengan biofilm. Biofilm dibentuk oleh suatu agregat mikroba sejenis maupun berbeda jenis yang melekat pada permukaan substrat biologis maupun non biologis, dimana satu sel dengan sel yang lainnya saling terikat dan melekat pada substrat dengan perantaraan suatu matriks extracellular polymeric substances (EPS) atau disebut juga exopolysaccharide. Disebutkan pula bahwa biofilm terbentuk oleh koloni sel-sel mikroba dan melekat pada permukaan substrat, berada dalam keadaan diam, dan tidak mudah terlepas. Biofilm dapat terbentuk pada kondisi sel bakteri penyusunnya hidup dan mati. Suatu bakteri dapat tumbuh membentuk biofilm ketika sudah tidak dapat tumbuh dalam bentuk planktonik. Kebanyakan dari biofilm terbentuk oleh sel dari spesies yang sama dibawah kondisi tertentu. (Hall-Stoodley, 2004; Madigan et al., 2010; Skogman, 2012). Daerah permukaan substrat merupakan habitat yang penting bagi mikroba. Lingkungan mikro pada daerah permukaan memiliki jumlah nutrien yang melimpah dibandingkan bagian bawah substrat. Hal ini berdampak langsung pada laju metabolisme dimana aktivitas mikroba daerah permukaan substrat akan lebih tinggi dibandingkan pada bagian bawah substrat. (Hoffman et al., 2005; Karatan & Watnick, 2009). Biofilm dapat dibentuk oleh satu jenis spesies mikroba, maupun lebih dari satu jenis mikroba, termasuk bakteri. Selama dalam biofilm, populasi mengalami mekanisme kompleks termasuk adanya berbagai reaksi biokimia dan menghasilkan substrat yang spesifik. Dari segi fisiologi, pada jenis mikroba yang sama, koloni sel yang tumbuh membentuk biofilm memiliki perbedaan dengan sel planktonik. Sel planktonik bersifat mengambang (floating) dan berenang pada TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 22 medium cair, sedangkan sel dalam biofilm harus dapat merespon berbagai faktor, termasuk mengenal sisi perlekatan spesifik atau non spesifik yang ada pada substrat mikroba. Substrat yang terorganisasi dalam biofilm dapat menghasilkan substansi yang spesifik yang tidak dapat dihasilkan secara individual, sehingga mampu membuat mikroba bertahan hidup pada lingkungan ekstrim, serta resisten terhadap antibiotik, desinfektan, fagosit dan sistem imun. (Hoffman et al., 2005; Karatan & Watnick, 2009) Biofilm dapat ditemukan pada permukaan substrat padat yang bersifat biotik maupun abiotik yang terbenam air dan lembab. Substrat biotik misalnya daun dan batang tumbuhan air, daerah perakaran, kulit dan gigi hewan air, serta usus manusia. Substrat abiotik misalnya jaringan implan, peralatan medis, partikel tanah, batu-batuan, pipa saluran air, bagian bawah galangan kapal, serta substrat lain yang tergenang air. Biofilm dapat tumbuh pada lingkungan ekstrim mulai dari lingkungan yang sangat asam sampai alkalin, sumber air panas, air asin, sampai ke daerah yang sangat dingin seperti di Antartika. (Karatan & Watnick, 2009). 2.5 Faktor yang mempengaruhi pertumbuhan biofilm dan mekanismenya Secara umum, faktor yang mempengaruhi pembentukan dan pertumbuhan biofilm antara lain adalah laju penetrasi nutrien, kelembaban lingkungan (terutama daerah permukaan substrat), temperatur, konsentrasi oksigen, pH, aerobisitas area dalam biofilm, tegangan permukaan, serta tingkat heterogen dan homogen populasi. Faktor-faktor tersebut menginduksi perlekatan mikroba pada permukaan substrat. Namun jenis material substrat yang digunakan mempunyai TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 23 efek yang sangat kecil terhadap pembentukan biofilm, dimana kemampuan bakteri dalam menghasilkan berbagai jenis enzim, dalam hal ini ektoenzim dan eksternal enzim, merupakan faktor yang sangat penting dalam menginisiasi terbentuknya interaksi antara sel dan substrat (Beech et al., 2005; Nester et al., 2007). Gambar 2.4 . Faktor yang berpengaruh terhadap pertumbuhan biofilm (Beech et al., 2005) Berbagai jenis bakteri sebagai salah satu jenis mikroorganisme memiliki faktor adhesin yaitu makromolekul khusus yang berfungsi untuk mengikatkan diri pada reseptor permukaan substrat. Fili dan fimbriae adalah salah satu contoh dari faktor adhesi tersebut. Hidrofobisitas dinding sel juga penting dalam meningkatkan afinitas sel terhadap permukaan substrat. Dengan mengubah komposisi lemak dan protein pada bagian luar membran, maka akan terjadi perubahan muatan dan hidrofobisitas sehingga dinding sel menjadi lebih hidrofobik. Namun, selain itu, adhesi bakteri pada permukaan substrat terutama dapat dimediasi oleh struktur lain berupa matriks mucopolysaccharide yang diekskresikan oleh koloni yang juga disebut sebagai extracellular polymeric substances. (Perklemm, 2000; Donlan, 2002; El Sharoud, 2007) TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 24 EPS dapat berupa kapsul sebagai bagian integral dari matriks biofilm, yang kemudian dilepaskan ke lingkungan (media cair) sebagai suatu sel planktonik atau disebut juga sebagai free EPS. Pada umumnya, EPS yang dihasilkan oleh mikroba merupakan campuran makromolekul kompleks seperti protein yang berasosiasi terhadap pembentukan biofilm (biofilm associated protein), polisakarida yang dihasilkan sel, serta sejumlah lipid, dan asam nukleat, dimana komposisinya berbeda pada masing-masing jenis mikroba, status fisiologi sel, dan berbagai faktor lingkungan lain. EPS sangat penting bagi kehidupan biofilm. EPS dapat menyediakan makanan bagi biofilm, terlibat dalam mekanisme pertahanan inang, dan membantu dalam agregasi dan pelekatan permukaan. Perlindungan EPS menyebabkan biofilm dapat bertahan pada kondisi dimana sel planktonik sudah tidak mampu bertahan hidup. (Wingender et al., 2011). Polisakarida yang menyusun EPS bersifat netral atau disebut polyanionic, khususnya EPS pada bakteri gram negatif. Kehadiran asam uronat (seperti DGlukoronat, D-Galaktonat, Asam Manuronat) atau keton yang terikat pada piruvat, dapat membentuk bagian anionik. Bagian ini merupakan bagian yang penting karena merupakan jalur asosiasi dari ion-ion seperti kalsium, magnesium, yang terlihat melintas berikatan dengan polimer dan menyediakan ikatan yang kuat yang terbentuk pada biofilm. Pada bakteri Gram positif, seperti Staphylococcus, komposisi kimia dari EPS terlihat cukup berbeda, utamanya pada ion kation dimana endapan koagulasi bakteri terdiri dari asam teichioc yang tercampur pada protein dalam kadar yang rendah. (Sanjaya, 2010) TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 25 EPS memiliki daya hidrasi yang tinggi karena dapat mengabsorbsi air dalam jumlah yang besar kedalam struktur ikatan hidrogen. EPS sebagian besar bersifat hidrofobik, meskipun ada EPS yang memiliki sifat hidrofilik. EPS dapat menjadi efek penanda pada biofilm, yaitu, komposisi dan struktur dari polisakarida yang mengindikasikan konformasi utama mereka. Sebagai contoh, beberapa bakteri memiliki EPS dengan ikatan residu 1,3-β-heksosa atau 1,4-βheksosa sehingga cenderung lebih kaku dan pada kasus-kasus tertentu sulit terlarut atau tidak dapat larut. Produksi EPS itu sendiri diketahui berasal dari kondisi nutrien pada medium pertumbuhan, dimana adanya karbon, nitrogen, potasium atau fosfat dapat menghambat sintesis EPS tersebut. (Aparna & Yadav, 2008; Sanjaya, 2010) 2.6 Proses pembentukan biofilm bakteri Terdapat lima tahap pembentukan biofilm bakteri pada substrat. Pada tahap pertama : terjadi perlekatan awal. Pada tahap ini terbentuknya biofilm dimulai dengan perlekatan sel planktonik pada permukaan substrat. Jarak antara sel dan substrat sebesar 50 nm telah mampu menciptakan perlekatan yang dimediasi oleh adanya interaksi elektrostastik dan ikatan van der waals. Sel-sel pada tahap perlekatan awal tidak melekat dengan kuat karena hanya mengandalkan kekuatan ikatan van der waals, sehingga disebut sebagai perlekatan reversibel. Setelah itu, koloni akan berusaha mengikatkan diri lebih kuat pada permukaan dengan menggunakan fili sebagai faktor adhesi. Selama tahap ini, sel bakteri mengalami pertumbuhan secara logaritmik. Perkembangan dan integritas struktur biofilm pada tahap ini sangat tergantung pada quorum – TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA sensing, 26 yaitu molekul ekstraseluler yang dapat meningkatkan komunikasi diantara bakteri. (Kus et al., 2004; Aparna & Yadav, 2008) Gambar 2.5 A) Perkembangan biofilm pada substrat. B) Foto mikroskopik perkembangan biofilm. (http://xnet.rrc.mb.ca/davidb/biofilms.htm) Selanjutnya pada tahap kedua terjadi perlekatan yang permanen melalui faktor adhesin tersebut sehingga disebut sebagai perlekaan irreversible, dimana bakteri mengalami multiplikasi dan mengeluarkan sinyal kimia untuk berkomunikasi secara internal. Substansi EPS mulai bekerja berdasarkan mekanisme genetik dan mikroorganisme dapat melekat dengan bantuan substansi tersebut. (Monroe, 2007; Aparna & Yadav, 2008) Pada tahap ketiga terjadi proses maturasi ke I dimana biofilm mengalami maturasi sehingga terus tumbuh sejalan dengan pertumbuhan koloni. Terjadi pertambahan ukuran dan perubahan bentuk. Pada tahap ini, ketebalan biofilm lebih dari 10 µm. (Aparna & Yadav, 2008). Pada tahap keempat mulai terjadi maturasi yang ke II dan agregasi bakteri. Pada tahap ini ketebalan lapisan biofilm mencapai lebih dari 100 mm dimana TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 27 agregasi mikroorganisme planktonik siap untuk menyebar dan siap menuju tahap proses yang terakhir. (Monroe, 2007; Aparna & Yadav, 2008) Pada tahap kelima ini terjadi proses dispersi, dimana biofilm akan memasuki tahap kelima beberapa hari setelah tahap keempat. Pada tahap ini .terjadi dispersi sel sehingga memungkinkan beberapa bakteri meninggalkan biofilm untuk berkembang kembali menjadi sel planktonik dan menyebar serta berkolonisasi di tempat lain. Pada tahap ini sel-sel dalam koloni akan terlepas sendiri atau bersama sebagian komponen matriks. Matriks ekstraseluler biofilm akan didegradasi oleh enzim dispersin B dan deoxyribonuclease . Enzim tersebut dapat dimanfaatkan sebagai agen anti-biofilm. Pada P. aeruginosa dan C. albicans, asam lemak cis-2-decenoic acid diketahui mampu menginduksi dispersi dan menghambat pertumbuhan koloni biofilm. (Kaplan et al., 2004; Xavier et al., 2005; Monroe, 2007; Izano et al., 2008; Davies et al., 2009). 2.7 Mekanisme Resistensi bakteri dan biofilmnya Terdapat perbedaan signifikan pada spesies mikroba yang sama, antara yang hidup dalam biofilm dengan yang hidup dalam bentuk planktonik. Biofilm membantu mikroba dalam meningkatkan daya resistensinya. Sel-sel mikroba sesil tersebut melepaskan antigen yang dapat menstimulasi antibodi host, namun antibodi tersebut tidak efektif membunuh biofilm meskipun pada host yang memiliki reaksi imunseluler dan humoral yang berkembang dengan baik. Sejalan dengan itu, populasi dalam biofilm dapat mengembangkan kemampuan resistensinya bahkan dapat meningkat 10 -1000 kali lipat dibandingkan dalam keadaan planktonik. Matriks biofilm melindunginya dari pengaruh senyawa kimia TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 28 merugikan sehingga mereka lebih kooperatif dan dapat berinteraksi dengan lingkungan. (Stewart & Costerton, 2001; Monroe,2007, Aparna & Yadav, 2008) Gambar 2.6 : Mekanisme biofilm bakteri untuk meningkatkan resistensi (Kishen, 2012) Biofilm adalah suatu bentuk mekanisme pertahanan sel. Berdasarkan studi in vitro, biofilm dapat menghindari serangan sel inang. Sebagai contoh, sel fagosit sulit untuk menelan bakteri dalam bentuk biofilm. Biofilm juga lebih resisten dibandingkan dengan sel planktonik terhadap agen antibakteri. Contohnya, khlorinasi biofilm sering tidak berhasil sebab bahan antibakteri hanya membunuh bakteri pada lapisan luar biofilm, dan tidak mampu berpenetrasi ke dalam lapisan biofilm sedangkan bakteri bagian dalam tetap hidup dan biofilm dapat berkembang, dimana persister cell yang ada memiliki resistensi yang lebih kuat. Antibakteri juga dapat dirusak oleh enzim yang dikeluarkan oleh matriks biofilm. Penggunaan ulang agen antibakteri dapat meningkatkan resistensi biofilm tersebut melalui mekanisme quorum-sensing dan ekspresi gen penyebab resistensi yang spesifik. (Sanjaya, 2010; Kishen, 2012) TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 29 Namun tidak semua jenis mikroba biofilm mempunyai resistensi yang kuat terhadap senyawa antimikroba. Contohnya, pada bakteri P. aeruginosa, bentuk biofilmnya tidak lebih resisten bila dibandingkan dengan bentuk sel planktoniknya pada fase stasioner, meskipun biofilm lebih resisten dibandingkan dengan sel planktonik pada fase logaritmik. Kemampuan resistensi sel bakteri dalam bentuk planktonik pada fase stasioner dan biofilm pada fase logaritmik dikarenakan adanya sel-sel yang memang menjadi lebih resisten saat memasuki fase tersebut atau bahkan sel tersebut memang bersifat resisten pada awal terbentuk. Resistensi biofilm bakteri terhadap antibakteri juga dipengaruhi oleh ketebalannya. Semakin tebal biofilm, maka akan semakin sulit antibakteri berpenetrasi kedalam biofilm tersebut (Hojo et al., 2009; Spoering & Lewis, 2001; Mah & O’tolle, 2001) Zat antibakteri dapat melakukan resistensi bakteri tersebut melalui aktivitas untuk melawan bentuk beberapa mekanisme. Mekanisme yang pertama dilakukan dengan mengganggu sintesis dinding sel. Sintesis dinding sel bakteri dapat diganggu zat antibakteri, sehingga dinding sel yang terbentuk menjadi tidak sempurna dan tidak tahan terhadap tekanan osmotis, sehingga menyebabkan pecahnya sel. Sintesis molekul lipoprotein membran sel bakteri akan terganggu, sehingga membran menjadi lebih permeable yang menyebabkan keluarnya zat-zat penting dari sel. Zat antibakteri juga dapat berperan sebagai antagonis ringan, sehingga dapat bersaing dengan zat-zat yang diperlukan untuk proses metabolisme bakteri, sehingga proses tersebut terhenti. (Idris, 2013) Dalam melawan resistensi bakteri, juga dapat dilakukan upaya untuk mengganggu sintesis protein sel, dimana zat antibakteri dapat berikatan dengan TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 30 sub unit ribosom bakteri, sehingga menghambat sintesis asam-asam amino dan menghasilkan protein yang inaktif. Selain itu, zat antibakteri dapat mengganggu sintesis asam nukleat pada bakteri. Hal ini disebabkan karena kelangsungan hidup sel sangat tergantung pada molekul-molekul protein dan asam nukleat tersebut. Gangguan apapun yang terjadi pada pembentukan atau fungsi zat-zat tersebut dapat mendenaturasi sel bakteri. Sel bakteri dapat rusak tanpa dapat diperbaiki lebih lanjut. (Idris, 2013) Tingkat ketahanan mikroba dalam biofilm terhadap berbagai antibiotik sebagai salah satu bentuk zat antibakteri yang diujikan dapat dilihat dari beberapa hasil penelitian sebelumnya. A. pyogenes, S. aureus, S. hyicus, S. agalactiae, C. renale, atau C. pseudotuberculosis yang terorganisasi dalam biofilm, tidak dapat terbunuh oleh antibiotik yang diujikan, namun bentuk planktoniknya sensitif antibiotik pada konsentrasi rendah. S. dysgalactiae baik dalam bentuk biofilm maupun planktonik tetap sensitif terhadap penicillin, ceftiofur, cloxacillin, ampicillin, dan oxytetracyclin, sedangkan E. coli dalam bentuk planktonik sensitif terhadap enrofloxacin, gentamicin, oxytetracycline dan trimethoprim, sulfadoxine. Enrofloxacin dan gentamicin efektif terhadap E. coli dalam bentuk biofilm. Penelitian sebelumnya juga menjelaskan bahwa bakteri Salmonella spp. dan P. Aeruginosa dalam bentuk planktonik diketahui sensitif dengan enrofloxacin, gentamicin, ampicillin, oxytetracycline, dan trimethoprim, sulfadoxine, namun dalam bentuk biofilm, bakteri tersebut hanya sensitif terhadap enrofloxacin. (Merle et al., 2002) TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 2.8 31 Biofilm Endodontik Mikroorganisme yang dapat hidup dalam cakupan biofilm endodontik harus memiliki kemampuan untuk membentuk dirinya sendiri (autopoeisis), melakukan homeostasis, menjadi lebih efektif saat berasosiasi daripada saat diisolasi, dan dapat merespon perubahan lingkungan sebagai suatu kesatuan unit biofilm dibandingkan sebagai planktonik individual ( bersifat communality). (Narayanan et al., 2010) Tiga komponen utama pembentukan biofilm, termasuk biofilm endodontik adalah sel bakteri, permukaan solid, serta medium cair yang mengandung nutrisi. Biofilm endodontik memiliki kategori sebagai berikut (Narayanan et al., 2010) : 1. Intracanal biofilm, yang dibentuk pada dentin saluran akar gigi yang terinfeksi 2. Extraradicular biofilm, yang dibentuk pada permukaan sementum akar gigi yang terinfeksi 3. Periapical biofilm, yang dibentuk pada jaringan periapikal gigi 4. Biomaterial centered biofilm, yang terbentuk pada material obturasi saluran akar yang pernah dirawat. Biofilm bakteri yang terbentuk pada regio periapikal memiliki kemampuan untuk mempertahankan mekanisme host dan menginduksi infeksi periapikal yang lebih lanjut. Mekanisme resistensi utama dari biofilm bakteri endodontik terhadap agen antimikroba diantaranya berupa resistensi yang berasosiasi dengan matriks eksopolisakarida yang disebut sebagai extracellular polymeric substances (EPS), tingkat pertumbuhan dan ketersediaan nutrisi, serta adanya adopsi fenotip faktor resistensi. EPS yang ada pada biofilm bakteri terbentuk dari layer-layer multipel TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 32 yang ditanam oleh bakteri, dimana EPS tersebut memiliki potensi untuk memodifikasi respon bakteri terhadap antimikroba dengan bersandiwara sebagai “diffusion shield” atau tameng dan menjadi penetralisir efek kimiawi dari anti antimikroba tersebut. Resistensi biofilm endodontik ini juga berkaitan dengan lambatnya pertumbuhan dan proses starvasi dari bakteri yang tersisa di biofilm sehingga memperlambat pengenalan bakteri terhadap antimikroba dan menghasilkan banyak persister cell. (Narayanan et al., 2010; Kishen, 2012). Tujuh bakteri patogen endodontik yang memiliki kemampuan untuk berpenetrasi pada tubuli dentin saluran akar secara in vitro, antara lain, P. endodontalis, P. gingivalis, F. nucleatum, A. israelli, P. acaes, C.albicans, golongan Streptococcus, dan terutama E. faecalis. Ketika bakteri tersebut hadir sebagai sel planktonik di saluran akar, maka masih mudah untuk dieliminasi oleh instrumen saluran akar serta substansi yang terkait dengan terapi endodontik. Namun ketika terorganisir menjadi biofilm, baik dalam bentuk monospesies maupun multispesies, maka bakteri tersebut akan melekat dengan baik di dinding saluran akar maupun pada penghubung lateral antara saluran akar dengan tubuli dentin. Bagian tersebut menjadi bagian yang sulit diatasi dan membutuhkan strategi terapi yang baik untuk mengatasinya. (Siqueira & Rocas, 2008). Bahan irigasi saluran akar seperti NaOCl, EDTA, Carsodyl®, Iodine, SDS (Sodium Dodecyl Sulphate) dan CTAB (Cetyl Trimethyl Ammonium Bromide) yang diberikan selama 1,5 – 10 menit dapat berpengaruh terhadap terjadinya pelepasan sel. Berdasarkan pengelompokan jenis bakteri, spesies bakteri Gram positif lebih resisten terhadap terjadinya pelepasan agregasi sel dibandingkan bakteri Gram negatif. Melalui confocal laser scanning microscopy dapat juga TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 33 dilihat terganggunya pembentukan biofilm bakteri didapatkan dari pemberian NaOCl. Disamping itu, iodine hanya dapat membunuh bakteri tersebut tanpa menghambat dan menganggu pembentukan biofilm. Sedangkan CTAB dan SDS dapat melakukan keduanya , baik menghambat pembentukan biofilm maupun membunuh bakteri planktoniknya ( disrupting and killing method). Penelitian membuktikan bahwa bahan irigasi chlorhexidine juga dapat mereduksi perlekatan bakteri E. faecalis yang merupakan bakteri Gram positif hingga 72%. (Siqueira & Rocas, 2008, Bryce et al., 2008) E. faecalis merupakan bakteri yang sangat erat kaitannya dengan kegagalan perawatan saluran akar, dimana diketahui struktur biofilmnya dapat memberikan pertahanan terhadap host maupun medikamen saluran akar yang digunakan. Biofilm dapat beradaptasi dalam lingkungan yang buruk dan dapat melakukan metabolism secara aktif walaupun dalam kondisi kekurangan nutrisi. Terapi antimikroba dapat mengeliminasi mikroba bebas atau yang disebut sebagai planktonik , namun tidak dapat sepenuhnya menghilangkan sel-sel yang terikat pada biofilm sehingga menimbulkan infeksi yang berulang. (Athanassiadis, 2010) Strategi terapi infeksi endodontik dengan biofilm sebagai sasarannya dapat dilakukan dengan metode menginaktivasi residen bakteri pada struktur biofilm, melakukan pemecahan struktur biofilm dan matriksnya, melakukan destruksi perlahan pada struktur biofilm, melakukan destruksi pada persister cell dan menganggu proses quorum-sensing pada biofilm, melakukan difusi ke dalam struktur biofilm dan membunuh bakteri penyusun yang ada didalamnya. (Siqueira & Rocas, 2008) TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 2.9 34 Patofosiologi biofilm Enterococcus faecalis E. faecalis mempunyai protein serin, gelatinase, dan protein pengikat kolagen yang membantu perlekatannya pada substrat dentin. Sebagian kecil dari koloni E. faecalis akan menginvasi dan bertahan di tubulus dentin. Kelebihan dari E.faecalis adalah kemampuannya untuk bertahan hidup tanpa makanan sampai memperoleh nutrisi yang adekuat. Di dalam tubulus dentin, bakteri ini dapat bertahan dari medikamen intrakanal CaOH2 sampai lebih dari dari 10 hari. Dalam kondisi tersebut, E. faecalis mampu membentuk biofilm, dan kemampuannya dalam membuat biofilm tersebut dapat meningkatkan pertahanan terhadap terjadinya dekstruksi. (Pinheiro et al., 2003 ; Stuart et al., 2006). Pada bakteri E. faecalis, faktor virulensi yang berpengaruh, diantaranya berupa substansi agregasi yang membentuk struktur intraselular multilayer sebagai syarat pembentukan biofilm. LTA yang diproduksi E. faecalis juga berfungsi untuk menjaga membran sel dan pertahanan permeabilitas eksternal bakteri, sedangkan peptidoglikan yang dihasilkan juga berperan dalam mempertahankan bentuk sel melalui dinding sel bakteri. Selain itu, feromon pada E. faecalis mampu meningkatkan resistensi dengan menginduksi produksi superoxide dan menyebabkan apoptosis jaringan. (Pinheiro et al., 2003 ; Stuart et al., 2006). Pada E. faecalis juga ditemukan gen yang berperan sebagai protein yang spesifik terhadap perlekatan pada permukaan substrat,yaitu Enterococcal Surface Protein (Esp). Protein tersebut berperan penting dalam pembentukan biofilm. Biofilm yang dibentuk mampu menghambat toleransi terhadap antibiotik vancomycin dan teicoplanin. Dasar pembentukan biofilm pada bakteri ini TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 35 sebenarnya belum diketahui pasti, namun studi terbaru lainnya yang menyebutkan bahwa gelatinase (GelE) sebagai suatu matriks metalloproteinase, mampu menginduksi produksi matriks polimer ekstraselular sehingga meningkatkan transduksi dan meregulasi respon pembentukan dan adesi pada biofilm. GelE dapat meningkatkan produksi peptida yang memberikan sinyal ekstraselullar melalui sekresi prekursor peptida yang tidak aktif menjadi aktif sehingga mempercepat proses pematangan biofilm. GelE juga diketahui terlibat dalam proses separasi sel pada pembentukan dan pematangan biofilm. Dengan kemampuannya menghasilkan biofilm, E. faecalis menjadi 100 kali lipat lebih resisten terhadap fagositosis, antibodi, dan antimikroba dibandingkan organisme lain yang tidak membentuk biofilm. (Kristich et al., 2004; Portnier, et al., 2003; Wang et al., 2011). GelE merupakan metalloprotease ekstraseluler yang dapat menghidrolisis gelatin, kolagen, dan kasein. GelE juga memecah fibrin sekaligus menghasilkan autolisin dari permukaan sel bakteri sehingga memungkinkan terjadinya kolonisasi bakteri yang melekat pada matriks. Proses autolisin tersebut terjadi dalam kondisi hidrofobik sehingga hidrofobisitas permukaan sel meningkat sehingga proses terbentuknya biofilm juga meningkat. GelE bersama sedikit substansi SprE (serin protease) menjadi operon, yaitu gen yang berada dalam suatu unit transkripsi yang mampu menciptakan adanya quorum-sensing pada bakteri. Mekanisme quorum-sensing yang dihasilkan GelE, Esp, dan SprE pada proses pembentukan biofilm bakteri e. faecalis ini disebabkan oleh adanya fsr locus. Fsr menyandi sistem komponen sinyal transduksi dan menghasilkan gen fsrA, fsrB, dan fsrC. FsrB menghasilkan peptide autoinduksi yang disebut sebagai TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI ADLN – PERPUSTAKAAN UNIVERSITAS AIRLANGGA 36 gelatinase biosynthesis activating pheromone (GBAP) yang ketika terakumulasi pada masa transisi menuju fase stasioner dapat menginduksi GelE, sprE dan Esp tersebut. Aktivitas gelatinase tersebut dapat membangun kerangka yang solid dalam pembentukan awal biofilm. Operon yang dihasilkan dari mekanisme tersebut bersama fsr memiliki fungsi intrinsik dalam menjadi antagonis bahan antimikroba. ( Carniol & Gilmore, 2004; Duggan & Sedgley, 2007; Mohamed & Huang, 2007; Archer, 2011; Skogman et al., 2012; Gupta, 2015) TESIS EFEKTIVITA EKSTRA SIWAK … IKA RHISTY CENDANA SARI