Karakteristik Imunoglobulin Y Antitetanus Diisolasi
advertisement

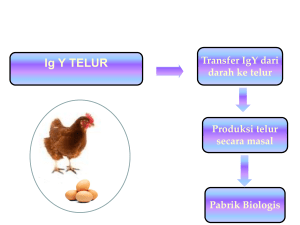
TINJAUAN PUSTAKA Sistem Imun Sistem imun dimiliki oleh semua spesies, digunakan untuk mempertahankan diri melawan benda asing yang masuk ke dalam tubuh. Keberadaan protein asing dan patogen dimonitor secara rutin oleh tubuh melalui pelepasan imunoglobulin. Sistem kekebalan akan mampu mengenali spesifik zat kimia yang membedakan sebuah patogen asing dari yang lainnya, serta mampu mengenali molekul asing dengan sel-sel tubuh beserta protein -proteinnya (Kuby 1997). Antibodi mampu mengenali dan berikatan dengan antigen spesifik sampai ribuan atau jutaan antigen. Interaksi antigen-antibodi merupakan interaksi biologi yang sangat spesifik. Sifat khusus itu yang dimanfaatkan dalam teknik imunologi (Abbas et al. 1997). Pertahanan tubuh melawan infeksi dapat diba gi atas dua yaitu : kekebalan alamiah (non spesifik) dan kekebalan spesifik (adaptive). Kekebalan non spesifik meliputi empat tipe pertahanan yaitu : pertahanan secara anatomi, fisiologi, fagositik, dan peradangan. Pertahanan secara anatomi merupakan pertahanan tubuh yang pertama mencegah masuknya mikrob patogen ke dalam tubuh. Pertahanan secara anatomi terdiri atas barier fisik kulit, selaput lendir, silia, proses batuk, dan bersin. Barier fisik berperan mencegah penetrasi patogen ke dalam tubuh dengan cara melisiskan dan menghambat kolonisasi kuman. Sebagian besar bakteri gagal untuk hidup lebih lama pada kulit karena pengaruh hambatan langsung dari asam laktat dan asam lemak yang disekresikan kelenjar keringat dan sekresi glandula sebaseus (Roitt 1988) . Pertahanan secara fisiologi akan menghambat perlekatan patogen yang masuk ke dalam tubuh melalui mekanisme fisiologi seperti pengaturan temperatur, pH, sekresi mucus, dan pelepasan mediator kimia (lisozim, sekresi sebaseus, asam lambung, laktoferin, dan asam neuramik), dan faktor humoral (komplemen, dan interferon). Pertahanan fagositik diperankan oleh sel hetrofil, basofil, eosinofil, sel natural killer, dan sel mast. Sel itu akan mencerna dan menghancurkan mikrob asing, serta membunuh sel tubuh yang ter infeksi kuman. Jaringan yang telah rusak dan infeksi menyebabkan reaksi peradangan (Halliwell dan Gorman 1989; Kuby 1997). 8 Respon imun spesifik terbentuk dari kemampuan tubuh menghasilkan respon yang spesifik untuk melawan patogen yang masuk ke dalam tubuh. Secara klasik respon imun spesifik dikelompokkan menjadi kekebalan humoral dan kekebalan berperantara sel (Roitt 1988). Dua tipe sel yang berperan secara aktif yaitu makrofag dan limfosit. Makrofag menguraikan antigen untuk disajikan pada sistem imum, dan limfosit mengenali fragmen antigen yang disajikan untuk produksi antibodi (Halliwell dan Gorman 1989). Imunitas spesifik selama merespon substansia asing juga membentuk sel memori sehingga mudah mengenali antigen jika terjadi paparan yang berulang (Roitt 1988). Respon humoral meliputi interaksi sel B (sel plasma) dengan antigen dan selanjutnya proliferasi dan diferensiasi membentuk antibodi dengan atau tanpa bantuan sel T. Limfosit B mengekspresikan imunoglobulin permukaan yang spesifik terhadap epitop dari antigen, dan limfosit T mengenali antigen yang telah diproses pada sel presenting antigen. Antibodi yang disekresikan oleh sel plasma menghasilkan antibodi soluble (terlarut). Respon imun selular meliputi interaksi reseptor sel T dan antigen yang telah diproses. Respon itu melalui dua jalur. Pertama , interaksi sel T dengan antigen dan sekresi limfokin untuk menarik makrofag yang akan memfagositosis antigen. Kedua, interaksi sel T sitotoksik dengan antigen yang dipresentasikan oleh MHC II yang akan menyebabkan lisis sel (Roitt 1988). Berdasarkan proses terbentuknya kekebalan dalam tubuh, kekebalan dibedakan atas dua tipe, yaitu kekebalan aktif dan kekebalan pasif. Pada proses imunisasi aktif tubuh akan memproduksi antibodi dan memberi kekebalan yang lama. Pada imunisasi pasif antibodi terbentuk segera tetapi memberikan perlindungan dalam waktu singkat (Abbas et al. 1997). Neonatus mendapatkan kekebalan dari induk melalui kolustrum selama laktasi pada mamalia dan kuning telur pada reptil dan burung (Anonim 2002). Kuning telur ayam telah diteliti dan mengandung lebih dari 200 antibodi berbeda. Setiap protein asing atau mikrob yang memapar ayam baik dengan cara imunisasi atau terpapar secara alami akan diproses dan menimbulkan antibodi untuk melawan bahan asing itu. Antibodi akan berkumpul di kuning telur dengan titer yang berbeda tergantung derajat paparan. Ayam adalah hewan yang paling 9 optimal memproduksi antibodi, dibandingkan dengan mamalia yang hanya memproduksi kolustrum saat partus (Da vis and Reeves 2002). Produk imun itu memberikan perlindungan secara alami terhadap infeksi selama perkembangan sistem imun anak belum berfungsi optimal (Anonim 2002). Imunoglobulin Imunoglobulin atau antibodi adalah kelompok protein yang mempunyai kema mpuan berikatan secara spesifik pada antigen dan mengeluarkan antigen itu dari tubuh. Antibodi adalah molekul protein yang dihasilkan oleh sel plasma sebagai akibat interaksi antara limfosit B peka antigen dengan antigen khusus (Kuby 1997). Struktur dasar dari antibodi tersusun atas empat rantai polipeptida yaitu dua rantai berat dan dua rantai ringan yang identik (Male et al. 1987). Rantai berat (H) dan rantai ringan (L) disatukan oleh ikatan kovalen disulfida. Posisi ikatan sulfida bervariasi tergantung dari kelas dan subkelas antibodi. Setiap molekul antibodi terbagi atas bagian yang dapat berubah (variable) dan bagian yang tetap (konstan). Bagian variable merupakan tempat pertautan antigen, sedangkan bagian konstan tempat sifat biologi antibodi. Bagian variabel dihubungkan dengan bagian konstan oleh bagian engsel. Pada bagian variabel terdapat bagian hipervariabel untuk mengenali berbagai variasi antigen. Bagian variabel dan konstan terdapat pada rantai berat dan rantai ringan antibodi (Kuby 1997). Secara umum imunoglobulin pada mamalia dibagi ke dalam lima kelas berdasarkan struktur regio konstan rantai berat, yaitu Ig G (γ), IgA (α ), Ig M (µ), Ig D (δ), dan Ig E (ε) dan dua tipe rantai ringan kaffa (κ) dan lamda (λ). Pada setiap molekul antibodi terdapat hanya satu tipe rantai ringan (Roitt 1988). Sedangkan pada sistem pertahanan unggas (ayam) ada tiga kelas imunoglobulin (Ig), yaitu IgA, IgY, dan IgM (Shimizu et al. 1992; Hatta et al. 1993; Sharma 1997). Di antara spesies avian, sistem imun aya m telah dipelajari de ngan intensif (Davis and Reeves 2002). Struktur imunoglobulin M dan A ayam mirip dengan yang ditemukan pada mamalia sedangkan struktur IgG mamalia berbeda dengan IgY ayam (Sharma 1997). Selain imunoglobulin, perlindungan terhadap patogen pada unggas juga diperankan oleh organ pertahanan yang terdiri atas bursa 10 fabricius, bone marrow, limpa, timus, glandula harderian, limponodus, limfosit yang bersirkulasi, dan jaringan limfoid pada saluran cerna (Shimizu et al. 1992; Hatta et al. 1993; Sharma 1997). Imunoglobulin Y Terminologi (istilah) IgY telah diperkenalkan sejak tahun 1969 dalam literatur yang diistilahkan dengan 7-S Ig terutama yang terdapat di serum, tetapi juga ditemukan dalam isi duodenum, bilasan trakea, dan plas ma seminal (Hadge dan Ambrosius 1984). Imunoglobulin Y telah diisolasi dari unggas (kalkun, ayam, itik, angsa) , ampibi, reptil (Hadge 1985), dan kura-kura darat (Hadge dan Ambrosius 1986). Pada awalnya, beberapa peneliti menduga bahwa IgY yang dihasilkan bangsa unggas sama dengan IgG mamalia, sedangkan kenyataannya berbeda (Szabo et al. 1998). Transpor IgY dari serum induk ke anak meliputi dua proses. Pertama , IgY ditransfer melewati epitel folikular dari ovari dan berakumulasi dalam kuning telur selama masa oogenesis, yang mirip dengan proses transfer IgG melalui plasenta pada mamalia. Kedua, pemindahan IgY dari kuning telur ke embrio yang sedang berkembang. Isotipe antibodi yang lain seperti IgA dan IgM ditransfer dalam jumlah terbatas ke putih telur (Sharma 1997). Konsentrasi IgY dalam kuning telur konstan sampai oosit matang. IgY tidak terdapat dalam putih telur, sedangkan IgA dan IgM hanya terdapat dalam putih telur. Tidak terjadi seleksi atau destruksi IgY selama proses transfer itu (Davis and Reeves 2002). IgY dalam kuning telur dipersiapkan untuk memberikan kekebalan pasif pada anak ayam. Kuning telur mengandung 8 sampai 20 mg IgY per ml atau 136 sampai 340 mg per kuning telur. Dalam setahun dapat diisolasi 30 g sampai 40 g IgY (Shimizu et al. 1992), sedangkan pada mamalia hanya 1.3 g (Davis and Reeves 2002). Hal itu menyebabkan ayam sebagai sumber IgY mendapat perhatian serius (Shimizu et al. 1992). Penelitian dan penggunaan Ig dari ayam, terutama IgY untuk terapi, pencegahan, dan diagnostik dalam satu setengah dekade terakhir berkembang dengan pesat. Secara alami IgY ayam berbeda dengan IgG mamalia dalam hal berat molekul, titik isoelektrik, berikatan dengan komplemen, dan spesifisitas terhadap 11 antigen yang diberikan (protein, bakteri, virus dan parasit ) (Hatta et al. 1993). Sedangkan berat molekul, morfologi, dan mobilitas imunoelektroforetik dari IgA dan IgM ayam mirip dengan IgA dan IgM mamalia (Davis and Reeves 2002). IgY tidak bereaksi silang dengan komponen struktural jaringan mamalia (Larsson et al. 1993). Hal ini me mberikan indikasi penggunaan IgY dalam diagnostik imunologis akan menghasilkan reaksi yang lebih spesifik. Hassl et al. (1987) melaporkan spesifisitas antibodi serum IgY ayam yang di imunisasi dengan antigen toxoplasma gondii lebih tinggi dibandingkan dengan serum antibodi IgG kelinci. Lebih lanjut, antibodi spesifik (IgY) yang ada dalam darah induk ayam, secara baik dapat ditransfer ke dalam telur. Titer IgY dalam darah dan dalam telur tidak berbeda secara signifikan (Larsson et al. 1993), dan tidak ada perbedaan kandungan IgY pada dua spesies ayam berbeda (Li et al. 1998). Sehingga telur dapat digunakan sebagai sumber protein hewani dan sebagai pabrik produksi antibodi (Regenmortel 1993; Losch et al. 1986). Imunoglobulin Y secara struktural berbeda dengan IgG pada mamalia. Rantai berat IgG dengan berat molekul (BM) 50 kDa terdiri atas empat domain yaitu : domain variabel (VH) dan tiga domain konstan (Cã1, Cã2, dan Cã3). Domain Cã1 terpisahkan dari Cã2 oleh regio engsel dan berhubungan secara fleksibel pada fragmen Fab. Sebaliknya rantai berat IgY dengan berat molekul 65 sampai 70 kDa , dan 2 rantai ringan (22 sampai 30 kDa). IgY memiliki berat molekul 180 kDa , tidak memiliki regio engsel dan memiliki empat domain konstan pada rantai berat yaitu Cυ1, Cυ2, Cυ3, dan Cυ4 (Schade et al. 1996) . IgY kekurangan domain Fc dan tidak dapat berikatan dengan komplemen mamalia atau protein A atau G dari mikrob, sehingga protein A dan G tidak dapat digunakan untuk purifikasi IgY, tetapi dengan modifikasi menggunakan antibodi rabit-anti-IgY, protein A dapat digunakan untuk isolasi IgY (Magor et al. 1994a). Perbedaan struktur kedua Ig ini dapat dilihat pada Gambar 1. 12 Gambar 1 Perbedaan struktur IgY dan IgG (Sumber. Schade et al. 1996). Pada itik dilaporkan memiliki tiga tipe imunoglobulin serum yaitu IgM dan dua bentuk mirip (isoform) IgY yaitu IgY utuh dan IgY terpotong. IgY utuh memiliki berat molekul 200 kDa dengan koefisien sidementasi 7.8 S dan IgY terpotong memiliki berat molekul 130 kDa dengan koefisien sidementasi 5.7 S. IgY terpotong kehilangan dua domain terminal pada regio konstan dari rantai berat yaitu domain 3 dan 4 (Warr dan Higgins 1995). Tabel 1 Karakter imunoglobulin itik Jenis imuno globulin Koefisien sidementasi Molekul utuh (kDa) Ig M 800 –900 Ig Y utuh 7.8 S 178 – 200 Ig Y terpotong 5.7 S 118 - 130 Dikutip dari :Warr dan Higgins, (1995) Berat Molekul Rantai Berat (kDa) 86 62 – 67 35 – 42 Rantai Ringan (kDa) 23 – 25 22 – 25 22 – 25 Struktur 7.8S IgY merupakan IgY tipikal ayam, tetapi struktur 5.7S IgY (∆Fc) merupaka n ekspresi antibodi yang tidak lazim (Magor et al. 1992; Magor et 13 al. 1994). Struktur dan antigenitas 5.7S IgY mirip dengan fragmen F(ab’)2 dari 7.8S IgY (Warr dan Higgins 1995). Itik membentuk dalam jumlah besar IgY()Fc). Bentuk ini cacat karena kehilangan dua domain C-terminal pada rantai H (υ). Struktur abnormal dari IgY()Fc) menyebabkan penurunan fungsi biologis Ig seperti aglutinasi, presipitasi, fiksasi komplemen, opsonisasi (Chan et al. 1999; Lundqvist et al. 2001), walaupun level serum dari boster meningkat (Warr dan Higgins 1995). Faktor lain yang berpengaruh yaitu pembentukan sterik dari lengan Fab (berfungsi monovalensi), regio engsel (hinge) yang kaku, keragaman yang sempit atau terbatas, kegagalan dalam pematangan ikatan antigen pada antibodi (Magor et al. 1994). Respon imun mukosa dependen-IgA itik perkembangannya terlambat selama penetasan dibandingkan dengan ayam (Lundqvist et al. 2001). Pada itik IgA mulai dideteksi pada umur 14 hari setelah menetas dan berfungsi optimal setelah umur 35 hari, sedangkan pada ayam telah berfungsi optimal pada umur 5 hari setelah menetas (Magor et al. 1998; Chan et al. 1999). Berbagai metode ekstraksi dan purifikasi telah dilaporkan oleh beberapa ahli. Ekstraksi IgY me lalui water dilusi (pelarutan dalam air) kuning telur (Akita dan Nakai 1992); presipitasi lemak dengan dektran sulfat yang mengandung CaCl2 (Szabo et al. 1998). Hasil ekstraksi dilakukan purifikasi dengan kromatografi menggunakan ion exchange (DEAE-Sephacel) dan filtrasi gel (Szabo et al.1998), mencampur serum dengan asam caprylat, diendapkan dengan amonium sulfat dan didialisis dengan PBS. Teknik ini sangat cepat, murah, sederhana dibandingkan dengan menggunakan metode ion exchange atau gel filtrasi kromatografi (Bhanushali et al. 1994). Purifikasi IgY dari telur dengan thiophilic interaction chromatography merupakan prosedur purifikasi untuk homogenitas IgY dalam langkah kromatogra fi tunggal setelah fraksinasi amonium sulfat. Recoveri dengan prosedur ini mampu sampai 100% (Hansen et al. 1998). Metode pelarutan dalam air dilakukan untuk memisahkan plasma protein terlarut dari granul kuning telur. IgY aktif dengan tingkat kemurnian yang tinggi didapat dari kombinasi beberapa teknik seperti presipitasi garam, filtrasi gel dan ion exchange chromatography. Presipitasi garam, ultrafiltrasi, dan gel filtrasi dianjurkan dilakukan secara berurutan (Akita dan Nakai 1992). Metode purifikasi 14 lain untuk isolasi adalah metode dua langkah purifikasi yaitu presipitasi dengan PEG diikuti de ngan perlakuan alk ohol. Uji spesifisitas dilakukan dengan cara hemaglutinasi indirek, uji imunodifusi, dan imunoelektroporesis (Hassl et al. 1987). Jumlah Ig spesifik yang terdapat dalam telur dari ayam yang diimunisasi adalah 1% dari total IgY (Hansen et al. 1998). Keuntungan Penggunaan Imunoglobulin Y Sistem imun ayam dilaporkan telah dipelajari lebih dari satu abad yang lalu, di awali dengan pengamatan pada ayam yang diimunisasi menunjukkan adanya transfer imunoglobulin dari serum ke kuning telur (Camenisch et al. 1999). Transfer ini diperlukan embrio aves dan anak untuk melawan berbagai penyakit. Penelitian pada sistem imun ayam berkontribusi secara substansial untuk memahami konsep mendasar dari imunologi dan perkembangan kelas Ig yang berbeda. Perkembangan penelitian pada imunoglobulin unggas terutama ayam juga di dukung oleh perkembangan ilmu pengetahuan dan semakin tingginya kesadaran akan animal welfare. Perkembangan penelitian itu melaporkan ayam sebagai alternatif terbaik untuk produksi antibodi poliklonal (Akita dan Nakai 1992; Shimizu et al.1992; Hatta et al. 1993; Schade dan Hlinak 1996; Camenisch et al. 1999). Penggunaan ayam sebagai sumber imunoglobulin mempunyai beberapa keuntungan antara lain : pemeliharaan ayam tidak mahal, koleksi te lur tida k invasif, isolasi dan afinitas purifikasi IgY cepat dan sederhana, aplikasi IgY sangat luas (Camenisch et al. 1999) . Ekstraksi IgY dari telur lebih menguntungkan dibandingkan dengan ekstraksi Ig mamalia. Keuntungan yang nyata adalah : lebih mudah mengkoleksi telur dari ayam dibandingkan koleksi serum dari mamalia, ketika mengambil darah dari mamalia memerlukan keahlian khusus sedangkan telur dapat dikoleksi oleh tenaga yang tidak dilatih secara khusus, harga pakan dan kandang ayam lebih murah diba ndingkan dengan hewan laboratorium (Camenisch et al. 1999) . Ayam dapat bertelur secara normal sebanyak 240 butir setahun, sedangkan pada kelinci darah hanya dapat diambil secara periodik dengan volume maksimum 50 ml (Nakai e t al. 1994) , dan saat koleksi telur tid ak menyebabkan cekaman pada ayam (Gassmann 2002). Koleksi antibodi melalui serum, ayam 15 tidak mengalami cekaman meskipun dalam periode bertelur. Sehingga penggunaan ayam menjadi metode alternatif untuk mengurangi penderitaan hewan. Jumlah hewan yang diperlukan untuk produksi antibodi lebih sedikit, karena ayam mampu memproduksi antibodi lebih tinggi dibandingkan kelinci (Gross dan Speck 1996). Antibodi ayam memiliki lebih banyak epitop terhadap antigen mamalia (Carlander et al. 1999) , dapat digunakan untuk menghindari kesalahan immunoassay akibat sistem komplemen (Fryer et al. 1999), faktor rheumatoid, dan reseptor Fc bakteri (Carlander et al. 1999). Pada pengukuran High-sensitivity C-reaktive protein (hs-CRP) yang merupakan salah satu marker untuk pengukuran resiko jantung, penggunaan antibodi mamalia seperti kelinci, tikus, dan kambing memberikan hasil kurang memuaskan, hal ini akibat faktor rheumatoid dalam sampel meyebabkan reaksi positif palsu. Permasalahan itu dapat ditanggulangi dengan penggunaan IgY (Tsen et al. 2003). Perbedaan jarak pilogenetik antara mamalia dan avian menyebabkan protein mamalia yang conserved (sulit isolasi juga unik) lebih imunogenik pada ayam dibandingkan dengan mamalia dan respon antibodi spesifik yang dihasilkan sangat tinggi (Akita dan Nakai 1992; Lee et al. 1997; Halper et al. 1999; Orsini et al. 2001). Sehingga ayam sebagai pilihan terbaik untuk produksi antibodi dibandingkan dengan mamalia jika antigen berasal dari manusia atau mamalia. Isolasi dan metode purifikasi IgY sederhana dan mudah (Gassmann, 2002). Kuning telur mengandung lemak yang tinggi (lipoprotein, granul phospitin yang bercampur dengan livetin dan low density lipoprotein ), yang bermasalah jika digunakan secara langsung (Makvandhi dan Fiuzi 2002). IgY yang telah o dimurnikan dapat bertahan satu tahun pada suhu 4 C dengan ditambahkan anti pertumbuhan bakteri seperti Na-azide. Pada suhu kamar stabil selama sebulan. Untuk freeze antibodi hendaknya dibuat aliquot dan hindari freeze dan thawing. Freeze dan thawing lebih merusak antibodi dibandingkan disimpan pada suhu 4 o C selama satu minggu atau sebulan (Polson 1990) . Imunoglobulin Y diisolasi secara noninvasive dari kuning telur. IgY yang telah dimurnikan di uji dengan berbagai metode dan teknik diagnosis, seperti presipitasi, elektroporesis, ELISA, mikroskup elektron, dan western blotting. 16 Beberapa dari metode itu telah dimodifikasi untuk menyesuaikan dengan sifat antibodi ayam. Hasil penelitian menunjukkan IgY ayam mampu menggantikan IgG yang dihasilkan dengan metode tradisional dari mamalia. Penggunaan IgY sangat memperhatikan keamanan hewan, produktivitas tetap tinggi, dan kekhususan tertentu yang dimiliki IgY untuk tujuan diagnosis (Gross dan Speck 1996), dan modifikasi diagnostik (Higgins et al.1995; Doellgast et al. 1997; Kummer dan Li-Chan 1998; Kim et al. 1999). Penggunaan IgY pada uji ELISA tidak berkompetitor dibandingkan dengan menggunakan antibodi mamalia (Benkirane et al. 1998). Aplikasi potensial penggunaan IgY terus meningkat untuk pencegahan penyakit, agen diagnostik dan biologis, suplemen pakan, dan pemberian secara oral untuk propilaksis (Akita dan Nakai 1992). Tabel 2 Kelebihan IgY dibandingkan dengan IgG mamalia No IgY Unggas IgG (Mamalia) 1 Cara Pengambilan sampel Tidak hewan 2. Jumlah antibodi 50 -100 mg Ig 200 mg Ig G/40 ml darah Y/butir telur 5 – 7 butir telur/ minggu 3. Jumlah antibodi spesifik 2 – 10 % 5% 4. Reaksi dengan rheumatoid faktor Tidak ada Ada 5. Reaksi dengan protein A Tidak ada dan G Ada 6. Reaksi dengan mamalia G Tidak ada Ada Tidak ada Ada Ig 7. Aktivasi komplemen Sumber : Schade et al. (1996) menyakiti Menyakiti hewan Penggunaan teknologi IgY lebih ditekankan pada perlindungan terhadap hewan, penggunaan ilmu pengetahuan, dan segi ekonomi. Perlindungan terhadap hewan seperti pengurangan, penggantian, dan menjadikan lebih baik; penggunaan ilmu pengetahuan yaitu kekhasan sistem imun bangsa avian dan bagian IgY; dan secara ekonomi, jumlah IgY yang dihasilkan dari satu ekor ayam lebih tinggi dari 17 kelinci (Schade dan Hlinak 1996). Secara ringkas beberapa kelebihan lain dari IgY dibandingkan dengan IgG mamalia dipaparkan pada Tabel 2. Penggunaan Teknologi IgY Teknologi IgY telah digunakan untuk berbagai hal sehubungan dengan imunoterapi dan imunodiagnostik (Sugita-Konishi et al. 1996). Telur (IgY) ayam sebagai makanan mempunyai peran ganda yaitu peran fungsional dan neutraceutical. Secara fungsional sebagai sumber protein, dan secara neutraceutical mampu meningkatkan fungsi imun. Peningkatan kekebalan dengan pemberian secara oral Ig telah dilakukan oleh sejumlah peneliti. Pemberian IgY dilakukan melalui produk makanan, terutama untuk formula anak-anak, karena anak-anak merupakan kelompok rentan terhadap penularan patogen melalui makanan (Akita dan Nakai 1992; Makoto et al. 1998). Dilaporkan `pencegahan E coli pada pedet sapi dengan pemberian kolustrum dicampur IgY, pencegaha n rotavirus berhasil dengan baik pada mencit, serta pencegahan diare perjalanan (wisata) (Davis dan Reeves 2002). Penggunaan IgG mamalia untuk diagnostik pada uji ELISA sering menghasilkan reaksi positif palsu. Hal itu akibat reaksi silang dari IgG suatu spesies dengan spesies lain. Masalah itu dapat ditanggulangi dengan pemakaian IgY ayam. Davis dan Reeves (2002) melaporkan IgY tidak bereaksi silang pada pemeriksaan laktoferin dan proteoglikan manusia dan sapi pada uji ELISA. Spesifitas IgY dari ayam dapat dimanfaatkan sebagai reagen standar untuk alat diagnostik dan mampu meningkatkan akurasi dalam penelitia n. Dilaporkan antibodi kuning telur ayam banyak digunakan untuk penelitian biomedis, diagnosis, propilaksis, dan terapi penyakit. Hal itu disebabkan oleh langkah ekstraksi IgY sangat sederhana dengan hasil purifikasi antibodi yang tinggi (Fischer et al. 1996). Produksi IgY secara mendasar dipengaruhi oleh tiga faktor yaitu: sifat alami ayam, prosedur imunisasi, dan modulasi nutrisi. Imunisasi pada ayam white leg horn menghasilkan lebih banyak telur dan IgY pada kuning telur dibandingkan dengan ayam lain (Li et al. 1998). 18 Stabilitas IgY Pengetahuan terhadap stabilitas molekul IgY sangat penting, jika IgY digunakan sebagai reagen dalam berbagai kondisi. Stabilitas dari molekul IgY dapat dipengaruhi oleh berbagai perubahan fisik maupun kimia seperti suhu, asam, dan enzim pencernaan. Stabilitas IgY menjadi sangat penting jika dipakai untuk terapi imunisasi pasif yang diberikan secara oral. Aplikasi yang praktis pemberian suatu antibodi pasif dilakukan dengan mencampur antibodi dengan makanan atau material farmaceutikal, sehingga pertimbangan stabilitas antibodi terhadap panas, pH atau enzim digesti harus diketahui dengan baik (Hatta et al. 1993). Valensi dari IgY adalah dua, sama dengan antibodi mamalia. Regio engsel pada IgY tidak ada menyebabkan IgY kurang fleksibel. Mobilitas yang terbatas akibat kakunya regio engsel berpengaruh terhadap kemampuan antibodi dalam presipitasi atau aglutinasi antigen. Stabilitas IgY dibawah kondisi asam dan digesti pepsin lebih rendah dibandingkan dengan IgG sapi. Tetapi IgY lebih stabil terhadap digesti enzim protease internal seperti tripsin dan kemotripsin, dan terlihat ada subpopulasi IgY tahan terhadap digesti papain (Hatta et al. 1993). Para peneliti melaporkan, stabilitas IgG kelinci terhadap panas dan asam lebih tinggi dibandingkan dengan IgY. Bentuk dari molekul IgY sering berubah karena pengaruh asam, yang berakibat penurunan aktivitas antibodi (Shimizu et al. 1992). Stabilitas IgY anti HRV pada temperatur di atas 70 oC dan pH 2 sampai 3 lebih rendah diba ndingkan dengan IgG anti HRV kelinci. Temperatur maksimum untuk denaturasi IgG kelinci adalah 77 o C (Hatta et al. 1993). Aktivitas IgY pada kuning telur dan ekstrak kasar menurun dengan meningkatnya suhu dari 70 oC sampai 80 o C, tetapi denaturasi panas antara kedua sampel tidak berbeda. (Chang et al. 1999). Aktivitas IgY turun setelah diinkubasikan pada pH 3.5 dan hilang total pada pH 3, sedangkan aktivitas IgG dilaporkan tidak berubah sampai pH 2. sedangkan pada pH alkalis (pH 11 sampai 13) tidak menunjukkan perubahan, dan sedikit berkurang setelah diinkubasi pada pH 12. Penurunan aktivitas yang sangat cepat dari IgY disebabkan kerusakan pada antigen binding site karena pengaruh asam (Shimizu et al. 1992). 19 Digesti pepsin sangat cocok untuk preparasi dan purifikasi Fab. Isolasi Fab optimum didapat setelah digesti pepsin terhadap IgY pada pH 4 selama 9 jam dalam konsentrasi NaCl rendah. Kondisi itu mendigesti secara lengkap fragmen Fc antibodi dan hanya menyisakan fragmen Fab (Akita dan Nakai 1993a). Liofilisasi kuning telur dengan 5% gum arabic serbuk sangat baik untuk menjaga stabilitas terhadap protease (Chang et al. 1999). Tetanus Tetanus adalah salah satu penyakit yang lazim terjadi pada manusia dan hewan vertebrata. Tetanus telah dikenal oleh manusia sejak sejarah kesehatan mulai dikenal, tetapi sampai saat ini masih merupakan masalah besar pada kesehatan masyarakat di beberapa negara berkembang, terutama pada negara miskin dengan kondisi kesehatan buruk, beriklim panas dan lembab (Bizzini 1993). Agen penyebab tetanus adalah Clostridium tetani, tumbuh dalam kondisi anaerob, spora berbentuk batang (Kiefer 2004) , di bawah mikroskop terlihat seperti stik drum dengan gelembung di kedua ujungnya, dengan pewarnaan gram sel bakteri menyerap warna sedangkan spora tidak terwarnai. C. tetani tumbuh optimum pada media agar darah yang diinkubasikan pada suhu tubuh manusia. Bakteri akan berada dalam bentuk inaktif dengan menghasilkan spora ketika lingkungan tempat tumbuhnya tertekan. Dalam kondisi seperti itu, bakteri sangat toleran dengan kondisi lingkungan yang ekstrim, sedangkan dalam bentuk aktif mensekresikan eksotoksin yang sangat poten menyebabkan penyakit tetanus (Anonim 2003). Habitat alami kuman tetanus adalah tanah, debu, saluran cerna beberapa hewan, dan kadang-kadang pada feses manusia (Ray 2004). Beberapa varian dari kuman ini telah dipetakan secara genomik. C. tetani E88 merupakan varian dari strain Massachussetts, genomnya tersusun atas 2 799 250 bp kromosum dengan 2 372 ORF (Oven Reading Frame) dengan kandungan G+C 28.6%. Toksin tetanus dan enzim kolagenase disandi pada plasmid 74 082 bp, yang terdiri atas 61 ORF, dengan kandungan G+C 24.5%. Sedangkan faktor virulen yang lain seperti susunan lapisan permukaan dan protein adesi terdapat pada 61 ORF. Kebanyakan 20 gen terlihat tidak berfungsi karena terjadi penurunan ORF akibat insertion, delesi, dan poin mutasi. Variasi G+C pada genom sangat rendah, hanya pada region yang kandungan G+C nyata tinggi (sebanding 50%) memiliki 6 gen cluster rRNA dan gen penyanding protein ribosom. Rendahnya fluktuasi dari G+C menyebabkan genom dari C. tetani lebih stabil dibandingkan enteropatogen lain. C. tetani terus dapat tumbuh apabila tersedia ion sodium secara ekstensif sebagai bioenergetik (Bruggemann e t al. 2003). Semua spesies hewan rentan terhadap toksin tetanus, tetapi tingkat kerentanannya berbeda -beda. Manusia dan kuda paling rentan sedangkan kucing dan burung lebih tahan. Berdasarkan LD50/kgBB, pada burung diperlukan 10 000 sampai 300 000 kali dosis toksin lebih tinggi dibandingkan dengan kuda untuk menimbulkan sakit (Bizzini 1993). Manifestasi penyakit tetanus dikelompokkan menjadi empat yaitu : paralisis spastis umum (general), cephalic , lokal, dan neonatal. Tetanolisin dan tetanospasmin merupakan toksin yang dihasilkan oleh kuman tetanus dan sangat berbahaya (Ray 2004). Pada manusia dosis letal dari toksin adalah 1 ng/kg BB. (Bruggemann et al. 2003). Tetanus lokal ditandai dengan kekakuan otot disekitar luka. Gejala ini akibat kegagalan inhibisi dari inervasi syaraf spinal dan medula pada otot yang terserang. Tetanus lokal serangan ringan dan mortalitas kurang dari 1%. Tetanus cephalic kejadiannya jarang. Masa inkubasi sangat pendek yaitu satu sampai dua hari, dan penyakit muncul apabila te rjadi luka di daerah wajah dan kepala. Kelumpuhan daerah wajah dan okulomotoris merupakan gejala utama dan sering diikuti dengan dispagia. Prognosisnya jelek karena penyakit sering ke arah tetanus general. Tetanus neonatal terjadi karena kontaminasi pada daerah umbilikalis. Dengan masa inkubasi yang sangat pendek sehingga bayi tak bisa terawat. Kegagalan terjadi karena gangguan pernafasan dengan kematian empat sampai 14 hari (Bizzini 1993). Penyakit tetanus terjadi karena kontaminasi langsung spora C. tetani pada berbagai luka akibat benda tajam seperti luka tusuk (puncture) oleh benda berkarat, luka bakar, ulcer, fraktur (patah tulang), luka operasi (infeksi saat operasi) atau saat injeksi obat (Kiefer 2004). Spora dari kuman tetanus akan cepat mengalami germinasi pada luka dengan tekanan oksigen rendah. Kondisi ini 21 ditemukan pada luka nekrosis yang tertutupi oleh keropeng, tanah, debu dan terbungkus kain (Siegmund 1979; Mims 1982). Infeksi dari spora C. tetani juga dapat melalui luka saat kastrasi, potong ekor, pencukuran bulu, dan tali pusar (Lewis 1998). Luka dengan kondisi oksidasi-reduksi yang rendah mempercepat spora germinasi dan berubah menjadi sel bakteri yang aktif (Kiefer 2004). Keparahan kejadian tetanus tergantung atas jumlah toksin yang mampu mencapai CNS, dan masa inkubasi yang pendek. Periode inkubasi (waktu yang diperlukan dari saat inokulasi sampai muncul gejala pertama) dapat dibedakan atas periode onset atau waktu yang diperlukan dari gejala pertama muncul sampai reflek spasmus yang pertama. Bakteri ini bersifat noninvasif dan gejala yang timbul karena pengaruh toksin yang akan terbentuk setelah periode inkubasi. Lamanya periode inkubasi dan keparahan penyakit dipengaruhi oleh jumlah toksin yang terbentuk pada awal infeksi dan toksigenitas strain yang menginfeksi, jumlah dan kecepatan toksin mencapai neural pathways dan sirkulasi darah, kemampuan perpindahan toksin pada neural pathways, panjang dari neural pathways, dan kerentanan reseptor pada CNS (tergantung spesies). Pada manusia masa inkubasi 14 hari sedangkan pada hewan 24 jam sampai dua minggu atau lebih (Bizzini 1993). Angka kematian akibat C. tetani menjadi sangat tinggi jika penanganan luka tidak baik dan terjadi dekat organ vital (Ray 2004). Awal infeksi, gejala pada lesi tidak teramati. Apabila kondisi lingkungan tidak mendukung spora akan dorman dalam beberapa hari sampai minggu (Kiefer 2004), jika kondisi mendukung spora mengalami germinasi, dan sel yang baru terbentuk melepaskan toksin yaitu tetanolisin dan tetanospasmin. Angka mortalitas lebih tinggi pada kuman dengan masa inkubasi pendek. C. tetani memerlukan adanya infeksi bakteri lain untuk berkembang di tempat infeksi awal, terutama untuk menimbulkan reaksi peradangan (Ray 2004), sehingga pemberian antitetanus sering dikombinasikan dengan obat untuk bakteri lain (Guidolin et al. 1998). Toksin yang terbentuk berjalan secara retrograde sepanjang serabut syaraf, dan menetap pada jaringan syaraf. Target utama dari toksin adalah daerah sekitar batang otak. Perkembangan gejala klinis penyakit tetanus diawali kontraksi otot secara intermiten disekitar tempat masuk kuman, selanjutnya lock jaw diikuti 22 dengan kekakuan seluruh tubuh, kemudian spasmus otot. Kematian terjadi karena kegagalan pernafasan (Kiefer 2004). Kejadian penyakit lebih sering terjadi di daerah pedesaan di negara dengan iklim panas terutama pada petani yang mendapat luka saat pengolahan tanah pertanian. Pada negara dengan program imunisasi tidak teratur, kejadian tetanus lebih banyak bersifat neonatal (Ray 2004). Di negara maju seperti Amerika, kejadian tetanus masih ditemukan meskipun rendah (50 orang pertahun) terutama pada orang yang tidak diimunisasi, imunisasi tidak lengkap atau teratur, dan telah diimunisasi dengan lengkap tetapi dosis boster tidak ma mpu memberikan perlindungan yang protektif (Ray 2004). Toksin Tetanus Toksigenesis adalah kemampuan bakteri patogen memproduksi toksin untuk menimbulkan penyakit. Ditinjau dari sifat biokimia, ada dua tipe toksin bakteri, yaitu toksin yang tersusun atas lipopolisakarida dan protein. Sedangkan berdasarkan atas proses pembentukan dibedakan atas endotoksin dan eksotoksin. Endotoksin adalah toksin yang dihasilkan bakteri gram negatif dari komponen struktural membran luar sel bakteri, dilepaskan dari sel bakteri yang lisis akibat pertahanan inang (enzim lisosim). Komponen penyusun endotoksin adalah lipopolisakarida (LPS) (Emsley 2002) . Eksotoksin merupakan tipe toksin protein terlarut (soluble), disekresikan oleh bakteri hidup selama masa pertumbuhan eksponensial. Produksi eksotoksin spesifik dari masing-masing spesies bakteri karena memiliki aktivitas sitotoksik pada sel yang khusus seperti tetanus dan botulinum hanya menyerang sel syaraf sedangkan pada tipe sel yang lain kerusakan yang ditimbulkan tidak khas. Dalam aksi sitotoksiknya memerlukan substrat khusus. Substrat itu merupakan komponen dari sel, organ atau cairan tubuh inang. Terminologi terhadap toksin protein bakteri disesuaikan dengan tempat kerja toksin itu seperti enterotoksin, neurotoksin, leukosidin, atau hemolisin. Toksin merupakan faktor virulensi dan hanya diproduksi oleh strain bakteri yang virulen (Todar 2002). Toksin tetanus merupakan suatu protein yang disintesis sebagai polipeptida rantai tunggal dengan berat molekul 150 kDa, terdiri atas dua komponen yaitu: Ujung amino (A-terminal atau fragmen A) rantai ringan (L) 23 dengan berat molekul 50 kDa, dan ujung carboxyl (C-terminal atau fragmen B) rantai berat (H) dengan berat molekul 100 kDa. Kedua komponen tersebut dihubungkan oleh ikatan disulf ida (Emsley 2000). Toksin dari kuman tetanus merupakan protein yang sangat poten apabila berikatan dengan axon neural syaraf perifer. Toksin yang terbentuk akan mencapai neuron motor dan menyebar secara lokal untuk mencapai sistem syaraf pusat (Mims 1982). Pada sekuen tingkat DNA, toksin tetanus memiliki homolog dengan neurotoksin botulinum. Memiliki dua rantai disulfida yang berlokasi antara rantai berat dan rantai ringan (cys 438 sampai cys 466), dan dalam fragmen C (cys 1076 sampai cys 1092). Toksin yang dihasilkan oleh kuman tetanus yaitu : tetanospasmin (zink metalloprotease) yang sangat poten menyerang jaringan syaraf (neurotoksin) , dan tetanolisin dengan sifat seperti hemolisin. Produksi toksin tergantung atas kondisi luka dan kultur yang tersedia. Tetanolisin dihasilkan dalam jumlah sedikit oleh strain patogenik dan tidak memainkan peran penting dalam proses penyakit (Bizzini 1993). Toksin tidak stabil terhadap panas, cahaya, asam, dan enzim proteolitik, sehingga harus disimpan dalam ruang gelap dan dingin. Toksin dapat dipecah oleh enzim proteolitik seperti tripsin, kemotripsin, elastase, clostripain (Habermann 1988), dan papain (Rowe et al. 2000). Digesti toksin dengan enzim papain akan memecah molekul toksin menjadi dua fragmen, yaitu rantai ringan dan rantai berat (Marvaud et al. 1998). Fragmen tunggal toksin kurang toksik dibandingkan dengan toksin secara utuh, untuk penghambatan neuromuskular. Rantai berat dan ringan dari toksin dapat dipisahkan secara isoelektrik. Rantai berat berperan dalam pelepasan noradrenalin dari otak dan K+ dari eritrosit. Pemberian toksin tidak efektif lewat mulut. Toksin dapat diendapkan dengan amonium sulfat dan dalam kondisi kering sangat poten dalam jangka lama (Bizzini 1993). Produksi toksin tetanus diperankan oleh gen TeTx (gen tetanus toksin) ditemukan pada 74 kb pE88 plasmid C.tetani. Regulasi aktivator transkripsi dari gen TeTx dilakukan oleh gen TetR (Bruggemann et al. 2003). Gen TetR berlokasi di upstream gen TeTx di daerah flanking 5’ disandi ole h 29 asam amino terminal. Gen TetR mempunyai berat molekul 21.562 kDa tersusun atas 24 178 asam amino, dengan gambaran pada DNA-binding protein bermotif helixturn-helix. Mekanisme pengaturan oleh gen TetR merupakan mekamisme regulasi conserved untuk gen neurotoksin. Selain mekanisme pengaturan melalui gen, produksi toksin pada C. tetani dipengaruhi oleh suatu peptida rantai pendek pada casein hydrolysate, dan faktor lain yang penting adalah signal lingkungan di tempat kuman yaitu keberadaan ion Zn (Marvaud et al. 1998). Plasmid pE88 juga menyandi faktor virulen yang lain seperti kolagenase (114 kDa) yang ditandai dengan ColT, tetanolisin O, hemolisin, protein binding-fibronektin. Enzim kolagenase memainkan peranan penting pada patogenesis C. tetani, karena fungsi dari enzim ini untuk merusak integritas jaringan dari inang yang terinfeksi. ColT mirip dengan ColB yang dihasilkan oleh C. botulinum sedangkan dengan spesies clostridium yang lain berbeda (segmen 2 pada ColT tidak ada) (Bruggemann et al. 2003). Sifat toksisitas toksin protein dapat dihilangkan tetapi sifat antigeniknya tetap dipertahanka n, yang disebut dengan toksoid. Toksoid dibuat dengan cara memberikan perlakuan pada toksin dengan berbagai reagen seperti formalin, iodine, pepsin, asam askorbat, dan keton. Larutan diinkubasikan pada suhu 37 oC dengan pH 6 sampai 9 selama beberapa minggu. Toksoid dapat digunakan dalam imunisasi buatan dan mampu menimbulkan titer antitoksin yang tinggi dalam serum (Todar 2002). Fragmen HC yang juga disebut fragmen C rantai berat adalah fragmen terminal karboksil (COOH-terminal) dari toksin tetanus dengan berat molekul 50 kDa, diperlukan pada stadium awal proses intoksikasi untuk aktivitas perlekatan pada gangliosida (Halpern dan Loftus 1993). Topologi dari fragmen HC, terdiri atas dua domain yaitu domain amino-terminal jelly roll dan domain carboksilteminal β-trefoil (Gambar 2). Domain carboksil-teminal β-trefoil mengandung bagian untuk berikatan dengan gangliosida (Fotinou et al. 2001), sedangkan domain amino-terminal jelly roll memiliki struktur mirip dengan lektin, sebagai kandidat untuk berikatan dengan gangliosida, sehingga dapat dikatakan toksin tetanus memiliki banyak binding site karbohidrat (Emsley et al. 2000). 25 Gambar 2 Fragmen Hc toksin tetanus (Emsley et al. 2000). Beberapa peneliti menyebutkan toksin protein khususnya yang bereaksi intraseluler terdiri atas dua komponen yaitu : subunit A (rantai ringan) berespon untuk aktivitas enzimatik dari toksin; subunit B (rantai berat) untuk berikatan dengan reseptor spesifik pada sel membran inang dan tempat transfer enzim untuk melewati membran sel. Toksin tetanus disintesis sebagai polipeptida tunggal, dibagi menjadi domain A dan B yang dapat dipisahkan dengan enzim proteolitik. Komponen enzimatik (subunit A) ini tidak aktif sampai dilepaskan dari toksin natif (A+B). Isolasi subunit A secara enzimatik aktif tetapi kurang mampu berikatan dan masuk ke dalam sel. Isolasi subunit B mampu berikatan dengan sel target tetapi tidak toksik (Todar 2002). Mekanisme Kerja Toksin Tetanus Pada luka yang terkontaminasi spora C. tetani dengan kondisi lingkungan anaerob, maka spora akan mengalami germinasi dan menjadi bentuk aktif. Pada masa pertumbuhan eksponensial akan dilepaskan eksotoksin yang disebut tetanospasmin. Toksin mempengaruhi kerja sistem syaraf menjadi irregular. Transmisi menuju otak melalui neuron secara retrograde (Anonim 2003). 26 Ada dua mekanisme toksin masuk ke sel target (sel syaraf). Pertama, disebut mekanisme langs ung, yaitu subunit B pada toksin natif berikatan dengan reseptor spesifik pada sel target (ujung syaraf motorik) dan menyebabkan terbentuknya lubang pada membran sel sebagai tempat masuknya subunit A ke dalam sitoplasma sel. Proses terikatnya toksin pada syaraf diawali terikatnya toksin dengan afinitas rendah pada gangliosida, selanjutnya kompleks membrangangliosida-toksin bergerak ke arah lateral sampai berikatan dengan afinitas tinggi pada reseptor protein spesifik toksin. Proses ini diikuti dengan langkah internalisasi toksin setelah itu bergerak retrograde pada axon ke ventral spinal cord dan batang otak (Bizzini 1993). Toksin yang terbentuk menyebar ke otot disekitarnya melalui ikatan dengan terminal presinaptik pada axon motor. Selanjutnya toksin masuk ke sistem limpatik dan vascular darah untuk menyebar ke seluruh otot dan ujung syaraf. Cara penyebaran toksin seperti ini menyebabkan tetanus general atau juga disebut descending tetanus. Blood brain barier dan blood barier nerve perifer merupakan jalan masuk langsung toksin ke sistem syaraf (Bizzini 1993). Kedua, disebut mekanisme alternatif, toksin natif berikatan dengan sel target dan struktur A/B masuk ke dalam sel melalui proses endocitosis mediatedreseptor (RME). Toksin yang berada dalam sel membentuk vesikel yang disebut endosom. Ion H+ masuk ke dalam endosom menyebabkan pH di dalam endosom menjadi rendah, hal itu mengakibatkan terpisahnya subunit A/B. Selanjutnya subunit B melepaskan subunit A dari endosom menuju target di sitoplasma sel (Gambar 3). Subunit B tetap di endosom dan mendaur ulang permukaan sel. Kedua kejadian itu memerlukan pemasukan molekul protein dalam jumlah besar ke dalam dan menembus membran bilayer lipid (pada sel membran atau membran endosom). Aktivitas itu sebagai refleks i dari kemampuan toksin A/B atau komponen B untuk masuk ke lapisan lipid membentuk jalur permeabel ion (Todar 2002). Mekanisme kerja toksin mirip untuk seluruh kuman yang memproduksi toksin protein hanya sel targetnya yang berbeda, seperti bakteri dipteria dan pseudomonas menggunakan jalur langsung dan RME sedangkan bordetella pertusis dan anthrax dengan cara mengkatalisis pembentukan cAMP dari ATP intraselular sel inang (Todar 2000). 27 Gambar 3 Proses perlekatan toksin bakteri pada sel (Rappuoli dan Montecucco 1997). Mekanisme kerja toksin tetanus meliputi empat proses yaitu : perlekatan pada sel ganglion; internalisasi (masuk) ke dalam vesicular; translokasi sitoplasmik; dan pelepasan proteolitik pada subs trat neuron. Perlekatan toksin tetanus pada sel ganglion diawali dengan terikatnya toksin pada gangliosida permukaan sel syaraf. Gangliosida sel syaraf mengandung sialogangliosida yang sering disebut protein-G pada membran sel. substansia Hal ini dimungkinkan karena ujung karbonil (HC) fragmen rantai berat dari toksin tetanus mengandung ganglioside-binding site (Gambar 4) . Masing-masing kuman menggunakan protein-G yang berbeda, misalnya toksin kolera menggunakan ganglioside GM1 (Bruggemann et al. 2003), toksin botulinum menggunakan ganglioside GT1b (Yowler et al. 2002), dan toksin tetanus menggunakan ganglioside GT1 dan atau GD1b; dan N-glikosilat p15 (Miana-Mena et al. 2002). C. tetani juga memiliki gen signel-recognition particle (SRP) sebagai sistem translokasi protein, protein ini mirip dengan SRP manusia. Sistem ini dipercaya berperan dalam proses translokasi dan masuknya toksin ke membran protein sel (Bruggemann et al. 2003). Perlekatan toksin tetanus pada permukaan neuron untuk dapat internalisasi ke dalam sel neuron juga terjadi melalui lipid 28 raft. Lipid raft (anyaman lipid) adalah suatu kompleks yang terbentuk dari protein glycosylphospatidylinositol (GPI), gangliosida, kolesterol dan spingolipid yang terletak dipermukan neuron. Komponen tersebut membentuk suatu anyaman yang lebih dominan kandungan lipidnya (Herreross et al. 2001). Perlekatan toksin tetanus pada lipid raft juga karena pengaruh marker rafts yang terkandung didalamnya. Marker rafts tersusun atas glikoprotein yang mempunyai berat molekul 15 kDa, sehingga sering disebut p15 (Herreros et al. 2000). Ketahanan dan keutuhan dari lipid rafts itu dipengaruhi oleh kandungan kolesterol pada permukaan neuron. Beberapa toksin yang dikenal sebagai pore-forming toxin berikatan pada komponen lipid rafts dipermukaan sel (Herreros et al. 2001). Anyaman lipid (lipid raft) adalah mikrodomain pada membran plasma. Komponen ini berfungsi untuk menyeleksi zat yang akan masuk ke dalam vesikel, lalu lintas menuju puncak membran, dan penerima tanda (signaling) (Brown dan London 2000). Gambar 4 Interaksi gangliosida pada dua permukaan binding site fragmen Hc. Lokasi Gal4-GalNAc3 adalah celah dalam pada Hc (warna merah) dan Sia7-Sia6 adalah lekuk yang dangkal (Fontinou et al. 2001). Protein agrin juga sangat berperan dalam pembentukan neuromuscular junction. Protein ini berperan dalam mereorganisasikan mikrodomain membran lipid (lipid raft) dan memediasi transpor langsung pada sel syaraf yang berdekatan. Agrin ini disekresikan dari neuron motor dan sel otot, bekerja secara ekstraseluler untuk memacu agregasi molekul secara lokal. Sehingga masuknya toksin tetanus ke dalam sel syaraf selalu melalui kompartemen membran sel (Miana-Mena et al. 2002). 29 Molekul gangliosida merupakan kelas glikospingolipid, ditemukan dalam konsentrasi tinggi pada membran sel neuron (Fotinou et al. 2001). Gangliosida tersusun atas asam sialat (N-acetylneuranimic) yang terikat pada oligosakarida (galaktose dan N-acetylgalaktosamin) dan linked dengan ceramide. Bentuk dasar gangliosida adalah Galβ3 GalNAc β 4 (NeuAcα 3) Galβ4 Glc βCer, dengan satu atau lebih asam sialat. GM1 dan GD 1b memiliki residu asam monosialik dan disialik yang berikatan dengan residu internal galaktosa, sedangkan GT1b dan 6Q1b berikatan dengan residu terminal galaktosa (Emsley 2000). Fragmen HC toksin tetanus akan mengenali reseptor gangliosida dan satu gangliosida akan berikatan secara simultan terhadap lebih dari satu molekul toksin tetanus (Lalli et al. 1999; Williamson et al. 1999; Knight et al. 1999). Toksin tetanus berikatan pada bagian Gal4-GalNac3 dan Sia7-Sia6 (Gambar 4)(Fotinou et al. 2001). Perlekatan toksin tetanus pada gangliosida, dan patogen lain seperti toksin E coli heat-labil tipe I, toksin kolera dan simian virus untuk menghindari degradasi oleh lisosim (MianaMena et al. 2002). Terikatnya fragmen HC dari subunit B menyebabkan terbentuknya lubang pada membran sel syaraf, melalui lubang ini toksin masuk ke dalam vesikular sel. Fragmen Hc mempunyai kemampuan melekat pada neuron dan diperlukan sebagai alat transporasi intraseluler oleh toksin tetanus (Lalli et al. 1999). Toksin tetanus mengalami proses pemecahan proteolitik menjadi ujung amino rantai L dan rantai H. Rantai H dapat dipecah menjadi fragmen HC dan HN. Masingmasing fragmen memiliki fungsi yang berbeda. Fragmen HC untuk berikatan pada sel yang disensitisasi kemudian internalisasi ke vesikel. Sedangkan fragmen HN untuk translokasi rantai L melewati membran vesikular (Fotinou et al. 2001). Setelah internalisasi, rantai ringan (L) bertranslokasi ke dalam sitosol (Rummel et al. 2003). Keberadaan residu asam sialat tunggal pada residu internal Gal pada GM1, tak cukup untuk tempat berikatan toksin tetanus, diperlukan residu asam sialik yang lebih banyak. Untuk perle katan fragmen Hc diperlukan dua tempat yang berbeda pada gangliosida. Pengetahuan tentang perlekatan neurotoksin clostridium pada reseptor sel neuron, memberikan suatu informasi yang penting untuk membuat agen terapeutik antitetanus (Fotinou et al. 2001). Pelepasan proteolitik ujung amino rantai ringan (L) menyebabkan aktivitas katalitik 30 metaloprotease untuk melawan sinaptobrevin dan merangsang terjadinya keracunan (Emsley et al. 2000; Fotinou et al. 2001). Aktivitas proteolitik dari rantai L terjadi secara selektif pada protein sinap, yaitu hanya pada sinaptobrevin (Herreros et al. 2001). Sinaptobrevin yaitu suatu komponen esensial untuk eksositosis sel neuron. Keberadaan bioenergetika ion sodium yang ekstensif dipercaya sebagai faktor tambahan keberhasilan invasi kuman tetanus ke jaringan (Bruggemann et al. 2003). Toksin untuk sampai pada sistem syaraf pusat (CNS) melalui syaraf perifer mene mbus sawar darah pada sinap (Mims 1982). Toksin berkumpul pada ujung syaraf (presinaptik) dan translokasi pada alpa motor neuron (Habermann 1988; Lewis 1998) kemudian berjalan sepanjang axis silinder syaraf motorik. Rantai berat dari toksin akan berikatan dengan reseptor gangliosida neuron dan rantai ringan (sangat toksik) akan mengganggu kontrol horn anterior. Motor syaraf pada batang otak sangat pendek sehingga toksin akan cepat sampai di nervus cranialis I yang berakibat spasmus otot mata dan rahang (Mims 1982). Toksin yang terlepas awalnya terserap oleh motor syaraf yang ada disekitar luka dan melalui traktus syaraf mencapai spinal cord, proses ini disebut ascenden tetanus. Peristiwa ini menyebabkan gejala spasmodik, kontraksi tonik. Jika toksin yang dilepaskan pada tempat infeksi, menyebar melalui jaringan limpe kemudian buluh darah kemudian sampai pada CNS, proses ini disebut descenden tetanus dengan gejala berupa tetanus general (Siegmund 1979). Pergerakan toksin pada organel axonal diperlukan mikrofilamen dan setelah axonal retrograde diperlukan peran myosin Va dan motor mikrotubuli (Lalli et al. 2003). Waktu yang diperlukan untuk perjalanan toksin menuju otak berhubungan dengan masa inkubasi penyakit (Gambar 5). Pemutusan syaraf itu akan memperlambat perjalanan toksin. Pemotongan spinal cord akan mencegah toksin sampai di otak. Sedangkan gangglion spinal dari syaraf sensoris sebagai barier penyebaran toksin (Lewis 1998). Masa inkubasi penyakit bervariasi dari tiga sampai 10 hari setelah infeksi pada luka. Gejala awal yang terlihat pada hewan adalah diam dan malas bergerak, kekakuan seluruh tubuh, kemudia n berbaring dalam 12 sampai 24 jam, gejala selanjutnya spasmus tetanik, opistotonos, dan hiperaestesia. Kematian terjadi tiga 31 sampai empat hari setelah muncul gejala klinis pertama (Lewis 1998). Tempat berikatan toksin tetanus dan toksin botulinum sama pada ujung terminal neuromuscular motor junction , tetapi mekanisme intraseluler pada sistem syaraf berbeda sehingga kedua toksin menunjukan gejala yang berbeda. Toksin botulinum (BoNTs) kerjanya bersifat lokal pada sistem syaraf perifer dengan mengganggu perlepasan neurotransmiter yaitu menghambat pelepasan a setilkolin 3. Gejala klinis Kekakuan,dan paralisis pada nervus motor cranialis dan perifer . Contoh lockjaw Gagal Jantung Gagal Respirasi 1. Luka terkontaminasi spora C. tetani 2. Penyebaran Toksin Gambar 5 Patogenesis penyakit tetanus (Anonim 2003). dan menyebabkan paralisis lemah. Sebaliknya toksin tetanus (TeNT) bekerja pada sistem syaraf pusat, berjalan secara retrograde pada axon neuron inhibitor dalam spinal cord dan memecah sinaptobrevin. Pelepasan rantai ringan juga menghalangi pelepasan neurotransmiter dengan cara mencegah pembentukan komplek SNARE sinaptik (Fotinou et al. 2001; Herreros et al. 2001). MianaMena et al. (2002) melaporkan toksin tetanus mengambat aktivitas neuromuskular presinaptik melalui penghambatan (menutupi) reseptor tempat berikatan ion sodium pada membran sel. Toksin tetanus hanya menghambat transmisi sinaptik tanpa merusak integritas dari syaraf. Sedangkan toksin botulinum dilaporkan 32 menghambat transmisi pada postsinaptik, yang khusus berikatan dan menghambat reseptor asetilkolin tanpa mempengaruhi fungsionalitas syaraf seperti aliran ion ke dalam sel syaraf. Gambar 6 Proses penghambatan toksin tetanus terhadap reseptor transmiter inhibitor (Emsley et al. 2000). Toksin tetanus menghambat pelepasan neurotransmiter dari membran presinaptik pada neuron inhibitor nervus terminal (Gambar 6) (Emsley 2000), kemudian berjalan melalui transpor retrograde dari neuromuskular junction ke sistem syaraf pusat dengan target penghambatan pada neuron di dalam spinal cord dan batang otak mamalia (Bruggemann et al. 2003). Transpor toksin ke tempat aksi di CNS tergantung atas te rikatnya toksin pada reseptor membran presinaptik (keterlimpahan disialo-dan trisialogangliosida atau sialoglikoprotein pada vehikel sinaptik) dan internalisasi ke dalam membran transpor retroaxonal dalam sistem carrier reticulum endoplasmic smooth. Toksin akan menghambat pelepasan glisin dan GABA dengan cara menghambat pelepasan stimulasi K+ , memblok secara lengkap Ca ++ serta menstimulasi sekresi katekolamin, dan mengganggu metabolisme cGMP. Tiga langkah aksi toksin yaitu: 1) toksin berikatan untuk fiksas i, hal itu tergantung pada suhu dan bersifat reversible, 2) molekul toksin bertranslokasi pada membran sel, hal itu tergantung pelepasan transmiter, 3) paralisis sangat tergantung suhu dan tidak berhubungan dengan pelepasan transmiter. Perubahan metabolisme yang menyertai tetanus adalah cairan tubuh, asam basa, keseimbangan elektrolit, karbohidrat, protein, lipid, dan metabolisme asam nukleat. Tetanus yang berat diawali oleh alkalosis respirasi diikuti oleh acidosis dan terus meningkat karena terbentuk asam laktat akibat aktivitas otot berlebih (Bizzini 1993). 33 Waktu yang diperlukan oleh toksin untuk sampai di batang otak tergantung dari lokasi lesi, dari percobaan injeksi pada otot lidah diperlukan waktu kurang dari dua jam mencapai batang otak, sedangkan injeksi melalui otot gastrocnemius diperlukan waktu lebih dari enam jam (Miana -Mena et al. 2002). Toksin mengkatalisis vesikel protein sinaptobrevin pada sinap melalui pelepasan proteolitik. Hal ini akan menyebabkan konstraksi otot secara kontinyu yang pertama kali dilihat pada otot dagu dan leher (lockjaw) (Bruggemann et al. 2003). Tetanospasmin merupakan Zink metaloprotease, dilepaskan dalam luka dan berikatan dengan motor neuron terminal daerah perifer, masuk ke dalam akson dan melalui transpor retr ograde intraneural mencapai nervus cell body di batang otak dan spinal cord. Toksin mengalami migrasi dari daerah sinap ke terminal presinap. Di daerah presinap toksin memblok pelepasan inhibitor neurotransmiter glisin dan gamma-aminobutyric acid (GABA) dengan cara memecah protein yang penting untuk fungsi pelepasan vesikel sinaptik. Salah satu protein penting itu yaitu sinaptobrevin. Protein itu menyebabkan penurunan efek penghambatan dan meningkatkan resting firing rate pada neuron motor sehingga terjadi kekakuan otot (Ray 2004). Berkurangnya waktu aktivitas reflek, berakibat polisinaptik menyebar ke impul (aktivitas glicinergik). Frekuensi agonis dan antagonis lebih sering dibandingkan dengan inhibisi sehingga terjadi spasmus. Hilangnya inhibisi juga mempengaruhi neuron preganglion simpatetik di daerah lateral substansia abu-abu spinal cord dan menyebabkan hiperaktivitas simpatik dan kadar katekolamin yang bersirkulasi tinggi (Ray 2004). Regulasi sintesis dan sekresi toksin tetanus dikontrol secara ketat oleh elemen regulator yang sangat sensitif terhadap signal lingkungan. Aktivitas ekstraseluler toksin tetanus sangat tergantung pada Zn++ untuk menghambat neurotransmisi pada sinap inhibitor, sedangkan produksi toksin dipteri dipengaruhi oleh ketersediaan ion Fe pada medium pertumbuhan bakteri, ekspresi toksin cholera dan faktor virulen adesin dikontrol oleh osmolaritas dan temperatur lingkungan (Todar 2002) . 34 Imunitas Terhadap Toksin Tetanus Faktor utama ketahanan tubuh terhadap toksin adalah fungsi barier tubuh, terutama blood brain barier ketika toksin bergerak pada neural pathways, barier uterin dan intestinal. Makrofag sebagai pertahanan utama terhadap kuman, tetapi kehadiran toksin dapat mengganggu pelepasan lisosim dari makrofag. Imunitas spesifik tidak berkembang pada pasien surviving karena jumlah toksin yang menyebabkan sakit tidak banyak untuk dapat imunogenik, toksin yang diproduksi secara insitu selalu berikatan pada reseptor pada nervus terminal yang menginervasi area itu (Bizzini 1993). Toksin tetanus merupakan antigen yang sangat baik, dan dapat dibuat antitoksin pada serum dengan titer tinggi. Kuda adalah produser antitoksin tetanus yang sangat baik. Pemakaian antitetanus kuda harus hati-hati jika pasien menderita alergi seperti asma atau eksem infantile atau alergi terhadap semua injeksi antiserum (Schroder dan kuhlmann 1991; Maple et al. 2001). Untuk dapat digunakan sebagai vaksin, toksin harus dihilangkan sifat toksisitasnya tanpa mengurangi sifat antigeniknya melalui perlakuan tertentu, seperti formalin, iodine, pepsin, asam askorbat, dan keton. Toksoid bersifat inaktif sehingga memerlukan adjuvan untuk stimulasi sistem imun (Bizzini 1983). Pada domba, imunisasi awal memerlukan dua kali dosis dengan interval pemberian empat sampai enam minggu. Imunisasi pertama dapat diberikan dosis sensitizing dan imunisasi kedua dapat diberikan dosis confirming (dosis yang diperkuat). Imunisasi ketiga diberikan satu tahun kemudian (Bizzini 1993). Kekebalan akan berkurang dalam periode tahun dan memer lukan boster secara berkala setiap lima tahun (Lewis 1998). Pada manusia imunisasi pertama diberikan saat umur dua tahun kemudian diulang setiap 10 tahun (Anonim 2003). Vaksin generasi baru yang telah dikembangkan dibuat dari C-terminal (fragmen C) rantai berat toksin tetanus yang diinaktivasi menggunakan formaldehid, fragmen ini tidak toksik dan mampu meningkatkan fungsi netralisasi antibodi (Marvaud et al. 1998). Kadar imunitas antitetanus berdasarkan atas memori imunologis yang bervariasi dan sangat tergantung umur, dengan bertambahnya umur dalam suatu populasi kemungkinan terserang infeksi tetanus tinggi (Schatz et al. 1998; Matos et al. 2002). 35 Pencegahan dengan Antitoksin Pada kedokteran hewan, penggunaan antitoksin untuk pencegahan penyakit member ikan hasil yang memuaskan. Pemberian imunisasi pasif dan dikombinasikan dengan imunisasi aktif juga baik. Standar internasional kandungan antitoksin tetanus tiap ampul adalah 120 IU (Sesardic et al. 1993). Antitetanus serum direkomendasikan dapat diberikan secara kontinyu pada orang yang mudah mendapat tetanus dari luka, terutama yang mempunyai sejarah imunisasi tidak lengkap atau status imunisasinya tidak jelas (Porter et al. 1992). Pemberian imunoglobulin (ATS) harus diikuti dengan imunisasi untuk pengobatan tetanus yang sering terjadi mengikuti kejadian luka, hal ini untuk mendapatkan kekebalan dalam waktu lebih panjang karena kekebalan dari imunisasi tetanus baru muncul 7 hari post imunisasi (Forrat et al. 1998). Pengobatan terhadap luka yang beresiko terkontaminasi infeksi tetanus dengan cara imunisasi aktif, manajemen pengobatan luka lokal, dan imunisasi pasif. Imunisasi pasif awalnya berkembang mulai abad ke-20, dan masih relevan sampai saat ini untuk pencegahan tetanus pada pasien yang mendapat luka. Hal itu juga dilakukan pada pasien penderita tetanus (Forrat et al. 1998). Proteksi untuk melawan efek letal toksin tetanus hanya dapat diproduksi dari dosis antigen yang sangat tinggi diikuti dengan imunisasi dengan bakteri hidup yang telah dilemahkan (Grangette et al. 2001).